Estudios recientes muestran que la inflamación crónica asociada a la aparición y el agravamiento de la diabetes mellitus tipo 2 es un factor importante en la patogenia de las complicaciones macrovasculares diabéticas. La miocardiopatía diabética se caracteriza por alteraciones cardiacas funcionales y estructurales, que la mayor parte de las veces consisten en una fibrosis miocárdica que incluye muerte de células miocárdicas y acumulación de proteínas de la matriz extracelular1. Se demostró que micofenolato mofetilo (MMF) proporciona mejoría de la lesión renal y previene la aparición de nefropatía a través de mecanismos antiinflamatorios, a la vez que atenúa la apoptosis de los podocitos2. En un estudio3 en que se utilizó un modelo de lesión producida por un balón en la arteria carótida, se observó que MMF reduce notablemente la hiperplasia de la íntima, con una disminución de la expresión de factor de crecimiento transcripcional (TGF) beta 1 y de colágeno III. El MMF aportó que evita la disfunción endotelial aumentando la disponibilidad de óxido nítrico, con lo que mejora la óxido nítrico sintasa endotelial4. El objetivo de este estudio es evaluar su efecto en la miocardiopatía diabética derivada de la diabetes mellitus tipo 2.
Se adquirieron ratones machos de 6 semanas de edad, db/m no diabéticos y db/db diabéticos de Jackson Laboratory (Sacramento, California, Estados Unidos). Todos los animales recibieron una dieta de pienso granulado para roedores (348 kcal/100 g) con un contenido del 5,5% de grasa en bruto y agua corriente ad libitum. El MMF (Roche Pharma AG; Grenzach-Wyhlen, Alemania) se incorporó al alimento (Dooyeol Biotech; Seúl, Corea) a una dosis oral de 30 mg/kg de peso corporal/día para un consumo de alimento de 0,2 g/g de peso corporal. A las 8 semanas de edad, se clasificó a los ratones en tres grupos de 6 animales cada uno: el grupo de control no diabético (db/m), el grupo de control diabético (db/db) y el grupo de diabéticos con MMF (db/db + MMF). Durante los experimentos, se efectuaron determinaciones mensuales de consumo de alimento, consumo de agua, volumen de diuresis, peso corporal, glucosa plasmática en ayunas y glucohemoglobina. Todos los experimentos realizados en animales se llevaron a cabo cumpliendo las directrices del Comité de Ética de Investigación Animal de la Kyung Hee University de Seúl, Corea.
Se realizó una ecocardiografía transtorácica para obtener imágenes bidimensionales en modo M empleando una sonda lineal de 12 MHz antes de sacrificar a los animales al final del protocolo del estudio (20 semanas) mediante fórmulas normalizadas. Se fijó el tejido cardiaco en formol al 4% tamponado y se incluyó en parafina. Se utilizaron cortes tisulares de 5 μm, que se desparafinizaron, se rehidrataron y se tiñeron con hematoxilina-eosina para determinar el área de miocardiocitos. Para visualizar la fibrosis cardiaca, se tiñeron los cortes con rojo Sirius. Las imágenes de todos los cortes de tejido cardiaco teñidos se analizaron utilizando el programa ImageJ versión 1.47t. Se determinaron las densidades capilar y arteriolar en el miocardio mediante tinción de CD31 y actina de músculo liso alfa.
Todos los valores se expresan en forma de media ± error estándar de la media. Los resultados se analizaron con la prueba de Kruskal-Wallis no paramétrica para comparaciones múltiples. Las diferencias significativas identificadas con la prueba de Kruskal-Wallis se confirmaron mediante prueba de Mann-Whitney (utilizada para comparar diferencias entre medias). Se consideraron estadísticamente significativos los valores de p < 0,05.
Diversos parámetros bioquímicos, como el peso corporal, el consumo diario de alimento y el consumo diario de agua, presentaron valores más altos en los grupos de ratones db/db que en el grupo db/m, pero no hubo diferencias entre los dos grupos de ratones db/db por lo que respecta a esos parámetros. Los dos grupos de ratones db/db presentaron valores de glucohemoglobina superiores a los del grupo db/m. Concretamente, la glucohemoglobina era mayor en el grupo db/db+MMF a las 20 semanas.
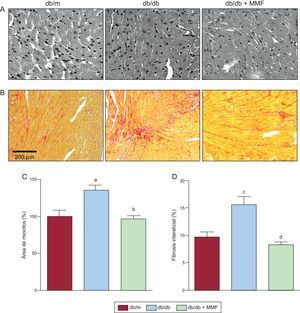
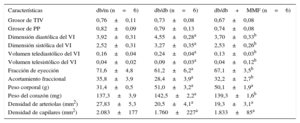
Tal como se muestra en la figura, el corazón de los ratones diabéticos sufrió hipertrofia, con aumento del área de miocitos cardiacos y con fibrosis intersticial. El área de corte transversal de miocardiocitos se redujo en los db/db + MMF en comparación con los ratones db/db no tratados (figuras A-C). Además, la fibrosis intersticial se atenuó también en el corazón de los ratones db/db + MMF (figuras B-D). Sin embargo, el MMF no tuvo efecto alguno en la densidad intramiocárdica de arteriolas y capilares (tabla). Los exámenes ecocardiográficos muestran un ventrículo izquierdo dilatado y reducción de la función cardiaca en los ratones db/db (tabla). En el grupo tratado con MMF hubo una reducción significativa de la dilatación del ventrículo izquierdo, según lo indicado por los mayores valores de dimensión y volumen diastólicos y sistólicos del ventrículo izquierdo. La fracción de eyección ventricular izquierda y el acortamiento fraccional mejoraron con el empleo de MMF.
Efectos de MMF en la miocardiopatía diabética de ratones db/db. El MMF atenúa la hipertrofia y la fibrosis de los miocitos de los ratones db/db. Imágenes representativas de tejidos cardiacos con tinción de hematoxilina-eosina (A) y áreas intersticiales con tinción de rojo Sirius (B). Cuantificación del área de corte transversal de miocardiocitos (C) y porcentaje de áreas intersticiales (D) en el gráfico. Los datos se analizaron con un ANOVA unidireccional utilizando una prueba post-hoc de Newman-Keuls y se expresaron como media±error estándar de la media (n ≥ 15 por grupo). MMF: micofenolato mofetilo.
ap < 0,001 frente a db/m.
bp < 0,001 frente a db/db.
cp < 0,01 frente a db/m.
dp < 0,01 frente a db/db.
Efectos de micofenolato mofetilo en la miocardiopatía diabética de los ratones db/db
| Características | db/m (n=6) | db/db (n=6) | db/db+MMF (n=6) |
|---|---|---|---|
| Grosor de TIV | 0,76±0,11 | 0,73±0,08 | 0,67±0,08 |
| Grosor de PP | 0,82±0,09 | 0,79±0,13 | 0,74±0,08 |
| Dimensión diastólica del VI | 3,92±0,31 | 4,55±0,28a | 3,70±0,33b |
| Dimensión sistólica del VI | 2,52±0,31 | 3,27±0,35a | 2,53±0,26b |
| Volumen telediastólico del VI | 0,16±0,04 | 0,24±0,04a | 0,13±0,03b |
| Volumen telesistólico del VI | 0,04±0,02 | 0,09±0,03a | 0,04±0,12b |
| Fracción de eyección | 71,6±4,8 | 61,2±6,2a | 67,1±3,5b |
| Acortamiento fraccional | 35,8±3,9 | 28,4±3,9a | 32,2±2,7b |
| Peso corporal (g) | 31,4±0,5 | 51,0±3,2a | 50,1±1,9a |
| Peso del corazón (mg) | 137,3±3,9 | 142,5±2,2a | 139,3±1,6b |
| Densidad de arteriolas (mm2) | 27,83±5,3 | 20,5±4,1a | 19,3±3,1a |
| Densidad de capilares (mm2) | 2.083±177 | 1.760±227a | 1.833±85a |
MMF: micofenolato mofetilo; PP: pared posterior; TIV: tabique interventricular; VI: ventrículo izquierdo.
Los datos expresan media ± error estándar de la media.
Los resultados de este estudio indican que el MMF previno la progresión de la miocardiopatía diabética en los ratones db/db de manera independiente del control de la glucemia. La pauta de tratamiento con MMF se utiliza ampliamente en el trasplante cardiaco para prevenir la vasculopatía del aloinjerto, pero los datos que respaldan el efecto favorable del MMF en el corazón no trasplantado son escasos. Algunos estudios han señalado que el MMF tiene propiedades antiaterógenas, y que produce una regulación negativa de las moléculas de adhesión endoteliales, reduce la proliferación de células de músculo liso arteriales e induce la apoptosis de monocitos y macrófagos2,5. El presente estudio tiene la limitación de que no se evaluó la causa subyacente al efecto cardioprotector del MMF. Si se confirma en el ser humano, el efecto cardioprotector alcanzado por el MMF en nuestra pequeña experiencia con un modelo de ratón diabético podría ser una manera efectiva de limitar la hipertrofia cardiaca y la fibrosis en los pacientes con miocardiopatía diabética.
FINANCIACIÓNEste trabajo fue financiado por el Bio & Medical Technology Development Program de la National Research Foundation (NRF) financiada por el gobierno de Corea (MEST) (N.o 2012M3A9C6050507). Roche proporcionó el MMF sin coste.