
La reperfusión coronaria produce un daño en la microcirculación y, en concreto, las células endoteliales. Este estudio evalúa el efecto del suero aislado tras la revascularización de pacientes con un infarto agudo de miocardio con elevación del segmento ST (IAMCEST) en la viabilidad celular, el grado de permeabilidad endotelial in vitro y la asociación de estos parámetros con una mayor extensión de los índices de resonancia magnética cardiaca (RMC) relacionados con el daño por reperfusión (edema, hemorragia y obstrucción microvascular).
MétodosSe incubaron células endoteliales de arteria coronaria humana con suero aislado 24 h tras la revascularización de 43 pacientes con IAMCEST evaluados mediante RMC y 14 sujetos de control. Se testó el efecto del suero de pacientes con IAMCEST en la pérdida de viabilidad celular por activación de la apoptosis y la necrosis, así como en la permeabilidad y la estructura de la monocapa endotelial.
ResultadosEl suero de pacientes con IAMCEST aumentó la apoptosis (p <0,01) y la necrosis (p <0,05) de células endoteliales de arteria coronaria humana y causó un incremento de la permeabilidad de la monocapa endotelial in vitro (p <0,01) debido a mayores espacios intercelulares (p <0,05 frente a los controles). Una mayor necrosis inducida por suero se asoció con más permeabilidad endotelial in vitro (p <0,05) y con una mayor extensión de los principales índices de daño tras reperfusión y mayor tamaño de infarto.
ConclusionesEl suero tras la reperfusión de pacientes con IAMCEST induce la apoptosis y la necrosis in vitro de las células endoteliales y la permeabilidad endotelial. Cuanto más potente sea el efecto inductor de necrosis, más deletéreas son las consecuencias en cuanto al daño estructural resultante.
Palabras clave
Tras el infarto agudo de miocardio con elevación del segmento ST (IAMCEST), la rápida reapertura de la arteria coronaria provoca estrés hemodinámico y oxidativo, conocido como lesión por isquemia/reperfusión1–3. En concreto, se ha sugerido que las anomalías sobre las células endoteliales (CE) tras la reperfusión de pacientes con IAMCEST se originan durante la isquemia, pero se intensifican rápidamente tras la revascularización4,5. Las lesiones por reperfusión favorecen la obstrucción capilar (obstrucción microvascular [OMV]), la extravasación del contenido sanguíneo al intersticio (hemorragia) y el aumento del contenido de agua en el compartimento extracelular (edema intersticial)6. Estos se consideran eventos causados por la lesión por reperfusión y tienen consecuencias negativas en la composición del tejido postinfarto. Dado que la reparación de microvasos actualmente se considera el objetivo terapéutico principal después del IAMCEST, es esencial mejorar la comprensión de los mecanismos que configuran la base de la fisiopatología de la lesión microvascular.
En el caso del IAMCEST, la lesión por isquemia/reperfusión puede activar la apoptosis, un mecanismo de muerte celular programada, que puede provocar necrosis y, por ende, pérdida de la integridad de la membrana celular y liberación de detritos celulares7. Varios estudios han analizado el efecto del suero aislado después de la reperfusión en cuanto a los parámetros de función endotelial8,9, pero, hasta donde sabemos, hay poca bibliografía sobre el impacto del suero aislado después de la reperfusión en la pérdida de viabilidad de las CE y en la permeabilidad y estructura de la barrera endotelial.
Los objetivos específicos de este estudio fueron: a) evaluar in vitro la capacidad del suero de pacientes con IAMCEST para disminuir la viabilidad de las CE mediante la promoción de vías apoptóticas y necróticas; b) demostrar in vitro si el suero de pacientes con IAMCEST modifica la permeabilidad y la estructura de la monocapa endotelial, y c) describir la asociación de la apoptosis y la necrosis inducidas por suero in vitro con cambios en la permeabilidad y con los indicadores derivados de la resonancia magnética cardiovascular (RMC) de la lesión por reperfusión (edema, hemorragia y OMV) y el tamaño del infarto.
MÉTODOSPoblación del estudioEl estudio se ajustó a los principios descritos en la Declaración de Helsinki, fue aprobado por el comité de ética en investigación local del Hospital Clínico Universitario de Valencia y se obtuvo el consentimiento informado por escrito de todos los participantes.
Los criterios de inclusión consistieron en pacientes con un primer IAMCEST con las características que señalan las definiciones actuales10 y que fueron tratados con intervención coronaria primaria durante las 12horas posteriores al inicio del dolor torácico y que se evaluaron mediante RMC 1 semana y 6 meses después del IAMCEST. Se incorporó prospectivamente a 57 pacientes consecutivos dados de alta entre julio de 2015 y diciembre de 2017.
Los criterios de exclusión fueron muerte (n=4), reinfarto (n=2), inestabilidad clínica (n=6) durante los primeros 6 meses posteriores al alta y claustrofobia (n=2). El grupo de estudio final estaba compuesto por 43 pacientes con IAMCEST (figura 1 del material adicional).
También se incorporó un grupo de control emparejado por edad y sexo con el grupo de estudio (tabla 1 del material adicional), compuesto por 14 pacientes. En estos pacientes se descartó la existencia de cualquier enfermedad cardiaca mediante una historia clínica exhaustiva, una exploración física y un estudio ecocardiográfico realizado por un cardiólogo clínico.
Características al ingreso y muestras de sangreLas características al ingreso de todos los pacientes se registraron prospectivamente. Se atendió a los pacientes en una unidad específica de IAMCEST tanto en el hospital como después del alta, y se siguieron estrictamente las recomendaciones actuales. En la tabla 1 se presentan más detalles de las características de los pacientes.
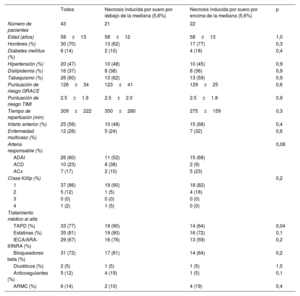
Características al ingreso de toda la cohorte de pacientes con infarto agudo de miocardio con elevación del segmento ST y de pacientes con necrosis inducida por suero por encima o por debajo de la mediana
| Todos | Necrosis inducida por suero por debajo de la mediana (5,6%) | Necrosis inducida por suero por encima de la mediana (5,6%) | p | |
|---|---|---|---|---|
| Número de pacientes | 43 | 21 | 22 | |
| Edad (años) | 58±13 | 58±12 | 58±13 | 1,0 |
| Hombres (%) | 30 (70) | 13 (62) | 17 (77) | 0,3 |
| Diabetes mellitus (%) | 6 (14) | 2 (10) | 4 (18) | 0,4 |
| Hipertensión (%) | 20 (47) | 10 (48) | 10 (45) | 0,9 |
| Dislipidemia (%) | 16 (37) | 8 (38) | 8 (36) | 0,9 |
| Tabaquismo (%) | 26 (60) | 13 (62) | 13 (59) | 0,9 |
| Puntuación de riesgo GRACE | 126±34 | 123±41 | 129±25 | 0,6 |
| Puntuación de riesgo TIMI | 2.5±1.9 | 2.5±2.0 | 2.5±1.8 | 0,9 |
| Tiempo de reperfusión (min) | 309±222 | 350±280 | 275±159 | 0,3 |
| Infarto anterior (%) | 25 (56) | 10 (48) | 15 (68) | 0,4 |
| Enfermedad multivaso (%) | 12 (28) | 5 (24) | 7 (32) | 0,6 |
| Arteria responsable (%) | 0,08 | |||
| ADAI | 26 (60) | 11 (52) | 15 (68) | |
| ACD | 10 (23) | 8 (38) | 2 (9) | |
| ACx | 7 (17) | 2 (10) | 5 (23) | |
| Clase Killip (%) | 0,2 | |||
| 1 | 37 (86) | 19 (90) | 18 (82) | |
| 2 | 5 (12) | 1 (5) | 4 (18) | |
| 3 | 0 (0) | 0 (0) | 0 (0) | |
| 4 | 1 (2) | 1 (5) | 0 (0) | |
| Tratamiento médico al alta | ||||
| TAPD (%) | 33 (77) | 19 (90) | 14 (64) | 0,04 |
| Estatinas (%) | 35 (81) | 19 (90) | 16 (72) | 0,1 |
| IECA/ARA-II/INRA (%) | 29 (67) | 16 (76) | 13 (59) | 0,2 |
| Bloqueadores beta (%) | 31 (72) | 17 (81) | 14 (64) | 0,2 |
| Diuréticos (%) | 2 (5) | 1 (5) | 1 (5) | 1,0 |
| Anticoagulantes (%) | 5 (12) | 4 (19) | 1 (5) | 0,1 |
| ARMC (%) | 6 (14) | 2 (10) | 4 (19) | 0,4 |
ACD, arteria coronaria derecha; ACx, arteria coronaria circunfleja; ADAI, arteria coronaria descendente anterior izquierda; ARA-II, antagonistas del receptor de la angiotensina II; ARMC, antagonistas de los receptores mineralocorticoideos; GRACE, Global Registry of Acute Coronary Events; IECA, inhibidores de la enzima convertidora de la angiotensina; INRA, inhibidor de la neprilisina y del receptor de la angiotensina; TAPD, tratamiento antiagregante plaquetario doble; TIMI, Thrombolysis in Myocardial Infarction.
Los valores se expresan como media±desviación estándar o n.° (%).
Las muestras de sangre se aislaron 24horas después de la revascularización coronaria, se centrifugaron durante las primeras 2horas tras el aislamiento a 800 × g a temperatura ambiente durante 15minutos y el suero se almacenó inmediatamente a -80°C hasta que se realizaron nuevos análisis.
Resonancia magnética cardiovascularLa RMC (unidad de 1,5 T, Magnetom Sonata; Siemens, Alemania) se realizó 7 [5-8] días (RMC de 1 semana) y 193 [160-237] días (RMC de 6 meses) después del IAMCEST, según nuestro protocolo de laboratorio11,12. Dos cardiólogos especializados en RMC, con 15 años de experiencia, realizaron y analizaron todos los estudios con un software certificado (QMASS MR 6.1.5, Medis, Países Bajos). Los datos de la RMC se registraron prospectivamente y se incluyeron inmediatamente en la base de datos.
En la sección de Métodos del material adicional se aporta más información sobre la adquisición y el análisis de las imágenes de RMC.
Cultivo de células endoteliales de arteria coronaria humanaSe utilizó un cultivo primario comercial de células endoteliales de arteria coronaria humana (CEACH) (Lonza, Bélgica). Según la información del fabricante, se aislaron células de las arterias coronarias de un donante sano con crioconservación en el tercer pase (500.000 células). Las células se descongelaron y cultivaron en medio de crecimiento endotelial humano 2 (Lonza, Bélgica) complementado con suero bovino fetal al 10% y 100 unidades/ml de penicilina/100μg/ml de estreptomicina (Gibco, Thermo Fisher Scientific, España). Las células se cultivaron, como de costumbre, en condiciones estériles en una atmósfera humidificada (21% de O2) a 37°C y al 5% de dióxido de carbono. Las células se pasaron por tripsinización cada 2-3 días.
Al realizar otros experimentos, se utilizaron las células en el sexto pase y se empleó un ensayo de cultivo celular ex vivo13 ligeramente modificado para analizar el efecto del suero en las CEACH. Las CEACH se sembraron en placas de 12 pocillos recubiertas con gelatina (100.000 células/ml) y 24horas después (80% de confluencia) el medio de cultivo se sustituyó por un medio modificado que consistía en medio de crecimiento endotelial 2 sin suero bovino fetal. A continuación, se añadió a los cultivos el 10% del suero de individuos con IAMCEST extraído 24horas después de la perfusión o de los controles. Después de 24horas de incubación, las células se levantaron o se fijaron para su posterior análisis.
Posteriormente, se utilizó un enfoque multidisciplinario para evaluar la activación de la apoptosis y la necrosis en las CEACH, y para estudiar los cambios en la permeabilidad y la estructura de la monocapa endotelial in vitro. Se presentan más detalles en la sección de Métodos del material suplementario y los datos brutos de todos los experimentos se incluyen en las tablas 2, 3, 4 y 5 del material adicional.
Análisis estadísticosLa distribución normal de los datos se verificó con la prueba de Kolmogorov-Smirnov. Los datos continuos distribuidos normalmente se expresan como la media±desviación estándar de la media y se compararon mediante la prueba de la t de Student para datos no emparejados. Los datos no paramétricos se expresan como la mediana [rango intercuartílico] y se compararon con la prueba de la U de Mann-Whitney. Los porcentajes de los grupos se compararon mediante la prueba de la χ2 o la prueba exacta de Fisher, según corresponda. Las correlaciones lineales se evaluaron utilizando el coeficiente de correlación de Pearson o la correlación de orden de rango de Spearman.
Se consideró la significación estadística de un valor bilateral de p <0,05. En todo momento se utilizó el paquete estadístico SPSS (versión 15.0, SPSS Inc, EE. UU.).
RESULTADOSLas características al ingreso de nuestra cohorte final se muestran en la tabla 1. No hubo diferencias significativas en las características iniciales y los factores de riesgo cardiovascular entre los pacientes con IAMCEST y los controles (tabla 1 del material adicional).
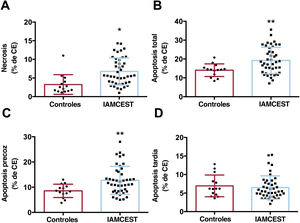
El suero de pacientes con IAMCEST induce necrosis y apoptosis en células endoteliales in vitroSegún el análisis de citometría de flujo, se detectó un aumento del porcentaje de células que sufrían necrosis (figura 1A) y apoptosis (figura 1B) tras tratar las CEACH con suero de pacientes con IAMCEST y compararlas con las de los controles. Específicamente, el porcentaje de células con apoptosis precoz aumentó preferentemente en el suero de pacientes con IAMCEST (figura 1C), mientras que no se detectaron diferencias en la apoptosis tardía (figura 1D) (tabla 2 del material adicional).
Efecto del suero de pacientes con IAMCEST sobre la viabilidad de las CEACH. Las CEACH se incubaron con suero de control (n=14) o suero de pacientes con IAMCEST (n=43) aislado 24horas después de la reperfusión. Los porcentajes de células con necrosis (A), apoptosis (B), apoptosis precoz (C) y apoptosis tardía (D) determinados por citometría de flujo aumentaron después del tratamiento con CEACH con suero de pacientes con IAMCEST en comparación con el suero de los controles.
CE, células endoteliales; CEACH, células endoteliales de arteria coronaria humana; IAMCEST, infarto agudo de miocardio con elevación del segmento ST.
* p <0,05.
** p <0,01 frente a controles.
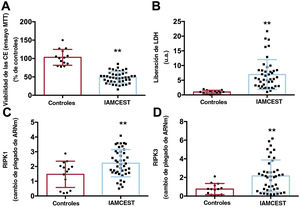
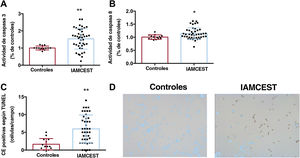
La activación de la necrosis después del tratamiento con suero de pacientes con IAMCEST reperfundidos se confirmó mediante un descenso de la viabilidad celular, demostrada por el ensayo de bromuro de 3-[4,5-dimetiltiazol-2-il]-2,5-difeniltetrazolio (figura 2A), un aumento de la liberación de lactato deshidrogenasa al medio extracelular (figura 2B) y el incremento en la expresión de ARNm de la serina/treonina-proteína quinasa 1 que interactúa con el receptor y la serina/treonina-proteína quinasa 3 que interactúa con el receptor (figura 2C,D, respectivamente) en CEACH tratadas con suero de pacientes con IAMCEST (tabla 3 del material adicional). Para corroborar la activación de la apoptosis, las CEACH incubadas con suero de pacientes con IAMCEST mostraron no solo una mayor actividad de caspasa 3 y caspasa 8 (figura 3A,B, respectivamente), sino también un mayor número de células positivas según el método TdT-mediated dUTP nick end labelling (TUNEL) (figura 3C,D) (tabla 4 del material adicional), lo que es un indicio de que existen células con fragmentación a partir del ácido desoxirribonucleico, como células apoptóticas y necróticas14.
Activación de la necrosis en CEACH después del tratamiento con suero de pacientes con IAMCEST. Las CEACH se incubaron con suero de controles (n=14) o suero de pacientes con IAMCEST (n=43) aislado 24horas después de la reperfusión. El suero de los pacientes con IAMCEST indujo una disminución de la viabilidad celular según lo reflejado por el ensayo MTT (A) y por el aumento de la liberación de LDH al medio extracelular (B). El suero de pacientes con IAMCEST provocó un aumento de la expresión de ARNm de los marcadores de necrosis RIPK1 (C) y RIPK3 (D).
CEACH, células endoteliales de arteria coronaria humana; IAMCEST, infarto agudo de miocardio con elevación del segmento ST; LDH, lactato deshidrogenasa; MTT, bromuro de 3-[4,5-dimetiltiazol-2-il]-2,5-difeniltetrazolio; RIPK, receptor que interactúa con la serina/treonina-proteína quinasa.
** p <0,01 frente a controles.
Activación de la apoptosis en CEACH después del tratamiento con suero de pacientes con IAMCEST. Las CEACH se incubaron con suero de controles (n=14) o suero de pacientes con IAMCEST (n=43) aislado 24horas después de la reperfusión. Tanto la actividad de caspasa 3 (A) como de caspasa 8 (B) y el número de células positivas según el método TUNEL (C) se intensificaron en CEACH tratadas con suero de pacientes con IAMCEST en comparación con los controles. Imágenes representativas de la tinción TUNEL realizada en CEACH tratadas con suero de controles o pacientes con IAMCEST (D).
CEACH, células endoteliales de arteria coronaria humana; IAMCEST, infarto agudo de miocardio con elevación del segmento ST.
* p <0,05.
** p <0,01 frente a controles.
Todos estos resultados indicaron que el suero aislado 24horas después de la perfusión de pacientes con IAMCEST tuvo un efecto perjudicial sobre las CE al activar la apoptosis y la necrosis in vitro.
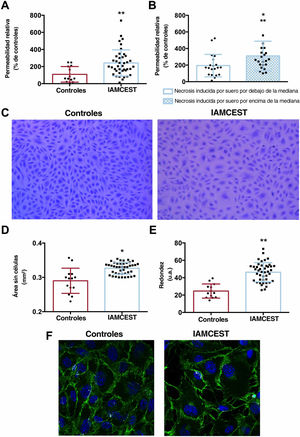
El suero de pacientes con IAMCEST mejoró la permeabilidad de la monocapa endotelialSe analizó si el suero de pacientes con IAMCEST también podía afectar la estructura y la función de la barrera endotelial mediante un ensayo de permeabilidad in vitro utilizando el conjugado con FITC-dextrano. En comparación con el suero de los controles, el suero de los pacientes con IAMCEST mostró una mayor migración de FITC-dextrano a través de la barrera vascular (figura 4A).
Impacto del suero de pacientes con IAMCEST sobre la barrera endotelial. Las CEACH se incubaron con suero de controles (n=14) o suero de pacientes con IAMCEST (n=43) aislado 24horas después de la reperfusión. Se detectó una mayor permeabilidad en las CEACH tratadas con suero de IAMCEST en comparación con las de los controles (A). Los pacientes cuyo suero indujo un porcentaje por encima de la mediana de CEACH con necrosis in vitro presentaron un mayor grado de permeabilidad in vitro (B). Imágenes representativas de la barrera endotelial después de la incubación con suero de controles y pacientes con IAMCEST (C). El suero de los pacientes con IAMCEST indujo un aumento en el área sin células de la monocapa endotelial (D), así como un incremento de la redondez de las células endoteliales (E). La barrera endotelial tratada con suero de controles o pacientes con IAMCEST (F) se incubó con anticuerpos antihumanos de VE-cadherina de ratón (1:250) y se visualizó la inmunorreactividad mediante los anticuerpos secundarios con Alexa Fluor 488 (VE-cadherina, verde) con microscopia confocal. Los núcleos se tiñeron con DAPI (azul).
CE, células endoteliales; CEACH, células endoteliales de arteria coronaria humana; IAMCEST, infarto agudo de miocardio con elevación del segmento ST.
* p <0,05.
** p <0,01 frente a controles.
A continuación, las células se tiñeron y fotografiaron para evaluar morfométricamente los cambios estructurales de la monocapa endotelial. Aunque el número de células por campo fue similar en los 2 grupos, el suero de los pacientes con IAMCEST mostró un aumento considerable del espacio entre las células (figura 4D), así como de su forma circular (figura 4E) (tabla 5 del material adicional). También se visualizó la presencia de la proteína cadherina endotelial vascular mediante microscopia confocal y también se detectaron cambios en la barrera endotelial (figura 4F). En general, el suero de pacientes con IAMCEST también produjo un efecto perjudicial en relación con la intensificación de la permeabilidad vascular al agrandar los espacios intercelulares.
Por último, los pacientes con IAMCEST se dicotomizaron en función de la mediana del porcentaje de CEACH en apoptosis total (18,4%) y necrosis (5,6%) según el análisis de citometría de flujo después de la incubación en suero del paciente. La tabla 1 muestra las características iniciales de los pacientes con IAMCEST con un porcentaje medio superior o inferior a la media de CEACH con necrosis in vitro.
Los pacientes cuyo suero indujo un alto porcentaje de células necróticas en el análisis de citometría de flujo también mostraron una barrera endotelial más permeable en un ensayo de permeabilidad vascular in vitro (p<0,05, figura 4B). En cambio, no se encontró asociación entre el porcentaje de células apoptóticas y el grado de permeabilidad vascular.
Relación entre la necrosis inducida por suero y los eventos causados por la lesión por reperfusión derivados de la RMCSe evaluó la asociación entre la necrosis y la apoptosis inducida por suero in vitro mediante análisis de citometría de flujo, con la estructura cardiaca resultante evaluada con estudios de RMC 1 semana y 6 meses después de la reperfusión (tabla 2).
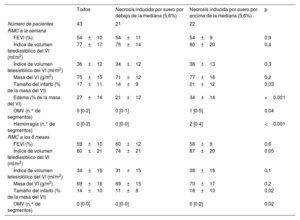
Características de la RMC de toda la cohorte de pacientes con infarto agudo de miocardio con elevación del segmento ST y de pacientes con necrosis inducida por suero por encima o por debajo de la mediana
| Todos | Necrosis inducida por suero por debajo de la mediana (5,6%) | Necrosis inducida por suero por encima de la mediana (5,6%) | p | |
|---|---|---|---|---|
| Número de pacientes | 43 | 21 | 22 | |
| RMC a la semana | ||||
| FEVI (%) | 54±10 | 54±11 | 54±9 | 0,9 |
| Índice de volumen telediastólico del VI (ml/m2) | 77±17 | 75±14 | 80±20 | 0,4 |
| Índice de volumen telesistólico del VI (ml/m2) | 36±12 | 34±12 | 38±13 | 0,3 |
| Masa del VI (g/m2) | 75±15 | 71±12 | 77±16 | 0,2 |
| Tamaño del infarto (% de la masa del VI) | 17±11 | 14±9 | 21±12 | 0,03 |
| Edema (% de la masa del VI) | 27±14 | 21±12 | 34±14 | <0,001 |
| OMV (n.° de segmentos) | 0 [0-2] | 0 [0-1] | 1 [0-5] | 0,04 |
| Hemorragia (n.° de segmentos) | 0 [0-2] | 0 [0-0] | 2 [0-4] | <0,001 |
| RMC a los 6 meses | ||||
| FEVI (%) | 59±10 | 60±12 | 58±9 | 0,6 |
| Índice de volumen telediastólico del VI (ml/m2) | 80±21 | 74±21 | 87±20 | 0,05 |
| Índice de volumen telesistólico del VI (ml/m2) | 34±16 | 31±15 | 38±16 | 0,1 |
| Masa del VI (g/m2) | 69±16 | 69±15 | 70±17 | 0,2 |
| Tamaño del infarto (% de la masa del VI) | 14±10 | 11±8 | 18±10 | 0,02 |
| OMV (n.° de segmentos) | 0 [0-0] | 0 [0-0] | 0 [0-2] | 0,02 |
FEVI, fracción de eyección del ventrículo izquierdo; OMV, obstrucción microvascular; RMC, resonancia magnética cardiovascular; VI, ventrículo izquierdo.
La OMV y la hemorragia se expresan como mediana [percentil 25 - percentil 75]. Todas las demás variables se expresan como media ±desviación estándar.
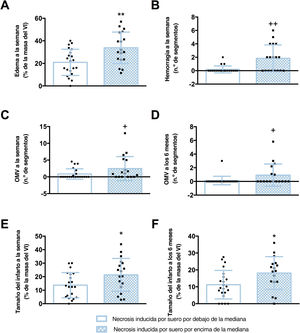
Los pacientes cuyo suero provocó que un mayor porcentaje (por encima de la mediana) de CEACH sufriera necrosis in vitro presentaron edema (figura 5A), hemorragia (figura 5B) y OMV (figura 5C) más extensos derivados de la RMC 1 semana después del infarto de miocardio (tabla 2, figura 1 del material adicional). En el estudio de RMC a los 6 meses, la hemorragia y el edema casi habían desaparecido en todos los pacientes, mientras que los pacientes con un porcentaje de CEACH con necrosis por encima de la mediana mostraron valores más altos de OMV en la fase crónica (figura 5D) (tabla 2, figura 5). Por último, también se detectó una asociación significativa entre el porcentaje de CEACH con necrosis in vitro y la extensión del tamaño del infarto según se derivaba de los estudios de RMC a 1 semana y a 6 meses (figura 5E y figura 4F, respectivamente) (tabla 2, figura 2 del material adicional). En cambio, el porcentaje de células en apoptosis in vitro no se asoció con estos indicadores derivados de la RMC cuando se evaluó a 1 semana o a 6 meses (tablas 6 y 7 del material adicional).
Asociación entre la necrosis inducida por suero y los indicadores de la estructura cardiaca derivados de la RMC después de IAMCEST. Los pacientes con IAMCEST (n=43) se dicotomizaron por la mediana del porcentaje de CEACH con necrosis (5,6%) en el análisis de citometría de flujo después de la incubación con suero. Los pacientes cuyo suero provocó un aumento del porcentaje de CEACH con necrosis in vitro (por encima del valor medio) presentaron una mayor extensión de edema (A), hemorragia (B), OMV (C) y tamaño del infarto (E) en fase aguda (1 semana después de la vascularización), así como mayor OMV (D) y tamaño del infarto (F) en fase crónica (6 meses).
CEACH, células endoteliales de arteria coronaria humana; IAMCEST, infarto agudo de miocardio con elevación del segmento ST; OMV, obstrucción microvascular; RMC, resonancia magnética cardiovascular; VI, ventrículo izquierdo.
+ p <0,05.
++ p <0,01 frente a necrosis inducida por suero por debajo de la mediana, analizada mediante la prueba de la U de Mann-Whitney.
* p <0,05.
** p <0,01 frente a necrosis inducida por suero por debajo de la mediana, analizada mediante la prueba de la t de Student para datos no emparejados.
En conjunto, la necrosis, pero no la apoptosis, inducida por el suero de pacientes con IAMCEST in vitro se asoció con la estructura cardiaca resultante tanto en la fase aguda como en la crónica después del infarto de miocardio (figura 6).
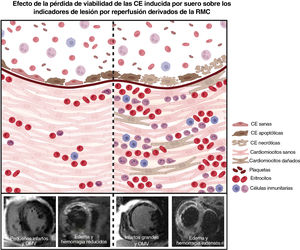
Figura central. El tratamiento de CEACH con suero aislado de pacientes con IAMCEST induce una pérdida de viabilidad celular al activar la apoptosis y la necrosis, así como la alteración de la estructura y la función de la monocapa endotelial. El panel izquierdo representa a aquellos pacientes con mayor porcentaje de células endoteliales con necrosis tras el tratamiento con suero aislado de pacientes con IAMCEST 24horas después de la revascularización. Este subgrupo de pacientes muestra el mayor grado de permeabilidad de la monocapa endotelial in vitro, lo que provoca una mayor migración de plasma, eritrocitos y leucocitos al tejido cardiaco. Estos 3 fenómenos están relacionados con la aparición de OMV derivada de la RMC, hemorragia intramiocárdica y edema (indicadores de lesión por reperfusión). En conjunto, la alteración de la membrana celular inducida después de la activación de la necrosis en las células endoteliales podría estar asociada con un aumento de la permeabilidad vascular, que en última instancia dará como resultado indicadores perjudiciales de estructura cardiaca. El panel derecho representa a aquellos pacientes con un menor porcentaje de células endoteliales con necrosis in vitro después de la incubación de sueros posreperfusión. Estos pacientes muestran una barrera endotelial más conservada, lo que limita la migración de plasma, eritrocitos y leucocitos al miocardio. Por tanto, su estructura cardiaca resultante está menos comprometida que la de los pacientes cuyos sueros provocan un mayor grado de necrosis. Imagen creada por BioRender.
CEACH, células endoteliales de arteria coronaria humana; IAMCEST, infarto agudo de miocardio con elevación del segmento ST; OMV, obstrucción microvascular; RMC, resonancia magnética cardiovascular; VI, ventrículo izquierdo.
La restauración rápida y completa del flujo sanguíneo coronario epicárdico después del IAMCEST es, sin duda alguna, fundamental para limitar el tamaño del infarto, mejorar la función ventricular a largo plazo y, lo que es más importante, reducir los eventos adversos durante el seguimiento1,15.
El efecto de la lesión por reperfusión en la circulación miocárdica se ha abordado ampliamente en estudios clínicos y experimentales4–6,8. Una investigación reciente analizó los cambios de la monocapa endotelial a nivel epicárdico después de la lesión por isquemia/reperfusión5. Aunque se detectaron anomalías leves en las CE durante la isquemia, aumentaron drásticamente después de la reperfusión, como lo refleja la ausencia casi completa de células CD31 positivas5. De manera compatible con estos datos, también se produce una disminución de la densidad de microvasos y una ultraestructura anómala en las CE de los microvasos miocárdicos después de la reperfusión4,6.
Esta tendencia se mantuvo en los pacientes con IAMCEST. A pesar del restablecimiento completo del flujo epicárdico, un número considerable de pacientes presentaba zonas hipoperfundidas en la región infartada16. Este fenómeno, conocido como OMV, tiene consecuencias perjudiciales para la estructura cardiaca resultante y el pronóstico15,17. Dado que la reparación de los microvasos podría convertirse en el principal objetivo terapéutico tras el IAMCEST18, es necesario avanzar en la comprensión de los mecanismos implícitos de la fisiopatología de la lesión microvascular, en la cual las CE son los actores principales.
Apoptosis y necrosis en células endoteliales después de IAMCESTEn el proceso de isquemia y reperfusión, los experimentos in vitro e in vivo han demostrado que las CE resistieron periodos prolongados (24-48horas) de hipoxia19,20 al activar mecanismos protectores20. Sin embargo, un estudio previo de una pequeña cohorte de pacientes (n=20) sugirió que el suero aislado de pacientes con IAMCEST después de la revascularización coronaria indujo apoptosis en CE in vitro según lo evaluado por citometría de flujo. Específicamente, este experimento concluyó que se detectó un aumento gradual de la apoptosis de CE en las incubaciones de sueros desde la prerreperfusión hasta 30 días después y alcanzó su punto máximo unas horas después de la reperfusión13. En este sentido, un estudio reciente realizado en 153 pacientes con síndrome coronario agudo encontró un mayor número de microvesículas derivadas del endotelio relacionadas con apoptosis, especialmente en pacientes con IAMCEST21.
La lesión por isquemia/reperfusión se ha relacionado tradicionalmente con la necrosis y la apoptosis en los miocardiocitos7. En pocas palabras, la apoptosis se caracteriza por la contracción celular y la condensación de la cromatina, mientras que la necrosis provoca la destrucción de las membranas celulares y la rotura de las mitocondrias. Aunque se ha demostrado la pérdida de viabilidad de las CE después del IAMCEST4,22, apenas se ha estudiado el efecto del suero aislado poco después de la reperfusión sobre la viabilidad del endotelio per se. En consecuencia, nuestro primer objetivo fue arrojar más luz sobre la activación de la apoptosis y la necrosis en CE tratadas con suero aislado 24horas después de la perfusión de pacientes con IAMCEST.
Se confirma que el suero aislado 24horas después de la revascularización produce efectos negativos en las CE a diferentes niveles subcelulares: en las mitocondrias, como se refleja en el ensayo de bromuro de 3-[4,5-dimetiltiazol-2-il]-2,5-difeniltetrazolio, y en la membrana celular por el aumento de la liberación de lactato deshidrogenasa al medio extracelular. Además, el análisis de citometría de flujo mediante la técnica de referencia para evaluar la viabilidad celular, la doble tinción para la unión de FITC-anexina V y el yoduro de propidio también confirmó que el suero de pacientes con IAMCEST activa drásticamente la apoptosis y la necrosis en estas células. La activación de estos dos fenómenos también se vio reforzada por la regulación al alza de marcadores sólidos de estas 2 vías en CEACH. Al parecer, el suero posterior a la reperfusión ejerce un doble efecto sobre las CE. Se ha notificado que activa la angiogénesis en las CE coronarias mediante el rápido aumento de los factores proangiogénicos poco después del inicio de la isquemia8,9. Además, estos datos indican que el suero también podría ejercer un impacto negativo en las CE más allá del efecto de la falta de oxígeno y nutrientes durante la isquemia y la rápida restauración del flujo sanguíneo coronario.
Función y estructura de la barrera endotelial después del IAMCESTLa integridad vascular puede verse comprometida por varios fenómenos. Los resultados de este estudio demuestran el efecto perjudicial del suero posterior a la reperfusión sobre la viabilidad de las CE, pero hasta donde sabemos hay muy pocos estudios in vitro que describan el impacto del suero de pacientes con IAMCEST en la función y estructura adecuadas de la barrera vascular.
Según nuestros datos, el suero de los pacientes con IAMCEST indujo hiperpermeabilidad, como se refleja en el aumento de la fuga de FITC-dextrano a través de la barrera endotelial. Además de evaluar la función, también se comprobó la estructura de la barrera endotelial mediante microscopia óptica y microscopia confocal utilizando anticuerpos anticadherina endotelial vascular, una molécula de adhesión ubicada en las uniones entre las CE. Se detectó un aumento importante de los espacios intercelulares tras la incubación con suero aislado después de la reperfusión de pacientes con IAMCEST en comparación con los controles. También se detectó un aumento de la redondez celular en las CEACH tratadas con suero de pacientes con IAMCEST. Una explicación probable es que la pérdida de viabilidad de las CE favorece un estado celular diferencial en las células en crecimiento, lo que provoca un aumento de la redondez de las células.
La lesión por reperfusión se ha relacionado previamente con la interrupción del revestimiento de las CE a través de diferentes mecanismos4,6. El incremento del calcio intracelular después de la revascularización coronaria activa los elementos contráctiles en las CE, lo que origina la formación de espacios intercelulares, que aumentan su permeabilidad a las moléculas grandes23. Otro estudio realizado con ratas puso de manifiesto que la reperfusión tiene un impacto aún mayor en las uniones endoteliales (proteínas fundamentales para la protección de la integridad endotelial) que los tiempos de isquemia prolongados4.
Sin embargo, nuestro estudio representa una situación diferente, en que solo el papel del suero de los pacientes con IAMCEST puede alterar la permeabilidad endotelial. Aunque está más allá del alcance de este estudio, nuevos estudios deberían explorar si el bloqueo/promoción de estas moléculas in vitro podría reducir la hiperpermeabilidad vascular inducida por el suero in vitro.
Asociación entre la pérdida de viabilidad de las células endoteliales y los indicadores de lesión por reperfusión derivados de la RMCLas anomalías en la integridad de la monocapa endotelial después de la reperfusión provocan la extravasación del contenido sanguíneo y el líquido plasmático en el miocardio infartado4,6. Los dos causan compresión externa de los capilares, lo que dificulta un suministro sanguíneo adecuado al miocardio infartado, lo que finalmente se relaciona con la aparición de OMV6. Estos 3 fenómenos pueden considerarse indicadores de lesión por reperfusión, que aparece unas horas después de la revascularización coronaria y se han relacionado con resultados adversos para el paciente. Por tanto, a continuación se trató de evaluar la contribución de la apoptosis y necrosis de las CE a la fisiopatología de los 3 indicadores anteriores de lesión por reperfusión.
Los resultados de este estudio mostraron una asociación entre la necrosis inducida por suero en CE in vitro y el grado de permeabilidad de la monocapa endotelial. En consonancia con estos resultados, la necrosis en un alto porcentaje de CE tras el tratamiento con suero aislado de pacientes con IAMCEST después de la reperfusión también se correlacionó con edema, hemorragia y OMV más extensos derivados de la RMC. Estos datos revelan que, junto con la interrupción de las uniones intercelulares4, la activación de la necrosis, una forma de lesión celular irreversible caracterizada por la rotura de la membrana celular, también podría participar en la promoción de la lesión microvascular con el aumento de la migración de plasma, eritrocitos y leucocitos, lo que generaría una estructura cardiaca más comprometida después del IAMCEST. En cambio, no se detectó ninguna asociación entre estos indicadores y la activación de la apoptosis, probablemente porque la apoptosis tiene menor impacto en la estructura del órgano que la necrosis. Por último, aunque muchos factores (p. ej., lesión por isquemia/reperfusión, rotura de placas ateroescleróticas durante la intervención percutánea, comorbilidades iniciales de los pacientes) participan en la fisiopatología de la OMV6,16, estos datos señalaron que el suero en sí es un factor adicional que ejerce un impacto negativo en las CE coronarias, que produce una peor estructura cardiaca.
LimitacionesEste es un estudio in vitro, centrado principalmente en la correlación entre la necrosis y la lesión de la monocapa endotelial a causa del suero aislado de pacientes con IAMCEST después de la reperfusión. El aislamiento de muestras de sangre extraídas de los lechos coronarios en lugar de muestras periféricas y el uso de CE microvasculares humanas en lugar de CEACH sería mejor para simular la situación in vivo.
Respecto a la redondez celular, el estado de diferenciación de las células en crecimiento después de la incubación con sueros de pacientes con IAMCEST podría influir en este indicador.
También habría sido útil analizar los mecanismos implícitos a la pérdida de CEACH inducida por el suero e investigar el efecto del suero en la función endotelial con mayor profundidad. Por último, estos resultados requieren confirmación en modelos experimentales y clínicos ya que las células no se expusieron a lesión por isquemia/reperfusión, una de las principales fuentes de lesión endotelial tras infarto de miocardio.
CONCLUSIONESEl suero de pacientes con IAMCEST indujo una pérdida de viabilidad de las CE al activar la apoptosis y la necrosis in vitro, y también aumentó la permeabilidad de las CE al agrandar los espacios intercelulares. La necrosis inducida por suero, pero no la apoptosis, in vitro en CEACH se relacionó con el grado de permeabilidad de la monocapa endotelial, así como con la lesión por reperfusión evaluada mediante los parámetros derivados de la RMC (edema, hemorragia y OMV) y el tamaño del infarto.
FINANCIACIÓNTrabajo financiado mediante subvenciones del Instituto de Salud Carlos III y de los Fondos Europeos de Desarrollo Regional (FEDER) (números de subvención PI20/00637 y CIBERCV16/11/00486, contrato de posgrado CM21/00175 a V. Marcos-Garcés), por la Conselleria de Educación – Generalitat Valenciana (PROMETEO/2021/008 a V. Bodí. y CIGE/2022/26 a V. Marcos-Garcés). J. Gavara agradece el apoyo financiero de la Agencia Estatal de Investigación (subvención FJC2020-043981-I/AEI/10.13039/501100011033).
CONTRIBUCIÓN DE LOS AUTORESC. Ríos-Navarro: concibió y diseñó el análisis; recopiló los datos; realizó el análisis formal; redactó el borrador original, y revisó y editó la versión final. J. Gavara: recopiló los datos; realizó el análisis formal; redactó el borrador original, y revisó y editó la versión final. E. de Dios: recopiló los datos; revisó y editó la versión final. N. Pérez-Solé: recopiló los datos y revisó y editó la versión final. T. Molina-García: recopiló los datos; revisó y editó la versión final. V. Marcos-Garcés: recopiló los datos; revisó y editó la versión final. A. Ruiz-Saurí: recopiló los datos y revisó y editó la versión final. A. Bayés-Genís: recopiló los datos y revisó y editó la versión final. F. Carrión-Valero: recopiló los datos y revisó y editó la versión final. F. J. Chorro: apoyo financiero y revisó y editó la versión final. V. Bodí: concibió y diseñó el análisis; realizó el análisis formal; apoyo financiero; redactó el borrador original y revisó y editó la versión final.
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto de intereses.
Las anomalías de la monocapa endotelial después del IAMCEST se inician durante la isquemia, pero se intensifican rápidamente tras la revascularización coronaria. Las lesiones por reperfusión facilitan la OMV, la hemorragia y el edema. Sin embargo, hasta donde sabemos, se han llevado a cabo pocos estudios sobre el impacto del suero después de la reperfusión en la pérdida de viabilidad de las CE y en la permeabilidad y estructura de la barrera endotelial.
¿QUÉ APORTA DE NUEVO?Los sueros aislados después de la reperfusión coronaria activan la necrosis y la apoptosis en las CE y aumentan el grado de permeabilidad endotelial in vitro. De hecho, la necrosis en un alto porcentaje de CE tras el tratamiento con suero aislado de pacientes con IAMCEST después de la reperfusión también se correlacionó con una estructura cardiaca derivada de la RMC más afectada. Estos datos revelan que la activación de la necrosis, una forma de lesión celular irreversible caracterizada por la rotura de la membrana celular, también podría promover la lesión microvascular, lo que provoca una estructura cardiaca más comprometida después del IAMCEST.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2023.08.005.


![Activación de la necrosis en CEACH después del tratamiento con suero de pacientes con IAMCEST. Las CEACH se incubaron con suero de controles (n=14) o suero de pacientes con IAMCEST (n=43) aislado 24horas después de la reperfusión. El suero de los pacientes con IAMCEST indujo una disminución de la viabilidad celular según lo reflejado por el ensayo MTT (A) y por el aumento de la liberación de LDH al medio extracelular (B). El suero de pacientes con IAMCEST provocó un aumento de la expresión de ARNm de los marcadores de necrosis RIPK1 (C) y RIPK3 (D). CEACH, células endoteliales de arteria coronaria humana; IAMCEST, infarto agudo de miocardio con elevación del segmento ST; LDH, lactato deshidrogenasa; MTT, bromuro de 3-[4,5-dimetiltiazol-2-il]-2,5-difeniltetrazolio; RIPK, receptor que interactúa con la serina/treonina-proteína quinasa. ** p <0,01 frente a controles. Activación de la necrosis en CEACH después del tratamiento con suero de pacientes con IAMCEST. Las CEACH se incubaron con suero de controles (n=14) o suero de pacientes con IAMCEST (n=43) aislado 24horas después de la reperfusión. El suero de los pacientes con IAMCEST indujo una disminución de la viabilidad celular según lo reflejado por el ensayo MTT (A) y por el aumento de la liberación de LDH al medio extracelular (B). El suero de pacientes con IAMCEST provocó un aumento de la expresión de ARNm de los marcadores de necrosis RIPK1 (C) y RIPK3 (D). CEACH, células endoteliales de arteria coronaria humana; IAMCEST, infarto agudo de miocardio con elevación del segmento ST; LDH, lactato deshidrogenasa; MTT, bromuro de 3-[4,5-dimetiltiazol-2-il]-2,5-difeniltetrazolio; RIPK, receptor que interactúa con la serina/treonina-proteína quinasa. ** p <0,01 frente a controles.](https://static.elsevier.es/multimedia/03008932/0000007700000003/v1_202402270442/S0300893223003834/v1_202402270442/es/main.assets/thumbnail/gr2.jpeg?xkr=eyJpdiI6ImpYb2Z3clF5Rmh6MG9aVFg1alY2QVE9PSIsInZhbHVlIjoiK3NPYTVLTjViZk5WVm9WandoTE5YUHhaQytDL1d1bjNqVXN2S3lYRklDUT0iLCJtYWMiOiJhNWFhMTcyZTRiMzJkNzBiZmVmMjdmZjVkOTk4MWQwMzQyOGQ3NDUxM2Y1ZDVmZTE5OTk3YzU1YWQzNDI3NDA0IiwidGFnIjoiIn0=)



