El control intensivo con insulina de la glucemia de pacientes con un síndrome coronario agudo reduce la reactividad plaquetaria durante la fase hospitalaria en comparación con un tratamiento convencional. Sin embargo, se desconoce el efecto en la reactividad plaquetaria con un control estricto de la glucemia a largo plazo.
MétodosEnsayo prospectivo y aleatorizado que evaluó el efecto de un tratamiento optimizado para el control de la glucemia (objetivo, 80-120 mg/dl) con insulina comparado con un tratamiento convencional (objetivo, < 180 mg/dl) en la reactividad plaquetaria al alta hospitalaria de pacientes con un síndrome coronario agudo e hiperglucemia. El objetivo primario es la valoración de la agregación plaquetaria tras estímulo con adenosina difosfato 20 μM a los 12 meses de seguimiento.
ResultadosSe incluyó a 104 pacientes (53 al tratamiento optimizado y 51 al convencional). No se encontraron diferencias en las características basales de ambos grupos, incluida la función plaquetaria. A los 12 meses de seguimiento, las cifras de glucemia eran significativamente menores en el grupo de tratamiento optimizado (104 frente a 119 mg/dl; p < 0,001). Sin embargo, la agregación plaquetaria tras estímulo con adenosina difosfato 20 μM no mostró diferencias significativas entre los grupos (tratamiento optimizado frente a convencional, 54,2 ± 14,3% frente a 55,1 ± 18,3%; p = 0,81). Tampoco se objetivaron diferencias significativas con los otros tests de función plaquetaria evaluados.
ConclusionesEl control optimizado de la glucemia con insulina a largo plazo en pacientes que han sufrido un síndrome coronario agudo no reduce la reactividad plaquetaria en comparación con un tratamiento convencional.
Palabras clave
Los pacientes con un síndrome coronario agudo (SCA) e hiperglucemia tienen mayor riesgo de nuevos eventos cardiovasculares tanto a corto como a largo plazo1–4. En los pacientes con hiperglucemia se ha documentado una mayor reactividad plaquetaria5 y, entre otros factores, se ha propuesto que la activación plaquetaria podría tener un papel fundamental en este contexto.
A pesar de que no esté establecido que el tratamiento agresivo de las cifras de hiperglucemia se traduzca en una disminución de eventos cardiovasculares6–11, nuestro grupo ha demostrado recientemente que el control intensivo con insulina en pacientes con SCA e hiperglucemia reduce la reactividad plaquetaria durante la fase hospitalaria12; además, esta reducción es tanto mayor cuanto peor fuera el control glucémico previo al evento coronario13.
Fuera de la fase aguda, los estudios que han evaluado protocolos para un control estricto de la glucemia a largo plazo también han arrojado resultados clínicos discordantes14–19. Por ello, las actuales guías de práctica clínica recomiendan un objetivo de control glucémico menos estricto (HbA1c < 7%)20. Por otro lado, los pacientes con cardiopatía isquémica crónica e hiperglucemia también tienen aumentada la reactividad plaquetaria, lo que se asocia a peor pronóstico21. Sin embargo, se desconoce el efecto de un control estricto de la glucemia en la reactividad plaquetaria.
En este estudio se evalúa el efecto en la reactividad plaquetaria de un protocolo optimizado para el control de la glucemia con insulina, en comparación con un protocolo convencional.
MÉTODOSDiseño del estudioEl estudio CHIPS12 (Control de Hiperglucemia y Actividad Plaquetaria en Pacientes con Síndrome Coronario Agudo) es un ensayo aleatorizado y unicéntrico que evaluó en una primera aleatorización los efectos de un protocolo intensivo con insulina intravenosa para el control de la glucemia en la reactividad plaquetaria de pacientes con SCA e hiperglucemia. Los detalles y los resultados de esta primera aleatorización del estudio se han publicado recientemente12,13.
Para el estudio a largo plazo, en el momento del alta hospitalaria se volvió a aleatorizar a los pacientes 1:1 a un tratamiento optimizado para el control de la glucemia (glucemia objetivo, 80-120 mg/dl) o un tratamiento convencional (glucemia objetivo, < 180 mg/dl). El manejo optimizado consistió en un seguimiento por una unidad de diabetes mellitus llevada por endocrinólogos expertos en diabetes mellitus. En este grupo, los pacientes recibieron por protocolo insulina ultralenta junto con bolos de insulina rápida en las comidas. Por otro lado, el manejo convencional consistió en un seguimiento por los médicos de atención primaria que a su juicio enviaban o no a los pacientes a un endocrinólogo general. La evaluación de la glucemia se realizó mediante test de glucosa capilar (Accu-Chek® Sensor; Roche, Manheim, Alemania).
En cuanto al manejo tras el SCA, todos los participantes recibieron el tratamiento recomendado por las actuales guías de práctica clínica, salvo contraindicación20,22,23. El estudio se realizó de acuerdo con la Declaración de Helsinki y fue aprobado por el comité ético de nuestro centro. Todos los participantes dieron su consentimiento por escrito para la participación en el estudio.
El objetivo primario del estudio se definió como la reducción de la agregación plaquetaria tras estímulo con adenosina difosfato (ADP) 20 μM evaluado a los 12 meses del SCA. Como objetivos secundarios, se evaluaron la reducción de la función plaquetaria con otros parámetros de agregación y de activación y la incidencia de eventos cardiovasculares.
Análisis de la función plaquetariaPara el estudio de la función plaquetaria, las muestras sanguíneas se recogieron mediante venopunción del antebrazo; se extrajo un volumen total de sangre de aproximadamente 30 ml, basalmente (en el momento del alta hospitalaria y antes de la aleatorización) y a los 12 meses del tratamiento. Los 3 ml iniciales se desecharon para evitar una activación plaquetaria espontánea. Investigadores ciegos al grupo de intervención asignado analizaron en menos de 1 h todas las muestras.
Agregación plaquetariaLa agregación plaquetaria se valoró mediante un agregómetro de transmisión de luz de dos canales (IZASA, Chrono-Log Model 490) por turbidimetría, utilizando plasma rico en plaquetas24. Se añadieron agonistas plaquetarios como estímulo: ADP 5 y 20 μM (objetivo primario del estudio), colágeno 6 μg/ml, epinefrina 20 μM y péptido del receptor activado de la trombina 25 μM. El plasma rico en plaquetas se obtuvo tras centrifugación de la sangre citratada durante 10 min a 800 rpm; posteriormente se mantuvo a 37°C durante 20 min antes de su uso. El plasma pobre en plaquetas se obtuvo a través de una segunda centrifugación del resto de sangre durante 10 min a 2.500 rpm. El recuento plaquetario en el plasma rico en plaquetas se ajustó a 250.000/μl mediante dilución del plasma autólogo cuando el recuento plaquetario se encontraba fuera de rango. El análisis de la agregación se realizó ajustando el agregómetro con plasma rico en plaquetas como referencia de 0% de transmisión de luz (0% de agregación) y plasma pobre en plaquetas como referencia del 100%, midiéndose durante 5 min el aumento en la transmisión de luz a través de la suspensión de plasma rico en plaquetas sometida a agitación constante e incubada a 37°C en presencia de un agonista plaquetario.
Índice de reactividad plaquetariaLa activación del receptor plaquetario P2Y12 se analizó mediante el índice de reactividad plaquetaria. Este índice se determinó mediante la evaluación de la proteína intracelular plaquetaria, según los protocolos previamente publicados25. Brevemente, la fosforilación de la fosfoproteína estimulada por vasodilatador se midió por citometría de flujo (Coulter EPICS XL-MCL™, SYSTEM II™ Software; Coulter, Miami, Florida, Estados Unidos) usando un kit comercial etiquetado con anticuerpos monoclonales (Biocytex Inc.; Marsella, Francia). El índice de reactividad plaquetaria se calculó después de medir la intensidad de fluorescencia media de la fosforilación de fosfoproteína estimulada por vasodilatador tras la adición de prostaglandina E1 (PGE1) y PGE1 + ADP. La PGE1 incrementa la fosforilación de fosfoproteína estimulada por vasodilatador a través de la estimulación de la adenilato ciclasa, mientras que la unión del ADP a receptores purinérgicos lleva a la inhibición de aquella. De esta forma, la adición de ADP a plaquetas estimuladas con PGE1 reduce la concentración de fosfoproteína estimulada por vasodilatador fosforilada inducida por PGE1. La elevación del índice de reactividad plaquetaria, por lo tanto, indica una upregulation de los mecanismos activadores del receptor P2Y12.
Expresión de selectina-P y activación de la glucoproteína IIb/IIIaLa expresión en la superficie plaquetaria del receptor activado de glucoproteína (GP) IIb/IIIa se evaluó usando anticuerpos PAC-1 (PAC1-FITC conjugated, Becton Dickinson; Rutherford, Nueva Jersey, Estados Unidos), como se ha descrito previamente26. La expresión de selectina-P se analizó mediante el anticuerpo anti-CD62P conjugado con ficoeritrina (0,3 mg/ml; Becton Dickinson, San Jose, California, Estados Unidos). Ambos receptores se evaluaron antes y después de la adición de ADP 10 μM. Las muestras se analizaron en 2 h por citometría de flujo (Coulter EPICS XL-MCL™, SYSTEM II™ Software; Coulter, Miami, Florida). La activación plaquetaria se expresó como el porcentaje de plaquetas positivas para la unión con el anticuerpo.
Análisis estadísticoSe comprobó la distribución normal de las variables mediante la prueba de Kolmogorov-Smirnov. Las variables cuantitativas se expresaron mediante la media ± desviación estándar si cumplían la condición de normalidad o mediante mediana [intervalo intercuartílico] en caso contrario. Las variables categóricas se expresaron mediante frecuencias y porcentajes. En todos los casos se comprobó la distribución de la variable frente a los modelos teóricos y se contrastó la hipótesis de homogeneidad de varianzas. La asociación entre variables categóricas se comprobó mediante el test de la χ2 o el test exacto de Fisher cuando al menos el 25% de los valores presentaban una frecuencia esperada < 5. Se utilizó la prueba de la t de Student para comparar variables cuantitativas con dicotómicas. De no cumplir con la condición de normalidad, se utilizó el test no paramétrico de la U de Mann-Whitney. La asociación entre variables cuantitativas se determinó mediante la correlación de Pearson. Se consideraron significativas la diferencias encontradas con una probabilidad de error ≤ 5% (p ≤ 0,05). Para el análisis de los datos se utilizó el programa SPSS versión 15.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
RESULTADOSDe los 115 pacientes aleatorizados en el estudio CHIPS, 5 fallecieron durante el ingreso hospitalario y 6 rechazaron continuar en el estudio en el momento de la segunda aleatorización. En total, al alta hospitalaria se aleatorizó a 104 pacientes a un tratamiento optimizado (n = 53) o convencional (n = 51). Las características basales, en cuanto a variables demográficas, características clínicas, datos de laboratorio y hallazgos angiográficos, se detallan en la tabla 1. No se objetivaron diferencias significativas entre ambos grupos en ninguna de las variables evaluadas, incluido el análisis de la función plaquetaria en el momento del alta hospitalaria (tabla 2).
Características clínicas según el grupo de tratamiento
| Control optimizado | Control convencional | p | |
| Pacientes | 53 | 51 | |
| Edad (años) | 67,2 ± 11,7 | 66,7 ± 12,3 | 0,84 |
| Varones | 34 (64,2) | 33 (64,7) | 0,95 |
| Factores de riesgo | |||
| Tabaquismo | 18 (34,0) | 13 (25,5) | 0,56 |
| Hipertensión | 41 (77,4) | 35 (68,6) | 0,32 |
| Dislipemia | 24 (45,3) | 27 (52,9) | 0,44 |
| Diabetes mellitus conocida | 36 (67,9) | 29 (56,9) | 0,24 |
| Antecedentes médicos | |||
| Ictus previo | 1 (1,9) | 0 | 0,32 |
| Enfermedad arterial periférica | 8 (15,1) | 5 (9,8) | 0,42 |
| Insuficiencia renal crónica | 4 (7,5) | 3 (5,9) | 0,74 |
| Episodio de SCA durante la hospitalización | |||
| SCACEST | 24 (45,3) | 26 (51,0) | 0,56 |
| Localización anterior | 7 (13,7) | 10 (20,0) | 0,40 |
| Clase Killip ≥ 2 | 20 (37,7) | 22 (43,1) | 0,58 |
| Enfermedad multivaso | 25 (51,0) | 28 (56,0) | 0,61 |
| Tratamiento intensivo con insulina al ingreso | 29 (54,7) | 25 (49,0) | 0,56 |
| FEVI (%) | 52,2 ± 13,2 | 50,6 ± 13,6 | 0,54 |
| Análisis de laboratorio | |||
| Glucosa (mg/dl) | 144 [111-180] | 142 [109-179] | 0,22 |
| HbA1c (%) | 7,5 ± 1,8 | 7,2 ± 1,7 | 0,29 |
| Hematocrito (%) | 38,2 ± 5,9 | 39,5 ± 6,1 | 0,29 |
| Recuento plaquetario (× 103/μl) | 216,6 ± 74,8 | 214,0 ± 68,3 | 0,88 |
| Creatinina (mg/dl) | 1,2 ± 0,7 | 1,1 ± 0,4 | 0,39 |
| Aclaramiento de creatinina (ml/min)* | 78,5 ± 36,8 | 76,6 ± 30,4 | 0,77 |
| Cistatina C (mg/dl) | 1,0 ± 0,5 | 0,9 ± 0,4 | 0,23 |
| Manejo durante la hospitalización | |||
| ACTP + stent farmacoactivo | 28 (54,9) | 19 (38,8) | 0,16 |
| ACTP + stent convencional | 9 (17,0) | 7 (13,7) | 0,84 |
| CRC | 4 (7,8) | 4 (8,2) | 0,95 |
| No revascularizados | 10 (19,6) | 9 (18,4) | 0,87 |
| Ácido acetilsalicílico | 51 (96,2) | 50 (98,0) | 0,59 |
| Clopidogrel | 47 (88,7) | 42 (81,0) | 0,34 |
| Bloqueadores beta | 43 (81,0) | 44 (88,0) | 0,19 |
| Estatinas | 51 (96,2) | 48 (94,0) | 0,96 |
| Insulina al alta hospitalaria | 35 (66,0) | 31 (60,8) | 0,34 |
ACTP: angioplastia coronaria transluminal percutánea; CRC: cirugía de revascularización coronaria; FEVI: fracción de eyección del ventrículo izquierdo; HbA1c: glucohemoglobina; SCA: síndrome coronario agudo; SCACEST: síndrome coronario agudo con elevación del segmento ST.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Análisis de la función plaquetaria basal (al alta hospitalaria)
| Control optimizado | Control convencional | p | |
| Pacientes | 53 | 51 | |
| Agregación plaquetaria (%) | |||
| ADP 5μM | 23,1 (20,1) | 24,7 (21,5) | 0,73 |
| ADP 20μM | 34,0 (24,8) | 35,2 (28,3) | 0,83 |
| Colágeno 6μg/ml | 28,7 (22,2) | 26,1 (28,4) | 0,85 |
| Epinefrina 20μM | 20,6 (14,7) | 21,1 (11,9) | 0,69 |
| TRAP 25μM | 47,1 (28,2) | 46,4 (29,2) | 0,91 |
| Activación plaquetaria (%) | |||
| Índice de reactividad plaquetaria | 63,1 (22,0) | 65,3 (22,1) | 0,60 |
| Expresión de selectina-P | 54,9 (22,1) | 53,9 (23,0) | 0,79 |
| Expresión de GPIIb/IIIa | 41,9 (31,7) | 42,7 (32,6) | 0,91 |
ADP: adenosina difosfato; GPIIb/IIIa: glucoproteína IIb/IIIa; TRAP: péptido del receptor activado de la trombina.
El manejo de la hiperglucemia durante el año de seguimiento, así como el tratamiento administrado y los eventos adversos objetivados, se detallan en la tabla 3. En los pacientes asignados a un tratamiento optimizado se realizó un mayor número de tests de glucemia capilar diarios y se controlaron de manera más exhaustiva (p < 0,001). El tratamiento optimizado, respecto al convencional, supuso un mejor control de la glucemia a los 12 meses (104 frente a 119 mg/dl; p < 0,001), así como un mejor control metabólico evaluado por las cifras de HbA1c (6,4 ± 0,7 frente a 6,8 ± 1,3 mg/dl; p < 0,001). Además, el manejo optimizado mostró un menor deterioro de la función renal en comparación con el manejo convencional. Este hecho se objetivó mejor con la medición de la cistatina C (0,8 ± 0,2 frente a 1,1 ± 0,6; p = 0,03).
Manejo a largo plazo y eventos cardiovasculares según el grupo de tratamiento
| Control optimizado | Control convencional | p | |
| Pacientes | 53 | 51 | |
| Control de la glucemia durante el estudio | |||
| Pacientes fuera de rangoa | 4 (7,7) | 2 (3,9) | 0,20 |
| Tests de glucosa capilar diarios | 5,4 ± 2,2 | 2,4 ± 1,0 | < 0,001 |
| Visitas médicas | 7,4 ± 2,0 | 3,6 ± 1,1 | < 0,001 |
| Análisis de laboratorio a los 12 meses | |||
| Glucosa (mg/dl) | 104 [88-124] | 119 [92-140] | < 0,001 |
| HbA1c (%) | 6,4 ± 0,7 | 6,8 ± 1,3 | < 0,001 |
| Hematocrito (%) | 39,5 ± 5,3 | 39,2 ± 5,8 | 0,76 |
| Recuento plaquetario (× 103/μl) | 227,1 ± 80,0 | 223,8 ± 76,4 | 0,57 |
| Creatinina (mg/dl) | 1,1 ± 0,6 | 1,0 ± 0,2 | 0,42 |
| Aclaramiento de creatinina (ml/min)b | 71,0 ± 33,4 | 72,8 ± 27,4 | 0,06 |
| Cistatina C (mg/dl) | 0,8 ± 0,2 | 1,1 ± 0,6 | 0,03 |
| Tratamiento a los 12 meses | |||
| Ácido acetilsalicílico | 51 (96,2) | 50 (98,0) | 0,59 |
| Clopidogrel | 36 (69,4) | 34 (66,7) | 0,80 |
| Antidiabéticos orales | 20 (37,7) | 40 (78,4) | < 0,001 |
| Insulina | 51 (96,2) | 26 (50,9) | < 0,001 |
| Eventos durante el seguimiento | |||
| Muerte | 2 (3,9) | 1 (2,0) | 0,42 |
| Reinfarto | 4 (7,7) | 6 (12,5) | 0,71 |
| Hipoglucemia < 60 mg/dl | 21 (39,6) | 6 (12,5) | < 0,001 |
| Hipoglucemia gravec | 5 (9,4) | 1 (2,0) | 0,10 |
| Hemorragia mayord | 2 (3,9) | 1 (2,0) | 0,74 |
| Hemorragia menord | 6 (11,3) | 5 (9,8) | 0,76 |
| Arritmias ventriculares | 4 (7,5) | 1 (2,0) | 0,19 |
HbA1c: glucohemoglobina.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
No se objetivaron diferencias en cuanto al tratamiento antiagregante, aunque sí en el manejo de la hiperglucemia, con un mayor porcentaje de pacientes tratados con insulina en vez de con antidiabéticos orales en el grupo de tratamiento optimizado. En cuanto a los eventos adversos, un mayor número de pacientes con el manejo optimizado presentaron episodios de hipoglucemia (glucemia < 60mg/dl), pero no se obtuvieron diferencias estadísticamente significativas en el número de episodios de hipoglucemia grave (el 9,4 frente al 2,0%; p = 0,10).
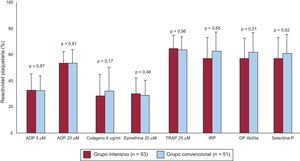
Análisis de la función plaquetaria durante el seguimientoLa figura refleja los resultados del análisis de la función plaquetaria a los 12 meses de tratamiento. No se objetivaron diferencias estadísticamente significativas entre el tratamiento optimizado y el convencional, tanto para el objetivo primario del estudio, la agregación plaquetaria tras estímulo con ADP 20 μM (el 54,2 ± 14,3% frente al 55,1 ± 18,3%; p = 0,81), como para los demás parámetros analizados: ADP 5 μM (el 34,0 ± 15,6% frente al 33,4 ± 15,8%; p = 0,87), colágeno 6 μg/ml (el 29,1 ± 23,1% frente al 37,2 ± 22,9%; p = 0,17), epinefrina 20 μM (el 32,9 ± 15,0% frente al 30,1 ± 16,1%; p = 0,46), péptido del receptor activado de la trombina 25 μM (el 67,6 ± 12,5% frente al 65,8 ± 14,3%; p = 0,56), índice de reactividad plaquetaria (el 59,3 ± 22,1% frente al 64,2 ± 22,6%; p = 0,44), expresión de GPIIb/IIIa (el 60,1 ± 16,7% frente al 65,5 ± 19,2%; p = 0,21) y expresión de selectina-P (el 61,0 ± 23,7% frente al 63,5 ± 23,4%; p = 0,65).
DISCUSIÓNNuestro estudio es el primero en evaluar un protocolo para el control intensivo de la glucemia a largo plazo en pacientes con hiperglucemia que han sufrido un SCA. A pesar de que se ha demostrado que los pacientes diabéticos presentan una elevada reactividad plaquetaria5, y que a su vez una mayor reactividad plaquetaria se traduce en mayor incidencia de eventos cardiovasculares a largo plazo21, nuestro estudio no detectó una reducción significativa de la función plaquetaria con ninguno de los tests analizados tras aplicar un protocolo intensivo con insulina.
Varias son las hipótesis sobre por qué nuestro estudio no objetivó diferencias significativas entre ambos grupos de tratamiento. En primer lugar, los pacientes del estudio tenían un control aceptable del metabolismo hidrocarbonado en el momento de la inclusión, con HbA1c en ambos brazos < 8%. Dado que se sabe que el beneficio en la reducción de la reactividad plaquetaria con un tratamiento intensivo con insulina es mayor para los pacientes con peor control previo, el beneficio total pudo ser menor en nuestro estudio13. En segundo lugar, aunque fue una reducción estadísticamente significativa, las cifras de glucemia alcanzadas en ambos grupos de tratamiento son adecuadas, con una diferencia absoluta entre ambos de 15 mg/dl. De hecho, en el estudio DIGAMI-2, las diferencias obtenidas entre ambos grupos de tratamiento eran de 16 mg/dl, y este hecho es uno de los argumentos que los autores dieron para explicar la ausencia de diferencias significativas entre los diferentes tratamientos16.
Por otro lado, este estudio indica que un protocolo para el control más agresivo de la glucemia a largo plazo enlentece el daño microvascular. Así, se pudo observar que con el control optimizado se redujo el deterioro de la función renal. Es interesante que la cistatina C fuera el parámetro que mejor objetivó el daño renal, por encima del aclaramiento de creatinina o los valores de creatinina plasmática. Este hecho adquiere gran relevancia en la práctica clínica, puesto que se ha demostrado que la cistatina C es un marcador pronóstico independiente en pacientes con un SCA29. Más controversia ha generado en la literatura médica si un protocolo intensivo para el control de la glucemia puede reducir el daño macrovascular. Los últimos estudios publicados muestran resultados contradictorios, incluso con aumento de la mortalidad en el grupo de control intensivo. Parece que el hecho de encontrar una mayor tasa de eventos cardiovasculares en alguno de ellos se debe más a la intensidad con que se disminuye la glucemia y con los episodios de hipoglucemia. De hecho, recientemente se han publicado varios metanálisis con los resultados de grandes ensayos clínicos, donde se ha podido comprobar una reducción en la incidencia de infarto de miocardio con el tratamiento intensivo, pero sin una disminución en la mortalidad total30–32. En nuestro estudio no se objetivaron diferencias significativas en los eventos cardiovasculares; aunque se objetivó mayor incidencia de hipoglucemias, no se observaron diferencias significativas en los episodios de hipoglucemia sintomáticos o < 40 mg/dl.
LimitacionesAunque se trata de un ensayo aleatorizado, se realizó en un único centro. El estudio carece de potencia suficiente para detectar diferencias, si las hubiera, en cuanto a los eventos adversos, fundamentalmente las hipoglucemias graves. No obstante, y a pesar de estas limitaciones, la consistencia de la metodología y del análisis estadístico refuerza los resultados obtenidos.
CONCLUSIONESEl control intensivo a largo plazo de la glucemia con insulina en pacientes con un SCA e hiperglucemia no reduce la reactividad plaquetaria, en comparación con un tratamiento convencional. No obstante, la implementación de un protocolo agresivo para el manejo ambulatorio a largo plazo de la hiperglucemia en pacientes con un SCA es factible y potencialmente seguro, con un porcentaje bajo de hipoglucemias graves, y puede disminuir la progresión del deterioro renal, en comparación con un protocolo convencional.
FINANCIACIÓNEste estudio se ha financiado con una beca no condicionada de la FIC (Fundación Interhospitalaria para la Investigación Cardiovascular) (Madrid, España; CIF G-81563801).
CONFLICTO DE INTERESESNinguno.