Palabras clave
Las estatinas inhiben la actividad de la 3-hidroxi-3-metilglutaril coenzima A (HMG-CoA) reductasa, enzima que cataliza la síntesis de mevalonato, paso limitante en la biosíntesis del colesterol1. La reducción resultante en el colesterol intracelular conduce a un aumento compensatorio de la captación de colesterol por los receptores de la lipoproteína de baja densidad (LDL) y a una disminución en el colesterol plasmático. El descubrimiento de las estatinas y su utilización en sujetos con valores elevados de colesterol ha permitido importantes logros en la prevención primaria y secundaria de la enfermedad coronaria2,3. Recientemente, la eficacia de las estatinas en la prevención primaria y secundaria de la enfermedad coronaria se ha extendido también a sujetos con valores de colesterol más bajos4-6. Además de reducir el colesterol LDL (cLDL), las estatinas tienen una serie de efectos pleiotrópicos en varios componentes de la aterosclerosis, incluyendo la función endotelial, la migración celular, y la inflamación y tendencia trombótica de la placa7-12. En animales normocolesterolémicos se ha evidenciado que las estatinas tienen un efecto protector en la lesión por isquemia-reperfusión del músculo cardíaco, probablemente a través de mecanismos relacionados con la producción de óxido nítrico (NO) derivado del endotelio13.
La serina/treonina proteína cinasa Akt o proteína cinasa B (PKB) es un regulador intracelular multifuncional de la supervivencia, crecimiento y metabolismo celular14 (fig. 1). En relación a sus funciones cardiovasculares, Akt/PKB actúa en la vía intracelular estimulada por el factor de crecimiento endotelial vascular (VEGF)14,15 y la angiopoyetina16-18, promoviendo la supervivencia celular y asegurando un desarrollo vascular adecuado19. La activación constitutiva de la señalización Akt protege a los cardiomiocitos de la apoptosis en la lesión por isquemia-reperfusión20. Además de su papel citoprotector, Akt funciona como un activador de la producción de NO por el endotelio en respuesta al VEGF y al estrés de cizallamiento a través de su capacidad para fosforilar la sintasa de óxido nítrico endotelial (eNOS) en las serinas 1179 o 117721,22, controlando de esta manera el tono vasomotor23. Por otra parte, Akt es esencial en la migración de las células endoteliales hacia el foco productor de VEGF24. Así pues, la capacidad de Akt para mediar la supervivencia celular, la producción de NO y la migración inducida por VEGF sugieren que la proteína cinasa Akt puede mediar la respuesta del endotelio a los estímulos angiogénicos.
Fig. 1. Estatinas, señalización Akt y angiogénesis/vasculogénesis. La angiopoyetina 1 (Ang-1), el VEGF y el factor de crecimiento de fibroblastos (FGF), al unirse a sus receptores de membrana, inducen la conversión de fosfatidilinositol 4,5-bifosfato (PIP2) a fosfatidilinositol 3,4,5-trifosfato (PIP3) por la fosfatidilinositol 3-cinasa (PI3K). La formación de PIP3 es necesaria para la fosforilación de la proteína cinasa Akt por la cinasa PDK-1. El tratamiento con estatinas aumenta la fosforilación de Akt, mientras la wortmanina (un inhibidor de PI3K) la previene. El mevalonato, el producto de la HMG-CoA reductasa, también inhibe la PI3K y la consiguiente fosforilación de Akt. Por tanto, las estatinas, al inhibir la HMG-CoA reductasa y la producción de mevalonato, aumentan la fosforilación de Akt y con ello la fosforilación y activación de la sintasa de óxido nítrico endotelial (eNOS), la síntesis de óxido nítrico (NO) y una variedad de efectos fisiológicos inducidos en la angiogénesis y vasculogénesis. La Akt también previene la apoptosis en las células endoteliales.
Recientemente se ha demostrado que las estatinas también estimulan la vía de señalización intracelular de la proteína cinasa Akt/PKB25-27 en las células endoteliales25 y las células endoteliales progenitoras (EPC) procedentes de la médula ósea26,27 y esto promueve tanto la angiogénesis25 como la vasculogénesis26. Los efectos de las estatinas en la cinética de las EPC han sido también demostrados en el hombre por Vasa et al28. Este artículo pretende revisar el efecto de las estatinas en la inducción de angiogénesis25 y vasculogénesis26 a través de mecanismos relacionados con la activación de la Akt25-27.
ANGIOGÉNESIS Y VASCULOGÉNESIS
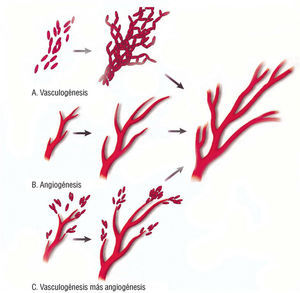
La angiogénesis y la vasculogénesis son responsables del desarrollo del sistema vascular en el embrión29-32. La vasculogénesis es el proceso de formación de los vasos sanguíneos a partir de células endoteliales progenitoras (angioblastos), las cuales migran y se fusionan con otras células endoteliales progenitoras y se diferencian en células endoteliales mientras forman nuevos vasos. Por el contrario, la angiogénesis es el proceso de extensión de vasos ya formados por gemación de nuevos capilares a través de la migración y proliferación de células endoteliales previamente diferenciadas (fig. 2).
Fig. 2. Representación esquemática de la angiogénesis y vasculogénesis. (A) La vasculogénesis es la agregación de angioblastos o células endoteliales progenitoras para formar los vasos sanguíneos. Los angioblastos coalescen in situ o migran para formar vasos sanguíneos en sitios distantes. (B) La angiogénesis es la formación de nuevos vasos a partir de vasos preexistentes por proliferación y migración de células endoteliales diferenciadas. (C) La angiogénesis y la vasculogénesis también pueden suceder de forma simultánea. (Tomada de Cleaver et al29.)
Inicialmente se creía que el proceso de vasculogénesis estaba restringido al desarrollo embrionario, mientras que la angiogénesis (que también ocurre en el embrión) era la única responsable de la neovascularización en el adulto; sin embargo, el paradigma de la neovascularización posnatal ha sido revisado recientemente con el descubrimiento de que las células endoteliales progenitoras circulan en sangre periférica33, se incorporan en los focos de neovascularización en los animales adultos34, aumentan en número en respuesta a la isquemia tisular35 y promueven el desarrollo de vasos colaterales después de su expansión in vitro y su posterior trasplante36. Estos estudios han establecido que tanto la angiogénesis como la vasculogénesis son responsables de la neovascularización en los adultos.
Un tercer mecanismo que probablemente contribuye al desarrollo de vasos colaterales es el incremento en tamaño y calibre de conexiones colaterales arteriolares preexistentes, un proceso llamado arteriogénesis37. La presencia y número de estos vasos colaterales nativos varía mucho entre individuos y especies. Cuando un vaso se ocluye, se produce un aumento en la velocidad del flujo sanguíneo en los vasos colaterales preexistentes y un incremento del estrés de cizallamiento en la luz, factores que contribuyen a la maduración de los vasos colaterales, particularmente los de mediano tamaño.
Métodos de estudio in vitro
El desarrollo de las técnicas de cultivo de células endoteliales ha permitido una mayor comprensión de los procesos involucrados en la angiogénesis38. Las células endoteliales en cultivo retienen la capacidad de responder a los factores que estimulan o inhiben la angiogénesis y también la capacidad de formar tubos endoteliales in vitro. Los ensayos de proliferación celular permiten el análisis del efecto de una determinada sustancia en la proliferación celular endotelial. La migración de las células endoteliales hacia una solución que contenga una determinada sustancia, separada por una membrana porosa, puede ser analizada en la cámara de Boyden. Los mecanismos de formación tubular endotelial y el efecto de una determinada sustancia sobre éstos se estudian mediante la utilización de ensayos bidimensionales o tridimensionales. Con estas técnicas se analizan los procesos de formación de la luz endotelial y la influencia de la matriz extracelular en el desarrollo del capilar38. Finalmente, los cultivos de células endoteliales permiten el estudio de las vías moleculares involucradas en los procesos de angiogénesis.
Recientemente, mediante el uso de técnicas de selección celular y medios de cultivo especiales, se han utilizado las técnicas empleadas con células endoteliales diferenciadas para el estudio de las células endoteliales progenitoras33-36.
Métodos de estudio in vivo
Si bien las técnicas in vitro permiten un análisis inicial de la angiogénesis y la vasculogénesis, existen múltiples factores que pueden influir o modular estos procesos in vivo38. Con el objetivo de estudiar los mecanismos de formación de vasos sanguíneos in vivo, se han desarrollado diferentes sistemas biológicos que permiten cuantificar o demostrar el efecto de una determinada sustancia: el microsaco corneal en el ratón, la membrana corioalantoidea en el embrión de pollo o los implantes esponjosos38. Estos sistemas, al requerir el posterior sacrificio del animal, sólo permiten capturar el efecto en un determinado momento. Para estudiar la evolución temporal de los acontecimientos en un mismo tejido, se han desarrollado las técnicas de microscopia intravital en la piel del dorso o en la piel del cráneo del ratón39. Finalmente, el desarrollo de las técnicas de ingeniería genética ha permitido estudiar el efecto de la supresión (knock-out) o adición (knock-in) de un gen en los procesos de vasculogénesis y angiogénesis.
El estudio de la vasculogénesis posnatal y el efecto de determinadas sustancias en los procesos de vasculogénesis han sido posibles gracias a la utilización de técnicas de citometría de flujo (FACS), técnicas especiales de cultivo celular de células endoteliales progenitoras (EPC) a partir de sangre periférica y a los modelos murinos de trasplante de médula ósea33-36. Las FACS permiten la detección y cuantificación de las EPC en sangre periférica mediante la utilización de anticuerpos dirigidos contra los antígenos de superficie de estas células. De este modo se puede analizar la influencia de determinados fármacos o factores de crecimiento en el número de estas células en sangre periférica. Las técnicas especiales de selección y cultivo celular desarrolladas por nuestro grupo han permitido también detectar y cuantificar las EPC. En el modelo murino de trasplante de médula ósea se trasplantan a un ratón receptor células de la médula ósea de un ratón donante que tiene en su material genético un gen que codifica la elaboración de una sustancia que permite su detección posterior (fig. 3). En nuestro caso este gen codifica la elaboración de la betagalactosidasa en las células endoteliales. Esta selectividad de expresión se consigue gracias a que, en el ratón donante, este gen está regulado por un promotor específico de las células endoteliales, el Tie-2. Por tanto, sólo las células endoteliales procedentes de la médula ósea del animal donante expresarán la betagalactosidasa que se podrá detectar en el animal receptor. Si después del trasplante de médula ósea, en el animal receptor, se realizan los experimentos biológicos descritos previamente, podremos analizar la influencia de una determinada sustancia en la vasculogénesis, ya que se podrá cuantificar el número de células endoteliales progenitoras que proceden de la médula ósea.
Fig. 3. Modelo murino de trasplante de médula ósea para el estudio de la vasculogénesis. Como donante de médula ósea, se utilizan ratones transgénicos que expresan constitutivamente el gen LacZ (que codifica para la betagalactosidasa) regulado por un promotor endotelial específico, el Tie-2. Se extrae la médula ósea y ésta es trasplantada a un ratón receptor cuya médula ósea ha sido irradiada subletalmente. Después de un período de 4 semanas para conseguir la reconstitución de la médula ósea trasplantada, se realizan una o más intervenciones en el ratón receptor (en el caso ilustrado un modelo de microsaco corneal) con el objetivo de estimular la neovascularización. Después de estas intervenciones, los animales son sacrificados y se realiza el estudio histológico con el fin de detectar la expresión de betagalactosidasa. Cuando se utiliza la tinción X-gal, las células que expresan betagalactosidasa son de color azulado. La utilización de un promotor específico para las células endoteliales permite la identificación de células azules que se han incorporado en los focos de neovascularización como células de linaje endotelial.
EFECTO DE LAS ESTATINAS EN LA INDUCCION DE ANGIOGÉNESIS Y VASCULOGÉNESIS
La investigación realizada tanto en nuestro laborato rio como en otros ha permitido demostrar que las estatinas estimulan la vía de señalización intracelular de la proteína cinasa Akt/PKB25-27, y esto promueve tanto la angiogénesis25 como la vasculogénesis26. Además, Vasa et al también han podido demostrar los efectos en el hombre de las estatinas en la cinética de las EPC28.
Efectos in vitro de las estatinas
Las estatinas activan rápidamente la proteína cinasa Akt/PKB en las células endoteliales25 y las EPC26,27, aumentando de este modo la fosforilación de la eNOS y la producción consiguiente de NO. La activación de la Akt por las estatinas promueve la proliferación, la migración y la supervivencia celular de las células endoteliales y EPC, así como la formación de la estructura vascular. Además, la inhibición de la Akt mediante la utilización de adenovirus que codifican formas de Akt negativas dominantes conduce a la inhibición de los efectos estimulados por las estatinas. Este potencial de las estatinas en los procesos de regeneración tisular fue previamente demostrado en osteoblastos, en los que aumenta su proliferación y nivel de actividad, con el consiguiente aumento en la formación de hueso40.
Si bien no se conocen con precisión los mecanismos de activación de la Akt por las estatinas, es probable que esté involucrada la señalización de la fosfatidilinositol 3-cinasa (PI3K), pues este proceso fue bloqueado por la wortmanina y el LY294002, dos inhibidores de esta enzima (fig. 1). Además, la inhibición de la HMG-CoA reductasa es necesaria, ya que la activación de la Akt por simvastatina fue inhibida cuando se añadía mevalonato a la incubación (fig. 1). Además de la biosíntesis del colesterol, el mevalonato es necesario en la producción de ubiquinona, dolicoles e isoprenoides, los cuales son esenciales en varios procesos celulares. Si bien las estatinas estabilizan el ARN mensajero (ARNm) de la eNOS a través de cambios en la síntesis de isoprenoides41, no pudimos observar cambios en los valores de la proteína sintasa eNOS. En este sentido, es importante destacar que el aumento en la concentración de ARNm ocurre más tarde (24 h) que la activación de la fosforilación de la eNOS por Akt (15 min). Este tiempo de activación más corto es consistente con los cambios inducidos por las estatinas en la producción de NO y en la vasodilatación observada en anillos aórticos ex vivo42.
Efectos in vivo de las estatinas
Las estatinas y la activación de la señalización intracelular de la Akt promueven la angiogénesis en modelos de isquemia periférica realizados en conejos normocolesterolémicos25. En los animales que recibieron estatinas se observaron mayores presiones de perfusión, un mayor número de colaterales y una mayor densidad capilar (fig. 4). Por otro lado, las estatinas aumentan el número de células endoteliales progenitoras en sangre periférica tanto en ratones26,27 como en humanos28. Además, las estatinas aumentan la neovascularización corneal en ratones normocolesterolémicos y esto en parte se debe a vasculogénesis a partir de EPC procedentes de la médula ósea (figs. 3 y 5)26. Mediante el modelo murino de trasplante de médula ósea fue posible evidenciar un mayor número de EPC procedentes de médula ósea en las córneas de aquellos ratones que fueron tratados con estatinas. Así pues, las estatinas tienen un importante efecto en la cinética de las EPC, tal y como previamente se había demostrado con el VEGF o el factor estimulador de colonias de granulocitos y monocitos (GM-CSF)35, y la movilización de estas células inducida por estos fármacos podría aumentar la neovascularización posnatal.
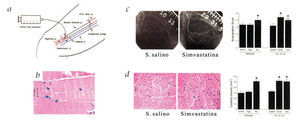
Fig. 4. Aumento de la neovascularización inducida por estatinas en la pierna del conejo en respuesta a la resección unilateral de la arteria femoral. a) La arteria femoral y sus ramas se disecan. La transferencia genética al endotelio se realiza mediante la infusión de adenovirus que codifican betagalactosidasa (Ad-βgal) o Akt (Ad-myrAkt) a la arteria femoral distal y la posterior incubación durante 15 min con el pinzamiento temporal de la vena femoral. b) Al tercer día, se extrae el músculo gastrocnemio y se realiza la tinción X-gal con el objetivo de determinar la distribución transgénica en las preparaciones histológicas de hematoxilina-eosina. c) La angiografía a través de ilíaca interna se realiza con el objeto de analizar la formación de colaterales en los diferentes grupos de tratamiento. En las angiografías realizadas a los 40 días se evidencia el incremento en la formación de vasos colaterales en aquellos animales que recibieron 0,1 mg/kg de simvastatina por inyección intraperitoneal en relación a los animales que fueron intervenidos pero sólo recibieron suero salino. El análisis cuantitativo de los vasos colaterales se realizó en el grupo control, en el grupo tratado con simvastatina y en el grupo de animales que recibieron una inyección intramuscular de Ad-VEGF. La puntuación angiográfica también fue analizada en los grupos experimentales que recibieron infusión de suero salino, Ad-βgal y Ad-myrAkt a los 31 días después de la cirugía. d) La tinción fosfatasa alcalina del músculo aductor de la pierna isquémica muestra una mayor densidad capilar en el grupo de animales tratados con simvastatina respecto al grupo control a los 40 días poscirugía. Los datos de cada experimento son presentados como la media ± DE (n = 6 conejos en cada uno de los grupos de tratamiento, *p < 0,05 en relación al grupo de infusión o inyección de suero salino mediante el análisis de la varianza de una sola cola). (Tomada de Kureishi et al25.)
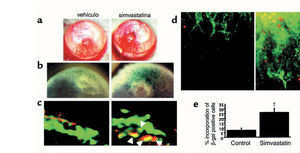
Fig. 5. Aumento de la neovascularización corneal por vasculogénesis inducida por estatinas. a) Fotos representativas en las que se evidencia la neovascularización corneal (izquierda, vehículo; derecha, simvastatina). b) Tinción X-gal de córneas enteras. Los puntos azulados son las células que expresan betagalactosidasa (izquierda, vehículo; derecha, simvastatina). c) Microfotografías representativas del examen histoquímico por fluorescencia de córneas en parafina procedentes de ratones Tie2/LacZ/BMT (izquierda, vehículo; derecha, simvastatina). La presencia de células doblemente positivas es una evidencia de que las células endoteliales progenitoras (EPC) procedentes de la médula ósea se incorporan en los focos de neovascularización (vasculogénesis). El color rojo muestra en este caso la betagalactosidasa y el color verde muestra el marcador endotelial específico isolectina B4. Las células doblemente positivas (color amarillo) son aquellas EPC procedentes de la médula ósea que se han incorporado en los nuevos vasos. d) Microfotografías representativas del examen histoquímico por fluorescencia de córneas enteras procedentes de ratones Tie2/LacZ/BMT (izquierda, vehículo; derecha, simvastatina). El color rojo muestra la betagalactosidasa y el color verde muestra el marcador endotelial específico lectina BS-1. e) Cuantificación de las EPC derivadas del trasplante incorporadas en la nueva vasculatura. Se expresa como la razón entre el número de EPC y el número total de células endoteliales que forman los nuevos vasos. +p < 0,05. (Tomada de Llevadot et al26.)
CONCLUSIONES
Las estatinas promueven la proliferación, migración y supervivencia celular de las células endoteliales y las EPC que proceden de la médula ósea a través de mecanismos relacionados con la activación de la serina/treonina proteína cinasa Akt o PKB. De forma similar al VEGF, las estatinas promueven la angiogénesis y la vasculogénesis. Así pues, la activación de la Akt puede ser responsable de parte de los efectos beneficiosos de las estatinas, incluyendo la neovascularización posnatal.
Correspondencia: Dr. J. Llevadot.
Servicio de Cardiología.
Centro Cardiovascular Sant Jordi.
Via Augusta, 269-273. 08017 Barcelona.
Correo electrónico: 27558jlg@comb.es