El ácido úrico y la gammaglutamil transferasa son indicadores pronósticos en la insuficiencia cardiaca crónica. No obstante, el mecanismo subyacente a la asociación observada entre ácido úrico, gammaglutamil transferasa y progresión y pronóstico de la insuficiencia cardiaca crónica sigue siendo en gran parte desconocido.
MétodosSe estudió la asociación del ácido úrico y la gammaglutamil transferasa con la dilatación mediada por flujo y con los índices ecocardiográficos del remodelado cardiaco en 120 pacientes con insuficiencia cardiaca isquémica crónica. Para determinar la contribución independiente del ácido úrico y la gammaglutamil transferasa en la dilatación mediada por flujo y en los índices ecocardiográficos del remodelado, se construyó una serie de modelos de regresión lineal múltiple, basados en los factores de riesgo tradicionales y no tradicionales que influyen en estos parámetros.
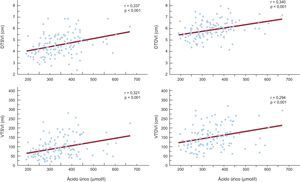
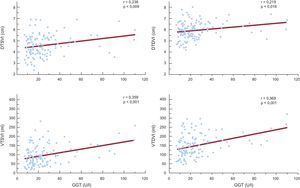
ResultadosEl ácido úrico es un factor independiente predictivo de dilatación mediada por flujo, pero no la gammaglutamil transferasa. El ácido úrico se asocia a todos los índices ecocardiográficos de disfunción ventricular izquierda evaluados en tres modelos de regresión múltiple; también muestra correlación con los diámetros telesistólico (r = 0,337) y telediastólico (r = 0,340) y los volúmenes telesistólico (r = 0,321) y telediastólicos (r = 0,294) del ventrículo izquierdo (p = 0,001). La gammaglutamil transferasa es un factor independiente predictivo de los volúmenes telesistólico y telediastólico del ventrículo izquierdo tras introducir un ajuste por todas las variables. La gammaglutamil transferasa muestra correlación con los diámetros telesistólico (r = 0,238; p = 0,009) y telediastólico (r = 0,219; p = 0,016) y los volúmenes telesistólico (r = 0,359; p < 0,001) y telediastólico (r = 0,369; p = 0,001) del ventrículo izquierdo.
ConclusionesEl ácido úrico y la actividad de gammaglutamil transferasa se asocian a los índices de remodelado ventricular izquierdo en pacientes con insuficiencia cardiaca isquémica crónica.
Palabras clave
La insuficiencia cardiaca crónica (ICC) es un síndrome de elevada prevalencia en todos los países industrializados y se asocia a gran morbilidad y mortalidad. Hay varios tipos de biomarcadores indicativos de la activación neurohumoral, la inflamación sistémica, el estrés oxidativo, el metabolismo y la disfunción renal, así como la anemia, que se ha demostrado que se asocian a la gravedad y la progresión de la enfermedad1. Además del péptido natriurético cerebral, sus derivados y la proteína C reactiva, en el pronóstico de la ICC se ha prestado especial atención a dos análisis de laboratorio de bajo coste, fácilmente disponibles y con alta sensibilidad: las determinaciones de ácido úrico (AU) y gammaglutamil transferasa (GGT) en plasma. Aunque la elevación de los valores plasmáticos de AU y GGT se asocia de manera significativa a la gravedad de la enfermedad, su trascendencia pronóstica en la ICC sigue levantando controversia2,3. Los recientes trabajos de Poelzl et al4 indican la existencia de una relación mutua entre estos biomarcadores, ya que los valores de GGT se asocian también a unas concentraciones de AU y proteína C reactiva superiores4. No obstante, el mecanismo subyacente a la asociación entre AU, GGT y progresión y pronóstico de la ICC sigue siendo en gran parte desconocido.
Tanto la GGT como la enzima xantina oxidasa, que es uno de los presuntos orígenes de la elevación del AU en la ICC, intervienen en la producción de radicales libres, que se sigue de una potenciación de la oxidación de las macromoléculas biológicas. Los radicales libres y los productos derivados del estrés oxidativo están involucrados en los procesos fisiopatológicos clave que tienen lugar en el curso de la progresión de la ICC, es decir, la disfunción endotelial y el remodelado. Así, los radicales libres producidos por la xantina oxidasa y en las reacciones en que interviene la GGT pueden contribuir al secuestro del óxido nítrico y dar lugar a la disfunción endotelial en la ICC. La función endotelial, evaluada mediante la dilatación de la arteria humeral tras la oclusión transitoria (vasodilatación mediada por flujo [VMF]), se correlaciona inversamente con las concentraciones séricas de AU de los sujetos con hiperuricemia asintomática asociada a hipertensión esencial5 y los pacientes con enfermedad renal crónica6. En cambio, la reducción del AU con un inhibidor de la xantina oxidasa mejora la función endotelial de los sujetos con hiperuricemia asintomática y los pacientes con ICC7,8. Aunque la disfunción endotelial se ha documentado en arterias periféricas y coronarias de pacientes con ICC9, la relación entre el AU y la función endotelial tan solo se ha investigado en un estudio, y no se dispone de datos respecto a la asociación entre actividad de GGT y disfunción endotelial. Además, cada vez es mayor el conjunto de pruebas que indica un papel importante del aumento del estrés oxidativo en el remodelado ventricular izquierdo adverso tras un infarto de miocardio10,11. Nuestro estudio previo y los de otros autores12,13 han puesto de manifiesto que la concentración de malondialdehído, un producto derivado del estrés oxidativo, se correlaciona con el grado de remodelado ventricular en la ICC secundaria a infarto de miocardio y en estos pacientes es un factor independiente predictivo de muerte. Además, la evidencia reciente indica que la hiperuricemia interviene en la patogenia del remodelado miocárdico en la insuficiencia cardiaca experimental14–16. Sin embargo, no se dispone de datos sobre el papel del AU o la GGT en la disfunción cardiaca en el contexto clínico. En este artículo se presenta la hipótesis de que la elevación del AU y la regulación positiva de la actividad de GGT se correlacionan con la disfunción endotelial y el remodelado ventricular. Además, se plantea la posibilidad de que haya asociación de estos dos marcadores de laboratorio con la disfunción endotelial o ventricular a través del estrés oxidativo.
En este estudio traslacional, se aborda la asociación de la actividad de GGT en plasma y la concentración de AU con la VMF y los índices ecocardiográficos de disfunción cardiaca en 120 pacientes con ICC isquémica y se investiga si esos efectos se producen a través de una potenciación del estrés oxidativo.
MÉTODOSPoblación del estudioEn este estudio participaron 120 pacientes con ICC que tenían enfermedad cardiovascular confirmada angiográficamente, inscritos consecutivamente en el Bezanijska Kosa Medical Center entre 2008 y 2009. Los diagnósticos de ICC se basaron en la historia clínica de los pacientes, la exploración física, la electrocardiografía, la radiología torácica, la ecocardiografía y la angiografía coronaria. Los criterios de inclusión principales fueron: fracción de eyección del ventrículo izquierdo < 45% y estabilidad de la ICC durante un periodo de 4 semanas en tratamiento farmacológico convencional que incluía diuréticos, bloqueadores beta e inhibidores de la enzima de conversión de la angiotensina. Se descartó el uso de antioxidantes y alopurinol en los 2 meses previos. Esos pacientes no tuvieron eventos agudos como infecciones, arritmias o interrupciones del tratamiento que pudieran desencadenar manifestaciones de insuficiencia cardiaca aguda. Por lo que respecta a la descompensación como criterio de exclusión, todos los pacientes en clases III y IV de la New York Heart Association (NYHA) recibían tratamiento con diuréticos y una dieta con restricción de sodio. Se excluyó a los pacientes con comorbilidades graves, insuficiencia renal, hepatopatía o alteraciones graves de la función pulmonar, así como a los que sufrían enfermedades autoinmunitarias, enfermedad maligna o inflamación aguda o crónica. Formaron el grupo de control, igualado en cuanto a edad y sexo, 69 sujetos sanos sin enfermedades agudas ni crónicas y sin síntomas relacionados con el sistema cardiovascular. El estudio recibió la aprobación del Comité Ético de la Facultad de Medicina de la Universidad de Belgrado. Todos los pacientes incluidos dieron su consentimiento informado por escrito.
Evaluación del tamaño y la función cardiacosSe determinaron la fracción de eyección del ventrículo izquierdo y las dimensiones telesistólica y telediastólica del ventrículo izquierdo mediante ecocardiografía transtorácica bidimensional17. Se estimaron los volúmenes telesistólico y telediastólico del ventrículo izquierdo y la fracción de eyección del ventrículo izquierdo mediante la regla de Simpson modificada biplanar a partir de las proyecciones de dos y de cuatro cámaras. El ventrículo dilatado tenía unas dimensiones telediastólicas ≥ 5,8cm. Se consideró normales los valores de volumen telesistólico del ventrículo izquierdo 33-68ml (varones) y 18-65ml (mujeres) y de volumen telediastólico del ventrículo izquierdo 96-157ml (varones) y 59-138ml (mujeres). Además, se realizó una ecografía Doppler y en modo M. Realizó las ecocardiografías siempre el mismo ecografista experimentado, con un aparato Vivid 7 (GE Medical Systems).
Evaluación no invasiva de la dilatación mediada por flujo en la arteria humeralSe aplicó una VMF dependiente e independiente del endotelio tras la evaluación ecocardiográfica, utilizando el transductor lineal de 13,0MHz (Vivid 7, GE Medical Systems). Después de un periodo de reposo de 15min en decúbito, se colocó el transductor 4-5cm por encima del codo en el plano de corte longitudinal para la determinación del diámetro y la velocidad de flujo de la arteria humeral en la situación basal. Se colocó un esfigmomanómetro en la parte superior del brazo y se hinchó hasta 250mmHg durante 5min, para luego deshincharlo bruscamente, y se realizó un segundo examen al cabo de 60-90 s. Después de 10min de reposo, se administró nitroglicerina sublingual (5 mg) y se examinó la arteria humeral en los 5min siguientes. Las determinaciones del diámetro se realizaron al final de la diástole y se calcularon al menos tres veces. Tanto la vasodilatación dependiente del endotelio como la independiente se definieron como el cambio porcentual de diámetro en comparación con el valor basal.
Métodos de laboratorioSe obtuvieron muestras de sangre de los pacientes con ICC durante las visitas ambulatorias. Las determinaciones de AU, glucosa, creatinina y urea séricos y el perfil lipídico se realizaron con kits comerciales. La actividad de GGT en suero se determinó a 37°C el día de la obtención de la muestra de sangre con un analizador modular P800. El límite inferior de detección fue 3 U/l, mientras que el límite superior de referencia se fijó en 38 U/l para las mujeres y 65 U/l para los varones. La concentración de malondialdehído y la actividad de glutatión peroxidasa en plasma se determinaron con métodos descritos previamente12. El estado neurohormonal se evaluó a partir de las concentraciones de péptido natriurético cerebral en plasma, utilizando el análisis de péptido natriurético cerebral Triage® (Biosite Inc.; San Diego, California, Estados Unidos).
Análisis estadísticoLa diferencia entre dos medias aritméticas se evaluó mediante análisis de la varianza, mientras que las diferencias entre proporciones se estimaron con una prueba de la χ2. Se utilizó el coeficiente de correlación de Pearson para determinar la relación entre las variables en estudio.
Para determinar la influencia independiente que tenían el AU y la GGT en los índices ecocardiográficos del remodelado y en la VMF, construimos una serie de modelos de regresión lineal múltiple basados en los factores de riesgo tradicionales y no tradicionales que afectan a estos parámetros. Todos los factores considerados de posible relevancia fisiológica respecto a los índices ecocardiográficos del remodelado y la VMF se introdujeron en un análisis de regresión lineal multivariable estándar, con un procedimiento de tres o cuatro pasos, utilizando el método de entrada. En el primer paso (modelo 1), se evaluó la influencia independiente del AU o la GGT, la edad, el sexo, el índice de masa corporal y el tabaquismo en los índices ecocardiográficos del remodelado y la VMF. En el segundo paso (modelo 2), se introdujeron ajustes por edad, sexo, índice de masa corporal, tabaquismo, diabetes mellitus y colesterol. En el tercer paso (modelo 3), se ajustó el modelo respecto a las covariables del segundo paso y se introdujo además un ajuste adicional respecto a la presión arterial sistólica y diastólica y la creatinina. El cuarto paso (modelo 4) fue la evaluación de la asociación del AU y la GGT con la VMF. En este cuarto paso, se ajustó el modelo respecto a las covariables del tercer paso y se introdujo un ajuste adicional por la proteína C reactiva de alta sensibilidad.
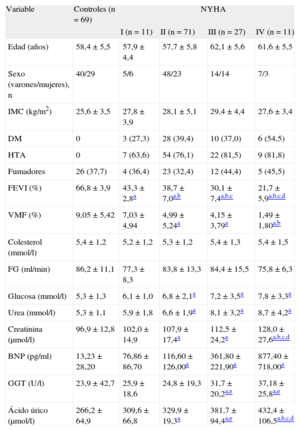
RESULTADOSCaracterísticas generales de los pacientes con insuficiencia cardiaca crónicaLas características de pacientes y sujetos control incluidos en este estudio se indican en la tabla 1. En los pacientes con ICC, no se observaron diferencias significativas entre los grupos en cuanto a edad, índice de masa corporal, frecuencia cardiaca o perfil bioquímico. La relación entre el péptido natriurético cerebral y la clase de la NYHA confirmó también que el péptido natriurético cerebral es un marcador cuantitativo de la ICC (tabla 1). Las demás características clínicas se han descrito ya en nuestro trabajo previo12. Se analizó el remodelado ventricular izquierdo y la disfunción endotelial como mecanismo fisiopatológico de progresión de la ICC. Todos los índices ecocardiográficos de la disfunción ventricular izquierda evaluados fueron significativamente superiores en los pacientes que estaban en clases de la NYHA III y IV que en los sujetos sanos y los pacientes en clases de la NYHA I y II. El grado de vasodilatación dependiente e independiente del endotelio (VMF) en la arteria humeral se redujo con la progresión de la ICC (tabla 1).
Características clínicas del grupo de estudio
| Variable | Controles (n = 69) | NYHA | |||
| I (n = 11) | II (n = 71) | III (n = 27) | IV (n = 11) | ||
| Edad (años) | 58,4 ± 5,5 | 57,9 ± 4,4 | 57,7 ± 5,8 | 62,1 ± 5,6 | 61,6 ± 5,5 |
| Sexo (varones/mujeres), n | 40/29 | 5/6 | 48/23 | 14/14 | 7/3 |
| IMC (kg/m2) | 25,6 ± 3,5 | 27,8 ± 3,9 | 28,1 ± 5,1 | 29,4 ± 4,4 | 27,6 ± 3,4 |
| DM | 0 | 3 (27,3) | 28 (39,4) | 10 (37,0) | 6 (54,5) |
| HTA | 0 | 7 (63,6) | 54 (76,1) | 22 (81,5) | 9 (81,8) |
| Fumadores | 26 (37,7) | 4 (36,4) | 23 (32,4) | 12 (44,4) | 5 (45,5) |
| FEVI (%) | 66,8 ± 3,9 | 43,3 ± 2,8a | 38,7 ± 7,0a,b | 30,1 ± 7,4a,b,c | 21,7 ± 5,9a,b,c,d |
| VMF (%) | 9,05 ± 5,42 | 7,03 ± 4,94 | 4,99 ± 5,24a | 4,15 ± 3,79a | 1,49 ± 1,80a,b |
| Colesterol (mmol/l) | 5,4 ± 1,2 | 5,2 ± 1,2 | 5,3 ± 1,2 | 5,4 ± 1,3 | 5,4 ± 1,5 |
| FG (ml/min) | 86,2 ± 11,1 | 77,3 ± 8,3 | 83,8 ± 13,3 | 84,4 ± 15,5 | 75,8 ± 6,3 |
| Glucosa (mmol/l) | 5,3 ± 1,3 | 6,1 ± 1,0 | 6,8 ± 2,1a | 7,2 ± 3,5a | 7,8 ± 3,3a |
| Urea (mmol/l) | 5,3 ± 1,1 | 5,9 ± 1,8 | 6,6 ± 1,9a | 8,1 ± 3,2a | 8,7 ± 4,2a |
| Creatinina (μmol/l) | 96,9 ± 12,8 | 102,0 ± 14,9 | 107,9 ± 17,4a | 112,5 ± 24,2a | 128,0 ± 27,6a,b,c,d |
| BNP (pg/ml) | 13,23 ± 28,20 | 76,86 ± 86,70 | 116,60 ± 126,00a | 361,80 ± 221,90a | 877,40 ± 718,00a |
| GGT (U/l) | 23,9 ± 42,7 | 25,9 ± 18,6 | 24,8 ± 19,3 | 31,7 ± 20,2a,e | 37,18 ± 25,8a,e |
| Ácido úrico (μmol/l) | 266,2 ± 64,9 | 309,6 ± 66,8 | 329,9 ± 19,3a | 381,7 ± 94,4a,e | 432,4 ± 106,5a,b,c,d |
BNP: péptido natriurético cerebral; DM: diabetes mellitus; FEVI: fracción de eyección del ventrículo izquierdo; FG: filtrado glomerular; GGT: gammaglutamil transferasa; HTA: hipertensión arterial; IMC: índice de masa corporal; NYHA: New York Heart Association; VMF: vasodilatación media por flujo.
Salvo otra indicación, los datos expresan n (%) o media ± desviación estándar.
Diferencia estadísticamente significativa en comparación con los pacientes en clase de la New York Heart AssociationI (p < 0,05).
Diferencia estadísticamente significativa en comparación con los pacientes en clase de la New York Heart AssociationII (p < 0,05).
Como se indica en la tabla 1, los valores de AU estaban significativamente elevados en los pacientes en clase de la NYHA II-IV, en comparación con los sujetos sanos (p < 0,001). Se observó un aumento progresivo del AU de los controles a los pacientes en peor clase funcional; dicho incremento era más pronunciado en clase de la NYHA IV (p < 0,001). Hubo una correlación moderada, pero aun así significativa, de los valores séricos de AU con el péptido natriurético cerebral (r = –0,361; p < 0,001) y con la fracción de eyección del ventrículo izquierdo (r = –0,335; p < 0,001), lo cual indica una relación clara con la gravedad de la disfunción miocárdica. La media de actividad de GGT en los pacientes en clase de la NYHA I-II no difería significativamente de los valores obtenidos en los sujetos control. Sin embargo, las cifras de GGT fueron mayores en los pacientes en clase de la NYHA III-IV que en los controles (p < 0,01) y los pacientes en clase de la NYHA I-II (p < 0,01) (tabla 1). Los valores de GGT no mostraron correlación con el péptido natriurético cerebral (r = –0,035; p = 0,707), pero se observó correlación entre cifras de GGT y fracción de eyección del ventrículo izquierdo (r = –0,259; p = 0,004).
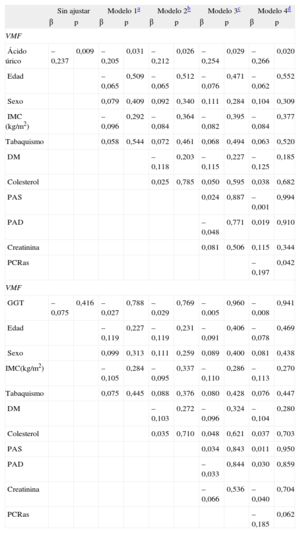
Asociación del ácido úrico con la vasodilatación mediada por flujo en pacientes con insuficiencia cardiaca crónicaLa asociación del AU y la actividad de GGT con la VMF se muestra en la tabla 2. En los análisis de regresión múltiple escalonados, el AU fue un predictor independiente y estadísticamente significativo de VMF en los cuatro modelos evaluados (modelo 1: β = –0,205; p = 0,031; modelo 2: β = –0,212; p = 0,026; modelo 3: β = –0,254; p = 0,029; modelo 4: β = –0,266; p = 0,020) (tabla 2). La GGT no fue un predictor de VMF estadísticamente significativo (tabla 2).
Modelos de regresión lineal múltiple para la asociación de la dilatación mediada por flujo con el ácido úrico y la gammaglutamil transferasa
| Sin ajustar | Modelo 1a | Modelo 2b | Modelo 3c | Modelo 4d | ||||||
| β | p | β | p | β | p | β | p | β | p | |
| VMF | ||||||||||
| Ácido úrico | –0,237 | 0,009 | –0,205 | 0,031 | –0,212 | 0,026 | –0,254 | 0,029 | –0,266 | 0,020 |
| Edad | –0,065 | 0,509 | –0,065 | 0,512 | –0,076 | 0,471 | –0,062 | 0,552 | ||
| Sexo | 0,079 | 0,409 | 0,092 | 0,340 | 0,111 | 0,284 | 0,104 | 0,309 | ||
| IMC (kg/m2) | –0,096 | 0,292 | –0,084 | 0,364 | –0,082 | 0,395 | –0,084 | 0,377 | ||
| Tabaquismo | 0,058 | 0,544 | 0,072 | 0,461 | 0,068 | 0,494 | 0,063 | 0,520 | ||
| DM | –0,118 | 0,203 | –0,115 | 0,227 | –0,125 | 0,185 | ||||
| Colesterol | 0,025 | 0,785 | 0,050 | 0,595 | 0,038 | 0,682 | ||||
| PAS | 0,024 | 0,887 | –0,001 | 0,994 | ||||||
| PAD | –0,048 | 0,771 | 0,019 | 0,910 | ||||||
| Creatinina | 0,081 | 0,506 | 0,115 | 0,344 | ||||||
| PCRas | –0,197 | 0,042 | ||||||||
| VMF | ||||||||||
| GGT | –0,075 | 0,416 | –0,027 | 0,788 | –0,029 | 0,769 | –0,005 | 0,960 | –0,008 | 0,941 |
| Edad | –0,119 | 0,227 | –0,119 | 0,231 | –0,091 | 0,406 | –0,078 | 0,469 | ||
| Sexo | 0,099 | 0,313 | 0,111 | 0,259 | 0,089 | 0,400 | 0,081 | 0,438 | ||
| IMC(kg/m2) | –0,105 | 0,284 | –0,095 | 0,337 | –0,110 | 0,286 | –0,113 | 0,270 | ||
| Tabaquismo | 0,075 | 0,445 | 0,088 | 0,376 | 0,080 | 0,428 | 0,076 | 0,447 | ||
| DM | –0,103 | 0,272 | –0,096 | 0,324 | –0,104 | 0,280 | ||||
| Colesterol | 0,035 | 0,710 | 0,048 | 0,621 | 0,037 | 0,703 | ||||
| PAS | 0,034 | 0,843 | 0,011 | 0,950 | ||||||
| PAD | –0,033 | 0,844 | 0,030 | 0,859 | ||||||
| Creatinina | –0,066 | 0,536 | –0,040 | 0,704 | ||||||
| PCRas | –0,185 | 0,062 | ||||||||
DM: diabetes mellitus; GGT: gammaglutamil transferasa; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PCRas: proteína C reactiva de alta sensibilidad; VMF: vasodilatación mediada por flujo.
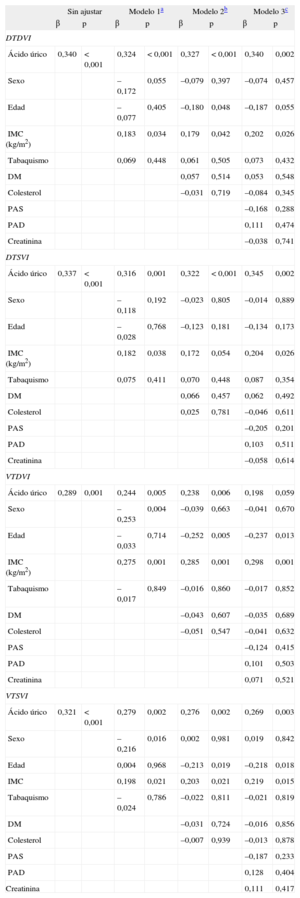
Los análisis de regresión múltiple escalonados de la asociación del valor de AU y el diámetro telediastólico del ventrículo izquierdo revelaron que el AU continuaba siendo un predictor independiente y estadísticamente significativo asociado al diámetro telediastólico del ventrículo izquierdo en los tres modelos (modelo 1: β = 0,324; p < 0,001; modelo 2: β = 0,327; p < 0,001; modelo 3: β = 0,340; p = 0,002) (tabla 3). El AU fue también un factor predictivo independiente y estadísticamente significativo del diámetro telesistólico del ventrículo izquierdo tras aplicar un ajuste por todas las variables (modelo 1: β = 0,316; p = 0,001; modelo 2: β = 0,322; p < 0,001; modelo 3: β = 0,345; p = 0,002), así como del volumen telesistólico del ventrículo izquierdo (modelo 1: β = 0,279, p = 0,002; modelo 2: β = 0,276; p = 0,002; modelo 3: β = 0,269; p = 0,003) (tabla 3). En los análisis de regresión múltiple escalonada de la asociación entre el AU y el volumen telediastólico del ventrículo izquierdo, el AU continuó siendo un factor predictivo independiente y estadísticamente significativo del volumen telediastólico del ventrículo izquierdo en el modelo 1 (β = 0,244; p = 0,005) y el modelo 2 (β = 0,238; p = 0,006), pero la relación dejaba de ser significativa en el modelo 3 (β = 0,198; p = 0,059) (tabla 3). La concentración de AU mostró correlación significativa con todos los índices ecocardiográficos de disfunción ventricular izquierda: diámetros telesistólico y telediastólico del ventrículo izquierdo, volúmenes telesistólico y telediastólico del ventrículo izquierdo (r = 0,337; p < 0,001; r = 0,340; p < 0,001; r = 0,321; p < 0,001; y r = 0,294; p = 0,001, respectivamente) (figura 1).
Modelos de regresión lineal múltiples para la asociación entre el ácido úrico y los índices ecocardiográficos del remodelado
| Sin ajustar | Modelo 1a | Modelo 2b | Modelo 3c | |||||
| β | p | β | p | β | p | β | p | |
| DTDVI | ||||||||
| Ácido úrico | 0,340 | < 0,001 | 0,324 | < 0,001 | 0,327 | < 0,001 | 0,340 | 0,002 |
| Sexo | –0,172 | 0,055 | –0,079 | 0,397 | –0,074 | 0,457 | ||
| Edad | –0,077 | 0,405 | –0,180 | 0,048 | –0,187 | 0,055 | ||
| IMC (kg/m2) | 0,183 | 0,034 | 0,179 | 0,042 | 0,202 | 0,026 | ||
| Tabaquismo | 0,069 | 0,448 | 0,061 | 0,505 | 0,073 | 0,432 | ||
| DM | 0,057 | 0,514 | 0,053 | 0,548 | ||||
| Colesterol | –0,031 | 0,719 | –0,084 | 0,345 | ||||
| PAS | –0,168 | 0,288 | ||||||
| PAD | 0,111 | 0,474 | ||||||
| Creatinina | –0,038 | 0,741 | ||||||
| DTSVI | ||||||||
| Ácido úrico | 0,337 | < 0,001 | 0,316 | 0,001 | 0,322 | < 0,001 | 0,345 | 0,002 |
| Sexo | –0,118 | 0,192 | –0,023 | 0,805 | –0,014 | 0,889 | ||
| Edad | –0,028 | 0,768 | –0,123 | 0,181 | –0,134 | 0,173 | ||
| IMC (kg/m2) | 0,182 | 0,038 | 0,172 | 0,054 | 0,204 | 0,026 | ||
| Tabaquismo | 0,075 | 0,411 | 0,070 | 0,448 | 0,087 | 0,354 | ||
| DM | 0,066 | 0,457 | 0,062 | 0,492 | ||||
| Colesterol | 0,025 | 0,781 | –0,046 | 0,611 | ||||
| PAS | –0,205 | 0,201 | ||||||
| PAD | 0,103 | 0,511 | ||||||
| Creatinina | –0,058 | 0,614 | ||||||
| VTDVI | ||||||||
| Ácido úrico | 0,289 | 0,001 | 0,244 | 0,005 | 0,238 | 0,006 | 0,198 | 0,059 |
| Sexo | –0,253 | 0,004 | –0,039 | 0,663 | –0,041 | 0,670 | ||
| Edad | –0,033 | 0,714 | –0,252 | 0,005 | –0,237 | 0,013 | ||
| IMC (kg/m2) | 0,275 | 0,001 | 0,285 | 0,001 | 0,298 | 0,001 | ||
| Tabaquismo | –0,017 | 0,849 | –0,016 | 0,860 | –0,017 | 0,852 | ||
| DM | –0,043 | 0,607 | –0,035 | 0,689 | ||||
| Colesterol | –0,051 | 0,547 | –0,041 | 0,632 | ||||
| PAS | –0,124 | 0,415 | ||||||
| PAD | 0,101 | 0,503 | ||||||
| Creatinina | 0,071 | 0,521 | ||||||
| VTSVI | ||||||||
| Ácido úrico | 0,321 | < 0,001 | 0,279 | 0,002 | 0,276 | 0,002 | 0,269 | 0,003 |
| Sexo | –0,216 | 0,016 | 0,002 | 0,981 | 0,019 | 0,842 | ||
| Edad | 0,004 | 0,968 | –0,213 | 0,019 | –0,218 | 0,018 | ||
| IMC | 0,198 | 0,021 | 0,203 | 0,021 | 0,219 | 0,015 | ||
| Tabaquismo | –0,024 | 0,786 | –0,022 | 0,811 | –0,021 | 0,819 | ||
| DM | –0,031 | 0,724 | –0,016 | 0,856 | ||||
| Colesterol | –0,007 | 0,939 | –0,013 | 0,878 | ||||
| PAS | –0,187 | 0,233 | ||||||
| PAD | 0,128 | 0,404 | ||||||
| Creatinina | 0,111 | 0,417 | ||||||
DM: diabetes mellitus; DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo.
Correlaciones entre ácido úrico e índices ecocardiográficos del remodelado. DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo.
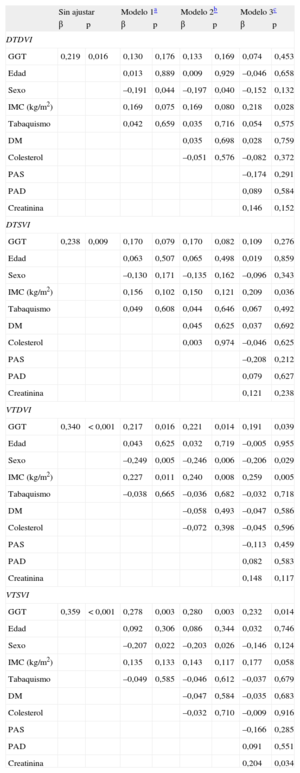
La GGT fue un significativo factor predictivo de los diámetros telediastólico y telesistólico del ventrículo izquierdo en el análisis de regresión sin ajustar (β = 0,219; p = 0,016; y β = 0,238; p = 0,009, respectivamente), pero tras introducir un ajuste en tres modelos de regresión múltiple diferentes, su efecto en los diámetros no fue significativo (tabla 4). En los análisis de regresión múltiple escalonados del volumen telediastólico del ventrículo izquierdo, la GGT fue un factor predictivo independiente y estadísticamente significativo correlacionado con el volumen telediastólico del ventrículo izquierdo en los tres modelos (modelo 1: β = 0,217; p = 0,016; modelo 2: ß = 0,221; p = 0,014; modelo 3: ß = 0,191; p = 0,039) (tabla 4). El AU fue también un factor predictivo independiente y estadísticamente significativo del volumen telesistólico del ventrículo izquierdo tras aplicar un ajuste por todas las variables (modelo 1: β = 0,278; p = 0,003; modelo 2: β = 0,280; p = 0,003; modelo 3: β = 0,232; p = 0,014) (tabla 4). Además, la actividad de GGT mostró correlación significativa con los diámetros telesistólico y telediastólico del ventrículo izquierdo y los volúmenes telesistólico y telediastólico del ventrículo izquierdo (r = 0,238; p = 0,009; r = 0,219; p = 0,016; r = 0,359; p < 0,001; y r = 0,369; p = 0,001, respectivamente) (figura 2).
Modelos de regresión lineal múltiple para la asociación entre la gammaglutamil transferasa y los índices ecocardiográficos del remodelado
| Sin ajustar | Modelo 1a | Modelo 2b | Modelo 3c | |||||
| β | p | β | p | β | p | β | p | |
| DTDVI | ||||||||
| GGT | 0,219 | 0,016 | 0,130 | 0,176 | 0,133 | 0,169 | 0,074 | 0,453 |
| Edad | 0,013 | 0,889 | 0,009 | 0,929 | –0,046 | 0,658 | ||
| Sexo | –0,191 | 0,044 | –0,197 | 0,040 | –0,152 | 0,132 | ||
| IMC (kg/m2) | 0,169 | 0,075 | 0,169 | 0,080 | 0,218 | 0,028 | ||
| Tabaquismo | 0,042 | 0,659 | 0,035 | 0,716 | 0,054 | 0,575 | ||
| DM | 0,035 | 0,698 | 0,028 | 0,759 | ||||
| Colesterol | –0,051 | 0,576 | –0,082 | 0,372 | ||||
| PAS | –0,174 | 0,291 | ||||||
| PAD | 0,089 | 0,584 | ||||||
| Creatinina | 0,146 | 0,152 | ||||||
| DTSVI | ||||||||
| GGT | 0,238 | 0,009 | 0,170 | 0,079 | 0,170 | 0,082 | 0,109 | 0,276 |
| Edad | 0,063 | 0,507 | 0,065 | 0,498 | 0,019 | 0,859 | ||
| Sexo | –0,130 | 0,171 | –0,135 | 0,162 | –0,096 | 0,343 | ||
| IMC (kg/m2) | 0,156 | 0,102 | 0,150 | 0,121 | 0,209 | 0,036 | ||
| Tabaquismo | 0,049 | 0,608 | 0,044 | 0,646 | 0,067 | 0,492 | ||
| DM | 0,045 | 0,625 | 0,037 | 0,692 | ||||
| Colesterol | 0,003 | 0,974 | –0,046 | 0,625 | ||||
| PAS | –0,208 | 0,212 | ||||||
| PAD | 0,079 | 0,627 | ||||||
| Creatinina | 0,121 | 0,238 | ||||||
| VTDVI | ||||||||
| GGT | 0,340 | < 0,001 | 0,217 | 0,016 | 0,221 | 0,014 | 0,191 | 0,039 |
| Edad | 0,043 | 0,625 | 0,032 | 0,719 | –0,005 | 0,955 | ||
| Sexo | –0,249 | 0,005 | –0,246 | 0,006 | –0,206 | 0,029 | ||
| IMC (kg/m2) | 0,227 | 0,011 | 0,240 | 0,008 | 0,259 | 0,005 | ||
| Tabaquismo | –0,038 | 0,665 | –0,036 | 0,682 | –0,032 | 0,718 | ||
| DM | –0,058 | 0,493 | –0,047 | 0,586 | ||||
| Colesterol | –0,072 | 0,398 | –0,045 | 0,596 | ||||
| PAS | –0,113 | 0,459 | ||||||
| PAD | 0,082 | 0,583 | ||||||
| Creatinina | 0,148 | 0,117 | ||||||
| VTSVI | ||||||||
| GGT | 0,359 | < 0,001 | 0,278 | 0,003 | 0,280 | 0,003 | 0,232 | 0,014 |
| Edad | 0,092 | 0,306 | 0,086 | 0,344 | 0,032 | 0,746 | ||
| Sexo | –0,207 | 0,022 | –0,203 | 0,026 | –0,146 | 0,124 | ||
| IMC (kg/m2) | 0,135 | 0,133 | 0,143 | 0,117 | 0,177 | 0,058 | ||
| Tabaquismo | –0,049 | 0,585 | –0,046 | 0,612 | –0,037 | 0,679 | ||
| DM | –0,047 | 0,584 | –0,035 | 0,683 | ||||
| Colesterol | –0,032 | 0,710 | –0,009 | 0,916 | ||||
| PAS | –0,166 | 0,285 | ||||||
| PAD | 0,091 | 0,551 | ||||||
| Creatinina | 0,204 | 0,034 | ||||||
DM: diabetes mellitus; DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo.
Correlaciones entre gammaglutamil transferasa e índices ecocardiográficos del remodelado. DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; GGT: gammaglutamil transferasa; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo.
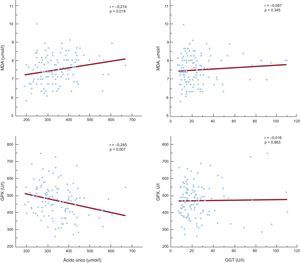
Para evaluar si el aumento de la concentración de AU y la actividad de GGT pudiera estar relacionado con una intensificación del estrés oxidativo, se evaluó la correlación de esos parámetros con la concentración de malondialdehído en plasma y la actividad de glutatión peroxidasa. La cifra de AU mostró asociación significativa con la concentración de malondialdehído y también con la actividad de glutatión peroxidasa (r = 0,214; p = 0,019 y r = –0,245; p = 0,007). Sin embargo, la actividad de GGT en plasma no presentó asociación con los marcadores del estrés oxidativo examinados (figura 3).
DISCUSIÓNAunque la disfunción endotelial se ha documentado en arterias periféricas y coronarias de pacientes con ICC9, tan solo un estudio realizado en 38 pacientes, predominantemente varones, con ICC en clase de la NYHA II-III, ha observado asociación entre el AU y la función endotelial. Dado que los criterios de inclusión estrictos de este estudio (VMF < 8%) podrían limitar la posibilidad de generalizar los resultados a una población con ICC menos grave, nuestra hipótesis fue que, en las fases iniciales de la ICC, el aumento de AU como indicador de la activación de la xantina oxidasa podría utilizarse como marcador del riesgo, mientras que, en las fases más avanzadas, el AU podría actuar como antioxidante y tener un efecto protector de las enzimas antioxidantes extracelulares, con lo que mejora la función endotelial. Sin embargo, los resultados del presente estudio, que incluyó el triple de participantes y con diversos estadios de la ICC, muestran una relación inversa entre AU y VMF, mientras que la actividad de la enzima antioxidante glutatión peroxidasa presentó una correlación inversa con el AU. Estos resultados son biológicamente plausibles, dado que el principal origen de la elevación del AU en la ICC es la xantina oxidasa, la enzima que produce el superóxido o el peróxido de hidrógeno como productos derivados de los pasos finales del metabolismo de la purina en presencia de hipoxia. En estas condiciones, un aumento del superóxido puede inactivar el óxido nítrico18, lo que indica un mecanismo subyacente importante en el desarrollo de la disfunción endotelial vascular en la ICC, que contribuye a la vasoconstricción sistémica y el aumento de la carga cardiaca.
El remodelado cardiaco es un factor pronóstico desfavorable asociado a hipertrofia miocárdica, fibrosis y disfunción ventricular después de un infarto de miocardio19. El mecanismo propuesto que causa una disminución de la contractilidad miocárdica es el daño celular producido por los radicales de oxígeno libres, con la consiguiente peroxidación de los fosfolípidos de membrana, que puede dar lugar a un aumento de la fluidez de esta y, por lo tanto, un incremento de la permeabilidad y pérdida de la integridad de la membrana20,21. En este estudio, se pone de manifiesto que la concentración de AU se correlaciona con el grado de disfunción del miocardio, en función de un análisis de regresión lineal de la asociación existente entre cifras de AU e índices ecocardiográficos del remodelado del ventrículo izquierdo. Este efecto del AU en el remodelado parece producirse en parte a través de un aumento de la peroxidación lipídica, puesto que el AU muestra una correlación significativa con el malondialdehído, un producto derivado de la peroxidación lipídica, y con la actividad antioxidante de la glutatión peroxidasa. En un modelo de infarto de miocardio en ratones, se observó que la expresión de la xantina oxidasa y la actividad de esta enzima están notablemente aumentadas en un margen de 2mm del tejido que circunda el área del infarto22. En el corazón, la xantina oxidasa se encuentra únicamente en el endotelio capilar23. Así pues, el AU generado en los estados hipóxicos tiene su origen en las células endoteliales de los capilares, y no en el miocardio24, y la hiperuricemia de la insuficiencia cardiaca puede reflejar los efectos metabólicos de la hipoxia en la microcirculación. La correlación entre AU y disfunción ventricular izquierda observada en el presente estudio confirma los resultados obtenidos en estudios in vitro que indican que la producción de especies moleculares de oxígeno reactivas por la xantina oxidasa da lugar a una depresión del mecanismo de acoplamiento de excitación-contracción en el músculo cardiaco25,26. Estos efectos inducirían una disminución de la contractilidad cardiaca y la rapidez de relajación del músculo cardiaco. Además de la xantina oxidasa, la hiperuricemia en sí puede influir en la producción de radicales libres y el remodelado miocárdico. Chen et al16 han demostrado que la hiperuricemia inducida por el ácido oxónico estimula la producción miocárdica de superóxido, lo que da lugar a incremento del remodelado ventricular inducido por la endotelina-1 en ratas con infarto. Además, el tratamiento de ratas hiperuricémicas con alopurinol y benzbromarona, que son fármacos hipouricemiantes, atenuó el remodelado después del infarto. Sin embargo, Cicoira et al27, que evaluaron los efectos de la elevación de concentraciones de AU en la función cardiaca de 150 pacientes con ICC debida a miocardiopatías dilatadas de diversa etiología, observaron una correlación significativa con la disfunción diastólica, pero no con los marcadores de la función sistólica o los volúmenes del ventrículo izquierdo. Las discrepancias existentes entre estos resultados y los nuestros pueden ser consecuencia de diferencias en la cohorte de estudio, que en el presente estudio es homogénea en cuanto a la causa de la ICC. Se observa una correlación positiva de las concentraciones de AU con el malondialdehído y los índices ecocardiográficos del remodelado. Aunque estos resultados no respaldan que haya relación causal entre el AU y el remodelado, sí indican que el AU podría contribuir a producir el aumento del estrés oxidativo que se observa en la ICC. Se deberá realizar nuevos ensayos experimentales para esclarecer la repercusión real que tiene el AU en la fisiología de la enfermedad cardiovascular.
Varios estudios de base poblacional han demostrado de manera uniforme que la actividad de GGT en suero, principalmente cuando está dentro de los límites normales, muestra una intensa asociación con la mayoría de los factores de riesgo cardiovascular. Aunque el mecanismo que subyace a esta asociación continúa siendo en gran parte desconocido, se han propuesto varias explicaciones para este fenómeno, como la congestión hepática, el aumento de producción de radicales libres y la inflamación4. En este estudio, se aborda la posible intervención de la GGT en la patogenia de la disfunción endotelial y el remodelado del ventrículo izquierdo en la insuficiencia cardiaca, puesto que ambos procesos están relacionados con el estrés oxidativo. Concretamente, la GGT ligada a la membrana interviene en la degradación del antioxidante glutatión, que da lugar en última instancia a los aminoácidos cisteína y glicina28. El reactivo tiol de cisteinilglicina puede generar radicales de anión superóxido y peróxido de hidrógeno a través de su interacción con hierro libre29. Se ha demostrado que las reacciones mediadas por la GGT catalizan la oxidación de las lipoproteínas de baja densidad, lo cual puede contribuir a producir procesos oxidativos que influyan en la evolución y la rotura de la placa30. De hecho, un estudio reciente ha demostrado una asociación de la GGT con la progresión de la aterosclerosis coronaria en pacientes con cardiopatía isquémica tratados con estatinas31. La enfermedad coronaria y el infarto de miocardio fueron las causas de la ICC en este estudio. La cisteína y la glicina son los precursores del glutatión intracelular. Así pues, la GGT también aporta a la captación y reutilización en la síntesis intracelular del glutatión. De esta forma, la GGT actúa como enzima de rescate en la síntesis del glutatión celular y desempeña, por lo tanto, una importante función en los sistemas de defensa antioxidante. En consecuencia, se ha apuntado que un aumento de la GGT en suero podría utilizarse como marcador del aumento del estrés oxidativo en el ser humano32,33. Aunque los resultados de este estudio indican que hay relación entre la disfunción cardiaca y la actividad de GGT, parece que no se relaciona con aumento de la oxidación lipídica o deterioro de la actividad antioxidante. Así pues, a diferencia de lo que ocurre con el AU, la actividad de GGT en suero no se asocia a los biomarcadores del estrés oxidativo en la ICC. En consecuencia, cabe especular con la posibilidad de que la elevación de la GGT en la insuficiencia cardiaca sea tan solo una parte del perfil colestásico de elevaciones de parámetros de laboratorio que se observa en estos pacientes, secundario a la congestión hepática. No obstante, la cuestión de los mecanismos involucrados en la asociación existente entre la GGT y la disfunción cardiaca deberá abordarse en futuros estudios in vitro y en animales de experimentación.
En la última década hemos asistido a avances significativos en el conocimiento de la fisiopatología de la insuficiencia cardiaca. En consecuencia, se han propuesto muchos marcadores diagnósticos y pronósticos diferentes, aunque son pocos los que tienen una aplicación clínica clara34,35. De entre ellos, el AU en suero parece cumplir estos criterios. En primer lugar, el clínico dispone de determinaciones repetidas del AU a un coste razonable y con obtención de los resultados en poco tiempo; en segundo lugar, la determinación del AU en suero aporta una información a la que no se tiene acceso directamente con una evaluación clínica cuidadosa, y por último, conocer la concentración de AU existente deberá facilitar al médico la toma de decisiones. El presente estudio muestra una correlación moderada entre las concentraciones de AU y los índices de remodelado. Pero, por otro lado, el AU y otros marcadores de la ICC evaluables actualmente carecen de especificidad cardiaca y sus concentraciones pueden verse influidas por los procesos sistémicos tanto inflamatorios como infecciosos que se producen con frecuencia en los pacientes con insuficiencia cardiaca. Hasta el momento, se han identificado varios nuevos biomarcadores con un vínculo biológico plausible con la fisiopatología de la insuficiencia cardiaca. De ellos, el ST-2 y la galectina tienen en común la capacidad de definir la gravedad del proceso de remodelado ventricular en curso34,36. Sin embargo, su uso clínico deberá confirmarse en estudios a gran escala.
LimitacionesLas limitaciones de este estudio derivan de su diseño transversal y su tamaño muestral bastante escaso, sobre todo en cuanto a ciertos subgrupos de NYHA. El diseño transversal del estudio impide determinar una relación causal y el valor pronóstico de estas determinaciones. En consecuencia, se deberá validar los resultados en nuevos estudios prospectivos con mayor número de pacientes en las clases de la NYHA de disfunción cardiaca avanzada.
CONCLUSIONESEn este estudio se observa que las concentraciones séricas de AU y la actividad de GGT se asocian a los índices ecocardiográficos de remodelado del ventrículo izquierdo de pacientes con ICC secundaria a una enfermedad coronaria isquémica. Por lo que respecta a la función endotelial, tan solo el AU en suero mostró una correlación inversa con la vasodilatación dependiente del endotelio en la ICC. Los efectos del AU en la función endotelial y la disfunción del ventrículo izquierdo pueden explicarse, al menos en parte, por su relación con los marcadores del estrés oxidativo como el malondialdehído y la actividad de glutatión peroxidasa.
FINANCIACIÓNEste trabajo se financió con la subvención 175052 del Ministerio de Educación, Ciencia y Desarrollo Tecnológico de Serbia.
CONFLICTO DE INTERESESNinguno.