El ancho de distribución eritrocitaria ha surgido como un marcador biológico con valor pronóstico en enfermedades cardiovasculares. Su valor adicional en la estratificación de riesgo de pacientes con insuficiencia cardiaca crónica no se encuentra establecido.
MétodosSe estudió consecutivamente a 698 pacientes ambulatorios con insuficiencia cardiaca crónica (edad, 71 años [intervalo intercuartílico, 62-77]; el 63% varones; fracción de eyección del ventrículo izquierdo, 40±14%). A su inclusión, se midió el ancho de distribución eritrocitaria y se registraron variables clínicas, bioquímicas y ecocardiográficas. La mediana de seguimiento fue 2,5 años [1,2-3,7].
ResultadosEn total, fallecieron 211 pacientes y 206 precisaron hospitalización por insuficiencia cardiaca descompensada. El análisis de Kaplan-Meier mostró un incremento tanto de la probabilidad de muerte como de ingreso por insuficiencia cardiaca a través de cuartiles de ancho de distribución eritrocitaria (log rank, p<0,001). El análisis ROC identificó el valor de ancho de distribución eritrocitaria del 15,4% como mejor punto de corte, asociado a un incremento independiente del riesgo tanto de muerte (hazard ratio=2,63; intervalo de confianza del 95%, 2,01-3,45; p<0,001) como de ingreso por insuficiencia cardiaca (hazard ratio=2,37; intervalo de confianza del 95%, 1,80-3,13; p<0,001). Este valor predictivo se mantuvo con o sin anemia. Además, la adición del ancho de distribución eritrocitaria a la estratificación de riesgo de muerte o ingreso por insuficiencia cardiaca a 1 año se asoció con una mejora tanto del índice relativo de discriminación integrada (33%; p<0,001) como de la reclasificación neta de eventos (10,3%; p=0,001).
ConclusionesEl ancho de distribución eritrocitaria es un marcador de riesgo independiente y añade información pronóstica sobre pacientes ambulatorios con insuficiencia cardiaca crónica. Los hallazgos indican su incorporación al manejo de estos pacientes.
Palabras clave
El índice del ancho de distribución eritrocitaria (ADE) describe el grado de heterogeneidad en el tamaño de los hematíes, y tanto la destrucción como el déficit en su producción conllevan un aumento de su valor1, 2. Este parámetro fue introducido como ayuda al diagnóstico diferencial de las anemias hipocromas, pero en los últimos años diversos trabajos han mostrado su asociación con un aumento de mortalidad en pacientes con insuficiencia cardiaca (IC)3, 4, 5, 6, 7, 8, así como en otras enfermedades crónicas e incluso en cohortes poblacionales9. Los mecanismos implicados en esta asociación no están bien aclarados, si bien se ha señalado que la inflamación y los déficits nutricionales, especialmente en el metabolismo del hierro, conllevan valores de ADE aumentados10.
Sólo dos estudios previos han evaluado su valor pronóstico en poblaciones ambulatorias con IC crónica3, 4, y sólo uno de ellos estudió específicamente su asociación con el riesgo de descompensación y hospitalización por IC3. Más allá de su asociación con mortalidad total, la relación entre valores elevados de ADE y riesgo de hospitalización por IC es de especial interés, por cuanto se sabe que este evento determina una progresión de la enfermedad y tiene el mayor impacto sociosanitario en su manejo clínico-terapéutico, lo que ha llevado a establecer estrategias específicas para su prevención, como las unidades de IC. Por otro lado, si bien se ha mostrado un valor pronóstico independiente de otras variables, ningún trabajo ha evaluado si el ADE aporta información adicional sobre las demás variables clínicas y, por lo tanto, se debe tener en cuenta en la práctica habitual más allá del resto de marcadores clínicos de riesgo.
El objetivo de este estudio es evaluar, en una amplia población ambulatoria de pacientes con IC crónica, si el ADE, un marcador simple y ampliamente disponible, identifica un mayor riesgo tanto de mortalidad como de hospitalización por IC descompensada y si su valor predictivo es adicional al de las demás variables clínicas.
MétodosPoblaciónSe estudió a 698 pacientes ambulatorios revisados consecutivamente en una consulta monográfica de IC de enero de 2003 a diciembre de 2005. En dicha visita se recogieron todas las variables demográficas, clínicas y analíticas de cada paciente. Todos los pacientes disponían de una ecocardiografía en los últimos 3 meses (Sonos 5500, Philips, Massachusetts, Estados Unidos), con las medidas y proyecciones recomendadas11. El seguimiento posterior de los pacientes se realizó mediante visitas ambulatorias, llamadas telefónicas, revisión de informes médicos y, en caso de duda, registros nacionales de mortalidad. El estudio fue aprobado por el comité ético del centro y todos los pacientes dieron su consentimiento informado por escrito. Los eventos adversos estudiados fueron muerte e ingreso hospitalario debido a IC descompensada. No hubo pérdidas de seguimiento, la base de datos para este estudio se cerró en mayo de 2008, todos los pacientes tuvieron un seguimiento de al menos 1 año y el seguimiento final tuvo una mediana de 2,5 años [intervalo intercuartílico, 1,2-3,7]. Se siguieron las recomendaciones STROBE para el diseño de estudios observacionales12.
Determinaciones analíticasLas muestras de sangre analizadas fueron las obtenidas en la visita de inicio, en ayunas y tras 10 min de reposo. Las muestras se procesaron inmediatamente después de su extracción para la determinación de todos los parámetros hemáticos con el analizador automático XE-2100 (Sysmex, Kobe, Japón) y de todos los parámetros bioquímicos con el analizador modular PE (Roche, Diagnostics, Manheim, Alemania). Se definió la presencia de anemia de acuerdo con los criterios de la Organización Mundial de la Salud: hemoglobina < 13 g/dl los varones y < 12 g/dl las mujeres13. Los datos de función renal se estimaron a partir del cálculo de la tasa de filtrado glomerular (TFG, en ml/min/1,73 m2) mediante la fórmula de Modification of Diet in Renal Disease14.
Análisis estadísticoSe evaluó la distribución normal de las variables continuas con la prueba de Kolmogorov-Smirnov. Los datos con una distribución normal se presentan mediante la media ± desviación estándar y los datos de distribución no normal, en forma de mediana [intervalo intercuartílico]. Las variables categóricas se expresan mediante porcentajes. Las diferencias a través de cuartiles de ADE se evaluaron mediante la tendencia lineal en el test de la χ2 y ANOVA, según correspondiese. La incidencia acumulada de mortalidad se estimó con el método de Kaplan-Meier, y se utilizó el parámetro estadístico log rank para las comparaciones. Para cada variable estudiada, se calcularon las hazard ratio (HR) derivadas del análisis de regresión de Cox para identificar los factores que por separado predecían la aparición de muerte y de ingreso por IC durante el seguimiento. El análisis operador-receptor se utilizó para definir el valor óptimo de corte para el ADE en la predicción de eventos, definido como aquel que maximizó la suma de sensibilidad y especificidad. Para el estudio del valor predictor añadido por el ADE, se construyó en primer lugar un modelo (método enter) en el que entraron todas las variables predictoras de eventos en el análisis univariable (p<0,05) excepto el ADE, y en un segundo paso se añadió el ADE para estudiar el incremento de χ2 en el modelo y el riesgo asociado. Los modelos multivariables se ajustaron por las variables potencialmente confusoras, que mostraron una asociación significativa con los cuartiles de ADE (Tabla 1). Este análisis se realizó para la población total y específicamente por los subgrupos de pacientes con y sin anemia. Además, para un mejor estudio del valor añadido por el ADE en la discriminación de riesgos, se estudió la mejora en la capacidad de predicción de eventos a 1 año mediante el análisis del índice de mejora integrada y el índice de mejora en la reclasificación de riesgo (bajo, < 15%; intermedio, 15-50%, y alto, > 50%), tal y como han definido Pencina et al15, 16. Se aceptaron como estadísticamente significativos todos los valores de p<0,05. El análisis estadístico se realizó con el programa SPSS versión 18.0 para Windows (SPSS, Inc., Chicago, Illinois, Estados Unidos).
Tabla 1. Características basales de la población por cuartiles de ancho de distribución eritrocitaria
| Cuartil 1 (n=183) | Cuartil 2 (n=173) | Cuartil 3 (n=175) | Cuartil 4 (n=167) | p | |
| Edad (años) | 69 [56-77] | 70 [60-77] | 72 [65-78] | 72 [67-78] | 0,009 |
| Varones | 132 (72) | 105 (61) | 111 (63) | 90 (54) | 0,001 |
| Diabetes mellitus | 84 (46) | 68 (39) | 66 (38) | 77 (46) | 0,903 |
| Hipertensión arterial | 103 (56) | 103 (59) | 118 (67) | 117 (70) | 0,003 |
| IMC (kg/m2) | 29 [26-31] | 27 [25-30] | 28 [26-31] | 27 [25-31] | 0,208 |
| NYHA III/IV | 46 (31) | 42 (27) | 60 (45) | 59 (50) | < 0,001 |
| EPOC | 26 (14) | 33 (19) | 45 (26) | 40 (24) | 0,008 |
| Ictus previo | 23 (13) | 21 (12) | 17 (10) | 24 (14) | 0,812 |
| Etiología isquémica | 88 (48) | 85 (49) | 80 (46) | 70 (42) | 0,201 |
| Fibrilación auricular | 52 (28) | 53 (31) | 64 (37) | 75 (45) | 0,001 |
| BCRIHH | 49 (27) | 53 (31) | 58 (33) | 64 (38) | 0,017 |
| Anemia | 52 (28) | 59 (34) | 82 (47) | 104 (62) | < 0,001 |
| Hemoglobina (g/dl) | 13,57 ± 1,70 | 13,21 ± 1,80 | 12,80 ± 1,85 | 11,93 ± 1,89 | < 0,001 |
| VCM (fl) | 90 [88-93] | 89 [87-93] | 89 [85-92] | 86 [83-91] | < 0,001 |
| Creatinina (mg/dl) | 1,12 [0,92-1,50] | 1,10 [0,93-1,30] | 1,18 [0,93-1,50] | 1,30 [1,00-1,80] | 0,001 |
| TFG (ml/min/1,732) | 65 [52-77] | 62 [48-76] | 61 [46-76] | 54 [40-68] | < 0,001 |
| Nitrógeno ureico (mg/dl) | 46 [36-62] | 47 [36-60] | 49 [36-69] | 55 [41-80] | 0,001 |
| Sodio (mEq/l) | 138 [136-141] | 138 [136-139] | 138 [135-141] | 138 [135-140] | 0,724 |
| Ácido úrico (mg/dl) | 7,2 [5,9-8,7] | 7 [5,5-8,9] | 7,2 [5,9-8,9] | 7,9 [6,5-9,7] | 0,019 |
| Albúmina (g/dl) | 3,8 [3,5-4,1] | 3,7 [3,4-3,9] | 3,8 [3,5-4,1] | 3,8 [3,4-4,2] | 0,150 |
| Proteínas totales (g/dl) | 6,57 ± 0,80 | 6,48 ± 0,57 | 6,60 ± 0,69 | 6,60 ± 0,86 | 0,744 |
| PCR (mg/dl) | 0,4 [0,2-2,3] | 0,5 [0,2-1,6] | 0,6 [0,2-1,4] | 0,8 [0,3-3,7] | 0,354 |
| Colesterol (mg/dl) | 170 [145-199] | 161 [143-188] | 161 [138-189] | 149 [122-189] | 0,004 |
| FEVI (%) | 40 [30-50] | 37 [30-48] | 40 [30-53] | 40 [30-56] | 0,377 |
| DTDVI (mm) | 57 [49-61] | 56 [50-66] | 55 [47-62] | 53 [46-58] | 0,146 |
| Aurícula izquierda (mm) | 44 [40-49] | 45 [40-51] | 45 [40-52] | 48 [44-56] | 0,011 |
| Medicación | |||||
| Antiagregantes | 119 (65) | 108 (62) | 102 (59) | 96 (58) | 0,108 |
| Anticoagulantes | 65 (35) | 62 (36) | 69 (40) | 80 (48) | 0,016 |
| Bloqueadores beta | 111 (61) | 114 (66) | 99 (57) | 80 (48) | 0,006 |
| IECA/ARA-II | 160 (87) | 147 (85) | 147 (84) | 127 (76) | 0,007 |
| Diuréticos de asa | 132 (72) | 123 (71) | 132 (76) | 138 (83) | 0,017 |
| Antialdosterónicos | 52 (28) | 47 (27) | 49 (28) | 50 (30) | 0,733 |
ARA-II: antagonistas de los receptores de la angiotensina II; BCRIHH: bloqueo completo de rama izquierda del haz de His; DTDVI: diámetro telediastólico de ventrículo izquierdo; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidor de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; NYHA: New York Heart Association; PCR: proteína C reactiva; TFG: tasa del filtrado glomerular; VCM: volumen corpuscular medio.
Las variables cualitativas se expresan como porcentaje y las cuantitativas, como media ± desviación estándar o mediana [intervalo intercuartílico].
En total se estudió a 698 pacientes (mediana de edad, 71 años [62-77]; el 63% varones; fracción de eyección del ventrículo izquierdo, 40 ± 14%), en los que la mediana del valor del ADE fue del 14,8% [13,8-16]. La Tabla 1 describe las características de la población distribuidas por cuartiles de ADE. El valor del ADE se asoció de manera directa con edad, clase funcional de la New York Heart Association, mayor prevalencia de sexo femenino, hipertensión arterial, broncopatía obstructiva crónica, fibrilación auricular y bloqueo completo de rama izquierda. Asimismo hubo asociación entre ADE y deterioro en los parámetros de función renal: menor TFG y mayores concentraciones de creatinina, nitrógeno ureico y ácido úrico. Las concentraciones de colesterol fueron menores según aumentaba el ADE, pero ni las proteínas plasmáticas ni el índice de masa corporal mostraron diferencias. Entre los parámetros hemáticos, como era esperable, el ADE aumentado se asoció con mayor prevalencia de anemia, menores cifras de hemoglobina y menor volumen corpuscular medio. En las ecocardiografías encontramos asociación con mayor dilatación auricular izquierda, pero no con la etiología isquémica o el grado de disfunción sistólica en términos de fracción de eyección o diámetro telediastólico de ventrículo izquierdo. El uso de anticoagulación y diuréticos de asa fue mayor, mientras que la tasa de bloqueadores beta e inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de angiotensina II fue menor.
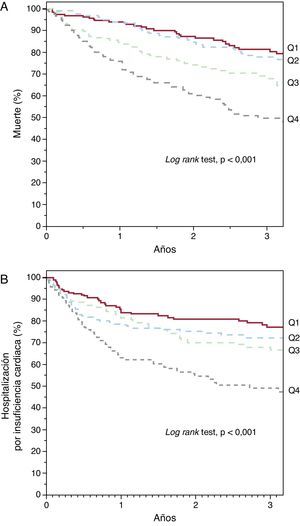
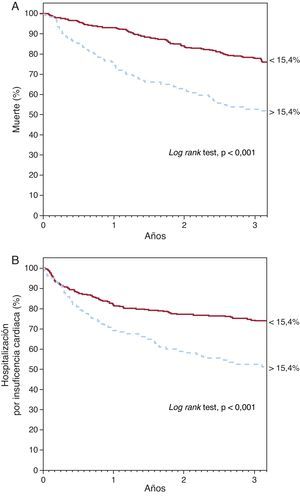
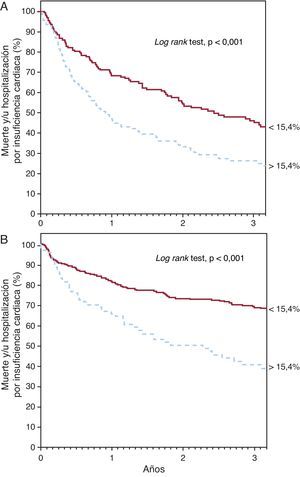
Ancho de distribución eritrocitaria y pronósticoDurante el seguimiento —mediana, 2,5 años [1,2-3,7]—, 211 pacientes fallecieron y 206 precisaron ingreso hospitalario por IC descompensada. El análisis de supervivencia de Kaplan-Meier mostró un incremento tanto de mortalidad como de ingreso por IC a través de los cuartiles de ADE (Figura 1) (log rank test, p<0,001 para ambos eventos). Asimismo, el análisis por cuartiles mostró un incremento del riesgo respecto al primer cuartil (Tabla 2). El análisis ROC mostró un área de 0,64 (intervalo de confianza del 95% [IC95%], 0,61-0,67) para la muerte y 0,59 (IC95%, 0,55-0,64; p<0,001) para la hospitalización por IC; en ambos análisis se identifica como mejor punto de corte el valor del 15,4%, el cual separó dos grupos de pacientes con una evolución significativamente diferente en el análisis de Kaplan-Meier (Figura 2) (log rank test, p<0,001). La presencia de un ADE > 15,4% se asoció a un incremento de casi el triple de riesgo para ambos eventos (Tabla 2). Además, el ADE mantuvo su valor predictivo tanto en presencia como en ausencia de anemia; en pacientes anémicos se asoció a un aumento del riesgo tanto de muerte (por unidad [%]; HR=1,163; IC95%, 1,086-1,245; p<0,001) como de ingreso por IC (por unidad [%]; HR=1,167; IC95%, 1,076-1,266; p<0,001), al igual que en pacientes no anémicos (por unidad [%]; HR=1,319; IC95%, 1,174-1,463; p<0,001) (por unidad [%]; HR=1,307; IC95%, 1,158-1,477; p<0,001). La Figura 3 muestra la probabilidad de que ocurra el evento combinado de muerte y/o ingreso hospitalario por IC atendiendo al valor de ADE > 15,4% en pacientes con y sin anemia por separado (log rank test, p<0,001 para ambos grupos).
Figura 1. Curvas de Kaplan-Meier de supervivencia libre de muerte (A) y hospitalización por insuficiencia cardiaca (B) según cuartiles (Q) de ancho de distribución eritrocitaria: Q1 (< 13,8%), Q2 (13,8-14,8%), Q3 (14,8-16%), Q4 (> 16%).
Tabla 2. Asociación entre valor de ancho de distribución eritrocitaria y eventos adversos en el análisis de riesgos de Cox
| Muerte | Ingreso por insuficiencia cardiaca | |||
| HR (IC95%) | p | HR (IC95%) | p | |
| ADE, por 1% | 1,26 (1,19-1,33) | < 0,001 | 1,25 (1,18-1,33) | < 0,001 |
| ADE (cuartiles) | < 0,001 | < 0,001 | ||
| Q1 < 13,8 | 1 | — | 1 | — |
| Q2 13,8-14,8 | 1,31 (0,83-2,06) | 0,246 | 1,32 (0,86-0,02) | 0,204 |
| Q3 14,8-16 | 2,05 (1,33-3,16) | 0,001 | 1,55 (1,02-2,37) | 0,040 |
| Q4 > 16 | 3,47 (2,29-3,16) | < 0,001 | 2,72 (1,83-4,05) | < 0,001 |
| ADE > 15,4% | 2,63 (2,01-3,45) | < 0,001 | 2,37 (1,80-3,13) | < 0,001 |
ADE: ancho de distribución eritrocitaria; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Figura 2. Curvas de Kaplan-Meier de supervivencia libre de muerte (A) y hospitalización por insuficiencia cardiaca (B) según el valor de ancho de distribución eritrocitaria por encima o por debajo del 15,4%.
Figura 3. Curvas de Kaplan-Meier de supervivencia libre del evento combinado de muerte y/o hospitalización por insuficiencia cardiaca según el valor del ancho de distribución eritrocitaria por encima o por debajo del 15,4%, en pacientes con anemia (A) y sin anemia (B).
Valor pronóstico adicional del ancho de distribución eritrocitariaLa Tabla 3 muestra las variables que se asociaron de forma significativa con mayor riesgo de muerte y de ingreso por IC y se incluyeron en el modelo clínico de riesgo. Tras tomar en consideración dicho modelo multivariable excepto el ADE, la inclusión del ADE en el último paso se asoció a una mejora significativa del poder predictivo del modelo tanto para mortalidad como para ingreso por IC (Tabla 4). De forma complementaria, se realizó un análisis a 1 año para conocer si el ADE se asociaba a una mejora adicional en la discriminación de eventos. En total, 212 pacientes (31%) habían fallecido o ingresado por IC al final del primer año de seguimiento. La toma en consideración del ADE como variable dicotómica referida al valor del 15,4% se asoció a una mejora significativa del índice de discriminación integrada, del 33% (p<0,001), y a una mejora del índice de reclasificación neta en un 10,3% (p=0,001) a expensas de la mejor identificación de pacientes con eventos (6,7%; p=0,020) y sin eventos (3,6%; p=0,015). Cuando se consideró sólo la muerte como evento adverso (n=89), el índice de reclasificación neta se incrementó en un 15,5% (p=0,006), fundamentalmente a expensas de la mejor identificación de eventos (13,8%; p=0,011); por el contrario, cuando el evento estudiado fue el ingreso hospitalario por IC (n=123), la mejora fue del 4,6% (p=0,022), a expensas de la mejora en la identificación de pacientes sin eventos (4%; p=0,001).
Tabla 3. Variables clínicas predictoras de eventos adversos en el análisis univariable de riesgo de Cox
| Muerte por cualquier causa | Ingreso por insuficiencia cardiaca | |||
| HR (IC95%) | p | HR (IC95%) | p | |
| Clase NYHA III/IV | 2,669 (1,970-3,602) | < 0,001 | 2,378 (1,708-3,311) | < 0,001 |
| Edad (años) | 1,036 (1,023-1,050) | < 0,001 | 1,028 (1,015-1,040) | < 0,001 |
| Hemoglobina (g/dl) | 0,730 (0,677-0,787) | < 0,001 | 0,747 (0,690-0,809) | 0,001 |
| TFG (ml/min/1,732) | 0,983 (0,977-0,990) | < 0,001 | 0,990 (0,984-0,996) | 0,002 |
| Bloqueadores beta | 0,576 (0,440-0,755) | < 0,001 | 0,696 (0,529-0,916) | 0,010 |
| Ictus previo | 1,748 (1,209-2,526) | 0,003 | 1,475 (0,969-2,245) | 0,070 |
| EPOC | 1,415 (1,039-1,929) | 0,028 | 1,313 (0,954-1,808) | 0,095 |
| Varones | 0,760 (0,577-1,001) | 0,051 | 0,721 (0,544-0,956) | 0,023 |
| Hipertensión arterial | 1,245 (0,938-1,654) | 0,130 | 1,657 (1,233-2,227) | 0,001 |
| Fibrilación auricular | 1,213 (0,914-1,610) | 0,182 | 1,729 (1,304-2,213) | < 0,001 |
| FEVI (%) | 0,995 (0,985-1,005) | 0,323 | 1,015 (1,005-1,026) | 0,004 |
| Etiología isquémica | 0,892 (0,680-1,170) | 0,410 | 0,724 (0,548-0,956) | 0,023 |
| Diabetes mellitus | 1,100 (0,838-1,445) | 0,493 | 1,595 (1,213-2,097) | 0,001 |
EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%: intervalo de confianza del 95%; NYHA: New York Heart Association; TFG: tasa de filtrado glomerular.
No alcanzaron significación estadística con p > 0,10 las demás variables estudiadas: índice de masa corporal, bloqueo completo de rama izquierda, nitrógeno ureico, sodio, ácido úrico, albúmina, proteínas totales, colesterol, diámetro de la aurícula izquierda y tratamiento con antiagregantes, anticoagulantes, inhibidor de la enzima de conversión de la angiotensina/antagonistas de los receptores de la angiotensina II y diuréticos de asa.
Tabla 4. Valor pronóstico adicional del ancho de distribución eritrocitaria sobre el mejor modelo clínico pronóstico en el análisis proporcional de riesgos de Cox
| Muerte | Hospitalización por insuficiencia cardiaca | |||||
| χ2 | p | HR (IC95%) | χ2 | p | HR (IC95%) | |
| Modelo clínico | 136 | 57 | ||||
| + ADE, por 1% | 158 | < 0,001 | 1,15 (1,07-1,22) | 72 | < 0,001 | 1,13 (1,06-1,21) |
| + ADE > 15,4% | 155 | < 0,001 | 1,81 (1,38-2,42) | 67 | 0,003 | 1,56 (1,16-2,09) |
ADE: ancho de distribución eritrocitaria; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Las variables incluidas en el modelo clínico fueron las predictoras en el análisis univariable ( tabla 2 ), así¿ como los potenciales factores de confusión ( tabla 1 ).
En una amplia población de pacientes ambulatorios con IC crónica, el valor aumentado del ADE mostró una asociación significativa con una peor evolución, tanto con mayor mortalidad como hospitalización por IC descompensada. Además, el ADE se comportó como una variable pronóstica capaz de aportar información adicional a la de las demás variables clínicas de riesgo.
Desde que Felker et al identificaron el ADE como el marcador de laboratorio con mayor poder pronóstico en la población del estudio CHARM3, esta simple medida biológica ha ido adquiriendo relevancia como marcador de riesgo. Tras esta primera descripción, nuestro grupo y otros han añadido nuevo conocimiento al mostrar que su valor pronóstico permanece también en poblaciones hospitalizadas con IC aguda5, 6, 7. Este valor predictivo no es exclusivo de pacientes con IC, sino que en los últimos años también se ha descrito en poblaciones generales9, 17 y en otras enfermedades del espectro vascular, como la enfermedad coronaria18, 19, 20, 21, vascular periférica22, cerebrovascular23 y arterial pulmonar24. En IC ambulatoria, tras la descripción inicial de Felker et al3, Allen et al encontraron en un registro con IC crónica que el valor predictivo de un ADE elevado persiste tras el ajuste por otras variables predictoras4. El análisis presentado en nuestro estudio sirve, en primer lugar, para confirmar el ADE como un marcador de riesgo independiente en pacientes con IC ambulatoria y, además, respecto a los otros dos estudios, muestra que un valor elevado de ADE aporta información pronóstica adicional a la de las demás variables clínicas, lo que supone una mejora en la capacidad de discriminación y de reclasificación de los pacientes en categorías de riesgo. Este resultado, trasladado a la práctica clínica, supone que, tras evaluar a nuestro paciente en la consulta, si además miramos el valor del ADE en el hemograma, podremos mejorar nuestra evaluación de riesgo del paciente.
Otro aspecto destacable de nuestro estudio es que el ADE tuvo capacidad para predecir tanto mortalidad como descompensaciones de IC con necesidad de hospitalización. Este aspecto es de importancia por cuanto, mientras que la mortalidad por cualquier causa es un evento complejo en el que subyacen diversos mecanismos etiológicos muchas veces no modificables, la hospitalización debida a descompensación de la IC es un evento estrechamente relacionado con la evolución de la enfermedad que determina mayores costes y peor pronóstico clínico, pero que se puede modificar mediante estrategias preventivas. El subanálisis del CHARM3 identificó un mayor riesgo del evento compuesto de muerte por cualquier causa u hospitalización por IC, pero no evaluó esta por separado. Allen et al4, en el registro STAMINA-HFP, evaluaron la hospitalización por cualquier causa pero no la específica por IC. Tampoco los demás estudios en IC aguda lo hicieron. En pacientes con enfermedad coronaria crónica y en remitidos para coronariografía pero sin IC, Tonelli et al19 y Horne et al21, respectivamente, encontraron asociación entre ADE y la aparición de IC sintomática de novo u hospitalización por IC en el seguimiento. Esta asociación se ve fortalecida por el hallazgo de Borné et al25 en una cohorte poblacional, en la que también encontraron asociación entre ADE y primera hospitalización por IC. En nuestro estudio, el ADE elevado fue un marcador de riesgo aumentado de descompensación de IC con necesidad de hospitalización, lo que, junto con los demás estudios, indica que el ADE puede ser un buen predictor de mayor inestabilidad clínica y riesgo de descompensación con necesidad de hospitalización.
Los mecanismos que subyacen a la asociación entre ADE y peor evolución no son completamente conocidos. El estudio presentado concuerda con los demás trabajos previos en que el valor predictor del ADE es independiente del de la hemoglobina o la presencia de anemia3, 4, 5. Sin embargo, este valor independiente no quiere decir que los mecanismos sean distintos, pues el ADE elevado repetidamente se ha asociado a aumento de inflamación y deterioro del metabolismo del hierro4, 26, 27. Ambos aspectos también están implicados en la aparición de anemia y, de hecho, recientemente se ha mostrado que el ADE predice la aparición de anemia a medio plazo28, lo que apunta a que el ADE estaría reflejando la mayor activación de estos mecanismos patológicos e identificando una peor evolución, tanto en un estadio inicial preanémico como más tardíamente cuando la anemia ya está establecida, lo que añade valor pronóstico a ambas subpoblaciones. Apoyan esta hipótesis los hallazgos de Jankowska et al, que recientemente han encontrado una elevada prevalencia de déficit de hierro (funcional o absoluta) en pacientes con IC crónica con o sin anemia, asociada a un peor pronóstico independiente con la presencia de anemia29. A su vez, este deterioro de la eritropoyesis y los mecanismos subyacentes tendría su reflejo en mayor daño miocárdico, como se refleja su asociación con la elevación de troponina cardiaca30. Quedaría por establecer si la atractiva idea de tratar a los pacientes con ADE elevado y déficit de hierro con hemoglobina dentro de límites normales podría tener repercusión en el desarrollo posterior de anemia y/o la evolución clínica de estos pacientes.
Por lo tanto, todos estos hallazgos indican que el ADE es un consistente marcador de riesgo en pacientes con IC y se debe tomar en consideración en la práctica clínica, máxime considerando su accesibilidad y bajo coste. En los distintos análisis, el ADE ha mostrado una asociación cuantitativa con el riesgo de eventos, por unidad (%) de incremento en su valor, pero la asociación resulta más fuerte en los valores más altos. En el análisis del CHARM3, la media de ADE en la población con eventos fue del 15,2%, y en su validación en el registro de Duke, el riesgo incrementado fue significativo en el quintil superior con valor > 15,3%. En la validación de Allen et al4, los pacientes con ADE ≥ 15,5% mostraron una significativa reducción de la supervivencia y peor pronóstico. En nuestro análisis, el valor por encima del 15,4% mostró la mejor capacidad de predicción, asociado con casi el triple de riesgo tanto de muerte como de hospitalización por IC, así como con una mejora de los índices de discriminación y reclasificación de dichos eventos. Por lo tanto, podría decirse que en pacientes ambulatorios se debe considerar el valor de ADE por encima de un 15,0-15,5% como referencia en la estratificación de riesgo, si bien la asociación entre ADE y riesgo es incremental.
LimitacionesEntre las limitaciones de este estudio están su carácter unicéntrico, que dificulta la extrapolación de los resultados; sin embargo, la población se obtuvo de manera consecutiva de una consulta general de IC y sus características no muestran sesgo de selección significativo. Otra limitación importante es la falta de ajuste por otros factores de riesgo, y en particular por péptidos natriuréticos y parámetros de ferrocinética. Sin embargo, los péptidos aún no están ampliamente disponibles y trabajos previos han demostrado que el valor del ADE es independiente y aditivo al de estos6, 7. Dada la relación entre ADE y ferrocinética, el estudio de la deficiencia de hierro absoluta o funcional pudo haber permitido un mejor estudio de la relación fisiopatológica entre ADE y pronóstico. De la misma forma, la obtención de medidas repetidas seriadas pudo haber permitido evaluar también el valor de los cambios del ADE en el tiempo.
ConclusionesEste estudio muestra que, en pacientes ambulatorios con IC crónica, el valor del ADE es un marcador de riesgo incrementado de que se produzcan tanto muerte como ingreso hospitalario por IC, lo que proporciona una mejora de la discriminación de riesgo, independiente de otras variables y de la presencia o no de anemia, por lo que resulta aconsejable su inclusión tanto en los modelos de riesgo como en la estratificación pronóstica en la práctica clínica habitual; se propone el valor del 15,4% como referencia para la toma de decisiones.
Conflicto de interesesNinguno.
Recibido 14 Septiembre 2011
Aceptado 11 Diciembre 2011
Autor para correspondencia: Servicio de Cardiología, Hospital Universitario Virgen de la Arrixaca, Ctra. Madrid-Cartagena s/n, 30120 El Palmar, Murcia, España. DomingoA.Pascual@carm.es