Observaciones recientes indican que los pacientes en que ya ha fallado la ablación por catéter podrían tener mayor riesgo de recurrencias de la fibrilación auricular (FA) tras un posterior procedimiento vía toracoscopia. Se evalúa el riesgo de recurrencias de FA en pacientes con el antecedente de fallo de la ablación por catéter que se someten a un procedimiento vía toracoscopia.
MétodosSe incluyó a pacientes de 3 centros. Se realizó un emparejamiento por puntuación de propensión para corregir la potencial heterogeneidad entre grupos en el análisis de ausencia de FA (ausencia de taquiarritmias auriculares de más de 30 s durante 1 año de seguimiento). Se obtuvieron muestras de orejuela izquierda (OI) para determinar la distribución de colágeno.
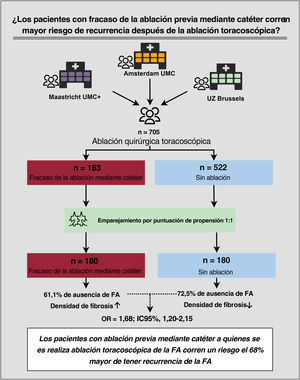
ResultadosSe incluyó a 705 pacientes, 183 de ellos con el antecedente de ablación por catéter fallida. Estos pacientes tenían menos factores de riesgo de recurrencia de la FA que los sometidos a ablación vía toracoscopia sin el antecedente de ablación por catéter: menor volumen de la aurícula izquierda indexado (40,9±12,5 frente a 43,0±12,5ml/m2; p=0,048) y menor frecuencia de insuficiencia cardiaca (el 1,5 frente al 8,9%; p=0,001) y FA persistente (el 52,2 frente al 60,3%; p=0,067). Sin embargo, la duración de la historia de FA fue significativamente más larga en los pacientes con el antecedente de ablación por catéter fallida (6,5 [4-10,5] frente a 4 [2-8] años; p<0,001). El análisis tras el emparejamiento por puntuación de propensión mostró mayor riesgo de recurrencias de la FA en los pacientes con el antecedente de ablación por catéter fallida (OR=1,68; IC95%, 1,20-2,15; p=0,034). La ausencia de FA fue del 61,1% en el grupo con antecedente de ablación por catéter fallida frente al 72,5% en el grupo sometido a ablación vía toracoscopia sin antecedente de ablación por catéter. El análisis histológico de muestras de la OI (n=198) mostró mayor densidad de fibras de colágeno en los pacientes con el antecedente de ablación por catéter fallida.
ConclusionesLos pacientes con el antecedente de ablación por catéter fallida muestran menos factores de riesgo de recurrencias de la FA que los no sometidos a ablación por catéter. Sin embargo, los primeros sufren más recurrencias de la FA tras someterse a un posterior procedimiento de ablación vía toracoscopia. Estos resultados podrían explicarse por una mayor progresión subclínica de la fibrosis auricular.
Palabras clave
La fibrilación auricular (FA) es la arritmia cardiaca más frecuente, con una incidencia estimada del 2 al 4% en adultos1. La FA se asocia con un aumento de la mortalidad de 2 a 3 veces, mayor riesgo de ictus, insuficiencia cardiaca y demencia, y una reducción general de la calidad de vida1,2. En pacientes con FA sintomática, está indicado tratamiento de control del ritmo con fármacos antiarrítmicos (FAA) o ablación2. La ablación mediante catéter es el tratamiento ablativo utilizado con más frecuencia para la FA2. La ablación quirúrgica toracoscópica es una alternativa segura y eficaz, en especial para pacientes con FA avanzada3–5. La ablación toracoscópica puede estar indicada después del fracaso de la ablación inicial mediante catéter. Sin embargo, investigaciones previas han demostrado que los pacientes con fracaso de la ablación previa mediante catéter corrían mayor riesgo de FA recurrente después de la ablación toracoscópica tras 5 años de seguimiento6. En cambio, Lim et al.7 mostraron una frecuencia similar de recurrencia de FA entre pacientes con ablación previa mediante catéter y sin ella. Sin embargo, los pacientes con fracaso de la ablación previa mediante catéter eran más jóvenes, tenían un índice de volumen de la aurícula izquierda (IVAI) más pequeño y menos pacientes presentaban FA permanente que aquellos sin ablación previa mediante catéter. Estas diferencias iniciales pueden haber ocultado las diferencias esperadas en los resultados. Teniendo en cuenta estos estudios, parece que en los pacientes con fracaso de la ablación previa mediante catéter se demuestra mayor riesgo de FA recurrente después de la ablación toracoscópica.
Por tanto, planteamos la hipótesis de que los pacientes con un fracaso de la ablación previa mediante catéter corren mayor riesgo de FA recurrente. Esta hipótesis no se puede probar con un diseño aleatorizado. Por tanto, estudiamos el resultado de los sometidos a ablación toracoscópica por FA sintomática con un análisis con emparejamiento por puntuación de propensión (con reemplazo de controles).
MÉTODOSSelección de pacientesSe incluyó a pacientes de 3 centros médicos universitarios sometidos a una primera ablación toracoscópica entre mayo de 2008 y mayo de 2019. Basándonos en un pequeño estudio piloto, esperábamos una diferencia del 10% en la recurrencia de FA entre pacientes emparejados con y sin fracaso de la ablación previa mediante catéter. Usando la prueba de McNemar para comparación de datos emparejados, alfa=0,05 y el 80% de potencia, calculamos que necesitábamos al menos 148 pares emparejados para demostrar una diferencia significativa. Se recopilaron las características clínicas iniciales previas al tratamiento toracoscópico, como los antecedentes de ablaciones y el tamaño de la aurícula izquierda. Los pacientes remitidos para ablación toracoscópica o híbrida con FA avanzada han fracasado en el tratamiento con, al menos, 1 fármaco antiarrítmico. En general, los pacientes presentan FA permanente, una aurícula izquierda hipertrofiada, fracaso de ablación previa mediante catéter o preferencia del paciente en lugar de una ablación mediante catéter4,8,9. El estudio se llevó a cabo según los criterios establecidos por la declaración de Helsinki10. El comité de ética de la Amsterdam UMC revisó el protocolo del estudio, dio permiso para este estudio y confirmó que la «Ley de Investigación Médica en Seres Humanos» no se aplica a este estudio (W22_077 # 22.110app.). Se permitió la exención de obtener el consentimiento informado, ya que se trataba de un ensayo retrospectivo, no se practicó ninguna intervención a los pacientes y los datos se recopilaron de forma anónima. Los datos no se pueden compartir por razones éticas y de privacidad. Los datos estarían disponibles previa solicitud motivada al autor correspondiente.
A partir de las bases de datos recopiladas prospectivamente de la Amsterdam UMC, la Maastricht UMC+y la UZ Brussels, se identificaron e incluyeron en el análisis actual pacientes con fracaso de la ablación previa mediante catéter y controles sin antecedentes de ablación previa. Se sometió a todos los pacientes a ablación epicárdica con evaluación epicárdica o endocárdica del bloqueo de la conducción. En la Amsterdam UMC, a todos los pacientes se les realizó ablación totalmente toracoscópica con aislamiento de las venas pulmonares y línea del techo y línea del trígono adicionales en pacientes con FA permanente. En la Maastricht UMC+ y la UZ Brussels, a los pacientes se les practicó ablación epicárdica y endocárdica simultánea (el mismo día) con un abordaje gradual. Si la FA estaba presente o era inducible después del aislamiento de las venas pulmonares (AVP), se practicaba una ablación en bloque de las venas pulmonares a nivel epicárdico. Se realizaba una línea del istmo cavotricuspídeo o una ablación del istmo mitral si había aleteo de aspecto típico y se llevaba a cabo una ablación de la zona intercava en pacientes con dilatación de la aurícula derecha. Durante la evaluación endocárdica del bloqueo de la conducción, se practicó un retoque endocárdico adicional cuando el bloqueo de conducción no se lograba a nivel epicárdico como se ha descrito con anterioridad8,9,11.
Seguimiento y objetivosEl seguimiento se llevó a cabo con monitorización con Holter de 24 horas a los 3, 6, 9 y 12 meses. Adicionalmente, se recogió el registro de episodios sintomáticos y cardioversiones. El objetivo principal del estudio fue la ausencia de cualquier taquiarritmia auricular> 30 s sin el uso de FAA durante el seguimiento de 1 año, de acuerdo con la declaración de consenso de HRS/EHRA/ECAS/APHRS/SOLEACE de 20172. Durante el periodo de cegamiento de 90 días después de la intervención, las recurrencias no se consideraron un fracaso de la intervención. Los FAA se suspendieron 3 meses después de la intervención. El objetivo principal fue la ausencia de FA sin el uso de FAA después de 1 año, con exclusión de los primeros 3 meses, que se consideraron el periodo de cegamiento12.
Análisis histológicoLa histología de la orejuela izquierda (OI) estaba disponible en una selección de pacientes de la Amsterdam UMC. Todos estos pacientes dieron su consentimiento informado por escrito para el uso del tejido de la OI para el análisis histológico. La OI se fijó en formalina al 4% y se incrustó en parafina. Se prepararon secciones de 5 μm de espesor y se tiñeron con rojo Picrosirius para cuantificar el colágeno intersticial. Las secciones se digitalizaron con 40 aumentos (Philips IntelliSite Ultra Fast Scanner, 0,25 μm/píxel, Philips, Países Bajos) y se seleccionaron de manera aleatoria 20 campos no superpuestos (máximo de 5.000 por 5.000 píxeles) de cada paciente para la cuantificación intersticial de colágeno. Se excluyó manualmente el colágeno endocárdico, epicárdico y perivascular. Se utilizó un análisis automatizado de imágenes mediante la deconvolución del color del software Image J para determinar la fracción de área de colágeno del área combinada de miocardiocitos y colágenos con exclusión del fondo blanco en las imágenes.
Las distintas fibras de colágeno intersticial se cuantificaron utilizando un algoritmo personalizado de Matlab. Las imágenes se binarizaron en una imagen en blanco y negro después de la deconvolución del color, se preprocesaron y se filtraron. En primer lugar, todos los píxeles blancos (que representan el colágeno) se dilataron y erosionaron usando un sello de radio de 5 píxeles (1,25 μm) para suavizar la imagen. Se rellenaron agujeros de 2.000 píxeles como máximo. Se identificaron, cuantificaron y retiraron de la imagen grandes fibrillas de colágeno (> 1.250 m2). La longitud de cada fibra restante se determinó por disección morfológica completa. Esta técnica crea una estructura bidimensional. La longitud de la fibra de cada estructura ≥ 4 píxeles se definió como la longitud entre los 2 puntos finales que estaban más alejados. El área de la fibra se determinó por el número de píxeles. Se cuantificó el número de las distintas fibras y la densidad de estas, definida como el número total de fibras dividido entre el área total del miocardio y el colágeno intersticial combinados. Todos los análisis histológicos se hicieron sin conocer el estado clínico ni el resultado. Un ejemplo ilustrativo del análisis de fibras se muestra en la figura 113.
Análisis estadísticoSe llevaron a cabo 2 análisis basados en la propensión. El análisis principal fue un emparejamiento por puntuación de propensión con reemplazo de controles. Se utilizó el «emparejamiento del vecino más cercano» basado en la puntuación de propensión; el calibrador fue una desviación estándar de 0,1 de la puntuación de propensión. El emparejamiento se realizó con el reemplazo, lo que implica que 1 control sin ablación podía emparejarse con más de 1 caso con fracaso de la ablación previa. El riesgo diferencial de recurrencia de la FA de los participantes emparejados se evaluó con la prueba de McNemar para comparación de datos emparejados. El emparejamiento se repitió 20 veces y los resultados se agruparon utilizando las reglas de Rubin. Se llevó a cabo un doble ajuste del análisis principal por regresión logística con agrupación de los errores estándar, incluyendo todas las variables con diferencia de medias estandarizada> 0,1 después del emparejamiento. La regresión logística condicional se utilizó como análisis secundario para evaluar con más detenimiento la asociación entre el fracaso de una ablación previa mediante catéter y la ausencia de FA. Este análisis corrige los factores de confusión basados en la puntuación de propensión y permite la inclusión de todos los pacientes en los cuales se calculó una puntuación de propensión. La regresión logística condicional se realizó con un tiempo=1,20 estratos y un cálculo de varianza robusta.
Las puntuaciones de propensión se calcularon con un modelo de regresión logística con ablación previa mediante catéter como resultado dependiente y 17 variables independientes. Se utilizó un conjunto predefinido de variables, con incorporación de variables que se asociaron significativamente con la ausencia de FA (p <0,05 en análisis de regresión de Cox univariable). Las variables seleccionadas fueron sexo, edad, diabetes mellitus, ictus, hipertensión, enfermedad vascular, tipo de FA, IVAI, duración de los antecedentes de FA (transformación logarítmica), índice de masa corporal (IMC), antecedentes de enfermedad cardiaca congestiva, insuficiencia de la válvula mitral, exclusión de la OI, conjunto de lesiones de ablación toracoscópica (categorizado como «solo AVP», «AVP+conjunto de lesiones según los criterios de Dallas», «AVP+ablación en bloque»), ablación de los plexos ganglionares durante la intervención y el centro donde se llevó a cabo la ablación toracoscópica. Las definiciones y los detalles de las variables incluidas figuran en la . El resultado del ritmo se definió de acuerdo con las pautas actuales: ausencia de cualquier taquiarritmia auricular>30 s en el electrocardiograma o registro de Holter, sin el uso de FAA2.
Las características iniciales de la cohorte total se compararon utilizando la prueba de la t de Student y la prueba de la U de Mann-Whitney para variables continuas distribuidas normal y asimétricamente, respectivamente. La prueba de la χ2 se utilizó para comparar variables binarias y cualitativas. La distribución del grosor de la fibra de colágeno se comparó con la prueba de Kolmogorov-Smirnov 2 para una muestra. Todas las pruebas fueron bilaterales; un valor de p < 0,05 se consideró que representaba significación estadística.
Participación de los pacientes y de la comunidadNi los pacientes ni la comunidad intervinieron en el diseño, la realización o la presentación de informes de este estudio.
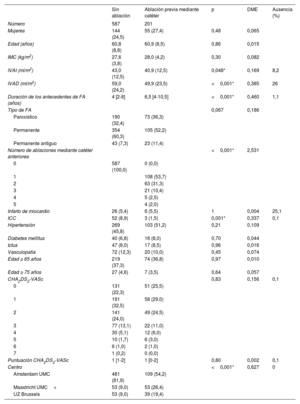
RESULTADOSCohorte de pacientes y características inicialesIntervinieron en este análisis 788 pacientes que se habían sometido a ablación quirúrgica toracoscópica para la FA: 590 pacientes de la Amsterdam UMC, 106 de la Maastricht UMC+ y 92 de la UZ Brussels. Las características iniciales de todos los pacientes se muestran en la tabla 1. A los pacientes con fracaso de la ablación previa mediante catéter se les había practicado 1 (n=108; 54%), 2 (n=63; 31%), 3 (n=21; 10%), 4 (n=5; 3%) o 5 (n=4; 2%) ablaciones anteriores. Se incluyeron 109, 53 y 39 pacientes con fracaso de la ablación mediante catéter de la Amsterdam UMC, la Maastricht UMC+y la UZ Brussels, respectivamente.
Características iniciales
| Sin ablación | Ablación previa mediante catéter | p | DME | Ausencia (%) | |
|---|---|---|---|---|---|
| Número | 587 | 201 | |||
| Mujeres | 144 (24,5) | 55 (27,4) | 0,48 | 0,065 | |
| Edad (años) | 60,8 (8,8) | 60,9 (8,5) | 0,86 | 0,015 | |
| IMC (kg/m2) | 27,6 (3,8) | 28,0 (4,2) | 0,30 | 0,082 | |
| IVAI (ml/m2) | 43,0 (12,5) | 40,9 (12,5) | 0,048* | 0,169 | 8,2 |
| IVAD (ml/m2) | 59,0 (24,2) | 49,9 (23,5) | <0,001* | 0,385 | 26 |
| Duración de los antecedentes de FA (años) | 4 [2-8] | 6,5 [4-10,5] | <0,001* | 0,460 | 1,1 |
| Tipo de FA | 0,067 | 0,186 | |||
| Paroxístico | 190 (32,4) | 73 (36,3) | |||
| Permanente | 354 (60,3) | 105 (52,2) | |||
| Permanente antiguo | 43 (7,3) | 23 (11,4) | |||
| Número de ablaciones mediante catéter anteriores | <0,001* | 2,531 | |||
| 0 | 587 (100,0) | 0 (0,0) | |||
| 1 | 108 (53,7) | ||||
| 2 | 63 (31,3) | ||||
| 3 | 21 (10,4) | ||||
| 4 | 5 (2,5) | ||||
| 5 | 4 (2,0) | ||||
| Infarto de miocardio | 26 (5,4) | 6 (5,5) | 1 | 0,004 | 25,1 |
| ICC | 52 (8,9) | 3 (1,5) | 0,001* | 0,337 | 0,1 |
| Hipertensión | 269 (45,8) | 103 (51,2) | 0,21 | 0,109 | |
| Diabetes mellitus | 40 (6,8) | 16 (8,0) | 0,70 | 0,044 | |
| Ictus | 47 (8,0) | 17 (8,5) | 0,96 | 0,016 | |
| Vasculopatía | 72 (12,3) | 20 (10,0) | 0,45 | 0,074 | |
| Edad ≥ 65 años | 219 (37,3) | 74 (36,8) | 0,97 | 0,010 | |
| Edad ≥ 75 años | 27 (4,6) | 7 (3,5) | 0,64 | 0,057 | |
| CHA2DS2-VASc | 0,83 | 0,156 | 0,1 | ||
| 0 | 131 (22,3) | 51 (25,5) | |||
| 1 | 191 (32,5) | 58 (29,0) | |||
| 2 | 141 (24,0) | 49 (24,5) | |||
| 3 | 77 (13,1) | 22 (11,0) | |||
| 4 | 30 (5,1) | 12 (6,0) | |||
| 5 | 10 (1,7) | 6 (3,0) | |||
| 6 | 6 (1,0) | 2 (1,0) | |||
| 7 | 1 (0,2) | 0 (0,0) | |||
| Puntuación CHA2DS2-VASc | 1 [1-2] | 1 [0-2] | 0,80 | 0,002 | 0,1 |
| Centro | <0,001* | 0,627 | 0 | ||
| Amsterdam UMC | 481 (81,9) | 109 (54,2) | |||
| Maastricht UMC+ | 53 (9,0) | 53 (26,4) | |||
| UZ Brussels | 53 (9,0) | 39 (19,4) |
DME, diferencia de medias estandarizada; FA, fibrilación auricular; ICC, insuficiencia cardiaca congestiva; IMC, índice de masa corporal; IVAD, índice del volumen de la aurícula derecha; IVAI, índice del volumen de la aurícula izquierda.
Los datos se expresan como números (%), media±desviación estándar o mediana [rango intercuartílico].
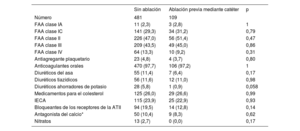
Las características iniciales se muestran en la tabla 1. Los pacientes con fracaso de la ablación previa mediante catéter presentaban antecedentes de FA de hacía más tiempo que los pacientes sin ablación: 6,5 [4-10,5] frente a 4 [2-8] (p=<0,001) años. Sin embargo, los pacientes con fracaso de la ablación del catéter tenían un IVAI más pequeño (40,9±12,5 frente a 43,0±12,5ml/m2, p=0,048), insuficiencia cardiaca menos congestiva (el 1,5 frente al 8,9%, p=0,001) y una proporción numéricamente menor presentó FA permanente (el 52,2 frente al 60,3%, p=0,067) en el momento de la ablación toracoscópica. Los datos de la Amsterdam UMC mostraron que no hubo diferencias en el uso de antiarrítmicos u otros fármacos cardiovasculares relevantes (tabla 2).
Uso inicial de antiarrítmicos y otros fármacos cardiacos de los pacientes de la Amsterdam UMC
| Sin ablación | Ablación previa mediante catéter | p | |
|---|---|---|---|
| Número | 481 | 109 | |
| FAA clase IA | 11 (2,3) | 3 (2,8) | 1 |
| FAA clase IC | 141 (29,3) | 34 (31,2) | 0,79 |
| FAA clase II | 226 (47,0) | 56 (51,4) | 0,47 |
| FAA clase III | 209 (43,5) | 49 (45,0) | 0,86 |
| FAA clase IV | 64 (13,3) | 10 (9,2) | 0,31 |
| Antiagregante plaquetario | 23 (4,8) | 4 (3,7) | 0,80 |
| Anticoagulantes orales | 470 (97,7) | 106 (97,2) | 1 |
| Diuréticos del asa | 55 (11,4) | 7 (6,4) | 0,17 |
| Diuréticos tiazídicos | 56 (11,6) | 12 (11,0) | 0,98 |
| Diuréticos ahorradores de potasio | 28 (5,8) | 1 (0,9) | 0,058 |
| Medicamentos para el colesterol | 125 (26,0) | 29 (26,6) | 0,99 |
| IECA | 115 (23,9) | 25 (22,9) | 0,93 |
| Bloqueantes de los receptores de la ATII | 94 (19,5) | 14 (12,8) | 0,14 |
| Antagonista del calcio* | 50 (10,4) | 9 (8,3) | 0,62 |
| Nitratos | 13 (2,7) | 0 (0,0) | 0,17 |
ATII, angiotensina II; FAA, fármacos antiarrítmicos; IECA, inhibidor de la enzima de conversión de la angiotensina.
Los datos se expresan como números (%).
A todos los pacientes se les realizó ablación toracoscópica con AVP bilateral. Se llevaron a cabo ablaciones adicionales del techo y el trígono en 307 (39,0%) pacientes y se practicó una ablación posterior en bloque a 186 (23,6%) pacientes. A 184 (23,4%) pacientes se les realizó cateterismo en el marco de la intervención híbrida. En 34 (18,5%) participantes, la ablación de retoque se hizo en una de las ablaciones realizadas a nivel epicárdico. En 37 (20,1%) se realizó una línea del istmo cavotricuspídeo; en 27 (14,7%), una línea del istmo mitral, y en 68 (37,0%) pacientes se realizó una ablación de electrogramas auriculares fraccionados complejos.
Para el cálculo de la puntuación de propensión, la ausencia de datos de una de las covariables provocó la eliminación de 83 participantes (ausencia de resultado: n=10; IVAI: n=63; duración de los antecedentes de FA: n=8; infarto de miocardio: n=1, y puntuación CHA2DS2-VASc: n=1). En total, se incluyó a 705 pacientes en el análisis principal: 183 casos con fracaso de la ablación mediante catéter y 522 controles sin ablación (figura 1).
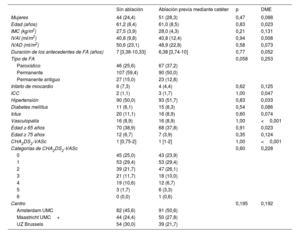
Resultado principalEn el análisis con emparejamiento por puntuación de propensión, con reemplazo de controles, se emparejó a 180 casos con fracaso de la ablación previa mediante catéter con 180 controles sin ablación (tabla 3). La ausencia de FA fue del 61,1% en los pacientes con ablación previa mediante catéter, en comparación con el 72,5% en los controles sin ablación. Los pacientes con ablación previa mediante catéter tenían el 68% más de riesgo de recurrencia de FA (OR = 1.68; IC95%, 1,20-2,15; p=0,034 (). La distribución de las puntuaciones de propensión antes y después del emparejamiento se muestra en la . En el análisis secundario, se incluyó a los 705 pacientes en los que se calculó la puntuación de propensión. El análisis de regresión logística condicional demostró un aumento del riesgo de recurrencia de FA del 39% (OR = 1,39; IC95%, 1,01-1,92; p=0,046) (tabla 4).
Características iniciales de 180 casos después del emparejamiento por puntuación de propensión con reemplazo de controles
| Sin ablación | Ablación previa mediante catéter | p | DME | |
|---|---|---|---|---|
| Mujeres | 44 (24,4) | 51 (28,3) | 0,47 | 0,088 |
| Edad (años) | 61,2 (8,4) | 61,0 (8,5) | 0,83 | 0,023 |
| IMC (kg/m2) | 27,5 (3,9) | 28,0 (4,3) | 0,21 | 0,131 |
| IVAI (ml/m2) | 40,8 (9,8) | 40,8 (12,4) | 0,94 | 0,008 |
| IVAD (ml/m2) | 50,6 (23,1) | 48,9 (22,8) | 0,58 | 0,073 |
| Duración de los antecedentes de FA (años) | 7 [3,38-10,33] | 6,38 [3,74-10] | 0,77 | 0,052 |
| Tipo de FA | 0,058 | 0,253 | ||
| Paroxístico | 46 (25,6) | 67 (37,2) | ||
| Permanente | 107 (59,4) | 90 (50,0) | ||
| Permanente antiguo | 27 (15,0) | 23 (12,8) | ||
| Infarto de miocardio | 6 (7,3) | 4 (4,4) | 0,62 | 0,125 |
| ICC | 2 (1,1) | 3 (1,7) | 1,00 | 0,047 |
| Hipertensión | 90 (50,0) | 93 (51,7) | 0,83 | 0,033 |
| Diabetes mellitus | 11 (6,1) | 15 (8,3) | 0,54 | 0,086 |
| Ictus | 20 (11,1) | 16 (8,9) | 0,60 | 0,074 |
| Vasculopatía | 16 (8,9) | 16 (8,9) | 1,00 | <0,001 |
| Edad ≥ 65 años | 70 (38,9) | 68 (37,8) | 0,91 | 0,023 |
| Edad ≥ 75 años | 12 (6,7) | 7 (3,9) | 0,35 | 0,124 |
| CHA2DS2-VASc | 1 [0,75-2] | 1 [1-2] | 1,00 | <0,001 |
| Categorías de CHA2DS2-VASc | 0,60 | 0,228 | ||
| 0 | 45 (25,0) | 43 (23,9) | ||
| 1 | 53 (29,4) | 53 (29,4) | ||
| 2 | 39 (21,7) | 47 (26,1) | ||
| 3 | 21 (11,7) | 18 (10,0) | ||
| 4 | 19 (10,6) | 12 (6,7) | ||
| 5 | 3 (1,7) | 6 (3,3) | ||
| 6 | 0 (0,0) | 1 (0,6) | ||
| Centro | 0,195 | 0,192 | ||
| Amsterdam UMC | 82 (45,6) | 91 (50,6) | ||
| Maastricht UMC+ | 44 (24,4) | 50 (27,8) | ||
| UZ Brussels | 54 (30,0) | 39 (21,7) |
DME, diferencia de medias estandarizada; FA, fibrilación auricular; ICC, insuficiencia cardiaca congestiva; IMC, índice de masa corporal; IVAD, índice del volumen de la aurícula derecha; IVAI, índice del volumen de la aurícula izquierda.
Los datos se expresan como números (%), media±desviación estándar o mediana [rango intercuartílico].
Resultados de 2 análisis basados en la propensión
| Análisis | Odds ratio | p |
|---|---|---|
| Emparejamiento por puntuación de propensión con reemplazo de controles | 1,68 (1,20-2,15) | 0,034* |
| Regresión logística condicional | 1,39 (1,01-1,92) | 0,046* |
Los datos se expresan como odds ratio (intervalo de confianza del 95%).
El doble ajuste del análisis principal de las variables subóptimas equilibradas (tipo de FA, IMC, edad ≥ 75, puntuación CHA2DS2-VASc y centro de tratamiento) generó una OR = 1,49; IC95%, 1,03-2,15; p=0,035 en pacientes con fracaso de la ablación previa mediante catéter en comparación con controles sin ablación.
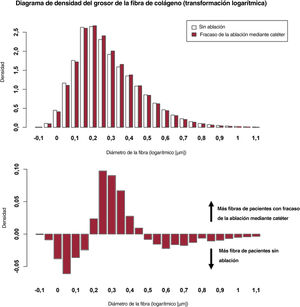
Fibrosis auricularLa histología de la OI estaba disponible en 198 pacientes, 38 de los cuales (19,2%) tenían una ablación previa mediante catéter. El fracaso de la ablación previa mediante catéter se asoció con un aumento de la densidad de la fibra de colágeno (fibras/mm2) (OR = 1,18; IC95%, 1,01-1,39; p=0,036). El área de la fibra de colágeno (2,3 [2,1-2,7] frente a 2,3 [1,9-2,6] μm2; p=0,70), la longitud de la fibra (3,2 [3,0-3,4] frente a 3,2 [2,9-3,4] μm; p=0,95) y el diámetro de la fibra (0,77 [0,72-0,82] frente a 0,76 [0,71-0,80] μm; p=0,53) se distribuyeron por igual entre los pacientes con y sin ablación previa mediante catéter, respectivamente. La figura 2 muestra la diferencia en la distribución del grosor de la fibra de colágeno. Los dos grupos de pacientes mostraron una curva de densidad en forma de campana después de la transformación logarítmica. De estas distribuciones, los valores medios fueron los mismos (figura 2A), pero el ancho de la campana difirió ligera, pero significativamente (p<0,001). Esta diferencia en la distribución se muestra en la figura 2B.
DISCUSIÓNAnálisis con emparejamiento por puntuación de propensiónEn este análisis con emparejamiento por puntuación de propensión se encontró mayor riesgo de recurrencia de la FA después de la ablación toracoscópica en pacientes con fracaso de la ablación previa mediante catéter fallida que en los controles sin ablación, aunque la mayoría de los pacientes de los 2 grupos no experimentaron recurrencia de la FA durante el seguimiento de 1 año. Los dos análisis basados en la puntuación de propensión (es decir, el emparejamiento por puntuación de propensión con el reemplazo de controles y la regresión logística condicional) indicaron mayor riesgo de recurrencia de la FA en pacientes con fracaso de la ablación previa mediante catéter, después de comparar las covariables incluidas. Con nuestro diseño de estudio retrospectivo, se identificó el fracaso de una ablación previa mediante catéter como marcador de eficacia reducida. El riesgo estimado de recurrencia fue mayor en el análisis con emparejamiento por puntuación de propensión con reemplazo de controles, donde cada caso se emparejó con un control muy similar. La inclusión de todos los pacientes idóneos en el modelo de regresión logística dio como resultado un riesgo más matizado, pero significativamente mayor de recurrencia de la FA. En esta selección de pacientes mediante emparejamiento por puntuación de propensión, es posible que los niveles de ausencia absoluta de FA no reflejen los de los estudios de cohortes publicados previamente4,6,8. Debido a la heterogeneidad de los pacientes y las características del tratamiento, hubo suficiente superposición para realizar estos análisis basados en la puntuación de propensión. Continuaron habiendo pequeñas diferencias entre los 2 grupos emparejados. Sin embargo, los pacientes con fracaso de la ablación mediante catéter presentaban más FA paroxística, menos tenían antecedentes de infarto de miocardio y menos tenían una edad ≥75 años, lo que podría haber reducido el riesgo diferencial de recurrencia. El doble ajuste del análisis principal de todas las variables subóptimas equilibradas validó los resultados con un efecto ligeramente menor y significativo. Por tanto, sostenemos que se logró un equilibrio satisfactorio en el emparejamiento, teniendo en cuenta el número relativamente bajo de pacientes incluidos y el gran número de variables incluidas en el cálculo de la puntuación de propensión.
Factores de riesgo clínicos de recurrencia de la fibrilación auricularAl inicio del estudio, los pacientes con fracaso de la ablación previa mediante catéter tenían un IVAI más pequeño, un índice del volumen de la aurícula derecha más pequeño, una insuficiencia cardiaca menos congestiva y una FA menos permanente, que son predictores conocidos de FA recurrente. Otros factores de riesgo clínicos de recurrencia de la FA, como la edad, la hipertensión y el sexo femenino, no difirieron entre los grupos. Un mayor riesgo de recurrencia de la FA, a pesar de que había menos factores de riesgo de recurrencia de la FA al inicio del estudio, parece contradictorio. Sin embargo, estos factores de riesgo pueden necesitar una interpretación diferente en el contexto de una ablación previa mediante catéter, que es un marcador de peor pronóstico. Tal vez los factores de riesgo existentes de recurrencia deben interpretarse de manera diferente ante el fracaso de la ablación mediante catéter. La aurícula izquierda puede encogerse después de la ablación mediante catéter, independientemente de que se haya restablecido el ritmo sinusal14,15y se ha descrito mayor contracción de la aurícula izquierda con estrategias de ablación más extensas16. La ablación del tejido auricular puede limitar la posibilidad de FA sostenida al reducir la superficie auricular total17 y, por tanto, posiblemente limitar la FA a paroxismos en lugar de hacerlo a episodios permanentes. Aparte de los factores de riesgo oscurecidos o invertidos, el número de episodios asintomáticos puede aumentar después de la ablación inicial mediante catéter18, lo que puede contribuir al aumento de la remodelación auricular con menos síntomas o ninguno de ellos. Por último, la percepción de los síntomas puede reducirse, independientemente del éxito clínico de la intervención19, lo que puede aumentar el umbral de los síntomas antes de que el paciente y el médico consideren repetir la intervención. La proporción de FA y TA en ambos grupos no difirió (no se presentan los datos).
En resumen, independientemente de la presencia de los predictores habituales de recurrencia de la FA, los pacientes con fracaso de la ablación previa mediante catéter son más propensos al fracaso de la intervención por vía toracoscópica. Por tanto, el fracaso de la ablación mediante catéter puede ser un marcador de peor pronóstico. En este punto, no podemos excluir ni confirmar que el fracaso de la ablación mediante catéter contribuya desde el punto de vista mecánico a una mayor recurrencia de la FA después de la ablación toracoscópica. Una o más ablaciones mediante catéter pueden inducir remodelación estructural y/o eléctrica, por lo cual los pacientes podrían ser más susceptibles a la recurrencia de la FA a pesar de la ablación toracoscópica. Las lesiones de ablación creadas durante ablaciones anteriores mediante catéter quizá se hayan convertido en una fuente de ectopia o ralentización de la conducción local. Además, las líneas incompletas, no transmurales, interrumpidas o reconectadas podrían generar circuitos de reentrada que conducen a la taquicardia auricular20. Sin embargo, el estudio actual se realizó sin cartografía endocárdica del sustrato en la aurícula izquierda. Por tanto, no se nos informó sobre la transmuralidad de las lesiones de ablación anteriores. No pudimos ajustarnos a ninguna lesión previa de ablación mediante catéter, ya que estas intervenciones se realizaron principalmente en centros distintos de aquellos en que se realizó la ablación toracoscópica. No podemos confirmar ni excluir que la ablación sobre tejido cicatricial maduro previamente ablacionado sea menos efectiva y afecte de forma negativa a la transmuralidad de nuevas lesiones de ablación. El éxito clínico de la repetición de las ablaciones mediante catéter y el AVP epicárdicas periprocedimiento en venas pulmonares previamente ablacionadas sugiere que la ablación en cicatrices de ablación más antiguas es factible y eficaz, aunque faltan datos.
Una explicación razonable de la diferencia en la recurrencia de la FA entre estos grupos es que hay uno (o varios) factores de riesgo ocultos que influyen decisivamente, de los cuales en este caso el fracaso de la ablación mediante catéter actúa como marcador. Respecto al análisis principal, no se disponía de medidas directas del sustrato fibrótico de la aurícula izquierda. Los pacientes con ablación previa mediante catéter pueden tener una forma más avanzada de FA, con un sustrato auricular que haya progresado más, por ejemplo, debido a unos antecedentes más lejanos de FA. Los pacientes pueden haber experimentado más episodios de FA y, por tanto, han sufrido más remodelación auricular inducida por la FA21. Se esperaría que un sustrato auricular que haya progresado más se tradujera en más características clínicas de remodelación o más graves. Sin embargo, no encontramos ninguna señal que apuntara a la presencia de factores de riesgo de recurrencia de la FA más establecidos. En cambio, en todo caso, parecía que los pacientes con fracaso de la ablación previa mediante catéter tenían menos factores de riesgo clínico, aparte de unos antecedentes más lejanos de FA.
Por lo que sabemos, solo hay 3 estudios que tratan sobre la asociación entre el fracaso de una ablación mediante catéter y peores resultados después de la ablación toracoscópica. Driessen et al.6 fueron los primeros en comunicar esta asociación en pacientes a quienes se les había realizado ablación toracoscópica, durante un seguimiento de 5 años. En el mismo centro, pero con diferentes pacientes, Wesselink et al.13 encontraron que el fracaso de una ablación previa mediante catéter fue un factor de riesgo independiente para la recurrencia de la FA durante un seguimiento de 2 años en 121 participantes con FA permanente. Por último, Lim et al.7 no encontraron ninguna asociación entre la ablación previa mediante catéter y la ausencia de FA. Sin embargo, sus pacientes sin ablación (n=47) eran mayores, tenían más FA permanente y un IVAI más grande, lo que puede haber reducido las diferencias en el resultado en relación con los pacientes con fracaso de la ablación mediante catéter.
Con todo, hubo diferencias sutiles en la estructura de la fibrosis de la aurícula izquierda entre los pacientes con ablación previa mediante catéter y sin ella en el subconjunto de pacientes de los cuales se disponía de un análisis histológico detallado. En este caso, se muestra por primera vez que la densidad de la fibra de colágeno es mayor en pacientes con una ablación previa mediante catéter que en pacientes sin ablación, mientras que el porcentaje total de colágeno no cambió. Además, la distribución del grosor de la fibra de fibrosis tenía un patrón característico diferente entre estos grupos de pacientes, lo que se ilustró mediante la curva diferencial (figura 2B). Esto puede ser compatible con la progresión subclínica del sustrato, que no se refleja (aún) en las características clínicas o electrofisiológicas iniciales.
Esta progresión subclínica del sustrato puede explicar el aumento del riesgo de recurrencia de la FA. Se desconoce si estas diferencias sutiles afectan a la velocidad de conducción o a la heterogeneidad en la aurícula, y si pueden contribuir a la arritmogénesis. Las fibras gruesas de colágeno pueden disminuir la velocidad de conducción transversal, aumentar la anisotropía y, por tanto, incrementar el riesgo de FA (recurrente)22. De la misma manera, el aumento de la densidad de las fibras de colágeno puede disminuir la velocidad de conducción23. A su vez, la disminución de la velocidad de conducción aumenta la probabilidad de reentrada y el riesgo de FA (recurrente)24. La distribución y estructura de la fibra de colágeno puede contribuir a la recurrencia de la FA y (en parte) puede explicar el mayor riesgo de recurrencia de la FA en pacientes con fracaso de la ablación previa mediante catéter.
LimitacionesEste estudio es un análisis retrospectivo de pacientes a quienes se les ha realizado ablación toracoscópica de la FA. Aunque la mayoría de los datos se recopilaron prospectivamente, hay limitaciones inherentes al diseño retrospectivo, como el hecho de que haya que ajustarse a conclusiones asociativas y el riesgo de sesgo de selección o sesgo de información. Nuestro objetivo era minimizar el riesgo de sesgo de selección con un diseño de emparejamiento por puntuación de propensión. En este análisis con emparejamiento por puntuación de propensión, no se pudieron corregir las variables que no se habían observado o no se habían registrado estructuralmente, y no se puede especular sobre el efecto potencial en el resultado de nuestro estudio. No se pudieron corregir las características de los fracasos de la(s) ablación(es) mediante catéter, como el conjunto de lesiones aplicado, que puede haber afectado al riesgo de recurrencia. No todos estos datos estaban disponibles, ya que estas intervenciones se realizaron principalmente en centros diferentes de aquellos en que se realizó la ablación toracoscópica. Se llevó a cabo una monitorización regular con Holter de 24 horas, que es una limitación sistemática, pero, en cualquier caso, una limitación. Una monitorización más intensiva podría haber aumentado la detección de recurrencias asintomáticas de FA; sin embargo, no tenemos ningún motivo para esperar que este efecto difiera entre los pacientes con fracaso de la ablación previa mediante catéter y sin ella. Debido a la monitorización intermitente, no se pudo informar sobre la carga de FA en casos de recurrencia.
CONCLUSIONESLos pacientes con fracaso de la ablación previa mediante catéter a quienes se practicó ablación toracoscópica de la FA corren un riesgo considerablemente mayor de recurrencia de la FA que los pacientes sin ablación. Esto es así a pesar de un número similar o incluso menor de factores de riesgo clínicamente relevantes establecidos de recurrencia de la FA. El fracaso de la ablación mediante catéter puede considerarse un marcador de mayor riesgo de recurrencia. Paralelamente, se demostró que los pacientes con fracaso de la ablación mediante catéter tienen mayor progresión subclínica de formación de fibrosis auricular.
FINANCIACIÓNLos autores no recibieron apoyo económico para la investigación, autoría o publicación de este artículo.
CONTRIBUCIÓN DE LOS AUTORESR. Wesselink, W.J.P. van Boven, A.H.G. Driessen y J.R. de Groot idearon y diseñaron este proyecto. R. Wesselink, M. Vroomen, I. Overeinder, J. Neefs, N.W.E. van den Berg, E.R. Meulendijks, F.R. Piersma, J. Luermans, B. Maesen, C. de Asmundis, G-B. Chierchia, M. La Meir y L.A.F.G. Pison contribuyeron con la inclusión de participantes y la recopilación de datos. R. Wesselink, M. Vroomen, I. Overeinder, J. Neefs, N.W.E. van den Berg, E.R. Meulendijks, F.R. Piersma, R.F.M. Al-Shama, T.A.C. de Vries, T.E. Verstraelen y J.R. de Groot participaron en el análisis e interpretación de los datos. Todos los autores contribuyeron a la redacción, evaluación crítica y/o revisión del original. Todos los autores aprobaron la versión final del original y son responsables de todos los aspectos del trabajo. R. Wesselink y J.R. de Groot fueron responsables del contenido general del artículo.
CONFLICTO DE INTERESESB. Maesen es asesor de Atricure y Medtronic, J. Luermans tiene un contrato de asesoría con Medtronic, G.B. Chierchia: AF Solutions Medtronic, Biosense Webster, Abbott Medical, Boston Scientific, Philips, Biotronik, A.H.G. Driessen: asesor de Atricure, en los últimos 5 años sin ingresos, L.A.F.G. Pison: asesor de Medtronic, M. La Meir: asesor de Atricure. J.R. de Groot recibe becas de investigación a través de su institución de Abbot, Atricure, Bayer, Boston Scientific, Daiichi Sankyo, Johnson & Johnson y Medtronic, y recibió honorarios como conferenciante/honorarios de asesoría de Atrian Medical, Atricure, Bayer, Biotronik, Daiichi Sankyo, IPPMed, Medtronic, Novartis y Servier. El resto de los autores no comunican ningún conflicto de intereses.
Agradecemos cordialmente al Profesor Dr. A.H. Zwinderman el apoyo estadístico.