Los resultados combinados se utilizan ampliamente, pero tienen diversas limitaciones. El modelo Clinical outcomes, healthcare resource utilization and related costs (COHERENT) es una aproximación nueva para presentar y comparar visualmente todos los componentes de los resultados combinados (incidencia, tiempo, duración) y los costes relacionados. El objetivo es evaluar su utilidad en una cohorte de pacientes.
MétodosSe diseñó un sistema de colores que representa gráficamente el porcentaje de pacientes en cada situación clínica (estado vital y ubicación: domicilio, urgencias, hospital), codificada jerárquicamente, en cada momento del seguimiento. Se aplicó a 1.126 pacientes con insuficiencia cardiaca aguda de 25 hospitales seguidos durante 30 días tras su visita a urgencias, y se calculó el tiempo en cada situación clínica y sus costes sanitarios.
ResultadosEl modelo ilustra visualmente los componentes del objetivo combinado a los 30 días (el 2,12% en urgencias, el 23,6% en hospitalización índice, el 2,7% en reingresos, el 65,5% vivo en casa y el 6,02% fallecido) y muestra diferencias significativas entre grupos de pacientes, hospitales o sistemas sanitarios. El instrumento también calcula y muestra los costes diarios y acumulados (total, 4.895.070 euros; media, 144,91 euros/paciente/día).
ConclusionesEl modelo COHERENT es un nuevo método para mostrar visualmente resultados combinados y sus costes que permite comparar grupos de pacientes y cohortes. El nuevo sistema puede ser útil como un nuevo criterio de valoración para ensayos clínicos o estudios observacionales, y un instrumento para la evaluación comparativa, la planificación clínica, el análisis económico y la implementación de la atención sanitaria basada en valor.
Palabras clave
Las variables de resultados combinados permiten comprender mejor el comportamiento de una enfermedad y aumentan la eficacia mediante el registro de más eventos en menos tiempo, lo cual permite reducir el tamaño muestral y el coste de los ensayos. No obstante, su uso está sujeto a varias limitaciones1–3. Actualmente no hay un modo de incorporar y analizar todos los componentes de las variables de resultados combinados, como su inicio y su duración.
La insuficiencia cardiaca aguda (ICA) es un buen contexto para utilizar variables de resultados combinados. La ICA es una enfermedad frecuente y grave que se caracteriza por cambios rápidos en la situación clínica con una morbimortalidad elevada a corto plazo4,5, un considerable consumo de los recursos sanitarios y un coste elevado6,7. Aún no se ha definido qué resultado o resultados combinados son ideales para describir con una única variable de resultado el itinerario asistencial de los pacientes con ICA o evaluar el efecto de los nuevos tratamientos o de los modelos asistenciales3. Los resultados combinados tradicionales, como el de mortalidad o reingreso, se han utilizado pero con limitaciones y además se carece de una solución satisfactoria para analizar sus distintos componentes más allá de la incidencia o el momento de aparición.
Este proyecto tiene por objetivo desarrollar un nuevo sistema para visualizar, evaluar y comparar resultados combinados con representaciones gráficas de interpretación fácil, que permiten cuantificar la incidencia, el inicio y la duración de cada uno de sus componentes, así como sus costes.
MÉTODOSModelo conceptualEl proyecto Clinical outcomes, healthcare resource utilization and related costs (COHERENT) es una iniciativa de los investigadores del Centro Nacional de Investigaciones Cardiovasculares (CNIC), el registro español Epidemiology of Acute Heart Failure in Emergency Departments (EAHFE) y el Servicio de Cardiología e Instituto de Investigación del Hospital Universitario 12 de Octubre de Madrid (España) para desarrollar un nuevo sistema para evaluar resultados combinados complejos de manera sencilla a través de gráficos. Se definió una lista mutuamente excluyente de situaciones clínicas que conformaban las variables de resultados combinados, que se codificaron de manera jerárquica. Se definió «situaciones clínicas» como el estado clínico del paciente (vivo o muerto) y la localización (en casa, en urgencias [SU] o en el hospital). Se registraron las situaciones clínicas en cada punto temporal determinado. Se elaboraron subcódigos adicionales para clasificar cada una de las unidades hospitalarias o ambulatorias utilizadas (como el servicio que ingresa al paciente) y las causas de los resultados (muerte o reingreso por IC, causa cardiovascular o cualquier causa).
Diseño del modelo gráficoSe elaboró un sistema de representación gráfica de las situaciones clínicas en el tiempo, cuyo eje de abscisas representa el porcentaje de pacientes en cada categoría posible de situación clínica y el eje de ordenadas, los días de seguimiento. Las gráficas están formadas por un conjunto de columnas de colores apiladas que cambian con el tiempo. Cada columna representa el 100% de los pacientes observados y los colores, el porcentaje de pacientes en cada situación clínica (figura 1A). Se estableció el supuesto de que los puntos temporales eran días completos, con la excepción de los periodos de 6 o 12 h utilizados para evaluar los primeros días en el «modelo detallado» (figura 1B). El número de categorías que aparece en la gráfica puede personalizarse desde un modelo básico (en casa, en el hospital, fallecido) hasta un modelo exhaustivo en el que se muestran todos los servicios involucrados o las causas de cada componente del resultado combinado. La gráfica se diseñó con la versión 3.4.3 del paquete estadístico R (© 2017 The R Foundation for Statistical Computing, Austria)8.
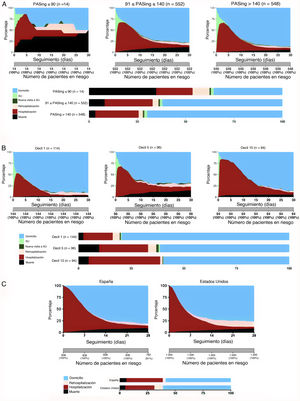
Modelo COHERENT: distribución a 30 días de las categorías predefinidas en la cohorte de pacientes tras acudir a urgencias por insuficiencia cardiaca aguda. El eje de abscisas representa el porcentaje de pacientes en cada situación clínica en cada momento (en días, eje de ordenadas) con cada situación clínica codificada con un color distinto. A: modelo COHERENT básico en el que se observa el tiempo fallecido (área en negro), el tiempo en urgencias, incluidos los reingresos (áreas verdes), el tiempo en el hospital, incluidos los reingresos (áreas rojizas) y el tiempo vivo en domicilio (área azul claro). B: modelo COHERENT detallado. Esta gráfica incluye el análisis de los primeros 7 días con una división adicional por horas durante los primeros 3 días (útil para el análisis del funcionamiento en urgencias), y un análisis detallado de las unidades donde los pacientes transcurrieron los primeros días de hospitalización. H: hospital; SU: servicio de urgencias; UCI: unidad de cuidados intensivos Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Para ilustrar el modelo, se utilizó una cohorte de pacientes con ICA. Para ello se seleccionó de manera aleatoria a 50 pacientes con ICA de cada uno de los 24 SU españoles incluidos en los registros 4 (febrero a marzo de 2014) y 5 (enero a febrero de 2016) del Epidemiology of Acute Heart Failure in Emergency Departments (EAHFE)9. El registro de las situaciones clínicas fue retrospectivo durante los 30 días posteriores al evento índice (visita a un SU por ICA).
Empleo del modelo para comparacionesSe evaluó la capacidad del modelo para comparar resultados con técnicas visuales y estadísticas en distintos contextos: a) la comparación entre subgrupos de pacientes se hizo enfrentando las diferencias en los resultados según las características de los pacientes; b) la comparación entre patrones asistenciales (es decir, ingreso en distintos servicios, cronologías como la estancia media [EM] en el SU o en el hospital o reingresos) se analizó comparando los distintos tipos de hospitales (es decir, benchmarking o evaluación comparativa) o sistemas sanitarios. En este último caso, se compararon los datos reales de este estudio con una cohorte simulada con datos de resultados publicados en Estados Unidos de pacientes hospitalizados con insuficiencia cardiaca10,11.
Cálculo de los costesLos costes de las situaciones clínicas se calcularon a partir de datos de 2014 publicados por el Ministerio de Sanidad, Servicios Sociales e Igualdad. Se utilizaron los costes medios estimados para las visitas a un SU, la hospitalización y la atención ambulatoria, y se consideraron los episodios de hospitales del Servicio Nacional de Salud español para las altas con los códigos 389.91, 402.01, 402.11, 402.91, 404.01, 404.03, 404.11, 404.13, 404.91, 404.93 y 428* de la Clasificación Internacional de Enfermedades, Novena Revisión, Modificación Clínica12. Se calcularon los costes medios y totales de los episodios asistenciales —definidos como el conjunto de servicios proporcionados a un paciente con un problema médico en un periodo de tiempo y en un sistema integrado de atención específico (es decir, un hospital)— y del proceso asistencial de un paciente, que incluye la suma de todos los episodios que un paciente con un problema médico sufre durante el tiempo de observación (en este caso 30 días). El coste de cada hospitalización se calculó como el número de casos de cada grupo relacionado por el diagnóstico multiplicado por el coste medio (estimado a partir del coste de 79 hospitales generales españoles) de dicho grupo dividido por el número total de casos. Otros costes se calcularon como el cociente entre los gastos hospitalarios del Servicio Nacional de Salud español y la actividad registrada en el sistema de información de asistencia especializada, considerada según las distintas modalidades de asistencia sanitaria (estancia en un SU sin hospitalización y hospitalización parcial para la hospitalización domiciliaria)13. En la se muestran otros detalles sobre el cálculo de los costes, como los costes unitarios medios diarios estimados por tipos de hospital.
Análisis estadísticoLos datos descriptivos de la situación clínica de todos los grupos se presentan como porcentajes del tiempo total dedicado en cada situación clínica. Los costes se presentan como gastos absolutos (en euros) y como porcentaje del coste total por tiempo de seguimiento, unidades de asistencia sanitaria o tipo de asistencia y media±desviación estándar (DE) por paciente y mes o día. Teniendo en cuenta que no hay ninguna prueba estadística que compare toda la información integrada en los modelos visuales y proteja la integridad del análisis estadístico, se tuvo especial cuidado en evitar los errores de tipo I, dada la multiplicidad de los datos (múltiples resultados, análisis de subgrupos, medidas repetidas en el tiempo). Por consiguiente, se propusieron 2 métodos para el análisis estadístico: a) una vez se visualizan las diferencias entre patrones, es posible aplicar pruebas estadísticas formales para sostener las diferencias entre grupos en lo que a situación clínica se refiere, y b) aplicar pruebas estadísticas formales al resultado compuesto predefinido ().
ÉticaEl Comité de Ética del Hospital Universitario Central de Asturias, Oviedo, aprobó los registros 4 y 5 del EAHFE. Los pacientes proporcionaron el consentimiento informado para participar y que se contactara con ellos para el seguimiento.
RESULTADOSObtención de la gráfica descriptivaLa figura 1A representa la situación clínica registrada durante cada día de los 30 días posteriores al ingreso en un SU, de cada uno de los 1.126 pacientes con ICA, con todos los datos disponibles (el 93,8% de los elegibles). Los motivos para la exclusión fueron pérdida de seguimiento de 9 pacientes y codificación incorrecta de 65. En la se presentan las características basales. La distribución de las categorías en función de la situación clínica durante los primeros 30 días se muestra en la tabla 1 y la figura 1. El área verde claro representa el tiempo transcurrido en la primera visita en urgencias, de toda la cohorte (media, 0,64 días; el 2,14% del tiempo total), el área marrón representa los días transcurridos durante la primera hospitalización (media, 7,09 días; el 23,63%), el área en negro representa los días posteriores a la muerte de los pacientes (media, 1,81 días; el 6,02%). El área azul claro representa los días vivo fuera del hospital (DVFH) (media, 19,65 días; el 65,56%). Teniendo en cuenta el consumo de recursos, el 23,6% del tiempo de seguimiento correspondió a las hospitalizaciones iniciales (área marrón); el 2,7%, a los reingresos (marrón claro) y el 0,8%, a las posteriores visitas a urgencias (verde oscuro) (figura 1A). La mortalidad acumulada a los 30 días fue del 8,7%, lo que supuso un 6,0% del tiempo total de seguimiento (área en negro; figura 1A). La mayor parte de los fallecimientos se debieron a causas cardiovasculares. En la figura 1B hay información más detallada de los primeros 7 días. La hospitalización en unidades de cuidados intensivos (cardiacos o generales) representó el 0,5% del tiempo y la hospitalización en plantas convencionales, el 25,8%: medicina interna (11,2%), cardiología (5,9%), geriatría (2,0%), larga estancia (2,2%), otros servicios hospitalarios (1,3%) y traslado a otros hospitales (1,9%) (tabla 1).
Tiempo (absoluto y relativo) transcurrido en cada situación clínica por los pacientes con insuficiencia cardiaca aguda durante los 30 días tras la visita a urgencias
| Tiempo en cada situación clínica al final del proceso de 30 días | ||
|---|---|---|
| (días, media) | (% del tiempo total) | |
| En casa | 19,65 | 65,50 |
| En urgencias | 0,64 | 2,12 |
| Durante la visita inicial a un SU | 0,41 | 1,37 |
| Visita repetida a un SU | 0,23 | 0,77 |
| En el hospital | 7,91 | 26,36 |
| Hospitalización inicial | 7,09 | 23,63 |
| Reingreso | 0,82 | 2,73 |
| Localización durante la hospitalización | ||
| Medicina interna | 3,36 | 11,20 |
| Durante la hospitalización inicial | 2,94 | 9,80 |
| Durante los reingresos | 0,42 | 1,40 |
| Cardiología | 1,78 | 5,93 |
| Durante la hospitalización inicial | 1,61 | 5,37 |
| Durante los reingresos | 0,17 | 0,57 |
| Geriatría | 0,59 | 1,97 |
| Durante la hospitalización inicial | 0,53 | 1,77 |
| Durante los reingresos | 0,06 | 0,20 |
| Unidad de corta estancia | 0,37 | 1,23 |
| Durante la hospitalización inicial | 0,34 | 1,13 |
| Durante los reingresos | 0,03 | 0,10 |
| Unidad de cuidados intensivos | 0,16 | 0,52 |
| Durante la hospitalización inicial | 0,16 | 0,52 |
| Durante los reingresos | 0,001 | 0,003 |
| Hospitalización en centro de larga estancia | 0,67 | 2,23 |
| Durante la hospitalización inicial | 0,63 | 2,10 |
| Durante los reingresos | 0,05 | 0,17 |
| Otros servicios hospitalarios | 0,40 | 1,33 |
| Durante la hospitalización inicial | 0,31 | 1,03 |
| Durante los reingresos | 0,08 | 0,27 |
| Transferidos a otro hospital | 0,58 | 1,93 |
| Mortalidad | 1,81 | |
| Muerte cardiovascular | 1,20 | |
| Muerte no cardiovascular | 0,44 | |
| Muerte por causas desconocidas | 0,17 | |
SU: servicios de urgencias.
Puesto que la presión arterial sistólica (PAS) inicial es un buen factor pronóstico en la ICA, se analizó el modelo comparando los resultados de los pacientes con PAS <90mmHg (n=14; 1,3%), PAS 90-140mmHg (n=552; 49,6%) y PAS> 140mmHg (n=548; 49,2%). Las diferencias en la mortalidad, el tiempo de hospitalización y los DVFH fueron visualmente evidentes (figura 2A) y estadísticamente significativas (p <0,001).
Ejemplos de uso del modelo COHERENT para comparar patrones de resultados según los distintos perfiles de riesgo, hospitales y sistemas sanitarios. A: comparación de patrones de resultados en pacientes con insuficiencia cardiaca aguda hipotensiva, normotensiva e hipertensiva, que incluye las estancias en urgencias. Para la comparación de resultados, p <0,001. B: comparación de los patrones de resultados entre hospitales según sus deciles de estancia media. El primer decil (decil 1) incluye los hospitales con menor estancia media y el décimo decil (decil 10), los de mayor estancia media. Los patrones son claramente distintos. Para la comparación de resultados, p <0,001. C: comparación de los patrones de resultado entre la cohorte del EAHFE (España, izquierda) y una cohorte simulada de Estados Unidos (derecha), basada en datos de la literatura médica10,11, que utiliza solo a pacientes hospitalizados (las visitas a urgencias no se incluyeron en este análisis). EAHFE: Epidemiology of Acute Heart Failure in Emergency Departments; PASing: presión arterial sistólica al ingreso; SU: servicio de urgencias.
Las diferencias de gestión clínica entre hospitales se compararon según su tercil de EM eligiendo 2 de los hospitales participantes del primer decil de EM, 2 del quinto y 2 del décimo (medias, 4,3, 7,6 y 10,2 días respectivamente) (figura 2B). La gráfica muestra de manera visual no solo la diferencia evidente en la proporción de tiempos transcurridos en el hospital (el 14,0, el 24,4 y el 32,9% respectivamente) establecidos por definición, sino también las diferencias en las otras proporciones, como el tiempo en urgencias (el 3,8, el 5,8 y el 3,3%), el domicilio (el 75,3, el 61,6 y el 57,8%) y las posteriores hospitalizaciones (el 4,0, el 2,1 y el 1,1%) (todas las diferencias en las comparaciones fueron significativas, p <0,001). Al comparar la cohorte española con una cohorte simulada de Estados Unidos, se observaron diferencias en la EM y la tasa de reingresos, pero no en los DVFH a 30 días (figura 2C). Como muestra de la flexibilidad del sistema, en este análisis se excluyeron las visitas a urgencias, ya que no pudo disponerse de esta información de los hospitales de Estados Unidos.
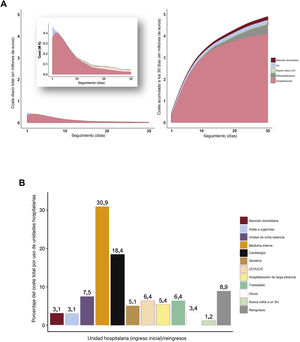
Cálculo de los costesSe calculó el coste total a 30 días por situación clínica, episodio y proceso asistencial del paciente con los costes unitarios medios diarios estimados por tipos de hospital (tabla 2, figura 3). Para el grupo estudiado, el coste total calculado fue de 4.895.070 euros (aproximadamente 5,7 millones de dólares estadounidenses), con un coste medio por proceso asistencial del paciente a 30 días de 4.347,3 euros, esto es 144,91 euros/paciente/día. Los costes se concentraron en los primeros 7 días (48,6%) y llegaron al 76,7% al final de la segunda semana (figura 3A). Las hospitalizaciones iniciales supusieron el 83,6% del coste total; los reingresos, el 9,0%, y todas las visitas a un SU, el 4,3%; medicina interna (35,4%), cardiología (20,3%) y las unidades de corta estancia (8,1%) generaron la mayor parte de los costes totales, mientras que el coste relacionado con los ingresos en unidades de cuidados intensivos supuso solo el 6,5%. Los episodios con los costes medios más altos fueron los ingresos en la unidad de cuidados intensivos cardiacos (12.627 euros), los traslados (5.823 euros), las hospitalizaciones de larga duración (5.395 euros) y los ingresos en servicios de cardiología (4.403 euros) (figura 3B).
Costes por proceso asistencial del paciente, situación clínica y episodio durante los primeros 30 días para toda la cohorte
| Frecuencias, n | Coste (euros) | % | |
|---|---|---|---|
| Total de pacientes | 1.126 | 100 | |
| Total de días-paciente | 33.780 | 100 | |
| Coste total | 4.895.069,9 | 100 | |
| Coste medio por proceso asistencial del paciente | 4.347,3 | ||
| Coste medio por paciente y día | 144,9 | ||
| Coste total por situación clínica | |||
| Servicios de urgencias* | 208.848,0 | 4,27 | |
| Atención domiciliaria | 149.376,0 | 3,05 | |
| Hospital | 4.536.845,9 | 92,68 | |
| Hospitalizaciones iniciales | 4.094.249,2 | 83,64 | |
| Cardiología | 898.258,6 | 18,35 | |
| Geriatría | 250.843,4 | 5,12 | |
| UCIC/UC | 315.683,7 | 6,45 | |
| Medicina interna | 1.513.713,1 | 30,92 | |
| Unidad de corta estancia | 369.248,3 | 7,54 | |
| Otros servicios hospitalarios | 746.502,0 | 15,24 | |
| Reingresos | 442.596,7 | 9,04 | |
| Cardiología | 95.226,1 | 1,95 | |
| Geriatría | 27.295,3 | 0,56 | |
| UCIC/UC | 1.497,7 | 0,03 | |
| Medicina interna | 217.403,1 | 4,44 | |
| Unidad de corta estancia | 28.612,1 | 0,58 | |
| Otros servicios hospitalarios | 72.562,3 | 1,48 | |
| Coste medio por episodio | 2.813,3 | ||
| Número de episodios | 1.740 | 100 | |
| Urgencias | 678 | 308,0 | 38,97 |
| Atención domiciliaria | 36 | 4.149,3 | 2,07 |
| Hospital | 1.026 | 4.421,9 | 58,97 |
| Hospitalizaciones iniciales | 897 | 4.564,4 | 51,55 |
| Reingresos | 129 | 3.431,0 | 7,41 |
UCIC/UC: unidad de cuidados intensivos cardiológicos/unidad coronaria.
Análisis visual de costes con el modelo COHERENT. A: análisis de costes relacionado con el tiempo para toda la cohorte; análisis diario, paralelo al de recursos sanitarios (izquierda) y coste acumulado a 30 días (derecha). B: distribución del coste hospitalario por unidades hospitalarias durante la hospitalización índice y los reingresos. SU: servicio de urgencias; UCIC/UC: unidad de cuidados intensivos cardiológicos/unidad coronaria.
Las variables de resultados combinados permiten registrar más eventos en menos tiempo y reducir el tamaño muestral y, en definitiva, el coste del estudio. El modelo COHERENT ofrece varias ventajas sobre las variables de resultados combinados tradicionales: a) posibilita describir «patrones» de atención de manera visual, fáciles de interpretar, con múltiples resultados al mismo tiempo —esto es, fotos instantáneas de la evolución de una cohorte o del funcionamiento de los sistemas sanitarios—; b) permite añadir más detalles en la descripción de los resultados (distintos tiempos, localización durante la hospitalización, causa del reingreso o la muerte), que pueden ser útiles para un análisis más profundo del consumo de recursos clínicos o un análisis de las causas de los componentes de los resultados combinados; c) facilita comparar distintas cohortes o grupos de pacientes, lo que los convierte en una opción ideal para la evaluación clínica y la evaluación comparativa, y d) hace posible incorporar el análisis de costes, lo que facilita incorporar estudios económicos.
Evaluación clínicaEl modelo ofrece una representación gráfica del proceso asistencial durante el curso de la ICA, una situación clínica compleja con un periodo vulnerable —que normalmente se gestiona en el hospital, pero no siempre (muchos pacientes reciben el alta directamente desde los SU)—, una fase de inestabilidad clínica tras el alta, con una amplia variabilidad de resultados clínicos y consumo de recursos según las características del paciente y las prácticas clínicas regionales14–18. Se desconoce cuál es el mejor resultado o resultados para evaluar los nuevos tratamientos de la ICA, un contexto complicado para el que se han propuesto varios resultados combinados distintos3. El modelo COHERENT puede utilizarse para comparar los resultados entre diversos subgrupos de pacientes (p. ej., los que reciben tratamientos distintos en un ensayo aleatorizado), ya que permite incluir varias de las variables más adecuadas para evaluar los resultados terapéuticos, como los DVFH19,20 o el tiempo en casa tras el alta21, definidos como más centrados en el paciente que los resultados tradicionales. Determinar los DVFH puede ser especialmente apropiado para los pacientes ancianos con mucha comorbilidad, como son los pacientes con ICA, que pueden dar más valor a pasar más tiempo en casa que a otros objetivos. No obstante, sigue siendo necesario validar o integrar estos nuevos resultados en resultados combinados consolidados.
Otro enfoque original y punto fuerte del modelo COHERENT es que permite iniciar el proceso asistencial a partir de la primera visita a un SU. La guía del ACC/AHA indica que la ICA requiere hospitalización22 y la mayoría de los estudios describen la ICA solo desde la perspectiva hospitalaria. No obstante, esta visión ignora la proporción significativa de pacientes que acuden a los SU y son dados de alta directamente —el 24% de la cohorte de este estudio y superior en otros países15—, un grupo a menudo olvidado pero que consume considerables recursos sanitarios, sobre todo si los pacientes vuelven a acudir a urgencias o requieren hospitalización pronto después del alta desde el SU. Estos pacientes merecen más atención en la estratificación del riesgo y el tratamiento clínico15. Para un mejor análisis de la fase inicial, se diseñó una opción para dividir los periodos iniciales en intervalos de 6 h (figura 2B). Esto es importante para el análisis de los pacientes de los SU, sobre todo en contextos en los que se aplican normas estrictas sobre el tiempo que se pasa en un SU, tales como la norma de dar el alta a las 4 h en Reino Unido o Australia Occidental23,24.
Evaluación comparativaEl modelo COHERENT ofrece la posibilidad de comparar «patrones asistenciales», tal como se muestra en las figura 2B,C. La primera muestra 3 tipos distintos de comportamientos hospitalarios, 2 caracterizados por decisiones precoces de los SU y 1 por estancias más largas en el SU (centro). El ejemplo de la izquierda podría definirse como «atrevido», con una alta proporción de altas precoces desde el SU, y el ejemplo de la derecha, como «conservador», con una mayoría de pacientes hospitalizados desde urgencias, con EM hospitalarias más largas. En medio figuran los hospitales cuya tasa de hospitalización es menor pero a expensas de dejar a los pacientes varios días en urgencias. Esta información puede ser muy importante para el tratamiento y la toma de decisiones (p. ej., para comprobar si los patrones asistenciales observados se ajustan a los modelos estratégicos o económicos en uno o varios hospitales), aspecto que no es fácil de evaluar, para lo que el modelo COHERENT puede ser de utilidad, ya que permite interpretarla de un vistazo.
En las figuras también se observa cómo influyen estos patrones en otros resultados como los reingresos o los DVFH. La figura 2C es un ejemplo de cómo el modelo visual puede servir para comparar el funcionamiento de distintos sistemas sanitarios. Una observación llamativa es el parecido en los DVFH observados en los sistemas sanitarios español y estadounidense a pesar de las diferencias en las EM modeladas de la hospitalización inicial según los datos reales españoles y los publicados de Estados Unidos. Así pues, el modelo proporciona información adicional importante que es apropiada para analizar la atención y la gestión sanitaria.
Análisis de costes y consumo de recursos sanitariosEl modelo presenta y calcula los costes desde la perspectiva del hospital, el componente más importante del cálculo de costes para los pacientes con insuficiencia cardiaca25, y lo hace con un enfoque basado en la incidencia26, que determina cómo cambia el coste de la atención a la insuficiencia cardiaca desde el episodio inicial en un SU a lo largo de la evolución de la enfermedad durante el seguimiento. Ofrece un método ascendente (basado en la persona), que asigna costes a los pacientes utilizando datos de casos reales cuando es posible y un método descendente (basado en la población) que adjudica los costes agregados obtenidos de las estimaciones indirectas27. Aunque los componentes del coste pueden estar sujetos a algunas variaciones según la información existente en cada caso, en general la carga económica de la insuficiencia cardiaca se considerará preferiblemente en términos de costes directos, tales como los atribuidos a los gastos de hospitalización y atención domiciliaria. No obstante, el sistema permitiría calcular tanto los costes ambulatorios como la atención primaria o la especializada, las consultas de insuficiencia cardiaca, la rehabilitación cardiaca, las consultas especializadas de enfermería y la atención domiciliaria o estimar los costes de la atención domiciliaria a partir de un registro de las horas de dedicación del profesional sanitario28. Conviene resaltar que este modelo permite considerar y calcular los costes de la estancia en observación, un consumo de recursos sanitarios cada vez más importante, con vías y modelos de facturación heterogéneos, a menudo ignorados en las mediciones de los reingresos y los índices de calidad29.
Investigaciones futurasEl modelo exige muchos datos y requiere información completa de la situación clínica de cada paciente en cada momento del seguimiento prestablecido (p. ej., cada día), por lo que se adecúa bien a los ensayos clínicos o los estudios observacionales exhaustivos, pero no necesariamente a la evaluación de la práctica clínica habitual. La viabilidad del modelo basado en datos extraídos de los sistemas de información y para periodos de seguimiento más largos se halla actualmente en evaluación. El modelo se ha probado en pacientes con ICA, a los que se adapta especialmente bien. Se está evaluando el sistema en otras enfermedades agudas y crónicas.
Limitaciones del estudioYa se ha mencionado que el modelo exige una recogida de datos exhaustiva. Además, el modelo COHERENT presenta varios desafíos estadísticos: es un método de visualización de datos longitudinales sobre resultados combinados. En la búsqueda de inferencia estadística formal, hay que tener en cuenta varias consideraciones (que van más allá del cometido de este artículo): a) el riesgo de errores de tipo I cuando se hacen comparaciones en múltiples cortes temporales; b) la necesidad de modelos de medidas repetidas apropiados al combinar tales datos; c) la obtención de estadísticos descriptivos apropiados para inferir efectos globales a lo largo del tiempo; d) si se diera un seguimiento más largo, el efecto de los seguimientos censurados podría tener importancia y las imputaciones múltiples podrían ser pertinentes, y e) si se centra la atención en los eventos no fatales, como el reingreso, hay que explicar el riesgo competitivo de fallecer, lo cual es más complicado si se analizan los episodios repetidos. Tal como está ahora, este método es un instrumento descriptivo para visualizar la evolución de las cohortes o grupos durante el seguimiento, pero no tiene ninguna función inferencial. Las pruebas estadísticas básicas se han proporcionado para generar hipótesis, no para hacer inferencias. Se debe ser cauteloso al comparar gráficas distintas, ya que estas pueden representar distintos momentos o procesos de la atención porque, aunque el modelo se ha diseñado para utilizarlo como solo instrumento para medir los resultados relacionados con el tiempo, los puntos de inicio y final pueden personalizarse según el diseño y los objetivos del estudio, de manera que un solo criterio de valoración no puede captar todos los resultados en una sola variable. Aunque 30 días es un tiempo estándar de seguimiento en este tipo de estudios, los puntos de inicio y final de los distintos resultados cambian. La visita a un SU, el ingreso en el hospital o la fecha de aleatorización son puntos de inicio, mientras que el momento final se establecerá al cabo de 30 días del ingreso para la mortalidad a 30 días o del alta para el reingreso a 30 días. Una solución es programar seguimientos más largos o más cortos según las necesidades del estudio. A este respecto, es importante mencionar que los porcentajes que se muestran en la tabla 1 no representan exactamente la visión completa de la cohorte, ya que se censuraron varios datos. Esto es así para la hospitalización inicial (el 3,2% de los pacientes seguían en el hospital a los 30 días) y en particular para la tasa de reingresos, donde se observa una menor carga que en los estudios específicos. Disponer de una visión completa del ingreso inicial y los reingresos requeriría un seguimiento de más de 30 días.
Por último, la mejora de la disnea, los resultados funcionales o la calidad de vida, que son pertinentes en enfermedades como la ICA, no pueden incorporarse al modelo, ya que no son mutuamente excluyentes con los otros resultados.
CONCLUSIONESEl modelo COHERENT facilita la descripción visual de la incidencia, el momento de inicio y la duración de todos los componentes de los distintos criterios de valoración combinados, así como los costes relacionados con el hospital, y permite comparar subgrupos de pacientes, cohortes y patrones asistenciales. Este modelo puede utilizarse como una nueva variable de resultados combinados en ensayos clínicos y un medio para la evaluación comparativa, el análisis económico y la implementación de una atención sanitaria basada en el valor.
- –
Las ventajas de utilizar variables de resultados combinados en la investigación clínica se contrarrestan por varias limitaciones, como la incapacidad de mostrar todos los componentes que contribuyen a los resultados y las dificultades para tratar los riesgos competitivos. No se han integrado resultados económicos a las variables de resultados combinados habituales.
- –
El modelo COHERENT utiliza resultados visuales fáciles de interpretar para presentar la incidencia, el inicio y la duración de todos los componentes de los resultados combinados, que pueden personalizarse, así como los costes relacionados con el hospital. El sistema permite comparar entre subgrupos y cohortes distintas. Este modelo puede ser útil como un nuevo criterio de valoración en ensayos clínicos, un instrumento para la evaluación comparativa, el análisis económico y la implementación de una atención sanitaria basada en el valor.
Este proyecto se creó sin financiación específica. El proyecto fue premiado por HealthStart madri+d como una de las 5 innovaciones finalistas en salud impulsadas por las universidades, la sanidad pública, la investigación o las instituciones tecnológicas de la Comunidad de Madrid durante el año 2019.
CONTRIBUCIÓN DE LOS AUTORESH. Bueno concibió el modelo y redactó el artículo. Ò. Miró y F.J. Martín-Sánchez contribuyeron al desarrollo del modelo, revisaron de manera crítica el contenido del artículo, y coordinaron la obtención de datos del grupo a estudio y el análisis inicial. V. Gil, P. Llorens, J. Jacob y P. Herrero-Puente contribuyeron a la coordinación y obtención de datos de grupo a estudio, y revisaron de manera crítica el artículo. J.L. Bernal realizó todos los cálculos económicos. J.L. Bernal, X. Rossello, G. Moreno y S.J. Pocock contribuyeron al desarrollo del modelo, al plan de análisis, al análisis estadístico y revisaron de manera crítica el contenido del artículo. V. Jiménez-Jiménez, C. Goñi, N. Naranjo, S. Garrote y J.C. Silla-Castro trabajaron en el desarrollo del sistema y el motor, y aprobaron el contenido del artículo. Los demás investigadores del Grupo especial de estudio del modelo COHERENT aplicado a la ICA-SEMES aprobaron el proyecto, obtuvieron los datos clínicos y aprobaron la versión final antes de su presentación. H. Bueno tuvo acceso ilimitado a todos los datos del estudio y se hace responsable de su integridad y del análisis de los datos.
CONFLICTO DE INTERESESLos autores afirman que no tienen ningún conflicto de intereses específico relacionado con el presente estudio. H. Bueno recibe financiación en investigación de Astra-Zeneca, BMS, Janssen y Novartis, ha recibido honorarios de asesoramiento de Astra-Zeneca, Bayer, BMS-Pfizer y Novartis y honorarios de conferenciante o apoyo por asistir a encuentros científicos de Astra-Zeneca, Bayer, BMS-Pfizer, Novartis y MEDSCAPE-the heart.og. El Grupo de investigación ICA-SEMES ha recibido financiación ilimitada de Orion Pharma y Novartis. El presente estudio fue diseñado, realizado, analizado y escrito exclusivamente por los autores, independientemente de cualquier fuente de financiación.
El CNIC cuenta con el apoyo del Ministerio de Economía, Industria y Competitividad (MINECO) de España y de la Fundación Pro CNIC, y es un Centro de Excelencia Severo Ochoa (adjudicación del MINECO SEV-2015-0505). El registro EHAFE fue financiado parcialmente por subvenciones del Instituto de Salud Carlos III y del Ministerio de Sanidad de España y por el FEDER (PI15/01019 y PI15/00773, PI18/00393, PI19/00456) y la Fundació La Marató de TV3 (2015/2510). Las urgencias: el Grupo de investigación sobre procesos y patologías del IDIBAPS recibe financiación económica de la Generalitat de Catalunya para grupos de investigación consolidados (GRC 2009/1385 y 2014/0313). H. Bueno recibe financiación en investigación del Instituto de Salud Carlos III, España (PIE16/00021 y PI17/01799), X. Rossello ha recibido financiación del programa de becas SEC-CNIC CARDIOJOVEN. G. Moreno recibió subvenciones de los Fondos Sociales Europeos a través de la Iniciativa de Empleo Juvenil 2016 – contratos de apoyo a la investigación (PEJ16/MED/AI-1132) proporcionados por la Comunidad de Madrid, y actualmente recibe financiación del Ministerio de Educación y Formación Profesional con una beca de formación de profesores universitarios (FPU18/03606) en la Universidad Complutense de Madrid. S. Garrote recibe financiación de los Fondos Sociales Europeos a través de la Iniciativa de Empleo Juvenil 2018 - Contratos predoctorales (PEJD-2018-PRE/BMD-9013) proporcionados por la Comunidad de Madrid. O. Miró recibe financiación del Ministerio de Sanidad de España y del FEDER (PI15/01019, PI18/00773), de La Marató de TV3 (2015/2510) y de la Generalitat de Catalunya para grupos de investigación consolidados (GRC 2009/1385, 2014/0313, 2017/1424).
Se agradece el apoyo de Fátima Sánchez-Cabo (CNIC), Gema García Sáez, (Universidad Politécnica de Madrid) y Elena Hernando (Universidad Politécnica de Madrid) en el desarrollo del motor del modelo COHERENT.