Estudios previos han sugerido que el tejido adiposo epicárdico (TAE) podría ejercer un efecto paracrino en el miocardio. Sin embargo, pocos estudios han evaluado su papel en el riesgo de recurrencia de la fibrilación auricular (FA). El objetivo de ese estudio fue evaluar la asociación entre el volumen de TAE y su atenuación con el riesgo de recurrencia de FA tras la ablación de FA.
MétodosSe incluyó un total de 350 pacientes consecutivos sometidos a ablación de FA - mediana de edad 57 años [RIC 48-65], 21% FA persistente. La grasa epicárdica se cuantificó mediante tomografía computarizada multidetector utilizando el software Syngo.via Frontier-Cardiac Risk Assessment, midiendo el volumen tejido adiposo pericárdico (VTAP), el volumen de TAE y la atenuación de TAE posterior a la aurícula izquierda. La recurrencia de FA se definió como cualquier episodio documentado de FA, aleteo auricular, o taquicardia auricular más de 3 meses después del procedimiento.
ResultadosTras una mediana de seguimiento de 34 meses [rango de 12 a 57 meses], 114 pacientes (33%) tuvieron recurrencia de FA. La regresión de Cox univariable mostró que los pacientes con un volumen de TAE ≥ 80ml tenían un mayor riesgo de recurrencia de FA (HR=1,65; IC95%, 1,14-2,39; p=0,007). Sin embargo, después del ajuste multivariable, el volumen de TAE no fue un predictor independiente de recurrencia de FA (HR=1,24; IC95%, 0,83-1,87; p=0,3). Se observaron resultados similares con VTAP. Los pacientes con menor atenuación de TAE no tenían un mayor riesgo de recurrencia de FA (prueba de rango logarítmico p=0,75).
ConclusionesLos parámetros de TAE, incluida la evaluación del volumen de TAE, VTAP y la atenuación de TAE, no fueron predictores independientes de recurrencia de FA después de la ablación con catéter.
Palabras clave
La fibrilación auricular (FA) es la arritmia cardiaca mantenida más frecuente en adultos y conlleva una morbimortalidad considerable1. Además, es un problema clínico importante debido a la predisposición a recidivar incluso después de la ablación de la FA1.
Como es sabido, la obesidad es uno de los más importantes factores de riesgo de FA2. Varios mecanismos fisiopatológicos pueden ser la causa de esta asociación, como un efecto sistémico, endocrino o paracrino (local)2,3. El tejido adiposo epicárdico (TAE), definido como la grasa que se encuentra entre el miocardio y el pericardio, es un tejido metabólicamente activo que produce varias citocinas proinflamatorias que pueden tener efecto directo en el miocardio4.
Estudios previos han demostrado que el TAE se asocia de manera independiente con una mayor carga ateroesclerótica coronaria5,6, puede influir negativamente en la remodelación cardiaca y causar dilatación de la aurícula izquierda (AI), hipertrofia del ventrículo izquierdo y disfunción diastólica y aumentar el riesgo de insuficiencia cardiaca con fracción de eyección conservada7–9.
Sin embargo, pocos estudios grandes han evaluado la influencia del TAE en el riesgo de FA o su recurrencia10,11. Además, hay varios métodos para cuantificar la cantidad de TAE, lo que podría afectar a los resultados. Por ejemplo, estudios previos han indicado que la cantidad de TAE posterior a la AI podría estar asociada con la carga y la recurrencia de FA, pero en esos estudios el grosor del TAE se midió como la distancia más corta entre la AI media y el esófago12,13. La cuantificación del volumen total del TAE podría ser una medición más fiable del TAE porque la arritmogénesis puede tener su origen en vías compartidas4. La evaluación volumétrica es la medición más precisa del volumen del TAE, ya que el grosor varía entre las regiones cardiacas4.
Los estudios mecanicistas indican que un proceso inflamatorio relacionado con el TAE puede contribuir a la arritmogénesis4. Estudios anteriores han demostrado que la atenuación de grasa medida por tomografía computarizada (TC) se correlaciona con la inflamación detectada por examen histológico y tomografía por emisión de positrones14, y es un marcador potencial de inflamación local del TAE. Esta medición se ha relacionado con el síndrome coronario agudo14,15, y más recientemente algunos autores han explorado su papel en los resultados de la ablación de la FA16,17.
El objetivo de este estudio es evaluar la asociación entre el TAE y el riesgo de FA. Específicamente, se propone evaluar si el volumen de TAE podría ser un predictor de recurrencia de FA después de la ablación de la FA con catéter y si la atenuación del TAE posterior a la AI (un posible biomarcador de inflamación local) podría estar involucrada en esta asociación.
MÉTODOSPoblación de estudioEntre enero de 2017 y diciembre de 2019, se incluyó en este estudio de cohortes retrospectivo a todos los pacientes consecutivos con FA sintomática a quienes se realizó una TC para la planificación de la intervención. Se excluyó a los pacientes que tuvieran una coronariopatía o una valvulopatía moderada o grave. Las características demográficas, los datos clínicos y los resultados iniciales se recopilaron a partir de las historias clínicas. La definición de las distintas variables se presenta en la .
El estudio se llevó a cabo según los principios enunciados en la Declaración de Helsinki y fue aprobado por el comité de ética local (referencia interna: 191-21). Se obtuvo el consentimiento informado para el uso de datos clínicos antes de la realización de la TC.
Mediciones del tejido adiposo cardiacoEl día de la intervención se realizó a todos los pacientes una TC con multidetectores mediante tomógrafo con multidetectores de 384 cortes (2 × 192) (SOMATOM Force Siemens) de acuerdo con un protocolo normalizado (resumido en el material adicional). Todos los datos se procesaron utilizando una estación de trabajo especializada (Syngo.via Frontier-Cardiac Risk Assessment, Siemens Medical Solutions).
Las medidas del tejido adiposo cardiaco las determinaron investigadores que desconocían los criterios de valoración del paciente. Todas las mediciones se adquirieron sin contraste. El tejido adiposo se definió como el intervalo de –150 a –50 unidades Hounsfield (UH).
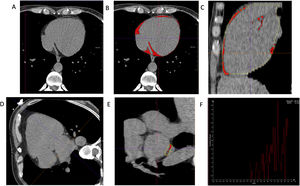
El tejido adiposo cardiaco se midió con 3 métodos, como se detalla en la figura 1:
- •
El volumen de tejido adiposo epicárdico (VTAE) se definió como la grasa entre la pared externa del miocardio y el pericardio. Para su evaluación, el pericardio se perfiló manualmente cada 10mm desde la bifurcación de la arteria pulmonar hasta el nivel de la válvula mitral y cada 20mm desde allí hasta el diafragma, y luego se reconstruyó semiautomáticamente como la suma de todos los cortes, como se ilustra en las figura 1A-C. Cuando fue necesario, se realizó el ajuste manual.
- •
Elvolumen de tejido adiposo pericárdico (VTAP) se definió como grasa interna y externa al pericardio4. Su valor se estimó automáticamente mediante el programa validado Syngo.via Frontier-Cardiac Risk Assessment (Siemens Medical Solutions).
- •
La atenuación del TAE posterior a la AI se midió con un solo corte, en eje corto, entre la AI media y el esófago. Los valores de atenuación de cada punto de esta área seleccionada se visualizaron en un gráfico y la atenuación se definió como el valor medio, como se ilustra en las figura 1D-F.
Ejemplo de medición del volumen de tejido adiposo epicárdico (VTAE) mediante tomografía computarizada. A: vista axial del contorno del pericardio; el pericardio se perfiló manualmente desde la bifurcación de la arteria pulmonar hasta el diafragma y el volumen final se calculó de manera semiautomática como la suma de todos los cortes. B y C: el color rojo indica el VTAE total desde las vistas axial y sagital respectivamente. Ejemplo de medición de la atenuación de la grasa posterior a la aurícula izquierda mediante tomografía computarizada, D: en una vista de 4 cámaras, se identificó la aurícula izquierda (AI) media. E: en el eje corto, en un solo corte, se perfiló un área entre la AI y el esófago. F: los valores de atenuación de cada punto del área seleccionada se mostraron en un gráfico. La atenuación se definió como el valor medio. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
La variabilidad entre observadores se evaluó en 20 pacientes seleccionados al azar. El coeficiente de correlación intraclase obtenido fue 0,991 (p<0,001) en la medición del VTAE y 0,884 (p<0,001) en la medición de la atenuación del TAE posterior a la AI.
Ablación con catéterTodas las intervenciones se realizaron con sedación intravenosa y control de la presión arterial, de la saturación de oxígeno y electrocardiográfico, con asistencia anestesiológica. Se utilizó el acceso venoso femoral en todas las intervenciones. Se colocó un catéter decapolar en el seno coronario. La punción transeptal se realizó mediante control radioscópico.
Las ablaciones con catéter incluyeron el aislamiento de las venas pulmonares con ablación con radiofrecuencia punto a punto y crioablación de segunda generación. La ablación con radiofrecuencia punto a punto se realizó con un catéter de ablación irrigado de 3,5mm (Thermocool SmartTouch o Thermocool SmartTouch SF) guiado por un sistema de mapeo electroanatómico 3D (CARTO-3, Biosense Webster Inc., Estados Unidos).
Se realizó un aislamiento exhaustivo de la vena pulmonar circundante. Simultáneamente se realizó la ablación del istmo cavotricuspídeo en pacientes seleccionados con aleteo auricular característico comprobado. Las ablaciones adicionales, como el aislamiento de la pared posterior, las lesiones lineales, los desencadenantes de la vena no pulmonar y la ablación de la zona de bajo voltaje, también se realizaron a criterio del cirujano.
Para la crioablación se utilizaron el sistema de catéter con crioablación cardiaca Arctic Front, el catéter de segunda generación Arctic Front Advance y el catéter orientable FlexCath (Medtronic, Estados Unidos). Se utilizó un balón de 28mm en todos los pacientes.
El catéter de mapeo se colocó en el ostium de las venas pulmonares, donde se comprobaron las posibilidades iniciales. El balón se infló en la AI. Se inyectó contraste para evaluar la oclusión del balón y, cuando fue posible, se empleó energía criotérmica. Los ciclos de congelación se aplicaron en cada vena pulmonar durante un mínimo de 240s. La estimulación diafragmática se llevó a cabo con un catéter decapolar para evitar la parálisis del nervio frénico.
Cada cirujano eligió el tipo de energía empleada. El criterio de valoración de la intervención fue el aislamiento eléctrico de todas las venas pulmonares de la AI. Se realizó cardioversión eléctrica si al final de la ablación se mantenía la FA.
SeguimientoEl protocolo de seguimiento estándar utilizado en nuestro centro incluye una primera evaluación clínica y un electrocardiograma de 12 derivaciones realizado 1 mes después del alta. Más adelante, el paciente es evaluado a los 3 y a los 6 meses con un electrocardiograma de 12 derivaciones y una consulta telefónica con un cardiólogo. Entre 9 y 12 meses después de la ablación, se realiza un control electrocardiográfico ambulatorio de 24 h, seguido de electrocardiograma y evaluación clínica a los 12, 18 y 24 meses y a continuación cada 12 meses. En cada visita, se pregunta a los pacientes por la recurrencia de arritmias con un cuestionario estandarizado sobre los síntomas relacionados con la arritmia (palpitaciones, molestias torácicas, astenia y mareos) y se les realiza una exploración física y un electrocardiograma de 12 derivaciones. Es posible que algunos pacientes necesiten más visitas según su estado clínico.
Criterios de valoración del estudioEl criterio de valoración principal se definió como la recurrencia de FA tras un periodo de recalibración (más de 3 meses después de la intervención). La recurrencia se definió como cualquier episodio registrado (electrocardiograma/Holter) de FA, aleteo o taquicardia auricular que durara más de 30s18. La información sobre la recurrencia de FA se recopiló mediante la revisión de las historias clínicas y fue objeto de censura estadística en noviembre de 2021. También se recopiló información sobre el nivel de recurrencia total (criterio de valoración secundario), definida como cualquier episodio registrado después de la ablación, incluido el periodo de recalibración.
Análisis estadísticosLas variables cualitativas se expresan como valores absolutos y porcentajes. Las variables continuas de distribución normal se expresan como media ± desviación estándar y las de distribución no normal, como mediana [intervalo intercuartílico]. Las características de los pacientes se compararon entre pacientes con y sin recurrencia mediante la prueba de la χ2 o la prueba de la t de Student, la prueba exacta de Fisher o la prueba de la U de Mann-Whitney, según el caso.
La exploración de datos inicial incluyó la regresión logística con transformación polinómica cúbica restringida para tener en cuenta las relaciones no lineales entre la recurrencia de FA y las mediciones del tejido adiposo (). La revisión de las curvas de efectos parciales de la regresión logística indicó que los pacientes con riesgo de recurrencia podrían estratificarse mediante un valor de corte del volumen de TAE de 80ml; del VTAP, de 150ml, y de TAE –75 UH tras la atenuación de la AI (). Se utilizaron modelos de riesgos proporcionales de Cox para estimar el efecto de las mediciones del TAE según 2 estrategias. Como una variable dicotómica definida por los valores de corte basados en datos predefinidos y como un valor continuo indexado por la superficie corporal total. Los 2 modelos se ajustaron a covariables clínicamente relevantes, como edad, sexo, hipertensión, diabetes, obesidad, subtipo de FA y AI dilatada. Las hipótesis de riesgos proporcionales se evaluaron con la prueba de residuos de Schoenfeld. Las hazard ratio (HR) con sus intervalos de confianza del 95% (IC95%) y los valores de p se comunican y se consideran estadísticamente significativos si p <0,05.
La supervivencia libre de recurrencia acumulada en el caso del TAE dicotómico se estimó utilizando el método de Kaplan-Meier y se comparó con la prueba de rangos logarítmicos.
Todos los gráficos y pruebas estadísticas se realizaron con el software estadístico R, versión 4.1.219, junto con los paquetes «rms»20, «survival»21, «survminer»22 y «gtsummary»23.
RESULTADOSCaracterísticas de la poblaciónDurante el periodo de estudio, 531 pacientes se sometieron a ablación de la FA. De estos, se excluyó a 125 porque tenían coronariopatía o valvulopatía moderada o grave y a 56 por perderse para el seguimiento. Las características clínicas, ecocardiográficas y de la ablación de la población del estudio se enumeran en la tabla 1. El 34% de los 350 pacientes incluidos eran mujeres y la mediana de edad, 57 [48-65] años. Tenían FA persistente el 21% y el 12% ya se había sometido antes a ablación de la FA con catéter.
Características de los pacientes
| Población totaln=350 | Sin recurrencia de la FAn=236 | Recurrencia de la FAn=114 | p | |
|---|---|---|---|---|
| Mujeres | 119 (34) | 71 (30) | 48 (42) | 0,026 |
| Edad (años) | 57 [48-65] | 55 [47-63,75] | 61 [51,75-67] | 0,001 |
| IMC | 27,4±3,83 | 27,3±3,82 | 27,5±3,87 | 0,599 |
| ASC (m2) | 1,93 [1,80-2,05] | 1,92 [1,81-2,05] | 1,94 [1,79-2,07] | 0,814 |
| Comorbilidades | ||||
| Hipertensión | 166 (47) | 110 (47) | 56 (49) | 0,659 |
| Diabetes mellitus | 41 (12) | 23 (10) | 18 (16) | 0,099 |
| Dislipemia | 153 (44) | 99 (42) | 54 (47) | 0,338 |
| Tabaquismo activo | 40 (12) | 27 (12) | 13 (12) | 0,994 |
| Insuficiencia cardiaca | 15 (6) | 10 (6) | 5 (7) | >0,9 |
| Enfermedad cerebrovascular | 6 (2) | 3 (1) | 3 (3) | 0,394 |
| Disfunción tiroidea | 66 (19) | 36 (15) | 30 (26) | 0,013 |
| Enfermedad renal crónica | 34 (10) | 22 (9) | 12 (11) | 0,721 |
| Apnea obstructiva del sueño | 35 (10) | 26 (11) | 9 (8) | 0,362 |
| Neumopatía | 13 (4) | 9 (4) | 4 (4) | >0,9 |
| FA persistente | 75 (21) | 36 (15) | 39 (34) | <0,001 |
| Duración de la FA (años) | 3 [1-6] | 2 [1-5] | 3 [2-6,5] | 0,031 |
| CHA2DS2-VASc | 0,043 | |||
| 0 | 98 (28) | 74 (32) | 24 (22) | |
| 1 | 118 (34) | 80 (34) | 38 (34) | |
| 2 | 79 (23) | 55 (24) | 24 (22) | |
| >2 | 50 (15) | 25 (11) | 25 (23) | |
| Cardioversión previa | 119 (36) | 72 (32) | 47 (44) | 0,042 |
| Aislamiento previo de las venas pulmonares | 41 (12) | 24 (10) | 17 (15) | 0,196 |
| Anticoagulación | 214 (65) | 139 (61) | 75 (73) | 0,041 |
| Antiarrítmicos | 169 (59) | 113 (57) | 56 (62) | 0,474 |
| Bloqueadores beta | 214 (61) | 137 (58) | 77 (68) | 0,088 |
| Parámetros ecocardiográficos | ||||
| Volumen de la AI (ml/m2) | 35 [30-40] | 33 [30-39] | 37 [30-42] | 0,001 |
| Diámetro de la AI (mm) | 40 [36-43] | 39 [36-42] | 41 [37-45] | 0,001 |
| Dilatación de la AI | 194 (60) | 121 (55) | 73 (72) | 0,005 |
| FEVI (%) | 60±4,6 | 60±4,6 | 60±4,5 | 0,829 |
| Características de la intervención | ||||
| Energía de la ablación: radiofrecuencia | 254 (73) | 169 (72) | 85 (75) | 0,562 |
| Seguimiento | ||||
| Recurrencia precoz | 43 (13) | 9 (4) | 34 (30) | <0,001 |
| Mortalidad | 1 (0,3) | 0 | 1 (0,9) | 0,326 |
AI: aurícula izquierda; ASC: área de superficie corporal; FA: fibrilación auricular; IMC: índice de masa corporal; FEVI: fracción de eyección del ventrículo izquierdo.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Durante el seguimiento, 43 pacientes (13%) presentaron recurrencia de la FA durante los primeros 3 meses. Después del periodo de recalibración de 3 meses, 114 pacientes (33%) presentaron recurrencia de la FA con una mediana de seguimiento de 34 meses dentro del intervalo de 12 a 57 meses. En comparación con aquellos sin recurrencia, los pacientes con recurrencia de la FA eran mayores, con más frecuencia mujeres y tenían significativamente más disfunción tiroidea, FA persistente, mayor duración de la enfermedad y mayor volumen de la AI (tabla 1).
Relación entre el volumen de TAE y la recurrencia de la FALos pacientes con un VTAE ≥ 80ml tuvieron mayor riesgo de recurrencia de la FA que los pacientes con menos VTAE (log-rank test, p=0,007), como se muestra en las curvas de Kaplan-Meier (figura 2A). Además, en la regresión de riesgos proporcionales de Cox univariante, los pacientes con VTAE ≥ 80ml tenían mayor riesgo de recurrencias (HR = 1,65; IC95%, 1,14-2,39; p=0,007), como se detalla en la tabla 2. Sin embargo, después del ajuste multivariante (edad, sexo, hipertensión, diabetes, obesidad, subtipo de FA y AI dilatada), el VTAE ≥ 80ml dejó de ser un predictor independiente de recurrencia de la FA (HR = 1,24; IC95%, 0,83-1,87; p=0,3).
Curvas de Kaplan-Meier de la supervivencia libre de recurrencias de la FA en pacientes con VTAE estratificado a 80ml (A), VTAP estratificado a 150ml (B) y atenuación del TAE posterior a la AI estratificado a –75 UH (C). El eje de tiempo comienza después del periodo de recalibración (el tiempo 0 corresponde a 3 meses después de la intervención). AI: aurícula izquierda; FA: fibrilación auricular; VTAE: volumen de tejido adiposo epicárdico; VTAP: volumen de tejido adiposo pericárdico.
Regresión de Cox univariante y multivariante de las mediciones de tejido adiposo como variable dicotómica y como valor continuo indexado a la ASC de recurrencia de FA
| Medición del tejido adiposo | N.o de eventos/n.o en riesgo | Modelo univariante | N.o de eventos/n.o en riesgo | Modelo multivariante* | ||
|---|---|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | |||
| VTAE ≥ 80 ml | 114/350 | 1,65 (1,14-2,39) | 0,007 | 102/317 | 1,24 (0,83-1,87) | 0,3 |
| VTAEI | 90/280 | 1,02 (1,01-1,03) | 0,001 | 86/267 | 1,01 (0,99-1,02) | 0,4 |
| VTAP ≥ 150 ml | 114/350 | 1,55 (1,07-2,24) | 0,019 | 102/317 | 1,10 (0,71-1,69) | 0,17 |
| VTAPI | 90/280 | 1,01 (1,00-1,01) | 0,004 | 86/267 | 1,00 (1,00-1,01) | 0,6 |
| Atenuación del TAE posterior a la AI <–75 UH | 111/338 | 1,06 (0,73-1,56) | 0,7 | |||
AI: aurícula izquierda; FA: fibrilación auricular; HR: hazard ratio; IC95%: intervalo de confianza del 95%; VTAE: volumen de tejido adiposo epicárdico; VTAEI: volumen de tejido adiposo epicárdico indexado al área de superficie corporal; VTAP: volumen de tejido adiposo pericárdico; VTAPI: volumen de tejido adiposo pericárdico indexado al área de superficie corporal.
También se evaluó la asociación entre VTAE y la recurrencia total de FA, incluido el periodo de recalibración. En este análisis, los pacientes con VTAE ≥ 80ml también tuvieron mayor riesgo de recurrencia total (HR = 1,59; IC95%, 1,12-2,27; p=0,01), pero después del ajuste multivariante el VTAE ≥ 80ml no se mantuvo como predictor independiente (HR = 1,17; IC95%, 0,79-1,73; p=0,4) (se detalla en la ).
Se observaron resultados similares después de indexar el VTAE a la superficie corporal total (tabla 2 y ).
Relación entre el volumen de TAE y la recurrencia de FASe encontró que los pacientes con VTAP ≥ 150ml tenían mayor riesgo de recurrencia de la FA que los pacientes con VTAP inferior (prueba de rangos logarítmicos, p=0,018), como se muestra en las curvas de Kaplan-Meier (figura 2B). Esta tendencia se observó en el modelo de riesgos proporcionales de Cox, que mostró que los pacientes con VTAP ≥ 150ml tenían mayor riesgo de recurrencia (HR = 1,55; IC95%, 1,07-2,24; p=0,019) (tabla 2). Después del ajuste multivariante, el VTAP dejó de ser un predictor independiente de recurrencia de la FA (HR = 1,10; IC95%, 0,71-1,69; p=0,17).
En el análisis de recurrencia total, los pacientes con VTAP ≥ 150ml tenían mayor riesgo de recurrencia total (HR = 1,51; IC95%, 1,06-2,15; p=0,023), pero después del ajuste multivariante, el VTAP ≥ 150ml no se mantuvo como predictor independiente (HR = 1,03; IC95%, 0,68-1,55; p=0,013) ().
Se observaron resultados parecidos tras indexar el VTAP a la superficie corporal total (tabla 2 y ).
Asociación entre la atenuación del TAE posterior a la AI y recurrencia de FANo fue posible evaluar la atenuación del TAE posterior a la AI de 12 pacientes (de 350), ya que no había tejido en el intervalo de –150 a –50 UH entre la AI y el esófago.
No se observó ninguna diferencia significativa en la recurrencia de la FA entre pacientes con atenuación del TAE posterior a la AI por encima o por debajo de –75 UH (figura 2C) (prueba de rangos logarítmicos, p=0,75). Lo mismo se observó en la regresión de riesgos proporcionales de Cox univariante (tabla 2) (HR = 1,06; IC95%, 0,73-1,56; p=0,7).
Asociación entre el volumen de TAE y la recurrencia de FA según el subtipo de FAEn todos los modelos multivariantes de riesgos proporcionales de Cox, la FA persistente se identificó como el único predictor independiente de recurrencia de la FA (); todas las HR oscilaron entre 1,89 y 2,19, con p < 0,011. Dado que el subtipo de FA podría haber influido en nuestros resultados, se realizó otro subanálisis para evaluar el efecto del subtipo de FA en el objetivo primario. En pacientes con FA paroxística, el VTAE ≥ 80ml se asoció con mayor riesgo de recurrencia, pero no después de ajustar por otras covariables (HR = 1,31; IC95%, 0,79-2,16; p=0,3) (). En los pacientes con FA persistente, no se encontró asociación entre el VTAE ≥ 80ml y la recurrencia de la FA (HR = 0,92; IC95%, 0,48-1,75; p=0,8).
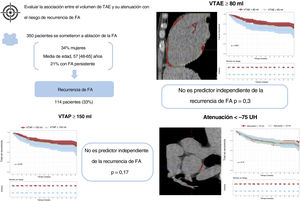
DISCUSIÓNEste es el estudio más amplio que haya evaluado la relación entre varios parámetros del TAE y la recurrencia de la FA después de la ablación con catéter. Se encontró que los pacientes con un VTAE ≥ 80ml tenían mayor riesgo de recurrencia de la FA. Los análisis de subgrupos según el subtipo de FA indican que esta asociación solo se observa en pacientes con FA paroxística. Sin embargo, después del ajuste multivariante, el VTAE no fue un predictor independiente de la recurrencia de la FA, lo que indica que esta asociación comunicada anteriormente se originó por factores de confusión. Además, el patrón de atenuación del TAE posterior a la AI (que podría ser un marcador de inflamación del TAE) no se asoció con la recurrencia de la FA en ningún análisis (figura 3).
Figura central. Asociación entre los parámetros de TAE y el riesgo de recurrencia de la FA. De 350 pacientes incluidos, 114 sufrieron recurrencias de la FA. Los pacientes con un VTAE ≥ 80ml tuvieron mayor riesgo de recurrencia de la FA; sin embargo, después del ajuste multivariante, el VTAE no fue un predictor independiente (HR = 1,24; IC95%, 0,83-1,87; p=0,3). El patrón de atenuación del TAE posterior a la AI no se asoció con la recurrencia de la FA. AI: aurícula izquierda; HR: Hazard ratio; IC95%: intervalo de confianza del 95%; FA: fibrilación auricular; TAE: tejido adiposo epicárdico; VTAE: volumen de tejido adiposo epicárdico; VTAP: volumen de tejido adiposo pericárdico.
Varios estudios han demostrado que la obesidad (evaluada por el índice de masa corporal) es un factor independiente de riesgo de FA2. Sin embargo, se sabe que el índice de masa corporal es una forma inexacta de evaluar la existencia de exceso de adiposidad4 y que la distribución heterogénea del tejido adiposo explica en gran medida los diversos riesgos cardiometabólicos observados en individuos con grados similares de adiposidad general3, debido a la característica actividad metabólica y los mediadores proinflamatorios secretados por varios depósitos de grasa24. Estudios previos han demostrado que el TAE, una forma de tejido adiposo visceral, se correlaciona con factores de riesgo de enfermedad cardiovascular25, con mayor riesgo de carga ateroesclerótica coronaria5,6 e insuficiencia cardiaca con fracción de eyección conservada9. Además, también se sabe que el TAE puede inducir remodelado cardiaco, que se relaciona con dilatación de la AI, hipertrofia del ventrículo izquierdo y disfunción diastólica7,8.
Varios mecanismos fisiopatológicos podrían contribuir a la asociación posterior entre el TAE y la FA. En primer lugar, se sabe que el TAE es una fuente local de varias adipocinas proinflamatorias (como la interleucina 1β y el factor de necrosis tumoral alfa), que pueden tener un efecto paracrino en el miocardio y los vasos cardiacos3,4,26. Además, la inflamación puede promover la fibrosis auricular y la aparición de FA26. El efecto del TAE se ve facilitado por su proximidad a las estructuras cardiacas, la ausencia de barreras fasciales entre la grasa y el miocardio y por su suministro de sangre compartido3,4,26. Además, la inflamación también podría afectar a la ablación, ya que el edema podría obstaculizar la formación adecuada de lesiones de ablación27. En segundo lugar, varios estudios anatomopatológicos han demostrado que el TAE puede infiltrarse en el miocardio y producir circuitos de microentrada, que posiblemente contribuyan al inicio de la FA3,26. Por último, la disfunción autonómica también puede estar implicada, ya que el plexo ganglionar se encuentra en la grasa epicárdica y su activación inflamatoria puede causar un acortamiento de los potenciales de acción4,28.
Aunque el TAE se asoció con la recurrencia de FA en el análisis univariante, en nuestro estudio el TAE no fue un predictor independiente de este resultado, lo que apunta a la contribución de los factores de confusión. Un modelo de regresión de Cox que incluye el TAE más cada una de las variables utilizadas para el ajuste mostró que la dilatación de la AI tuvo el mayor impacto. También se evaluaron otros parámetros del TAE, como el VTAP, que muestran resultados similares. El primer estudio que comunicó una posible asociación entre VTAE y recurrencia de la FA mostró que un gran VTAE se asocia con recurrencia de la FA después de la ablación (239,0 ± 90,2 frente a 153,5 ± 42,7ml; p=0,0002). Sin embargo, no hubo supervivencia sin recurrencias ni se realizó ningún análisis multivariante para evaluar si este era un predictor independiente29. Existen otros estudios que respaldan30,31 o contradicen32,33 estos resultados sobre el VTAE. Nakatani et al.30 no encontraron asociación entre el VTAE y las recurrencias de la FA, pero evaluaron a una población muy pequeña (n=44). Maeda et al.32 mostraron que, en 218 pacientes japoneses, el VTAE indexado a la superficie corporal fue un predictor de recurrencia de FA independientemente de otros factores de riesgo (HR = 1,02; IC95%, 1,00-1,03; p=0,012). La discordancia entre nuestro estudio y el de Maeda et al.32 podría explicarse por diferencias raciales, ya que los asiáticos tienen más morbilidad cardiovascular con menos adiposidad general y los estudios han demostrado que las estimaciones del efecto del TAE son más fuertes en estas poblaciones que en las de Norteamérica o Europa3. Además, en nuestro modelo de ajuste multivariante se incluyeron predictores de recurrencia de la FA clínicamente relevantes, mientras que Maeda et al.32 solo ajustaron las variables que en el análisis univariante obtuvieron p <0,10.
Relación entre el TAE y recurrencia de la FA según el subtipo de FA (FA paroxística frente a FA persistente)Nuestro estudio indica que el VTAE tiene mayor impacto en la recurrencia de la FA en pacientes con FA paroxística que en aquellos con FA persistente. La FA persistente se asocia con una remodelación más estructural y eléctrica, lo que puede imponer un mayor riesgo de recurrencia34. Es posible que en los casos de FA paroxística los mecanismos proarritmogénicos del VTAE influyan en el riesgo de recurrencia de la FA, aunque esta asociación podría estar mediada por factores de confusión.
Impacto de varios parámetros del TAE y riesgo de recurrencia de la FAEn teoría, se puede considerar que el volumen del TAE es el parámetro más fiable para medir la grasa epicárdica4. Sin embargo, se optó por evaluar también el efecto de otros parámetros (como el VTAP y la atenuación del TAE posterior a la AI, como se detalla en la figura 1) en la recurrencia de la FA. Se sabe que, mientras que el TAE está dentro del pericardio, el TAP corresponde a toda la grasa dentro y fuera del pericardio. La medición del TAP no requiere identificar el pericardio, lo que permite una evaluación más rápida y no requiere una excelente calidad de imagen4, lo que puede contribuir a una implementación clínica más fácil. Se encontró que las estimaciones del efecto eran más pequeñas que el VTAE, en consonancia con estudios previos3, ya que la proximidad anatómica al miocardio facilita los mecanismos fisiopatológicos en la arritmogénesis.
Dado que la inflamación del TAE podría participar en la recurrencia de la FA y la calidad del tejido adiposo, más que la cantidad, puede ser un predictor más relevante de la recurrencia de la FA, también se recopilaron datos sobre la medición de la atenuación del TAE posterior a la AI. Se sabe que la inflamación desplaza la atenuación del tejido adiposo hacia un valor más positivo17. Estudios previos han asociado la atenuación del TAE con lesiones coronarias culpables en el síndrome coronario agudo y la mortalidad cardiaca15. Ciuffo et al.16 encontraron que el aumento de la atenuación del tejido adiposo periauricular medida a partir de un solo corte de TC fue un predictor de recurrencia de la FA, mientras que otro estudio17 mostró que tras el ajuste el aumento de la atenuación del tejido adiposo posterior a la AI por evaluación volumétrica no era predictor (HR = 1,26; IC95%, 0,90-1,76; p=0,181). En este estudio no se encontró ninguna asociación entre este parámetro y el riesgo de recurrencia de la FA. Por lo tanto, nuestros datos respaldan que la atenuación del tejido adiposo posterior a la AI no es útil en este entorno, aunque el grosor y las características del TAE pueden variar entre las diferentes regiones miocárdicas.
Puntos fuertes y limitacionesHasta donde sabemos, este es uno de los estudios más detallados sobre la asociación entre la recurrencia de la FA y varias mediciones del tejido adiposo cardiaco e incluye un seguimiento a largo plazo. El TAE se evaluó principalmente calculando el VTAE, que requiere un seguimiento manual individual y detallado del pericardio de cada paciente. El coeficiente de correlación intraclase de esta medición fue excelente. En el análisis multivariante, se ajustó por varios factores de riesgo clínico importantes implicados en la recurrencia de la FA para atenuar la confusión.
Hay algunas limitaciones que deben abordarse. En primer lugar, el seguimiento del paciente no incluyó seguimiento eléctrico continuo mediante registradores de eventos o bucles, por lo que este estudio no pudo evaluar la recurrencia subclínica de la FA o la carga de FA. En segundo lugar, este estudio excluyó a los pacientes con coronariopatía y valvulopatía; en consecuencia, las conclusiones no pueden extrapolarse a esas poblaciones. En tercer lugar, no se evaluó si el perímetro abdominal, el cociente cintura/cadera o los parámetros de la grasa abdominal derivados de la TC podrían haber aportado más información sobre los efectos de la adiposidad local frente a la general3,7.
CONCLUSIONESLos parámetros del TAE, como la evaluación del volumen del TAE, el volumen del TAP y la atenuación del TAE, no son predictores independientes de la recurrencia de la FA después de la ablación con catéter.
FINANCIACIÓNEste estudio fue financiado por: a) fondos nacionales a través de la FCT Fundação para a Ciência e Tecnologia, I.P., en el ámbito del Centro de I + D Cardiovascular-UnIC (UIDB/00051/2020 y UIDP/00051/2020), y b) Fondo Europeo de Desarrollo Regional (FEDER), a través del Programa Operativo Regional Norte en el marco del proyecto HEALTH-UNORTE: establecimiento de biobancos y estrategias de medicina regenerativa para impulsar la investigación en enfermedades cardiovasculares, musculoesqueléticas, neurológicas, oncológicas, inmunológicas e infecciosas (NORTE-01-0145-FEDER-000039).
El patrocinador no participó en el diseño del estudio, la recopilación de datos, el análisis o la interpretación de los resultados, la redacción del original o la decisión de publicar el artículo.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores cumplen los siguientes 4 criterios: a) contribuyeron sustancialmente a la concepción y el diseño, la obtención de datos o su análisis e interpretación; b) redactaron el artículo o realizaron una revisión crítica de este; c) dieron la aprobación final a la versión que se publicará, y d) acordaron asumir la responsabilidad de la exactitud y la integridad del original. I. Cruz y S. Lopes Fernandes contribuyeron por igual a este artículo.
CONFLICTO DE INTERESESLos autores declaran no tener ningún tipo de conflicto de intereses.
- –
La obesidad es un conocido factor de riesgo de aparición de FA. Sin embargo, el índice de masa corporal es una forma inexacta de evaluar el exceso de adiposidad.
- –
Estudios previos han demostrado que el TAE, una forma de grasa visceral, se correlaciona con enfermedades cardiovasculares.
- –
Pocos grandes estudios han evaluado la influencia del TAE en el riesgo de recurrencia de la FA y se han centrado solo en un método para cuantificar el TAE.
- –
Este es uno de los estudios más grandes y detallados que investigan la asociación entre la recurrencia de la FA y varias mediciones de tejido adiposo cardiaco.
- –
Tanto el VTAE como el VTAP se asociaron con recurrencia de la FA en el análisis univariante; sin embargo, no se mantuvieron como predictores independientes tras ajustar por otros factores de riesgo clínico.
- –
El patrón de atenuación del TAE posterior a la AI (un posible biomarcador de inflamación local) no se asoció con la recurrencia de FA.