A pesar de que reducir las cifras de colesterol con el tratamiento hipolipemiante se asocia con una marcada reducción de las complicaciones cardiovasculares, un porcentaje importante de pacientes conhipercolesterolemia no logra los objetivos de control recomendados, independientemente de su riesgo cardiovascular. Aunque esto se debe en parte a una insuficiente intensificación del tratamiento hipolipemiante, con escasa prescripción del tratamiento combinado, también son necesarios nuevos fármacos que ayuden a lograr estos objetivos. El ácido bempedoico es un nuevo tratamiento hipolipemiante oral, el primero de su clase, que disminuye la concentración de colesterol inhibiendo la enzima adenosina trifosfato-citrato liasa, que dentro de la cadena de la síntesis de colesterol está antes de donde actúan las estatinas. Es destacable que el ácido bempedoico no se activa en el músculo esquelético, lo que reduce el riesgo de efectos secundarios musculares. Un programa amplio de ensayos clínicos ha demostrado su eficacia para reducir el colesterol, en monoterapia o combinado con otros tratamientos hipolipemiantes, con un buen perfil de seguridad. En el presente documento se proponen algoritmos de abordaje sencillos y fácilmente aplicables, para posicionar cuáles serían los candidatos potenciales que más se beneficiarían del tratamiento con ácido bempedoico, en función del riesgo cardiovascular, el tratamiento hipolipemiante previo y los valores de colesterol unido a lipoproteínas de baja densidad, con el fin de que la mayoría de los pacientes alcancen precozmente los objetivos de control.
Palabras clave
El aumento del colesterol unido a lipoproteínas de baja densidad (cLDL) y, en general, de las lipoproteínas que contienen apolipoproteína B se asocia con un aumento muy marcado del riesgo cardiovascular (CV)1,2. De hecho, constituyen la base para el desarrollo de la enfermedad CV ateroesclerótica3.
La reducción del cLDL mediante el tratamiento hipolipemiante, tanto en prevención primaria como secundaria, se asocia con una disminución de las complicaciones CV4. En efecto, la mortalidad ajustada por edad de los pacientes con cardiopatía isquémica ha disminuido en los últimos años, en parte por un mejor control del perfil lipídico5. Además, en términos relativos, este beneficio ocurriría en todas las edades, desde los más jóvenes hasta la población más anciana6. Asimismo, es importante resaltar que el beneficio de cualquier tratamiento hipolipemiante, farmacológico y no farmacológico, depende principalmente de su capacidad para reducir el cLDL, de tal forma que, a mayor reducción, mayor beneficio7.
Por desgracia, a pesar de los tratamientos hipolipemiantes tradicionalmente empleados para el paciente con dislipemia (dieta, estatinas, ezetimiba, inhibidores de PCSK9), las cifras actuales de control del cLDL siguen siendo muy pobres. Así, en un reciente estudio llevado a cabo en 6.364 pacientes provenientes de 20 servicios de cardiología de hospitales secundarios o terciarios de España, aproximadamente el 60% de los pacientes lograron un cLDL < 70 mg/dl (el objetivo vigente en el momento de realizarse el estudio) a los 12 meses de un síndrome coronario agudo. Esto se debió en gran medida a una insuficiente intensificación del tratamiento hipolipemiante durante ese periodo, ya que aproximadamente el 75% tomaba estatinas de alta potencia (el 15%, estatinas de potencia intermedia); el 25%, ezetimiba y menos del 1%, inhibidores de PCSK98. El estudio DA VINCI, que incluyó a 5.888 pacientes (3.000 en prevención secundaria y 2.888 en prevención primaria) de 18 países europeos, mostró que la mayoría de los pacientes no lograron los objetivos de control de cLDL9. En consecuencia, estos resultados muestran que en la práctica clínica no se intensifica lo suficiente el tratamiento hipolipemiante. De hecho, el proyecto Cardio Right Care Control mostró que en España, ante un paciente con insuficiente control del cLDL, en cerca del 60% de los casos se aumenta la dosis o se cambia de estatina, pero solo en el 23% se combina una estatina y ezetimiba y en el 18% se añadían otros fármacos hipolipemiantes10. Por otro lado, el estudio DA VINCI mostró que, en prevención secundaria, incluso de los pacientes que tomaban inhibidores de PCSK9, solo el 58% alcanzó un cLDL < 55 mg/dl9. Es decir, que además de intensificar el tratamiento hipolipemiante mediante la combinación de fármacos, es necesario disponer de nuevas alternativas terapéuticas que ayuden a mejorar el control del cLDL del paciente con dislipemia. En este sentido, el ácido bempedoico ha venido a completar el arsenal terapéutico hipolipemiante actualmente disponible.
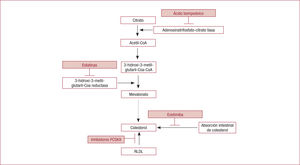
Ácido bempedoico, mecanismo de acción y propiedades farmacocinéticasEl ácido bempedoico es un nuevo tratamiento hipolipemiante oral, el primero de su clase, que disminuye el colesterol intracelular al inhibir la enzima adenosina trifosfato-citrato liasa, que se encuentra dentro de la cadena de la síntesis de colesterol (figura 1)11-13. El ácido bempedoico es un profármaco que requiere activación por la enzima acil-CoA sintetasa 1 de cadena larga, que se encuentra en el hígado pero no en el músculo esquelético, lo que justificaría un menor riesgo de posibles efectos adversos musculares con este fármaco. La inhibición de la síntesis intracelular de colesterol produce una regulación al alza de los receptores de LDL y reduce las concentraciones de cLDL en sangre. Además, también disminuye la síntesis de los ácidos grasos hepáticos13. Actualmente, el ácido bempedoico está indicado para adultos con hipercolesterolemia primaria (familiar y no familiar heterocigótica) o dislipemia mixta, como adyuvante a la dieta, combinado o no con otros tratamientos hipolipemiantes, según los casos13.
Tras la administración oral (180 mg 1 vez al día), el ácido bempedoico se absorbe rápidamente y alcanza la concentración plasmática máxima a las 3,5 h. Aunque la biodisponibilidad del ácido bempedoico no se afecta por los alimentos, estos retrasan su absorción. En consecuencia, el ácido bempedoico se puede tomar con y sin alimentos. El volumen de distribución es de 18 l, la unión a proteínas plasmáticas es muy abundante (> 99%) y la vida media es de 21 h. La vía principal de eliminación del ácido bempedoico es su glucuronización. Tras la administración oral, aproximadamente el 70% de la dosis se presenta en la orina, principalmente como conjugado de acil glucurónido, y el 30% en las heces, y solo el 5% se excreta inalterado en la orina y las heces. La farmacocinética del ácido bempedoico no se altera por la edad, la raza, el sexo o el peso, por lo que no es necesario ajustar la dosis. Tampoco es necesario ajustar la dosis para pacientes con insuficiencia renal de leve a moderada (se dispone de pocos datos de pacientes con insuficiencia renal grave) ni en los pacientes con insuficiencia hepática leve o moderada (Child-Pugh A o B), si bien no se dispone de datos de pacientes con insuficiencia hepática grave (Child-Pugh C) (tabla 1)13,14.
Aspectos prácticos del tratamiento con ácido bempedoico
| Dosis | 180 mg (1 comprimido) al día |
|---|---|
| Alimentos | Se puede tomar con o sin alimentos |
| Ajuste de dosis | No es necesario ajustar según: • Edad, sexo, peso o raza • Función renal (faltan datos en caso de disfunción grave) • Función hepática (faltan datos en caso de disfunción grave) |
| Interacciones | Se puede combinar con estatinas, ezetimiba e inhibidores de PCSK9 (excepto simvastatina a dosis elevadas) |
| Contraindicaciones | Hipersensibilidad al principio activo o a alguno de los excipientes Embarazo Lactancia Toma concomitante de simvastatina > 40 mg/día |
| Precauciones | Interrumpa el tratamiento: • Si aparece hiperuricemia acompañada de síntomas de gota • Si persiste un aumento de las transaminasas > 3 veces el LSN |
LSN : límite superior de la normalidad.
Tabla elaborada con datos de la ficha técnica de Nilemdo13.
En cuanto al riesgo de interacciones, la administración de una dosis única de 40 mg de simvastatina con 180 mg de ácido bempedoico en estado estacionario aumenta la exposición de simvastatina hasta 2 veces, por lo que el empleo concomitante con simvastatina > 40 mg está contraindicado. En cambio, las elevaciones de las concentraciones con otras estatinas, como atorvastatina, pravastatina y rosuvastatina, son más discretas, de entre 1,4 y 1,5 veces en el área bajo la curva, por lo que no hace falta ajustar la dosis. Tampoco se considera clínicamente significativa la interacción con ezetimiba (incremento sobre el área bajo la curva < 20%) (tabla 1)13,14.
Desarrollo clínico del ácido bempedoicoEl desarrollo clínico del ácido bempedoico cuenta con numerosos ensayos clínicos que han demostrado su eficacia en el perfil lipídico y la seguridad solos o junto con otros tratamientos hipolipemiantes15. A continuación se resumen algunos de los estudios más relevantes.
Se han llevado a cabo ensayos clínicos en fase II en pacientes con diferentes perfiles (intolerancia a estatinas, en combinación con estatinas, ezetimiba o evolocumab, diabéticos o hipertensos, entre otros). Aunque estos estudios tuvieron corta duración, de algunas semanas, los resultados fueron bastante consistentes, con mejoras significativas del perfil lipídico en los diferentes perfiles de pacientes16-21.
En los últimos años se han publicado varios ensayos clínicos en fase III con el ácido bempedoico. El estudio CLEAR Harmony es un ensayo clínico en el que 2.230 pacientes con enfermedad CV ateroesclerótica, hipercolesterolemia familiar o ambas, cLDL > 70 mg/dl (cLDL basal, 103 mg/dl) a pesar de las dosis máximas toleradas de estatinas con o sin otros tratamientos hipolipemiantes recibieron ácido bempedoico (n = 1.488) o placebo (n = 742) durante 52 semanas. La incidencia de efectos adversos totales y graves fueron similares en ambos grupos de tratamiento, aunque la incidencia de efectos adversos que motivaran la interrupción del tratamiento fue mayor con el ácido bempedoico (el 10,9 frente al 7,1%; p = 0,005), así como la incidencia de gota (el 1,2 frente al 0,3%; p = 0,03). A las 12 semanas de tratamiento, el ácido bempedoico redujo el cLDL un 18% (p < 0,001) en comparación con el grupo de placebo22. En la fase abierta de extensión de este estudio (CLEAR Harmony OLE), los pacientes (970 del grupo de tratamiento activo y 492 del grupo de placebo del estudio CLEAR Harmony) recibieron ácido bempedoico durante 78 semanas, seguidas por un periodo de aclaramiento de 4 semanas. Aproximadamente el 96% tenía enfermedad CV ateroesclerótica y el 94% tomaba estatinas de moderada a alta intensidad. Al final del estudio, la mayoría de los pacientes (86%) completaron el seguimiento mostrando un perfil de seguridad parecido al del ensayo clinico de fase III23. El estudio CLEAR Wisdom incluyó a 779 pacientes (cLDL basal, 120 mg/dL; 522 tratados con ácido bempedoico y 257 con placebo durante 52 semanas) con enfermedad CV ateroesclerótica, hipercolesterolemia familiar heterocigota o ambos y cLDL > 70 mg/dl a pesar del tratamiento hipolipemiante máximo tolerado. A las 12 semanas, en comparación con placebo, el ácido bempedoico redujo un 17% el cLDL. También se observaron mejoras significativas del resto del perfil lipídico, así como de la proteína C reactiva ultrasensible24. El CLEAR Serenity incluyó a 345 pacientes con hipercolesterolemia (cLDL basal, 158 mg/ dl) e intolerancia a las estatinas (el 93% por síntomas musculares) que recibieron ácido bempedoico o placebo durante 24 semanas. A las 12 semanas, en comparación con el placebo, el ácido bempedoico redujo el cLDL un 21%. También se objetivaron mejoras significativas en el colesterol no unido a lipoproteínas de alta densidad (no HDL) (18%), el colesterol total (15%), la apolipoproteína B (15%) y la proteína C reactiva ultrasensible (24%). El ácido bempedoico se toleró bien25. El estudio CLEAR Tranquillity incluyó a 269 pacientes con intolerancia a las estatinas y cLDL > 100 mg/dl en tratamiento hipolipemiante. Tras un periodo inicial de 4 semanas de tratamiento con ezetimiba, se aleatorizó a los pacientes a ácido bempedoico o placebo durante 12 semanas. Al final del seguimiento, el ácido bempedoico redujo el cLDL un 28,5% más que el placebo. También se observaron mejoras significativas en colesterol no HDL (24%), colesterol total (18%), apolipoproteína B (19%) y proteína C reactiva ultrasensible (31%). Las tasas de eventos adversos, incluidos los musculares, y las interrupciones por efectos secundarios fueron similares en ambos grupos de tratamiento26. Esto es relevante, ya que el bajo riesgo de efectos secundarios musculares con el ácido bempedoico se podría asociar con una mayor adherencia al tratamiento a largo plazo.
En otro ensayo clínico de fase III llevado a cabo en 301 pacientes con hipercolesterolemia y alto riesgo CV debido a enfermedad CV ateroesclerótica, hipercolesterolemia familiar heterocigota o múltiples factores de riesgo CV (cLDL basal, 150 mg/dl) en tratamiento con la dosis máxima tolerada de estatinas, se aleatorizó a los pacientes a recibir una combinación fija de ácido bempedoico y ezetimiba, ácido bempedoico, ezetimiba o placebo añadidos al tratamiento con estatinas. Tras 12 semanas de tratamiento, la combinación fija redujo el cLDL un 38% en comparación con el placebo (p < 0,001 ), un 23% frente a ezetimiba y un 17% frente al ácido bempedoico en monoterapia. El perfil de seguridad de la combinación fue similar al de los otros 3 brazos de tratamiento27.
En un estudio farmacodinámico tomando los datos de 14 estudios clínicos de fases I-III, se reportó que combinar el ácido bempedoico con las dosis más bajas de estatinas lograría una reducción del cLDL similar a la obtenida cuadriplicando la dosis de la estatina. Así, si la reducción de cLDL con atorvastatina 80 mg es del 54%, se conseguiría un 54% con atorvastatina 20 mg + ácido bempedoico 180 mg, y del 42% con simvastatina 40 mg frente al 46% de simvastatina 10 mg + ácido bempedoico 180 mg28. En un análisis combinado de 13 ensayos clínicos (4.858 pacientes), se objetivó que la combinación de ácido bempedoico y estatina fue más eficaz que la estatina sola para reducir el cLDL (18%), y la combinación de ácido bempedoico y ezetimiba también fue más eficaz frente a ezetimiba sola (19%). Sin embargo, el efecto del ácido bempedoico en el cLDL depende de si se toman estatinas y de qué tipo. Así, si el paciente no tomaba estatinas, la reducción con ácido bempedoico era del 28,5%; si tomaba estatinas de baja o moderada intensidad, del 20%, y si tomaba estatinas de alta intensidad, del 17,6%29. En un análisis agrupado de 3.621 pacientes, tras 12 semanas de tratamiento, en el grupo de pacientes tratados con estatinas la disminución del cLDL fue del 21,2% en las mujeres y el 17,4% en los varones, mientras que en el grupo de pacientes intolerantes a las estatinas, fueron el 27,7 y el 22,1% respectivamente. Además, ambos grupos de pacientes y ambos sexos toleraron bien el ácido bempedoico30. En un análisis combinado de 4 ensayos clínicos de fase 3 sobre el ácido bempedoico (n = 2.425) frente a placebo (n = 1.198) en pacientes con hipercolesterolemia de alto riesgo CV (enfermedad CV ateroesclerótica o hipercolesterolemia familiar heterocigota) y tratamiento hipolipemiante estable o hipercolesterolemia con intolerancia a las estatinas tratados de 12 a 52 semanas, a las 12 semanas la reducción del cLDL fue del 18% en el primer grupo y el 24,5% en el segundo en comparación con placebo. Esta reducción se mantuvo a lo largo del seguimiento. Asimismo, las reducciones con ácido bempedoico fueron significativamente mayores respecto al colesterol no HDL, el colesterol total, la apolipoproteína B y la proteína Creactiva de alta sensibilidad. Con respecto a la seguridad, los eventos adversos relacionados con el tratamiento fueron más frecuentes con el ácido bempedoico; los más comunes fueron el aumento de ácido úrico (el 2,1 frente al 0,5%; p < 0,001 ), gota (el 1,4 frente al 0,4%; p = 0,008), disminución del filtrado glomerular (el 0,7 frente a < 0,1%; p = 0,02) y aumento de las enzimas hepáticas (el 2,8 frente al 1,3%; p = 0,004). Sin embargo, los efectos adversos totales, los efectos adversos graves, los efectos adversos musculares y los aumentos importantes de las transaminasas ocurrieron de manera similar en ambos grupos. Además, hubo menos casos de diabetes o empeoramiento de diabetes con el ácido bempedoico (el 4,0 frente al 5,6%; p = 0,03)31. Recientemente se ha publicado un estudio en fase II en el que se objetivó que el ácido bempedoico añadido al tratamiento de base con inhibidores de PCSK9 proporcionaría reducciones adicionales del cLDL, de hasta el 30%, sin aumentar el riesgo de efectos adversos32.
En definitiva, y considerando todos estos datos en conjunto, la reducción de cLDL con el ácido bempedoico estaría en torno a un 15-29% de media, en función de su combinación con estatinas; con la combinación del ácido bempedoico con ezetimiba, alrededor del 38%27,29,33. Tomando como base la tabla propuesta por la guía europea de dislipemia de 2019 y de prevención CV de 2021 sobre la eficacia relativa de los diferentes tratamientos hipolipemiantes para reducir el cLDL1’2, se completa añadiendo la eficacia relativa del ácido bempedoico solo o en combinación (tabla 2)1,2,27,29,33.
Reducción media del cLDL con diferentes tratamientos hipolipemiantes, solos o en combinación
| Tratamiento | Reducción del cLDL, % |
|---|---|
| Ezetimiba | 20 |
| Ácido bempedoico | 25 |
| Estatina de moderada intensidad | 30 |
| Ezetimiba + ácido bempedoico | 38 |
| Estatina de moderada intensidad + ácido bempedoico | 50 |
| Estatina de alta intensidad | 50 |
| Inhibidores de PCSK9 | 60 |
| Estatinas de moderada intensidad + ezetimiba + ácido bempedoico | 64 |
| Estatina de alta intensidad + ácido bempedoico | 65 |
| Estatina de alta intensidad + ezetimiba | 65 |
| Estatina de alta intensidad + ezetimiba + ácido bempedoico | 72 |
| Estatina de alta intensidad + inhibidores de PCSK9 | 75 |
| Estatina alta intensidad + ezetimiba + inhibidores de PCSK9 | 85 |
Con respecto a los efectos del ácido bempedoico en los eventos CV, actualmente está en marcha el estudio CLEAR Outcomes. En él se ha incluido a más de 14.000 pacientes con enfermedad CV ateroesclerótica establecida o alto riesgo de sufrirla, intolerancia a estatinas documentada y cLDL > 100 mg/dl en tratamiento hipolipemiante máximo tolerado. Se ha aleatorizado a los pacientes a ácido bempedoico 180 mg/día o placebo añadidos al tratamiento recomendado por las guías de práctica clmíca. La variable primaria del estudio es el tiempo hasta un primer infarto de miocardio no mortal, ictus no mortal, muerte CV o revascularización coronaria. Se estima una mediana de exposición al tratamiento de 42 meses34. Sin embargo, aunque la evidencia acerca del impacto real del ácido bempedoico la aparición de la enfermedad CV ateroesclerótica provendrá de los resultados del estudio CLEAR Outcomes, varios trabajos han analizado los efectos del ácido bempedoico en los eventos CV como objetivos secundarios de varios ensayos clínicos. Los estudios de aleatorización mendeliana indican que la reducción del colesterol que implica la reducción de la actividad de la ATP citrato liasa se acompaña de un descenso en la tasa de eventos superponible al observado con otros tratamientos hipolipemiantes35,36.
Candidatos potenciales al ácido bempedoico en la práctica clínicaA pesar de las recomendaciones de las guías de práctica clínica1, lo cierto es que un porcentaje importante de pacientes no logra los objetivos de control del cLDL, principalmente por la insuficiente prescripción de los tratamientos hipolipemiantes disponibles8,9,37. Tradicionalmente, las guías proponen un abordaje de tratamiento vertical, en el que se van añadiendo fármacos de manera progresiva si no se logran los objetivos de control1. El problema de este planteamiento es que puede retrasar la consecución de estos objetivos, máxime en situaciones de dificultad de acceso al sistema sanitario, como ha ocurrido durante la pandemia por COVID-1938. Por otra parte, teniendo en cuenta que se conoce la capacidad de cada tratamiento hipolipemiante para reducir el cLDL1,2,27,33, se puede estimar de manera sencilla el tratamiento que necesita cada paciente en función de su cLDL y los objetivos de control que necesita. En ocasiones, con monoterapia será suficiente, pero en otras será necesario un tratamiento hipolipemiante combinado de inicio. Además, habrá que hacer otras consideraciones a la hora de ajustar la medicación, como la intolerancia a las estatinas, comorbilidades específicas o posibles interacciones farmacológicas. En este contexto, se han publicado diferentes consensos, tanto internacionales39,40 como de la Sociedad Española de Cardiología41,42, con el objetivo de ajustar el tratamiento hipolipemiante a lo que necesita cada paciente en función de su riesgo cardiovascular, el tratamiento hipolipemiante previo y las cifras de cLDL, y de esta forma conseguir los objetivos de control de una manera más sencilla y precoz para obtener el máximo beneficio posible del tratamiento hipolipemiante43,44. De hecho, ya hay evidencia de que la aplicación de dichos algoritmos se asocia con un mejor control lipídico45,46.
Con el mismo objetivo de facilitar el abordaje del paciente con dislipemia y considerando que ha aumentado el arsenal terapéutico disponible con la introducción del ácido bempedoico, hemos desarrollado 2 algoritmos para posicionar cuáles serían los candidatos potenciales que más se beneficiarían del tratamiento con ácido bempedoico en función de su riesgo CV, el tratamiento hipolipemiante previo y el cLDL (figuras 2 y 3). Son de sencilla aplicación y se ha tenido en cuenta la capacidad de cada tratamiento hipolipemiante solo o en combinación para reducir el cLDL (tabla 2).
Pacientes con hipercolesterolemia de muy alto riesgo CV, candidates a la toma de ácido bempedoicob. cLDL: colesterol unido a lipoproteías de baja densidad; CV: cardiovascular; iPCSK9: inhibidores de PCSK9. Se recomienda el empleo de combinaciones fijas frente a la toma de comprimidos por separado, para mejorar la adherencia al tratamiento. Figura de elaboración propia.
*Para los pacientes con riesgo CV extremo (en el primer año tras síndrome coronario agudo + antecedentes de otro evento vascular, enfermedad arterial periférica, enfermedad polivascular, enfermedad coronaria multivaso o hipercolesterolemia familiar), se considera un objetivo de cLDL más estricto y prescripción precoz de iPCSK9.
De acuerdo con las restricciones de uso de iPCSK9 del Informe de Posicionamiento Terapéutico (IPT) de la Agencia Española del Medicamento47.
Pacientes con hipercolesterolemia en riesgo CV bajo, moderado o alto candidatos para el ácido bempedoico. cLDL: colesterol unido a lipoproteínas de baja densidad; CV: cardiovascular; HF: hipercolesterolemia familiar; iPCSK9: inhibidores de PCSK9. Figura de elaboración propia. Se recomienda el empleo de combinaciones fijas frente a la toma de comprimidos por separado, para mejorar la adherencia al tratamiento.
*Insistir antes en cambios estilo de vida, salvo valores de cLDL basales muy elevados, que iniciar el tratamiento farmacológico directamente.
Sin embargo, además de optimizar el tratamiento farmacológico con todas las herramientas disponibles y los algoritmos propuestos, hay estrategias que van a mejorar globalmente el control lipídico y son imprescindibles. Así, el control lipídico siempre debe abordarse de una manera integral. Hay que promover en todos los pacientes la dieta mediterránea, el ejercicio físico y el control de los demás factores de riesgo CV. El ejercicio en sí mejora mucho los síntomas musculares que puedan asociarse con los tratamientos hipolipemiantes1,2. Para los pacientes en prevención secundaria, integrar al mayor número de pacientes en los programas de rehabilitación cardiaca tiene la máxima evidencia sobre el mejor control lipídico farmacológico y no farmacológico y del riesgo CV en general48. También es más necesario que nunca articular protocolos de continuidad asistencial, fomentar los programas de enfermería, incentivar la adherencia terapéutica y unificar informes al alta donde figuren claramente los objetivos de tratamiento y un cronograma de próximos controles lipídicos49. Asimismo, la telemedicina, que se ha implementado en la práctica clínica, es de enorme utilidad también en el control lipídico del paciente50.
ConclusionesConseguir los objetivos de cLDL es imprescindible para mejorar el pronóstico de los pacientes con dislipemia. Además, cuanto antes se consiga este control, el beneficio va a ser mayor. Sin embargo, las cifras actuales de control son bastante pobres, tanto en prevención primaria como en secundaria. Esto se debe, por una parte, a una intensificación insuficiente del tratamiento hipolipemiante, con escasa prescripción de tratamientos combinados, y por otra que, pese a los tratamientos hipolipemiantes tradicionalmente disponibles, para un porcentaje de pacientes significativo no basta. El ácido bempedoico es un nuevo fármaco hipolipemiante, el primero en su clase, del que se ha demostrado que reduce eficazmente el cLDL de una manera segura (bajo riesgo de efectos secundarios musculares), solo o en combinación con otros fármacos. Con el objetivo de facilitar su implementación e identificar qué pacientes se van a beneficiar más, en el presente documento se presentan unos algoritmos sencillos y prácticos.
Contribución de los autoresTodos los autores han contribuido de manera sustancial a la concepción, el diseño, la redacción y la revisión del trabajo.
Conflicto de interesesC. Escobar ha recibido honorarios por becas, ponencias o labores de asesoría de Amgen, Sanofi, MSD, Mylan, Servier, Ferrer, DaiichiSankyo y Novartis; V. Barrios ha recibido honorarios por becas, ponencias o labores de asesoría de Daiichi-Sankyo, Almirall, Amgen, Mylan, Novartis y Sanofi; A. Ariza no tiene conflictos de intereses; R.l Campuzano ha recibido honorarios por becas, ponencias o labores de asesoría de Amgen, Sanofi, Ferrer, Daiichi-Sankyo, Servier y Novartis; J. M. Gámez ha recibido honorarios por becas, ponencias o labores de asesoría de Sanofi, Amgen, Novartis, Mylan y Almirall; J. M. Mostaza ha recibido honorarios por becas, ponencias o asesoría de Amgen, Sanofi, Novartis y Daiichi-Sankyo.