Palabras clave
INTRODUCCIÓN
La tromboembolia pulmonar (TEP) ha sido «tierra de nadie» durante décadas, a caballo entrela neumología y la cardiología, entre la medicina interna y la de cuidados intensivos, entre la radiologíay la medicina nuclear, entre la hematología y la cirugía cardiotorácica. Además, los factores de riesgomás importantes para la TEP se dan de maneraagrupada en pacientes con seguimiento en los departamentos de traumatología y ortopedia, neurología, oncología u obstetricia. Los médicos que afrontan la TEP utilizan idiomas diferentes y estrategias terapéuticas distintas según su ámbito clínicode procedencia. Ahora parece que hay una posibilidad de poner fin a esta «Torre de Babel» gracias ala creciente apreciación de que los problemas clínicos clave —tanto en la TEP como en la hipertensión pulmonar tromboembólica crónica (HPTEC)—están relacionados con la sobrecarga de presión y lainsuficiencia del ventrículo derecho (VD). Los cardiólogos, incluidos los especialistas de unidades decuidados intensivos cardiacos, se empiezan a interesar más por el conocimiento de esta enfermedad ypor la forma de combatirla. La Sociedad Europeade Cardiología (SEC) fue la primera en elaboraruna guía de práctica clínica detallada sobre la TEPy la HPTEC1,2. Es importante señalar que en losgrupos de trabajo que elaboraron y actualizaron losdocumentos participaron radiólogos, neumólogos,hematólogos, intensivistas y cirujanos, con lo quese estableció una plataforma común universalmenteaceptable para la comunicación. El presente textoasume la guía reciente de la ESC, con la adición denuevas evidencias cuando es necesario.
ENFERMEDAD TROMBOEMBÓLICA AGUDA
Epidemiología y factores predisponentes
La epidemiología de la TEP es difícil de valorardada su forma de presentación inespecífica y losfrecuentes errores diagnósticos. La tasa de incidencia anual de tromboembolia venosa (TEV) sesitúa probablemente entre 20 y 70 casos/100.000habitantes3,4. Aproximadamente una tercera partede estos pacientes presentan TEP aguda y en elresto hay una trombosis venosa profunda (TVP)aislada5. Los datos clínicos y post mórtem obtenidos en la zona de Malmö (Suecia), donde se realizan autopsias en la mayor parte de las muertes, indicaban que la incidencia de la TEP era deaproximadamente 20/10.000 habitantes/año6. Aproximadamente un 10% del total de pacientescon TEP aguda fallecen en un plazo de 1-3 meses7,8.
De cada 10 pacientes fallecidos en el hospital,1 muere a causa de TEP, y 1 de cada 100 pacienteshospitalizados fallece por esta causa9-11.
La TEV es consecuencia de la interacción entrefactores de riesgo relacionados con el paciente yfactores relacionados con el contexto. Los factorespredisponentes relacionados con el paciente suelenser de carácter permanente, mientras que los relacionados con el contexto son de tipo transitorio12 (tabla 1). A la TEP que aparece en ausencia de todofactor obvio relacionado con el contexto se la denomina a menudo «no provocada».
Los factores predisponentes relacionados con elpaciente son la edad, los antecedentes de TEVprevia, el cáncer activo, la enfermedad neurológicacon paresia de extremidades, los trastornos médicosque requieren reposo prolongado en cama, como lainsuficiencia cardiaca o respiratoria, y la trombofilia congénita o adquirida, la terapia hormonalsustitutiva y el empleo de anticonceptivos orales12. Estos últimos dos factores pueden considerarsetambién relacionados con el contexto, en especial siun episodio embólico se produce de manera relativamente temprana tras el inicio de la administración hormonal. La identificación de la presencia de factores predisponentes y la estimación de su importancia relativa pueden ser útiles tanto en la evaluación de la probabilidad clínica con fines diagnósticos como para la toma de decisiones relativas a laprevención primaria. Lamentablemente, la TEPpuede producirse en pacientes que no presentanningún factor predisponente identificable. El porcentaje de pacientes con TEP idiopática o sin factores predisponentes fue de alrededor del 20% en elInternational Cooperative Pulmonary EmbolismRegistry (ICOPER)13.
Recientemente han surgido nuevas evidencias relativas a factores predisponentes en varias áreas deespecial interés o controversia:
- En un metaanálisis de 14 estudios se evaluó lainfluencia de los viajes como factor predisponentede TEV. Según los datos obtenidos en 4.055 casosde TEV documentados, su riesgo relativo en losviajeros aumentaba en 2,8 (intervalo de confianza[IC], 2,2-3,7). El riesgo aumentaba en un 18 y un26% cada 2 h de aumento de duración del viaje decualquier tipo y del viaje en avión, respectivamente14.
- En un estudio de cohorte de ámbito nacionalrealizado en Dinamarca, con un registro de 10,4 millones de años-mujer, que incluía a 3,3 millones deaños-mujer correspondientes a mujeres que tomaban anticonceptivos orales, se observaron 4.213 episodios de trombosis venosa, incluida TEP.El riesgo absoluto global de TEV cada 10.000 añosmujer fue de 3,01 en las mujeres que no tomabananticonceptivos orales y de 6,29 en las que sí. Elriesgo disminuía según aumentaba la duración deluso y con las dosis de estrógenos más bajas. Los anticonceptivos orales con contenido de desogestrel,gestodeno o drospirenona se asociaron a un riesgo1,5-2 veces superior al observado con levonorgestrel. Los anticonceptivos que contenían solamenteprogestágenos y los dispositivos intrauterinos liberadores de hormonas no se asociaron a un aumentodel riesgo de trombosis venosa15.
- Con objeto de aclarar qué indicador de laobesidad describe mejor el aumento del riesgo deTEV, se efectuó un seguimiento de 27.178 varones y 29.876 mujeres de 50-64 años de edad,durante 10 años, en un estudio prospectivo. Huboun total de 641 episodios de TEV verificados mediante la revisión de las historias clínicas. Se observó una asociación positiva del perímetro decadera con la TEV en las mujeres, pero no en losvarones, mientras que el perímetro de cinturatenía una asociación positiva con la TEV en losvarones, pero no en las mujeres. Se identificaronasociaciones positivas entre la TEV y el peso corporal, el índice de masa corporal y la masa grasacorporal total16.
El misterio de la TEP idiopática está aún pendiente de explorar. Recientemente se ha observadoque ciertos marcadores de la inflamación, como laproteína C reactiva de alta sensibilidad (hs-CRP),el fibrinógeno y el factor VIII, están aumentadosen los pacientes con TEV idiopática en comparación con «secundaria»17, lo que respalda la hipótesis de que la primera puede tener algunos factorespredisponentes en común con la tromboemboliaarterial18. La reciente observación de que la trombosis a una edad temprana del paciente era elfactor predictivo más potente para la TEV en susfamiliares (odds ratio [OR] = 3,27; IC del 95%,1,68-6,38, para los pacientes de edad < 45 años enel momento de la TEV en comparación con los deedad > 71 años) ha puesto de relieve la base genética de la TEV. Es interesante señalar que la presencia de factor V Leiden o del gen de protrombinaG20210A fue un factor predictivo independientemás débil para la TEV en los familiares (OR ajustada = 1,48; IC del 95%, 0,94-2,33)19. La contribución genética en la etiología de la TEV se ha evaluado recientemente con mayor detalle mediantemetaanálisis en los que se ha incluido un total de126.525 casos y 184.068 controles procedentes de173 estudios de casos y controles20. Se examinaron21 genes y 28 polimorfismos. En la población caucásica, se observó una asociación significativa delfactor V G1691A y A4070G, la protrombinaG20210A y G11991A, el PAI-1 4G/5G y el fibrinógeno alfa Thr312Ala con el TEV. Es interesante señalar que tanto el factor XIII Val34Leu como el fibrinógeno beta 455 G/A mostraron un efectoprotector significativo.
Aunque todos estos datos mejoran nuestro conocimiento de la fisiopatología de la TEV y respaldanen especial el concepto de un componente genéticoimportante en la etiología de la TEV idiopática, enla actualidad no son de gran ayuda para el manejoclínico cotidiano de los pacientes.
Abordaje diagnóstico según el estadiopronóstico inicial
El enfoque actualmente utilizado ante un paciente en el que se sospecha una TEP se basa en unaestratificación pronóstica inicial de los pacientes enun grupo de riesgo alto (> 15%) y otro en el que nohay un riesgo alto de muerte temprana relacionadacon la TEP1. Esta estratificación se basa por completo en la evaluación clínica, es decir, en una búsqueda de la posible presencia de shock o hipotensión sistémica. La hipotensión se define como unapresión arterial sistólica < 90 mmHg o un descensode ésta ≥ 40 mmHg en comparación con el nivel habitual durante un mínimo de 15 min y sin una causaalternativa aparente21.
Pacientes en alto riesgo
La mayoría de las recomendaciones diagnósticasrelativas a los pacientes en shock o con hipotensiónno están respaldadas por una evidencia basada enensayos adecuadamente diseñados y se fundamentan en las opiniones de expertos.
En los pacientes en alto riesgo, la prioridad es confirmar o descartar con la máxima urgencia la presencia de trombos arteriales pulmonares con repercusión hemodinámica; dichos trombos suelen sermúltiples, grandes y de localización proximal. Sinembargo, la exploración diagnóstica de primera líneadebe permitir también un diagnóstico diferencial respecto a otros trastornos que comportan un peligroinmediato para la vida. El síndrome coronarioagudo, la disección aórtica con taponamiento cardiaco, la disfunción valvular o ventricular izquierdaaguda, pero también el neumotórax a tensión o incluso una hemorragia interna importante, puedenmanifestarse con signos y síntomas similares a los dela TEP aguda, como la disnea aguda, el dolor torácico, el síncope y la inestabilidad hemodinámica.
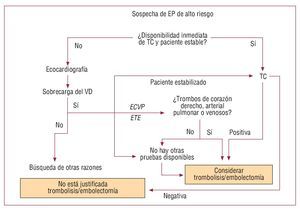
La angiotomografía computarizada (angio-TC)es la exploración diagnóstica de primera elecciónrecomendada en los pacientes de alto riesgo en quese sospecha una TEP (fig. 1). Sin embargo, la ecocardiografía de urgencia a la cabecera del pacientees una alternativa aceptable si el estado clínico delpaciente es crítico1. Una ecocardiografía del VDnormal descarta la presencia de TEP con peligropara la vida. Los signos inequívocos de sobrecargaaguda de presión en el VD señalan muy claramentea una TEP (aunque no son diagnósticos) en estecontexto clínico. Debe iniciarse la administración de heparina no fraccionada (HNF) intravenosa ydebe considerarse seriamente la conveniencia de untratamiento trombolítico1. La identificación detrombos cardiacos derechos en la ecocardiografíajustifica un tratamiento agresivo, que incluya trombolisis o embolectomía, sin necesidad de otras evaluaciones diagnósticas22.
Fig. 1. Algoritmo diagnóstico propuestopara pacientes con sospecha de tromboembolia pulmonar aguda que presentan shock o hipotensión. La letra cursiva y laslíneas punteadas indican otras propuestasadicionales que no se incluyen en el algoritmo original de la guía de la SociedadEuropea de Cardiología. ECVP: ecografíade compresión venosa proximal; ETE:ecocardiograma transesofágico; TC: angiografía por tomografía computarizada;TEP: tromboembolia pulmonar; VD: ventrículo derecho.
Mientras se prepara el tratamiento trombolítico,debe considerarse una confirmación mediante TC(en caso de que pueda estabilizarse al paciente) omediante una ecografía con compresión venosa ouna ecocardiografía transesofágica (ETE) realizadas a la cabecera del paciente23. La confirmacióndirecta de los trombos es especialmente importanteen pacientes con contraindicaciones relativas parala trombolisis. Es preferible la evaluación no invasiva, debido a su menor tasa de complicaciones hemorrágicas locales24,25. Sin embargo, la angiografíaclásica puede ser útil también, sobre todo en un paciente remitido al laboratorio de hemodinámica acausa de una sospecha de síndrome coronarioagudo. Si la ecocardiografía revela una disfuncióncardiaca derecha y no izquierda, una angiografíapulmonar inmediata puede ser más apropiada queel traslado de un paciente inestable a la sala de exploración de TC.
Pacientes que no están en alto riesgo
En ellos, la estrategia diagnóstica no se centrasólo en la confirmación de la TEP (o de la TVP,puesto que ambos trastornos conducen a lasmismas decisiones terapéuticas en caso de pacienteshemodinámicamente estables). Es más importanteque la evaluación diagnóstica identifique a los pacientes en que a pesar de la sospecha clínica de TEPpuede obviarse la anticoagulación con un riesgoaceptablemente bajo de que se produzca algún episodio nuevo de TEV en un futuro inmediato. Elriesgo se define mediante la frecuencia de apariciónde un episodio de TEV clínicamente manifiesto enlos 3 meses siguientes y no debe superar un 1-2%(con un límite superior del IC del 95% del 3%), esdecir, la tasa esperada de TEV tras una angiografíapulmonar negativa26.
Este enfoque «probabilístico» es necesario paraafrontar el elevado número de pacientes que presentan disnea, dolor torácico u otros signos y síntomas inespecíficos. De hecho, tan sólo en un25-30% de estos pacientes se confirma la TEP conun estudio diagnóstico completo. Así pues, la evaluación diagnóstica debe empezar con la identificación de los pacientes con una probabilidad clínicade TEP previa a la exploración baja o moderadasegún las reglas de predicción de Wells o de Ginebra o según la evaluación subjetiva27,28. Estos pacientes pueden ser dados de alta sin anticoagulación, basándose tan sólo en el resultado negativo deuna determinación de dímero D en plasma. Los métodos de determinación del dímero D de sensibilidad moderada son suficientes para tomar una decisión de este tipo en pacientes con probabilidadclínica baja, mientras que las pruebas de alta sensibilidad permiten hacerlo también en pacientes conprobabilidad clínica intermedia29,30.
Dado que las concentraciones de dímero D aumentan con la edad, las comorbilidades o el embarazo30-33, esta prueba es más útil para la evaluación depacientes previamente sanos que presentan una enfermedad aguda y son atendidos en el servicio deurgencias31,33-35. En los pacientes con un dímero D elevado y en los que presentan una probabilidad clínicaalta, son necesarias exploraciones de imagen, preferiblemente con una angio-TC multidetectores (TCMD)36.
Dos ensayos clave han evaluado la utilidad diagnóstica de determinadas técnicas de imagen no invasivas clave en el contexto de la probabilidad clínica de una TEP. El estudio PIOPED37 se centró enla gammagrafía pulmonar y el PIOPED II38, en laTCMD. Ambos ensayos pusieron de relieve una influencia importante de la probabilidad previa a laprueba en el rendimiento diagnóstico de una exploración concreta. Así pues, las discrepancias entrelas necesidades de evaluación clínica y de laboratorio requieren nuevas consideraciones diagnósticas. Un resultado negativo de la TCMD en un paciente con una probabilidad clínica de TEP elevada,de la misma forma que ocurre con una TCMD positiva (limitada a arterias subsegmentarias) en unpaciente con una probabilidad previa a la pruebabaja, debe motivar la realización de nuevas pruebasde verificación39. Un mayor aumento del número dedetectores de TC puede conducir a una notificaciónexcesiva de émbolos pulmonares subsegmentariosdistales, cuya trascendencia clínica no está clara40.
En la tabla 2 se presenta una relación concisa delas pruebas diagnósticas y sus combinaciones validadas y se explica la probabilidad clínica de TEP1. Esta información puede ser útil para elaborar algoritmos diagnósticos alternativos que a veces debenajustarse de manera individualizada a la disponibilidad local limitada de pruebas de laboratorio.
Un abordaje diagnóstico que se atenga a las guíasactuales se asocia a un mejor resultado41 y debeaplicarse de manera activa. Los ordenadores y programas informáticos modernos pueden ser útilespara normalizar el manejo de los pacientes en quese sospecha o se confirma una TEP aguda42.
Excepto en los pacientes con baja probabilidadclínica de TEP y los que presentan hemoptisis uotras contraindicaciones significativas, ante la sospecha clínica debe iniciarse una anticoagulacióncon heparina de bajo peso molecular (HBPM), conobjeto de reducir el riesgo de una recurrencia temprana de la TEP durante el tiempo necesario paracompletar el estudio diagnóstico1.
Deben señalarse los intentos recientes de simplificar dos reglas de predicción anteriormente validadas43-46. En la puntuación de Wells, se ha propuestouna escala binomial (improbable-probable), en vezde tres niveles de probabilidad previa a la prueba(baja-intermedia-alta). Además, recientemente seha asignado un mismo rango a todos los elementosde la puntuación de predicción, sin que ello afecteaparentemente a su rendimiento43-45. Se están introduciendo cambios similares en la puntuación de Ginebra46. Aunque actualmente se ha introducido unacierta confusión, es posible que finalmente estos esfuerzos conduzcan a un uso más sencillo y generalizado de las reglas de predicción.
Se presentan constantemente nuevas ideas y métodos diagnósticos. Se ha propuesto la determinación del CO2 teleespiratorio como posible alternativaa la determinación del dímero D, para utilizarlacomo complemento de la regla de predicción deWells47. En el estudio PIOPED II se evaluó la utilidad de ampliar la angio-TC también a una flebografía de TC. Sin embargo, el rendimiento diagnóstico adicional fue desdeñable y no justificaba elaumento de exposición a la radiación38. Se ha propuesto el empleo de la gammagrafía pulmonar comoexploración más apropiada que la TC en el embarazo, puesto que comporta un riesgo similar para elfeto, pero con menor riesgo de inducción de cáncerde mama en la madre48,49. El posible papel de las exploraciones exentas de radiación, como la ecografíatorácica50-52 y la endobronquial53, está pendiente todavía de ensayos de validación prospectivos que permitan establecer su utilidad ante la sospecha de TEP.
Ensayos más pequeños54-57 han señalado el papelde la resonancia magnética (RM) como exploracióndiagnóstica en la TEP, que se ha definido recientemente en el amplio ensayo prospectivo PIOPED III. La principal limitación de la RM fue la elevadafrecuencia de imágenes técnicamente inadecuadas,que osciló entre el 11 y el 52% (media, 25%) en lossiete centros participantes. Por consiguiente, la angio-RM identificó tan sólo un 57% (59 de 104) delos pacientes con una TEP confirmada de maneraobjetiva. La angio-RM técnicamente adecuada tuvouna sensibilidad del 78% y una especificidad del99%, y al combinarla con la flebografía de RM,estas cifras fueron del 92 y el 96%, respectivamente.Lamentablemente, tan sólo se dispuso de resultadostécnicamente adecuados de ambas exploraciones58 en la mitad de los pacientes (194 de 370).
Tratamiento inicial y evaluación pronósticadetallada
Las principales recomendaciones para el manejoinicial de la TEP aguda se resumen en la tabla 3.
Tromboembolia pulmonar de riesgo alto
Como se ha mencionado antes, los pacientes conTEP aguda que tienen un riesgo elevado de muertetemprana se identifican por la presencia de shock ohipotensión sistémica. El objetivo terapéutico enesos pacientes consiste no sólo en evitar una recurrencia temprana de la embolia con peligro para lavida (inicialmente mediante la administración deheparina intravenosa), sino también en facilitar unareducción de la carga del VD. Esto se puede intentar y conseguir en la mayor parte de los casoscon una trombolisis intravenosa59.
En los pacientes con TEP de alto riesgo se prefiere el empleo de HNF, iniciado de forma inmediata mediante bolo intravenoso ajustado según elpeso (80 U/kg) y seguido de 18 U/kg/h, junto conuna posterior infusión ajustada al uso de HBPM enfunción del tiempo de tromboplastina activada(TTPA)60. No hay un consenso respecto a si debesuspenderse o no la administración de heparina durante el empleo del fármaco trombolítico y, de serasí, cuándo debe reiniciarse.
De las tres pautas de tratamiento trombolíticoformalmente aprobadas para la TEP, solamente seutiliza en la actualidad la de alteplasa (activador deplasminógeno tisular recombinante) en infusión de100 mg en 2 h, iniciada generalmente con 10 mg enbolo. Otra posibilidad es el empleo de una infusiónrápida de alteplasa a la dosis de 0,6 mg/kg (máximo,50 mg) en un plazo de 15 min, en situaciones de urgencia, como por ejemplo durante la reanimacióncardiorrespiratoria61. Las pautas basadas en la administración de un bolo seguido de una infusión intravenosa prolongada de estreptocinasa o urocinasase han sustituido en la práctica clínica por las infusiones más rápidas de dosis altas en 1-2 h. Estaspautas eran similares a las utilizadas en el infartoagudo de miocardio, puesto que alcanzaban unalisis más rápida del coágulo, con un menor riesgode hemorragia62.
Se han obtenido también resultados hemodinámicos satisfactorios en la TEP aguda con el empleode un doble bolo de reteplasa, mediante dos inyecciones (10 U) con 30 min de separación entre ellas63 o con el empleo de tenecteplasa en bolo64. Sin embargo, ni reteplasa ni tenecteplasa han sido aprobadas formalmente hasta el momento para el tratamiento de la TEP.
En pacientes con contraindicaciones para latrombolisis y en el 10% que no obtiene mejoría apesar del empleo de este tratamiento, debe considerarse la conveniencia de una embolectomía quirúrgica65. Vale la pena recordar que un paciente conTEP que comporte peligro para la vida se estabilizade inmediato tras la introducción de un bypass cardiopulmonar. Una serie más reciente ha aportadodatos tranquilizadores en cuanto a los resultados dela embolectomía quirúrgica66. Como alternativascabe considerar la embolectomía a través de catéter,la fragmentación del trombo o ambas cosas, si sedispone de la experiencia y el material necesarios67,68.
Cuando no hay posibilidad inmediata de una intervención quirúrgica o mediante catéter en un paciente en estado crítico por TEP confirmada objetivamente, no existe casi ninguna contraindicaciónque impida el uso de la trombolisis1. Excepto en loscasos en que hay un antecedente reciente de hemorragia cerebral o una hemorragia interna grave nocontrolada, debe considerarse la trombolisis, porejemplo en pacientes operados recientemente. Enestos casos es preciso prever la aparición de complicaciones hemorrágicas graves y tratarlas de inmediato. La administración intrapulmonar de agentestrombolíticos no es ni más segura ni más efectivaque la administración sistémica68,69.
Tromboembolia pulmonar sin riesgo elevado
El objetivo principal del tratamiento en los pacientes normotensos con TEP es una prevención inmediata y efectiva de las recurrencias de embolias yde la extensión local de los trombos intrapulmonares. Esto debe intentarse, y suele conseguirse, conel empleo de anticoagulación, lo cual permite quepredomine la trombolisis intrínseca y la retraccióndel trombo. La eliminación de los trombos del lechopulmonar y el restablecimiento de una hemodinámica normal pueden requerir semanas o meses, ypuede que no lleguen a ser completos70.
El empleo de HBPM a dosis ajustada según elpeso es el tratamiento de primera elección para lamayoría de los pacientes con TEP aguda documentada71-73, incluidos los que presentan hemoptisis acausa de un infarto pulmonar. El fondaparinux entres dosis fijas establecidas en función del peso corporal (5 mg para pacientes de menos de 50 kg,7,5 mg para pacientes de 50-100 kg y 10 mg parapacientes de más de 100 kg de peso corporal) es unaalternativa válida74, en especial en pacientes con insuficiencia renal, puesto que permite una administración sin necesidad de modificar la dosis hasta valores de filtrado glomerular (FG) de tan sólo 20 ml/kg/min, en comparación con los de 30 ml/kg/minpara las HBPM. Es probable que el fondaparinuxno induzca la formación de anticuerpos antiplaquetarios PF4 ni una trombocitopenia «inducida porheparina». A diferencia de las HBPM, no debeusarse durante el embarazo, dada la falta de evidencia al respecto. El tratamiento con HBPM norequiere una monitorización de laboratorio, excepto en presencia de valores extremos de peso corporal, una reducción significativa del aclaramientode creatinina o en el embarazo en el periodo previoal parto. En estas situaciones, cabe considerar untratamiento con control de la actividad anti-Xa71. La tinzaparina, la enoxaparina y la dalteparina (enpacientes con cáncer) están aprobadas formalmentepara el uso en la TEP. Sin embargo, es una prácticahabitual extrapolar la evidencia existente a otrasHBPM que tienen una eficacia documentada en eltratamiento de la TVP.
Se prefiere el uso de HNF intravenosa al deHBPM en diversas situaciones clínicas como las siguientes: TEP inestable y de «alto riesgo», riesgosignificativo de hemorragia o insuficiencia renalgrave. Es crucial el empleo de una dosis de HNFsuficientemente alta para la prevención satisfactoriade los episodios recurrentes de TEP. La administración diaria de dosis intravenosas ≥ 40.000 U debeser eficaz incluso en casos en que no hay una prolongación adecuada del TTPA (que se define comode > 1,5 a 2,5 veces el valor de control), aunque unamonitorización de la actividad anti-Xa podría seraún más tranquilizadora75.
La anticoagulación iniciada con heparinas ofondaparinux debe continuarse con un antagonistade la vitamina K (AVK). El empleo de AVK oralespuede iniciarse ya en el primer día de tratamiento ymantenerse en paralelo con la administración de unanticoagulante parenteral en dosis terapéuticas durante al menos 4 días. Éste puede suspenderse sólotras haber alcanzado un valor de la razón normalizada internacional (INR) situado dentro de los límites terapéuticos, es decir, 2-3 durante ≥ 2 díasconsecutivos71. En algunos pacientes en los que lamonitorización de la INR óptima parece difícil,puede usarse una HBPM para la prevención secundaria a las dosis recomendadas para este fin por elfabricante, que generalmente son de un 50-75% dela dosis terapéutica plena1. El embarazo es una situación específica en que la mayor parte de los expertos indican utilizar una dosis de HBPM de un75-100% de la dosis terapéutica hasta el momentodel parto, debido a su mayor eliminación76.
La trombofilia no requiere modificaciones del tratamiento inicial, excepto en los casos con un déficit significativo de antitrombina. Puede dar lugara una resistencia a la HNF, que se manifiesta poruna ausencia de prolongación del TTPA y puedecorregirse con un aumento de la dosis de HNF osustitución con antitrombina. El efecto del déficitde antitrombina en la eficacia de la HBPM esmenos claro.
Tromboembolia pulmonar de riesgo intermedio
Puede considerarse también el uso de trombolisisen algunos pacientes seleccionados que no cumplenlos criterios de alto riesgo de muerte temprana relacionada con la TEP1. Una evaluación pronósticadetallada, mediante la búsqueda de una posible sobrecarga de presión/disfunción del VD o una posible lesión miocárdica, puede identificar a pacientes normotensos con un riesgo relativamentemás alto.
Se ha considerado a la ecocardiografía una exploración clave para predecir la evolución intrahospitalaria en la TEP aguda25,77-80. Esto se ha puesto enduda en un reciente metaanálisis en el que se incluyó a 475 pacientes normotensos con TEP; ese estudio indicó que la ecografía tenía solamente valores predictivo negativo (60%) y positivo (58%)moderados respecto a la muerte temprana81. La estandarización de unos criterios ecográficos quepuedan aplicarse de manera universal en el establecimiento de los estadios pronósticos de TEP agudaes una cuestión todavía sin resolver82.
La TCMD, que actualmente es el método preferido para el diagnóstico de la TEP, puede detectarde forma simultánea un crecimiento del VD debidoa la TEP, lo que tiene implicaciones en el pronóstico83. En un metaanálisis de dos estudios en los quese incluyó a 191 pacientes normotensos con TEP, seobservó un valor predictivo negativo global del 58%y un valor positivo del 57% para la dilatación delVD en la TC respecto a la predicción de una muertetemprana81.
Los péptidos natriuréticos proporcionan unaperspectiva sobre la función ventricular, incluida lacausada por TEP aguda, que no se basa en métodosde imagen84-87. Un metaanálisis en el que se incluyóa un total de 1.132 pacientes observó que el aumento de las concentraciones plasmáticas de BNP/NT-proBNP estaba relacionado con un riesgo significativo de muerte temprana (OR = 7,6; IC del95%, 3,4-17)88. El valor pronóstico de los péptidosnatriuréticos puede mejorar cuando se consideranconjuntamente con la ecocardiografía89 o los datosclínicos90.
Aunque todos los indicadores de la disfunciónVD citados parecen útiles para la estratificaciónpronóstica en los pacientes normotensos, es decir,pacientes con TEP que por lo demás «no están en alto riesgo», no se han definido unos valores decorte universales y en la actualidad no pueden formularse recomendaciones terapéuticas al respecto.Concretamente, la sobrecarga/disfunción del VDpor sí sola no parece justificar el uso sistemático depautas de tratamiento más invasivas como la trombolisis o la embolectomía24.
Igual que ocurre en el síndrome coronario agudo,las troponinas cardiacas pueden detectarse en hastaun 50% de los pacientes con TEP aguda91. En unmetaanálisis en el que se incluyó a 1.985 pacientesde 20 estudios, se ha descrito un aumento del riesgode muerte (OR = 5,24; IC del 95%, 3,28-8,38) en lospacientes con concentraciones de troponina elevadas92. Al realizar una evaluación similar limitadaa 1.366 pacientes normotensos incluidos en nueve estudios, se observó que la elevación de la troponina no contribuía por sí sola al establecimiento deestadios pronósticos satisfactorios93. No se ha evaluado todavía la utilidad de las determinaciones detroponina de alta sensibilidad en la TEP. Otrosmarcadores de la lesión o la isquemia miocárdicacon posible utilidad pronóstica en la TEP son lasproteínas transportadoras de ácidos grasos de tipocardiaco (H-FABP)94-97 y el factor de crecimiento ydiferenciación 15 (GDF-15)98.
Lamentablemente, el valor predictivo positivo encuanto a la mortalidad es bajo y el valor de corte óptimo no se ha establecido de manera universalpara ninguno de los biomarcadores específicos indicadores de una lesión miocárdica. Con un únicomarcador de riesgo que sea «positivo» según los criterios locales, basta para considerar que un pacientetiene un «riesgo intermedio» de muerte temprana(un 3-15% de mortalidad hospitalaria o a 30 días).Es probable que los signos de lesión miocárdica ydisfunción tengan un valor aditivo. Dado queaproximadamente un 25% de los pacientes conriesgo intermedio tienen un curso clínico complicado24, debe plantearse una monitorización estrictapor telemetría o en la unidad de cuidados intensivos, con objeto de poder aplicar un tratamientoinmediato de «rescate» (la denominada estrategiade «espera vigilante»). Para 2012 se espera disponerde los resultados de un estudio controlado y aleatorizado, largamente esperado, en el que se valora elposible efecto beneficioso de la trombolisis en comparación con la heparina sola en pacientes con TEPaguda que presentan signos ecocardiográficos desobrecarga del VD y un aumento de la troponinaplasmática (estudio PEITHO).
Tromboembolia pulmonar de riesgo bajo
La TEP de riesgo bajo puede diagnosticarse enpacientes en los que se han determinado los marcadores de disfunción del VD y lesión miocárdica, pero han dado resultados negativos. Sin embargo,la evolución de los pacientes también puede verseinfluida por las comorbilidades y el estado general.Recientemente, se ha validado un Pulmonary Embolism Severity Index (PESI) en poblaciones amplias de pacientes con TEP99,100, y se ha observadoque permite identificar a los pacientes con tasasmuy bajas de acontecimientos adversos101. Este índice tiene en cuenta factores como edad, sexo y comorbilidades, taquicardia, taquipnea, hipotensión,hipotermia, hipoxemia y confusión. Un valor bajodel índice PESI puede facilitar las decisiones relativas a un alta rápida en los pacientes de bajo riesgocon TEP aguda y seguir tratamiento domiciliario.
Prevención secundaria a largo plazo
Tras un episodio documentado de TEP, la prevención de las recurrencias es prioritaria. Sin ella,hasta un 50% de los pacientes puede sufrir un episodio recurrente en los primeros 3 meses102. Mientras que la TEP provocada exige sólo 3 meses deanticoagulación, con un riesgo desdeñable de recurrencia tardía, se considera que la TEP no provocada es una enfermedad que persiste durante todala vida del paciente. La frecuencia de las recurrencias parece ser independiente de la manifestaciónclínica inicial de TEV, pero la recurrencia de laTEV es 3 veces más probable que se manifieste enforma de TEP si el episodio clínico inicial ha sidouna TEP que si ha sido una TVP103. Sin embargo, lamayoría de los datos disponibles se refieren a laTVP y no a la TEP sola, e indican una tasa de recurrencias de al menos un 30% al cabo de8-10 años104-106. El tratamiento con AVK es muyefectivo para reducir el riesgo de recurrencia detromboembolia en hasta un 90%107. Sin embargo, elriesgo de recurrencia reaparece tras la suspensiónde esta medicación, sea cual sea el tiempo en que sehaya utilizado108,109. Tras una TEP no provocada,las indicaciones para una anticoagulación oral másprolongada o indefinida deben evaluarse de formaindividualizada tras un mínimo de 3 meses de prevención secundaria inicial. En esta población de pacientes hay una clara necesidad de nuevos marcadores adicionales que permitan mejorar laestratificación del riesgo de recurrencia de TEV. Ladeterminación del dímero D 1 mes después de suspendida la administración de AVK puede ayudar.Los pacientes con una concentración anormal dedímero D en plasma deben reanudar la anticoagulación, dado el riesgo relativamente elevado de recurrencias110. Los depósitos trombóticos persistentes detectados mediante ecografía concompresión venosa en el sistema venoso profundoconstituyen otro indicador de aumento del riesgode recurrencia en la TEP idiopática111.
Aun siendo eficaz, la prescripción sistemática deprevención indefinida con anticoagulación es cuestionable si se tiene en cuenta el aumento del riesgode hemorragias graves1,71,107,112. De hecho, la anticoagulación crónica previene la recurrencia de TEVa costa de una tasa de hemorragias graves de un3-4% en los ensayos clínicos y de hasta un 5-9% enla práctica clínica habitual113. Las complicacioneshemorrágicas aparecidas durante los primeros3 meses de tratamiento son un importante factordeterminante de la mortalidad. De los 407 pacientesseguidos en el registro RIETE que presentaron unahemorragia grave durante el periodo de estudio,133 (33%) fallecieron en los 30 días siguientes (lamitad de ellos a causa de hemorragias)114. Así pues,es importante volver a evaluar periódicamente lasindicaciones y contraindicaciones para continuarcon la prevención de la TEV, teniendo en cuentatambién las preferencias de los pacientes71.
Las terapias antiagregantes plaquetarias combinadas de dos fármacos que se aplican después demuchas intervenciones cardiovasculares constituyenuna nueva dificultad para la anticoagulación profiláctica a largo plazo. Los filtros venosos parecen reducir la mortalidad cuando se implantan a causa decomplicaciones hemorrágicas en pacientes tratadoscon anticoagulantes en los primeros 3 meses tras unepisodio de TEV. En el registro RIETE, la colocación de un filtro de vena cava fue la única variableasociada de forma independiente a una incidenciamenor de hemorragias mortales (OR = 0,1; IC del95%, 0,01-0,79) y de mortalidad por todas las causas(OR = 0,21; IC del 95%, 0,07-0,63). La suspensión dela anticoagulación se asoció a un aumento del riesgode muerte (OR = 2,31; IC del 95%, 1,37-3,94)114.
Se recomienda anticoagulación por tiempo indefinido tras un segundo episodio de TEV no provocada. Los pacientes con trombofilia o cáncer activotambién son candidatos a empleo indefinido de anticoagulación con AVK. En los pacientes concáncer se necesita una prevención secundaria conHBPM en vez de AVK, puesto que su evoluciónparece mejorar, al menos cuando se administra durante los primeros 6 meses siguientes a un episodiode TEV agudo115,116.
Actualmente están en estudio anticoagulantes denueva generación, en su mayor parte de tipo anti-Xa y agentes antitrombínicos directos, para laprofilaxis y el tratamiento de la TEV, y es posibleque sean útiles para mejorar el equilibrio entre eficacia en la prevención y riesgo de hemorragia117.
ENFERMEDAD TROMBOEMBÓLICACRÓNICA
La HPTEC puede diagnosticarse si se visualizantrombos organizados en arterias pulmonares principales, lobulares, segmentarias o subsegmentarias enun paciente con hipertensión pulmonar (HP) precapilar, es decir, con una presión arterial pulmonar(PAP) media ≥ 25 mmHg, una resistencia vascularpulmonar (RVP) > 2 UI y una presión de oclusiónarterial pulmonar ≤ 15 mmHg.
Epidemiología y factores predisponentes
La HPTEC es una consecuencia poco frecuentede la TEP aguda. Hasta hace poco se pensaba quesolamente en un 0,1-0,5% de los pacientes con TEPaguda se desarrollaba HPTEC118, mientras que enla inmensa mayoría los tromboémbolos del lechopulmonar se eliminaban principalmente mediante laactividad trombolítica endógena119. Estudios másrecientes indican una prevalencia de la HPTEC superior, que alcanza el 3,1 y el 3,8%, a 1 y 2 años deun episodio embólico respectivamente120. Un estudio multicéntrico prospectivo observacional de259 pacientes tras un primer episodio de TEP pusode relieve una incidencia total de HPTEC del 0,8%durante 46 meses de observación, con una incidencia el doble de alta (1,5%) en los pacientes conTEP idiopática121.
Se considera que la HPTEC se debe principalmente a la trombolisis endógena interrumpida trasun episodio tromboembólico122. Se han identificadopocos factores de riesgo protrombóticos en los pacientes con la enfermedad y sólo un 50% de los pacientes con una HPTEC documentada tienen antecedentes identificables de TEP aguda123. Otrostrastornos médicos asociados a la HPTEC son lossiguientes: esplenectomía, válvula ventricular parael tratamiento de la hidrocefalia, osteomielitis crónica y enfermedad inflamatoria intestinal124.
Abordaje diagnóstico
Toda limitación de la capacidad de ejercicio denueva aparición y motivada por la disnea obliga aconsiderar la posibilidad de una HPTEC entre susposibles causas. Esto es especialmente cierto(aunque no de forma exclusiva) en los pacientes conantecedentes de enfermedad tromboembólica venosa. Debe tenerse en cuenta también la posibilidadde HPTEC en todos los pacientes con signos ecocardiográficos de sobrecarga de presión del VD sise han descartado las causas frecuentes de HP.
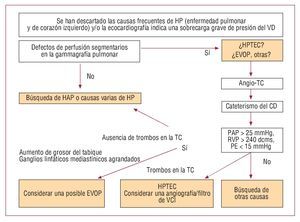
La indicación sistemática de un examen ecocardiográfico prospectivo en los pacientes asintomáticos que han sobrevivido a una TEP aguda o a unaHPTEC es cuestionable. Un reciente estudio prospectivo realizado en Países Bajos, de examen sistemático en 866 pacientes con antecedentes de TEPaguda, ha mostrado el 0,57% (IC del 95%,0,02%-1,2%) de prevalencia de HPTEC, que también fue más alto (1,5%; IC del 95%, 0,08%-3,1%)en los casos idiopáticos. Sin embargo, la mayoríade los pacientes con HPTEC ya habían sido identificados por la presencia de signos y síntomas clínicos. Esto ocurrió antes de que se los invitara aparticipar en el examen ecocardiográfico formal sistemático; este examen tuvo un rendimiento diagnóstico adicional muy bajo para la HPTEC, y noresultó útil en la práctica según lo indicado por losautores125. En la figura 2 se presenta un algoritmoque puede ser útil para planificar la estrategia diagnóstica ante la sospecha de una HPTEC.
Fig. 2. Abordaje diagnóstico propuestopara los pacientes con signos ecocardiográficos de sobrecarga de presión ventricular derecha inexplicada. CD: corazónderecho; dcms: dyn x cm x 5-5; EVOP:enfermedad venooclusiva pulmonar; HAP:hipertensión arterial pulmonar; HP: hipertensión pulmonar; HPTEC: hipertensiónpulmonar tromboembólica crónica; PAP:presión arterial pulmonar; PE: presión enclavada; RVP: resistencia vascular pulmonar; TC: tomografía computarizada; VCI:vena cava inferior; VD: ventrículo derecho.
Contrariamente a lo que sucede en la TEP aguda,la gammagrafía de perfusión pulmonar sigue teniendo un papel importante en el diagnóstico diferencial de la HP crónica. Es un instrumento excelente para la detección sistemática de la HPTEC126. Una gammagrafía de perfusión normal permite descartar la HPTEC, mientras que la presencia de defectos múltiples debe motivar la realización denuevas exploraciones de imagen con fines diagnósticos. La angio-TC es el siguiente paso recomendado. Si pueden visualizarse trombos murales,bandas intraluminales o membranas, la HPTEC esmuy probable. Un patrón de perfusión en mosaicoen la TC de alta resolución es una observación frecuente que respalda el diagnóstico. Según la extensión y el carácter de las lesiones intrapulmonares, ysegún la experiencia local, la angiografía pulmonarclásica puede ser necesaria o no para aceptar la indicación quirúrgica. Si se realiza, facilita la identificación no sólo de los depósitos postrombóticos murales organizados, sino también de redes o bandasresiduales, posibles restos fibrosos de trombos que pueden contribuir a aumentar la RVP. Así pues, lasalteraciones intravasculares que se observan en laHPTEC son diferentes de las que se dan en la TEPaguda126. En la hipertensión arterial pulmonar(HAP) es de destacar que pueden encontrarsetrombos organizados situados en las arterias pulmonares proximales, sobre todo en los pacientescon síndrome de Eisenmenger. Estos depósitospueden ser consecuencia de la estasis local en arterias muy dilatadas y no tienen consecuencias hemodinámicas directas, excepto por la posible embolización de arteria a arteria. Las anomalías de lasarterias pulmonares, los tumores vasculares (comoangiosarcomas o leiomiomas), la arteritis de Takayasu y la fibrosis mediastínica pueden causar problemas diagnósticos importantes, puesto que semejan una HPTEC cuando se evalúan con métodosde diagnóstico por imagen127-129. La interpretaciónde las imágenes y las decisiones diagnósticas y terapéuticas ante la sospecha de HPTEC requieren unaespecial experiencia y un enfoque multidisciplinario, por lo que deben quedar únicamente enmanos de centros de referencia especializados.
Tratamiento
La HPTEC avanzada, si no se trata, tiene muymal pronóstico. Ello se debe no sólo a los depósitospostembólicos persistentes, sino también al remodelado de las arteriolas pulmonares, similar al que seobserva en la HAP, que aumenta de forma progresiva la poscarga del VD130. Los datos históricos relativos a pacientes con HPTEC en los que se ha utilizado solamente un tratamiento de sostén indican una mortalidad de un 30-80%, según el valor dePAP media existente en el momento de la presentación inicial (> 30 mmHg y > 50 mmHgrespectivamente)131. Los pacientes con HPTEC perocon un valor de PAP media < 30 mmHg presentaron una mortalidad del 12% durante un periodode 18,7 meses de seguimiento, que contrastaba conla mortalidad del 50% observada en los pacientescon una PAP media > 30 mmHg132.
Tratamiento quirúrgico
La endarterectomía pulmonar (EAP) quirúrgicaes la forma de tratamiento preferida en los pacientes con HPTEC123,126.
En 1973, Kenneth Moser y Nina Braunwald, delUC San Diego, describieron el empleo eficaz de estaintervención133. Desde entonces, la EAP se ha realizado con la ayuda de un bypass cardiopulmonar yrequiere periodos remitentes de hipotermia profunda, lo que impide un sangrado retrógrado procedente de la circulación bronquial y permite la extracción de la íntima de la arteria pulmonar,llegando hasta las ramas segmentarias y a veces subsegmentarias, junto con los depósitos postrombóticos organizados intraluminales adheridos a ella. Sila endarterectomía bilateral completa se realiza deforma técnicamente satisfactoria y se controlan lasposibles complicaciones perioperatorias, como lahemorragia o el edema pulmonar de reperfusión, lamejoría clínica hemodinámica y pronóstica a largoplazo puede ser extraordinaria134. La mayor parte delos centros utilizan de forma sistemática la implantación de filtros de vena cava antes de la EAP paraprevenir la recurrencia perioperatoria o tardía deTEP. Esto se produce a veces en pacientes con unresultado excelente de la EAP que no mantienen demanera adecuada la anticoagulación crónica al considerar que están curados de la enfermedad.
Recientemente, algunos cirujanos que realizanEAP se han mostrado contrarios a la implantaciónde filtros de vena cava, ya que pueden dificultar laaplicación de sistemas de apoyo vital extracorpóreos (extracorporeal life support systems [ECLS]).Estas intervenciones pueden salvar la vida de pacientes con insuficiencia del VD o respiratoria graveen el postoperatorio inmediato135. Los filtros venosos extraíbles podrían ser una solución, pero eneste contexto clínico todavía no hay experiencia.
La endarterectomía puede no ser eficaz en todoslos pacientes. Depende principalmente de la contribución relativa del elemento postrombóticoproximal y del elemento proliferativo distal en laelevación de la RVP y el aumento de la poscargadel VD. Jamieson et al136 describieron cuatro tiposde hallazgos intrapulmonares observados durantelas intervenciones de EAP que se correlacionaron con el pronóstico. En la mayoría de los pacientescon HPTEC que son posibles candidatos a una intervención quirúrgica, la decisión respecto a su operabilidad está relativamente clara. En los demás,otros métodos más sofisticados basados en la evaluación Doppler de la onda de PAP reflejada, la determinación de la partición de la RVP o las pruebasde reactividad vascular pulmonar137-140 pueden aportar alguna ayuda. Sin embargo, aún existe ungrupo de pacientes significativo en los que no hayningún método que permita predecir preoperatoriamente de manera inequívoca el resultado hemodinámico final de la cirugía.
Las indicaciones universalmente aceptadas parala EAP son:
- Clase funcional III o IV de la OMS.
- RVP > 300 dyn x s x cm-5.
- Alteraciones proximales localizadas en arteriaspulmonares principales, lobulares o segmentarias.
- Ausencia de comorbilidades graves.
Los principales indicadores de un resultado satisfactorio de la EAP son141:
- Experiencia del cirujano y del equipo.
- Concordancia entre la RVP y el porcentaje deoclusión del lecho arterial pulmonar.
- RVP preoperatoria < 1.000-1.200 dyn x s x cm-5.
- Ausencia de comorbilidades específicas (esplenectomía, shunt ventriculoauricular).
- RVP postoperatoria inmediata < 500 dyn x s x cm-5.
En algunos pacientes, la oclusión unilateral completa produce una limitación del ejercicio pese a quelas alteraciones hemodinámicas en reposo sean relativamente leves. Esto se debe principalmente al aumento del espacio muerto en el pulmón no perfundido y puede ser también una indicación para laEAP142. Sin embargo, por razones que no están deltodo claras, las oclusiones de la arteria pulmonarunilateral se asocian a un riesgo elevado de recidivatras la EAP143, y es preciso tener en cuenta este hechoal evaluar la indicación quirúrgica en un paciente.
La experiencia y el enfoque multidisciplinario sonesenciales para alcanzar un resultado satisfactorioen la cirugía de la HPTEC. Los datos del centro deSan Diego, en el que se han realizado más de 2.000 intervenciones de EAP, indican que la mortalidad inicial del 20% se redujo al 4,5% para las intervenciones realizadas después de 2004144,145.
Tratamiento médico
A todos los pacientes con HPTEC se les debeaplicar anticoagulación durante toda la vida, generalmente con un AVK, para prevenir la recurrenciade la TEP y la extensión local de los trombos a arterias y arteriolas pulmonares y a la microcirculación pulmonar124. Esto es aplicable tanto antescomo después de la EAP (incluidos los pacientes alos que se han implantado filtros de vena cava), asícomo en los pacientes que sólo reciben tratamientomédico.
En los pacientes sintomáticos, debe considerarseel uso de medidas de sostén similares a las recomendadas en la HAP2; esto incluye el uso de diuréticosen pacientes con insuficiencia del VD y oxigenoterapia en los pacientes con hipoxemia. Se debe recomendar también la vacunación contra la gripe yevitar el embarazo y la actividad física excesiva.
A pesar de la mejora de la técnica quirúrgica y dela experiencia, todavía hay casi un 50% de pacientescon HPTEC sintomática que reciben únicamentetratamiento médico. Esto se debe principalmente alas alteraciones distales inoperables o a lascomorbilidades123,141,145. Además, en un 10% de lospacientes, la HP persiste después de la EAP debidoa que quedan depósitos distales o a la contribucióndel remodelado arteriolar123,141,145. Han surgido posibles indicaciones para un tratamiento dirigido enla HPTEC debido a la creciente evidencia favorablerespecto al tratamiento vasodilatador y antirremodelado en la HAP146 que han estimulado la realización de ensayos clínicos.
Las posibles indicaciones para el tratamiento médico en la HPTEC son:
- Enfermedad distal considerada inoperable.
- Comorbilidades que aumentan prohibitivamente el riesgo de la cirugía.
- Como tratamiento puente para la EAP o eltrasplante en pacientes con alto riesgo.
- HP persistente a pesar de la EAP.
Varias series piloto de pequeño tamaño y estudiosde casos y controles han respaldado el concepto dela terapia médica dirigida en la HPTEC. Sin embargo, la evidencia fiable basada en ensayos prospectivos, aleatorizados, controlados y con inclusión de un grupo placebo todavía no es concluyente. Losprincipales resultados de tres ensayos llevados acabo en la HPTEC147-149 se indican en la tabla 4. Dosde estos ensayos fueron de pequeño tamaño. Elúnico que dispuso de la potencia estadística necesaria para detectar una diferencia significativa entreel grupo de tratamiento activo y el grupo control fueel ensayo BENEFIT. En ese estudio se incluyó a pacientes con HPTEC inoperable o con HP que persistía más de 6 meses después de la EAP. Los criterios de valoración coprincipales independientesfueron el cambio de la RVP expresado como porcentaje del valor basal y el cambio respecto al valorbasal en la distancia recorrida durante 6 min, tras16 semanas de tratamiento con bosentán 125 dosveces al día o con placebo. Los criterios de valoración cosecundarios fueron el cambio de la clase funcional de la Organización Mundial de la Salud respecto a la situación basal y otros parámetroshemodinámicos. El ensayo puso de manifiesto unefecto estadísticamente significativo del tratamientocon bosentán en comparación con placebo encuanto a la RVP, con una reducción respecto alvalor basal del 24,1% (IC del 95%, -31,5% a -16%;p < 0,0001) a las 16 semanas147. El otro criterio devaloración coprincipal, la distancia recorrida en6 min, no llegó a alcanzarse, y la mejora media en elgrupo de tratamiento activo en comparación con elgrupo placebo fue de sólo +2,2 m (IC del 95%, -22,5a 26,8 m; p = 0,5449). Hubo varios parámetros clínicamente relevantes que presentaron una mejoría significativa en los pacientes asignados aleatoriamentea bosentán, en comparación con los tratados conplacebo, como la resistencia pulmonar total y el índice cardiaco, así como las concentraciones plasmáticas de NT-proBNP. El tratamiento con bosentánse toleró bien. Aún no está claro cómo puede explicarse la discrepancia entre los resultados hemodinámicos y los funcionales. Se ha señalado que se produce una pérdida de condicionamiento físico queretrasa la recuperación funcional en los pacientescon HPTEC, debido a las comorbilidades y a laedad más avanzada, en comparación con lo observado en la HAP.
En un reciente estudio retrospectivo observacional de 355 pacientes tratados con EAP en SanDiego entre 2005 y 2007, no pareció haber un efectobeneficioso con el tratamiento preoperatorio de bosentán, sildenafilo o epoprostenol (utilizados enmonoterapia o de forma combinada) en comparación con lo observado en 244 pacientes que recibieron solamente un tratamiento de sostén. La terapia dirigida produjo un retraso en la derivaciónde los pacientes al tratamiento quirúrgico, pero noinfluyó en el curso postoperatorio150. A pesar deque estos datos no son concluyentes, una parte significativa de los pacientes con HPTEC en todo elmundo recibe tratamiento con una farmacoterapiadirigida. Un amplio registro europeo de HPTEC recientemente completado deberá aportar mayor información sobre las estrategias diagnósticas y terapéuticas y sobre los resultados actualmenteobtenidos en los pacientes con HPTEC en Europa.Y lo que es más importante, la mayoría de losnuevos fármacos estudiados en el tratamiento de laHAP se estudian también de forma paralela en pacientes con una HPTEC inoperable y «persistente».Esto resultará útil para llevar a cabo una evaluación objetiva de la utilidad y el lugar que debeocupar el tratamiento médico específico en estas indicaciones.
ABREVIATURAS
HBPM: heparina de bajo peso molecular.
HNF: heparina no fraccionada.
HPTEC: hipertensión pulmonar tromboembólicacrónica.
TCMD: tomografía computarizadamultidetectores.
TEP: tromboembolia pulmonar.
TVP: trombosis venosa profunda.
VD: ventrículo derecho.
Full English text available from: www.revespcardiol.org
Conflictos de intereses: Adam Torbicki declara ser consultor de Actelion,Bayer Schering, Eli Lilly, GlaxoSmithKline y mondoBIOTECH, haberrecibido honorarios por conferencias de Bayer Schering, Eli Lilly, Actelion,Pfizer y Sanofi Aventis, y haber realizado investigaciones financiadas porActelion, Bayer Schering, Bristol-Myers-Squibb, Eli Lilly, GlaxoSmithKline,Sanofi Aventis, mondoBIOTECH y Pfizer.
Correspondencia: Prof. A. Torbicki.
Department of Chest Medicine. Institute of Tuberculosis and LungDiseases.
ul Plocka 26. 01-138 Varsovia. Polonia.
Correo electrónico: a.torbicki@igichp.edu.pl