No se dispone de tratamientos farmacológicos que demuestren reducir la morbimortalidad asociada en pacientes con insuficiencia cardiaca y función sistólica conservada (IC-FEc). El objetivo del presente estudio fue evaluar si en pacientes con IC-FEc, el entrenamiento de la musculatura inspiratoria (EMI), la electroestimulación muscular funcional (EMF) o la combinación de ambas (EMI + EMF) puede mejorar la capacidad funcional, calidad de vida, parámetros de disfunción diastólica o biomarcadores a las 12 y 24 semanas.
MétodosUn total de 61 pacientes estables con IC-FEc (clase funcional de la New York Heart Association II-III) se aleatorizaron (1:1:1:1) a recibir un programa de 12 semanas de EMI, EMF, o EMI + EMF frente a tratamiento médico estándar (control). El objetivo primario fue evaluar el cambio en el consumo máximo de oxígeno. Los objetivos secundarios fueron los cambios en la calidad de vida, parámetros ecocardiográficos y biomarcadores. Se utilizó un modelo lineal mixto para comparar los cambios entre los diferentes grupos.
ResultadosLa edad media fue 74 ± 9 años y la proporción de mujeres fue del 58%. El test de consumo máximo de oxígeno fue de 9,9 ± 2,5ml/min/kg. A las 12 semanas, con respecto al grupo control, el incremento medio de consumo máximo de oxígeno fue de 2,98, 2,93 y 2,47 para EMI, EMF y EMI + EMF, respectivamente (p < 0,001). Este incremento se mantuvo a las 24 semanas (1,95, 2,08 y 1,56, respectivamente; p < 0,001). Resultados similares se observaron en la puntuación del cuestionario de calidad de vida (p < 0,001).
ConclusionesEn los pacientes con IC-FEc e importante reducción de la capacidad funcional, tanto el EMI como la EMF se asocian con una marcada mejoría de la capacidad funcional y la calidad de vida.
Ensayo clínico registrado en ClinicalTrials.gov (Identificador: NCT02638961).
Palabras clave
La insuficiencia cardiaca (IC) con función sistólica conservada (IC-FEc) constituye la forma predominante de IC en la población de edad avanzada, en particular mujeres1,2. Hasta la fecha, los ensayos farmacológicos más representativos llevados a cabo en personas con IC-FEc no han podido demostrar ningún beneficio pronóstico importante3-7, lo cual puede explicar por qué la morbilidad y la mortalidad asociadas con este síndrome siguen siendo excesivamente altas8-10. El rasgo clínico característico de la IC-FEc es una reducción grave de la capacidad funcional11, que limita las actividades cotidianas de los pacientes y es un determinante importante de mal pronóstico y mala calidad de vida (CdV)8.
Se ha demostrado repetidamente que el ejercicio aeróbico mejora la capacidad de esfuerzo y la CdV de los pacientes con IC y fracción de eyección reducida12-14; no obstante, no está claro cómo afecta a los pacientes con la actual definición de IC-FEc15. Otras terapias físicas, como el entrenamiento de la musculatura inspiratoria (EMI) y la electroestimulación muscular funcional (EMF), también mejoran la capacidad de ejercicio y la CdV de los pacientes con IC y fracción de eyección reducida13,14; no obstante, hay poca evidencia que respalde su viabilidad y su utilidad clínica en la IC-FEc16,17.
En consecuencia, este estudio controlado y aleatorizado, el ensayo TRAINING-HF (Inspiratory Muscle Training and Functional Electrical Stimulation for Treatment of Heart Failure With Preserved Ejection Fraction), evalúa el efecto del EMI, la EMF y su combinación en la capacidad funcional de los pacientes con IC-FEc de moderada a grave. Los objetivos secundarios analizados fueron la CdV, los parámetros ecocardiográficos y los biomarcadores cardiacos.
MÉTODOSDiseño del estudioEs un estudio controlado y aleatorizado, abierto e iniciado por un investigador, que se llevó a cabo en un centro médico académico entre septiembre de 2015 y diciembre de 2016. El estudio contó con pacientes con IC-FEc y clase funcional de la New York Heart Association (NYHA) II-III/IV. El diseño del estudio se ha publicado anteriormente18. El diagnóstico de IC-FEc se estableció según los criterios de la guía de 2012 de la Sociedad Europea de Cardiología19. Todos los pacientes proporcionaron el consentimiento informado y el protocolo fue aprobado por el comité ético según los principios de la Declaración de Helsinki y regulaciones nacionales. Una empresa independiente (MedStat Consulting; Reading, Pensilvania, Estados Unidos) llevó a cabo todos los análisis.
Población del estudioLa elegibilidad de los pacientes candidatos se basó en los siguientes criterios de inclusión: a) clase funcional de la NYHA ≥ II; b) fracción de eyección del ventrículo izquierdo > 50% mediante el método Simpson y diámetro diastólico final < 60 mm; c) cardiopatía estructural (hipertrofia del ventrículo izquierdo/dilatación de la aurícula izquierda) o disfunción diastólica estimada mediante ecocardiografía bidimensional según la guía de 2012 de la Sociedad Europea de Cardiología19, y d) estabilidad clínica determinada por la ausencia de ingresos hospitalarios durante los 3 meses anteriores. Los criterios de exclusión fueron: a) incapacidad para realizar una prueba inicial de ejercicio válida; b) enfermedad valvular primaria de moderada a grave; c) angina inestable, infarto de miocardio o cirugía cardiaca en los 3 meses previos; d) arritmias no controladas o presión arterial no controlada durante las pruebas de ejercicio cardiopulmonar; e) enfermedad pulmonar primaria significativa, incluidos antecedentes de hipertensión arterial, enfermedad pulmonar tromboembólica crónica o enfermedad pulmonar obstructiva crónica, y f) cualquier otra comorbilidad con una esperanza de vida < 1 año.
IntervenciónEvaluación de la elegibilidad, aleatorización y primera visitaSe aleatorizó en 4 grupos (1:1:1:1) a los pacientes que cumplían los criterios de inclusión/exclusión y firmaron el consentimiento informado por escrito18: a) solo los cuidados habituales; b) un programa domiciliario de EMI de 12 semanas; c) un programa de EMF de los músculos de las extremidades inferiores de 12 semanas, o d) un programa en el que se combinaban el EMI y la EMF (EMI + EMF) de 12 semanas de duración. El seguimiento se extendió a 24 semanas con el objetivo de explorar la persistencia de los resultados a las 12 semanas. La primera visita incluía una anamnesis exhaustiva, una exploración física, medidas antropométricas y pruebas que llevaban a cabo 2 cardiólogos que desconocían el grupo al cual estaban asignados los pacientes. Las pruebas fueron: electrocardiograma, ecocardiografía, pruebas de ejercicio cardiopulmonar, test de los 6min de marcha, determinación de la presión inspiratoria máxima, CdV evaluada mediante el Minnesota Living With Heart Failure Questionnaire (MLHFQ) y los biomarcadores cardiacos.
Intervención de entrenamientoGrupo sometido a los cuidados habituales. Los pacientes asignados a este grupo no recibieron terapia física alguna. Los evaluó semanalmente un fisioterapeuta que determinaba la presión inspiratoria máxima en cada visita prefijada.
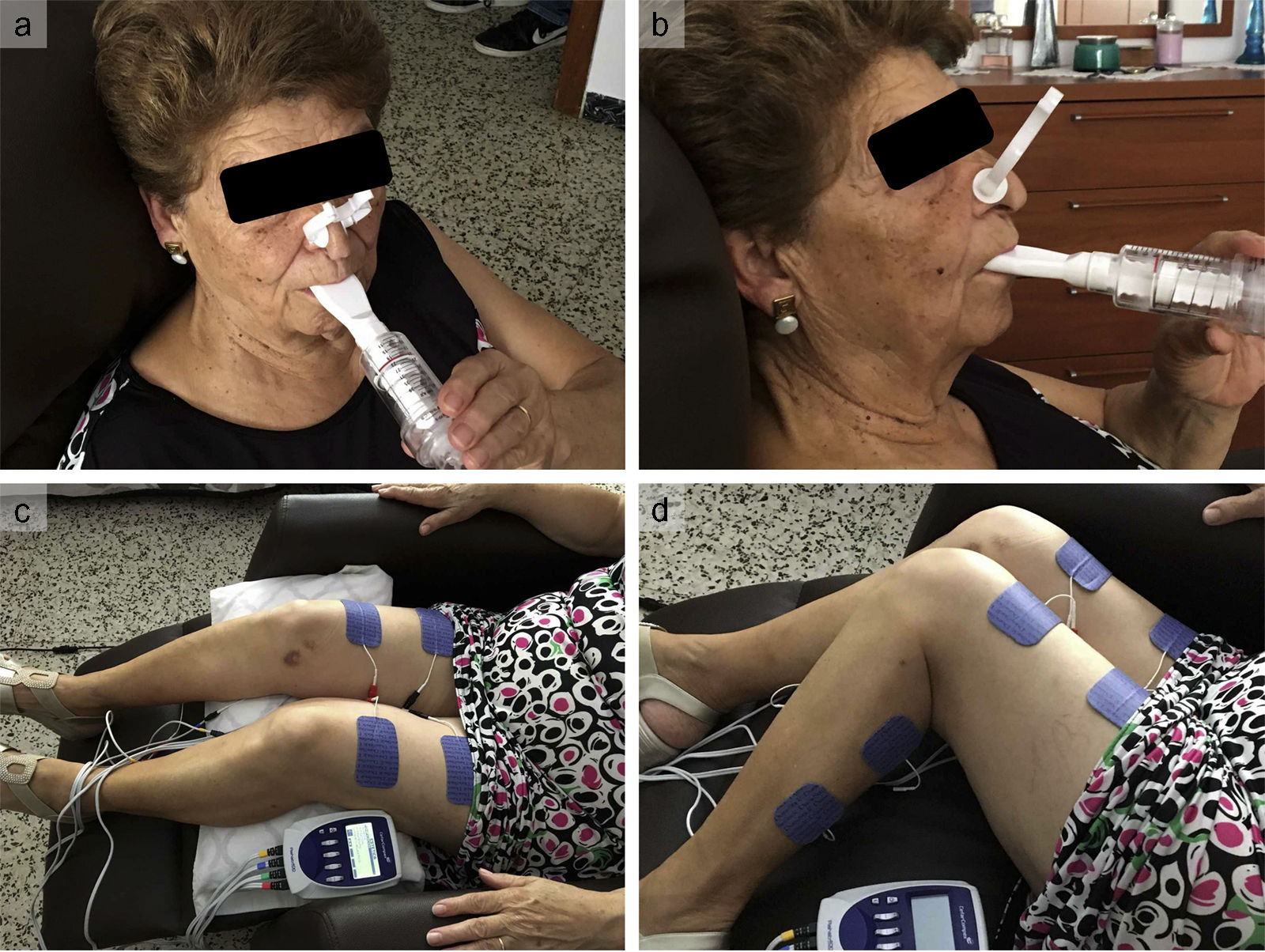
Grupo sometido a entrenamiento de la musculatura inspiratoria. A estos pacientes se les enseñaba a entrenar 2 veces al día (20min cada sesión) en casa y durante 12 semanas utilizando un dispositivo Treshold IMT (Respironics Inc.) (). Un fisioterapeuta les enseñaba a mantener la respiración diafragmática durante el periodo de entrenamiento. En un inicio, la resistencia de todos los participantes fue de un 25 a un 30% de la presión inspiratoria máxima durante 1 semana. El fisioterapeuta exploró a los pacientes semanalmente, revisando su diario de recogida de datos y determinando la presión de inspiración máxima. La resistencia se modificaba en cada sesión hasta un 25-30% de la presión inspiratoria máxima determinada.
Grupo sometido a electroestimulación muscular funcional. Estos pacientes trabajaron con un fisioterapeuta siguiendo un programa de EMF para ambas piernas de 45min diarios, 2 días a la semana durante un total de 12 semanas. Se utilizaron 8 electrodos adhesivos en la piel, sobre el cuádriceps (5cm por debajo del pliegue inguinal y 3cm por encima del límite superior de la rótula) y los músculos gastrocnemios (2cm por debajo de la rodilla y justo por encima del extremo proximal del tendón de Aquiles) de ambas piernas (). El estimulador (Rehab 400 Cefar Compex) se configuró para administrar una corriente bifásica de baja frecuencia (10-50 Hz) durante 5 s, seguida de un reposo de otros 5 s. La intensidad de la estimulación se ajustó para conseguir una contracción muscular visible sin malestar.
Grupo sometido a entrenamiento de la musculatura inspiratoria + electroestimulación muscular funcional. Los pacientes asignados a EMI + EMF recibieron al mismo tiempo EMI y EMF durante 12 semanas.
Visitas de seguimiento de los médicosUn cardiólogo entrenado de la unidad de IC evaluó a todos los pacientes a la aleatorización y en visitas a las 12 y a las 24 semanas. En función de la situación clínica del paciente, se permitieron visitas adicionales. Entre las visitas protocolarias prefijadas, destacan la evaluación previa de los antecedentes clínicos, la exploración física, la antropometría, el electrocardiograma, las pruebas de ejercicio cardiopulmonar, el test de los 6min de marcha, la presión inspiratoria máxima, el MLHFQ y el análisis de sangre. Las pruebas de ejercicio cardiopulmonar, el test de los 6min de archa, la prueba de evaluación de la fuerza de la musculatura inspiratoria, la ecocardiografía, la CdV relacionada con la salud y los biomarcadores séricos se describen con detalle en el .
Criterios de valoraciónEl criterio de valoración primario del estudio fue comparar los cambios observados en el consumo máximo de oxígeno (VO2máx) a partir de la situación inicial (Δ-VO2máx) en cada grupo de tratamiento activo frente a los cuidados habituales a las 12 y las 24 semanas. Los criterios de valoración secundarios fueron: a) cambios en la CdV a las 12 y las 24 semanas desde la situación inicial (frente a cuidados habituales) (Δ-MLHFQ); b) cambios en el cociente E/Ea (Δ-cociente E/Ea) a las 12 y las 24 semanas de la situación inicial (frente a los cuidados habituales) y Δ-índice de volumen de la aurícula izquierda, y c) cambios a las 12 y las 24 semanas desde la situación inicial (frente a cuidados habituales) en la fracción aminoterminal del propéptido natriurético cerebral (Δ-NT-proBNP) y CA125 (Δ-CA125). Como objetivos exploratorios, se compararon los cambios observados desde la situación inicial en la eficiencia respiratoria (Δ-VE/VCO2) y Δ-distancia recorrida en el test de los 6min de marcha en cada grupo de tratamiento activo con los cuidados habituales a las 12 y las 24 semanas. La evaluación de los objetivos relacionados con la seguridad incluyó comparar la mortalidad y/o el índice de hospitalización por IC aguda en cada grupo de tratamiento activo frente a los cuidados habituales en la visita realizada a las 24 semanas. El personal involucrado en la recogida de datos/tratamiento desconocía la pertenencia a cada grupo de tratamiento.
Análisis estadísticoTodas las comparaciones estadísticas se realizaron según un principio de intención de tratar modificado.
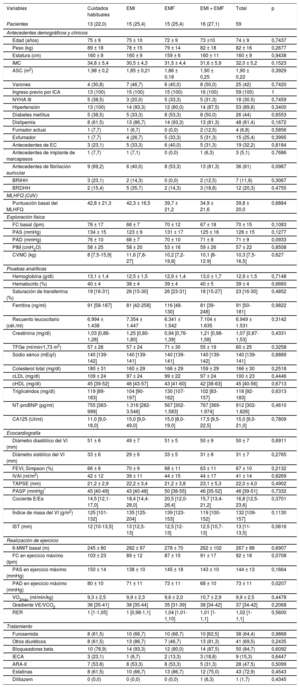
Análisis descriptivoLas variables categóricas y continuas se presentan como media ± desviación estándar, mediana [intervalo intercuartílico] o porcentajes según resulte adecuado (tabla 1). Se compararon las variables continuas entre los grupos utilizando el ANOVA unidireccional o la prueba de Kruskal-Wallis para las distribuciones asimétricas normales y no normales de las variables respectivamente. Las variables discretas se compararon utilizando la prueba de la χ2.
Características basales de la población del estudio
| Variables | Cuidados habituales | EMI | EMF | EMI + EMF | Total | p |
|---|---|---|---|---|---|---|
| Pacientes | 13 (22,0) | 15 (25,4) | 15 (25,4) | 16 (27,1) | 59 | |
| Antecedentes demográficos y clínicos | ||||||
| Edad (años) | 75 ± 9 | 75 ± 10 | 72 ± 9 | 73 ±10 | 74 ± 9 | 0,7437 |
| Peso (kg) | 89 ± 18 | 78 ± 15 | 79 ± 14 | 82 ± 18 | 82 ± 16 | 0,2677 |
| Estatura (cm) | 160 ± 8 | 160 ± 9 | 159 ± 6 | 160 ± 11 | 160 ± 9 | 0,9438 |
| IMC | 34,8 ± 5,4 | 30,5 ± 4,3 | 31,5 ± 4,4 | 31,6 ± 5,9 | 32,0 ± 5,2 | 0,1523 |
| ASC (m2) | 1,98 ± 0,2 | 1,85 ± 0,21 | 1,86 ± 0,18 | 1,90 ± 0,25 | 1,90 ± 0,22 | 0,3929 |
| Varones | 4 (30,8) | 7 (46,7) | 6 (40,0) | 8 (50,0) | 25 (42) | 0,7420 |
| Ingreso previo por ICA | 13 (100) | 15 (100) | 15 (100) | 16 (100) | 59 (100) | 1 |
| NYHA III | 5 (38,5) | 3 (20,0) | 5 (33,3) | 5 (31,3) | 18 (30.5) | 0,7459 |
| Hipertensión | 13 (100) | 14 (93,3) | 12 (80,0) | 14 (87,5) | 53 (89,8) | 0,3400 |
| Diabetes mellitus | 5 (38,5) | 5 (33,3) | 8 (53,3) | 8 (50,0) | 26 (44) | 0,6553 |
| Dislipemia | 8 (61,5) | 13 (86,7) | 14 (93,3) | 13 (81,3) | 48 (81,4) | 0,1672 |
| Fumador actual | 1 (7,7) | 1 (6,7) | 0 (0,0) | 2 (12,5) | 4 (6,8) | 0,5856 |
| Exfumador | 1 (7,7) | 4 (26,7) | 5 (33,3) | 5 (31,3) | 15 (25,4) | 0,3995 |
| Antecedentes de EC | 3 (23,1) | 5 (33,3) | 6 (40,0) | 5 (31,3) | 19 (32,2) | 0,8184 |
| Antecedentes de implante de marcapasos | 1 (7,7) | 1 (7,1) | 0 (0,0) | 1 (6,3) | 3 (5,1) | 0,7686 |
| Antecedentes de fibrilación auricular | 9 (69,2) | 6 (40,0) | 8 (53,3) | 13 (81,3) | 36 (61) | 0,0987 |
| BRIHH | 3 (23,1) | 2 (14,3) | 0 (0,0) | 2 (12,5) | 7 (11,9) | 0,3067 |
| BRDHH | 2 (15,4) | 5 (35,7) | 2 (14,3) | 3 (18,8) | 12 (20,3) | 0,4755 |
| MLHFQ (CdV) | ||||||
| Puntuación basal del MLHFQ | 42,8 ± 21,3 | 42,3 ± 16,5 | 39,7 ± 21,2 | 34,9 ± 21,6 | 39,8 ± 20,0 | 0,6884 |
| Exploración física | ||||||
| FC basal (lpm) | 78 ± 17 | 66 ± 7 | 70 ± 12 | 67 ± 18 | 70 ± 15 | 0,1083 |
| PAS (mmHg) | 134 ± 15 | 123 ± 9 | 131 ± 17 | 125 ± 16 | 128 ± 15 | 0,1277 |
| PAD (mmHg) | 76 ± 10 | 68 ± 7 | 70 ± 10 | 71 ± 8 | 71 ± 9 | 0,0933 |
| PIM (cmH2O) | 58 ± 25 | 58 ± 20 | 53 ± 16 | 59 ± 26 | 57 ± 22 | 0,8508 |
| CVMC (kg) | 8 [7,5-15,9] | 11,6 [7,8-27] | 10,2 [7,2-19,8] | 10,1 [8-12.9] | 10,3 [7,5-16,5] | 0,627 |
| Pruebas analíticas | ||||||
| Hemoglobina (g/dl) | 13,1 ± 1,4 | 12,5 ± 1,5 | 12,9 ± 1,4 | 13,0 ± 1,7 | 12,9 ± 1,5 | 0,7148 |
| Hematocrito (%) | 40 ± 4 | 38 ± 4 | 39 ± 4 | 40 ± 5 | 39 ± 4 | 0,6660 |
| Saturación de transferrina (%) | 19 [16-31] | 26 [15-30] | 26 [23-31] | 18 [15-27] | 23 [16-30] | 0,4852 |
| Ferritina (ng/ml) | 91 [58-187] | 81 [42-258] | 116 [48-130] | 81 [39-248] | 91 [50-181] | 0,9822 |
| Recuento leucocitario (cél./ml) | 6.994 ± 1.438 | 7.354 ± 1.447 | 6.341 ± 1.542 | 7.104 ± 1.635 | 6.949 ± 1.531 | 0,3142 |
| Creatinina (mg/dl) | 1,03 [0,86-1,28] | 1,25 [0,80-1,80] | 0,94 [0,76-1,39] | 1,21 [0,98-1,58] | 1,07 [0,87-1,53] | 0,4331 |
| TFGe (ml/min/1,73 m2) | 57 ± 26 | 57 ± 24 | 71 ± 30 | 55 ± 19 | 60 ± 25 | 0,3258 |
| Sodio sérico (mEq/l) | 140 [139-142] | 140 [139-141] | 140 [139-141] | 140 [139-142] | 140 [139-141] | 0,8889 |
| Colesterol total (mg/dl) | 180 ± 31 | 160 ± 29 | 166 ± 29 | 159 ± 29 | 166 ± 30 | 0,2518 |
| cLDL (mg/dl) | 109 ± 24 | 97 ± 24 | 99 ± 22 | 97 ± 24 | 100 ± 23 | 0,4446 |
| cHDL (mg/dl) | 45 [39-52] | 46 [43-57] | 43 [41-60] | 42 [38-63] | 45 [40-56] | 0,6713 |
| Triglicéridos (mg/dl) | 119 [89-183] | 104 [90-197] | 130 [107-162] | 102 [83-157] | 118 [92-183] | 0,6313 |
| NT-proBNP (pg/ml) | 755 [383-999] | 1.316 [282-3.546] | 567 [302-1.583] | 767 [369-1.974] | 912 [302-1.826] | 0,4610 |
| CA125 (UI/ml) | 11,0 [9,0-18,0] | 15,0 [9,0-49,0] | 15,0 [8,0-19,0] | 17,5 [9,5-22,5] | 15,0 [9,0-21,0] | 0,7809 |
| Ecocardiografía | ||||||
| Diámetro diastólico del VI (mm) | 51 ± 6 | 49 ± 7 | 51 ± 5 | 50 ± 9 | 50 ± 7 | 0,6911 |
| Diámetro sistólico del VI (mm) | 33 ± 6 | 29 ± 6 | 33 ± 5 | 31 ± 8 | 31 ± 7 | 0,2765 |
| FEVI, Simpson (%) | 66 ± 8 | 70 ± 9 | 68 ± 11 | 63 ± 11 | 67 ± 10 | 0,2132 |
| IVAI (ml/m2) | 42 ± 12 | 39 ± 11 | 44 ± 15 | 44 ± 17 | 41 ± 14 | 0,8269 |
| TAPSE (mm) | 21,2 ± 2,9 | 22,2 ± 3,4 | 21,2 ± 3,8 | 23,1 ± 5,3 | 22,0 ± 4,0 | 0,4902 |
| PASP (mmHg)* | 45 [40-49] | 43 [40-48] | 50 [38-55] | 46 [35-52] | 46 [39-51] | 0,7332 |
| Cociente E/Ea | 14,5 [12,1-17,0] | 18,4 [14,4-28,0] | 20,5 [12,0-26,4] | 15,7 [13,4-21,2] | 16,8 [12,5-23,6] | 0,3701 |
| Índice de masa del VI (g/m2) | 125 [101-132] | 135 [125-204] | 139 [123-153] | 119 [100-152] | 132 [109-157] | 0,1130 |
| IST (mm) | 12 [10-13,5] | 13 [12,5-13] | 12,5 [12-13] | 12,5 [10,7-13] | 13 [11-13,5] | 0,0616 |
| Realización de ejercicio | ||||||
| 6-MWT basal (m) | 245 ± 80 | 282 ± 97 | 278 ± 70 | 262 ± 102 | 267 ± 88 | 0,6907 |
| FC en ejercicio máximo (lpm) | 103 ± 23 | 89 ± 12 | 87 ± 15 | 91 ± 17 | 92 ± 18 | 0,0708 |
| PAS en ejercicio máximo (mmHg) | 150 ± 14 | 138 ± 10 | 145 ± 18 | 143 ± 10 | 144 ± 13 | 0,1664 |
| PAD en ejercicio máximo (mmHg) | 80 ± 10 | 71 ± 11 | 73 ± 11 | 68 ± 10 | 73 ± 11 | 0,0207 |
| VO2máx (ml/min/kg) | 9,3 ± 2,5 | 9,9 ± 2,3 | 9,6 ± 2,0 | 10,7 ± 2,9 | 9,9 ± 2,5 | 0,4478 |
| Gradiente VE/VCO2 | 36 [35-41] | 38 [35-44] | 35 [31-39] | 38 [34-42] | 37 [34-42] | 0,2068 |
| RER | 1 [1-1,05] | 1 [0,98-1,1] | 1,04 [1,01-1,10] | 1,01 [1-1,1] | 1,02 [1-1,1] | 0,5600 |
| Tratamiento | ||||||
| Furosemida | 8 (61,5) | 10 (66,7) | 10 (66,7) | 10 [62,5] | 38 (64,4) | 0,9868 |
| Otros diuréticos | 8 (61,5) | 13 (86,7) | 7 (46,7) | 13 (81,3) | 41 (69,5) | 0,2435 |
| Bloqueadores beta | 10 (76,9) | 14 (93,3) | 12 (80,0) | 14 (87,5) | 50 (84,7) | 0,6092 |
| IECA | 3 (23,1) | 1 (6,7) | 2 (13,3) | 3 (18,8) | 9 (15,3) | 0,6447 |
| ARA-II | 7 (53.8) | 8 (53,3) | 8 (53,3) | 5 (31,3) | 28 (47,5) | 0,5099 |
| Estatinas | 8 (61,5) | 10 (66,7) | 13 (86,7) | 12 (75,0) | 43 (72,9) | 0,4543 |
| Diltiazem | 0 (0,0) | 0 (0,0) | 0 (0,0) | 1 (6,3) | 1 (1,7) | 0,4345 |
6-MWT: test de los 6min de marcha; ARA-II: antagonistas del receptor de la angiotensina II; ASC: área de superficie corporal; BRDHH: bloqueo de la rama derecha del haz de His; BRIHH: bloqueo de la rama izquierda del haz de His; CA125: antígeno carbohidrato 125; CdV: calidad de vida; cHDL: colesterol unido a lipoproteínas alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; CVMC: contracción voluntaria máxima del cuádriceps; E/Ea: cociente entre la velocidad de llenado precoz del Doppler transmitral y la velocidad anular del Doppler tisular; EC: enfermedad coronaria; EMF: electroestimulación muscular funcional; EMI: entrenamiento de la musculatura inspiratoria; FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; gradiente VE/VCO2: relación entre la ventilación minuto y el índice de eliminación de CO2; ICA: insuficiencia cardiaca aguda; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; IST: grosor septo interventricular; IVAI: índice de volumen de la aurícula izquierda; MLHFQ: Minnesota Living with Heart Failure; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PASP: presión arterial sistólica pulmonar; PIM: presión inspiratoria máxima; RER: cociente de intercambio respiratorio; TAPSE: desplazamiento sistólico del anillo tricuspídeo; TFGe: tasa de filtrado glomerular estimada según la fórmula Modification of Diet in Renal Disease; VI: ventrículo izquierdo; VO2máx: consumo máximo de oxígeno.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
La hipótesis nula del estudio fue que, entre los 4 grupos de intervención, las diferencias absolutas en la media de VO2máx desde la situación inicial eran parecidas a los 3 y a los 6 meses. Para la determinación del tamaño de la muestra de este estudio, se presumió la prueba bilateral con un nivel de significación de α = 0,05. La magnitud del efecto en el VO2máx asociado co el EMI se basó en un estudio piloto llevado a cabo por nuestro grupo16; en ese estudio, el EMI se asoció con un aumento significativo de la media del VO2máx de 3 ml/kg/min (de 9 ± 2,5 a 12 ± 2,5 ml/kg/min) a las 12 semanas. Con estos datos en mente, se consideró un cambio medio de 3,0 ml/kg/min y una desviación estándar común de 3,0. La magnitud del efecto en la EMF se basó en un estudio reciente sobre IC con fracción de eyección reducida20, en el que la EMF se asoció con un aumento significativo de la media del VO2máx de 2 ml/kg/min (de 9,6 ± 3,5 a 11,6 ± 2,8 ml/kg/min) a las 10 semanas. Debido a la ausencia de cualquier fuente sobre el efecto de la EMF en la IC-FEc, se especuló que habría un aumento del VO2máx similar en estos pacientes. En consecuencia, se consideró un cambio medio de 2,0ml/kg/min y una desviación estándar común de 3,0. En el caso de los pacientes asignados a ambas intervenciones (EMI + EMF), y suponiendo un efecto sinérgico de los 2 tratamientos, se consideró una magnitud del efecto de ambas intervenciones de aproximadamente 4,0 ± 3,0 ml/kg/min. Suponiendo una distribución 1:1:1:1, un total de 48 pacientes (12 por grupo) proporcionaría una potencia estadística del 80% con un nivel de significación α < 0,05. Al final, fueron 15 los pacientes por grupo (60 en total) y se supuso que el número de bajas o pérdidas durante el seguimiento ascendería a un 20%. Para calcular el tamaño de la muestra se utilizó el software GLIMMPSE.
Análisis inferencialesTodos los criterios de valoración relacionados con la eficacia (primario y secundarios) se analizaron utilizando un modelo de efectos mixtos para medidas repetidas para comparar su Δ (diferencia absoluta con respecto a los valores iniciales) en las distintas modalidades terapéuticas (entre los distintos efectos) y a lo largo del tiempo (efecto dentro de un mismo tratamiento). La diferencia entre grupos se ajustó para las múltiples comparaciones utilizando el método Sidak. El modelo incluyó tratamiento, mes y la interacción entre un tratamiento × mes como efectos prefijados, y el valor inicial del criterio de valoración como covariable. La decisión de incluir la variable tiempo como efecto aleatorio (gradiente aleatorio) en cualquier modelo de efectos mixtos para medidas repetidas se basó en una prueba de razón de verosimilitud. Siempre se utilizó una métrica de covarianza poco estructurada. No obstante, en la tabla 2 se han representado las medias cuadráticas menores de los criterios de valoración (y no su Δ); además, no se hicieron ajustes por incluir el valor inicial del criterio de valoración como covariable. Todos los análisis se basaron en todos los datos disponibles sin imputación de valores omitidos. Un valor de p < 0,05 bilateral se consideró estadísticamente significativo en todos los análisis. Todos los análisis se realizaron con Stata 14.2.
Criterios de valoración principal y secundarios con valores observados y estratificados por grupo de tratamiento y visitas programadas
| Criterios de valoración | Cuidados habituales | EMI | ||||||
|---|---|---|---|---|---|---|---|---|
| Basal | 12 semanas | 24 semanas | p* 12 semanas 24 semanas | Basal | 12 semanas | 24 semanas | p* 12 semanas 24 semanas | |
| Pacientes, n | 13 | 13 | 13 | 15 | 13 | 13 | ||
| VO2máx (ml/min/kg) | 9,3 ± 2,5 | 8,8 ± 2,6 | 8,9 ± 2,5 | 0,111 0,204 | 9,9 ± 2,3 | 12,6 ± 3,4 | 11,7 ± 3,1 | < 0,001 < 0,001 |
| MLHFQ | 42,8 ± 21,3 | 42,6 ± 21,8 | 40,4 ± 22,4 | 1,000 0,997 | 42,3 ± 16,5 | 27,8 ± 14,8 | 27,2 ± 14,5 | < 0,001 < 0,001 |
| NT-proBNP (pg/ml) | 755 [383-999] | 983 [246-1.193] | 721 [311-866] | 0,928 1,000 | 1.316 [282-3.546] | 910 [183-2.301] | 909 [199-1.941] | 0,068 0,034 |
| CA125 (UI/ml) | 11,0 [9.0-18.0] | 16,0 (8-21] | 17,0 [8,0-22,0] | 0,305 0,168 | 15,0 [9,0-49,0] | 13,0 [8,0-19,0] | 15,0 [9,0-19,0] | 0,993 0,994 |
| Cociente E/Ea | 14,5 [12,1-17] | 14,3 [13,4-19,0] | 15,8 [12,7-21,5] | 1,000 0,939 | 18,4 [14,4-28,0] | 17,2 [12,4-23,1] | 17,6 [12,8-23,3] | 0,015 0,207 |
| IVAI (ml/m2) | 42 ± 12 | 44 ± 20 | 44 ± 19 | 0,898 0,787 | 39 ± 11 | 36 ± 9 | 31 ± 11 | 0,719 0,008 |
| Gradiente VE/VCO2 | 37,9 ± 6,3 | 37 ± 5,9 | 37,4 ± 5,4 | 0,813 0,981 | 38,5 ± 5,7 | 35,3 ± 5,8 | 34,4 ± 4,7 | 0,011 0,001 |
| Criterios de valoración | EMF | EMI + EMF | ||||||
|---|---|---|---|---|---|---|---|---|
| Basal | 12 semanas | 24 semanas | p* 12 semanas 24 semanas | Basal | 12 semanas | 24 semanas | p* 12 semanas 24 semanas | |
| Pacientes, n | 15 | 13 | 13 | 16 | 13 | 13 | ||
| VO2máx (ml/min/kg) | 9,6 ± 2,0 | 11,8 ± 2,6 | 11,0 ± 3,3 | < 0,001 < 0,001 | 10,7 ± 2,9 | 12,9 ± 3,7 | 12,1 ± 3,7 | < 0,001 0,002 |
| MLHFQ | 39,7 ± 21,2 | 27,1 ± 16,7 | 31,1 ± 20,5 | 0,014 0,275 | 34,9 ± 21,6 | 19,8 ± 14,6 | 25,3 ± 14,1 | < 0,001 0,029 |
| NT-proBNP (pg/ml) | 567 [302-1.583] | 667 [247-1.310] | 672 [210-1.918] | 0,750 0,978 | 767 [369-1.974] | 615 [344-1.242] | 1.007 [306-2.106] | 0,845 0,809 |
| CA125 (UI/ml) | 15,0 [8,0-19,0] | 14,0 [10,0-16,0] | 14,0 [10,0-17,0] | 0,926 0,987 | 17,5 [9,5-22,5] | 17,0 [10,0-21,0] | 21,0 [15,0-27,0] | 0,960 0,109 |
| Cociente E/Ea | 20,5 [12-26,4] | 15,7 [11,8-21,8] | 17,2 [12,6-23,5] | 0,001 0,092 | 15,7 [13,4-21] | 14,5 [11,4-19,9] | 14,5 [10,1-16,6] | 0,632 0,011 |
| IVAI (ml/m2) | 44 ± 15 | 41 ± 14 | 43 ± 16 | 0,093 0,495 | 40 ± 17 | 33 ± 12 | 35 ± 12 | 0,928 0,997 |
| Gradiente VE/VCO2 | 35,1 ± 4,5 | 34,5 ± 6,3 | 35 ± 5,8 | 0,959 0,996 | 38,4 ± 4,5 | 35,4 ± 4,5 | 36,4 ± 5 | 0,009 0,120 |
CA125: antígeno carbohidrato 125; E/Ea: cociente entre la velocidad de llenado transmitral precoz por Doppler transmitral y la de llenado diastólico por Doppler tisular; EMF: electroestimulación funcional; EMI: entrenamiento de la musculatura inspiratoria; gradiente VE/VCO2: relación entre la ventilación minuto y el índice de eliminación de CO2; IVAI: índice de volumen de la aurícula izquierda; MLHFQ: Minnesota Living with Heart Failure Questionnaire; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; VO2máx: consumo máximo de oxígeno.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo tabintercuartílico].
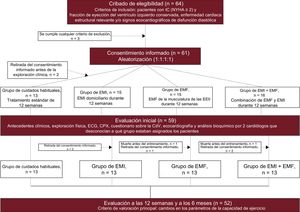
Se cribó a un total de 64 pacientes para ver si eran elegibles y se aleatorizó a 61. Antes de la evaluación inicial (visita 1), 2 pacientes retiraron el consentimiento informado, por lo que al iniciar la intervención quedaban 59. Antes de la intervención de entrenamiento, 2 pacientes fallecieron y 5 abandonaron el estudio por otros motivos (falta de apoyo de los cuidadores o posibles dificultades de transporte que pudieran impedir el cumplimiento de las visitas programadas); finalizaron el ensayo 52 pacientes (figura 1). La media de edad de la muestra que inició la intervención era 74 ± 9 años; el 34 (58%) eran mujeres, 18 (30,5%) se clasificaban en clase funcional de la NYHA III/IV, y todos los participantes habían sido ingresados con anterioridad a causa de una IC aguda descompensada. El VO2máx medio, el índice de masa corporal, la puntuación del MLHFQ y el test de los 6min de marcha fueron 9,9 ± 2,5 ml/min/kg, 32 ± 5,2, 39,8 ± 20 y 267 ± 88 m respectivamente. La mediana [intervalo intercuartílico] del valor de NT-proBNP y la eficacia respiratoria (gradiente VE/VCO2) fueron 912 [302-1.826] pg/ml y 37 [34-42] respectivamente. Los valores de p generales indicaban que no había diferencias significativas en las características iniciales entre los 4 grupos de tratamiento, excepto por la presión arterial diastólica cuando el ejercicio era máximo (tabla 1). Los valores medios observados de todos los criterios de valoración, estratificados según el tratamiento asignado y las visitas prefijadas (basal y a las 12 y las 24 semanas) se presentan en la tabla 2.
Diagrama de flujo para la inclusión y el seguimiento de los pacientes. CdV: calidad de vida; CPX: pruebas de ejercicio cardiopulmonar; ECG: electrocardiograma; EMF: electroestimulación muscular funcional; EEII: extremidades inferiores; EMI: entrenamiento de la musculatura inspiratoria; IC: insuficiencia cardiaca; NYHA: New York Heart Association.
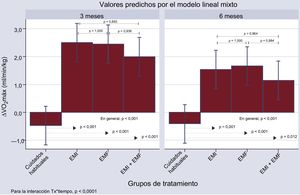
El modelo de efectos mixtos para las medidas repetidas mostró un aumento significativo del Δ-VO2máx con el EMI, la EMF y EMI + EMF a las 12 y las 24 semanas (figura 2). Cuando se utilizó el grupo sometido a los cuidados habituales como categoría de referencia, el aumento neto de la media en el Δ-VO2máx a las 12 semanas fue de 2,98, 2,93 y 2,47 con el EMI, la EMF y EMI + EMF respectivamente (en general, p < 0,001); además, el contraste individual entre cada grupo de tratamiento activo y los cuidados habituales fue significativo (figura 2). A las 24 semanas este efecto significativo persistía, aunque menos intensamente, con valores netos de Δ-VO2máx de 1,95, 2,08 y 1,56 con EMI, EMF y EMI + EMF respectivamente (en general, p < 0,001). No se documentaron diferencias estadísticamente significativas en el Δ-VO2máx a las 12 ni a las 24 semanas al comparar los 3 grupos activos (figura 2).
Comparación intraindividualEn general, se constató una disminución de los valores de Δ-VO2máx de -0,96, -0,78 y -0,85 con EMI, EMF y EMI + EMF en las comparaciones a las 24 y las 12 semanas (en general, p < 0,001); no se documentaron cambios significativos en el grupo tratado con cuidados habituales (+0,06; p = 0,84).
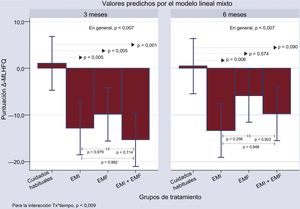
Criterios de valoración secundariosPuntuación del Minnesota Living with Heart Failure QuestionnaireEn general, los 3 grupos de tratamiento activo mostraron una disminución significativa en la puntuación del Δ-MLHFQ comparado con el grupo de cuidados habituales a las 12 semanas (figura 3), mientras que no se produjeron cambios importantes en el grupo de cuidados habituales. La comparación con el grupo de cuidados habituales reveló una disminución media neta de 13,85, 10,91 y 16,34 en los grupos de EMI, EMF y EMI + EMF (p ≤ 0,005 en todas la comparaciones) a las 12 semanas. El efecto persistía con el EMI y fue marginal con EMI + EMF. El efecto de la EMF dejó de ser significativo (figura 3).
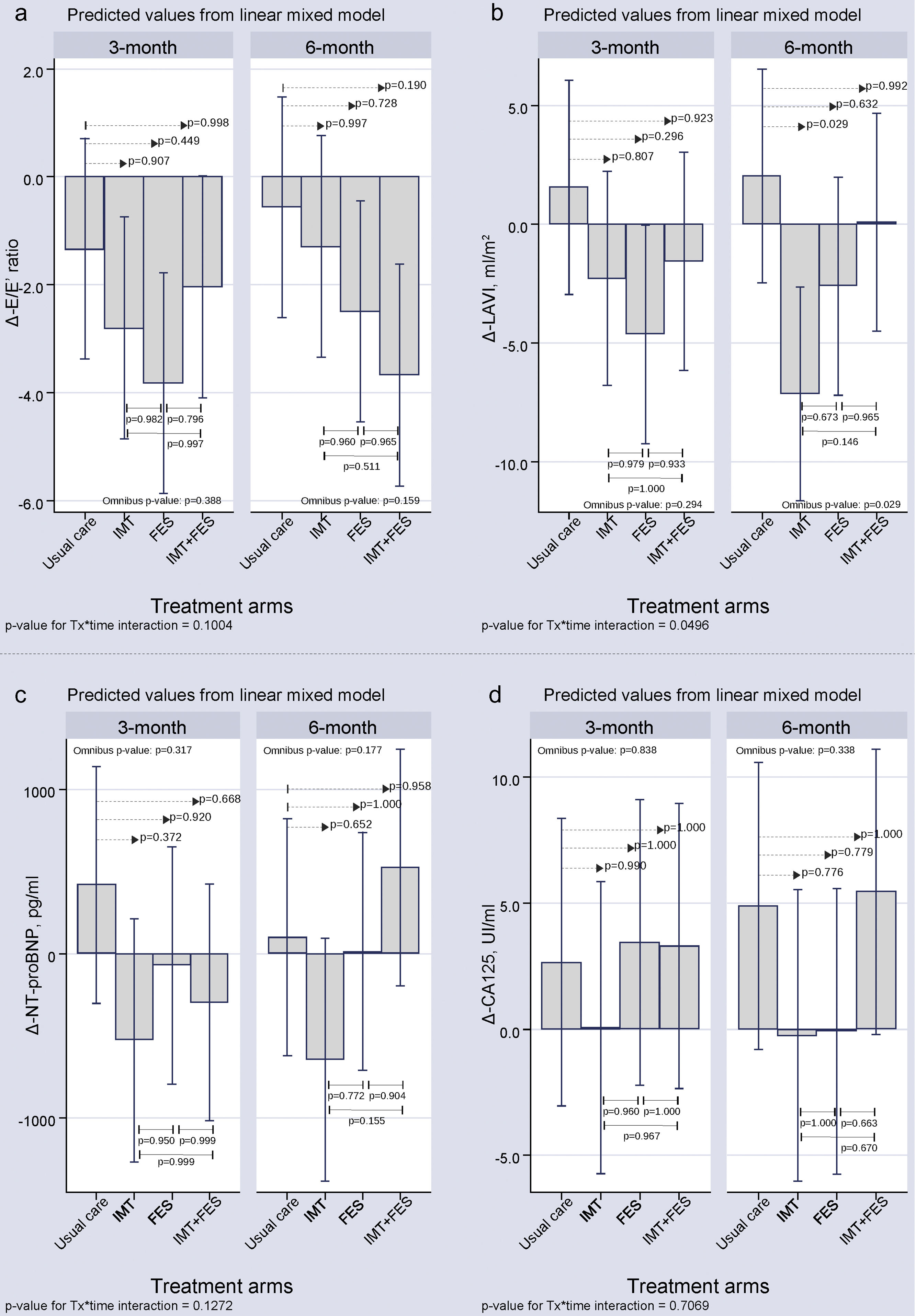
Parámetros ecocardiográficosEn todos los grupos de tratamiento se constató una disminución del cociente Δ-E/Ea en las visitas realizadas a las 12 y 24 semanas (). No obstante, a las 12 y las 24 semanas no se observaron diferencias significativas en ninguno de los grupos de tratamiento activo frente al grupo de cuidados habituales. El índice Δ-volumen de la aurícula izquierda a los 3 meses mostró ausencia de diferencias significativas entre cualquier grupo de tratamiento activo y el de cuidados habituales. En la visita a los 6 meses, tuvo lugar una disminución significativa del índice de Δ-volumen de la aurícula izquierda solo en el grupo de EMI comparado con los cuidados habituales (-9, 20; p = 0,029) ().
Parámetros de laboratorioNo se observaron diferencias significativas en Δ-NT-proBNP y Δ-CA125 entre los distintos grupos de tratamiento a los 3 y los 6 meses ().
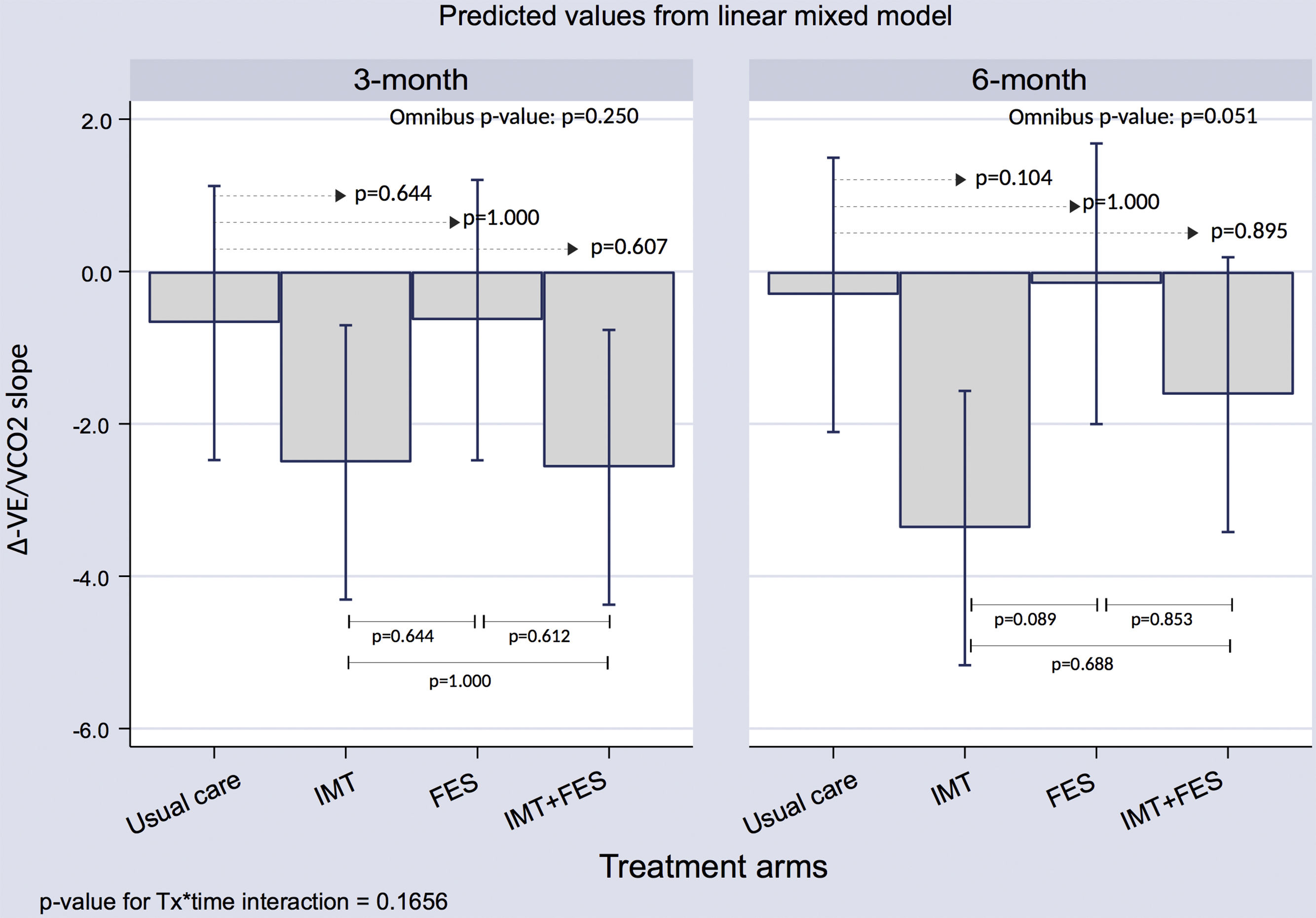
Análisis exploratoriosGradiente VE/VCO2No se observaron diferencias significativas en la eficiencia respiratoria entre los distintos grupos de tratamiento a los 3 y los 6 meses ().
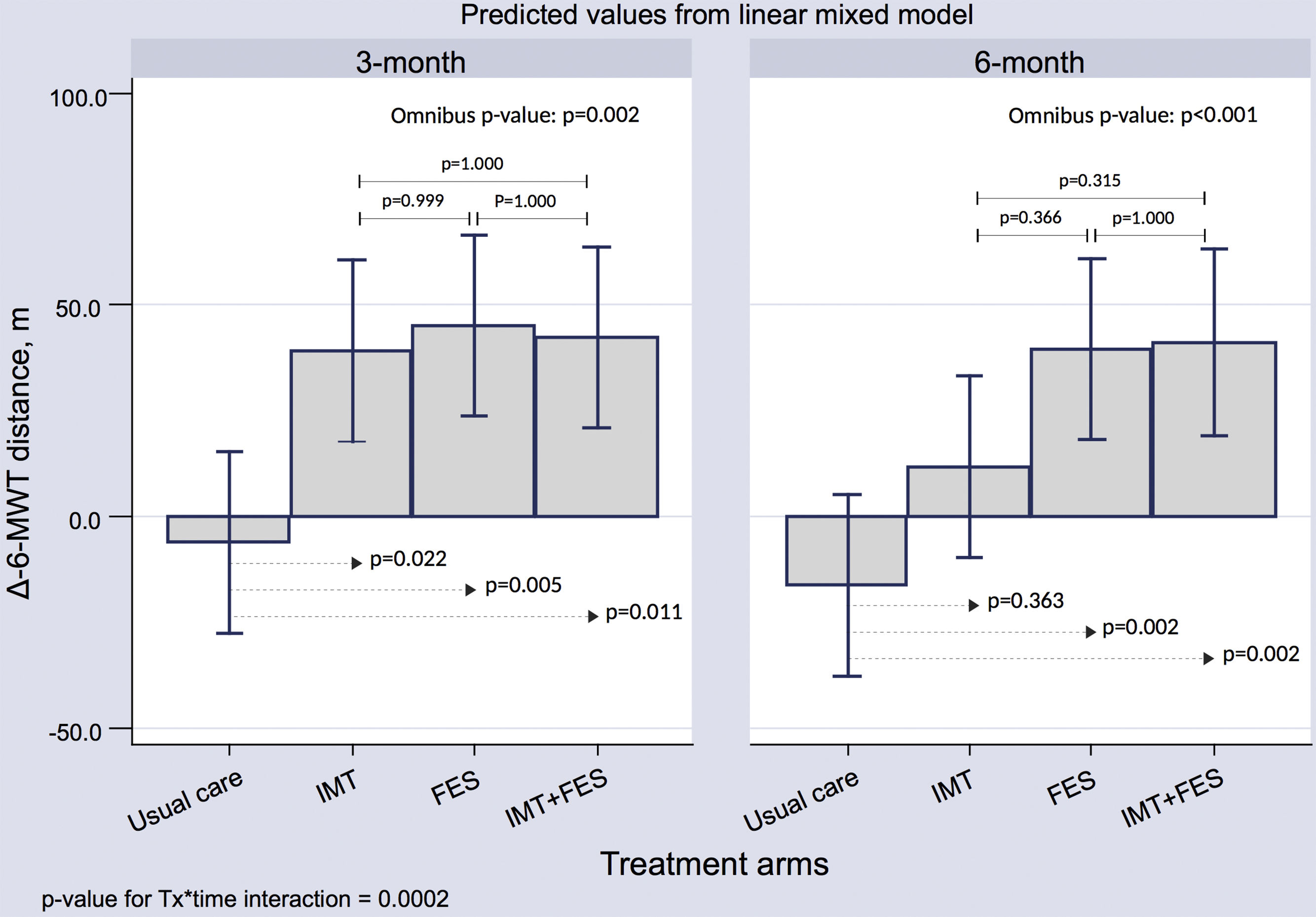
Test de los 6min de marchaEn los 3 grupos de tratamiento activo se observó una mejora significativa en la distancia recorrida en la visita a los 3 meses comparado con los cuidados habituales (p < 0,05 en todos los casos). A los 6 meses, este efecto favorable persistía en los grupos sometidos a EMF y EMI + EMF ().
SeguridadA los 6 meses de seguimiento, habían fallecido 3 personas —EMI (n = 1), EMF (n = 1) y EMI + EMF (n = 1)— y se habían producido 8 episodios de IC aguda descompensada —cuidados habituales (n = 4), EMI + EMF (n = 2) y EMI (n = 2)—. No se observaron diferencias significativas entre los distintos grupos de tratamiento en lo que respecta al resultado combinado de muerte e IC aguda descompensada (p = 0,44).
DISCUSIÓNEn este estudio controlado y aleatorizado, las 3 intervenciones activas de terapia física (EMI, EMF y EMI + EMF) dieron como resultado una mejoría sustancial del VO2máx y la CdV a las 12 semanas. El efecto en el VO2máx disminuyó de magnitud a las 24 semanas, pero se mantuvo significativo en todos los grupos activos. El efecto favorable en la CdV persistió durante 24 semanas en el grupo sometido únicamente a EMI. No se observaron cambios considerables en los índices ecocardiográficos y los biomarcadores utilizados como criterios de valoración. Hasta la fecha, el TRAINING-HF es el primer ensayo llevado a cabo en pacientes con IC-FEc que evalúa el efecto del EMF, la EMI y su combinación en la capacidad funcional máxima a corto y medio plazo. En general, estos resultados destacan la eficacia del EMI, la EMF y su combinación en la mejoría de la capacidad funcional de los pacientes con IC-FEc.
Terapias físicas en la insuficiencia cardiaca con función sistólica conservadaEjercicio físicoLos pacientes con IC-FEc suelen ser añosos, predominantemente mujeres, con alta prevalencia de comorbilidades cardiovasculares1,2,21 y no cardiovasculares como obesidad, inestabilidad del equilibrio o limitaciones ortopédicas21. Esta infinidad de comorbilidades desempeña un papel importante en el fomento de la inactividad, la ausencia de condicionamiento y la atrofia muscular progresiva22, que a la larga altera gravemente la capacidad funcional de estos pacientes23. El entrenamiento con ejercicios aeróbicos puede mejorar considerablemente la capacidad funcional de los pacientes obesos y sexagenarios con IC-FEc15. Sin embargo, la viabilidad de los programas convencionales de rehabilitación cardiaca basados en el ejercicio para pacientes ancianos con IC-FEc avanzada es más cuestionable; en realidad, los datos procedentes de los registros actuales sobre IC han puesto de relieve que estos pacientes tienen menos probabilidad de remitirse a programas de rehabilitación cardiaca basados en el ejercicio después de un ingreso por IC24.
Entrenamiento de la musculatura inspiratoriaEn un estudio piloto previo realizado con 26 pacientes con IC-FEc sintomática16, se observó que un protocolo de EMI de baja intensidad se asociaba con importantes mejoras en la capacidad para realizar ejercicio y la CdV. Los resultados del presente estudio no solo confirmaron hallazgos previos (a los 3 meses la magnitud del Δ-VO2máx era similar en los 2 estudios: +2,9 y 2,7 ml/min/kg), sino que los efectos favorables perduraban en el seguimiento a los 6 meses. Curiosamente, la magnitud del efecto favorable del EMI en el VO2máx era comparable a la hallada en los pacientes con IC y fracción de eyección reducida25-27.
Electroestimulación muscular funcionalHasta la fecha, solo 1 ensayo aleatorizado ha analizado los efectos de esta intervención pasiva en pacientes con IC-FEc17. Karavidas et al.17 incluyeron a 30 pacientes con una media de edad de 69 ± 8 años, y mostraron que la EMF mejora la capacidad funcional (evaluada por la distancia recorrida en el test de los 6min de marcha), la CdV y la función endotelial sin producir cambios en los biomarcadores o los parámetros diastólicos a las 6 semanas. Estos resultados concuerdan con aquellas observaciones, pero también amplían las ventajas funcionales de la EMF a un subgrupo de pacientes de más edad y con una IC-FEc más grave. Tal como se ha explicado con el EMI, la magnitud de la mejoría funcional observada en ambos ensayos concuerda con los resultados obtenidos en pacientes con IC y fracción de eyección reducida tratados con la misma modalidad de EMF (programa de corta duración, con un tiempo total de estimulación < 30 h)28.
Combinación de terapias físicas (EMI + EMF)El protocolo combinado mejoró el VO2máx durante el seguimiento, pero no fue superior al programa de EMI o EMF. Esta falta de efecto gradual indica que en los pacientes con IC-FEc el margen de mejoría con este tipo de protocolos sería pequeño. Así pues, se cree que, una vez alcanzado este umbral con cualquiera de las intervenciones (EMI o EMF), no puede obtenerse ningún otro efecto aunque estas se combinen.
Plausibilidad biológicaAunque no era el objetivo de este estudio analizar los mecanismos fisiológicos que subyacen a los efectos de estas terapias físicas, se han postulado varios mecanismos posibles para explicar los efectos favorables del EMI y la EMF en la capacidad funcional de los pacientes con IC-FEc. Estos son: a) un retraso en la aparición de fatiga diafragmática, que lleva a una reducción en la captación de los músculos respiratorios accesorios y, en definitiva, a una mejora en la eficiencia respiratoria26,29; b) atenuación del reflejo presor inducido por ejercicio en el músculo esquelético30; c) aumento de la fuerza muscular y la masa muscular y mejora de la capacidad aeróbico-oxidativa14,31, y d) mejoría de la función endotelial17.
Curiosamente, no se documentaron alteraciones cardiacas estructurales o funcionales con el EMI o la EMF en el tratamiento de pacientes con IC-FEc que pudieran explicar su efecto favorable16,17. En este estudio, tampoco se pudo documentar cambios sustanciales en el cociente E/Ea, el volumen de la aurícula izquierda, los péptidos natriuréticos y el CA125 (un marcador de la congestión) a pesar de las mejoras en la capacidad de ejercicio y la CdV. Los efectos extracardiacos que no están directamente relacionados con la mejoría de la función cardiaca pueden desempeñar un papel importante en el efecto favorable de estas intervenciones.
Implicaciones clínicasTanto el EMI como la EMF son intervenciones simples, de bajo coste e inocuas que podrían implementarse en programas de ejercicio en el domicilio tras un corto periodo de entrenamiento. Según nuestras observaciones, los programas de EMI y EMF en el domicilio son alternativas adecuadas, factibles y efectivas para mejorar la capacidad de ejercicio y la CdV de los pacientes con IC-FEc, y pueden actuar como «terapias puente» a programas convencionales de rehabilitación cardiaca basados en el ejercicio.
Limitaciones del estudioHay que señalar varias limitaciones. En primer lugar, como es un estudio unicéntrico, la generalización de estos resultados a otras poblaciones puede estar limitada. Segundo, es posible que la baja potencia estadística pueda explicar los resultados negativos de las intervenciones en los criterios de valoración de los biomarcadores ecocardiográficos y cardiacos. Tercero, la aplicabilidad de estos resultados no puede extrapolarse directamente a los pacientes con formas más leves de la enfermedad. Cuarto, en pacientes asignados a grupos de tratamiento activo, no puede descartarse un efecto placebo en algunos criterios de valoración tales como la CdV. Por último, no se evaluaron los efectos funcionales y clínicos de la EMF y el EMI a largo plazo (> 24 semanas).
Además, aunque algunas variables —como parte de las características basales— mostraron tendencia a diferir estadísticamente entre los distintos grupos de tratamiento, se optó por no incluirlas en ninguno de los análisis de resultados para evitar el sobreajuste del modelo.
CONCLUSIONESEn este estudio controlado y aleatorizado, una intervención de 12 semanas de EMI, EMF, o EMI + EMF en pacientes con IC-FEc y capacidad aeróbica reducida se relacionó con una mejora importante de la capacidad de ejercicio y la CdV. Se requieren más estudios para confirmar estos resultados y elucidar los mecanismos fisiopatológicos subyacentes a estos efectos favorables. Estas 2 terapias físicas pueden convertirse en tratamientos estándar para pacientes con IC-FEc.
FINANCIACIÓNEste trabajo contó con la financiación parcial de la Sociedad Española de Cardiología, Investigación Clínica en Cardiología, beca SEC 2015; CIBERCV 16/11/00420, 16/11/00403; FEDER y PIE15/00013.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
Aunque la IC-FEc se ha convertido en la forma más corriente de IC en los países desarrollados, actualmente no hay ningún tratamiento efectivo y basado en la evidencia para esta enfermedad.
- –
El rasgo clínico característico de la IC-FEc es una reducción grave de la capacidad funcional que limita las actividades de la vida diaria de los pacientes y es un determinante importante de mal pronóstico y mala CdV.
- –
Terapias físicas como el EMI y la EMF mejoran la capacidad de ejercicio y la CdV de los pacientes con IC y fracción de eyección reducida; no obstante, hay pocos indicios que respalden su viabilidad y utilidad clínica en la IC-FEc.
- –
Es el primer ensayo en pacientes con IC-FEc que evalúa el efecto del EMF, la EMI y la combinación de ambos en la capacidad funcional máxima a corto y medio plazo.
- –
En general, estos resultados destacan la eficacia del EMI, la EMF y su combinación en la mejora de la capacidad funcional y la CdV de los pacientes con IC-FEc.
- –
Tanto el EMI como la EMF son intervenciones simples, de bajo coste e inocuas que podrían implementarse en programas de ejercicio en el domicilio.
- –
Los programas de EMI y EMF son alternativas adecuadas, factibles y efectivas para los pacientes con IC-FEc y pueden actuar como «terapias puente» a programas convencionales de rehabilitación cardiaca basados en el ejercicio.