Palabras clave
INTRODUCCIÓN
La angioplastia transluminal coronaria percutánea (ACTP) es una técnica de tratamiento aceptado y efectivo para la enfermedad aterosclerosa coronaria. Sin embargo, el fenómeno de la reestenosis angiográfica coronaria acontece entre un 30-60% de los pacientes después de la angioplastia coronaria con balón1,2. Los mecanismos relacionados con el proceso reestenótico incluyen el «recoil» elástico de la arteria, la formación local de trombo, el remodelado vascular y la respuesta proliferativa neointimal2-5. La hiperplasia neointimal se produce por la migración y proliferación de las células musculares lisas y miofibroblastos y por la deposición de matriz extracelular proveniente de estas células musculares lisas tras el daño inducido por el balón de angioplastia5-7. La introducción del stent en el arsenal del cardiólogo intervencionista consiguió reducir la tasa de reestenosis a un 15-20% de los casos8,9, al ser capaz de prevenir tanto el «recoil» elástico como el remodelado negativo del vaso10. Sin embargo, la tasa de reestenosis después de la implantación de un stent permanece elevada, especialmente en los casos en que se tratan vasos pequeños o lesiones largas, donde puede llegar a un 30% de los casos11. La reestenosis después de la implantación de un stent está causada primariamente por hiperplasia neointimal inducida por el traumatismo de los «struts» del stent sobre la pared vascular. Su tratamiento con las técnicas convencionales (angioplastia con balón o debulking previo) es bastante desalentador, obteniéndose una tasa de reestenosis de entre un 27-63%, la cual incluso puede aumentar con el número de reintervenciones que se realicen12-14.
En tanto que la radioterapia ha sido efectiva en aquellos procesos con una importante actividad fibroblástica, como las cicatrices queloideas o el pterygium ocular15,16, se pensó en la posibilidad que este tratamiento, administrado de forma coadyuvante, podría inhibir la reestenosis después del intervencionismo coronario percutáneo.
Historia
Friedman et al llevaron a cabo el primer estudio experimental en 1964, utilizando como isótopo radiactivo el iridio 192 (192Ir) en conejos hipercolesterolémicos17. En 1992, Liermann et al realizaron en Frankfurt los primeros 4 casos de braquiterapia en pacientes que habían sido sometidos a una angioplastia femoral percutánea18. Una segunda ola de estudios experimentales se llevó a cabo en los EE.UU.: Wiedermann y Weinberger en Nueva York19, Waksman y Crocker en Atlanta20 y Mazur y Raizner en Houston21. Paralelamente, en Europa, Verin y Popowski irradiaron arterias carótidas e ilíacas de conejos con el emisor β puro 90ytrio (90Y)22. La primera experiencia clínica en arterias coronarias humanas fue realizada por Condado et al en Venezuela, quienes insertaron una guía de 192Ir en el interior de un catéter no centrado en la luz del vaso por medio de un dispositivo de liberación manual23, y por Verin et al, quienes utilizaron una fuente β y un catéter centrado en la luz del vaso24. Ambos estudios demostraron que la administración de radiación en el interior de la arteria coronaria es factible y segura, aunque la tasa de reestenosis observada en estos estudios seguía siendo elevada. Posteriormente, el primer estudio aleatorizado diseñado para demostrar la eficacia de la radiación γ en la prevención de la reestenosis después del tratamiento percutáneo25 comunicó resultados muy prometedores. Este hecho animó a los investigadores a desarrollar nuevos sistemas y a diseñar nuevos estudios que servirían para objetivar el verdadero potencial de esta nueva técnica.
Sistemas de radioterapia intracoronaria
La radiación puede administrarse con sistemas de radioterapia externa (teleterapia) o bien por medio de sistemas de braquiterapia los cuales, a su vez, pueden utilizar sistemas con catéter (catheter-based systems) o bien stents radiactivos26. La braquiterapia por catéter permite la utilización de emisores β o γ, los cuales pueden ser enviados al segmento coronario a tratar de forma manual o automática. Asimismo, la tasa de dosis puede ser alta (del orden de 5 Gy/min cuando se utilizan isótopos β) o baja (del orden de 1 Gy/min cuando se utilizan emisores γ). Los stents radiactivos utilizan principalmente emisores β puros con una tasa de dosis muy baja (del orden de 0,4 cGy/h). Así, con los sistemas por catéter la dosis prescrita se administra en un período de tiempo que va desde los 3 min para la radiación beta hasta los 25 min para la radiación γ, mientras que en el caso del stent radiactivo la dosis prescrita se administra en meses. En la tabla 1 se expone una lista de los isótopos más comúnmente utilizados en braquiterapia intracoronaria.
FISIOPATOLOGÍA DE LA RADIACIÓN INTRACORONARIA
Tejido y célula blanco de la braquiterapia
Numerosos estudios experimentales han demostrado reducciones significativas del grado de hiperplasia neointimal cuando la radiación β o γ se administra inmediatamente antes o después de la ACTP19,22. Sin embargo, el mecanismo por el cual la radiación puede prevenir la reestenosis no se conoce por completo. Recientemente se ha identificado el papel potencial de la adventicia en el proceso reestenótico27. En este sentido, la proliferación celular y la síntesis de factores de crecimiento han demostrado ser más importantes en la adventicia que en la capa media en las fases iniciales después de la ACTP. Estas células adventiciales migrarían hacia la media contribuyendo a la masa celular en la neoíntima27. Experimentos posteriores28 demostraron que el número de células adventiciales en proliferación podía ser reducido de forma significativa tras la administración de radiación ionizante (tanto por medio de una fuente de 90estroncio/ytrio (90Sr/Y) o una fuente de 192Ir). Asimismo, la migración de estas células proliferantes también quedaba inhibida. Por otra parte, el reclutamiento de fibroblastos α-actina positivo en la adventicia a los 14 días de un daño inducido por la distensión de un balón de angioplastia resultaba reducido con la radiación intracoronaria, hecho que sugería una inhibición de la fibrosis adventicial y, por consiguiente, una inhibición del remodelado vascular constrictivo28. De estas observaciones experimentales se podría inferir que la capa de tejido blanco de la braquiterapia es la adventicia. Más controversia existe en la identificación de la célula blanco dentro de la capa adventicial. Recientemente se ha propuesto la hipótesis unificada para la reestenosis vascular29. Según esta teoría, la célula que desempeña un mayor papel en la reestenosis postangioplastia coronaria sería la misma que iniciaría el proceso aterosclerótico, esto es, el macrófago derivado del monocito. Esta célula es la más radiosensible de las células de la pared arterial y actuaría como inductora o «trigger» para la proliferación, migración y conversión fenotípica de los fibroblastos adventiciales a miofibroblastos29.
Evidencias clínicas de los estudios de factibilidad
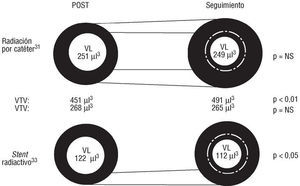
El efecto de la radiación intracoronaria sobre el remodelado vascular ha sido demostrado clínicamente en el estudio BERT. En este estudio, la braquiterapia se administraba a través de un sistema no centrado (Sistema Beta-Cath™, Novoste Corporation) que utiliza el emisor β puro 90Sr/Y. La dosis prescrita era aleatorizada a 12, 14 o 16 Gy a 2 mm de la fuente30. En un estudio volumétrico cuantitativo mediante ecografía intracoronaria (IVUS) en los segmentos irradiados después de angioplastia con balón, el volumen total del vaso (volumen limitado por la membrana elástica externa) sufrió un incremento significativo durante los 6 meses de seguimiento. Este aumento en el tamaño total del vaso (remodelado positivo) fue capaz de acomodar un incremento paralelo en el volumen de la placa (placa + media). Como resultado, el volumen luminal permanecía sin cambios a los 6 meses de seguimiento (fig. 1)31. Esta evolución morfológica no quedaba inhibida por la implantación de un stent coronario en el segmento irradiado. Este hecho ha sido constatado en una cohorte de pacientes tratados por medio de un sistema centrado (Sistema Guidant™) que utiliza el isótopo β puro 32fósforo (32P)32.
Fig. 1. Efecto de la braquiterapia basada con catéter en las estructuras vasculares. El volumen total del vaso aumentó significativamente durante el seguimiento después de angioplastia con balón y radiación. Este remodelado compensador fue paralelo a un incremento medio en el volumen de placa. Como consecuencia el volumen luminal permaneció sin cambios. VTV: volumen total del vaso; VL: volumen luminal, (datos extraídos de Sabaté et al31).
Distinta evolución se ha observado después de la implantación de un stent radiactivo33. Tanto en un grupo de pacientes que recibieron stents radiactivos (Isotentstm) de baja (0,75-1,5 μCi) o alta (6-12 μCi) actividad, el remodelado vascular estaba abolido por fuera de los límites del stent, a la vez que la hiperplasia intimal intra-stent se inhibía de manera dependiente de la dosis33,34. Diferencias en actividad y tasa de dosis (sistemas por catéter: alta actividad-alta tasa de dosis; stent radiactivo: baja actividad-baja tasa de dosis) pueden ser responsables de este patrón de evolución morfológica distinto entre ambos sistemas de braquiterapia.
El efecto de la braquiterapia sobre la funcionalidad del vaso coronario ha sido evaluada en segmentos coronarios irradiados (mediante un sistema no centrado) después de angioplastia con balón35. A los 6 meses de seguimiento, la respuesta vasomotora dependiente del endotelio (estudiada mediante la infusión de dosis crecientes de acetilcolina intracoronaria) estaba preservada en la mayoría de segmentos coronarios irradiados. Este hallazgo contrastaba con el que presentaban aquellos segmentos no tratados distales a la región de la angioplastia o aquellos segmentos coronarios de un grupo control de pacientes tratados mediante angioplastia con balón y sin irradiación intracoronaria. No obstante, es importante resaltar el hecho de que, en esta cohorte de pacientes, la dosis calculada en la íntima fue relativamente baja (8,2 ± 3 Gy). Por tanto, el efecto de dosis más elevadas o de sistemas de liberación que permitan una distribución de la dosis más homogénea no fueron evaluados en este estudio. Sin embargo, estos hallazgos clínicos fueron concordantes con trabajos experimentales en los que la función endotelial estaba preservada durante el seguimiento después de altas dosis (20 Gy) de radiación γ36. Una posible explicación del efecto protector de la braquiterapia podría obtenerse de un modelo experimental de arterias coronarias porcinas sometidas a daño por distensión inducido por un balón con placebo o radiación37. En dicho modelo, en el grupo irradiado la expresión de la enzima óxido nítrico sintasa-inducible (iNOS), responsable de la producción de óxido nítrico, estaba aumentada, mientras que la expresión del factor de crecimiento transformador de la citocina β1 (TGF- β1) estaba suprimido. iNOS es potencialmente responsable de la inhibición de la hiperplasia neointimal y de la estimulación de la reendoteliazación, mientras que TGF- β1 incrementaría la hiperplasia intimal y la fibrosis al modular negativamente la expresión de iNOS37. En contraste con estos hallazgos, un estudio reciente experimental38 demostró que la combinación de ACTP e irradiación reducía la relajación dependiente de óxido nítrico inducida por la sustancia P. Por tanto, quedaría por establecer la repercusión funcional real de estos distintos hallazgos en la práctica clínica.
LIMITACIONES DE LA BRAQUITERAPIA INTRACORONARIA
Formación aneurismática
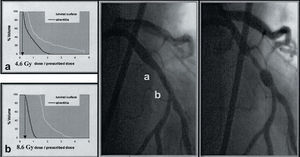
Teóricamente, el efecto positivo de la radiación intracoronaria sobre el remodelado vascular observado en los primeros 6 meses de seguimiento podría inducir la formación de un aneurisma coronario en la zona tratada. La incidencia de formación aneurismática después de ACTP, definida como aquella dilatación coronaria que excede en 1,5 veces el diámetro de referencia de los segmentos coronarios adyacentes angiográficamente normales, oscila entre un 3,4 y un 5,4%, y en principio no se ha asociado al desarrollo de reestenosis angiográfica o a una evolución clínica desfavorable39. La incidencia de este acontecimiento después de un tratamiento con braquiterapia intracoronaria se desconoce. Condado et al23 describieron 4 casos (20%) de aneurisma coronario que se desarrollaron a los 2 meses del tratamiento con radiación γ. En dos de ellos se observó un incremento tardío del diámetro del vaso a los 6 y 8 meses del tratamiento, permaneciendo desde entonces invariable hasta los 5 años de seguimiento (Condado JA, comunicación personal, Cardiovascular Radiation Therapy IV, Washington, febrero 2000). Este fenómeno se relacionó con una dosis elevada de radiación recibida por los segmentos coronarios tratados. Así, aunque la dosis prescrita oscilaba entre 20 y 25 Gy a 1,5 mm de profundidad, la dosis real calculada a posteriori osciló entre 19 y 55 Gy23. En una cohorte de pacientes incluidos en el estudio BERT-1,5 (Rotterdam arm) se demostró un caso de aneurisma coronario en el segmento irradiado. Además, esta dilatación coronaria se acompañó de un incremento focal de placa dentro de la región irradiada que producía reestenosis del vaso coronario31. En un análisis subsegmentario de la dosis recibida en ambas zonas (reestenótica y aneurimática) se objetivó una clara falta de homogeneidad de la distribución de la dosis. Así, el segmento reestenótico recibió en la adventicia la mitad de la dosis que la que recibió el segmento aneurismático (4,6 frente a 8,6 Gy, respectivamente; fig. 2). Asimismo, la presencia de una disección coronaria inducida por la ACTP podría haber precipitado el desarrollo de la formación aneurismática en el contexto de una dosis de radiación relativamente elevada. Sin embargo, esta hipótesis no ha sido confirmada hasta el momento, ya que no se han descrito nuevos casos de aneurisma coronario después de ACTP y braquiterapia intracoronaria a pesar de haber incrementado la dosis prescrita en los estudios más recientes.
Fig. 2. Dilatación aneurismática y reestenosis en un paciente tratado con radiación beta después de angioplastia con balón. La dosis recibida por la adventicia, calculada mediante histogramas dosis-volumen, difiere sustancialmente entre ambas zonas de interés. A: región reestenótica (4 ,6 Gy). B: región aneurismática (8,6 Gy).
Oclusión trombótica tardía
La incidencia de trombosis tardía post-ACTP (después de un mes) en la era del tratamiento profiláctico con aspirina y ticlopidina o clopidogrel (durante 15 días a 1 mes) es anecdótica40. Sin embargo, este fenómeno llegó a ser aparente y inesperadamente frecuente ya en las primeras series de pacientes tratados con radiación intracoronaria. Así, en los primeros 92 pacientes tratados en el Thoraxcenter con radiación β intracoronaria, la incidencia de trombosis tardía con acontecimientos clínicos mayores (infarto de miocardio o fibrilación ventricular) llegó a ser del 6,6% de los casos entre los 2 y 15 meses después del tratamiento (fig. 3)41. Posteriormente, este hecho fue confirmado en las series americanas de pacientes tratados con radiación γ. Así, de las series de pacientes incluidos en los estudios WRIST, Long-WRIST, SVG-WRIST, GAMMA-1 y BETA-WRIST se calculó una incidencia de oclusión trombótica tardía del 9,1% comparada con el 1,2% en los pacientes que recibieron placebo a los 5,4 ± 3 meses después del procedimiento42. La implantación de un stent convencional dentro de la región irradiada se ha considerado un factor que contribuye de manera importante al desarrollo de este fenómeno. En este sentido, la incidencia de trombosis tardía en la cohorte de pacientes que recibieron un stent llegó a ser de hasta un 8,8% en la serie de Rotterdam y de hasta un 14,6% en la serie americana. El retraso en la endotelización del stent como consecuencia de la braquiterapia podría ser el precursor de este acontecimiento43. Asimismo, existe la posibilidad que la braquiterapia indujera una malaposición tardía del stent al no ser capaz de seguir el remodelado positivo del vaso promovido por la radiación44,45. Por otro lado, en aquellos pacientes tratados únicamente por medio de angioplastia con balón, la persistencia de disecciones coronarias inducidas por el balón que no han sido selladas es un hallazgo frecuente a los 6 meses de seguimiento46. La posible influencia de estas disecciones coronarias persistentes con la trombosis tardía debe ser dilucidada (fig. 3).
Fig. 3.< /font> Trombosis tardía después de braquiterapia. A: estenosis severa en el segmento medio de la coronaria derecha. B: buen resultado angiográfico después de angioplastia con balón y radiación. Sin embargo, por ecografía intracoronaria se aprecia en la zona tratada una disección submedial (flecha) que crea una doble luz (f: falsa luz; t: verdadera luz). C: tres meses después see videncia oclusión trombótica del vaso.
Esta evidencia clínica tiene su correlato experimental47. En un análisis retrospectivo de secciones de tejido de 51 modelos porcinos juveniles (76 arterias coronarias) sometidos a daño por distensión inducido por el balón, seguido de radiación con dosis entre 0 y 18 Gy, se demostró un incremento dependiente de la dosis de la tasa de trombo a los 14 días del tratamiento. Sin embargo, este incremento en la tasa de trombo se producía a expensas de un incremento del trombo mural más que a un incremento del trombo luminal47.
También se ha comunicado la trombosis tardía después de la implantación de un stent radiactivo en el Milan Dose-Response Study34. Este registro incluía 122 32P stents radiactivos emisores β implantados en 91 lesiones de 82 pacientes. Tres niveles de actividad fueron estudiados: 0,75-3,0 μCi (n = 23), 3,0-6,0 μCi (n = 29) y 6,0-12 μCi (n = 30). Uno de los pacientes del grupo de elevada actividad presentó trombosis tardía del stent a los 3 meses de seguimiento tras haber suspendido tanto la aspirina como la ticlopidina. Estudios patológicos demostraron que la neoíntima de los stents de elevada actividad (3,0-23 μCi) consistía en fibrina, eritrocitos, células inflamatorias ocasionales y células musculares lisas con endotelización parcial de la superficie luminal48.
Los últimos datos clínicos presentados indican que un tratamiento a largo plazo con 2 fármacos antiplaquetarios (aspirina y clopidogrel) previene la incidencia de este fenómeno49. Por tanto, en la actualidad se considera imprescindible mantener dicha combinación farmacológica como mínimo 6 meses en aquellos pacientes sin nuevo stent y hasta 1 año en pacientes con un nuevo stent implantado.
Efecto borde (efecto candy wrapper)
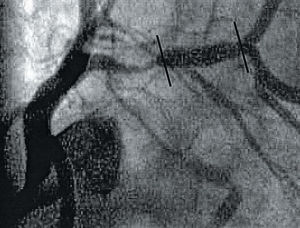
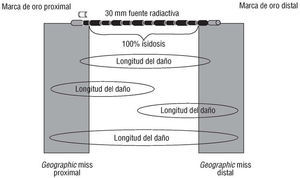
Una limitación importante de la braquiterapia intracoronaria es el desarrollo de lesiones estenóticas nuevas en los extremos o bordes del segmento coronario irradiado (fig. 4). Este efecto «borde», también llamado candy wrapper, al recordar la imagen angiográfica de estas estenosis al envoltorio de un caramelo, fue descrito originariamente después de la implantación de un stent radiactivo de moderada actividad (> 3 μCi)34. Sin embargo, este fenómeno no es exclusivo del stent radiactivo, pudiendo afectar a los segmentos coronarios irradiados con los sistemas con catéter31. El daño vascular50 concomitantemente con dosis bajas de radiación recibidas en los extremos del segmento irradiado51 pueden estar implicadas en la fisiopatología de este fenómeno. Para integrar ambos componentes se ha propuesto un nuevo concepto en cardiología intervencionista: el geographic miss52. Este concepto ha sido redefinido del mismo término radiooncológico que describe una causa de fracaso del tratamiento debido a dosis bajas de radiación. En estos casos, una pequeña parte de la zona a tratar no ha sido adecuadamente irradiada debido a que el volumen total tumoral es mayor de lo esperado o bien el margen establecido ha sido insuficiente para cubrir el tumor por completo53. Teóricamente, estas condiciones pueden producirse cuando se dañan los extremos del segmento irradiado, donde por definición la dosis recibida es bastante baja (fig. 5). En un análisis retrospectivo52 de 50 pacientes consecutivos tratados con radiación β después de angioplastia con balón o stent, la incidencia de este acontecimiento fue del 32%. Las siguientes causas indujeron a incurrir en el geographic miss: a) desarrollo de complicaciones derivadas del procedimiento que hicieron extender la zona de tratamiento más allá de los márgenes del segmento irradiado; b) falta de disponibilidad de fuentes de radiación lo suficientemente largas para cubrir la zona de tratamiento, y c) error en el posicionamiento de la fuente radiactiva sobre la zona tratada. En los extremos con geographic miss se demostró, por medio de análisis coronario cuantitativo, una pérdida luminal tardía significativamente mayor (0,84 ± 0,6) comparada con la de los segmentos irradiados por completo (0,15 ± 0,4) y la de los bordes no dañados durante el procedimiento (0,09 ± 0,4; p < 0,0001). Asimismo, la tasa de reestenosis binaria fue significativamente mayor en los bordes con geographic miss (fig. 5).
Fig. 4. Reestenosis objetivada a los 4 meses de seguimiento en el extremo proximal de un stent radioactivo (entre marcas).
Fig. 5. Concepto de geographic miss. Nótense las distintas posibilidades de crear daño en los extremos de la zona irradiada.
Conceptualmente, la incidencia de geographic miss después de la implantación de un stent radiactivo es del 100%, ya que la longitud del balón sobre el que el stent está premontado es siempre más larga que el propio stent. Por tanto, ambos extremos están siempre dañados en el momento de la implantación y siempre reciben dosis bajas de radiación. Este hecho podría explicar el hecho de que en el Milan Dose-Response Study la incidencia de reestenosis sea alta (52% en el grupo de baja actividad, 41% en el de moderada actividad y 50% en el de elevada actividad) y mayoritariamente a expensas de la alta tasa de reestenosis en los bordes del stent radiactivo (31% en el grupo de baja actividad, 38% en el de moderada actividad y 39% en el de elevada actividad)34. Asimismo, los autores identificaron la razón balón-arteria como factor asociado al desarrollo de las estenosis de los bordes del stent34. Estudios cuantitativos volumétricos mediante ecografía intracoronaria demostraron que la ausencia de remodelado positivo, o incluso el desarrollo de un remodelado negativo junto al crecimiento de la placa aterosclerosa, eran los contribuyentes principales en la reducción de la luz vascular a ambos extremos del segmento irradiado, ya sea por medio de los sistemas de braquiterapia con catéter31 o bien por medio del stent radiactivo33,34.
El uso de balones rectangulares para implantar el stent radiactivo, stents con extremos fríos (cold-end stent) o calientes (hot-end stent), stents emisores * o bien técnicas híbridas (stent radiactivo con sistemas con catéter para irradiar los extremos) han sido propuestos para minimizar este efecto desfavorable54. Sin embargo, los resultados de estudios clínicos con estos nuevos diseños de stent radiactivo no han resuelto el problema55,56. Como resultado, la utilización del stent como soporte para braquiterapia ha quedado excluido de la práctica clínica.
Retraso en el desarrollo de la reestenosis
Desde el punto de vista teórico, la braquiterapia intracoronaria podría inducir un retraso en el proceso reestenótico, más que una inhibición permanente de la reestenosis57. Así, considerando una dosis única de 12 o 16 Gy resultaría en una despoblación de células musculares lisas entre 10-3 y 10-6 (sólo una célula de cada 1.000 a un millón sobreviviría), el número de mitosis de la células supervivientes necesarias para reestenosar la arteria sería de 12 a 20, las cuales tendrían lugar en un período comprendido entre 12 y 24 meses. Aunque también es sabido que las células musculares lisas no son malignas y, por tanto, su capacidad mitótica no es indefinida, al menos desde un punto de vista teórico, no se puede asumir que el proceso reestenótico acabe a los 6 meses de la intervención57. Este concepto ha sido observado en los estudios clínicos. En el estudio Scripps, el diámetro luminal mínimo en los pacientes no tratados a los 6 meses de seguimiento se redujo de 2,49 ± 0,81 mm a los 6 meses a 2,12 ± 0,73 mm a los 3 años en el grupo irradiado con 192Ir, mientras que no varió en el grupo placebo58. De forma similar, en el estudio WRIST59, la revascularización de la lesión diana se incrementó de un 13,8% a los 6 meses a un 26,2% a los 2 años de seguimiento60. De este modo, consideramos que, a diferencia de los estudios de reestenosis históricos, la eficacia de la radiación intracoronaria debería evaluarse a largo plazo (más de un año de seguimiento).
Falta de uniformidad en la dosis administrada
Éste es un fenómeno inherente a la presencia de un grado variable de curvatura del vaso, tortuosidad, afilamiento o «tappering», remodelado y distribución de la placa. Además, la posición de la fuente radiactiva en la luz vascular no es fija durante el ciclo cardíaco, pudiendo variar axial o perpendicularmente durante el tiempo requerido para administrar la dosis (dwell time). Este hecho induciría, a su vez, a un cierto grado de inhomogeneidad en la dosis administrada. Finalmente, tanto el isótopo (β- o γ-emisor) y el sistema usado para liberar la radiación (centrado o no centrado, stent radiactivo) puede influir en la distribución de la dosis. Así, por medio de histogramas dosis-volumen, Carlier et al61 demostraron en 23 pacientes incluidos en el estudio BERT-1,5 que el 90% del volumen de adventicia recibía sólo el 37% de la dosis prescrita. Simulando el centrado de la fuente radiactiva y el uso de un emisor γ, este porcentaje se incrementaba, respectivamente, al 49 y 67% de la dosis prescrita. Además, en un análisis subsegmentario de los segmentos irradiados por medio de un sistema no centrado y el emisor β 90Sr/Y, la dosis administrada en la adventicia variaba considerablemente entre subsegmentos, oscilando entre < 2 y 12 Gy62. La dosis administrada se identificó como un factor predictivo independiente del volumen de placa durante el seguimiento, existiendo una correlación significativa entre ambas variables. Así, la uniformidad de la dosis puede potencialmente influir en la evolución de los pacientes sometidos a braquiterapia intracoronaria. Por tanto, el diseño de sistemas capaces de administrar de manera homogénea y en el tejido diana la dosis prescrita debe considerarse prioritario en toda investigación relacionada con la radiación intracoronaria.
Condado et al 23 utilizaron por primera vez la radiación γ para el tratamiento de estenosis coronarias de novo después de angioplastia con balón. Un total de 21 pacientes (22 lesiones) fueron incluidos en el estudio. El seguimiento angiográfico a 5 años ha sido presentado recientemente (Condado JA, comunicación personal, Cardiovascular Radiation Therapy IV, Washington, febrero 2000). El diámetro luminal mínimo disminuyó desde el procedimiento a los 6 meses y hasta los 2 años. Posteriormente se mantuvo estable hasta los 5 años de seguimiento (1,97 mm posprocedimiento; 1,77 mm a los 6 meses y 1,68 mm a los 2, 3 y 5 años). La tasa de reestenosis fue del 23,8% a los 5 años. No se ha descrito ninguna formación aneurismática ni ningún caso de trombosis tardías. Teirstein et al 25 diseñaron el primer estudio aleatorizado con radiación γ para el tratamiento de lesiones reestenóticas. Un total de 55 pacientes con reestenosis posterior a angioplastia con balón (n = 20) o implantación de un stent (n = 35) que iban a ser tratados mediante la implantación de un stent coronario fueron incluidos en este estudio. Los índices angiográficos de reestenosis fueron marcadamente diferentes en el grupo irradiado comparado con el grupo placebo: pérdida luminal tardía de 0,38 ± 1,06 mm en el grupo tratado con 192Ir frente a 1,03 ± 0,97 mm en el grupo placebo (p = 0,009); tasa de reestenosis (incluyendo bordes) del 16,7% en el grupo irradiado y del 53,6% en el placebo (p = 0,025). Además, mediante ecografía intracoronaria se demostró un 60% de reducción en el crecimiento intimal intra- stent después de la braquiterapia (15,5 frente a 45,1 μl; p = 0,01). A pesar de la reducción tardía arriba mencionada del diámetro luminal mínimo durante el seguimiento, el beneficio global en el grupo tratado con 192Ir se mantuvo a los 3 años de seguimiento 58: revascularización de la lesión diana del 15,4% en el grupo 192Ir frente al 48,3% en el grupo placebo (p < 0,01); tasa de reestenosis del 33% en el grupo irradiado frente al 64% en el no irradiado (p < 0,05). En el subgrupo de pacientes diabéticos y en aquellos que recibieron > 8 Gy se observó un beneficio especial 63. El estudio WRIST (Washington Radiation for In-Stent Restenosis Trial) 59 fue un estudio monocéntrico, doble ciego, aleatorizado para el tratamiento de pacientes con reestenosis intra- stent. Un total de 130 pacientes (100 arterias coronarias nativas y 30 injertos de vena safena) fueron aleatorizados a placebo o radiación con 192Ir con una dosis prescrita de 14 Gy a 2 mm de la fuente. En este estudio se utilizaron todo tipo de dispositivos antes de la radiación: rotablator (45%), láser (35%), stent (35%) y balón (7%). A los 6 meses de seguimiento se observó una reducción significativa de la tasa de reestenosis, pérdida luminal tardía y revascularización de la lesión diana en el grupo tratado con 192Ir. Además, los dispositivos utilizados no influyeron en la evolución de los pacientes en ambos grupos, aunque la implantación de un stent intra- stent se relacionó con una mayor tasa de trombosis tardía en el grupo irradiado 64. Aunque el grupo irradiado con 192Ir presentó una mayor tasa de recurrencias que el placebo entre los 6 meses y 2 años (9,3 frente a 0%), la necesidad de revascularización del vaso diana estuvo todavía marcadamente reducida en el grupo irradiado con 192Ir (26,2 frente a 63,1% en el grupo placebo; p = 0,001) a los 2 años 60. Como una extensión del estudio WRIST, 2 estudios evaluarán la efectividad de la radiación γ en pacientes con reestenosis intra- stent largas (> 36 < 80 mm; Long-WRIST) y en venas safenas (SVG-WRIST). Datos no publicados demuestran una reducción de un 41% en la tasa de reestenosis en los pacientes aleatorizados a radiación en el estudio Long-WRIST (Waksman R, comunicación personal, Cardiovascular Radiation Therapy V, Washington, febrero 2001). El estudio GAMMA-1 65 fue un estudio multicéntrico, doble ciego, aleatorizado, diseñado a demostrar la eficacia de la radiación γ ( 192Ir) en pacientes con reestenosis intra- stent. En este estudio, en un 80% de las lesiones se llevó a cabo un re- stent. El grupo irradiado presentó un 41% de reducción en la tasa de reestenosis (el 55% en grupo placebo frente al 32% en el tratado con 192Ir). Sin embargo, la tasa de trombosis tardía fue mayor en el grupo irradiado (5,3 frente a 0,8% en grupo placebo; p = 0,07). Como ocurría en el estudio SCRIPPS, los pacientes diabéticos presentaron un beneficio especial en la reducción de la tasa de reestenosis con braquiterapia (36,1% reestenosis en el grupo tratado con 192Ir frente a 76% en el grupo placebo; p = 0,01). (Teirstein PS, comunicación personal, Cardiovascular Radiation Therapy IV, Washington, febrero 2000.)
Estudios con emisores β
El estudio GENEVA fue el primero de factibilidad, diseñado en Europa (Ginebra, Suiza) y primero en el mundo en valorar la radiación β intracoronaria en humanos24. El emisor β puro 90Y, era posicionado por medio de un catéter de centrado (Schneider Endovascular Radiation System, Schneider Worldwide, Büllach, Suiza), siendo la dosis prescrita de 18 Gy en la superficie del balón. Un total de 15 pacientes con estenosis de novo fueron irradiados después de angioplastia coronaria con balón. La reestenosis durante el seguimiento fue del 40%. Los investigadores atribuyeron estos resultados desfavorables a la dosis baja que realmente r ecibieron estos pacientes (< 4 Gy). El estudio BERT (Beta Energy Restenosis Trial)30 fue un estudio de factibilidad limitado a 23 pacientes en 2 centros (Emory y Brown Universities). El estudio fue diseñado para evaluar la fuente de 90Sr/Y posicionada por medio de un sistema hidráulico (BetaCath System, Novoste Corporation). A los 6 meses se evidenció una tasa de reestenosis del 15%, así como una pérdida luminal tardía media de 0,05. Este estudio tuvo 2 extensiones: «the Canadian arm» y «the European arm». Los resultados de la extensión canadiense fueron comparables con los del estudio BERT original66 mientras que la tasa de reestenosis de la extensión europea fue más elevada (28%) (Wardeh AJ, comunicación personal, EuroCVS, La Haya, enero 2000). El estudio Beta-WRIST67 fue una extensión del estudio WRIST original pero en el que se utilizó el emisor puro β, 90Y y un sistema de centrado (Schneider Endovascular Radiation System, Schneider Worldwide, Büllach, Suiza) para el tratamiento de pacientes con reestenosis intra-stent. Este estudio utilizó como grupo control el grupo placebo del estudio WRIST original. Los resultados angiográficos y de ecografía intracoronaria fueron comparables con los del estudio WRIST. El estudio PREVENT (Proliferation REduction with Vascular ENergy Trial) fue un estudio prospectivo, aleatorizado, ciego y multicéntrico diseñado a determinar la seguridad del sistema de radiación β de Guidant ( Santa Clara, CA) en arterias coronarias tratadas con angioplastia con balón o stent. Un total de 72 pacientes fueron aleatorizados a recibir placebo, 16, 20 o 24 Gy prescritos a 1 mm de la fuente radiactiva. A los 6 meses de seguimiento, la tasa de reestenosis (incluyendo los extremos del segmento i rradiado) fue significativamente menor en el grupo irradiado (22 frent e a 52% del grupo placebo; p < 0,01). Sin embargo, la trombosis tardía fue mayor en el grupo irradiado c on 32P (7 casos), por lo que finalmente la tasa de acontecimientos cardíacos mayores resultó comparable entre ambos grupos (27% en el grupo irradiado frente a 32% en grupo placebo; p = NS)68. El estudio Boston Scientific/Schneider Dose-Finding69 fue un estudio multicéntrico, prospectivo, aleatorizado, no controlado con placebo, diseñado a determinar el efecto de 4 dosis diferentes de radiación β administradas por medio del emisor 90Y a través de un dispositivo centrado (Schneider Irradiation Therapy System, Büllach, Suiza) en lesiones coronarias de novo tratadas con angioplastia con balón. Cinco centros europeos aleatorizaron 181 pacientes a recibir 9, 12, 15 o 18 Gy a 1 mm de profundidad en el tejido. A los 6 meses de seguimiento se demostró una reducción dependiente de la dosis en la tasa de reestenosis: 29% en el grupo de 9 Gy, 21% en el de 12 Gy; 16% en el de 15 Gy y 15% en el de 18 Gy; p = 0,14 para la comparación 9 frente a 18 Gy. Excluyendo los pacientes que recibieron stent, esta reducción dependiente de la dosis fue más evidente: 28% en el grupo de 9 Gy; 17% en el de 12 Gy; 16 Gy en el de 15 Gy y 4% en el de 18 Gy; p = 0,02 para la comparación 9 frente a 18 Gy69. El estudio START fue el primer estudio aleatorizado que utilizó radiación β por medio del emisor 90Sr/Y y el Beta-Cath System (16 o 20 Gy según el diámetro de referencia por análisis coronario cuantitativo) o placebo en pacientes con reestenosis intra-stent. La revascularización del vaso diana presentó una reducción del 32% en el grupo tratado (16 frente a 24% en el grupo placebo; p = 0,02). De manera similar, la tasa de reestenosis se redujo en un 36% (45% en el grupo placebo frente a 29% en el grupo irradiado con 90Sr/Y). No se ha detectado hasta el momento ninguna oclusión tardía ni ninguna formación aneurismática (Popma JJ, comunicación personal, Scientific Sessions of the American College of Cardiology, Anaheim, CA, marzo 2000). Asimismo, los resultados del estudio INHIBIT (INtimal Hyperplasia Inhibition with Beta In-stent Trial), que es un estudio aleatorizado, multicéntrico, doble ciego y controlado con placebo, diseñado para demostrar la seguridad y eficacia del sistema Guidant en pacientes con reestenosis intra-stent, han sido presentados recientemente con unos resultados comparables a los del estudio START: reducción de un 53% en la tasa de acontecimientos cardíacos mayores y de un 49% en la tasa de reestenosis (Waksman R, comunicación personal, Scientific Sessions of the American Heart Association, Anaheim, CA, noviembre 2000). En el registro BRIE (Beta Radiation in Europe), que incluyó 149 pacientes tratados con el sistema Betacath (Novoste Corporation) por enfermedad coronaria de hasta 2 vasos con lesiones de novo aptas para angioplastia con balón y/o stent, la tasa de reestenosis y acontecimentos cardíacos mayores fue mayor de la esperada (34%) (Serruys PW, comunicación personal Scientific Sessions of the American Heart Association, Anaheim, noviembre 2000). Finalmente, los resultados del estudio BETACATH, que es un estudio prospectivo, multicéntrico, aleatorizado, controlado con placebo y diseñado para evaluar la seguridad y eficacia de la fuente de 90Sr/90Y (Beta-Cath System, Novoste Corporation) frente a placebo en lesiones de novo y reestenóticas de vasos nativos, se han presentado recientemente (Kuntz RE, Scientific Sessions of the American College of Cardiology, Orlando, marzo 2001). No se encontraron diferencias significativas en cuanto a incidencia de fallo del vaso diana (objetivo primario) a los 8 meses entre ambos grupos. Además, el grupo irradiado presentó una tasa de reestenosis mayor que el grupo placebo cuando el análisis se realizaba en todo el segmento tratado contando los extremos de la fuente radiactiva. Este fracaso en el tratamiento fue debido muy probablemente a efecto borde inducido por el diseño propio del estudio (que se realizó antes del conocimiento del concepto de geographic miss).
Estudios con stent radiactivo
La fase 1A del estudio IRIS (Isostent for Restenosis Intervention Study) fue un estudio no aleatorizado diseñado para evaluar la seguridad de la implantación de stents de 15 mm Palmaz-Schatz impregnados con el isótopo 32P de muy baja actividad (0,5-1,0 μCi), en pacientes con estenosis coronarias de novo o reestenóticas sintomáticas. Un total de 32 pacientes fueron tratados en los EE.UU. No hubo casos de trombosis subaguda, muerte o revascularización de la lesión diana a los 30 días (parámetro de valoración primaria de seguridad), aunque la tasa de reestenosis fue del 31%70. Este estudio se extendió (IRIS 1B) para stents de mayor actividad (0,75-1,5 μCi) en los EE.UU. y Europa. Aunque se demostró seguridad en la implantación de estos stents, la tasa de reestenosis no era menor que la de los stents convencionales71. Posteriormente se llevó a cabo el European 32P Dose-Response Study. Se utilizaron 4 rangos de actividad en stents de Palmaz-Schatz o BX: 1,5-3,0; 3,0-6,0; 6,0-12, y 12-20 μCi. El grupo de Milán (n = 82 pacientes) comunicó una supresión dependiente de la dosis de la hiperplasia neointimal (entre 1,5 y 12 μCi). Se observó una reestenosis en los extremos del stent (candy wrapper) en el 36% de los casos con actividad de 1,5-3,0 μCi; en el 38% para actividad de 3,0-6,0 μCi, y en el 39% para actividad de 6,0-12 μCi34. Datos recientes indican que la implantación de stents radiactivos de actividad de mayor actividad (21 μCi) no reduce la tasa de reestenosis en los extremos del stent72. Heidelberg incluyó 11 pacientes con stents de actividad entre 1,5-3,0 μCi. La revascularización del vaso diana fue del 36%, localizándose la reestenosis en la articulación del stent de Palmaz-Schatz73. En Rotterdam, 40 pacientes recibieron un stent de actividad comprendida entre 6,0 y 12,0 μCi. No se observó ningún caso de reestenosis intra-stent. Sin embargo, en los extremos del stent se produjo una tasa de reestenosis del 44%, siendo la revascularización de la lesión diana del 25% de los pacientes74. Como se ha comentado previamente, los dispositivos diseñados para solventar el problema del efecto borde después de la implantación de un stent radiactivo55,56 no han sido efectivos. Por tanto, dicho dispositivo no se considera de utilidad clínica en la actualidad en el tratamiento percutáneo de lesiones coronarias.
CONCLUSIONES
La radiación intracoronaria, ya sea administrada mediante emisores β o γ, ha demostrado de forma coherente en todos los estudios ser efectiva en la prevención de la reestenosis después de angioplastia coronaria en el subgrupo de pacientes con reestenosis intra-stent (fig. 7). En la actualidad no existen datos clínicos que apoyen la utilización de esta técnica de forma generalizada a todo tipo de lesiones. Este hecho, asociado al coste del procedimiento, hace que debiera limitarse su uso clínico sólo a los pacientes con reestenosis intra-stent. La combinación de agentes antiagregantes administrados a largo plazo (mínimo 6 meses) y el conocimiento y reconocimiento de las potenciales fuentes de error en el tratamiento (geographic miss) han conseguido minimizar la incidencia de trombosis tardía y del efecto borde. La interacción, coordinación y cooperación entre distintos servicios (física médica, radiooncología y cardiología), así como el conocimiento de los respectivos campos y métodos de trabajo, son imprescindibles en la puesta en marcha de un programa de braquiterapia intracoronaria en el hospital.
Fig. 7. Esquema representativo de la evidencia clínica de los estudios con braquiterapia: los estudios multicéntricos aleatorizados se exponen en la columna 4 de evidencia, los unicéntricos aleatorizados en la columna 3, los registros multicéntricos en la columna 2 y los registros unicéntricos en la columna 1. Nótese que los estudios en lesiones con alta probabilidad de reestenosis (reestenosis intra-stent) han sido positivos para el tratamiento con braquiterapia. Por el contrario, tanto los registros iniciales como los estudios multicéntricos aleatorizados, en lesiones de menor riesgo de reestenosis (lesiones de novo) han sido negativos, a excepción del estudio Dose-Finding.