Palabras clave
INTRODUCCIÓN
Hace ya 40 años que el patólogo Donald Teare1 describió la enfermedad que hoy día conocemos como miocardiopatía hipertrófica (MH). Desde entonces han sido numerosos e importantes los avances realizados, tanto en el conocimiento de sus características clínicas, fisiopatológicas y etiológicas, como en su tratamiento2-9. No obstante, todavía persisten numerosas incógnitas, incluyendo las que plantea el tratamiento de muchos de estos pacientes.
La MH es una enfermedad del sarcómero cardíaco, frecuentemente familiar, con una gran heterogeneidad morfológica, funcional y clínica9,10. La enfermedad se caracteriza por un aumento de la masa miocárdica, con desorganización de miocitos y miofibrillas, aumento de la matriz colágena y alteraciones en las arterias coronarias intramiocárdicas3,4. Su diagnóstico se basa en la presencia de una hipertrofia ventricular, generalmente asimétrica y con distribución muy variable, no explicada por otra causa10. Algunos pacientes presentan gradientes intraventriculares e insuficiencia mitral, y son frecuentes las alteraciones de la función diastólica ventricular y la isquemia miocárdica2-4.
La prevalencia estimada de la enfermedad en la población general es del 0,2-0,5%11. La historia natural de la MH se caracteriza por una lenta progresión de los síntomas, un progresivo deterioro de la función ventricular y la posibilidad de muerte súbita en cualquier momento de la evolución4,6. La incidencia de muerte súbita varía según el tipo de población estudiado; así, mientras en algunos centros de referencia es del 2,5% por año en adultos y de hasta el 6% en niños12,13, en pacientes ambulatorios no seleccionados esta incidencia es mucho menor, alrededor del 1% por año12,14.
Uno de los aspectos más característicos de la MH es la presencia en algunos pacientes, probablemente no más del 20-30% de los casos, de un gradiente de presión intraventricular2,6,9. En la mayoría de éstos el gradiente es subaórtico y se acompaña de insuficiencia mitral, aunque puede ser medioventricular o situado en el tracto de salida ventricular derecho. En la forma más frecuente de MH obstructiva (MHO), y según la clasificación propuesta por Wigle2, el gradiente subaórtico puede ser persistente, presente en situación basal, lábil, que varía de forma espontánea, o latente, que aparece sólo en situaciones que provocan aumento de la contractilidad y/o disminución del llenado ventricular y de la poscarga. El mecanismo y significado del gradiente subaórtico han sido motivo de controversia durante décadas2,5. Así, para muchos autores representa una auténtica obstrucción al vaciamiento ventricular, producido en la mayoría de los casos por el movimiento sistólico anterior de las valvas mitrales debido a un efecto Venturi por la rápida eyección a través de un tracto de salida ventricular estrecho, aunque también podría deberse en algunos casos a una anomalía estructural del propio aparato subvalvular. Por el contrario, para otros autores el gradiente no reflejaría una auténtica obstrucción, sino que estaría producido por la contracción hiperdinámica de un ventrículo prácticamente vacío. Probablemente, la interpretación del significado que el gradiente intraventricular pueda tener en un paciente concreto requiere del conocimiento del volumen relativo eyectado al comenzar el gradiente.
Los componentes fisiopatológicos que determinan los síntomas y el curso clínico de la MH son fundamentalmente la disfunción diastólica, la isquemia miocárdica, las arritmias y, cuando existe, la obstrucción al tracto de salida ventricular izquierdo, siendo su contribución relativa muy variable de unos pacientes a otros3,4. En general, la presencia de un gradiente subaórtico no supone necesariamente una mayor severidad de la enfermedad15,16. No obstante, la magnitud del gradiente se correlaciona de manera clara con la severidad de los síntomas y existe suficiente evidencia de que, en estos pacientes, la disminución del gradiente se acompaña generalmente de una reducción de los síntomas y un aumento de la tolerancia al ejercicio2,17. Esta mejoría sintomática y funcional justifica sin duda el empleo de medidas terapéuticas dirigidas a reducir o eliminar el gradiente y la insuficiencia mitral, eliminando o reduciendo los factores responsables de la obstrucción.
El tratamiento médico de la MHO sintomática se basa en la utilización de agentes bloqueadores beta, antagonistas del calcio, como el verapamilo, y algunos fármacos antiarrítmicos como la disopiramida o la amiodarona, con los que se consigue un adecuado control de los síntomas en la mayoría de los casos8,18. Sin embargo, una minoría de estos pacientes continúa presentando síntomas severos de disnea, angina y/o síncope a pesar de un tratamiento médico correcto. Estos casos, cuyo manejo puede suponer un auténtico reto para el clínico, han sido considerados clásicamente como candidatos a tratamiento quirúrgico8. Aunque al reducir el gradiente y disminuir las presiones intraventriculares y la insuficiencia mitral la cirugía ha demostrado ser un tratamiento eficaz para estos pacientes, las obvias limitaciones de las técnicas quirúrgicas han estimulado el desarrollo en los últimos años de otras alternativas terapéuticas, como la estimulación eléctrica bicameral o la ablación septal con alcohol, para este poco frecuente pero complejo grupo de enfermos con MH que presentan obstrucción subaórtica y síntomas severos. No obstante, el verdadero papel de cada una de estas opciones terapéuticas en el tratamiento de los síntomas, así como su posible influencia en el pronóstico de estos pacientes, no está en muchos casos plenamente establecido y sigue siendo motivo de controversia19.
El presente artículo constituye una puesta al día del tratamiento de la MHO sintomática y en él se revisan las diferentes alternativas terapéuticas actualmente disponibles.
TRATAMIENTO MÉDICO
El tratamiento médico es el primer escalón terapéutico en el manejo de la MH. La mayoría de los pacientes mejora clínicamente sólo con fármacos, y en aquellos casos en los que se precisan medidas terapéuticas más agresivas (cirugía, marcapasos o ablación), el mantenimiento de la medicación puede ser necesario para conseguir un adecuado control de los síntomas8,18. Los primeros fármacos utilizados fueron los bloqueadores beta y, posteriormente, los antagonistas del calcio y la disopiramida, aunque ninguno de ellos ha demostrado ser útil para modificar la evolución de la enfermedad o mejorar la supervivencia8,18.
La utilización de los bloqueadores beta en el tratamiento de la MHO está fuertemente asentada desde la decada de los sesenta, por la apreciación empírica de que su administración produce una mejoría subjetiva de los síntomas en un buen número de pacientes. Los bloqueadores beta constituyen, todavía en la actualidad, el pilar principal del tratamiento farmacológico en la MH3,8. No obstante, existen pocos estudios sobre su utilidad y la mayoría de ellos son antiguos20-28, siendo el propranolol el fármaco más estudiado. Los bloqueadores beta mejoran los síntomas de angina, disnea, mareo y síncope20,21,23 y actúan reduciendo el consumo miocárdico de oxígeno a través de una disminución de la frecuencia cardíaca y de la contractilidad21,25. Asimismo, los bloqueadores beta pueden prevenir el aumento de la obstrucción desencadenado por el ejercicio físico23, y son efectivos también para disminuir la obstrucción en reposo de grado ligero26, aunque tienden a ser menos eficaces en pacientes con grados más severos de obstrucción5. Aunque algunos autores sugieren que los bloqueadores beta mejoran la función diastólica favoreciendo la relajación ventricular y mejorando la distensibilidad del miocardio27,28, parece ser que la mejoría de la función diastólica que provocan es secundaria a la prolongación de la diástole que se produce al disminuir la frecuencia cardíaca, lo que favorece el llenado ventricular8.
Entre los antagonistas del calcio, el verapamilo es con el que se tiene más experiencia. Actúa reduciendo la obstrucción en el tracto de salida del ventrículo izquierdo, como consecuencia de su efecto inotrópico negativo29-32, y mejorando la función diastólica. El verapamilo favorece la relajación ventricular, y esto mejora el llenado diastólico y disminuye las presiones de llenado del ventrículo izquierdo33-36; tiene también un efecto favorable sobre la circulación coronaria mejorando la perfusión miocárdica37-39. Diversos autores han demostrado que el verapamilo reduce los síntomas y mejora el rendimiento físico en pacientes con MHO29,30,32,40. En un estudio se comparó nadolol con verapamilo y placebo y se halló que, si bien ninguno de los dos fármacos mejoró la capacidad de ejercicio, el verapamilo produjo una mejoría de los síntomas superior al nadolol o al placebo41. Aunque algunos estudios sugerían que el tratamiento con verapamilo podía producir una reducción de la hipertrofia ventricular valorada mediante electrocardiograma o angiografía32, otros no encontraron cambios ecocardiográficos significativos en el grado de hipertrofia tras un año de tratamiento30.
Sin embargo, el tratamiento de la MHO con verapamilo puede producir diferentes complicaciones, algunas de ellas graves, como consecuencia de los efectos que el fármaco ejerce en el tono vascular periférico, la contractilidad y la conducción eléctrica30,31. Aunque el verapamilo disminuye inicialmente el gradiente en el tracto de salida del ventrículo izquierdo gracias a su efecto inotrópico negativo, una vasodilatación excesiva puede acompañarse de un descenso importante de la presión arterial, disminuyendo la poscarga y aumentando la estimulación simpática refleja, lo que desencadenaría de forma paradójica un aumento en el grado de obstrucción y de la presión intraventricular31. Así, se ha observado que en pacientes con presiones pulmonares elevadas o con síntomas de congestión pulmonar, sobre todo si además tienen obstrucción al tracto de salida, el verapamilo puede desencadenar edema pulmonar o muerte súbita como consecuencia de su efecto vasodilatador, y posiblemente también debido a una depresión de la contractilidad, por lo que este fármaco debe evitarse en este tipo de pacientes30,31. Por otro lado, el verapamilo puede producir disfunción del nodo sinusal y diversos grados de bloqueo AV.
A pesar de que el diltiacem y el nifedipino han demostrado mejorar la función diastólica ventricular42-45, debe evitarse su administración en pacientes con MHO, ya que, debido a su potente efecto vasodilatador periférico, pueden dar lugar a un aumento de la obstrucción y de las presiones intraventriculares42,44.
La disopiramida es un agente antiarrítmico de la clase 1A que posee un importante efecto inotrópico negativo46-48. En pacientes con MHO, la disopiramida produce una disminución del gradiente que se acompaña de una mejoría de los síntomas y de la capacidad de ejercicio46, aunque este beneficio inicial hemodinámico y clínico disminuye con el tiempo7. En un estudio aleatorio, cruzado y doble ciego, en el que comparó la disopiramida con los bloqueadores beta y placebo, tanto la disopiramida como los bloqueadores beta indujeron una reducción del gradiente, aunque la primera fue más efectiva; la disopiramida también tuvo un efecto superior a los bloqueadores beta en cuanto a la mejoría de la tolerancia al ejercicio físico48. No obstante, la disopiramida posee cierta actividad anticolinérgica que es responsable del acortamiento del tiempo de conducción AV, por lo que es conveniente añadir bloqueadores beta al tratamiento con disopiramida para evitar una frecuencia cardíaca elevada en caso de un descenso de la fibrilación auricular8. La aparición de otros efectos anticolinérgicos, como sequedad de boca o visión borrosa, puede también limitar su uso.
La mejoría de los síntomas hemodinámicos con fármacos inotroponegativos se produce por la eliminación del contacto entre la válvula mitral y el septo, y la obstrucción, al disminuir la aceleración de la eyección ventricular izquierda y prolongar el tiempo hasta que ésta alcanza la máxima velocidad. En condiciones basales, la velocidad pico se alcanza en la primera mitad de la sístole y tras el tratamiento en la segunda49.
Elección del fármaco
Debido a la gran heterogeneidad de la MH y a los múltiples mecanismos fisiopatólogicos responsables de los síntomas, la respuesta clínica a los distintos fármacos es muy variable. Además, pueden aparecer efectos secundarios, algunos de ellos importantes, por lo que el tratamiento médico debe ser individualizado para cada paciente3,6,8,18.
En general, los bloqueadores beta controlan mejor la disnea y el verapamilo es más eficaz en la angina8. Los bloqueadores beta y la disopiramida son especialmente útiles en la MHO y la recomendación de uno u otro varía según los distintos autores5. El verapamilo puede mejorar los síntomas y la capacidad de ejercicio en algunos pacientes que no responden a los bloqueadores beta30. No obstante, el verapamilo debe evitarse en caso de obstrucción severa y síntomas congestivos30,31. La asociación de bloqueadores beta y antagonistas del calcio puede ser útil en algunos pacientes con síntomas refractarios a un solo fármaco50,51.
Otros fármacos
Otros fármacos pueden ser también utilizados en el manejo de la MH. La digoxina, por su efecto inotrópico positivo debe, en general, evitarse, salvo que sea necesaria para controlar la frecuencia cardíaca en la fibrilación auricular cuando los bloqueadores beta o los antagonistas del calcio no son eficaces3,5,8. También puede ser útil en aquellos casos en los que se produce una evolución de la enfermedad hacia una progresiva dilatación y disfunción sistólica ventricular52, siendo el tratamiento indicado en estos casos el habitual en la insuficiencia cardíaca congestiva8, incluyendo el trasplante cardíaco8,18. Los diuréticos pueden emplearse en el manejo de los síntomas, pero siempre con precaución ya que, debido a la disfunción diastólica existente en la MH, son necesarias unas presiones relativamente elevadas para obtener un llenado ventricular diastólico adecuado8. La amiodarona ha demostrado ser útil en la prevención de las recurrencias de la fibrilación auricular53,54, en la supresión de los episodios de taquicardia ventricular no sostenida55 y en la prevención de la muerte súbita56. Los anticoagulantes deben emplearse en los casos de fibrilación auricular recurrente o crónica, y el umbral para el inicio de esta medicación debe ser bajo, dado el alto riesgo embolígeno de esta enfermedad8.
Aunque la endocarditis infecciosa es una complicación relativamente rara en la MH, los pacientes con turbulencias intracardíacas (gradiente intraventricular, insuficiencia mitral) deben recibir profilaxis8,18,57.
TRATAMIENTO QUIRÚRGICO
Objetivos e indicaciones
Los objetivos del tratamiento quirúrgico en la MHO son el alivio de la obstrucción subaórtica y de la insuficiencia mitral y la normalización de las presiones ventriculares aumentadas; con ello se pretende mejorar el grado funcional clínico y la calidad de vida de los pacientes y, en determinados casos, también el pronóstico3,8,58. La indicación general es la coexistencia de un gradiente severo de al menos 50 mmHg, ya sea basal o provocable, junto con síntomas limitantes y/o síncope recurrente a pesar de un tratamiento médico adecuado, situación que se da sólo en un 10-15% de los pacientes con MH. Existe acuerdo en no indicarla sólo en función del gradiente3,8,58.
Técnicas quirúrgicas
Desde 1958, en que Cleland59 realizó por primera vez con éxito una miotomía transaórtica en un paciente con MHO, han sido múltiples las técnicas quirúrgicas empleadas para el tratamiento de esta enfermedad60-85. La técnica quirúrgica más ampliamente utilizada es la miotomía-miectomía septal transaórtica o intervención de Morrow61. En ella, la miectomía septal se realiza a través de una aortotomía cercana al seno coronario derecho, que se prolonga hacia el septo interventricular y distalmente hacia el ápex ventricular; a continuación se realiza otra incisión paralela a la anterior y a su izquierda, desde la comisura situada entre ambas valvas coronarias, y se extrae un fragmento rectangular del septo de unos 3 cm. Para que la miectomía sea efectiva debe extirparse una cantidad de músculo suficiente que permita una adecuada ampliación del tracto de salida ventricular; como consecuencia, se separa la valva mitral anterior, disminuyendo o desapareciendo el SAM, el gradiente subaórtico y la insuficiencia mitral2,61,62. La utilización del ecocardiograma intraoperatorio permite adecuar la cantidad de tejido resecado, valorar in situ la competencia de la válvula mitral y estimar el alivio de la obstrucción72.
Intervenciones menos populares han sido las de Bigelow60 (miotomía transaórtica) y Kirklin70 (miectomía transventricular). Asimismo, uno de los grupos con más experiencia, el de Bircks y Schulte68,69, ha conseguido excelentes resultados combinando las incisiones de Morrow y Bigelow, y extendiendo la miectomía incluso hasta la pared lateral del ventrículo izquierdo.
El recambio valvular mitral propuesto por Cooley63 no ha tenido, en general, tan amplia aceptación. Los riesgos potenciales inherentes a las prótesis valvulares hacen que, a pesar de sus buenos resultados hemodinámicos y clínicos, este tipo de cirugía se reserve para pacientes con insuficiencia mitral severa por afección intrínseca de la válvula, para aquellos con un septo interventricular demasiado fino (< 18 mm) para la miectomía y para los que la operación de Morrow no ha sido suficientemente eficaz72,74. No obstante, algunos autores defienden el recambio valvular mitral como primera opción quirúrgica cuando el equipo quirúrgico tiene poca experiencia con las técnicas de miotomía/miectomía58,78. Por otro lado, la plicatura mitral o reconstrucción valvular, asociada a la miectomía, ha sido también empleada por algunos grupos85.
Consecuencias del tratamiento quirúrgico
En pacientes con MHO, el tratamiento quirúrgico disminuye eficazmente el gradiente subaórtico y la insuficiencia mitral y, en la mayoría de los casos, mejora de manera clara su grado sintomático y su capacidad funcional3,8,58. La liberación de la obstrucción subaórtica produce una reducción de la presión sistólica ventricular izquierda y, como consecuencia, una disminución en el consumo de oxígeno miocárdico y del flujo coronario, aumentado basalmente en pacientes con MHO86,87. El beneficio es mayor en enfermos con gradiente y flujo coronario máximo más elevado antes de la cirugía39. Además, tras la cirugía mejoran o se normalizan los defectos de perfusión miocárdica detectados en las pruebas isotópicas, existiendo una correlación entre la mejoría y el grado de disminución del gradiente y de las presiones intraventriculares; la mejoría observada en algunos defectos fijos de perfusión indicaría la presencia de miocardio viable en estos casos88.
El efecto de la cirugía sobre la función diastólica ventricular no está, sin embargo, tan claro, a pesar de que en la mayoría de los pacientes se reduce la presión telediastólica ventricular izquierda tras la intervención66,72.
Resultados del tratamiento quirúrgico
La miectomía septal logra reducir o abolir el gradiente subaórtico, el SAM y la insuficiencia mitral en un 90-95% de los pacientes con MHO8,58,66. Además, la disminución del gradiente conseguida con la cirugía es permanente, como demuestran seguimientos realizados a largo plazo66,72 (tabla 1).
La mejoría sintomática es el primer objetivo del tratamiento quirúrgico de la MHO y, por el análisis de las distintas series publicadas, es evidente que la cirugía proporciona una mejoría sintomática muy superior a la aportada por ningún otro tratamiento58. Así, en la serie de los Institutos Nacionales de Salud Americanos, el 90% de los pacientes operados mejoraron su grado funcional a corto plazo, manteniéndose esta mejoría a los 5 años en el 70% de ellos66,72. Los resultados obtenidos por otros grupos son muy similares (tabla 1), con un 85-90% de los pacientes en clase funcional I-II al cabo del primer año58,67-71,73-84.
Sin embargo, no está claro si el abordaje quirúrgico es capaz de prolongar la vida de estos enfermos. La mortalidad anual tardía es del 1,5-4%67-84, siendo las supervivencias de las últimas series del 90% al primer año y del 85% a los 5 años77,80,81,84. Algunos autores han comparado el curso clínico y la supervivencia a largo plazo de sus pacientes operados con los que presentan aquellos tratados médicamente, siendo en algunos casos menor la mortalidad del grupo quirúrgico. En un estudio, el beneficio parecía ser todavía mayor en los pacientes quirúrgicos que eran, además, tratados con verapamilo75. No obstante, se trata de series retrospectivas y la caracterización de los pacientes incluidos en ellas es casi siempre incompleta, lo que hace difícil conocer realmente qué pacientes se benefician más de la cirugía58. La evolución postoperatoria puede verse condicionada por la aparición de determinadas arritmias, sobre todo fibrilación auricular65,66,74,81, y de insuficiencia cardíaca, tanto diastólica como sistólica89,90; en estos casos no está claro si la disfunción ventricular ocurre como consecuencia de la intervención o por la propia evolución natural de la enfermedad58. En general, no se observa correlación entre las condiciones basales en que se realizó el procedimiento y la mortalidad tardía en estos pacientes73, aunque en algunas series la presencia de insuficiencia cardíaca previa a la cirugía y la asociación de otros procedimientos quirúrgicos pueden ser predictores de una mayor mortalidad tardía83.
El riesgo quirúrgico asociado a la miectomía, con cifras de mortalidad perioperatoria del orden del 7-8%, ha sido uno de los principales inconvenientes de esta técnica durante años65,68,70. Sin embargo, el perfeccionamiento de las técnicas de protección miocárdica y la mayor experiencia de los equipos quirúrgicos han permitido reducir estas cifras hasta menos del 2% en series recientes71-84 (tabla 1). En general, la mortalidad es mayor en pacientes mayores de 65 años73, cuando se asocian otros procedimientos quirúrgicos como revascularización coronaria4,68,69 y cuando persiste gradiente residual73. No obstante, no se ha encontrado relación entre el riesgo quirúrgico y otros factores clínicos o hemodinámicos basales como el grado funcional, la severidad del gradiente o la regurgitación mitral73. Las principales causas de mortalidad perioperatoria son el bajo gasto cardíaco, las alteraciones de la función vascular periférica y la insuficiencia aórtica58.
La complicación más frecuente de la cirugía son los trastornos de la conducción intraventricular61. Hasta un 41% de los pacientes sometidos a una intervención de miotomía/miectomía presentan un bloqueo de rama izquierda posquirúrgico69,82, si bien éste no altera los efectos hemodinámicos de la intervención91. Los grados mayores de bloqueo son menos frecuentes y, de ellos, sólo el 3-5% precisan un marcapasos definitivo74,79, lo que contrasta con el 10% comunicado en las primeras series4. El otro gran grupo de complicaciones son las mecánicas, como regurgitación mitral importante4,74, insuficiencia aórtica severa secundaria a la aortotomía92, o comunicación interventricular por lesión exagerada de un septo no demasiado hipertrófico79,93. La incidencia de comunicación interventricular varía entre el 1 y el 5%71-73, pero la utilización de la ecocardiografía intraoperatoria puede prácticamente eliminar este riesgo, al permitir al cirujano disponer de una más perfecta información sobre el grado y distribución de la hipertrofia septal. McIntosh94 y Maron72 recomiendan que se evite la miectomía en pacientes con un septo relativamente fino (< 18 mm) o una distribución muy heterogénea de la hipertrofia.
Otras técnicas quirúrgicas
Por último, en una minoría de enfermos con MH la obstrucción no es subaórtica sino medioventricular, pudiendo coexistir, además, ciertas anomalías en el aparato subvalvular que favorecen el movimiento de la válvula mitral hacia el septo y la aparición de un gradiente dinámico2,4,5. No está claro en qué medida estas posibles malformaciones sólo coexisten o participan activamente en el desarrollo de la enfermedad95,96, aunque estudios realizados en animales demuestran que el desplazamiento anterior del músculo papilar puede provocar un gradiente en ausencia de hipertrofia ventricular severa95. En cualquier caso, el manejo en esta situación es complejo, y las intervenciones clásicas para eliminar la obstrucción resultan ineficaces, por lo que en algunos de estos casos se han intentado otras formas de reconstrucción del aparato subvalvular, con buenos resultados95-97.
MARCAPASOS BICAMERAL
La observación inicial de Hassenstein98, en 1975, de que la estimulación eléctrica del corazón producía una disminución del gradiente en el tracto de salida del ventrículo izquierdo supuso la justificación para el ensayo, años después, de la estimulación secuencial AV como una alternativa terapéutica menos invasiva y más asequible que la cirugía para aquellos pacientes con MHO que presentaban obstrucción severa y síntomas limitantes que no respondían al tratamiento médico99-102.
Mecanismo de actuación
No se conoce el mecanismo exacto por el que el marcapasos produce una disminución del gradiente o mejora los síntomas. En teoría, la estimulación eléctrica del ventrículo derecho produciría una activación ventricular asincrónica similar a la encontrada en el bloqueo completo de rama izquierda, que daría lugar a una ampliación del tracto de salida del ventrículo izquierdo, disminuyendo así la velocidad del flujo en esta localización. Esta reducción de la velocidad del flujo de eyección ventricular disminuye el efecto Venturi y el SAM, produciéndose como consecuencia una disminución del gradiente99,102-104 y de la insuficiencia mitral105. Los efectos que la estimulación eléctrica produce sobre la función diastólica son contradictorios. En estudios de estimulación aguda algunos autores describen un empeoramiento de la función diastólica, sobre todo con intervalos AV cortos106,107; otros grupos, en cambio, encuentran una mejoría significativa de los parámetros de función diastólica tras la estimulación eléctrica100,108 o bien ausencia de cambios109. El posible remodelado ventricular producido por la estimulación eléctrica crónica, con modificación de las propiedades eléctricas y hemodinámicas del miocardio, explicaría la persistencia de los efectos beneficiosos del marcapasos incluso cuando éste es desconectado, y la mejoría progresiva de los síntomas a medio y largo plazo110. Algunos autores encontraron en sus series una regresión del grado de hipertrofia108,109, pero este hallazgo no ha sido confirmado en un ensayo aleatorio multicéntrico de diseño más potente110.
Selección del intervalo auriculoventricular óptimo
La programación de un intervalo AV óptimo es crucial para la obtención de un beneficio terapéutico máximo111-113. El intervalo AV debe ser lo suficientemente corto como para que se produzca una preexcitación máxima del ventrículo derecho, tanto en reposo como durante el ejercicio. Pero si este intervalo es demasiado corto, el llenado ventricular dependiente de la contracción auricular, que es fundamental en la MH debido a la disfunción diastólica existente, disminuye, produciéndose así una elevación de la presión auricular izquierda y una disminución del gasto cardíaco. A veces es necesario el tratamiento con fármacos (bloqueadores beta o verapamilo), o incluso la modificación o ablación con radiofrecuencia del nodo AV, para prolongar el tiempo de conducción a través del sistema de conducción nativo y asegurar así una captura ventricular máxima111,112. La posición del electrodo también es importante, siendo el beneficio mayor con posiciones más distales, próximas al ápex ventricular114.
Existe cierta controversia acerca de la utilidad de los estudios de estimulación aguda previos a la implantación del marcapasos. En algunos de estos estudios no se encuentra correlación entre los resultados hemodinámicos agudos y los resultados a largo plazo, y esto puede ser debido a los posibles cambios adaptativos que se producirían con la estimulación crónica y que no son detectados con las pruebas iniciales de estimulación103,105,110, por lo que se desaconsejaría su realización. Por otra parte, estos estudios pueden ser útiles a la hora de identificar a aquellos pacientes cuyos parámetros hemodinámicos empeoran con la estimulación secuencial y en los que la implantación del marcapasos podría ser incluso perjudicial113.
Efectos del marcapasos secuencial
En los primeros estudios realizados en los años ochenta se encontró que el marcapasos bicameral producía una disminución significativa del gradiente en la mayoría de los pacientes115, junto con una mejoría sintomática subjetiva y un aumento de la capacidad de ejercicio100. Estudios posteriores demostraron reducciones del gradiente de entre el 43 y el 70%102,116, que se acompañaban de mejoría clínica en hasta un 91% de los pacientes y de un incremento en el tiempo de ejercicio109. Fananapazir et al116 encontraron, además, una mejoría de los parámetros hemodinámicos, que se mantuvieron incluso cuando se desconectó el marcapasos después de un período de estimulación crónica y una regresión de la hipertrofia ventricular significativa en un 23% de los pacientes109. Estos hallazgos dieron lugar a que se propusiese, por parte de estos autores, al marcapasos como tratamiento de elección para todos los pacientes con MHO y síntomas severos, antes incluso de considerar la miectomía o el recambio valvular mitral116, y también su implante en niños asintomáticos para atenuar la hipertrofia y prevenir el desarrollo de la obstrucción durante el período de crecimiento109, siendo todo ello el origen de una gran controversia117. Precisamente a raíz de estas consideraciones se pusieron en marcha los primeros ensayos clínicos aleatorizados.
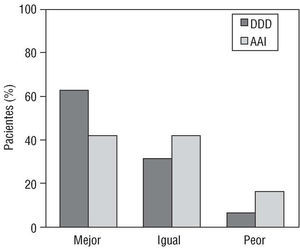
Nishimura et al104 realizaron un estudio aleatorio cruzado doble ciego con 21 pacientes en el que se comparaba la estimulación en modo DDD con el marcapasos en forma inactiva (AAI). Tras la estimulación DDD se producía una disminución significativa del gradiente de 76 ± 61 a 55 ± 38 mmHg (p < 0,05). El 63% de los pacientes con estimulación DDD presentaron una mejoría sintomática subjetiva, pero también el 42% de los que estaban en modo AAI, sin que se apreciaran cambios significativos en el consumo pico de oxígeno entre los dos grupos, lo que da a entender que esta modalidad terapéutica puede tener cierto efecto placebo (fig. 1). Además, el marcapasos no mejoraba los síntomas en un 31% de los pacientes y un 5% incluso presentaba un empeoramiento.
Fig. 1. Respuesta sintomática objetiva tras estimulación parmanente, comparando ambos modos de programación. AAI: estimulación AAI a 30 lat/min; DDD: estimulación DDD continua. Modificada de Nishimura et al104.
En el primer estudio multicéntrico aleatorio doble ciego118 se incluyeron 83 pacientes a los que se implantó un marcapasos bicameral que se programó en modo DDD o AAI de forma aleatoria durante un período de 12 semanas, invirtiéndose después el modo de estimulación durante otras 12 semanas. Finalmente, se reprogramó el marcapasos dejándolo en el modo de estimulación preferido por cada paciente. Con la estimulación DDD se produjo una disminución del gradiente de 59 ± 36 a 30 ± 25 mmHg (p < 0,001) y una mejoría tanto de los síntomas como de la calidad de vida119. Los síntomas también mejoraron de forma significativa en el grupo asignado al modo inactivo (AAI). La desactivación del marcapasos después de un período activo produjo un empeoramiento de los síntomas y fue necesaria la reprogramación precoz del marcapasos a modo activo en 14 pacientes. Después del período de estimulación aleatoria inicial, 79 enfermos prefirieron la estimulación DDD. La mejoría de la tolerancia al ejercicio físico se produjo principalmente en los pacientes en los que la duración del ejercicio era menor de 10 min.
En otro estudio multicéntrico aleatorio (M-PATHY)110 se incluyó a 48 pacientes a los que se implantó un marcapasos bicameral que se programó de forma aleatoria en modo DDD o AAI durante 3 meses, cambiándose al otro modo de estimulación durante otros 3 meses y manteniéndolo 6 meses más de forma activa. La disminución del gradiente a los 12 meses fue, en general, modesta (de 82 ± 32 a 48 ± 32 mmHg; p < 0,001) y en un 43% de los pacientes no disminuyó o incluso aumentó. En los primeros 6 meses no se encontraron diferencias en cuanto a síntomas y capacidad de ejercicio entre ambos grupos. Después de los 6 meses adicionales de estimulación DDD se evidenció una mejoría subjetiva de los síntomas, que no se acompañó de un incremento del consumo pico de oxígeno. A los 12 meses de seguimiento, 6 pacientes (12%), todos ellos de edad avanzada (entre 65 y 75 años), presentaron mejoría clínica, tanto en parámetros objetivos como subjetivos. En este estudio no se encontraron cambios en los parámetros de función sistólica y diastólica, y tampoco se observó una disminución en el grosor del septo.
En estos 2 estudios multicéntricos se observa que el marcapasos es capaz de producir una disminución del gradiente del tracto de salida del ventrículo izquierdo, aunque el grado de respuesta es muy variable entre los pacientes, además de que no parece existir una correlación directa entre la magnitud de cambio del gradiente del tracto de salida y la mejoría clínica. El hecho de que se encuentre mejoría de los síntomas tanto tras la estimulación DDD como en el grupo control sugiere que el efecto placebo del marcapasos es importante120, y el hallazgo de una mejoría objetiva en la capacidad de ejercicio en ambos grupos puede ser explicada por un efecto de entrenamiento. Existe también una discordancia entre la mejoría subjetiva apreciada por los pacientes y la ausencia de mejoría en los datos objetivos de tolerancia al ejercicio (duración del ejercicio y consumo máximo de oxígeno).
Selección de los pacientes que se pueden beneficiar del marcapasos
En comparación con la cirugía, la estimulación bicameral produce una reducción del gradiente menor y también una menor mejoría de los síntomas y de la capacidad funcional121,122 (tabla 2). Aun así, el marcapasos puede ser una alternativa terapéutica importante en pacientes seleccionados. No obstante, como no todos los enfermos mejoran y algunos incluso pueden empeorar, es importante conocer los parámetros que permitan identificar a los pacientes que se beneficiarían de la implantación del marcapasos113. Así, los pacientes de mayor edad108,110 y los que tienen peor capacidad funcional110,118 parecen ser los que presentan una mejoría más importante de los síntomas. Además, los enfermos con mayor edad tienen con más frecuencia trastornos de conducción, con lo que suelen tener intervalos AV más prolongados y puede ser más fácil una programación correcta del marcapasos. Pero hay que tener en cuenta que el beneficio total para un paciente en concreto depende del grado de actividad previa, de forma que los ancianos y aquellos con mayor limitación se conformarían con incrementos más pequeños de la capacidad funcional que los pacientes más jóvenes y menos limitados113, presentando por tanto una mejoría subjetiva mayor.
Lo que sí parece claro es que aquellos pacientes que no tienen síntomas severos o que presentan obstrucción sólo tras maniobras de provocación y que tendrían, por otra parte, una evolución clínica favorable no deberían ser sometidos de forma innecesaria a una técnica que es invasiva19, con un efecto placebo nada despreciable104,110,118 y sobre la que actualmente no existen datos de resultados a largo plazo, además de que ni siquiera hay evidencia de que disminuya el riesgo de muerte súbita o altere la historia natural de la enfermedad123. Por tanto, el marcapasos no puede considerarse hoy día como tratamiento de elección para todos los pacientes con MH obstructiva y debería ser reservado para aquellos enfermos con MH obstructiva y síntomas severos que no mejoran con tratamiento médico que no desean operarse o que presentan problemas médicos concomitantes que elevan el riesgo quirúrgico112,113.
ABLACIÓN PERCUTÁNEA DE RAMAS SEPTALES
Concepto e indicaciones
La ablación percutánea de ramas septales es, quizá, la única forma de tratamiento cuyo fundamento consiste en ocasionar una lesión potencialmente deletérea124, y constituye la opción más recientemente introducida para el tratamiento de la MHO sintomática. Su aplicación inicial se basó en observaciones previas realizadas en el campo de la electrofisiología125; a ellas les siguieron experiencias aisladas en las que se comprobó que la oclusión transitoria de una arteria coronaria modificaba las funciones sistólica y diastólica en las áreas dependientes de ella126 y, de la misma manera, el gradiente de presión dinámico de los pacientes con MHO se reducía al ocluir la rama septal correspondiente127. Tras las publicaciones iniciales de Gietzen128 y Sigwart129, diversos trabajos han puesto de manifiesto la utilidad de la ablación percutánea en el tratamiento de la MHO130-134 y ya disponemos de los resultados a corto y medio plazo de las primeras series130-139 (tablas 3 y 4).
El objetivo de la embolización septal es la reducción de la masa ventricular izquierda en el septo interventricular proximal mediante la producción controlada de un infarto127,131. Sus indicaciones generales son similares a las de la cirugía, e incluyen los síntomas severos y refractarios al tratamiento médico en presencia de un gradiente subaórtico basal de al menos 40 mmHg o máximo superior a 60 mmHg128. Además, son imprescindibles una anatomía coronaria favorable y la ausencia de otros trastornos con indicación quirúrgica131. Se ha argumentado que el alivio de la obstrucción en las primeras fases podría atenuar e incluso prevenir la hipertrofia masiva, la fibrosis y sus complicaciones, pero no existen datos objetivos que justifiquen tratar las formas leves y/o los individuos asintomáticos140. En algunos centros se ha intervenido a pacientes con mejor grado funcional pero que no toleraban la medicación o tenían alto riesgo de muerte súbita131.
Descripción del procedimiento
El procedimiento es técnicamente sencillo. Comienza con la realización de mediciones ecocardiográficas y hemodinámicas basales y tras estimulación (con maniobras de Valsalva o después de una extrasístole ventricular) para obtener el gradiente máximo. A continuación, una coronariografía descarta la presencia de enfermedad coronaria o de anatomía desfavorable y permite una óptima selección angiográfica de la rama que se va a embolizar. La localización de la arteria diana mediante oclusión transitoria129,132 no predice el resultado final131,136. Seguidamente se realiza la inyección intracoronaria selectiva de alcohol o micropartículas, para inducir un infarto limitado, pudiendo ser necesario tratar más de una rama130. El etanol provoca deshidratación inmediata y necrosis de los miocitos125 que, dependiendo de su concentración local, puede causar una lesión transmural. Por último, se repite el estudio ecocardiográfico y hemodinámico. Recientemente se han introducido ciertos elementos técnicos, como la inyección selectiva de contraste intracoronario, que han mejorado los resultados y la seguridad, obviando potenciales efectos colaterales, como el tratamiento innecesario de determinadas ramas132, y procurando menores tasas de recurrencia131.
Resultados inmediatos
Transcurridos sólo unos segundos desde la inyección se puede ya observar, en el 85-95% de los pacientes, la primera consecuencia del infarto septal, que es la reducción del gradiente, basal y máximo127,129,130,132,133,139 (tabla 3). A continuación se aprecia el adelgazamiento septal130. La normalización de las presiones diastólicas aórtica y ventricular mejora la perfusión coronaria, reduce la isquemia y favorece el llenado2,131,141. En contra de la opinión de algunos autores, que consideran que esta técnica transforma la enfermedad de una forma no obstructiva, en la que persisten la disfunción diastólica y la tendencia arritmogénica de la aurícula izquierda136, datos actuales demuestran que la ablación septal facilita la relajación global del ventrículo a través de sus efectos predominantes en el tracto de entrada, que compensan la asincronía de otras zonas141,142. También se reduce la regurgitación mitral y, con ello, el tamaño de la aurícula143, y la presión pulmonar tiende a normalizarse. Estos resultados son similares a los comunicados tras cirugía58 y superiores al marcapasos19,130,132,133-144.
De la misma forma que tras la miectomía, la ablación mejora los síntomas145, traduciendo así los cambios hemodinámicos inducidos141 (tabla 4). El procedimiento suele ser bien tolerado145, pero casi la totalidad de los pacientes presentan angina durante y tras la ablación, y en las siguientes horas aparecen también datos electrocardiográficos y enzimáticos de infarto de miocardio. En el 50% de los casos asciende el segmento ST y en una cifra similar aparecen ondas Q, si bien estos hallazgos no son concordantes entre sí146. Por otro lado, la elevación enzimática guarda relación con la cantidad de etanol inyectada131, pero no con las dimensiones del infarto, que podría sobreestimarse, pues tras una agresión química se produce mayor elevación y con diferente progresión que cuando la causa es isquémica130.
Resultados a corto y medio plazo
La reducción del gradiente es máxima al cabo de unas semanas tras el procedimiento130,132-134,141,147, de forma que más de la mitad de los pacientes presenta una disminución adicional a consecuencia de un proceso de remodelado132. La clase funcional mejora significativamente7,136,137, pasando de ser 3,1 ± 0,5 basalmente a 1,06 ± 0,6 al primer año139 (tabla 4), y aumenta la tolerancia al esfuerzo cuantificada mediante ergometría, con un tiempo de ejercicio que asciende de 271 ± 160 hasta 407 ± 211 s, siendo ambas diferencias estadísticamente significativas (p = 0,024)139. Globalmente, la capacidad de ejercicio se incrementa en torno a un 40%134,136,148. No se ha evidenciado recurrencia durante el seguimiento136,137. Todo esto descarta el potencial efecto placebo que algunos le pretenden asignar124,133,148.
En algunas series, el control ecocardiográfico realizado a los 3 meses no evidencia dilatación del ventrículo izquierdo ni efecto sobre la función sistólica141. Sin embargo, a más largo plazo se observa una reducción del 28% en el grosor del septo y del 17% en la masa ventricular, lo que sugiere un remodelado del ventrículo133. En otras publicaciones también involuciona la pared posterior, probablemente por la mejoría de las presiones y parámetros diastólicos131,142. Aunque existe tendencia a la dilatación ventricular con el tiempo, ésta no es significativa, ya que dicho remodelado se restringe al área tratada130, induciéndose así cambios similares a la cirugía131,132,136,142. Por otra parte, estudios isotópicos objetivan sólo la existencia de una escara limitada y sin isquemia perilesional133.
Complicaciones y riesgos
Básicamente, la ablación septal constituye un procedimiento seguro, con rápida recuperación y baja morbimortalidad a corto-medio plazo129,140. El riesgo depende de la experiencia del profesional que lo realiza19 y se han descrito trastornos de conducción, arritmias ventriculares y muerte145,149. La mortalidad global asociada a la ablación, analizando conjuntamente las principales series de enfermos, es del 2%130-134, si bien aquí se incluyen la curva de aprendizaje y los resultados de una serie de enfermos con elevada comorbilidad134. Hasta la actualidad no se han identificado subgrupos con diferente riesgo.
Las complicaciones más frecuentes son los trastornos de conducción, debido a que el infarto se localiza en el inicio del sistema de conducción ventricular146. Los bloqueos de alto grado y la necesidad de marcapasos definitivo suponían el 15-20% en las primeras series130,144; su presencia es imprevisible y está directamente relacionada con la fibrosis inducida por la escara140,142,144. Más recientemente se comunican cifras superponibles a las obtenidas tras cirugía133,148. Entre los trastornos menores de conducción destaca la producción de bloqueo de rama en el 52-91% de los casos130,132,147, de los que la mitad es de rama derecha y carece de repercusión146. Sólo en el 10% de los casos aparece, de forma diferida, bloqueo de rama izquierda146.
El otro gran grupo de complicaciones son las taquiarritmias ventriculares originadas en la proximidad de la escara. En teoría, la cicatriz podría ser sustrato de arritmias malignas por reentrada y potencialmente existe riesgo de muerte súbita durante el seguimiento, lo que podría limitar la aplicación de esta técnica, en especial en sujetos jóvenes y niños19,140. Sin embargo, la aparición precoz de arritmias ventriculares es inferior al 2%, y además éstas cursan sin consecuencias clínicas148.
Finalmente, otro teórico problema es que, dado que la MH está causada por mutaciones en proteínas del sarcómero y que la hipertrofia ventricular característica de la enfermedad puede ser secundaria y compensadora del bajo rendimiento contráctil de un sarcórero anormal150,151, la provocación de un infarto en una amplia zona del miocardio septal podría ser poco prudente.
INDICACIÓN DEL TRATAMIENTO Y SELECCIÓN DE LA TÉCNICA
Son muchas las explicaciones que se intenta dar al hecho de que, a pesar de los incesantes avances realizados en el conocimiento de la MH, en la actualidad aún no se hayan esclarecido ciertos aspectos oscuros y relevantes, como son las directrices que deben regir su tratamiento. Por un lado, la MH es un proceso benigno y compatible con una esperanza de vida normal en la mayoría de los enfermos14,19. Por otro, no hay suficiente información que evidencie que el alivio de la obstrucción sea capaz de mejorar el pronóstico, además de que ninguna de las opciones actualmente vigentes ha demostrado detener la evolución natural del proceso; por ello, a priori se descarta el tratamiento de los pacientes asintomáticos14,57. Lo que sí parece claro es que la severidad de la obstrucción puede condicionar la intensidad de los síntomas, por lo que la reducción del gradiente debe ser un objetivo deseable14,127.
En general, una gran proporción de enfermos con MHO presentan escasos síntomas y son fácilmente controlables con medicación7-8,19,152. En ellos, los bloqueadores beta y la disopiramida resultan superiores a los antagonistas del calcio. Sólo en el caso particular en que se demuestre obstrucción dinámica severa y síntomas refractarios a medicación, lo que ocurre en no más de un 5-10% de los pacientes con MHO, se debe intentar otras formas de abordaje directo de la obstrucción8.
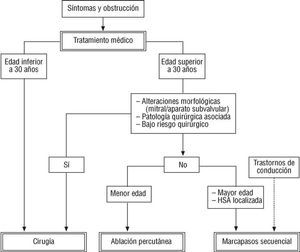
Las técnicas mejor asentadas son la ablación de ramas septales con abordaje percutáneo y, sobre todo, la cirugía, representada por la miectomía septal. Ambas adquieren progresivamente mayor solidez, mientras que la estimulación cardíaca permanente ha defraudado en sus expectativas iniciales140. Tanto la cirugía como la embolización septal han demostrado ejercer un efecto favorable y persistente60,61,69. Sus indicaciones específicas han sido ampliamente descritas en esta revisión. Una adecuada selección de los pacientes candidatos debe permitir la consecución de resultados todavía mejores, con cada vez mayor seguridad para el paciente. Si bien las dos son técnicas meramente paliativas129-131,134,148,153, cada vez hay más evidencia de que, cuando menos, no empeoran el pronóstico de la MHO. La preferencia por una u otra alternativa dependerá de factores como la anatomía coronaria, la coexistencia de otras enfermedadaes, o la afección valvular o subvalvular mitral y, por supuesto, de los recursos disponibles en cada centro (fig. 2). Es más, la elección de cualquiera de ellas no excluye la posible aplicación futura de la otra82,154. Por último, sólo en el caso particular de un reducido grupo de pacientes con MHO, generalmente mayores, que además tienen trastornos del ritmo asociados, podría plantearse la utilización de marcapasos secuenciales, pues la variabilidad de resultados comunicados por esta forma de tratamiento impide su extensión a otros supuestos112.
Fig. 2. Algoritmo terapéutico a seguir en los pacientes con MHO sintomática.
Este trabajo ha sido realizado con la colaboración de la Sociedad Española de Cardiología y la Sociedad Andaluza de Cardiología, que han otorgado sendas ayudas para estancias de Residentes de Cardiología en el extranjero. Correspondencia: Dra. A.M. Montijano Cabrera. Marcos de Obregón, 7; 7-4. 29016 Málaga. Correo electrónico: amontijano@medynet.com Recibido el 12 de diciembre de 2000. Aceptado para su publicación el 15 de agosto de 2001.