La evaluación del riesgo de arritmias ventriculares en pacientes con tetralogía de Fallot reparada (TFr) es compleja. Este estudio pretende identificar las características electrofisiológicas del ventrículo derecho (VD) asociadas con un mayor riesgo de arritmias ventriculares en pacientes con TFr.
MétodosSe incluyó a todos los pacientes consecutivos con TFr sometidos a mapeo electroanatómico del VD en un centro terciario. Mediante modelos de regresión logística, se identificaron los factores asociados con mayor riesgo de taquicardia ventricular (TV) clínica o inducida y, secundariamente, solo de TV clínica.
ResultadosDe los 56 pacientes incluidos, 21 presentaron TV clínica o inducida. Los factores asociados con TV clínica o inducida fueron: extrasistolia ventricular (EV) frecuente/TV no sostenida en el Holter de 24 h (OR=11,34; IC95%, 1,50-85,97; p=0,019), intervalo HV> 55ms (OR=21,20; IC95%, 3,12-144,14; p=0,002) y tiempo de activación del VD (por cada 10 ms, OR=1,34; IC95%, 1,02-1,75; p=0,035). El modelo que incluía dichas variables mostró una buena capacidad de discriminación, con un área bajo la curva de 0,884 (IC95%, 0,79-0,97; p <0,001). Cuando se consideró únicamente la TV clínica, las variables asociadas de manera independiente fueron el intervalo HV> 55ms (OR=9,65; IC95%, 1,41-66,14; p=0,021) y la EV frecuente/TV no sostenida (OR=13,14; IC95%, 1,95-88,54; p=0,008) (área bajo de la curva=0,836; IC95%, 0,663-1,000; p=0,002).
ConclusionesLa EV frecuente/TV no sostenida, el intervalo HV> 55ms y el tiempo de activación del VD son factores asociados con mayor riesgo de arritmias ventriculares en pacientes con TFr.
Palabras clave
La tetralogía de Fallot reparada (TFr) constituye el grupo más amplio de adultos con cardiopatía cianótica reparada, y se estima que su prevalencia es de alrededor de 0,23/1.000 habitantes1,2. A pesar de una buena supervivencia a largo plazo, las lesiones residuales conllevan un aumento de la morbilidad y la mortalidad en la edad adulta, en comparación con las de la población general.
La muerte súbita cardiaca es una de las principales causas de muerte en esta población con una incidencia estimada de 1,4/1.000 años-persona3,4. Además, se ha documentado una prevalencia elevada (14,6%) de arritmias ventriculares (AV) no mortales, en su mayor parte taquicardia ventricular (TV) monomórfica, en los adultos con TFr5.
Aunque se han descrito varios factores de riesgo en esta población, sigue habiendo controversia respecto a cuáles son los mejores factores predictivos de AV y muerte de causa cardiaca6–8. Estudios recientes indican que el mapeo electroanatómico del ventrículo derecho (VD) podría ser útil para identificar sustratos con un riesgo arritmogénico superior9,10. Sin embargo, la evidencia existente en el ámbito de la TFr continúa siendo escasa.
El objetivo de este estudio es identificar los parámetros clínicos y electrofisiológicos del VD que se asocian con mayor riesgo de AV en una población seleccionada de pacientes con TFr y alto riesgo.
MÉTODOSPoblación del estudioSe realizó un estudio ambispectivo en el que se incluyó a todos los pacientes consecutivos con TFr remitidos para estudio electrofisiológico (EEF) y mapeo electroanatómico del VD en un centro terciario de referencia entre julio de 2006 y julio de 2017. Se incluyó a la mayoría de los pacientes (n=50) de manera prospectiva en el momento del EEF (noviembre de 2012 a julio de 2017); además, se incluyó retrospectivamente a otros 6 pacientes (marzo de 2006 a octubre de 2012). Siguiendo lo establecido en nuestro protocolo clínico estándar, las indicaciones de EEF y mapeo electroanatómico del VD para los pacientes con TFr fueron: TV espontánea documentada, sospecha clínica de TV y estratificación del riesgo (con posible ablación) antes de reemplazo de la válvula pulmonar. El estudio se atuvo a las normas nacionales e internacionales (Declaración de Helsinki de 2013) y fue aprobado por el Comité de Ética del Instituto de Investigación Vall d’Hebron (VHIR). Todos los pacientes dieron su consentimiento informado específico para el estudio.
Se obtuvieron datos clínicos, ecocardiográficos, de resonancia magnética, del electrocardiograma basal (sin estimulación), del EEF y del mapeo electroanatómico. Se obtuvo la información relativa a la presencia de episodios de taquicardia ventricular no sostenida (TVNS) o extrasistolia ventricular (EV) frecuente (> 30/h)11 a partir de los registros electrocardiográficos, la monitorización con Holter de 24 h o la interrogación del desfibrilador automático implantable.
Estudio electrofisiológico y mapeo electroanatómico del ventrículo derechoSe suspendió la administración de los fármacos antiarrítmicos 5 periodos de semivida antes del procedimiento. El EEF se llevó a cabo con sedación superficial consciente y por acceso venoso femoral. Se evaluó la conducción auriculoventricular basal. Se aplicó estimulación ventricular programada para la inducibilidad de TV a 3 ciclos basales (600/500/400ms) con acoplamiento de hasta 3 extraestímulos hasta llegar al periodo refractario o 200ms, desde el ápex del VD y en el tabique infundibular, tanto al inicio como durante la infusión de isoproterenol (2-10 μg/min). La estimulación ventricular programada se consideró positiva en caso de inducción de TV sostenida (monomórfica o polimórfica) o fibrilación ventricular.
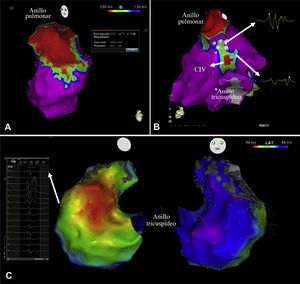
Se realizó mapeo electroanatómico tridimensional de VD durante ritmo sinusal, utilizando el QRS como referencia, con Ensite Velocity (n=11) y Ensite Precision (n=4) (Abbott) o Carto XP (n=4) y Carto 3 (n=37) (Biosense Webster). Los catéteres de mapeo utilizados fueron NaviStar (n=41) (Biosense Webster) y Cool-Flex (n=14) y Tacticath Quartz (n=1) (Abbott). Se registraron las características del electrograma (amplitud bipolar pico-pico y tiempo de activación local, definido como la deflexión aguda del electrograma bipolar local coincidente con el máximo descenso de la señal unipolar local) en cada punto con contacto y se codificaron en mapas de color de voltaje y secuencia de activación sobre la carcasa anatómica del VD (figura 1). Los puntos se obtuvieron en localizaciones estables y con adecuado contacto a un umbral de 15mm. De acuerdo con la literatura previa12, los electrogramas con un voltaje pico-pico <1,5mV se consideraron de bajo voltaje y las áreas con un mínimo de 3 puntos adyacentes con un voltaje pico-pico <0,5mV se consideraron áreas de cicatriz. Se midieron las áreas de cicatriz de todo el VD y del tracto de salida (infundíbulo) del VD (TSVD) y se calculó el porcentaje de cicatriz respecto al área total del VD. Se cuantificaron los istmos anatómicos con una amplitud de voltaje > 0,5mV entre las áreas de cicatriz y los anillos valvulares (figura 1). Se etiquetaron los electrogramas fragmentados (EGMF), definidos como aquellos con al menos 4 deflexiones, duración > 40ms y voltaje <1mV13, así como los potenciales dobles (PD), definidos como aquellos con 2 componentes separados por una línea isoeléctrica (figura 1). Con objeto de obtener una localización uniforme de los EGMF y los PD, se segmentó el VD en 7 áreas anatómicas (tabique del VD, pared anterior del VD, pared posterior del VD, comunicación interventricular, TSVD septal, TSVD anterior y TSVD posterior) y se calculó el número de áreas con EGMF y con PD. Se determinó el tiempo total de activación del VD, definido como el tiempo transcurrido entre el primero y el último de los electrogramas, y el tiempo de activación infundibular, definido como el tiempo entre el borde septal y el borde lateral de la comunicación interventricular.
A: área de cicatriz del tracto de salida del ventrículo derecho (en rojo) en el mapa de voltaje de un paciente con una reparación con un parche transanular. B: vista posterior del mapa de voltaje del ventrículo derecho que muestra un área de cicatriz en la CIV; se han marcado en el mapa los potenciales dobles y los electrogramas fragmentados con puntos azules y rosas respectivamente. C: mapa de activación de un paciente con un tiempo de activación del ventrículo derecho de 108ms. CIV: comunicación interventricular. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Las variables se presentan como media±DE, mediana [intervalo intercuartílico] o n (%), según proceda. Las diferencias entre los grupos se compararon con la prueba exacta de Fisher, la prueba de la t de Student o la de la U de Mann-Whitney, según procediera. El objetivo principal fue la aparición, en cualquier momento, de AV espontánea o inducida. Para conseguir una mayor aplicabilidad clínica, se definió también un objetivo secundario para el que se evaluó exclusivamente la presencia de AV espontánea. Las variables asociadas con ambos objetivos se exploraron con el análisis de regresión logística. Las variables continuas se categorizaron en estratos para su simplificación. Los estratos establecidos para el tiempo de activación del VD fueron cada 10ms a partir del número entero más próximo al valor mínimo (60ms). Se incluyeron en el modelo multivariable las variables que presentaban una asociación con p <0,1 y las consideradas de interés clínico. Se evaluaron los diversos modelos para elegir el que contuviera el menor número de variables posible y maximizara la capacidad de discriminación, evaluada mediante el área bajo la curva (AUC) de características operativas del receptor. El nivel de significación estadística se estableció en 0,05 para todos los análisis. Los análisis estadísticos se llevaron a cabo con los programas informáticos IBM SPSS 20.0 y RStudio.
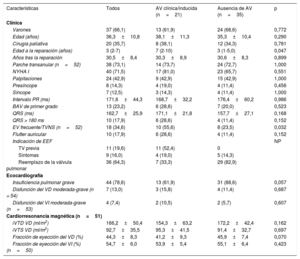
RESULTADOSPoblación del estudioSe incluyó en el estudio a 56 pacientes con TFr. En la tabla 1 se presentan las características basales de la población del estudio. En todas las cirugías reparadoras se utilizó un abordaje transventricular. A 38 pacientes se les implantó un parche transanular para ampliar el TSVD; a 3, un conducto entre el VD y la arteria pulmonar y a 15, solo se les practicó una ventriculotomía. Al momento del EEF, 8 pacientes se habían sometido a reemplazo de la válvula pulmonar a causa de una insuficiencia pulmonar grave y 5, a una ablación focal que no había sido efectiva. Treinta y nueve pacientes (69%) presentaban síntomas consistentes en palpitaciones (n=24), presíncope (n=8) o síncope (n=7). En términos generales, el estado funcional evaluado por el clínico responsable del paciente fue bueno (en clase I de la NYHA, 40 pacientes; clase II, 14 y clase III-IV, 2). Las exploraciones de diagnóstico por la imagen confirmaron que casi un 80% de los pacientes presentaban una insuficiencia pulmonar grave, si bien en la inmensa mayoría la función sistólica de ambos ventrículos estaba conservada o mostraba solo una reducción leve.
Características clínicas
| Características | Todos | AV clínica/inducida (n=21) | Ausencia de AV (n=35) | p |
|---|---|---|---|---|
| Clínica | ||||
| Varones | 37 (66,1) | 13 (61,9) | 24 (68,6) | 0,772 |
| Edad (años) | 36,3±10,8 | 38,1±11,3 | 35,3±10,4 | 0,290 |
| Cirugía paliativa | 20 (35,7) | 8 (38,1) | 12 (34,3) | 0,781 |
| Edad a la reparación (años) | 3 (2-7) | 7 (2-10) | 3 (1-5,0) | 0,047 |
| Años tras la reparación | 30,5±8,4 | 30,3±8,9 | 30,6±8,3 | 0,899 |
| Parche transanular (n=52) | 38 (73,1) | 14 (73,7) | 24 (72,7) | 1,000 |
| NYHA I | 40 (71,5) | 17 (81,0) | 23 (65,7) | 0,551 |
| Palpitaciones | 24 (42,9) | 9 (42,9) | 15 (42,9) | 1,000 |
| Presíncope | 8 (14,3) | 4 (19,0) | 4 (11,4) | 0,456 |
| Síncope | 7 (12,5) | 3 (14,3) | 4 (11,4) | 1,000 |
| Intervalo PR (ms) | 171,6±44,3 | 168,7±32,2 | 176,4±60,2 | 0,986 |
| BAV de primer grado | 13 (23,2) | 6 (28,6) | 7 (20,0) | 0,523 |
| QRS (ms) | 162,7±25,9 | 171,1±21,8 | 157,7±27,1 | 0,168 |
| QRS > 180 ms | 10 (17,9) | 6 (28,6) | 4 (11,4) | 0,152 |
| EV frecuente/TVNS (n=52) | 18 (34,6) | 10 (55,6) | 8 (23,5) | 0,032 |
| Flutter auricular | 10 (17,9) | 6 (28,6) | 4 (11,4) | 0,152 |
| Indicación de EEF | NP | |||
| TV previa | 11 (19,6) | 11 (52,4) | 0 | |
| Síntomas | 9 (16,0) | 4 (19,0) | 5 (14,3) | |
| Reemplazo de la válvula pulmonar | 36 (64,3) | 7 (33,3) | 29 (82,9) | |
| Ecocardiografía | ||||
| Insuficiencia pulmonar grave | 44 (78,6) | 13 (61,9) | 31 (88,6) | 0,057 |
| Disfunción del VD moderada-grave (n = 54) | 7 (13,0) | 3 (15,8) | 4 (11,4) | 0,687 |
| Disfunción del VI moderada-grave (n=53) | 4 (7,4) | 2 (10,5) | 2 (5,7) | 0,607 |
| Cardiorresonancia magnética (n=51) | ||||
| iVTD VD (ml/m2) | 166,2±50,4 | 154,3±63,2 | 172,2±42,4 | 0,162 |
| iVTS VD (ml/m2) | 92,7±35,5 | 95,3±41,5 | 91,4±32,7 | 0,697 |
| Fracción de eyección del VD (%) | 44,3±8,3 | 41,2±9,3 | 45,9±7,4 | 0,070 |
| Fracción de eyección del VI (%) (n=50) | 54,7±6,0 | 53,9±5,4 | 55,1±6,4 | 0,423 |
AV: arritmia ventricular; EEF: estudio electrofisiológico; EV: extrasistolia ventricular; iVTD: índice de volumen telediastólico; iVTS: índice de volumen telesistólico; NP: no procede; TV: taquicardia ventricular; TVNS: taquicardia ventricular no sostenida; VD: ventrículo derecho; VI: ventrículo izquierdo.
Los valores expresan n (%) o media ± desviación estándar.
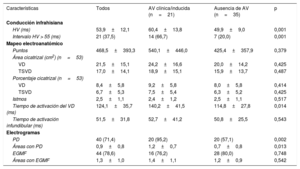
En la tabla 2 se muestran los valores de los parámetros del EEF y el mapeo electroanatómico obtenidos durante el mismo procedimiento. En el procedimiento en que se realizó el mapeo, se indujeron un total de 17 TVMS en 14 pacientes con una longitud media de ciclo de 291,9±68,5ms (200-410 ms). No se indujo ningún episodio de TV polimórfica ni de fibrilación ventricular. Se documentó una conducción infrahisiana patológica en 21 pacientes (38%).
Características electrofisiológicas
| Características | Todos | AV clínica/inducida (n=21) | Ausencia de AV (n=35) | p |
|---|---|---|---|---|
| Conducción infrahisiana | ||||
| HV (ms) | 53,9±12,1 | 60,4±13,8 | 49,9±9,0 | 0,001 |
| Intervalo HV > 55 (ms) | 21 (37,5) | 14 (66,7) | 7 (20,0) | 0,001 |
| Mapeo electroanatómico | ||||
| Puntos | 468,5±393,3 | 540,1±446,0 | 425,4±357,9 | 0,379 |
| Área cicatrizal (cm2) (n=53) | ||||
| VD | 21,5±15,1 | 24,2±16,6 | 20,0±14,2 | 0,425 |
| TSVD | 17,0±14,1 | 18,9±15,1 | 15,9±13,7 | 0,487 |
| Porcentaje cicatrizal (n=53) | ||||
| VD | 8,4±5,8 | 9,2±5,8 | 8,0±5,8 | 0,414 |
| TSVD | 6,7±5,3 | 7,5±5,4 | 6,3±5,2 | 0,425 |
| Istmos | 2,5±1,1 | 2,4±1,2 | 2,5±1,1 | 0,517 |
| Tiempo de activación del VD (ms) | 124,1±35,7 | 140,2±41,5 | 114,8±27,8 | 0,014 |
| Tiempo de activación infundibular (ms) | 51,5±31,8 | 52,7±41,2 | 50,8±25,5 | 0,543 |
| Electrogramas | ||||
| PD | 40 (71,4) | 20 (95,2) | 20 (57,1) | 0,002 |
| Áreas con PD | 0,9±0,8 | 1,2±0,7 | 0,7±0,8 | 0,013 |
| EGMF | 44 (78,6) | 16 (76,2) | 28 (80,0) | 0,748 |
| Áreas con EGMF | 1,3±1,0 | 1,4±1,1 | 1,2±0,9 | 0,542 |
AV: arritmia ventricular; EGMF: electrogramas fragmentados; PD: potenciales dobles; TSVD: tracto de salida del ventrículo derecho; VD: ventrículo derecho.
Los valores expresan n (%) o de media ± desviación estándar.
El mapeo electroanatómico de alta densidad (media, 469 puntos) puso de relieve que todos los pacientes tenían cicatriz en el VD con un área que abarcaba una media del 8% del tejido del VD (en 3 casos no pudo calcularse la extensión de la cicatriz por razones técnicas). En la mayor parte de los pacientes, las áreas de cicatriz se encontraban en las regiones afectadas por la cirugía reparadora (TSVD, comunicación interventricular y pared anterior del VD). Otras ubicaciones de la cicatriz (pared inferior y otras localizaciones septales) fueron infrecuentes (11%). Todos los pacientes mostraron como mínimo 1 istmo anatómico, con una media de 2,5 istmos por paciente.
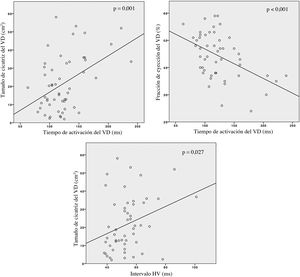
Los valores medios del tiempo de activación del VD y del tiempo de activación infundibular fueron de 124,1±35,7 y 51,5±31,8ms respectivamente. Se documentó correlación entre el tiempo de activación del VD y los parámetros anatómicos y funcionales del VD (figura 2), de tal manera que se observó una correlación positiva con el tamaño de la cicatriz (r=0,455; p=0,001) y una correlación negativa con la fracción de eyección del VD (r=–0,475; p <0,001). De igual modo, el tamaño de la cicatriz mostró una correlación similar con el intervalo HV (r=0,307; p=0,027) (figura 2).
Las prevalencias de PD y EGMF en el conjunto de la población fueron altas (el 71 y el 79%) y solo en 3 pacientes no se encontraron electrogramas patológicos. En el conjunto de la población, se observó la presencia de PD y EGMF en una media de 0,9±0,8 y 1,3±1,0 áreas anatómicas, en su mayoría en el TSVD y alrededor de la comunicación interventricular.
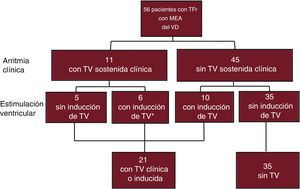
Variables asociadas con AVDe los 56 pacientes, 21 presentaron AV espontánea o inducida; 11 pacientes tuvieron TV clínica (1 de ellos, también un episodio de muerte súbita cardiaca recuperada) y a otros 10 pacientes sin ninguna AV previa se indujo TV sostenida en el EEF (figura 3). De los 11 pacientes con TV clínica, 4 fueron también inducibles en el procedimiento en el que se realizó el mapeo electroanatómico y otros 2 habían sido inducibles en un EEF previo. A 5 de los pacientes se les había implantado un desfibrilador automático implantable antes del EEF. Los otros 35 pacientes constituyeron el grupo sin AV.
El análisis univariante (tabla 1) puso de manifiesto que los pacientes con AV eran de más edad cuando se les practicó la reparación quirúrgica (mediana de edad, 7 frente a 3 años; p=0,047) y mostraban una mayor prevalencia de EV frecuente/TVNS (el 56 frente al 24%; p=0,032). La función sistólica del VD medida por cardiorresonancia magnética tendió a ser inferior en el grupo de pacientes con AV, si bien las dimensiones del VD fueron similares en los 2 grupos.
No se observaron diferencias significativas entre los 2 grupos por lo que respecta a la edad en el momento de la evaluación, el tiempo transcurrido tras la intervención, la función ventricular izquierda, los antecedentes de cirugía paliativa, la aplicación de un parche transanular, los síntomas asociados con la arritmia y los parámetros del electrocardiograma basal.
El tiempo de conducción infrahisiano fue significativamente más largo en el grupo de pacientes con AV (intervalo HV, 60,4±13,8 frente a 49,9±9,0ms; p=0,001), con un porcentaje más alto de pacientes con alteraciones de la conducción infrahisiana (el 67 frente al 21%; p=0,001) (tabla 2). La extensión del área de cicatriz en el VD y el TSVD fue similar en los 2 grupos. El tiempo de activación del VD fue significativamente más largo en el grupo con AV (140,2±41,5 frente a 114,8±22,8ms; p=0,014), aunque no se observaron diferencias significativas entre los grupos en el tiempo de activación infundibular (52,74±41,23 frente a 50,76±35,51 ms; p=0,543). Los pacientes con AV mostraron una prevalencia de PD significativamente superior (el 95 frente al 57%; p=0,002) y un mayor número de áreas anatómicas con PD (1,24±0,7 frente a 0,71±0,75; p=0,013). Sin embargo, no se observaron diferencias en cuanto a la prevalencia de EGMF ni en el número medio de áreas con EGMF (tabla 2).
Respecto a las variables que mostraron una asociación con el objetivo principal en el análisis univariante, el modelo multivariante más conciso fue el elaborado con el número mínimo de variables con la máxima capacidad de discriminación. El modelo final incluyó las siguientes variables (tabla 3): un intervalo HV > 55ms (odds ratio [OR] = 21,20; IC95%, 3,11-144,14; p=0,002); la presencia de EV frecuente/TVNS (OR = 11,33; IC95%, 1,50-85,97; p=0,019) y el tiempo de activación del VD (por intervalo de 10ms, OR = 1,34; IC95%, 1,02-1,75; p=0,035). El modelo que incluía esta información mostró una capacidad de discriminación, evaluada con el AUC, de 0,884 (IC95%, 0,79-0,97; p <0,001). No se confirmó que otros factores como la edad en el momento de la reparación quirúrgica, la presencia de PD y el número de áreas con PD, que se asociaban con la AV en el análisis univariante, tuvieran una asociación independiente en el análisis multivariante.
Modelo multivariable
| AV clínica o inducida | |||
| Variable | OR | IC95% | p |
| EV frecuente/TVNS | 11,33 | 1,50-85,97 | 0,019 |
| Intervalo HV > 55 ms | 21,20 | 3,11-144,14 | 0,002 |
| Tiempo de activación del VD estratificado (intervalos de 10ms) | 1,34 | 1,02-1,75 | 0,035 |
| AV clínica | |||
| Variable | OR | IC95% | p |
| EV frecuente/TVNS | 13,14 | 1,95-88,54 | 0,008 |
| Intervalo HV > 55 ms | 9,65 | 1,41-66,14 | 0,021 |
AV: arritmia ventricular; EV: extrasistolia ventricular; IC95%: intervalo de confianza del 95%; OR: odds ratio; TVNS: taquicardia ventricular no sostenida; VD: ventrículo derecho.
Como objetivo secundario y a fin de proporcionar una orientación de mayor aplicabilidad clínica, también se evaluaron las variables que podían asociarse exclusivamente con la AV clínica (n=11). Es de destacar que la inducibilidad de TV se consideró en este caso uno de los factores predictivos de interés. Los resultados del análisis univariante se presentan en la . En el modelo multivariante (tabla 3), solo la EV frecuente/TVNS (OR = 13,14; IC95%, 1,95-88,54; p=0,008) y un intervalo HV > 55ms (OR = 9,65; IC95%, 1,41-66,14; p=0,021) mostraron una asociación independiente con la TV espontánea. El modelo que incluía estas variables mostró una potencia de discriminación, evaluada con el AUC, de 0,836 (IC95%, 0,663-1,000; p=0,002).
DISCUSIÓNLas AV son una complicación frecuente en los adultos con TFr, que aumenta la morbilidad e incluso puede producir muerte súbita cardiaca3–5,14. Además, los pacientes con TFr y desfibrilador automático implantable tienen altas tasas de descargas inapropiadas7. Así pues, la evaluación del riesgo de AV es crucial para aplicar medidas de prevención eficaces. El presente estudio pone de manifiesto que el EEF y el mapeo electroanatómico del VD proporcionan una información útil para la evaluación del riesgo arrítmico en esta población. Concretamente, un HV > 55ms, la EV frecuente/TVNS y el tiempo de activación del VD medido en el mapeo electroanatómico se asociaron con AV espontánea o inducida. Además, cuando se tuvieron en cuenta solo los eventos clínicos como resultado de interés, un HV > 55ms y la EV frecuente/TVNS mostraron también una asociación independiente.
Las exploraciones invasivas han mostrado que la mayoría de las TV de los pacientes con TFr son secundarias a un mecanismo de macrorreentrada que afecta al VD15. Las cicatrices quirúrgicas, los obstáculos anatómicos y la lesión del tejido miocárdico constituyen el sustrato arritmógeno perfecto. Tal como se preveía, teniendo en cuenta el tipo de abordaje quirúrgico empleado en la cirugía de reparación, todos los pacientes de nuestra serie tenían cicatriz en el VD y al menos 1 istmo anatómico. La mayor parte de estas cicatrices se encontraban en regiones afectadas por la cirugía previa y solo en unos pocos casos (11%) había otras áreas del VD afectadas. Aunque podría parecer razonable encontrar una relación entre la extensión de la cicatriz y la propensión a las arritmias, no se observaron diferencias significativas entre el grupo de pacientes con AV clínicas o inducidas y el grupo sin arritmias. Esto difiere de lo observado anteriormente mediante técnicas de imagen para la evaluación de la fibrosis densa. Babu-Narayan et al.16 observaron una asociación entre la extensión de la fibrosis ventricular por cardiorresonancia magnética y el riesgo de arritmias en pacientes con TFr. Sin embargo, en este caso, los autores consideraron las arritmias auriculares como un evento arrítmico y, por otra parte, en nuestro contexto no puede darse por sentada la existencia de una correlación exacta entre la cicatriz evaluada por cardiorresonancia magnética y el mapeo electroanatómico. A este respecto, de manera similar a lo observado en el presente análisis, Drago et al.10 no observaron asociación alguna entre el área de bajo voltaje y la inducibilidad de TV en una serie de pacientes con TFr en los que se realizó mapeo electroanatómico del VD.
Tiene interés señalar que hubo otros parámetros del mapeo electroanatómico del VD que mostraron una asociación con el riesgo de AV en nuestra cohorte. Un tiempo de activación del VD más prolongado se asoció con AV clínicas o inducidas en el análisis multivariante (por intervalo de 10ms, OR = 1,34; IC95%, 1,02-1,75; p=0,035). La conducción ventricular más lenta es una manifestación de un miocardio dañado, lo cual es coherente con que se observara correlación positiva entre esta variable y la extensión de la cicatriz. Desde un punto de vista fisiopatológico, una activación más prolongada del VD en ritmo sinusal podría ser consecuencia de que haya áreas de conducción eléctrica lenta que pueden ser el sustrato de TV por reentrada. Esto coincide con los resultados de Kapel et al.9, que indicaron que los istmos arritmógenos del VD en pacientes con TFr tenían una velocidad de conducción inferior a la de los istmos no arritmógenos. Debe señalarse que la velocidad de conducción del istmo puede ser difícil de medir debido a la complejidad de delimitar el borde del istmo. No ocurre lo mismo con el tiempo de activación del VD, que puede obtenerse con facilidad en el mapa del VD en ritmo sinusal. El tiempo de activación del infundíbulo, que es donde se encuentra con más frecuencia un istmo arritmógeno, no mostró una prolongación significativa en los pacientes con AV. Esto puede estar relacionado con que el tiempo de activación del VD, a diferencia del tiempo de activación infundibular, refleja la afección general del miocardio del VD. De hecho, se demostró una correlación negativa entre la función y el tiempo de activación del VD, lo cual pone de relieve que los pacientes con una mayor afección del VD tienen ciertas características electrofisiológicas que los hacen más vulnerables a las AV.
Los EGMF y los PD podrían considerarse la expresión electroanatómica de la presencia de áreas de conducción lenta y de bloqueo funcional o anatómico. Sin embargo, ni la presencia de EGMF ni su extensión anatómica mostraron una asociación con el riesgo de AV. Los EGMF son una expresión focal de daño tisular. Sin embargo, las AV en pacientes con TFr, a diferencia de lo que ocurre en la cardiopatía isquémica, no son consecuencia de pequeños canales inmersos en la cicatriz, sino que más bien son un fenómeno de macrorreentrada que afecta a istmos anatómicos de mayor tamaño, en los que una velocidad de conducción enlentecida no se manifiesta por este tipo de potencial local. Aunque en el análisis univariante la prevalencia de PD y el número medio de áreas de PD fueron significativamente mayores en el grupo con TV clínica o inducida, no hubo una asociación independiente con las AV en el modelo final. De hecho, los PD pueden corresponder también a un bloqueo de la conducción eléctrica que puede llegar a impedir la aparición de arritmias por reentrada.
Uno de los resultados principales de este estudio es que los pacientes con AV tenían un intervalo HV significativamente más largo. Un intervalo HV anormal se asoció con AV clínica o inducida (OR = 21,20; IC95%, 3,12-144,14; p=0,002) y también AV clínica (OR = 9,65; IC95%, 1,41-66,14; p=0,021). La información disponible en la literatura médica respecto a la posible asociación entre una conducción auriculoventricular anormal y las AV en la TFr es escasa. Garson et al.17 estudiaron a un grupo de 27 pacientes con TFr sometidos a EEF, y observaron que los pacientes a los que se podía inducir una TV sostenida o una TVNS tenían un intervalo HV significativamente más largo. Además, Kimura et al.18 observaron que el bloqueo auriculoventricular de primer grado y la prolongación del intervalo PR (≥ 2ms/año) eran factores de riesgo que se asociaban de manera independiente con las AV mortales en una cohorte de 176 pacientes con TFr. Sin embargo, en nuestra serie ni el intervalo PR ni el bloqueo auriculoventricular de primer grado mostraron asociación con las AV. Además del efecto del tamaño muestral, el intervalo HV podría ser un parámetro más sensible, puesto que, a diferencia del intervalo PR, no se ve afectado por la variabilidad de la conducción nodular. Las razones de la asociación entre la conducción infrahisiana prolongada y la TV pueden ser diversas. Un intervalo HV prolongado podría ser consecuencia de una cirugía reparadora más agresiva y, por consiguiente, puede reflejar una lesión más amplia del miocardio ventricular. Esto concuerda con que se observara una correlación positiva significativa entre la extensión del tejido cicatrizal y el intervalo HV (r=0,307; p=0,027). Además, el deterioro de la conducción infrahisiana podría producir asincronía ventricular y disfunción sistólica, con lo que aumenta el riesgo de AV. A este respecto, el intervalo PR mostró una correlación significativa con la dilatación y la disfunción del VD en el estudio de Kimura et al.18. En el presente estudio, la función sistólica del VD tendió a ser peor en el grupo con TV clínica o inducida, aunque sin alcanzar significación estadística.
Respecto a las variables clínicas, solo se pudo observar una asociación entre la EV frecuente/TVNS y la TV. Desde un punto de vista fisiopatológico, parece razonable plantear la hipótesis de que la EV frecuente/TVNS pueda desencadenar una TV sostenida. Además, esta observación coincide con lo ya publicado5,6,19. Aunque el pequeño tamaño de la muestra nos impide extraer conclusiones definitivas a este respecto, la fuerza de la asociación entre la EV frecuente/TVNS y la variable de interés indica que tal vez sea la información de mayor trascendencia clínica con fines predictivos. La ausencia de asociación entre la disfunción del VD y la TV es llamativa, aunque la función sistólica del VD tendió a ser inferior en el grupo con AV y estuvo relacionada con los 2 factores de riesgo electrofisiológicos identificados (tiempo de activación del VD y conducción infrahisiana anormal). Esto resalta la mayor exactitud predictiva de los marcadores electrofisiológicos para la estratificación del riesgo de AV en la población con TFr.
Hasta donde sabemos, este es el primer estudio que establece 2 parámetros determinados de forma invasiva (intervalo HV y tiempo de activación del VD) como factores asociados con la AV en los pacientes con TFr. Estos factores, además de la EV frecuente/TVNS, son útiles para evaluar el sustrato arritmógeno en los pacientes con TFr. La contribución relativa de los parámetros invasivos y los parámetros clínicos en la predicción de los eventos arrítmicos en los pacientes con TFr deberá abordarse en futuros estudios con poblaciones más amplias. Si nuestros resultados se reproducen en otros estudios, podría revaluarse una posible nueva indicación de EEF para los pacientes con TFr. Desde un punto de vista clínico, tiene más interés la identificación de los individuos en riesgo de AV clínica que la de aquellos con una AV inducida en el EEF. Por este motivo, se llevó a cabo un análisis de regresión incluyendo solo la AV clínica como resultado de interés. Tanto el intervalo HV patológico como la EV frecuente/TVNS mostraron una asociación significativa con la AV en el análisis multivariante. Aunque fue significativa en el análisis univariante, en el multivariante no se confirmó que la inducibilidad de TV se asociara de manera independiente con la AV clínica. Esto podría ser consecuencia del pequeño tamaño muestral y de la baja tasa de eventos en nuestra población, ya que la inducibilidad de la TV es un reconocido factor de riesgo de AV en los pacientes con TFr20. Asimismo el mapa de activación del VD mostró en el análisis univariante una asociación con la AV clínica que no se confirmó en el modelo multivariable. Serán necesarios nuevos estudios en series de pacientes más grandes para esclarecer el papel real del mapeo del VD en la predicción de la AV clínica en los pacientes con TFr.
LimitacionesEl tamaño de nuestra muestra es pequeño. Sin embargo, el estudio aporta datos preliminares sobre posibles nuevos parámetros asociados con la AV en los pacientes con TFr con una buena capacidad de discriminación. Además sienta las bases para nuevos estudios, muy probablemente multicéntricos, que incluyan una población de pacientes más amplia. En el presente estudio se incluyó a una población seleccionada de pacientes con TFr remitidos para EEF tras documentarse o sospecharse TV o con indicación de reemplazo de la válvula pulmonar. Por consiguiente, en futuros estudios específicos deberá evaluarse la aplicabilidad de nuestros resultados a la población general de pacientes con TFr. Cuando se llevó a cabo el EEF, a 5 pacientes se les había practicado anteriormente una ablación focal que no resultó eficaz. Estas intervenciones se realizaron sin sistemas de navegación y mapeo y, por otra parte, los abordajes utilizados se limitaron a la ablación focal, que resultó clínicamente ineficaz, por lo que creemos que no tuvo repercusión alguna en el tiempo de activación del VD. Es importante señalar que un análisis de sensibilidad con la exclusión de estos pacientes no mostró cambios importantes en los modelos de regresión logística ().
CONCLUSIONESUna evaluación no invasiva e invasiva combinada mediante monitorización Holter, EEF y mapeo electroanatómico del VD puede ser útil para evaluar el riesgo de AV en los pacientes con TFr. Un intervalo HV > 55ms, el tiempo de activación del VD y la EV frecuente/TVNS se asocian con AV clínica o inducida en una población seleccionada de pacientes con TFr. Además, un intervalo HV > 55ms y la EV frecuente/VTNS muestran asociación con la AV clínica. Los resultados de nuestra serie ponen de manifiesto que los parámetros electrofisiológicos pueden desempeñar un papel en la estratificación del riesgo de AV en los pacientes con TFr.
CONFLICTO DE INTERESESLa Unidad de Arritmias recibe subvenciones de formación de Boston Scientific y subvenciones de investigación de Abbott. N. Rivas-Gándara recibe honorarios por asesoramiento y conferencias de Abbott. J. Francisco-Pascual, B. Benito, J. Perez-Rodon y A. Santos-Ortega reciben honorarios por conferencias de Abbott. Los demás autores no declaran conflictos de intereses.
I. Ferreira-González es editor jefe de Rev Esp Cardiol. Se ha seguido el procedimiento editorial establecido por la Revista para garantizar un tratamiento imparcial del manuscrito.
Los pacientes con una tetralogía de Fallot reparada están en alto riesgo de taquicardia ventricular y muerte súbita cardiaca. La estratificación del riesgo de arritmias ventriculares es crucial para aplicar medidas preventivas eficaces e individualizadas. Estudios recientes indican que el mapeo electroanatómico del ventrículo derecho podría ser útil para identificar sustratos de mayor riesgo arritmogénico.
El estudio electrofisiológico invasivo y el mapeo electroanatómico del ventrículo derecho son útiles para la estratificación del riesgo de arritmias ventriculares en los pacientes con una tetralogía de Fallot reparada. Una conducción infrahisiana anormal (intervalo HV > 55 ms) y un tiempo de activación del ventrículo derecho más prolongado son marcadores electrofisiológicos del riesgo de arritmias de los pacientes con tetralogía de Fallot reparada.