Palabras clave
INTRODUCCIÓN
La enfermedad cardiovascular aterosclerótica es un problema global de salud pública de importancia cada vez mayor. A pesar de los avances que se han realizado en el tratamiento de la enfermedad coronaria clínicamente manifiesta, las recidivas son frecuentes. Un aspecto que tiene aún mayor importancia es el hecho de que el inicio del tratamiento tras un episodio clínico representa un abordaje terapéutico demasiado tardío. Por tanto, se sigue investigando intensamente para identificar estrategias que permitan reducir de manera eficaz el riesgo vascular. La demostración de una reducción de las complicaciones clínicas en respuesta a los tratamientos concretos sigue siendo la prueba sine qua non de su efecto terapéutico. Sin embargo, la evaluación del impacto de las potenciales estrategias preventivas se debe llevar a cabo en el contexto de una combinación de múltiples agentes con eficacia demostrada. Las elevadas tasas de administración concomitante de aspirina, bloqueadores beta y estatinas, además del control activo de la presión arterial y la glucemia, van a dar lugar a una disminución sustancial de las tasas de complicaciones en los grupos placebo. Debido a ello, será necesario incluir en los estudios un número cada vez mayor de pacientes en los que se tendrá que realizar un seguimiento durante muchos años para alcanzar una tasa de episodios clínicos suficiente que permita evaluar la eficacia terapéutica de los agentes experimentales. La introducción de modalidades de imagen que permiten visualizar la pared arterial ofrece una oportunidad única para controlar las modificaciones en el tamaño y la morfología de la placa aterosclerótica en respuesta a la administración de posibles tratamientos antiateroscleróticos. Los estudios con estas modalidades de imagen pueden ofrecer una información preliminar muy valiosa para el diseño de ensayos clínicos con asignación aleatoria y de gran envergadura.
EFECTO DE LAS INTERVENCIONES TERAPÉUTICAS EN LA ATEROSCLEROSIS ESTABLECIDA
En ensayos clínicos de prevención primaria y secundaria se ha demostrado que hay varios agentes hipolipemiantes que reducen la incidencia de los episodios clínicos1-9. Todavía no se ha determinado con precisión el mecanismo que permite alcanzar este efecto beneficioso. Varios grupos de investigadores han intentado determinar si la reducción de los episodios o las complicaciones se debe a una disminución de la «carga» de ateroma. La demostración de la regresión de la placa en respuesta a una intervención ha sido relativamente difícil. Esta dificultad ha despertado un interés considerable por la posibilidad de que el efecto clínico asociado con el uso de estas intervenciones terapéuticas sea debido principalmente a las modificaciones en la composición de la placa, más que a cambios en su tamaño. A pesar de que esta posibilidad podría ser real, en la actualidad no hay ningún método establecido para evaluar las modificaciones de las características de la placa en el ser humano.
La angiografía coronaria es el parámetro de valoración primario para la detección de estenosis luminales significativas. Desempeña un papel clave en el proceso de toma de decisiones clínicas respecto a la implementación de una amplia gama de estrategias de revascularización. Sin embargo, la capacidad de la coronariografía para determinar con antelación la aparición de complicaciones isquémicas es limitada. Varios grupos de investigación han observado que la mayor parte de los infartos de miocardio tiene lugar en un territorio vascular irrigado por una lesión causal que en la coronariografía inicial fue considerada únicamente como una estenosis de grado leve10-12. No obstante, de manera progresiva se ha ido aceptando que, mientras que la coronariografía es una técnica útil para la visualización del borde luminal, su capacidad para identificar la extensión total de la aterosclerosis es limitada13. Todo ello ha dado lugar al desarrollo de modalidades de imagen que pueden ofrecer una definición más precisa de la placa aterosclerótica. La ecografía intravascular (EIV) se ha convertido en una técnica que ofrece la oportunidad única de definir la respuesta de la pared arterial frente a las modificaciones seriadas producidas por la acumulación de la placa aterosclerótica.
ECOGRAFÍA INTRAVASCULAR
La EIV conlleva la introducción, en las arterias coronarias epicárdicas, de un catéter cuya punta contiene un transductor ecográfico de alta frecuencia. La técnica se puede realizar con seguridad en el momento de la coronariografía diagnóstica. La EIV genera imágenes transversales tomográficas de alta resolución de la pared arterial: la placa y la luz coronarias. La EIV se puede utilizar en el contexto de una intervención coronaria para guiar el proceso de toma de decisiones relativas al tratamiento de lesiones específicas. Además, la visualización continua durante la retirada del catéter genera una serie de imágenes tomográficas que permiten una evaluación sistemática de la severidad de la afección aterosclerótica. La retirada del catéter se realiza manualmente o mediante su conexión a un dispositivo motorizado que desplaza el catéter a una velocidad constante (en general a 0,5 mm/s).
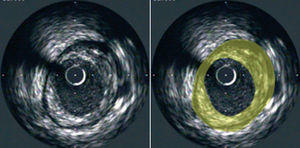
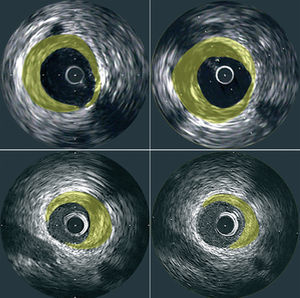
Las imágenes generadas ofrecen información relativa a la extensión y la composición de la placa aterosclerótica. Mediante la técnica de planimetría es posible determinar el área ocupada por la lámina elástica externa (LEE) y por la luz. Posteriormente se puede calcular el área de la placa como la diferencia entre las áreas de la LEE y de la luz14 (fig. 1). Mediante la generación de una serie de imágenes consecutivas obtenidas durante la retirada uniforme del catéter se puede realizar la sumación de las áreas de las placas detectadas en estas imágenes tomográficas con objeto de calcular el volumen de placa de ateroma en el segmento arterial evaluado. La mayor parte de los grupos de investigación ha utilizado para el análisis volumétrico imágenes obtenidas a intervalos precisos de 1 mm. La EIV también proporciona una evaluación de la presencia, la severidad y la localización de la calcificación. La capacidad de realizar estudios mediante EIV en el mismo segmento arterial y en diferentes momentos subraya las posibilidades de esta técnica para evaluar la progresión natural del proceso aterosclerótico, así como el impacto causado por las diferentes intervenciones terapéuticas frente a la aterosclerosis (fig. 2).
Fig. 1. Imagen tomográfica de una arteria coronaria, obtenida mediante la retirada del catéter de ecografía intravascular (panel izquierdo). El área de la placa (en amarillo) aparece como el área que queda entre los bordes iniciales de la lámina elástica externa y de la luz (panel derecho).
Fig. 2. Imágenes transversales de ecografía intravascular en las que se demuestra la progresión de la placa (paneles superiores) y la regresión de la placa (paneles inferiores) en zonas preespecificadas que habían sido estudiadas tanto al inicio del estudio (paneles izquierdos) como durante el seguimiento (paneles derechos).
LA ECOGRAFÍA INTRAVASCULAR DEFINE LA EVOLUCIÓN NATURAL DE LA ATEROGÉNESIS
La EIV ha permitido realizar avances importantes en el conocimiento de la respuesta de la pared arterial frente al depósito de la placa aterosclerótica. La capacidad de visualización de toda la pared vascular permite una determinación precisa de la carga ateromatosa. La EIV ha confirmado que la aterosclerosis es un proceso mucho más difuso de lo que se podría considerar mediante el análisis de la angiografía coronaria15. Además, los estudios realizados con EIV han demostrado que este proceso crónico se inicia durante las primeras etapas de la vida. En un estudio realizado sobre 262 pacientes en los que se efectuó trasplante cardíaco, la EIV se realizó en las arterias coronarias del donante poco tiempo después del procedimiento de trasplante. En uno de cada 6 corazones aparentemente sanos procedentes de donantes adolescentes se observó la presencia de ateroma significativo, definido por un nivel máximo del grosor medio de la placa > 0,5 mm. La prevalencia de ateroma significativo aumentó espectacularmente con la edad16. Estos resultados confirman los obtenidos en estudios previos, en que se demostraba la aparición temprana de ateroma macroscópico en estudios de autopsia17,18. Además, también confirman los estudios efectuados en la población general en los que se ha utilizado el grosor medio de la capa intima de la carótida como parámetro subrogado para evaluar la aterosclerosis coronaria19,20.
Se ha demostrado que la pared vascular no es un elemento pasivo en el proceso aterosclerótico. Por el contrario, la pared sufre modificaciones sustanciales, tanto en su tamaño como en su estructura, en respuesta a la acumulación de la placa. Según datos obtenidos en estudios de autopsia, Glagov et al describieron la remodelación arterial como una expansión de la lámina elástica interna en respuesta a la presencia de ateroma21. Estos cambios, confirmados con posterioridad mediante estudios con EIV22,23, son capaces de mantener inicialmente las dimensiones de la luz. Por tanto, es posible que la pared arterial presente una cantidad sustancial de ateroma antes de que se produzca una obstrucción detectable en la coronariografía. En otros estudios se ha demostrado que la dirección de la remodelación arterial se correlaciona con la forma de presentación clínica. Así, las lesiones causales en el contexto de los síndromes coronarios agudos tienen más posibilidades de asociarse con la remodelación expansiva, mientras que la remodelación constrictiva se correlaciona con la angina de pecho estable24.
En pacientes con antecedentes de síndrome coronario agudo, la EIV ha identificado la presencia de múltiples placas con rotura en el interior de las arterias coronarias25,26. La rotura de la placa se ha demostrado no solamente en el vaso causante del episodio clínico, sino también a todo lo largo del árbol coronario. Este hecho apoya el concepto de que la aterosclerosis y sus complicaciones isquémicas forman parte de un proceso sistémico más que focal27,28. También confirma la realidad de que la mayor parte de los episodios de rotura de placa no se acompaña de isquemia clínica. Todo ello indica que hay una combinación de factores que influyen en el hecho de que la rotura de la cubierta fibrosa dé lugar a trombosis y oclusión de la luz29.
La EIV también ha ofrecido información importante acerca de la evolución natural de procesos no ateroscleróticos, tal como la vasculopatía del trasplante. La EIV es una técnica de gran sensibilidad para la detección del engrosamiento neointimal temprano30,31. Mediante estudios seriados, la EIV ha documentado la incidencia y las tasas subsiguientes de progresión de estas modificaciones, así como el impacto de las intervenciones terapéuticas32,33. Por ello, la EIV seriada se ha convertido en una prueba de referencia para el control sistemático de las arterias coronarias en los receptores de trasplante cardíaco34.
APLICACIÓN DE LA ECOGRAFÍA INTRAVASCULAR PARA EVALUAR EL IMPACTO DE LAS INTERVENCIONES TERAPÉUTICAS EN LA EVOLUCIÓN NATURAL DE LA PROGRESIÓN DE LA ATEROSCLEROSIS
La posibilidad de que la EIV se realice de manera seriada para la cuantificación de la severidad y la extensión de la placa aterosclerótica o del engrosamiento neointimal ofrece una gran oportunidad para evaluar el impacto de las intervenciones terapéuticas. Se han publicado varios estudios en los que se describe el impacto de las estrategias terapéuticas que modifican las concentraciones plasmáticas de los lípidos, la presión arterial y los mediadores inmunológicos de la vasculopatía del trasplante.
IMPACTO DE LA ELEVACIÓN DE LAS CONCENTRACIONES DE LAS HDL EN LA INTENSIDAD DE LA PLACA
A pesar de los abundantes datos que indican el efecto protector de las lipoproteínas de densidad alta (HDL) tanto en personas35 como en animales36-39, los datos relativos al efecto beneficioso del incremento de las HDL en el ser humano son limitados. Recientemente se ha señalado que la infusión de partículas reconstituidas de HDL que contienen la apolipoproteína A-I Milano, una variante de apo A-I, induce una progresión rápida del ateroma coronario en el ser humano40. Un grupo de 47 pacientes en los que se realizaron coronariografía y EIV durante las 2 semanas siguientes a un síndrome coronario agudo fue distribuido de manera aleatoria para recibir semanalmente infusiones intravenosas de placebo o de complejos apo A-I Milano/fosfolípido (ETC-216) con una dosis de proteína de 15 o de 45 mg/kg durante 5 semanas. Dos semanas después de la última infusión se repitió el estudio con EIV. El grupo de tratamiento combinado, constituido por los pacientes que recibieron dosis altas o bajas de ETC-216, mostró una reducción del 4,2% en el volumen de ateroma. El grado de regresión fue mayor en los subsegmentos de 10 mm con afección más grave. Este resultado amplía los hallazgos de que los portadores de la variante apo A-I Milano parecen presentar una protección relativa frente a la coronariopatía, a pesar de las bajas concentraciones de HDL41, y de que las infusiones de características similares en modelos animales ejercen un efecto beneficioso en el tamaño y la composición de las lesiones42-44. Además, amplía también los hallazgos de que la combinación de niacina y de una estatina, con la consiguiente elevación de la concentración de HDL, ha dado lugar a una regresión de la aterosclerosis en estudios angiográficos45 y a una interrupción en la progresión del grosor medio de la capa íntima de las arterias carótidas46. Este estudio de pequeña envergadura representa una prueba de concepto importante en el sentido de que las intervenciones que favorecen el incremento de la concentración de HDL pueden influir de manera drástica en el ateroma coronario. Además, justifica la realización de estudios a mayor escala para investigar con mayor detalle el posible impacto que tiene el incremento de las concentraciones de HDL sobre el ateroma coronario y la incidencia de complicaciones clínicas.
IMPACTO DE LA DISMINUCIÓN DE LOS LÍPIDOS EN LA INTENSIDAD DE LA PLACA
Se ha demostrado de manera concluyente que la disminución de las concentraciones de lipoproteínas de densidad baja (LDL) tras la administración de estatinas reduce las complicaciones clínicas1-6. No obstante, todavía no sabemos si hay un umbral para las LDL por debajo del cual el efecto beneficioso clínico sea limitado. Todo ello ha generado un debate considerable en el desarrollo de las directrices para la disminución de las concentraciones de lípidos. Los estudios mediante EIV seriada han definido la respuesta del atero ma coronario frente a las estrategias intensivas de disminución de las concentraciones de lípidos. Se han publicado estudios preliminares sobre la regresión de la aterosclerosis, determinada mediante coronariografía cuantitativa y EIV tras la eliminación de LDL del plasma, en pacientes con hipercolesteremia familiar y falta de respuesta al tratamiento médico convencional47,48. En numerosos estudios angiográficos se ha demostrado que la reducción de los lípidos con estatinas retrasa la progresión del ateroma, en comparación con el placebo49-53. En estudios recientes con EIV se ha evaluado directamente la posibilidad de que el grado de disminución de las LDL mediante estatinas pueda influir en el ateroma coronario.
En el estudio Reversal of Atherosclerosis with Aggressive Lipid Lowering (REVERSAL)54 participaron 502 pacientes con enfermedad coronaria y una concentración de colesterol unido a lipoproteínas de baja densidad (cLDL) entre 125 y 210 mg/dl, que fueron distribuidos aleatoriamente para recibir tratamiento mediante una estrategia hipolipemiante de intensidad moderada con pravastatina (40 mg/día) o mediante una estrategia hipolipemiante intensiva con atorvastatina (80 mg/día), durante 18 meses. La concentración media de cLDL se redujo hasta 79 y 110 mg/dl con atorvastatina y pravastatina, respectivamente. Además, las estrategias terapéuticas presentaron diferencias marcadas en su capacidad para reducir la concentración de proteína C reactiva (PCR). La PCR disminuyó en un 36,4 y un 5,2% en los grupos de atorvastatina y pravastatina, respectivamente. La EIV seriada demostró que el volumen de ateroma aumentó en un 2,7% con pravastatina, lo que indicaba una progresión neta. Por el contrario, el tratamiento con atorvastatina no dio lugar a modificaciones significativas en el volumen del ateroma, en comparación con el valor existente al inicio del estudio. Además, se demostró que ambas estrategias facilitaban la regresión del ateroma en los segmentos de 10 mm que presentaban la mayor severidad de placa al momento de inicio del estudio. En conjunto, estos resultados indican que el uso de una estrategia hipolipemiante intensiva puede modificar la historia natural de la progresión del ateroma coronario. Estos resultados también son congruentes con los obtenidos recientemente en el estudio Treating to New Targets (TNT), en el que se demostró que la potenciación de la disminución de la concentración de LDL mediante la administración de atorvastatina a dosis elevadas (en comparación con la administración de atorvastatina a dosis bajas) se asoció con una disminución del 22% en los criterios combinados de valoración clínicos.
El efecto beneficioso del tratamiento con estatinas sobre severidad de la placa ha sido apoyado recientemente por la observación de que en un pequeño grupo de 40 varones con hipercolesteremia y cardiopatía isquémica, la aplicación de una dieta hipolipemiante durante 3 meses seguida por la administración de 40 mg diarios de simvastatina dio lugar a una reducción del 42,6% en la concentración de LDL y a una disminución asociada del 6,3% en el volumen de la placa, consistente con la regresión de ésta55.
Aunque la aplicación de ambas estrategias en el estudios REVERSAL pareció dar lugar a una relación de carácter continuo entre las modificaciones de las concentraciones de LDL y los cambios en la progresión de la placa, para cualquier concentración de cLDL la pendiente de la línea de regresión fue menor con atorvastatina. Aparentemente, la menor tasa de progresión con atorvastatina fue equivalente a un 20% adicional de disminución de la concentración de cLDL con pravastatina e indicó que los efectos beneficiosos de atorvastatina pueden ir más allá de la disminución de las concentraciones de lípidos. En un análisis posterior se demostró una correlación entre el grado de disminución de la PCR y la tasa de progresión de la placa, de manera que los pacientes que presentaron la reducción mayor de la PCR fueron los que mostraron evidencia de un regresión del ateroma56. El efecto beneficioso progresivo de la disminución intensiva de los lípidos y su correlación con el grado de reducción de la PCR se ha apoyado en el efecto beneficioso observado recientemente con la administración de dosis altas de atorvastatina, en comparación con la administración de pravastatina, sobre la tasa de complicaciones clínicas en pacientes con síndrome coronario agudo en el estudio Pravastatin or Atorvastatin Evaluation and Infection Therapy (PROVE-IT)57,58.
Se ha demostrado que la disminución de la concentración de LDL ejerce un efecto beneficioso sobre la severidad de la placa cuando dicha disminución tiene lugar en el contexto de un síndrome coronario agudo reciente. En el estudio ESTABLISH59, un grupo de 70 pacientes con infarto agudo de miocardio con elevación del segmento ST fue tratado mediante intervención percutánea sobre la lesión causante y, posteriormente, fue asignado de manera aleatoria a un grupo de atorvastatina (20 mg/día) o a un grupo de tratamiento convencional con una dieta hipolipemiante, durante un período de 6 meses. En el grupo de tratamiento convencional se pudo administrar un inhibidor de la absorción de colesterol en los casos en que la concentración de LDL se mantenía por encima de 150 mg/dl. En 48 de los pacientes se efectuó EIV seriada en la zona proximal o distal a la intervención, tanto al inicio del estudio como durante el seguimiento. El tratamiento con atorvastatina se asoció con una reducción del 41,7% en las concentraciones de LDL y produjo regresión de la placa demostrada por una disminución del 13,1% en su volumen. Por el contrario, la concentración de LDL no se modificó en el grupo de tratamiento convencional, en el que se observó un incremento del 8,7% en el volumen de la placa. Durante el seguimiento, el porcentaje de modificación en el volumen de la placa se correlacionó tanto con la concentración de LDL como con la reducción porcentual de la concentración de LDL. El resultado de este estudio realizado con un seguimiento escaso es congruente con el obtenido en el estudio Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering (MIRACL)60 en el que participaron pacientes con síndrome coronario agudo. En este estudio, la administración de atorvastatina a dosis elevada se asoció con una reducción significativa del 16% en las complicaciones clínicas durante el período de las 16 semanas posteriores a un síndrome coronario agudo.
EFECTO DE LA DISMINUCIÓN DE LA PRESIÓN ARTERIAL EN LA SEVERIDAD DE LA PLACA
En estudios con aplicación clínica de EIV también se ha evaluado el efecto del abordaje de factores de riesgo distintos de las lipoproteínas plasmáticas. Actualmente no hay consenso respecto al control óptimo de la presión arterial en los pacientes normotensos con enfermedad coronaria establecida. En el estudio Comparison of Amlodipine vs Enalapril to Limit Occurrences of Thrombosis (CAMELOT)61, publicado recientemente, se evaluó la influencia de la reducción de la presión arterial sobre la incidencia de complicaciones clínicas y en la cantidad de placa en personas normotensas. Participó un total de 1.991 pacientes con enfermedad coronaria y con una presión arterial diastólica < 100 mmHg, con o sin tratamiento, que fueron distribuidos aleatoriamente para recibir amlodipino (10 mg/día), enalapril (20 mg/día) o placebo, durante un período de 24 meses. El tratamiento con amlodipino dio lugar a una reducción del 31% en la incidencia combinada de complicaciones clínicas, en comparación con el placebo. Este efecto beneficioso fue debido principalmente a una disminución del 27% en la necesidad de revascularización coronaria y a una reducción del 42% en la necesidad de hospitalización por angina. Un total de 274 de estos pacientes fue incluido en un subestudio con EIV en el que se demostró la progresión de la placa con el placebo y la ausencia de modificaciones en la carga aterosclerótica con la administración de amlodipino. Al considerar a los pacientes que presentaban una presión arterial inicial superior a la media (en un análisis preespecificado), la diferencia entre los grupos de amlodipino y placebo fue estadísticamente significativa. También se observó que los efectos de los grupos de tratamiento en las complicaciones clínicas se correspondían con su efecto sobre el volumen de la placa.
APLICACIÓN DE LA ECOGRAFÍA INTRAVASCULAR SERIADA PARA CONTROLAR LA PROGRESIÓN DE OTRAS FORMAS DE ENFERMEDAD VASCULAR
La EIV ha ofrecido información sobre la respuesta in vivo de la pared arterial frente a la angioplastia. En concreto, ha permitido determinar que la reestenosis tras las intervenciones percutáneas sin uso de endoprótesis se debe a una combinación de retracción arterial, remodelación y desarrollo de hiperplasia neointimal62. Además de facilitar la evaluación del efecto de las endoprótesis (tanto de las metálicas sin revestimiento como de las que permiten la infusión de fármacos)63,64, la EIV seriada se ha utilizado para evaluar la utilidad clínica de diversas estrategias experimentales que podrían inhibir la formación de la neoíntima. En el estudio Multivitamins and Probucol, realizado con asignación aleatoria, se evaluó a 317 pacientes que recibieron tratamiento con el antioxidante probucol, complejos multivitamínicos, la combinación de ambos o placebo durante un período de 30 días antes de la angioplastia coronaria y durante un período de 6 meses después de ésta. La EIV seriada realizada en un subgrupo de 94 pacientes confirmó que la reestenosis fue debida principalmente a una remodelación insuficiente en el contexto de la formación de la neoíntima, lo que fue impedido por el tratamiento con probucol65. Se demostró que una estenosis seccional < 67% detectada con la EIV inmediatamente tras la angioplastia era un factor predictivo de baja incidencia de reestenosis en los pacientes tratados con probucol, al cabo de 6 meses66. Además, recientemente se ha demostrado que el agente antiinflamatorio y antioxidante experimental AGI-1067 impide la reestenosis tras la angioplastia, sin que aparezca la prolongación del complejo QTc que se observa con el probucol67.
Dado que la EIV se ha convertido en la prueba de referencia para el seguimiento clínico del desarrollo y la progresión de la vasculopatía coronaria en los receptores de trasplante cardíaco, ofrece una oportunidad única para evaluar la eficacia de las estrategias dirigidas a la inhibición de este proceso. El inicio de la vasculopatía del trasplante conlleva un mal pronóstico clínico y es la principal indicación para repetir el trasplante cardíaco68. En estudios recientes se ha observado que la progresión de la vasculopatía coronaria es un factor predictivo de la incidencia de complicaciones clínicas a largo plazo69,70. Por desgracia, hay pocas opciones terapéuticas que hayan demostrado influir en este proceso71. Se ha hecho cada vez más aparente que hay una secuencia de acontecimientos inmunológicos que inducen la formación de la hiperplasia neointimal72; debido a ello, recientemente se ha prestado atención a los mediadores inmunológicos como objetivos potenciales.
Everolimus es un nuevo inhibidor de la proliferación e inmunodepresor73. La EIV seriada se ha utilizado para demostrar la capacidad de everolimus para prevenir el desarrollo de la vasculopatía74. En un estudio se realizó la asignación aleatoria de 634 receptores de trasplante cardíaco primario a grupos de tratamiento con 1,5 mg de everolimus, 3 mg de everolimus o 1-3 mg de azatioprina, en combinación con tratamiento médico o convencional. La EIV de las arterias coronarias se realizó durante el período de 6 semanas despues del trasplante y a los 12 meses de seguimiento. En comparación con el grupo de azatioprina, la incidencia de vasculopatía se redujo en un 33 y en un 42% en los grupos de everolimus con dosis baja y dosis alta, respectivamente. Además, everolimus inhibió el incremento del grosor intimal máximo medio en un 60-70%. Este efecto beneficioso se asoció con una disminución del 22-42% en el criterio clínico de valoración correspondiente a un parámetro combinado constituido por muerte, pérdida del injerto o necesidad de repetición del trasplante, pérdida del paciente durante el seguimiento, rechazo agudo de grado IIIA o rechazo con compromiso hemodinámico. Este resultado refleja la importancia de la EIV seriada in vivo para correlacionar el impacto de las intervenciones terapéuticas con la incidencia de vasculopatía arterial y sus complicaciones clínicas.
Aunque hasta el momento no hay una prueba definitiva, todos los datos obtenidos en ensayos clínicos en que se ha utilizado EIV e información clínica apoyan la utilización de la EIV como un parámetro sustituto fiable de la evolución clínica.
NECESIDAD DE DESARROLLO DE ESTRATEGIAS PARA ESTUDIAR LA ACTIVIDAD DE LA PLACA
Cada vez es más aceptado el hecho de que la composición de la placa aterosclerótica, además de su extensión total, representa un determinante importante de su traducción en isquemia clínica. Varios grupos de investigación han observado que el infarto de miocardio tiene lugar predominantemente en el territorio vascular correspondiente a la lesión causante de la complicación clínica, que en la coronariografía puede aparecer como una estenosis de intensidad leve o moderada10-12. En estudios anatomopatológicos se ha demostrado que las placas con abundantes macrófagos tienen más posibilidades de presentar erosión o rotura de su cubierta fibrosa, que representa el factor precipitante característico de las complicaciones isquémicas28,75. En apoyo de esta posibilidad, se ha observado que las concentraciones sistémicas de PCR son un factor predictivo de la evolución, tanto en personas sanas76 como en el contexto de los síndromes coronarios agudos77. Por tanto, se ha despertado un enorme interés por el desarrollo de técnicas de imagen que permitan el seguimiento de la actividad de la placa aterosclerótica. En el contexto de investigación se han utilizado varias técnicas para definir la composición de la placa. Aunque la EIV ofrece una valoración excelente de la extensión y la severidad de la lesión aterosclerótica, su capacidad para definir los componentes de la placa es relativamente escasa y se limita a una distinción genérica entre los componentes ecotransparentes (lipídicos), ecodensos (fibrosos) y calcificados. No obstante, la relación entre las características histológicas y ecográficas de la placa son poco consistentes14. Los avances más recientes de la EIV se han centrado en el análisis del backscatter de la radiofrecuencia para la caracterización de los componentes de la placa, con una correlación histopatológica adecuada78. El análisis espectral de estos datos de radiofrecuencia ha permitido identificar con precisión el tamaño y la composición de los diferentes componentes de la placa aterosclerótica en las arterias coronarias humanas ex vivo. A consecuencia de ello, esta técnica se ha introducido en el contexto clínico para identificar las lesiones con abundantes lípidos y, por tanto, potencialmente vulnerables. La tomografía de coherencia óptica (optical coherence tomography [OCT]), que analiza la luz reflejada, no los ultrasonidos, ha permitido la visualización con alta resolución de la actividad de los macrófagos del ateroma79,80. Además, la posibilidad de cuantificar mediante catéter la temperatura de la placa81,82 y su susceptibilidad a la compresión81,83 también permiten identificar las regiones con inflamación y con abundantes lípidos. La limitación principal de cada una de estas estrategias es la necesidad del cateterismo cardíaco invasivo. El abordaje ideal sería una evaluación no invasiva de las arterias coronarias. Se ha señalado que la resonancia magnética (RM) permite definir los componentes de la placa84,85. No obstante, todavía no se dispone de una técnica de RM para su uso clínico en este sentido. Por el contrario, la tomografía computarizada (TC) se limita en el momento actual a la evalua ción de la intensidad de la calcificación coronaria, a la detección de las estenosis luminales y a la definición de la remodelación arterial en respuesta a la placa86-88. Se han efectuado intentos de evaluación de las características de la pared arterial mediante el uso de unidades Hounsfeld. La combinación de la TC con la tomografía por emisión de positrones (PET), que facilita la evaluación precisa de la actividad de los macrófagos en la placa89, es un abordaje prometedor. Los desarrollos futuros de estas técnicas de imagen van a ofrecer una oportunidad ideal para evaluar la variación seriada de la composición de la placa y, por tanto, de su vulnerabilidad en respuesta a las diferentes intervenciones terapéuticas aplicadas in vivo.
CONCLUSIONES
El desarrollo de la EIV ha incrementado nuestros conocimientos de los factores que influyen en la acumulación progresiva de la placa aterosclerótica. La posibilidad de realizar la EIV de manera seriada ofrece una oportunidad única para definir las modificaciones que tienen lugar en el ateroma en respuesta a diferentes estrategias farmacológicas. Se ha demostrado que la modificación activa de los factores de riesgo cardiovascular tradicionales puede influir de manera importante en la evolución natural de la progresión de la placa. Este efecto beneficioso parece complementar la capacidad de las intervenciones citadas para prevenir las complicaciones clínicas. La posibilidad de identificar estrategias que permitan conseguir la regresión del ateroma, y no sólo la detención de su progresión o la reducción de la vulnerabilidad de la placa, representa un cambio de paradigma importante en la protección cardiovascular. A consecuencia de ello, será cada vez más importante incorporar las evaluaciones seriadas de la cantidad de placa ateromatosa como criterio principal de valoración en el diseño de los ensayos clínicos que se realicen en el futuro y cuyo objetivo sea el desarrollo de estrategias emergentes para reducir, todavía más, el riesgo cardiovascular.
Correspondencia: Dr. E. Murat Tuzcu.
The Cleveland Clinic Foundation. Department of Cardiovascular Medicine/F15
9500 Euclid Avenue. Cleveland OH 44195. Estados Unidos.
Correo electrónico: tuzcue@ccf.org