Los resultados y las complicaciones del procedimiento de ablación de fibrilación auricular varían ampliamente entre los diferentes centros. Nuestro objetivo es analizar los resultados y las complicaciones derivadas de este procedimiento en nuestro centro e identificar los factores predictores de éxito y de seguridad.
MétodosEntre 2002 y 2009 se realizó un total de 726 procedimientos de ablación de fibrilación auricular. Basándonos en la aplicación sistemática de un protocolo de anticoagulación y sedación consciente desde enero 2008, podemos establecer dos estrategias de ablación que constituyen dos grupos bien diferenciados: grupo A, constituido por 419 procedimientos realizados antes de enero 2008, y grupo B, formado por 307 procedimientos realizados después.
ResultadosEl 60,9% de los pacientes no presentaron recurrencia arrítmica tras varios procedimientos durante un seguimiento medio de 8,7 meses. Con un único procedimiento, la tasa total de éxito fue del 41%, significativamente mayor entre los pacientes del grupo B (el 51,6 frente al 35,2% de éxito en el grupo A; p = 0,001). Hubo un total de 31 complicaciones mayores (4,2%); 26 en el grupo A (6,2%) y 5 en el grupo B (1,6%) (p = 0,002). La protocolización del procedimiento fue un factor predictor de la ausencia de complicaciones (odds ratio = 0,406; intervalo de confianza del 95%, 0,214-0,769; p < 0,006).
ConclusionesLa aplicación sistemática de un protocolo de anticoagulación y sedación consciente se asocia a la mejora de los resultados y la reducción de las complicaciones en el procedimiento de ablación de fibrilación auricular. Otros factores no evaluados en este estudio, como la curva de aprendizaje de los operadores y la progresiva mejora tecnológica, pueden haber influido en los cambios observados.
Palabras clave
En la última década, la ablación con catéter de la fibrilación auricular (FA) se ha convertido en un procedimiento habitual de práctica clínica. Paralelamente a la progresiva curva de aprendizaje de los operadores, con los años se ha producido una notable mejora tecnológica y la sistematización de la técnica1, 2, 3. Sin embargo, hay pocos datos en la literatura acerca de los beneficios derivados de la modificación de la técnica juntamente con la adquisición de experiencia de los operadores y la evolución de la tecnología.
Debido a la rápida expansión de las indicaciones de la ablación y la demanda creciente de la ablación de la FA4, 5, 6, 7, 8, resulta obligado tratar de identificar y establecer un procedimiento seguro, así como analizar la tasa de complicaciones reales que se da en cada centro.
El objetivo del presente estudio es analizar los resultados y las complicaciones sufridas por los pacientes sometidos a la ablación percutánea de las venas pulmonares (VP) en nuestro centro los últimos 7 años, para así identificar los posibles factores predictores de éxito en el tratamiento de la FA y las potenciales fuentes de complicaciones.
MétodosEntre octubre de 2002 y diciembre de 2009, se realizaron en nuestro centro 726 procedimientos de ablación percutánea de las VP mediante un sistema de cartografía tridimensional no fluoroscópica (CARTO® o NAVX®) en un total de 542 pacientes.
Se sometió sistemáticamente a todos los pacientes a un ecocardiograma transesofágico en las 48 h previas a la ablación, para descartar la presencia de trombos intracavitarios. Asimismo se realizó una tomografía computarizada (TC) o resonancia magnética (RM) de la aurícula izquierda (AI) y de las VP en un 74,2% de los procedimientos, con el fin de integrar las imágenes con el sistema de cartografía electroanatómica y adquirir mejores resolución espacial y definición anatómica durante el procedimiento de ablación.
Se suspendió la anticoagulación oral los 3 días previos a la ablación, con el consiguiente inicio de heparina de bajo peso molecular el día antes del procedimiento.
Desde enero de 2008, todos los procedimientos se realizaron según un protocolo de anticoagulación y sedación consciente (Tabla 1). Los pacientes sometidos a este régimen de anticoagulación y sedación protocolizada constituyeron el grupo B, mientras que los pacientes pertenecientes al grupo sometido a la ablación de VP antes de 2008 constituyeron el grupo A.
Tabla 1. Protocolo de anticoagulación y sedación consciente aplicado sistemáticamente en los procedimientos de ablación de la fibrilación auricular realizados desde enero de 2008
| Protocolo de anticoagulación periprocedimiento |
| Dosis inicial, administrada justo después de la realización de la punción transeptal |
| a. < 75 kg: 5.000 UI HNF |
| b. > 75 kg: 6.000 UI HNF |
| Control del ACT cada 10min hasta alcanzar ACT > 200 s |
| Si el ACT es: |
| a. 150-200 s, administrar 3.000 UI HNF, con nuevo control de ACT a los 10 min |
| b. 201-250 s, administrar 2.000 UI HNF, con nuevo control de ACT a los 30 min |
| c. 250 s, no administrar HNF, con nuevo control de ACT a los 30 min |
| Protocolo de anticoagulación tras el procedimiento |
| En las siguientes 6 h, reiniciar anticoagulación, administrando HBPM a dosis de 1 mg/kg/12 h, a la vez que se reinicia warfarina hasta lograr dosis óptimas de anticoagulación (INR > 2). Mantener anticoagulación oral durante al menos 2 meses. Su interrupción podrá realizarse en ausencia de un riesgo > 1 según la escala CHADS |
| Sedación consciente |
| Al inicio |
| Dolantina 25 mg+midazolam 1mg en bolo±fentanilo 30μg |
| Justo antes de la punción transeptal |
| Fentanilo, < 65 kg: 30 ml/h perfusión; ≥ 65 kg: 40 ml/h (300μg/120ml SSF=2 amp./120ml SSF) |
| Justo antes de la aplicación de radiofrecuencia |
| Fentanilo 75μg (5 ml) bolo±midazolam 1-2mg adicional bolo en casos necesarios |
ACT: tiempo de coagulación activado; amp.: ampolla; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; INR: razón normalizada internacional; SSF: suero salino fisiológico.
Todos los pacientes firmaron el consentimiento informado antes del procedimiento y el estudio fue aprobado por el comité ético de nuestro centro.
Procedimiento de ablaciónEl procedimiento de ablación percutánea se llevó a cabo a través de un acceso venoso femoral, con monitorización de la saturación arterial de oxígeno y monitorización invasiva de la presión arterial. Tras una doble punción transeptal, se accedió a la AI, donde se situó el catéter de ablación y, desde el año 2006, el catéter circular (Lasso®, Biosense-Webster Lasso, o Inquiry Optima®, St. Jude Medical) para registro y estimulación. A continuación, se administró heparina sódica no fraccionada (HNF) según la estrategia establecida. Se realizó un mapa tridimensional de la AI y las estructuras adyacentes mediante sistema de navegación CARTO® (Biosense Webster) o NavX® (St. Jude Medical). Además, siempre que fue posible, se integraron las imágenes de RM o de TC para optimizar la reconstrucción anatómica. La radiofrecuencia (RF) se aplicó con un catéter de ablación de 8 mm o de punta irrigada de 3,5 mm a una temperatura objetivo de 55 o 45°C y una salida máxima de 60 o 40 W respectivamente. Se realizaron lesiones continuas de RF cercando las VP homolaterales a nivel astral. Además, se realizaron líneas de ablación en la pared posterior, el techo de la AI y el istmo mitral y se procedió a la ablación de las áreas con alta fragmentación de los electrogramas locales en algunos subgrupos de pacientes, lo que se determinó en función del tipo de FA o el tamaño auricular. Por otra parte, la participación de nuestro centro en estudios aleatorizados contribuyó también a variar la metodología empleada respecto a la realización de las líneas o ablación de los electrogramas fragmentados en determinados grupos de pacientes.
El objetivo del procedimiento era la disminución del voltaje de los electrogramas locales de las VP<0,15 mV en los pacientes en quienes no se utilizó catéter circular o la desaparición de los potenciales de VP en el catéter circular y la comprobación del bloqueo bidireccional entre la AI y las VP. El bloqueo de la línea del techo se comprobó por la presencia de dobles potenciales y la activación caudocraneal de la pared posterior. El aislamiento de la pared posterior se comprobó por la desaparición de potenciales y la falta de captura auricular con captura local. No se procedió a comprobar sistemáticamente el bloqueo del istmo mitral en los pacientes sin antecedentes de flutter izquierdo.
En el grupo A se administró midazolam y fentanilo durante el procedimiento, a juicio del operador, mientras que la sedación en el grupo B respondió a una estrategia sistemática consistente en dolantina, midazolam y fentanilo (Tabla 2).
Tabla 2. Características basales de los pacientes y diferencias entre subgrupos atendiendo a la realización de la ablación antes y después de enero de 2008
| Características basales de pacientes | Total (n=542) | Grupo A (< 01/08) (n=270) | Grupo B (> 01/08) (n=272) | p |
| Edad | 53,1±10,7 | 52,4±11 | 54±10 | 0,086 |
| Sexo masculino | 77% | 76,6% | 77,6% | 0,792 |
| Tipo arritmia | ||||
| Paroxística | 51,3% | 52,4% | 49,8% | 0,547 |
| Persistente | 31,2% | 27,4% | 36,7% | 0,023 |
| Persistente larga evolución | 13,4% | 14,7% | 11,6% | 0,317 |
| Flutter izquierdo | 4% | 5,5% | 1,9% | 0,035 |
| Duración mínima (meses) | 62,3±60,9 | 65,2±59,8 | 56,7±62,7 | 0,173 |
| HTA | 42,2% | 42,7% | 41,6% | 0,791 |
| Ausencia de cardiopatía | 78,8% | 77,2% | 78,6% | 0,710 |
| Taquimiopatía | 7,3% | 6,9% | 7,9% | |
| Cardiopatía valvular | 4,9% | 5,9% | 3,3% | |
| AI (mm) | 42±5,6 (25-59 mm) | 41,6±5,4 | 42,7±5,8 | 0,025 |
| FE | 58,3±9,7 (15-84%) | 58,4±10 | 58,1±9,3 | 0,768 |
| DTDVI (mm) | 52,7±5,4 | 52,4±5,3 | 53,1±5,5 | 0,170 |
| DTSVI (mm) | 34,1±6,2 | 33,7±5,8 | 34,7±6,6 | 0,151 |
| SAOSa | 19,4% | 18,1 | 21,5 | 0,411 |
| IMC | 27,8±3,7 | 27,7±3,4 | 28,6±4,8 | 0,284 |
| Sobrepeso/obesidad | 79,5% | 79,7% | 78,4% | 0,605 |
| Deportistas de alto rendimientob | 15,7% | 13,9% | 18,1% | 0,244 |
AI: aurícula izquierda; DTDVI: diámetro telediastólico de ventrículo izquierdo; DTSVI: diámetro telesistólico de ventrículo izquierdo; FE: fracción de eyección; HTA: hipertensión arterial; IMC: índice de masa corporal; SAOS: síndrome de apnea obstructiva del sueño.
a Pacientes con alto riesgo según el cuestionario de Berlín que presentan un índice de apnea-hipopnea >10 o pacientes portadores de aparatos de ventilación no invasiva con presión positiva de la vía aérea o presión positiva coninua de la vía aérea nocturna al inicio del estudio 5 .
b Deportistas de alto rendimiento: pacientes con práctica deportiva vigorosa, regular y prolongada, al menos 3h/semanales durante > 2 años 7 .
Con respecto a la estrategia de la anticoagulación en el grupo A, se limitó a la administración de un bolo inicial de HNF, monitorizando de manera variable el tiempo de coagulación activado (ACT) y administrando cantidades de heparina variables, a juicio del operador; se aceptaron anticoagulaciones < 250 ms. Sin embargo, en el grupo B se administró un bolo inicial de 5.000 o 6.000 UI de HNF, según el peso del paciente, seguido de una monitorización regular y establecida del ACT y la administración de heparina según la dosis establecida hasta alcanzar valores comprendidos entre 250 y 300 ms.
SeguimientoTras la ablación, siguiendo las directrices acordadas por el grupo de expertos de la Heart Rhythm Society/European Heart Rhythm Association/European Cardiac Arrhtymia Society4, 5, la anticoagulación tras la ablación se mantuvo en todos los pacientes durante al menos 3 meses, y se interrumpió o se continuó según las recomendaciones actuales basadas en la escala de riesgo CHADS2. Interrumpir o mantener el tratamiento antiarrítmico durante el seguimiento se realizó a criterio del cardiólogo. El seguimiento de los pacientes se llevó a cabo con visitas cada 3-6 meses durante al menos 1 año. Cada visita incluyó la realización de un ECG de superficie y un Holter-ECG de 48 h. Entre los 6 y los 9 meses, se llevó a cabo un ecocardiograma transtorácico y una TC o RM de las VP a fin de descartar complicaciones diferidas.
Se definió la recurrencia arrítmica como cualquier episodio de taquiarritmia auricular con una duración > 30 s registrado más allá de los primeros 3 meses de la ablación. Se consideró el periodo correspondiente a los primeros 3 meses tras la ablación como el periodo de blanqueo o ventana, de modo que los eventos arrítmicos que tuvieron lugar en ese periodo no se contabilizaron como recurrencias4.
Se registraron las complicaciones clínicamente relevantes relacionadas con el procedimiento de ablación. Las complicaciones mayores se definieron como las que supusieron riesgo vital, causaron daño permanente o requirieron intervención terapéutica y prolongación de la estancia hospitalaria9.
Análisis estadísticoLas variables continuas se expresan como media ± desviación estándar y las variables categóricas, como porcentajes. Las diferencias en las características basales de los pacientes halladas entre los procedimientos realizados antes y después de la fecha de la protocolización de la anticoagulación y sedación, así como entre los procedimientos exitosos y los no exitosos y entre los libres de complicaciones y con complicaciones clínicamente relevantes, se analizaron usando los estadísticos χ2 y t de Student, aplicando un valor de p<0,05 como valor estadísticamente significativo. Para determinar el éxito de la técnica, se analizó la supervivencia libre de recurrencia arrítmica mediante el método de Kaplan-Meier, empleando el modelo de regresión de Cox para el análisis multivariable de todos los factores significativos. Finalmente, para determinar la existencia de factores predictores independientes de complicaciones, se forzó la introducción de todos los factores significativos del análisis univariable mediante el modelo de regresión logística binaria, estimando la odds ratio (OR) y tomando p<0,05 como valor estadísticamente significativo.
ResultadosDesde octubre de 2002 hasta diciembre de 2009, se realizaron 726 procedimientos de ablación de VP mediante sistema de cartografía no fluoroscópica en un total de 542 pacientes. Las características basales de la población se muestran en la Tabla 2. El 77% de los pacientes eran varones, con una media de edad de 53 años; el 21,2% tenía cardiopatía estructural y el 42,2%, hipertensión. El diámetro AP medio de la AI fue de 42 mm y la fracción de eyección del ventrículo izquierdo estaba conservada en la mayoría de los pacientes. El 51,3% de los pacientes presentaban FA paroxística; el 31,3%, FA persistente; el 13,4%, FA persistente de larga evolución, y un 4%, flutter auricular izquierdo. Requirieron al menos un segundo procedimiento 153 pacientes (el 28,2% del total de pacientes), lo que representa un total de 184 reablaciones.
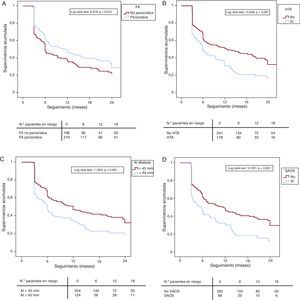
Resultados de la ablaciónLa probabilidad general de éxito con sólo un procedimiento de ablación tras un seguimiento máximo de 24 meses fue del 41,1% (el 51,6% de los pacientes del grupo B frente al 35,2% del grupo A; p=0,001), y se elevó al 60,9% tras repetir el procedimiento. Del total de recurrencias, el 75,3% presentaba de forma predominante FA y el 24,7%, flutter auricular atípico. En la Tabla 3 se muestran las características de los pacientes con y sin recurrencias arrítmicas tras la primera ablación. Tal y como se aprecia en las curvas de supervivencia representadas tras un primer procedimiento, los pacientes con FA no paroxística (Figura 1A), hipertensión arterial (Figura 1B), AI dilatada (Figura 1C) y síndrome de apnea obstructiva del sueño (SAOS) (Figura 1D) presentaron más recurrencias arrítmicas durante el seguimiento. La Tabla 4 muestra las variables predictoras de recurrencia, y la hipertensión arterial y el SAOS resultaron ser factores predictores de recurrencia independientes tras un primer procedimiento de ablación. Tener dilatada la AI (> 44 mm) y una FA no paroxística mostraron una tendencia a favor de las recurrencias, pero no alcanzaron la significación estadística en el análisis multivariable. La presencia de cardiopatía estructural o la realización de la línea mitral no fueron predictores independientes de recurrencia.
Tabla 3. Diferencias en las características basales entre los pacientes con y sin recurrencias tras un primer procedimiento
| Resultados de la ablación (procedimiento) 24 meses de seguimiento máximo | Recurrencia arrítmica (58,9%) | No recurrencia arrítmica (41,1%) | p |
| Grupo A/B | 64,8% grupo A frente a 48,4% grupo B | 35,2% grupo A frente a 51,6% grupo B | 0,001 |
| Edad (años) | 53,6±10,8 | 52,4±10,8 | 0,267 |
| Sexo | 59% varones frente a 58,4% mujeres | 41% varones frente a 41,6% mujeres | 0,917 |
| HTA | 66,7% HTA frente a 52,5% normotensos | 33,3% HTA frente a 47,5% normotensos | 0,003 |
| AI dilatada (> 44 mm) | 69% AI dilatada frente a 52,9% AI no dilatada | 31% AI dilatada frente a 47,1% AI no dilatada | 0,003 |
| FE (%) | 58,1±9,6 | 58,7±9,3 | 0,584 |
| Cardiopatía estructural | 68,1% CP frente a 56,3% no CP | 31,9% CP frente a 43,7% no CP | 0,042 |
| FAPx | 54,8% FAPx frente a 65% FA no Px | 45,2% FAPx frente a 35% FA no Px | 0,031 |
| Duración arritmia (meses) | 64,2±50,7 | 59,9±61,4 | 0,463 |
| SAOS | 77,1% SAOS frente a 55,3% no SAOS | 22,9% SAOS frente a 44,7% no SAOS | 0,001 |
| IMC | 28,1±3,4 | 27,3±4 | 0,166 |
| Tiempo EEF (min) | 144±51,7 | 147,6±49,3 | 0,542 |
| Tiempo RF (s) | 2.689±1.195 | 2.686±1.184 | 0,984 |
| LT | 61,1% LT frente a 47,8% no LT | 38,9% LT frente a 52,2% no LT | 0,066 |
| LM | 65,2 LM frente a 47% no LM | 34,8% LM frente a 53% no LM | 0,003 |
AI: aurícula izquierda; CP: cardiopatía; EEF: estudio electrofisiológico; FAPx: fibrilación auricular paroxística; FE: fracción de eyección; HTA: hipertensión arterial; IMC: índice de masa corporal; LM: línea mitral; LT: línea del techo; RF: radiofrecuencia; SAOS: síndrome de apnea obstructiva del sueño.
Grupo A: antes de enero de 2008; Grupo B: después de enero de 2008.
Figura 1. A: análisis de la supervivencia (Kaplan-Meier); seguimiento libre de recurrencia arrítmica tras un primer procedimiento de ablación, atendiendo al tipo de fibrilación auricular. B: análisis de la supervivencia (Kaplan-Meier); seguimiento libre de recurrencia arrítmica tras un primer procedimiento de ablación entre pacientes hipertensos y normotensos. C: análisis de la supervivencia (Kaplan-Meier); seguimiento libre de recurrencia arrítmica tras un primer procedimiento de ablación entre los pacientes con diámetro de aurícula izquierda > 44 o < 45 mm. D: análisis de la supervivencia (Kaplan-Meier); seguimiento libre de recurrencia arrítmica tras un primer procedimiento de ablación en los pacientes con y sin síndrome de apnea obstructiva del sueño. AI: aurícula izquierda; FA: fibrilación auricular; HTA: hipertensión auricular; SAOS: síndrome de apnea obstructiva del sueño.
Tabla 4. Análisis multivariable: factores independientes predictores de recurrencia arrítmica
| Variables | HR | IC95% | p |
| HTA | 1,502 | 1,102-2,046 | 0,010 |
| SAOS | 1,420 | 1,008-2,001 | 0,045 |
| AI dilatada | 1,293 | 0,945-1,769 | 0,108 |
| FA paroxística | 0,841 | 0,624-1,133 | 0,256 |
AI: aurícula izquierda; FA: fibrilación auricular; HR: hazard ratio; HTA: hipertensión arterial; IC95%: intervalo de confianza del 95%; SAOS: síndrome de apnea obstructiva del sueño.
Hubo un total de 61 complicaciones clínicamente relevantes (8,4%): 48 pertenecientes a procedimientos del grupo A (11,45%) y 13 a procedimientos del grupo B (4,2%), con diferencia estadísticamente significativa (p=0,002) (Tabla 5). En total, 31 (4,2%) fueron clasificadas como graves o mayores, y resultaron significativamente más frecuentes en los procedimientos del grupo A (26; 6,2%) que en el B (5; 1,6%; p=0,002), y 30 (4,1%) fueron clasificadas como complicaciones menores, sin diferencias estadísticamente significativas entre los grupos (22 en el grupo A, el 5,2%, y 8 en el grupo B, el 2,6%; p=0,129). Las diferencias observadas entre subgrupos se debieron principalmente a una reducción de las complicaciones embólicas (coronarias y cerebrovasculares), tal y como se aprecia en la Tabla 5. Registramos un total de 9 embolias coronarias de aire (1,2%), todas transitorias y con completa resolución de la clínica anginosa y la elevación del segmento ST en el ECG con nitroglicerina endovenosa. De ellas, 8 (1,9%) tuvieron lugar con anterioridad a la aplicación del protocolo especificado (grupo A) y 1 (0,3%) después (grupo B). Igualmente registramos un total de 9 accidentes isquémicos cerebrales transitorios (AIT). El resto de las complicaciones mayores, a excepción de los taponamientos pericárdicos (7; 1%), a pesar de su gravedad, fueron excepcionales. Hubo un total de 4 seudoaneurismas femorales (0,6%), los cuales requirieron la reparación quirúrgica de la arteria. Mención especial merece una rotura del aparato subvalvular mitral por atrapamiento del catéter circular durante la cartografía electroanatómica de la AI, que requirió reparación quirúrgica urgente de la válvula mitral, y una perforación cardiaca por desgarro de la unión venoauricular de la VP superior izquierda durante la cartografía, que requirió pericardiocentesis urgente y sutura quirúrgica del desgarro. En cuanto a las complicaciones menores, no hubo diferencias en la interrupción del procedimiento debido a complicación de la punción transeptal con punción pericárdica o aórtica (sin taponamiento) (el 3,8% en el grupo A y el 2,3% en el grupo B; p=0,29). Registramos 3 pericarditis con derrame pericárdico no severo asociado (0,4%), 2 (0,3%) esofagitis (clínica de disfagia transitoria con dolor retroesternal urente asociado, sin evidencia de fístula esofagicoauricular), y 2 pacientes (0,3%) presentaron estenosis significativas de VP (definida como reducción a menos del 50% del calibre vascular de al menos una VP), aunque sin repercusión clínica. Los únicos factores relacionados de manera estadísticamente significativa con mayor prevalencia de complicaciones totales fueron la protocolización del procedimiento, el empleo de catéter circular (ambos protectores) y el sexo femenino (Tabla 6); la protocolización del procedimiento (OR=0,406; intervalo de confianza del 95% [IC95%], 0,214-0,769; p<0,006) y el sexo masculino (OR=0,503; IC95%, 0,275-0,919; p<0,026) resultaron predictores independientes de la ausencia de complicaciones. A pesar de que los procedimientos del grupo B fueron discretamente más largos (162±48min en el grupo B frente a 131±45min en el grupo A; p<0,001) y tuvieron tiempos de aplicación de RF más largos (3.221±984 ms en el grupo B frente a 2.307±1.062 ms en el grupo A; p<0,001), estos factores no resultaron predictores de complicaciones.
Tabla 5. Diferencias en las complicaciones de la ablación de las venas pulmonares según la protocolización del procedimiento (grupo A: procedimientos realizados antes de enero de 2008, sin protocolización; grupo B: procedimientos realizados después de enero de 2008, protocolizados).
| Complicaciones | Totales (n=726) | Grupo A (n=419) | Grupo B (n=307) | p |
| Mayores | 31 (4,3) | 26 (6,2) | 5 (1,6) | 0,002 |
| AIT | 9 (1,2) | 8 (1,9) | 1 (0,3) | 0,087 |
| Embolia coronaria | 9 (1,2) | 8 (1,9) | 1 (0,3) | 0,087 |
| Taponamiento pericárdico | 7 (1) | 6 (1,4) | 1 (0,3) | 0,248 |
| Rotura subvalvular mitral | 1 (0,1) | 0 | 1 (0,3) | 0,423 |
| TEP | 1 (0,1) | 1 (0,2) | 0 | 0,392 |
| Seudoaneurisma femoral | 4 (0,5) | 3 (0,7) | 1 (0,3) | 0,642 |
| Menores | 30 (4,1) | 22 (5,2) | 8 (2,6) | 0,129 |
| Punción transeptal complicada | 23 (3,2) | 16 (3,8) | 7 (2,3) | 0,290 |
| Pericarditis | 3 (0,4) | 3 (0,7) | 0 | 0,267 |
| Esofagitis | 2 (0,3) | 1 (0,2) | 1 (0,3) | 0,825 |
| Estenosis VP asintomática | 2 (0,3) | 2 (0,5) | 0 | 0,511 |
| Totales | 61 (8,4) | 48 (11,4) | 13 (4,2) | 0,002 |
AIT: accidente isquémico transitorio; TEP: tromboembolia pulmonar; VP: venas pulmonares.
Los datos expresan n (%).
Tabla 6. Características diferenciales entre los procedimientos que presentan complicaciones. Análisis univariable
| Complicaciones (%) | |||
| Variable analizada | Sí | No | p |
| Empleo de catéter circular | 3,1 | 7,8 | 0,019 |
| Protocolización del procedimiento | 4,2 | 10,5 | 0,002 |
| Sexo masculino | 6,8 | 11,8 | 0,040 |
| HTA | 8,3 | 7,9 | 0,850 |
| SAOS | 8,1 | 9 | 0,771 |
| Antecedentes de ACV | 12,9 | 8,4 | 0,382 |
| Cardiopatía | 4,8 | 9,2 | 0,067 |
| Línea mitral | 5,9 | 6,3 | 0,842 |
| Línea del techo | 5,3 | 9,2 | 0,094 |
| FA paroxística | 7,6 | 8,3 | 0,750 |
| AI dilatada | 7,1 | 9,9 | 0,201 |
ACV: accidente cerebrovascular; AI: aurícula izquierda; FA: fibrilación auricular; HTA: hipertensión arterial; SAOS: síndrome de apnea obstructiva del sueño.
Debido a la prevalencia creciente de FA en nuestra población, y con el fin de dar respuesta a las exigencias crecientes en el tratamiento de ablación de la FA, cada vez son más los laboratorios que se inician en esta técnica. La ablación de FA es un procedimiento complejo, y sus complicaciones, aunque infrecuentes, pueden ser graves. Los resultados presentados en las distintas series varían ampliamente y dependen fundamentalmente de la experiencia del centro y el tipo de FA. En este sentido, a pesar de las elevadas tasas de éxito publicadas para la FA paroxística, superiores al 80% en las series publicadas inicialmente por grupos pioneros, son inferiores al 70% cuando se revisan series más recientes10, 11, 12. Del mismo modo, si comparamos para un mismo grupo las primeras series publicadas con series posteriores, los resultados también varían ampliamente (de tasas de éxito a 6 meses < 60% a tasas libres de recurrencia al año > 90%)10, 13 debido a la curva de aprendizaje y el avance tecnológico acompañante. Esto mismo ocurre en la FA persistente, de modo que, dependiendo del centro, la técnica empleada y la metodología para la detección de las recurrencias, las tasas de éxito oscilan entre un 50 y 75%12, 14. En nuestra serie, el éxito total de la ablación es del 60,9%, algo menor que lo publicado por algunos de estos grupos. Posiblemente, este mayor porcentaje de recurrencias en nuestro grupo se deba a la aceptación de recurrencia arrítmica con un criterio muy riguroso, en el que cualquier episodio arrítmico registrado a partir del tercer mes de seguimiento (periodo de blanqueo) de más de 30 s de duración se considera como tal, independientemente de que sea sintomático o no o de que el paciente esté tomando fármacos antiarrítmicos, ligado a la realización de Holter de 48 h (ocasionalmente de 7 días) a los 3, 6 y 12 meses, y finalmente a la recomendación insistente que damos a los pacientes de obtener registros ECG en caso de sufrir síntomas que indiquen arritmia. En nuestra institución, todos los procedimientos incluidos en la serie se realizaron mediante cartografía no fluoroscópica de la AI, con ayuda de las imágenes tridimensionales previamente adquiridas con TC o RM, especialmente útil en el caso de anatomías complejas, empleando en más del 80% de los casos un catéter de ablación irrigado y con el objetivo principal de lograr el aislamiento eléctrico de las VP mediante la aplicación de RF a nivel de la unión venoauricular. Según estudios previamente publicados, en los pacientes hipertensos, con AI dilatada, FA no paroxística y con SAOS, la ablación de las VP resulta menos efectiva15, 16, 17, 18, 19, 20, 21, 22; mientras que en nuestra serie la hipertensión arterial y el SAOS han sido los más potentes predictores de recurrencia independientes. Paralelamente, observamos que los pacientes con ablación lineal del istmo mitral presentaron un mayor número de recurrencias. Probablemente su realización incompleta, sin comprobación del bloqueo, podría haber resultado proarrítmica. Por este motivo, en la gran mayoría de los procedimientos realizados en los últimos 2 años, la línea mitral no ha sido realizada. Por otra parte, en nuestro estudio el empleo de catéter circular para cartografiar la AI se asoció con una reducción de las complicaciones totales; sin embargo, dado que su empleo en el grupo A del estudio es muy minoritario y se introdujo sistemáticamente en el grupo B, podría haber un efecto tiempo y el beneficio real en la reducción de las complicaciones podría no ser tan claro.
A pesar de que las complicaciones han ido disminuyendo de acuerdo con la curva de aprendizaje de los operadores y gracias a los avances tecnológicos, sigue habiendo complicaciones mayores y representan en nuestra serie el 4,2%, lo que supone una frecuencia similar a la recogida en el último registro mundial sobre los métodos, la eficacia y la seguridad de la ablación por catéter de la FA23.
La mayoría de las complicaciones aparecen durante o inmediatamente después del procedimiento. El taponamiento cardiaco sigue siendo la más frecuente complicación con potencial riesgo vital, en la mayoría de los casos relacionada con el procedimiento de punción transeptal. En nuestra serie esta complicación no disminuyó significativamente con el tiempo, probablemente en relación con la incorporación de un nuevo operador en los últimos 2 años de la serie, pues es indiscutible la importancia de la curva de aprendizaje. En el presente estudio, de las 61 complicaciones, el 79% se compone de las derivadas de la punción transeptal (con o sin taponamiento) y eventos embólicos tanto cerebrales como coronarios. A partir de la instauración de un protocolo de anticoagulación y sedación consciente durante el procedimiento, se observó una reducción de las complicaciones tromboembólicas (de 8 antes a 1 después de su instauración sistemática). Previamente a la protocolización del procedimiento, se realizaba la aplicación de un bolo inicial de HNF, monitorizando de manera variable el ACT y administrando dosis de HNF variables a juicio del operador, lo que conllevaba aceptar niveles de anticoagulación subóptimos (< 250 s). Según este protocolo, el objetivo es mantener durante todo el procedimiento niveles de ACT > 250 ms.
Por otra parte, es de especial importancia la manipulación cuidadosa de las vainas y los sistemas de irrigación continua para evitar tanto la formación de trombos como la introducción de aire en el sistema, ya que ello puede ser causa de gran parte de los eventos cardioembólicos, fundamentalmente coronarios. En este sentido, resulta primordial la formación del personal de enfermería en la vigilancia de los niveles de anticoagulación y los sistemas de irrigación y la detección precoz de complicaciones.
La reducción significativa de complicaciones con el paso de los años responde sin duda a varios factores. Por una parte, la sistematización de la anticoagulación durante el procedimiento ha contribuido a conseguir unos niveles óptimos y estables de anticoagulación, lo que podría explicar la reducción significativa de las complicaciones embolicas a partir de 2008. Por otra, con los años el análisis de las complicaciones y la búsqueda exhaustiva de sus potenciales causas han contribuido a la formación tanto del personal médico como del personal de enfermería. La curva de aprendizaje ha supuesto una atención exhaustiva a la manipulación de los catéteres, saber reconocer las potenciales fuentes de complicaciones y, por lo tanto, evitar su aparición.
Asimismo, junto con la protocolización de la anticoagulación, en 2008 se inició un protocolo de sedación consciente a todos los pacientes. Este protocolo, definido gracias a las recomendaciones de los compañeros del servicio de anestesiología, posiblemente sea un factor adicional de la reducción de las complicaciones, gracias a un mayor confort del paciente y, por ello, mayores estabilidad del catéter y seguridad del procedimiento.
Limitaciones del estudioDado que se trata de un estudio prospectivo y no aleatorizado, no es posible detectar qué porcentaje de la mejora en resultados y complicaciones deriva de los tres factores implicados: aprendizaje, mejora tecnológica y protocolización. Por otra parte, en la evaluación del éxito resulta primordial el método de monitorización empleado en el seguimiento para registrar las recurrencias arrítmicas, debido a que a menudo no hay buena correlación entre los síntomas percibidos por el paciente y los episodios de arritmia persistentes. Sin embargo, la monitorización de los resultados fue igual en ambos grupos. Por último, hay aspectos técnicos de los procedimientos, tales como la realización de la línea mitral, la línea del techo o el empleo del catéter circular, cuyas limitaciones derivadas tanto de su realización no estandarizada ni protocolizada como de la falta de datos especialmente en los procedimientos iniciales, han sido reiteradamente comentadas en el texto, y son necesarios estudios aleatorizados que analicen el valor predictor de tales factores.
ConclusionesEl procedimiento de ablación de las VP ha experimentado una mejora significativa en la tasa de resultados y complicaciones con el paso de los años.
La aplicación sistemática de un protocolo de anticoagulación y sedación consciente se asocia a la mejora de los resultados y la reducción de las complicaciones en el procedimiento de ablación de FA. Otros factores no medidos en este estudio, como la curva de aprendizaje de los operadores y la progresiva mejora tecnológica, pueden haber influido en los cambios observados.
FinanciaciónEl presente artículo ha sido financiado en parte por una beca del Instituto de Salud Carlos III: REDINSCOR RD06/0003/0008.
Conflicto de interesesNinguno.
Recibido 18 Marzo 2011
Aceptado 3 Agosto 2011
Autor para correspondencia: Sección de Arritmias, Servicio de Cardiología, Institut del Tòrax, Hospital Clínic Universitari de Barcelona, Villarroel 170, 08036 Barcelona, España. lmont@clinic.ub.es