La mayoría de los dispositivos de asistencia ventricular (DAV) de larga duración utilizados actualmente son intracorpóreos y de flujo continuo. Sus principales inconvenientes son el coste elevado y la imposibilidad de ofrecer soporte biventricular. El objetivo de este estudio es describir los resultados de una estrategia de implante de un DAV paracorpóreo de flujo pulsátil como puente al trasplante (PAT) en pacientes adultos.
MétodosAnálisis retrospectivo de las características, complicaciones y resultados de una serie unicéntrica de pacientes consecutivos tratados con el DAV EXCOR como PAT entre 2009 y 2015.
ResultadosEn este periodo se implantaron 25 DAV, 6 de ellos biventriculares. En 12 pacientes la indicación fue directamente PAT y en 13 puente a la decisión debido a la presencia de contraindicaciones potencialmente reversibles o posibilidad de recuperación. Veinte pacientes (80%) alcanzaron el objetivo del trasplante cardiaco tras una mediana de soporte de 112 días (rango 8-239). Las principales complicaciones fueron: infecciosas (52% de los pacientes), neurológicas (32%, la mitad de ellas mortales), hemorrágicas (28%) y fallo del DAV que obligó a cambiar algún componente de este (28%).
ConclusionesEl 80% de los pacientes tratados con el DAV EXCOR como PAT alcanzaron el objetivo tras una mediana de soporte de casi 4 meses. Las complicaciones más frecuentes fueron las infecciosas y las más graves las neurológicas. El empleo de estos DAV de flujo pulsátil como PAT, en nuestro medio, es una estrategia factible que consigue resultados similares a los DAV de flujo continuo.
Palabras clave
A pesar de los constantes avances terapéuticos en insuficiencia cardiaca (IC), un número importante de estos pacientes llega a una situación de IC refractaria a los tratamientos convencionales. Para la mayoría de ellos el trasplante cardiaco (TxC) sigue siendo el tratamiento de elección; sin embargo, la escasez de donantes y la presencia de contraindicaciones o comorbilidades hacen que muchos pacientes no puedan acceder a esta terapia. Por ello, los dispositivos de asistencia ventricular (DAV) han experimentado un rápido desarrollo en los últimos años. Su función es dar soporte circulatorio a los pacientes con IC avanzada hasta llegar al TxC como «puente al trasplante» (PAT), hasta que la función cardiaca se recupere en casos de cardiopatías reversibles («puente a la recuperación») o como tratamiento definitivo en pacientes no candidatos a TxC («terapia de destino»).
Actualmente los DAV paracorpóreos de flujo pulsátil han dado paso a una nueva generación de bombas de flujo continuo más duraderas, de menor tamaño y consumo, y de implantación intracorpórea. Sus resultados son muy aceptables, aunque con la limitación de su elevado coste y la dificultad para asistir a ambos ventrículos a la vez. En España, con un tiempo medio de espera de TxC menor de 6 meses (inferior al de otros países de su entorno) y con condicionantes económicos que limitan la expansión de estas terapias, los DAV pulsátiles podrían mantener su utilidad como PAT.
La escasa evidencia publicada sobre la utilidad de los DAV pulsátiles de larga duración en adultos se basa fundamentalmente en casos clínicos aislados1–3. El objetivo de este trabajo es analizar los resultados globales de una estrategia de implante del DAV pulsátil de larga duración EXCOR (Berlin Heart) como PAT en una serie unicéntrica de pacientes adultos con IC avanzada.
MÉTODOSDiseño del estudioEstudio observacional retrospectivo basado en un registro local en el que se incluyó a todos los pacientes con implante del DAV EXCOR entre 2009 y 2015. El registro contenía todas las variables del registro IMACS (International Society for Heart and Lung Transplantation Registry for Mechanically Assisted Circulatory Support) y otras adicionales consideradas de interés. Entre estas variables figuran características demográficas, clínicas, analíticas, ecocardiográficas y hemodinámicas de los pacientes, datos del implante y datos de seguimiento a la semana, al mes y posteriormente cada 3 meses. Se recogieron específicamente todos los eventos adversos relacionados con el DAV: hemorragias, trombosis, ictus, infecciones, arritmias, fallo de ventrículo derecho (VD), disfunción del DAV y sensibilización por desarrollo de anticuerpos anti-HLA (human leukocyte antigen). El objetivo primario del estudio es evaluar la utilidad del DAV para alcanzar el desenlace final (TxC o explante por mejoría). El objetivo secundario es analizar las complicaciones ocurridas durante el periodo de asistencia.
Pacientes y procedimientoSe indicó el implante del DAV en pacientes de edad igual o mayor de 16 años con IC aguda o crónica, en clase funcional IV de la New York Heart Association, refractaria a otras modalidades de tratamiento y que estaban incluidos en lista de espera de TxC o se estaba valorando su inclusión, pero en los que se estimaba la imposibilidad de alcanzar el TxC sin un dispositivo «puente». Por lo general se trataba de pacientes con múltiples ingresos por IC y con necesidad de inotrópicos intravenosos. La cardiopatía debía tener características anatómicas favorables para el buen funcionamiento del dispositivo: fundamentalmente, disfunción sistólica grave del ventrículo izquierdo con tamaño de la cavidad normal o aumentado. Se consideraron condiciones desfavorables las miocardiopatías hipertróficas y restrictivas, así como la presencia de esternotomía previa.
A todos los pacientes se les realizó un cateterismo derecho durante su valoración pronóstica previa al implante del DAV. Los pacientes con hipertensión pulmonar que contraindicaba el TxC (≥ de 2 de los siguientes criterios: presión arterial pulmonar sistólica ≥ 50mmHg, gradiente transpulmonar ≥ 15mmHg, resistencia vascular pulmonar ≥ 3,5 unidades Wood) se sometieron a un segundo cateterismo tras la administración de diuréticos e inotrópicos (milrinona, levosimendán), vasodilatadores sistémicos (nitroprusiato) y pulmonares (óxido nítrico inhalado). Si aun así no se alcanzaban cifras compatibles con la realización del TxC, en los pacientes con estabilidad clínica suficiente, se pautaba sildenafilo o bosentán durante 12-16 semanas y se repetía el cateterismo derecho. Se consideró «hipertensión pulmonar refractaria» aquella que no respondía suficientemente a todas estas medidas.
Los casos se presentaron en una sesión medicoquirúrgica donde se decidió la indicación, la fecha del implante del DAV, y si este debía ser izquierdo o biventricular en función del riesgo de fracaso del VD tras el implante4. A todos los pacientes se les informó de los potenciales beneficios y riesgos del procedimiento y firmaron un consentimiento informado específico.
La cirugía se realizó mediante esternotomía con el corazón latiendo y bajo circulación extracorpórea. Los pacientes se monitorizaron durante el implante con catéter de Swan-Ganz y ecocardiograma transesofágico para valorar la función del VD y la correcta colocación de las cánulas.
Durante las primeras horas tras el implante, los pacientes recibieron fármacos vasoactivos e inotrópicos para mantener una presión arterial media entre 70-80mmHg. En los casos de DAV izquierdo con fracaso del VD se añadía óxido nítrico, milrinona, sildenafilo intravenoso y/o derivados de prostaciclinas inhalados. Una vez se retiraban estos fármacos, se iniciaba tratamiento de IC de acuerdo con las guías de práctica clínica. En los casos con persistencia de fallo del VD se mantenía el sildenafilo oral.
A las 12-24h de la cirugía, si no existía hemorragia significativa, se iniciaba anticoagulación con enoxaparina o heparina sódica y posteriormente se sustituía por acenocumarol con un INR (cociente internacional normalizado) objetivo de 2,5-3,5. A los 2-3 días, o una vez retirados los drenajes, se añadía antiagregación plaquetaria (ácido acetilsalicílico + dipiridamol) y su efecto se medía mediante el test Multiplate (Roche Diagnostics; Basilea, Suiza). Se consideró resistencia al ácido acetilsalicílico tener valores de Multiplate-ASPI-test > 50 U y al dipiridamol valores de Multiplate-ADP-test > 40 U. En estos casos se aumentaba la dosis del fármaco resistente. Si la resistencia persistía, se sustituía este por otro antiagregante: en la mayoría de casos clopidogrel.
Las curas de los orificios de salida de las cánulas se realizaban por personal especializado de enfermería con suero fisiológico y clorhexidina, según protocolo local, cada 12h durante los 3 primeros días o en caso de infección local y cada 24-48h a partir de entonces. En todos los casos se entrenaba al paciente y al menos un familiar para que pudieran realizar las curas en su domicilio, tras el alta hospitalaria, así como para controlar la anticoagulación (Coagucheck XS, Roche) y reconocer las principales alarmas del dispositivo. Las bombas del DAV, de pared transparente, debían valorarse 3 veces al día con una linterna para descartar la existencia de trombos en su interior.
Tras el alta, los pacientes acudían a revisión al hospital cada 7-15 días. Si se mantenían estables, se esperaba al tercer mes tras el implante para valorar de nuevo la indicación de TxC (DAV como puente a la decisión) o activarlos de nuevo en la lista si ya habían estado previamente (DAV como PAT). El paciente entraba directamente en lista de espera urgente grado 1 (prioridad regional) de la Organización Nacional de Trasplantes. Si había disfunción grave de la asistencia, podía incluirse en grado 0 (prioridad nacional).
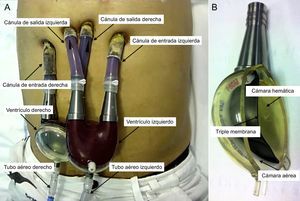
Dispositivo de asistencia ventricularEl DAV de flujo pulsátil EXCOR Berlin Heart (Berlín, Alemania) consta de una cánula de entrada, que se inserta habitualmente en el ápex del ventrículo izquierdo, y de una cánula de salida en la aorta ascendente (asistencia izquierda) o en la aurícula derecha y la arteria pulmonar (asistencia derecha) y puede hacerse asistencia biventricular. Estas cánulas de silicona se tunelizan por encima del diafragma hasta salir por la piel y se conectan a una bomba o ventrículo artificial colocado en posición paracorpórea en el hemiabdomen superior. Las bombas tienen una carcasa externa de poliuretano trasparente y tamaño variable (entre 10-80ml) y están divididas por una triple membrana en 2 cámaras (sanguínea y aérea). La cámara sanguínea, recubierta en su interior por un material biocompatible, es la que se comunica con las cánulas de entrada y salida a través de unas válvulas unidireccionales que inicialmente eran mecánicas (monodisco) y posteriormente de poliuretano (trivalvas), menos ruidosas. La cámara aérea se llena por presión positiva en sístole y se vacía por presión negativa en diástole a través de un tubo de aire conectado a una unidad de impulsión neumática que puede ser estacionaria (consola IKUS) o portátil ambulatoria (figura 1 y ).
Análisis estadísticoLas variables numéricas se describen mediante media ± desviación estándar, o medianas y rango, según cumplieran o no la asunción de normalidad. Las variables categóricas se expresan como frecuencia absoluta y relativa. La supervivencia global se ha estimado mediante el método actuarial de Kaplan-Meier. Para analizar el tiempo hasta el trasplante se ha estimado la función de incidencia acumulada, puesto que la muerte actúa como evento competitivo en su observación. Los resultados se muestran junto a su correspondiente intervalo de confianza del 95%. Todos los tests se realizaron a 2 colas y se consideró un resultado estadísticamente significativo un valor de p < 0,05. Para los análisis se utilizó el programa STATA/IC 14.1.
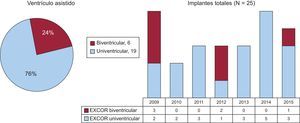
RESULTADOSCaracterísticas basales de los pacientesEntre 2009 y 2015 se implantaron 25 DAV EXCOR en el Hospital Universitario Puerta de Hierro: 19 izquierdos y 6 biventriculares (figura 2). En el momento del implante, 12 pacientes llevaban en lista de espera de TxC una mediana de 37 días (rango, 8-322). Los otros 13 casos se implantaron como puente a la decisión: 9 por alguna contraindicación potencialmente reversible (7 de ellos por hipertensión pulmonar refractaria) y 4 porque la IC era potencialmente mejorable. El resto de características se muestran en la tabla 1.
Características clínicas, ecocardiográficas y hemodinámicas basales de la población (n = 25)
| Mujeres | 3 (12) |
| Edad (años) | 47,7 ± 11,8 |
| Área de superficie corporal (m2) | 1,9 ± 0,2 |
| Tipo de cardiopatía | |
| Miocardiopatía dilatada no isquémica | 9 (36) |
| Miocardiopatía dilatada isquémica | 8 (32) |
| Síndrome coronario agudo | 3 (12) |
| Miocarditis aguda | 3 (12) |
| Miocardiopatía hipertrófica | 1 (4) |
| Miocardiopatía arritmogénica del VD | 1 (4) |
| Grado INTERMACS | |
| 1-2 | 9 (36) |
| 3-4 | 16 (64) |
| Tiempo desde el diagnóstico de IC | |
| < 1 mes | 3 (12) |
| 1 mes-1 año | 3 (12) |
| > 1 año | 19 (76) |
| Cirugía cardiaca previa | 1 (4) |
| Portador de DAI | 18 (72) |
| Portador de dispositivo de RSC | 8 (32) |
| Situación en las 48 h preimplante | |
| Inotrópicos | 21 (84) |
| Balón de contrapulsación intraaórtico | 8 (32) |
| Otra asistencia circulatoria | 2 (8) |
| Respirador | 5 (20) |
| Diálisis | 1 (4) |
| Parámetros analíticos 24 h preimplante | |
| Creatinina (mg/dl) | 1,4 ± 0,5 |
| GOT/AST (U/l) | 23 [17-31] |
| Bilirrubina (mg/dl) | 1,5 ± 0,8 |
| Ácido láctico (mg/l) | 1,4 ± 0,8 |
| NT-proBNP (pg/ml) | 8.580 [6.123-21.814] |
| Parámetros ecocardiográficos | |
| DTDVI (cm) | 6,7 ± 0,9 |
| FEVI (%) | 20,4 ± 6,7 |
| Insuficiencia mitral IV | 12 (48) |
| Insuficiencia tricúspide III-IV | 12 (48) |
| Insuficiencia aórtica III-IV | 1 (4) |
| TAPSE (mm) | 15,7 ± 5,1 |
| Parámetros hemodinámicos | |
| IxC (l/min/m2) | 2,2 ± 0,5 |
| PCP (mmHg) | 26,9 ± 7,3 |
| PAPs (mmHg) | 56,1 ± 18,5 |
| PAPm (mmHg) | 39,8 ± 11,9 |
| GTPm (mmHg) | 12,8 ± 7,5 |
| RVP (UW) | 2,2 ± 2,1 |
| PVC (mmHg) | 14,6 ± 6,6 |
| RVSWI* (mmHg × l/m2) | 0,71 ± 0,36 |
| Contraindicación para TxC | 9 (36) |
| HTP refractaria | 7 (28) |
| Peso excesivo | 1 (4) |
| Fallo grave de otros órganos | 1 (4) |
DAI: desfibrilador automático implantable; DTDVI: diámetro telediastólico del ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; GOT/AST: transaminasa glutámico-oxalacética/aspartato aminotranferasa; GTPm: gradiente transpulmonar medio; HTP: hipertensión pulmonar; IC: insuficiencia cardiaca; INTERMACS: Interagency Registry for Mechanically Assisted Circulatory Support; IxC: índice cardiaco; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; PAPm: presión arterial pulmonar media; PAPs: presión arterial pulmonar sistólica; PCP: presión capilar pulmonar; PVC: presión venosa central; RSC: resincronización cardiaca; RVP: resistencia vascular pulmonar; RVSWI: índice de trabajo sistólico del ventrículo derecho; TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo; TxC: trasplante cardiaco; VD: ventrículo derecho.
Salvo otra indicación, los datos expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Los 16 DAV implantados entre 2009 y 2013 tenían válvulas mecánicas; los 9 implantados a partir de 2014, válvulas de poliuretano. En 2 pacientes hubo que realizar una cirugía concomitante: una plastia valvular aórtica por insuficiencia aórtica grave y una reparación con parche de un desgarro de pared aneurismática del ventrículo izquierdo. Durante las primeras horas hubo que intervenir de nuevo a 5 pacientes (20%): 3 por hemorragia no controlable, 1 para implantar una asistencia derecha de corta duración y 1 para recolocar una cánula mal posicionada.
Evolución de los pacientes con la asistencia durante la hospitalizaciónFallecieron por complicaciones quirúrgicas 4 (16%) de los 25 pacientes asistidos. De los 21 pacientes restantes, 18 (86%) recibieron el alta hospitalaria y los otros 3 permanecieron ingresados: 2 por ser residir a gran distancia y 1 por decisión propia.
En los 12 primeros casos, la antiagregación consistió en 200mg de ácido acetilsalicílico y 300-800mg de dipiridamol. Posteriormente, ambos fármacos se sustituyeron por 75mg diarios de clopidogrel por mala tolerancia digestiva al dipiridamol y falta de eficacia en los tests de laboratorio.
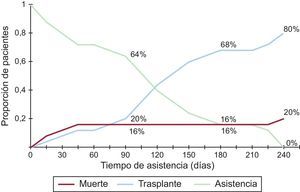
Destino final de los pacientes asistidosDe los 25 pacientes, 20 (80%) llegaron al TxC tras una mediana de 112 días (rango, 8-239) de soporte. Los otros 5 (4 izquierdos y 1 biventricular) fallecieron tras una mediana de 17 días (rango, 6-218). La supervivencia a los 30 días fue del 88% (intervalo de confianza del 95%, 66-96). En la figura 3 se presenta la curva de riesgos competitivos que muestra la situación de los pacientes a 90, 180 y 240 días tras el implante del DAV.
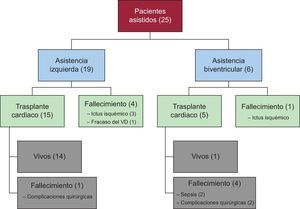
La supervivencia global a 1 año de los pacientes trasplantados (15 DAV izquierdos y 5 biventriculares) fue del 75%, similar a la de pacientes trasplantados sin DAV. La mortalidad tras el trasplante fue mayor en pacientes con DAV biventricular (80% biventricular frente a 7% izquierdo) y mayor al inicio de la serie. En la figura 4 se muestra el flujo de los pacientes según el tipo de DAV y los resultados.
En los 7 pacientes en los que se implantó el DAV por hipertensión pulmonar refractaria se demostró una reducción marcada de esta, hasta permitir su inclusión en lista de espera de TxC, en un tiempo medio de 7,7 semanas. La asistencia fue univentricular en todos los casos y todos recibieron el TxC con éxito, sin casos de fracaso del VD. La evolución tras el trasplante, al año, fue buena en los 7 pacientes.
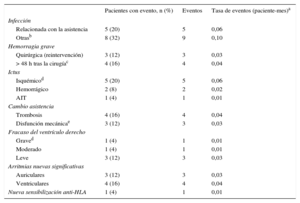
Complicaciones con la asistenciaVeintitrés pacientes (92%) presentaron algún efecto adverso con la asistencia (tabla 2). Las complicaciones más frecuentes fueron las infecciosas (52% de los pacientes). La mayoría de las infecciones (20%) fueron celulitis bacterianas en la zona pericanular y todas se controlaron con curas locales y antibióticos. Además, hubo 3 infecciones abdominales (2 colecistitis y 1 apendicitis) que precisaron abordaje quirúrgico.
Eventos adversos (n = 25)
| Pacientes con evento, n (%) | Eventos | Tasa de eventos (paciente-mes)a | |
|---|---|---|---|
| Infección | |||
| Relacionada con la asistencia | 5 (20) | 5 | 0,06 |
| Otrasb | 8 (32) | 9 | 0,10 |
| Hemorragia grave | |||
| Quirúrgica (reintervención) | 3 (12) | 3 | 0,03 |
| > 48 h tras la cirugíac | 4 (16) | 4 | 0,04 |
| Ictus | |||
| Isquémicod | 5 (20) | 5 | 0,06 |
| Hemorrágico | 2 (8) | 2 | 0,02 |
| AIT | 1 (4) | 1 | 0,01 |
| Cambio asistencia | |||
| Trombosis | 4 (16) | 4 | 0,04 |
| Disfunción mecánicae | 3 (12) | 3 | 0,03 |
| Fracaso del ventrículo derecho | |||
| Graved | 1 (4) | 1 | 0,01 |
| Moderado | 1 (4) | 1 | 0,01 |
| Leve | 3 (12) | 3 | 0,03 |
| Arritmias nuevas significativas | |||
| Auriculares | 3 (12) | 3 | 0,03 |
| Ventriculares | 4 (16) | 4 | 0,04 |
| Nueva sensibilización anti-HLA | 1 (4) | 1 | 0,01 |
AIT: accidente isquémico transitorio; DAV: dispositivo de asistencia ventricular; HLA: human leukocyte antigen.
Siete pacientes (28%) presentaron hemorragias con necesidad de transfusión, ninguna de ellas fatal: 3 hemorragias tras la cirugía y 4 sin relación con la cirugía (1 hemoperitoneo tras rotura espontánea de bazo, 2 hemorragias digestivas y 1 epistaxis).
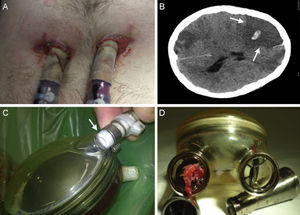
Las complicaciones más graves fueron los accidentes cerebrovasculares, que ocurrieron en 8 pacientes (32%). Cinco fueron ictus isquémicos (en 4 casos extensos y mortales: 3 en los primeros días tras la cirugía y 1 a los 218 días). Hubo 2 ictus hemorrágicos (clínicamente leves y controlados con suspensión temporal de la anticoagulación) y 1 paciente presentó un accidente isquémico transitorio coincidiendo con INR bajo. No hubo diferencias significativas en relación con el tipo de válvulas (mecánica o de poliuretano) del DAV (p = 0,31).
Siete pacientes (28%) necesitaron sustitución del ventrículo artificial. En 4 casos fue por presentar trombos en la cámara hemática, en 2 por desgarro de alguna capa de la membrana que separa ambas cámaras2 y en uno por rotura de la cánula de aire (figura 5). En otros 10 pacientes se visualizaron pequeños depósitos de fibrina que se resolvieron con modificaciones de antiagregación/anticoagulación, sin precisar recambio del dispositivo.
Complicaciones de pacientes con asistencia. A: infección de la zona pericanular. B: tomografía craneal de ictus isquémico derecho con trasformación central hemorrágica (flechas). C: rotura parcial de la zona de conexión de cánula de aire con ventrículo artificial (flecha). D: trombo en válvula mecánica de salida de ventrículo artificial derecho.
Cinco pacientes (20%) tuvieron algún grado de fracaso del VD tras el implante del DAV izquierdo. Tan solo un paciente precisó una asistencia derecha de corta duración (Levitronix CentriMag) por fallo grave del VD.
Siete pacientes (28%) presentaron arritmias con el DAV (3 auriculares y 4 ventriculares). Aunque la tolerancia de la arritmia fue buena al estar 1 o los 2 ventrículos asistidos (), en todos se intentó controlar el ritmo con fármacos (4 casos) y/o cardioversión eléctrica (3 pacientes).
Un paciente que recibió varias trasfusiones desarrolló anticuerpos anti-HLA de clase II que no interfirieron en el resultado posterior del TxC.
La mayoría de las complicaciones se produjeron en las primeras semanas, excepto la propia disfunción del DAV, que fue más frecuente a partir del tercer mes (figura 6).
DISCUSIÓNEste trabajo muestra la serie más amplia de pacientes tratados con un DAV pulsátil de larga duración en España, en donde —con un tiempo en lista de espera relativamente corto (mediana de 27 días en situación de urgencia y de 120 días en casos electivos)— un alto porcentaje de pacientes (80%) puede recibir soporte circulatorio adecuado hasta alcanzar el TxC con éxito. Un 24% de ellos recibieron asistencia biventricular que no hubiera sido posible con un DAV de flujo continuo.
Hay muy poca evidencia científica con DAV de flujo pulsátil como PAT. En el caso del dispositivo EXCOR, la principal información procede de una serie de pacientes aportada por el propio fabricante que recoge 241 implantes realizados en 10 centros (el 67% DAV biventriculares), con supervivencia global del 83% a los 6 meses y del 81% al año5. Se podría pensar que estos datos reflejan los resultados de centros seleccionados con amplia experiencia y, sin embargo, las cifras son similares a las de otra serie unicéntrica publicada en 2013 con 54 pacientes asistidos con el mismo DAV. Como en nuestro caso, un 24% fueron asistencias biventriculares y la supervivencia global a los 13 meses fue del 80%6.
Para comparar los resultados obtenidos con otros tipos de asistencias se dispone de los datos del registro norteamericano INTERMACS, que recoge más de 12.000 implantes de dispositivos de larga duración desde 2008 (el 95% DAV intracorpóreos izquierdos de flujo continuo) con supervivencias del 80% al año y del 70% a los 2 años7. El registro europeo EUROMACS recoge más de 700 implantes (> 90% DAV de flujo continuo), con supervivencias del 68% al año y del 59% a los 2 años. En este registro, a diferencia del INTERMACS, hasta el 20% de los DAV son biventriculares8. Las asistencias dobles mostraron peores resultados en ambos registros, con una supervivencia al año del 50% en INTERMACS y del 26% en EUROMACS.
En España, el número de implantes es significativamente menor que en los países de su entorno. Las razones para ello podrían ser el alto coste de estos dispositivos junto a la relativa facilidad para acceder a un TxC con tiempos de espera razonables9.
Esta experiencia con los 25 primeros pacientes a los que se ha implantado un EXCOR sugiere la utilidad de esta estrategia en las siguientes situaciones:
- •
Pacientes en lista de espera de TxC electivo que presentan deterioro progresivo, pérdida de masa muscular, daño de otros órganos, ingresos repetidos y/o dependencia de inotrópicos (INTERMACS 2 y 3). Este fue el motivo del implante del DAV en 12 casos del presente estudio. Estos pacientes no tienen criterios de TxC urgente, por lo que muchos acaban trasplantándose en peores condiciones y/o con una asistencia de corta duración, con el consiguiente aumento de riesgo10.
- •
Pacientes con alguna contraindicación para TxC potencialmente reversible a medio plazo con un DAV, como la hipertensión pulmonar refractaria. Hasta hace pocos años estos pacientes eran rechazados para TxC o se trasplantaban asumiendo un riesgo elevado de fracaso del VD tras el trasplante.
- •
Pacientes con alto riesgo de fracaso del VD tras el implante de un DAV izquierdo. Esta complicación ensombrece el pronóstico de los pacientes asistidos11. Una opción en estos casos es el implante programado de un DAV biventricular, algo que no permiten los actuales intracorpóreos de flujo continuo. Esta estrategia resultó eficaz en 5 de los 6 pacientes de la presente serie para llegar al TxC, aunque los resultados tras el trasplante fueron desfavorables en relación directa con los problemas técnicos y las complicaciones de la cirugía. Esto contrasta con otra pequeña experiencia en España que sí ha resultado positiva12. El verdadero problema es que, hoy por hoy, no existen buenas opciones de asistencia de larga duración para los casos con disfunción biventricular grave. Los resultados son desalentadores en todos los registros publicados. Por ello, a la luz de estas consideraciones, los implantes de DAV biventriculares deberían quedar reservados para individuos seleccionados sin otras opciones mejores de tratamiento como, por ejemplo, el implante de una asistencia doble de corta duración y el trasplante urgente o el implante de una asistencia izquierda con medidas transitorias de soporte farmacológico o mecánico del VD.
En cuanto al tipo y la frecuencia de las complicaciones ocurridas en los pacientes de este estudio con asistencia pulsátil, estas fueron comparables a las descritas con otros tipos de asistencias e, igualmente, la mayoría ocurrieron en los primeros 30 días. En el estudio ADVANCE con el dispositivo de flujo continuo Heartware como PAT, un 17% de los pacientes tuvieron alguna infección relacionada con el dispositivo (20% en esta serie), un 27% presentó hemorragias graves (28% en esta serie) y un 20% accidentes cerebrovasculares: incidencia algo menor que en la presente serie, en la que hubo un 32% de ictus con elevada letalidad13. La mayoría de los ictus ocurrieron en los primeros casos y durante los primeros días tras el implante, por lo que no puede descartarse la influencia de la curva de aprendizaje. En ese sentido, la potencial ventaja de EXCOR frente a las asistencias intracorpóreas es que el ventrículo es externo y trasparente; lo que permite visualizar la formación de trombos en su interior y recambiarlo antes de que estos puedan embolizar o afectar al funcionamiento del DAV, tal como se hizo en 4 de los pacientes.
En cuanto a los costes, es evidente que la necesidad de recambio de algún ventrículo en 7 de los 25 pacientes de la serie aumentó el coste global de esta estrategia. Aun así, parece razonable pensar que el coste con este tipo de asistencia sigue siendo menor que con las asistencias de flujo continuo debido a la diferencia de precios entre ambos dispositivos (un ventrículo pulsátil cuesta alrededor de un tercio del coste una asistencia de flujo continuo). Además hay que tener en cuenta que, aunque es mucho menos frecuente que con los ventrículos pulsátiles, también hay un porcentaje de las asistencias de flujo continuo que necesitan recambio por trombosis o disfunción (según datos del registro INTERMACS, alrededor del 10% a los 2 años). En cualquier caso, debe quedar claro que el presente estudio no se diseñó para evaluar los costes de la técnica.
LimitacionesEntre las limitaciones de este trabajo cabe destacar que se trata del análisis de un registro unicéntrico y retrospectivo (aunque con recogida pormenorizada «en tiempo real» de toda la información en una base de datos diseñada específicamente desde el primer caso), con un número relativamente pequeño de casos que incluye curva de aprendizaje. Este último factor se atenuó por la asistencia de un cirujano experto en los primeros casos y por las visitas de aprendizaje que el equipo hizo a otros centros con experiencia en DAV. En cualquier caso, la serie ilustra las posibilidades que tiene en España esta modalidad de DAV en una situación real.
CONCLUSIONESEsta serie demuestra que la estrategia de implantar un DAV pulsátil de larga duración tipo EXCOR como PAT en un país como España (con tiempos en lista de espera no muy prolongados) es factible, con tasas de supervivencia hasta el TxC comparables a las obtenidas con dispositivos intracorpóreos de flujo continuo. La incidencia de complicaciones es relativamente elevada (aunque manejable en la mayoría de los casos), con excepción de las de origen neurológico.
CONFLICTO DE INTERESESS. Serrano Fiz es proctor de Berlin Heart para el implante de la asistencia ventricular EXCOR.
- –
Los dispositivos de asistencia ventricular han experimentado un rápido desarrollo en los últimos años, demostrando su utilidad en pacientes con IC avanzada, como PAT y como tratamiento definitivo.
- –
La mayoría de los dispositivos que se implantan en la actualidad son bombas intracorpóreas de flujo continuo, que tienen como limitaciones su alto coste y la dificultad para asistir al mismo tiempo ambos ventrículos.
- –
En España el número de implantes es significativamente inferior que en los países de su entorno.
- –
La razón principal puede ser la relativa facilidad para acceder a un trasplante en un tiempo de espera razonable.
- –
Este trabajo muestra la serie española más amplia de pacientes tratados con un DAV de larga duración de flujo pulsátil como PAT cardiaco. Se demuestra que la estrategia de utilizar este tipo de asistencias es factible en un país con tiempos medios en lista de TxC relativamente cortos y una situación de dificultad económica.
- –
La posibilidad de dar soporte biventricular favorece su utilización.
- –
Las complicaciones asociadas al uso de estos dispositivos son frecuentes y elevadas, aunque manejables en la mayoría de los casos y comparables a las descritas con los dispositivos intracorpóreos de flujo continuo.
Este trabajo no podría haberse realizado sin la colaboración de todo el personal de los Servicios de Cardiología, Cirugía Cardiaca, Anestesia y Reanimación del Hospital Universitario Puerta de Hierro de Majadahonda. Agradecimientos especiales a las doctoras Dolores García-Cosío, Inés Sayago y Natalia Jaramillo, a Gustavo Blaires por su soporte con la informática y a Ana Royuela por su ayuda con la estadística.