Recientemente los neurólogos han comenzado a realizar ecocardioscopia para la detección de cardiopatías en pacientes con ictus isquémico, lo cual requiere un proceso previo de formación acreditada. Se diseñó un estudio prospectivo con el objetivo de analizar la incidencia de cardiopatías detectadas por ecocardioscopia en una unidad de ictus integrada en red con una Unidad de Imagen Cardiaca y el pronóstico de la detección de cardiopatía estructural a 1 año de seguimiento.
MétodosSe incluyeron los casos que ingresaron por ictus isquémico o accidente isquémico transitorio en un hospital clínico universitario de 2017 a 2021 y fueron evaluados mediante ecocardioscopia. Se estudió la presencia de cardiopatía estructural y cardiopatía embolígena. Se analizaron los eventos cardiovasculares (ECV) durante el primer año de seguimiento.
ResultadosSe realizó ecocardioscopia a 706 pacientes. Se detectó cardiopatía estructural en el 52,1% de los casos y cardiopatía embolígena en el 31,9%. El 5,49% había sufrido ECV al año de seguimiento. La presencia de cardiopatía estructural de novo se asoció de manera independiente con una mayor probabilidad de ECV (HR=1,72; IC95%, 1,01-2,91; p=0,046).
ConclusionesLa ecocardioscopia dentro de un proceso integrado en red de atención al ictus con unidades de imagen cardiaca es una técnica accesible y de alta rentabilidad diagnóstica. Su uso permite actuaciones clínicas y terapéuticas directas en la prevención de nuevas embolias cerebrales y otros ECV en este grupo de pacientes.
Palabras clave
El ictus isquémico es una afección con elevada incidencia que genera gran discapacidad, pues es la primera causa de dependencia en el adulto y la segunda causa de demencia en el mundo. Su incidencia global se está incrementando notablemente por el aumento de la esperanza de vida1. En España constituye la segunda causa de muerte en la población general y la primera en la mujer2. Hasta en un 25-30% de los ictus isquémicos se detectan cardiopatías subyacentes que causan la embolia cerebral3–5. La más frecuente es la fibrilación auricular (FA); otros defectos estructurales como la depresión de la función ventricular, las zonas de acinesia y la presencia de vegetaciones, trombos intracavitarios o tumores cardiacos también son fuentes de alto riesgo cardioembólico. Otras enfermedades que también se han identificado como potencialmente causantes de un ictus cardioembólico pero con un riesgo menor son el foramen oval permeable (FOP), la aurícula izquierda dilatada o las placas de ateroma aórticas6. Por este motivo, en la última guía de la AHA/ASA, publicada en 2021, para la prevención secundaria de ictus isquémico se recomienda la realización sistemática de un ecocardiograma transtorácico (ETT) en el estudio de pacientes con ictus isquémico de origen indeterminado o criptogénico7.
Sin embargo, el ETT no siempre está disponible de inmediato debido a la sobrecarga asistencial de las unidades de imagen cardiaca, lo que puede prolongar el ingreso hospitalario y los diagnósticos específicos. Con el desarrollo de la tecnología y de los equipos de ecografía portátiles en los últimos años, la ecocardiografía se ha hecho accesible para otros grupos de profesionales no cardiólogos, como médicos de familia, internistas, intensivistas o neurólogos, y surge el término «ecocardioscopia» como prueba de imagen de ultrasonidos utilizada por el médico responsable del paciente, con el objetivo de mejorar la exploración física cardiaca convencional. La ecocardioscopia está dirigida a responder cuestiones concretas que buscan una orientación diagnóstica a una patología relevante, está indicada en situaciones clínicas específicas, definidas por los síntomas del paciente y por los escenarios clínicos y tiene un carácter limitado, no exhaustivo, que busca un alto valor predictivo negativo8.
En 2019 la Sociedad Española de Cardiología (SEC) acreditó un programa de formación en ecocardioscopia para neurólogos y otros especialistas9.
La implementación sistemática de la ecocardioscopia realizada por neurólogos dentro del proceso asistencial de las unidades de ictus y en coordinación con las unidades de imagen cardiaca está escasamente difundida y su utilidad todavía no se ha evaluado. Por este motivo, se ha diseñado un estudio prospectivo de los casos evaluados mediante ecocardioscopia integrada en red en unidades de imagen cardiaca en pacientes con ictus isquémico o accidente isquémico transitorio (AIT), con el objetivo de conocer la incidencia y el tipo de enfermedad estructural observada y si esta se asoció con una mayor incidencia de eventos cardiovasculares (ECV) a 1 año de seguimiento.
MÉTODOSSe realizó un estudio observacional prospectivo de casos consecutivos evaluados mediante ecocardioscopia realizada por neurólogos a pacientes ingresados por ictus isquémico en la unidad de ictus del servicio de neurología en un hospital clínico universitario de 2017 a 2021.
En 2019 se desarrolló la certificación en Ecocardioscopia de la Sección de Imagen Cardiaca de la Sociedad Española de Cardiología y la Sociedad Española de Neurología9. En el estudio participó un neurólogo con experiencia en patología cerebrovascular y ecocardiografía, formado durante 6 meses en la unidad de imagen cardiaca y acreditado en ecocardioscopia.
Durante los años 2017-2021, los estudios se llevaron a cabo mediante el equipo de ecografía portátil Toshiba Xario-200 con posibilidad de Doppler espectral y Doppler color y obtención de medidas indexadas de cavidades cardiacas, que permitía una evaluación cardiaca completa y una posterior digitalización y transmisión en red al repositorio de imagen médica de la unidad de imagen cardiaca (EchoPAC Software, GE Healthcare, España) del centro, donde podían revisar y almacenar.
El criterio para la ecocardioscopia fue el ingreso hospitalario por un ictus isquémico o AIT de etiología no conocida en el momento del ingreso o sospecha de etiología cardioembólica. Se excluyeron los casos de etiología del ictus conocida al ingreso: ictus aterotrombótico por ateromatosis carotídea grave u oclusión homolateral a la lesión isquémica, ictus lacunar e ictus cardioembólico por estenosis mitral moderada-grave conocida o por FA previa conocida sin anticoagulantes o en dosis infraterapéuticas (paroxística o permanente)10. También se excluyeron los casos de pacientes con prótesis valvulares mecánicas o biológicas, ya que a estos se les indicaba una ecocardiografía reglada directamente, los casos de demencia grave y gran dependencia a raíz del ictus, definida como escala de Rankin modificada ≥ 511, y los pacientes con infartos cerebrales malignos en situación de cuidados paliativos12.
Los 100 estudios ecocardioscópicos iniciales los revisaron cardiólogos de la unidad de imagen, y obtuvieron una elevada concordancia entre ambos especialistas para el cribado de cardiopatía estructural (CE) y embolígena. Posteriormente, todos los estudios en los que el neurólogo detectó una potencial cardiopatía estructural o embolígena se revisaron en la unidad de imagen cardiaca.
El diagnóstico final CE se consideró por la presencia de cualquiera de los indicados en la tabla 113–16.
Diagnóstico final de cardiopatía estructural13–16
| HVI moderada-grave | En mujeres: SIV ≥ 13 mmEn varones: SIV ≥ 14 mm |
| Septo interauricular aneurismático | Excursión máxima del tabique interauricular> 10 mm o una excursión total combinada derecha-izquierda ≥ 15 mm |
| FOP de alto riesgo embólico | FOP con shunt derecha-izquierda: aparición de flujo espontáneo o paso de microburbujas hacia la AI en los primeros 3 latidos tras el relleno de contraste de la aurícula derechaGran tamaño del FOP (≥ 2 mm)Presencia de otras características:• SIA y septo hipermóvil• Shunt moderado-grave (≥ 30 burbujas/3 latidos)• Válvula de Eustaquio prominente• Red de Chiari |
| Alteraciones segmentarias de la contractilidad del ventrículo izquierdo | Acinesia o discinesia de más un segmento |
| AI dilatada | Volumen indexado de la AI> 41 ml/m2 |
| Valvulopatía izquierda significativa | Insuficiencia o estenosis aórtica de grado moderado o graveInsuficiencia o estenosis mitral de grado moderado o grave |
| FEVI reducida | Mujeres: FEVI <54% (medida por Simpson)Varones: FEVI <53% (medida por Simpson) |
| Endocarditis infecciosa sobre válvula nativa | Presencia de vegetaciónAbsceso o fístula cardiaca |
| Trombo intracavitario | AuricularVentricular |
| Tumor cardiaco | Fibroelastoma papilarMixoma |
| Dilatación de la raíz aórtica | En cualquiera de las siguientes regiones anatómicas:• Anillo aórtico: ≥ 13±1 mm/m2• Senos de Valsalva: ≥ 19±1 mm/m2• Unión sinotubular: ≥ 15±1 mm/m2• Aorta ascendente tubular: ≥ 15±1 mm/m2 |
AI: aurícula izquierda; DE: desviación estándar; FEVI: fracción de eyección del ventrículo izquierdo; FOP: foramen oval permeable; HVI: hipertrofia ventricular izquierda; SIA: septo interauricular aneurismático; SIV: septo interventricular; VI: ventrículo izquierdo.
Se consideraron cardiopatías embolígenas las cardiopatías estructurales que condicionaron un cambio en el tratamiento clínico y terapéutico para la prevención secundaria de nuevas embolias cerebrales: a) FOP de alto riesgo embólico; b) alteraciones segmentarias de la contractilidad del ventrículo izquierdo; c) aurícula izquierda con dilatación moderada-grave; d) endocarditis infecciosa; e) trombo intracavitario; f) disfunción del ventrículo izquierdo con fracción de eyección del ventrículo izquierdo <35%; g) tumor cardiaco, y h) valvulopatía izquierda en caso de estenosis mitral o aórtica moderada-grave13–15,17-23.
Se registraron hasta 2 tipos de CE y embolígena diferentes por cada paciente.
Se indicó ETT reglado en los siguientes casos: a) estudio de valvulopatía izquierda significativa; b) imagen indicativa de trombo intracavitario; c) valoración de las alteraciones segmentarias de la contractilidad evaluadas incorrectamente por ecocardioscopia a criterio del cardiólogo de la unidad de imagen, y d) imágenes potencialmente embolígenas que apuntaran a vegetaciones o tumoraciones cardiacas.
Se indicó ecocardiografía transesofágica (ETE) en los siguientes casos: a) estudio de FOP en pacientes menores de 60 años con ictus de origen indeterminado, y b) imágenes potencialmente embolígenas que indicaran vegetaciones, tumoraciones cardiacas o sospecha de trombo auricular 16,24,25.
En el estudio transesofágico de FOP, se utilizó ecocontraste con solución agitada de 10 ml de un expansor de volumen con gelatina succinilada (Gelaspan)24.
Se estudió con monitorización Holter-ECG de 24 h a todos los pacientes con ictus indeterminado y de 30 días en los casos de ictus de causa indeterminada con alta sospecha de cardioembolia para la detección de FA paroxística, como en los casos de dilatación moderada o grave de la aurícula izquierda15,26 detectada por ecocardioscopia y revisada en unidad de imagen cardiaca.
Concluido el estudio etiológico, se clasificó la etiología del ictus isquémico y del AIT utilizando los criterios TOAST3 en cardioembólico, aterotrombótico, lacunar, indeterminado e ictus de causa inhabitual. Se utilizó la National Institutes of Health stroke scale (NIHSS) que puntúa de forma numérica la gravedad del ictus: leve, <4; moderada, <16; grave, <25, y muy grave, ≥ 25 puntos27,28. A los 3 meses se utilizó la escala Rankin modificada para evaluar la capacidad funcional tras un ictus, que puntúa en los siguientes grados: 0, asintomático; 1, discapacidad muy leve; 2, discapacidad leve; 3, discapacidad moderada; 4, discapacidad moderadamente grave; 5, discapacidad grave, y 6, muerte11.
Se analizó por ecocardioscopia el ritmo cardiaco de los pacientes evaluados: ritmo sinusal, ritmo en FA y ritmo de marcapasos. El ritmo cardiaco por sí solo no se consideró CE.
Tras conocer la información aportada por los estudios de imagen, se llevaron a cabo las siguientes medidas en el tratamiento clínico y terapéutico: a) si había confirmación de FOP de alto riesgo embólico, se indicó cierre percutáneo en los casos de edad inferior a 60 años e ictus isquémico o AIT tras la exclusión de cualquier otra causa por estudio etiológico completo24; b) si había hallazgo de aurícula izquierda con dilatación moderada o grave en ritmo sinusal, se indicó Holter-ECG de 30 días para la búsqueda de FA paroxística15,26; c) si había hallazgo de endocarditis infecciosa, se indicó terapia antibiótica y cirugía en los casos seleccionados29; d) si había hallazgo de trombo intracavitario, se instauró tratamiento anticoagulante con heparina sódica no fraccionada hasta su resolución; e) en caso de disfunción del ventrículo izquierdo con FEVI <35%, alteraciones segmentarias de la contractilidad con acinesia o discinesia o estenosis mitral moderada-grave, se indicó inicio de anticoagulación con antagonista de la vitamina K en prevención secundaria23 y f) si había un tumor cardiaco, se indicó cirugía resectiva30.
Se evaluaron los siguientes ECV desde el alta hospitalaria durante el primer año de seguimiento: a) nuevo ictus isquémico o AIT; b) aparición de un infarto agudo de miocardio; c) ingreso en urgencias por episodio de insuficiencia cardiaca con o sin necesidad de ingreso hospitalario, y d) diagnóstico de FA de novo.
Para analizar las diferencias entre los ECV identificados en el seguimiento de los pacientes en función de si había CE o no, se tuvieron en cuenta los casos en que el diagnóstico fue de CE de novo.
El equipo investigador aseguró el cumplimiento de las normas de Buena Práctica Clínica, la Declaración de Helsinki y la normativa de protección de datos y de tratamiento de la historia clínica. El estudio fue aprobado por el Comité de Ética del Hospital Clínico Universitario de Santiago de Compostela con el código de registro 2022/162.
Al tratarse de un estudio con datos de salud, se aseguró el cumplimiento de lo establecido en la Disposición adicional 17.a de la Ley orgánica 3/2018, del 5 de diciembre, de protección de datos personales y garantía de los derechos digitales. Se siguió el procedimiento de uso de datos seudoanonimizados en investigación. Dado que no se obtuvo el consentimiento expreso de los pacientes, se garantizó la separación técnica y funcional entre el equipo investigador y quienes realizaron la seudoanonimización y la conservación de la información.
Los datos se recogieron a partir de los registros asistenciales BICHUS y UNIDAD DE ICTUS (REDCAP), que recopilan la información clínica de los pacientes atendidos en la unidad de ictus del centro, y se completó con la información aportada por las pruebas de ecocardioscopia, ETT y ETE.
Se realizó un análisis estadístico con el programa SPSS versión 28 (SPSS Inc, Estados Unidos) y con el programa R, versión 4.1.0. Se evaluó el estadístico kappa para medir la concordancia de los hallazgos obtenidos en el programa de ecocardioscopia realizada por neurólogos de los primeros 100 estudios frente a los obtenidos mediante ecocardiograma reglado llevado a cabo por cardiólogos especialistas en imagen cardiaca. En este contexto, la probabilidad de acuerdo aleatorio es de 0,5.
Para las variables continuas se utilizaron la media±desviación estándar, los percentiles 25 y 75 y los valores mínimo y máximo tras eliminar los valores anómalos. Se comprobaron las diferencias entre los pacientes con o sin CE mediante un test de Wilcoxon para las variables continuas. Para las variables categóricas se utilizaron las frecuencias absoluta y relativa. Las diferencias entre los 2 grupos se evaluaron mediante el test de Fisher. Se realizó un análisis de regresión de Cox para analizar las variables que se asociaron de manera independiente con la aparición de ECV. Las hazard ratio (HR) se ajustaron por las variables que obtuvieron p <0,4 en el análisis bivariado. Los resultados se expresaron como HR ajustadas con el intervalo de confianza del 95% (IC95%). Se utilizó un modelo de Kaplan-Meier para calcular el tiempo libre de enfermedad hasta la ocurrencia de un ECV hasta la finalización del seguimiento. Todos los valores de p <0,05 se consideraron significativos en todos los test.
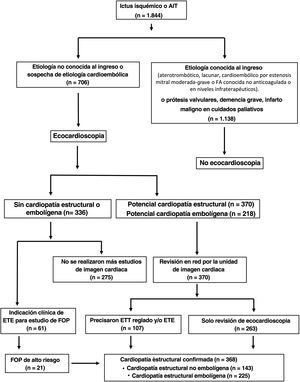
RESULTADOSDurante el periodo comprendido entre 2017 y 2021, ingresaron 1.844 pacientes con ictus isquémico o AIT y se realizó ecocardioscopia al 38,3% (n=706); 33 habían sufrido un AIT y 673, un ictus isquémico. Se excluyó al 61,7% (n=1.138) por presentar algún criterio de exclusión.
Se realizó un test de concordancia en los primeros 100 estudios de ecocardioscopia para cribado de CE o embolígena. La proporción de concordancia observada entre los 2 grupos resultó de 0,98. El coeficiente kappa toma el valor de (0,98-0,5) / (1-0,5)=0,48 × 2=0,96.
De los 706 pacientes evaluados por ecocardioscopia, se detectó una potencial CE o potencial cardiopatía embolígena en el 52,4% (n=370) y el 30,8% (n=218) respectivamente. En los casos sin cardiopatía detectada pero con indicación clínica de estudio de FOP, se indicó ETE (n=61).
Los estudios con hallazgos de cardiopatía se revisaron en la unidad de imagen cardiaca. En 263 pacientes solo se revisó la ecocardioscopia por considerarla concluyente; al resto se le indicó ETT reglado o ETE. Tras la revisión de la ecocardioscopia, el estudio de ETT reglado y ETE, se confirmó CE en el 52,1% (n=368); de estos, se detectó CE embolígena en el 31,9% (n=225) y CE no embolígena en el 20,3% (n=143) (figura 1).
Representación esquemática de los criterios de inclusión y exclusión y del flujo de trabajo con la estrategia de ecocardioscopia integrada en red con una unidad de imagen cardiaca en los pacientes que ingresaron por ictus isquémico o AIT en la unidad de ictus. AIT: accidente isquémico transitorio; FA: fibrilación auricular; ETE: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica.
Se realizó ETE a 120 pacientes (16,9%) y ETT reglado a 68 (9,6%); 20 pacientes precisaron ambos estudios.
En la tabla 2, teniendo en cuenta que se registraron hasta 2 tipos de cardiopatías por cada paciente, se recogen el número y el tipo de cardiopatías detectadas por ecocardioscopia, las confirmadas tras la evaluación en la unidad de imagen y las evaluadas por ETT o ETE reglado.
Tipos de cardiopatías detectadas en la ecocardioscopia y tipos de cardiopatías confirmadas tras evaluación en unidad de imagen cardiaca. Frecuencia de cardiopatías de cada categoría y las evaluadas por ETT reglado y ETE
| Hallazgos potenciales en ecocardioscopia | Evaluación en unidad de imagen cardiaca | ||||
|---|---|---|---|---|---|
| Tipo de cardiopatía detectada | N | Evaluación ETT reglado | Evaluación ETE | Tipo de cardiopatía confirmada | N |
| HVI moderada-grave | 152 | 5 | 1 | HVI moderada-grave | 152 |
| AI dilatada moderada o grave | 85 | 10 | 3 | AI dilatada moderada o grave | 85 |
| Alteraciones segmentarias de la contractilidad | 63 | 13 | 1 | Alteraciones segmentarias de la contractilidad | 63 |
| Septo interauricular aneurismático | 42 | 1 | 30 | FOP de alto riesgo embólico con SIA | 19 |
| Estenosis aórtica significativa | 12 | 12 | 0 | Estenosis aórtica moderada-grave | 12 |
| Insuficiencia aórtica significativa | 12 | 8 | 1 | Insuficiencia aórtica moderada-grave | 8 |
| Estenosis mitral significativa | 5 | 5 | 2 | Estenosis mitral moderada-grave | 5 |
| Insuficiencia mitral significativa | 10 | 10 | 3 | Insuficiencia mitral moderada-grave | 10 |
| Imagen valvular potencialmente embolígena pendiente de caracterizar | 21 | 11 | 18 | Endocarditis infecciosa | 9 |
| Fibroelastoma | 2 | ||||
| Nódulos de calcio, excrecencias de Lambl o artefactos | 10 | ||||
| FEVI reducida | 29 | 10 | 0 | FEVI reducida | 29 |
| Imagen que indica trombo intracavitario | 14 | 7 | 3 | Trombo intracavitario | 9 |
| Artefactos | 5 | ||||
| Dilatación raíz aórtica | 11 | 3 | 0 | Dilatación de la raíz aórtica | 11 |
| Miocardiopatía dilatada con FEVI <35% | 10 | 3 | 0 | Miocardiopatía dilatada con FEVI <35% | 10 |
| Imagen que indica mixoma | 2 | 2 | 2 | Mixoma | 2 |
| Sin cardiopatía estructural | 336 | 0 | 61* | FOP de alto riesgo embólico | 21 |
AI: aurícula izquierda; ETE: ecocardiograma transesofágico; ETT: ecocardiograma transtorácico; FEVI: fracción de eyección del ventrículo izquierdo; FOP: foramen oval permeable; HVI: hipertrofia ventricular izquierda; SIA: septo interauricular aneurismático; VI: ventrículo izquierdo.
Número de cardiopatías no estructurales evaluadas por ETE por indicación clínica: ictus isquémico o accidente isquémico transitorio de origen indeterminado tras estudio etiológico completo en menores de 60 años.
En la tabla 3 se observan las características de los pacientes después del estudio etiológico y las diferencias entre los pacientes con y sin CE.
Características de los pacientes con ictus o AIT evaluados con ecocardioscopia tras estudio etiológico, según la presencia de cardiopatía estructural
| Características | Total (n=706) | CE(n=368) | No CE(n=338) | p |
|---|---|---|---|---|
| Edad (años) | 66,8±13,2 | 69,1±13,2 | 64,3±12,8 | <0,001 |
| Varones | 430 (60,9) | 226 (61,4) | 204 (60,4) | 0,774 |
| Etiología del ictus | ||||
| Cardioembólico | 182 (25,8) | 156 (42,4) | 26 (7,7) | <0,001 |
| Aterotrombótico | 68 (9,6) | 23 (6,25) | 45 (13,3) | 0,002 |
| Indeterminado | 323 (45,8) | 136 (36,9) | 187 (55,3) | <,001 |
| Lacunar | 114 (16,1) | 46 (12,5) | 68 (20,1) | 0,008 |
| Causa inhabitual | 19 (2,7) | 7 (1,9) | 12 (3,6) | 0,244 |
| Ritmo cardiaco | ||||
| FA | 114 (16,1) | 91 (24,7) | 23 (6,8) | <0,001 |
| Sinusal | 585 (82,9) | 271 (73,6) | 314 (92,9) | <0,001 |
| Marcapasos | 6 (0,8) | 5 (1,4) | 1 (0,3) | 0,219 |
| NIHSS al ingreso | 4,50±2,0 | 5,40±6,07 | 3,52±4,71 | <0,001 |
| ERm a los 3 meses ≥ 2 | 410 (58,1) | 225 (61,1) | 185 (54,7) | 0,093 |
CE: cardiopatía estructural; ERm: escala de Rankin modificada; FA: fibrilación auricular; NIHSS: National Institutes of Health Stroke Scale.
Los valores expresan n (%).
En el 81,3% de los casos con CE fue un diagnóstico de novo (n=299), ya que la cardiopatía no era conocida.
Se analizaron los ECV desde el alta hospitalaria hasta el primer año de seguimiento en los pacientes con diagnóstico de CE de novo frente a los pacientes sin CE. El total de ECV registrados fue de 35. En la tabla 4 se muestra la frecuencia de los diferentes eventos y según la presencia de CE de novo. Los ECV fueron más frecuentes en los pacientes con CE de novo que en los pacientes sin CE (el 8,36 frente al 2,96%; p=0,003).
Eventos cardiovasculares totales y tipos de eventos cardiovasculares detectados en los pacientes dados de alta con ictus isquémico o AIT estudiados con ecocardioscopia, según tuvieran cardiopatía estructural de novo o no tuvieran cardiopatía estructural
| Variable | Total (n=637) | CE de novo (n=299) | Sin CE (n=338) | p |
|---|---|---|---|---|
| Eventos cardiovasculares totales | 35 (5,49) | 25 (8,36) | 10 (2,96) | 0,003 |
| Ictus isquémico | 16 (2,51) | 10 (3,68) | 5 (1,48) | 0,127 |
| Infarto agudo de miocardio | 3 (0,47) | 3 (1,00) | 0 | 0,103 |
| Insuficiencia cardiaca | 9 (1,41) | 6 (2,01) | 3 (0,89) | 0,318 |
| FA de novo | 7 (1,10) | 5 (1,67) | 2 (0,59) | 0,262 |
AIT: accidente isquémico transitorio; CE: cardiopatía estructural; FA: fibrilación auricular.
Los valores expresan n (%).
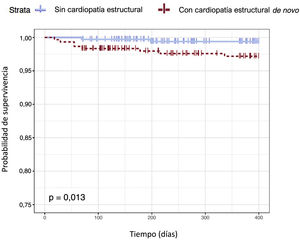
En el modelo de regresión de Cox se observa que la presencia de CE de novo se asocia de manera independiente con la ocurrencia de ECV (HR=1,72; IC95%, 1,01-2,91; p=0,046). La edad también se asocia con ECV (HR=1,03; IC95%, 1,01-1,05) y el pronóstico funcional a los 3 meses, medido con la escala de Rankin modificada, muestra asociación inversa (HR=0,46; IC95%, 0,27-0,77) (tabla 5). En la figura 2 se representan las 2 curvas de supervivencia o periodo libre de enfermedad hasta el ECV en pacientes con y sin CE de novo calculadas mediante el estimador de Kaplan-Meier. Existen evidencias significativas de que se produce una reducción de la probabilidad de supervivencia frente a ECV en pacientes con CE de novo (p=0,013).
Resultados del modelo de regresión de Cox para factores asociados con la aparición de eventos cardiovasculares en el seguimiento
| Variable | Regresión de Cox univariante | |
|---|---|---|
| HR (IC95%) | p | |
| CE de novo | 1,89 (1,13-3,19) | 0,016 |
| Edad | 1,03 (1,01-1,05) | 0,006 |
| Sexo | 1,23 (0,71-2,03) | 0,492 |
| FA | 1,33 (0,73-2,40) | 0,353 |
| NIHSS al ingreso | 0,99 (0,94-1,04) | 0,602 |
| ERm a los 3 meses | 0,53 (0,32-0,90) | 0,017 |
| Regresión de Cox multivariante | ||
| CE | 1,72 (1,01-2,91) | 0,046 |
| Edad | 1,03 (1,01-1,05) | 0,006 |
| ERm a los 3 meses | 0,46 (0,27-0,77) | 0,003 |
CE: cardiopatía estructural; ERm: escala de Rankin modificada; FA: fibrilación auricular; HR: hazard ratio; IC95%: intervalo de confianza del 95%; NIHSS: National Institutes of Health Stroke Scale.
Los resultados de este estudio muestran que la ecocardioscopia realizada por personal sanitario cualificado, en este caso neurólogos, e integrado en red con una unidad de imagen cardiaca en el proceso de atención al ictus es una técnica útil que permite identificar a un elevado número de pacientes con CE no conocida que presentan un peor pronóstico con alta incidencia de ECV durante el primer año de seguimiento, lo que posibilita establecer estrategias de prevención adecuadas. Además, en combinación con el estudio de ETT reglado y ETE permite detectar un elevado porcentaje de cardiopatía embolígena, que condiciona un tratamiento clínico-terapéutico específico para, entre otros objetivos, evitar nuevas embolias cerebrales (figura 3).
En nuestro conocimiento, es la primera vez que se describen los resultados de un programa de ecocardioscopia llevada a cabo por neurólogos en pacientes hospitalizados por ictus isquémico o AIT e integrada en red con una unidad de imagen cardiaca. La digitalización y el almacenamiento centralizado de imagen médica permite que se pueda analizar de inmediato y en conjunto con el especialista de imagen cardiaca, con lo cual se ahorra el ecocardiograma reglado en más del 90% de los pacientes y se puede aliviar la demanda asistencial de estas unidades. Por otra parte, los conocimientos del neurólogo específicamente formado permiten la correcta interpretación de la probabilidad pretest y de la etiología de los hallazgos. Esta integración del binomio neurólogo y cardiólogo facilita el proceso de toma de decisiones.
Otros estudios que analizaron la factibilidad y la precisión diagnóstica de esta técnica en manos de no cardiólogos frente al ecocardiograma reglado también obtuvieron resultados excelentes31–34.
En nuestro estudio se evaluó al 38,3% de los pacientes que habían sufrido un ictus isquémico o AIT por una causa desconocida o por sospecha de etiología cardioembólica. Según los datos obtenidos por una revisión sistemática que analiza la realización de ETT en pacientes que sufren un ictus o un AIT, se ha demostrado que es coste-efectivo solo cuando los facultativos lo consideran adecuado35, y las guías de práctica clínica, en esta misma línea, recomiendan el ETT o el ETE para pacientes con causa del ictus o el AIT no identificada y sospecha de etiología cardioembólica7.
En nuestro trabajo, el cribado de CE mediante ecocardioscopia sistemática para pacientes con ictus isquémico o AIT de etiología indeterminada al ingreso o con sospecha de etiología cardioembólica detecta hallazgos en el 52% de los estudios.
Con base en la detección de CE, que incluye la cardiopatía embolígena, se han puesto en marcha medidas de prevención de nuevas embolias cerebrales que podrían condicionar la ausencia de diferencias en la incidencia de ictus isquémico en pacientes con y sin CE.
Además, los hallazgos diferentes de cardiopatía embolígena también se beneficiarían de estrategias de prevención de ECV, como en caso de hipertrofia ventricular izquierda moderada-grave36, valvulopatías izquierdas como la insuficiencia aórtica o mitral moderada-grave37 o la detección de dilatación de aorta torácica38.
Nuestro estudio es uno de los de mayor valor muestral realizados hasta el momento en este campo, y analiza la incidencia no solo de cardiopatía embolígena con implicaciones directas en el tratamiento en prevención secundaria del ictus, sino las derivadas de presencia de CE al año de seguimiento. La CE supone un mayor riesgo de ECV a largo plazo, principalmente insuficiencia cardiaca congestiva.
LimitacionesLa principal limitación del estudio es que no se ha analizado el impacto en términos de necesidad y eficiencia de la introducción de esta técnica en la práctica clínica habitual.
Por otra parte, no se ha realizado ecocardioscopia a todos los pacientes con ictus isquémico o AIT de etiología conocida al ingreso, lo que podría constituir un sesgo de selección y subestimar el hallazgo de cardiopatías en el conjunto de pacientes con enfermedad cerebrovascular.
En este estudio no se han evaluado los factores de riesgo de los pacientes ni otros datos de la historia clínica, como el tratamiento recibido en el momento del ictus isquémico (fibrinolisis intravenosa o trombectomía mecánica) o el tratamiento antitrombótico pautado al alta. Otra limitación es que se trata de un estudio realizado en un único centro.
CONCLUSIONESLa ecocardioscopia realizada e interpretada por facultativos acreditados y formados, en este caso neurólogos, dentro de un proceso integrado en red con unidades de imagen cardiaca es una técnica accesible y de alta rentabilidad diagnóstica. Su uso permite actuaciones clínicas y terapéuticas en la prevención de nuevas embolias cerebrales y otros ECV en pacientes con ictus.
FINANCIACIÓNNo se recibió financiación para la preparación de este manuscrito.
CONTRIBUCIÓN DE LOS AUTORESI. López-Dequidt, primera autora: diseño, inclusión de pacientes y redacción del artículo. A. Martínez-Monzonis: diseño y redacción del artículo. C. Peña-Gil: diseño y redacción del artículo. A. González-Maestro: análisis estadístico. V. González-Salvado: redacción del artículo. M. Santamaría-Cadavid: inclusión de pacientes y redacción del artículo. S. Arias-Rivas: inclusión de pacientes y redacción del artículo. J.M. Prieto-González: coordinación y redacción del artículo. J.R. González-Juanatey, autor para correspondencia: coordinación, diseño del artículo y redacción del artículo.
CONFLICTO DE INTERESESNinguno.
- –
En el estudio etiológico del ictus isquémico, se recomienda la realización sistemática de ETT. Recientemente se ha introducido un programa de formación en ecocardioscopia específica para neurólogos.
- –
Se analiza por primera vez la utilidad de esta técnica para hallar cardiopatías en unidades de ictus en coordinación con unidades de imagen cardiaca.
- –
Los resultados muestran una alta detección de cardiopatía estructural, que conlleva peor pronóstico a largo plazo por aumento de ECV, y de cardiopatía embolígena, que precisan estrategias de prevención adecuadas.