Los xantomas tendinosos (XT) son acumulaciones lipídicas muy específicas de la hipercolesterolemia familiar (HF), pero con una alta variabilidad en su presentación, en su mayoría debido a causas desconocidas. La lipoproteína(a) es un factor de riesgo independiente de enfermedad cardiovascular aterosclerótica en la población general, pero también en la HF. Dado que la concentración de lipoproteína(a) es variable en la HF, y los XT podrían resultar de un proceso proaterogénico y proinflamatorio, este estudio buscó analizar el tamaño de los XT en los tendones de Aquiles de pacientes con HF y las variables asociadas, incluyendo la concentración de lipoproteína(a).
MétodosRealizamos un estudio transversal en 377 pacientes con diagnóstico molecular de HF heterocigota. Se recopiló el grosor máximo del tendón de Aquiles (GMTA) mediante ecografía usando equipos y procedimientos estandarizados, además de variables demográficas y lipídicas. Utilizamos una regresión lineal multivariante log-gaussiana para predecir el tamaño de los XT, incluyendo factores de riesgo cardiovascular clásicos y lipoproteína(a).
ResultadosEl promedio de colesterol de lipoproteínas de baja densidad fue de 277mg/dL sin tratamiento hipolipemiante, y la mediana de GMTA de 5,50mm. Encontramos que edad, sexo, colesterol de lipoproteínas de baja densidad y lipoproteína(a) estaban asociados de manera independiente al GMTA. Sin embargo, estas cuatro variables explicaron solo parte de la variabilidad (R2=0,205).
ConclusionesLos XT, una característica distintiva de la HF, son altamente heterogéneos en su manifestación. La variabilidad interindividual puede explicarse parcialmente por edad, sexo, colesterol de lipoproteínas de baja densidad y lipoproteína(a), aunque representando únicamente 20% de esta heterogeneidad.
Palabras clave
La hipercolesterolemia familiar (HF) es un trastorno genético con un patrón de transmisión hereditaria autosómico dominante que afecta al metabolismo de las lipoproteínas y se caracteriza por unas concentraciones muy altas de colesterol unido a lipoproteínas de baja densidad (cLDL), un aumento del riesgo de enfermedad coronaria (EC) prematura y depósitos de colesterol superficiales en tejidos extravasculares, como los xantomas tendinosos (XT)1.
Los XT son muy específicos de la HF en los pacientes con el cLDL elevado, por lo que constituyen un criterio diagnóstico importante en las guías actuales2,3. Los XT detectados por clínica se dan habitualmente en un tercio de los pacientes con HF heterocigótica (HFHe) a partir de la segunda década de la vida, y aumentan con la edad4. El tendón de Aquiles es la localización más frecuente de aparición de los XT, y la ecografía del tendón de Aquiles aumenta la detección de XT a hasta un 75% de los pacientes con HFHe en la edad adulta5. En la ecografía, los XT aparecen en forma de uno o varios nódulos focales o como un engrosamiento anteroposterior de los tendones. Sin embargo, es probable que haya un sesgo en la estimación de la prevalencia de los XT en la HFHe, debido a su gran importancia para el diagnóstico clínico de la HF.
Las placas ateroescleróticas y los xantomas tienen muchas características en común. Ambos están formados por colágeno y células espumosas. Estas últimas proceden de macrófagos como resultado de un aumento de la captación de partículas de LDL oxidadas. La composición lipídica de los XT consiste en un 55% de colesterol libre, un 28% de ésteres de colesterol y un 13% de fosfolípidos, lo cual se asemeja mucho a la composición de las estrías grasas y de las lesiones ateromatosas avanzadas de las arterias6,7. Estas semejanzas sugieren la existencia de mecanismos patogénicos relacionados en los XT y la enfermedad coronaria ateroesclerótica. De hecho, es posible que los XT se asocien con un riesgo más de 3 veces superior de EC prematura en los pacientes con HFHe4,8–10. Sin embargo, esta asociación se atenúa o desaparece cuando se aplica un ajuste por los factores de riesgo cardiovascular como el cLDL11,12.
Otra similitud de interés entre los XT y la enfermedad cardiovascular ateroesclerótica es la variación interindividual por lo que respecta a su presencia. Hay factores de riesgo cardiovascular comunes, así como factores específicos de la HF, como el tipo de mutación que la causa, que se asocian con el riesgo de EC en la HFHe y explican en parte las diferencias de EC entre distintos pacientes con HFHe12. No obstante, los factores de riesgo tradicionales y los defectos idénticos en el gen LDLR no explican bien la variabilidad observada en los XT. Esto indica que otros factores aún no identificados controlan la aparición de XT2, y es posible que identificarlos permita caracterizar mejor el riesgo de EC en esta población.
La lipoproteína(a) [Lp(a)] es un bien conocido factor independiente del riesgo de enfermedad cardiovascular ateroesclerótica en la población general y también en los pacientes con HFHe13. Los pacientes con HFHe con altas concentraciones de Lp(a) (> 50mg/dl) tienen mayor riesgo cardiovascular en comparación con los que presentan concentraciones de Lp(a) bajas y la misma mutación nula14. Dado que la Lp(a) muestra amplias diferencias entre los distintos pacientes con HFHe15 y los XT probablemente sean consecuencia de un estado proaterogénico y proinflamatorio16, se planteó la hipótesis de que la alta concentración de Lp(a) sea de especial importancia en presencia de XT.
El objetivo de este estudio es analizar la presencia y el tamaño de los XT en los tendones de Aquiles de pacientes con un diagnóstico genético de HFHe y las variables asociadas con su aparición, incluida la concentración de Lp(a). Se tomó el grosor máximo del tendón de Aquiles (GMTA) como una variable continua, de manera similar al enfoque utilizado para la ateroesclerosis, y se consideró que los pacientes con XT clínicos tenían una mayor probabilidad de estar en la parte alta del espectro de la distribución.
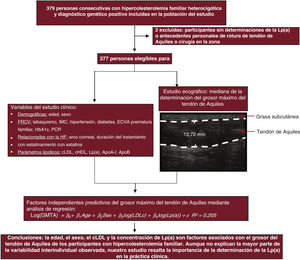
MÉTODOSSe llevó a cabo un estudio transversal de participantes con un diagnóstico molecular de HFHe bien definido, en los que se analizó la posible asociación de las características clínicas y bioquímicas con los XT del tendón de Aquiles.
Se seleccionó a pacientes consecutivos con HFHe y diagnóstico genético positivo de la unidad de lípidos del Hospital Miguel Servet. Se excluyó a los participantes de quienes no se disponía de determinaciones de la Lp(a) y a los que tenían antecedentes personales de rotura del tendón de Aquiles o intervenciones quirúrgicas en la zona. En total, solamente se excluyó a 2 pacientes. Por consiguiente, un total de 377 participantes completaron el protocolo del estudio y fueron incluidos en el análisis.
Mediciones de los xantomas tendinososSe midió el GMTA en los tendones de Aquiles mediante ecografía de alta resolución con un equipo y unos procedimientos operativos estandarizados, según lo descrito con anterioridad17.
Parámetros clínicos y analíticosSe extrajeron muestras de sangre tras 10 h en ayunas y tras la suspensión de todo tratamiento hipolipemiante durante un mínimo de 5 semanas, excepto en los participantes con antecedentes personales de enfermedad cardiovascular o un riesgo muy alto de ECV. En estos últimos, se registraron valores lipídicos previos sin uso de medicación hipolipemiante si se disponía de ellos o se ajustaron los valores lipídicos en función del tratamiento con estatinas18. Ninguno de los pacientes había estado en tratamiento con inhibidores del PCSK9 en el momento en que se realizó la ecografía del tendón de Aquiles o la extracción de la muestra de sangre, ya que los inhibidores del PCSK9 podrían reducir las concentraciones de Lp(a). Todas las determinaciones bioquímicas se llevaron a cabo en un laboratorio central, según lo descrito con anterioridad19. La concentración de Lp(a) se determinó en muestras de plasma fresco mediante nefelometría, utilizando el reactivo LPAX junto con el IMMAGE Immunochemistry System, siguiendo las instrucciones del fabricante. Se utilizaron 4 muestras diarias de control de calidad, con un coeficiente de variación <12% en todos los casos. A los resultados de Lp(a) situados por debajo del umbral de detección se les imputó un valor de 0,5mg/dl, que corresponde a la mitad de ese umbral.
El Biobanco del Sistema de Salud de Aragón (PT17/0015/0039) proporcionó las muestras de los participantes incluidos en este estudio, con la aprobación de los comités de ética y científico.
Se estudiaron los genes LDLR (NM_000527.4), APOB (NM_000384.2) y PCSK9 (NM_174936.3) de todos los participantes con sospecha clínica de HF, mediante las plataformas LIPOchip® (Progenika Biopharma-Grifols, España)20 o LIPID inCode® (GENinCode, España)21. Estas plataformas incluyen mutaciones puntuales, reordenaciones grandes y variaciones en el número de copias. Tan solo se incluyó a los participantes con mutaciones patógenas o probablemente patógenas de los genes canónicos de la HF. La patogenicidad de las variantes genéticas se determinó según lo establecido en la guía del American College of Medical Genetics and Genomics22.
Los datos se analizaron con el programa informático R Studio, versión 2022.07.2+576. Se realizó un análisis descriptivo de las variables cuantitativas de distribución normal, y los resultados se presentan en forma de media ± desviación estándar. Para las variables cuantitativas con distribución no paramétrica (Lp(a), triglicéridos, proteína C reactiva, diámetro máximo de los XT), los datos se presentan mediante la mediana [intervalo intercuartílico]. Para las variables cualitativas se estimó el número total de casos y el porcentaje y las comparaciones se hicieron mediante la prueba de la χ2 de Pearson; las comparaciones de medias se llevaron a cabo con la prueba de la t de Student y las de medianas, con la de la U de Mann-Whitney no paramétrica. Se consideró estadísticamente significativo un valor de p ≤ 0,05. Se utilizaron gráficos emparejados para explorar las posibles asociaciones entre las variables de interés. Para la predicción independiente del GMTA a partir de las variables demográficas y lipídicas (tabla 1), se utilizó una regresión lineal con un modelo log-gaussiano.
Características del grupo de hipercolesterolemia familiar
| Participantes, n | 377 |
|---|---|
| Media de edad (años) | 43,3±14,1 |
| Mujeres | 200 (53,1) |
| Han fumado en algún momento | 187 (49,6) |
| Tabaquismo de los pacientes que han fumado en algún momento (paquetes-años) | 20,1±18,1 |
| Índice de masa corporal | 25,3±4,36 |
| Arco corneal | 138 (36,6) |
| Presión arterial sistólica (mmHg) | 128±17,1 |
| Presión arterial diastólica (mmHg) | 76,8±10,3 |
| Diabetes mellitus | 11 (2,9) |
| Hipertensión | 48 (12,7) |
| ECVA | 35 (9,3) |
| Edad de la ECVA (años) | 48±10,7 |
| ECVA prematura familiar | 138 (36,6) |
| Duración del tratamiento con estatinas (años) | 6,14±2,08 |
| Colesterol total (mg/dl) | 357±68,4 |
| Triglicéridos (mg/dl), mediana | 97 [69,2-154] |
| cLDL (mg/dl) | 277±66,9 |
| cHDL (mg/dl) | 53,2±14,7 |
| Lipoproteína(a) (mg/dl), mediana | 25,4 [9,6-59,6] |
| Apolipoproteína A-I (mg/dl) | 145±30,7 |
| Apolipoproteína B (mg/dl) | 179±42,0 |
| Proteína C reactiva (mg/l), mediana | 1,50 [0,60-3,10] |
| HbA1c (%) | 5,35±0,47 |
| Grosor máximo del tendón de Aquiles (mm) | 5,50 [4,92-6,54] |
ECVA: enfermedad cardiovascular ateroesclerótica; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; HbA1c: glucohemoglobina.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Formaron el grupo de estudio 377 participantes con HFHe que presentaban variantes patógenas (n=312, 82,8%) o probablemente patógenas (n=65, 17,2%) en los genes LDLR (n=338, 89,8%), APOB (n=15, 4,0%) y PCSK9 (n=4, 1,1%) o una mutación p.Leu167del en el gen APOE (n=20, 5,3%). Las características clínicas y bioquímicas principales se presentan en la tabla 1. La media de edad de los participantes fue 43,3 años, con un ligero predominio de las mujeres respecto a los varones (el 53,1 frente al 46,9%). Las prevalencias de enfermedad cardiovascular ateroesclerótica (ECVA), hipertensión y diabetes fueron relativamente bajas, con tasas del 9,3, el 12,7 y el 2,9% respectivamente. La media de la concentración de cLDL fue de 277mg/dl sin tratamiento hipolipemiante, y la mediana del GMTA fue de 5,50 (intervalo, 3,38-16,6) mm (tabla 1).
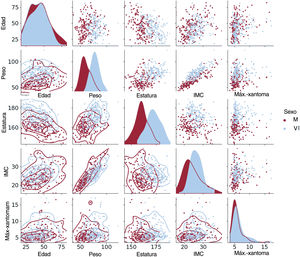
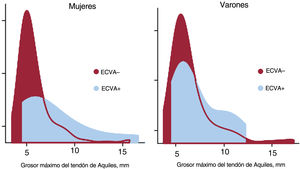
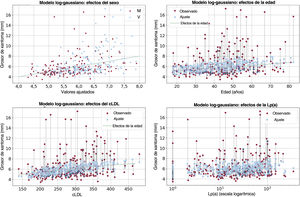
Tal como se preveía, los participantes varones tenían mayores talla, peso y prevalencia de obesidad que las mujeres. De igual modo, la obesidad fue más prevalente en los participantes de más edad. Por lo que respecta al GMTA, los valores extremadamente altos mostraron una mayor prevalencia en los participantes varones, que son propensos a ser más obesos (figura 1). La distribución del GMTA mostró un patrón bimodal tanto en los varones como en las mujeres, con una asimetría positiva sustancial. En una pequeña parte de los participantes, el GMTA mostró valores significativamente mayores y muy alejados de la mediana o la media, en especial en los pacientes con ECVA, en los que había tendones de Aquiles de mayor grosor (figura 2).
El GMTA mostró valores significativamente mayores tanto en los varones como en las mujeres, con una desviación significativa respecto a la media o la mediana, en especial en los pacientes con ECVA, cuyos tendones de Aquiles eran más gruesos. ECVA: enfermedad cardiovascular ateroesclerótica; GMTA: grosor máximo del tendón de Aquiles.
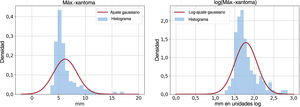
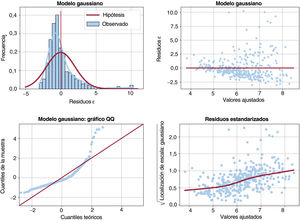
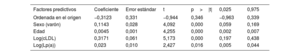
En el panel de la izquierda de la figura 3 se pone claramente de manifiesto que la función de distribución de probabilidad gaussiana, que es el supuesto habitual en los modelos de regresión lineal estándares, no es apropiada para nuestros datos por su simetría y porque no puede incluir en el modelo los valores atípicos. Una solución frecuente para abordar el problema de la asimetría es aplicar una transformación logarítmica a la variable de resultado, con lo que se obtiene una distribución final que está más próxima a la simetría (véase el panel de la derecha de la figura 3). En la tabla 2 se presentan los factores independientes predictivos del GMTA en la regresión lineal con un modelo log-gaussiano. Se observó que la edad, el sexo, el cLDL y la Lp(a) mostraban una asociación independiente con el GMTA, aunque estas 4 variables explicaban tan solo un pequeño porcentaje de la varianza total observada en el GMTA (R2=0,205). Además, la incertidumbre del modelo aumentaba a medida que se incrementaba el GMTA, como se refleja en la figura 4, en la que los residuos van siendo más grandes a medida que aumenta el tamaño del tendón de Aquiles. Las demás variables incluidas en la tabla 1, como la duración del tratamiento hipolipemiante, no mostraron una asociación estadísticamente significativa con el GMTA.
Factores independientes predictivos del grosor máximo del tendón de Aquiles mediante regresión lineal con un modelo log-gaussiano
| Factores predictivos | Coeficiente | Error estándar | t | p>|t| | 0,025 | 0,975 |
|---|---|---|---|---|---|---|
| Ordenada en el origen | −0,3123 | 0,331 | −0,944 | 0,346 | −0,963 | 0,339 |
| Sexo (varón) | 0,1143 | 0,028 | 4,092 | 0,000 | 0,059 | 0,169 |
| Edad | 0,0045 | 0,001 | 4,255 | 0,000 | 0,002 | 0,007 |
| Log(cLDL) | 0,3171 | 0,061 | 5,173 | 0,000 | 0,197 | 0,438 |
| Log(Lp(a)) | 0,023 | 0,010 | 2,427 | 0,016 | 0,005 | 0,044 |
cLDL: colesterol unido a lipoproteínas de baja densidad; Lp(a): lipoproteína (a).
Por lo que respecta a los efectos de la edad, los residuos más grandes fueron positivos (que indican subestimación) y se dieron en pacientes de mediana edad (de 45 a 60 años). Este patrón apunta a que un efecto de la edad no lineal, en forma de U, podría ser favorable para mejorar este modelo. Por lo que respecta al cLDL y la Lp(a), no se observó un patrón claro en los residuos, que se produjeron en toda la gama de concentraciones lipídicas (figura 5).
Gráficos de dispersión de la variable de resultado en relación con las predicciones (en el panel superior izquierdo) o con las variables explicativas cuantitativas (para el resto de los paneles). Las líneas negras verticales a trazos en 3 de los paneles muestran los puntos correspondientes del gráfico de dispersión. En el panel de los efectos de la edad, se añade un pequeño desplazamiento del eje x para evitar el solapamiento de los puntos. cLDL: colesterol unido a lipoproteínas de baja densidad; Lp(a): lipoproteína(a).
Los XT son un signo distintivo de la HF que muestra una amplia variabilidad en su aparición. Se observó que la edad, el sexo masculino, el cLDL y la concentración de Lp(a) se asociaban con el GMTA medido por ecografía en los participantes con HFHe que tenían un diagnóstico genético confirmado. Sin embargo, a pesar de que estas 4 variables no explican por completo la variación interindividual observada (R2=0,205), la determinación de la Lp(a) continúa siendo una parte importante de la práctica clínica en los pacientes con HFHe (figura 6).
Figura central. Selección de los pacientes y determinación de los factores independientes predictivos del grosor del xantoma del tendón de Aquiles por ecografía en la hipercolesterolemia familiar heterocigota. Los factores asociados con el grosor del tendón de Aquiles de los participantes con hipercolesterolemia familiar fueron la edad, el sexo masculino, el cLDL y la concentración de Lp(a). apoA-I: apolipoproteína A-I; apoB: apolipoproteína B; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; ECVA: enfermedad cardiovascular ateroesclerótica; FRCV: factores de riesgo cardiovascular; HbA1c: glucohemoglobina; IMC: índice de masa corporal; Lp(a): lipoproteína (a); PCR: proteína C reactiva.
La asociación entre los XT y la ECV se describió a finales del siglo xviii1. En las décadas de los años veinte y treinta, 2 científicos noruegos, Francis Harbitz y Carl Müller, describieron las características microscópicas de los XT y sus semejanzas con la arterioesclerosis y delimitaron un nuevo trastorno caracterizado por una enfermedad cardiaca hereditaria, xantomatosis e hipercolesterolemia, al que actualmente denominamos HF23.
En este estudio, nuestro objetivo es identificar las variables asociadas con la aparición de los XT en la HFHe. En nuestro análisis de esta asociación hay 2 cuestiones importantes: en primer lugar, se incluyó solo a pacientes con un diagnóstico genético de HFHe, con mutaciones patógenas o probablemente patógenas en los genes canónicos de la HF. Además, el desencadenante del estudio genético fue la sospecha de una HFHe a causa de una forma de presentación familiar de altas concentraciones de cLDL y se incluyó a pacientes consecutivos, con independencia de que hubiera enfermedad cardiovascular o cualquier signo clínico. Dado que los XT constituyen un potente criterio diagnóstico de HF, en este estudio se evitó la selección basada en el diagnóstico clínico de HFHe y el sesgo de seleccionar un subgrupo especial dentro de la HF. La segunda cuestión importante en nuestra metodología es la cuantificación de los XT mediante ecografía de alta resolución. La ecografía no solo permite un diagnóstico de la presencia de xantomas cuando se observan áreas hipoecogénicas en la estructura interna del tendón, sino que también posibilita un análisis cuantitativo del tamaño del tendón mediante la medición de su diámetro anteroposterior24. Esto permite un análisis más preciso del tamaño del tendón de Aquiles y un análisis de la asociación de una variable cuantitativa25. Para evitar el sesgo, se ocultaron las características clínicas y bioquímicas de los pacientes a los ecografistas que llevaron a cabo la técnica ecográfica y la medición de los xantomas.
Hay varios resultados importantes de este estudio que conviene resaltar. En primer lugar, el tamaño del tendón de Aquiles en la HFHe es una variable continua, pero muestra una distribución bimodal. Esto significa que hay un porcentaje de los participantes con HFHe que tienen una mayor predisposición a presentar XT. La prevalencia de los XT difiere en los distintos estudios, y depende en gran parte de los criterios diagnósticos de la enfermedad, que en algunos casos incluyen la presencia de XT, lo cual hace difícil identificar su prevalencia real en la población con HFHe. Además, los estudios que incluyen la detección mediante ecografía indican un mayor porcentaje de participantes con XT. Por otra parte, los criterios diagnósticos de los XT en la ecografía no están bien establecidos y difieren entre los distintos estudios. Empleando unos criterios que incluyen el diámetro máximo del tendón, que es fácilmente reproducible, la prevalencia de los xantomas es de alrededor de un 40% en la HFHe en la edad adulta5.
En segundo lugar, la causa de los XT es multifactorial, y hay 4 variables que parecen desempeñar un papel importante: edad, sexo masculino, dLDL y concentración de Lp(a). Los XT son infrecuentes antes de los 30 años y su prevalencia aumenta hasta la edad de 50 años para estabilizarse luego, lo cual indica que los factores desencadenantes tardan en actuar, incluso en personas con predisposición a su aparición. Sin embargo, hay un grupo de personas con HFHe que parecen ser resistentes a la aparición de XT incluso a edades avanzadas. Los factores causantes de predisposición y de resistencia no parecen estar relacionados con el tipo de mutación que causa la HF ni con la concentración de cLDL, ya que los participantes con el alelo nulo muestran también una gran heterogeneidad en la aparición de XT. Los varones tienen una mayor predisposición a la aparición de XT, al igual que ocurre en el caso de la EC prematura, y ello indica que los mismos factores que influyen en la aparición de la EC podrían favorecer también la aparición de XT11. La asociación con la edad, el sexo y el cLDL ya se había descrito en los XT detectados por clínica4 y se confirmó luego en un metanálisis7.
En tercer lugar, con independencia de los factores de riesgo clásicos, la concentración de Lp(a) muestra asociación lineal con la presencia de XT. Esto concuerda con la semejanza de patogenia entre las placas vasculares de arterioesclerosis y la formación de los XT. Los factores proaterogénicos de la Lp(a) incluyen su papel proinflamatorio en el transporte de fosfolípidos oxidados y colesterol en el interior de la pared arterial y en la modulación de la fibrinolisis. De hecho, los monocitos en cultivo procedentes de pacientes con HFHe y XT tienen una predisposición a formar células espumosas en respuesta a las LDL oxidadas que es mayor que la de los macrófagos de pacientes sin xantomas26,27. Además, se ha descrito una disminución de la expulsión del colesterol de los macrófagos para su paso a las lipoproteínas de alta densidad (HDL) en los participantes con xantomas en comparación con lo observado en los que no los tienen28. De igual modo, las SNV asociadas con diferente respuesta a la inflamación se asocian con la aparición de XT29. La formación de XT podría verse favorecida por la inflamación, según indica su ubicación preferente en el tendón de Aquiles, una zona distal del cuerpo sometida a una elevada carga mecánica, donde los factores que favorecen la inflamación, como la isquemia o el estrés traumático, podrían desempeñar un papel importante. Sin embargo, la proteína C reactiva, que es un buen marcador de la inflamación sistémica, no se asoció con la presencia de XT en nuestro estudio. Las concentraciones de Lp(a) continuaron sin presentar diferencias entre los sexos hasta la edad de 50 años, y luego fueron moderadamente superiores en las mujeres30; además, parece plausible que a la Lp(a) le lleve tiempo contribuir a la formación de los XT. Así pues, es improbable que un análisis desglosado por sexo permita explicar por completo la variabilidad de los XT según este.
Por último, de entre todas las variables clínicas y analíticas estudiadas, tan solo 4 parecen mostrar una asociación independiente con la presencia de XT, y consideradas conjuntamente tan solo explican alrededor de un 20% de la variación en el tamaño del tendón de Aquiles. Este porcentaje es aún menor en los participantes que tenían los XT más voluminosos, por lo que en ellos la incertidumbre es aún mayor e indica que aún se está lejos de explicar las diferencias en la presencia de XT en la HFHe.
LimitacionesNuestro estudio tiene varias limitaciones. En primer lugar, se trata de un estudio transversal que incluye a algunos participantes jóvenes y no se sabe si en estos se desarrollarán XT en el futuro. En segundo lugar, la mayoría de los participantes estaban en tratamiento con fármacos hipolipemiantes en el momento del estudio, algunos de ellos durante largos periodos. Aunque la duración del uso de estatinas no mostró una asociación con el tamaño de los XT, no se puede descartar definitivamente su posible repercusión en los resultados. No obstante, las estatinas no modifican de manera sustancial la concentración de Lp(a), lo cual indica que es posible que no tengan una influencia importante en la asociación observada con esta lipoproteína.
CONCLUSIONESLos XT, que son un signo característico de la HF, muestran heterogeneidad en su forma de presentación, con tendencia a una presencia bimodal en ambos sexos y una gran asimetría positiva. Las variables asociadas con su grosor fueron la edad, el sexo masculino, el cLDL y la concentración de Lp(a); sin embargo, estas variables no explican la mayor parte de la variabilidad interindividual observada. Nuestro estudio resalta la importancia de estas 4 variables, incluida la determinación de la Lp(a), en la práctica clínica con los pacientes con HF.
- -
Los xantomas tendinosos constituyen un importante criterio diagnóstico de la hipercolesterolemia familiar en las guías actuales. Los xantomas y las placas ateroescleróticas tienen muchas características comunes en su composición, lo cual indica mecanismos patogénicos relacionados.
- -
Los factores de riesgo cardiovascular comunes, como la hipertensión, la diabetes, el tabaquismo y el cLDL, y los factores específicos de la HF, como el tipo de mutación que la causa, explican en parte las diferencias de EC entre los distintos pacientes con HFHe; sin embargo, no explican bien la variabilidad en la presencia de XT en los participantes con HF.
- -
La lipoproteína (a) es un bien conocido factor independiente del riesgo de enfermedad cardiovascular ateroesclerótica, no solo en la población general, sino también en los pacientes con HFHe, y contribuye a producir un estado proaterogénico y proinflamatorio.
- -
La distribución del GMTA es una variable continua, pero tiene un patrón bimodal. En una pequeña parte de los participantes, el GMTA mostró unos valores significativamente mayores, en especial en los pacientes con ECVA, que tenían tendones de Aquiles de mayor grosor.
- -
Ya se había descrito antes una asociación de la edad, el sexo y el cLDL con los XT detectados clínicamente que se confirmó en un metanálisis. En nuestro estudio se observó que la Lp(a) se asociaba también de manera independiente con el GMTA detectado por ecografía.
- -
A pesar de estas observaciones, la variabilidad en los xantomas tendinosos no se explica por completo por estas 4 variables, que dejan sin explicar hasta un 80% de la variación.
Este estudio contó con el apoyo de las subvenciones PI18/01777 y PI19/00694 del Ministerio de Economía y Competitividad de España, CIBERCV y el Gobierno de Aragón B-14. Estos proyectos son cofinanciados por el Instituto de Salud Carlos III y el Fondo Europeo de Desarrollo Regional (FEDER) de la Unión Europea «Una manera de hacer Europa».
CONSIDERACIONES ÉTICASEste estudio cumple la Declaración de Helsinki y fue aprobado por el comité de ética local (Comité de ética de la Investigación de la Comunidad Autónoma de Aragón). Se obtuvo el consentimiento informado por escrito de todos los participantes antes de su participación en este estudio de investigación.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se ha utilizado ninguna herramienta de inteligencia artificial en la preparación de este trabajo.
CONTRIBUCIÓN DE LOS AUTORESP. Corredoira, F. Civeira y V. Marco-Benedi diseñaron el estudio y redactaron el manuscrito en inglés. A. Cenarro supervisó el análisis genético de los participantes con hipercolesterolemia familiar. S. Peribáñez se centró en el trabajo de campo, la obtención de los datos y la gestión de las cuestiones de ética. S. Olmos elaboró las figuras, realizó el análisis estadístico y llevó a cabo una revisión crítica del diseño del estudio.
CONFLICTO DE INTERESESNo se declara ninguno.
Queremos expresar nuestro especial reconocimiento por su colaboración a los pacientes y el Biobanco del Sistema de Salud de Aragón (PT17/0015/0039) integrado en la Red Nacional de Biobancos de España.