Una baja adherencia al tratamiento antiagregante plaquetario doble (TAPD) condiciona peor pronóstico tras un síndrome coronario agudo (SCA). Se analizó si el riesgo de eventos adversos cardiovasculares mayores (MACE) tras la interrupción prematura del TAPD varía según el inhibidor del P2Y12.
MétodosAnálisis preespecificado de pacientes con SCA tratados con ticagrelor o clopidogrel entre 2015 y 2019 dentro de un registro prospectivo multicéntrico. Se categorizó la suspensión prematura como indicada por el médico o como interrupción por hemorragia, efectos secundarios o incumplimiento del paciente. La asociación entre la suspensión del TAPD y los MACE se analizó mediante modelos multivariantes de Cox dependientes del tiempo, con estimadores robustos ponderados por probabilidad inversa de censura.
ResultadosDe 2.180 pacientes, 174 (8,3%) suspendieron el TAPD precozmente (126 por indicación médica y 48 por disrupción). Los pacientes incumplidores tenían más edad y más comorbilidad que los adherentes. Frente a la suspensión indicada por el médico, la disrupción del TAPD fue más precoz y frecuente con el ticagrelor que con el clopidogrel. La suspensión del TAPD condicionó mayor riesgo de MACE (HRajustada=1,32; IC95%, 1,10-1,76), principalmente en caso de la disrupción (HRajustada=1,47; IC95%, 1,22-1,73). Este riesgo aumentó exponencialmente en los 90 días posteriores al SCA y fue más evidente con ticagrelor (pinteracción<0,001). Tras considerar la duración del TAPD, esta interacción no resultó significativa en la escala aditiva (exceso de riesgo debido a interacción=0,12; IC95%, –0,99 a 1,24).
ConclusionesEn este registro multicéntrico, 1 de cada 12 pacientes suspendió precozmente el TAPD durante el primer año tras el SCA. En comparación con la suspensión indicada por el facultativo, la disrupción del tratamiento condicionó mayor riesgo de MACE. Tras ajustar la duración del TAPD, esta asociación no se modificó en función del tipo de inhibidor del P2Y12.
Ensayo clínico registrado en ClinicalTrials.gov (Identifier: NCT02500290).
Palabras clave
La guía vigente recomienda el empleo de un tratamiento antiagregante plaquetario doble (TAPD) con inhibidores del receptor P2Y12 (iP2Y12) potentes frente a clopidogrel durante al menos 12 meses después de un síndrome coronario agudo (SCA)1. Sin embargo, a pesar de la aplicación generalizada de estrategias de prevención secundaria a lo largo de las últimas 2 décadas, los pacientes con SCA continúan teniendo alto riesgo de recidiva de eventos isquémicos, en especial durante el primer año siguiente al evento índice2–4.
La falta de adherencia al TAPD y sobre todo la disrupción debida a falta de adherencia o a un evento hemorrágico se asocian con un aumento del riesgo de eventos trombóticos5–7. A pesar del mayor beneficio que pueden aportar los iP2Y12 potentes, la interrupción prematura del ticagrelor se ha descrito en hasta un 25% de los pacientes incluidos en ensayos clínicos aleatorizados (ECA)4. En ese contexto, en comparación con el clopidogrel, el ticagrelor tiene efectos adversos relativamente frecuentes, como hemorragia y disnea, que pueden justificar una disrupción prematura del tratamiento o un cambio a un fármaco menos potente5,8–11. No obstante, por el momento no está claro que la repercusión clínica de una interrupción prematura no programada del TAPD después de un SCA pueda variar en función de la clase de iP2Y12 utilizada11,12. Teniendo en cuenta estas incertidumbres, nuestro objetivo es describir la frecuencia, los factores determinantes y la importancia clínica de los diferentes patrones de falta de adherencia al TAPD con ticagrelor en comparación con clopidogrel en una cohorte contemporánea de pacientes con SCA.
MÉTODOSDiseño y población del estudioSe presenta un subanálisis preespecificado (ClinicalTrials.govNCT04630288, Safety and Efficacy of Ticagrelor vs Clopidogrel in Patients With Acute Coronary Syndrome) del registro CREA-ARIAM (identificador de ClinicalTrials.govNCT02500290, Antiplatelet Therapy in Acute Coronary Syndrome [ACS]. Safety and Efficacy of Switching Antiplatelet), una rama prospectiva, multicéntrica e iniciada por los investigadores del registro ARIAM-Andalucía (Analysis of Delay in Acute Myocardial Infarction in Andalucia). Las características detalladas del diseño, las definiciones y los resultados principales de los registros ARIAM-Andalucía y CREA-ARIAM ya se presentaron en otras publicaciones13,14. El control de calidad de los datos del registro ARIAM-Andalucía se lleva a cabo a intervalos regulares a través de auditorías externas independientes realizadas por la Agencia de Calidad Sanitaria de Andalucía. Se examinó prospectivamente a los pacientes con SCA ingresados en unidades de cuidados intensivos cardiacos entre marzo de 2015 y abril de 2019 para determinar su elegibilidad para el estudio en función de que se los fuera a tratar al menos 12 meses con un TAPD con clopidogrel o ticagrelor. Los principales criterios de exclusión fueron los antecedentes de hemorragia intracraneal previa o de hemorragia mayor reciente, los pacientes dados de alta con prasugrel o anticoagulantes orales y los pacientes perdidos para el seguimiento o con datos faltantes (métodos 1 del material adicional). El estudio fue aprobado por el Comité de Ética de Investigación Regional de Andalucía y los comités de ética de investigación de cada uno de los centros participantes. Todos los pacientes aptos para el estudio debían dar su consentimiento informado por escrito.
Objetivos y definiciones del estudioEl objetivo principal fue la primera aparición de un evento adverso cardiaco mayor (MACE), un objetivo combinado de mortalidad por cualquier causa, infarto de miocardio15, ictus, revascularización de la lesión diana no programada o trombosis del stent definida a 1 año16. Los objetivos secundarios fueron cada uno de los componentes individuales del objetivo principal y una definición más restrictiva de los MACE (MACE-2) que incluía la muerte de causa cardiovascular, el infarto de miocardio, la revascularización de la lesión diana no programada y la trombosis del stent definida. La hemorragia mayor se definió como una hemorragia de tipo 3 o 5 según los criterios del Bleeding Academic Research Consortium (BARC)17 (métodos 2 del contenido adicional).
Exposición y determinación de los resultadosSe realizó un rastreo sistemático y prospectivo de los objetivos clínicos y del estado de exposición al TAPD durante los 12 meses posteriores al evento índice, en el que se llevaron a cabo visitas ambulatorias de seguimiento programadas tras el alta hospitalaria, a cargo de coordinadores de investigación formados para ello, mediante entrevistas telefónicas estructuradas con los pacientes o sus familiares, que se programaron a los 1, 6 y 12 meses del alta (métodos 2 del material adicional). Estas entrevistas incluyeron un cuestionario elaborado específicamente para este fin, en el que se pedía a los pacientes que aportaran información detallada sobre los reingresos hospitalarios, las visitas ambulatorias, los efectos adversos asociados a los medicamentos o cualquier cambio que se hubiera producido en su tratamiento antiagregante plaquetario desde el último contacto. Concretamente, se recabaron datos relativos a las fechas de detención y reinicio de la medicación, los motivos de la interrupción prematura y el tratamiento sustitutivo utilizado, según procediera. La información autorreportada se validó de manera sistemática con los datos obtenidos a mano de las historias clínicas electrónicas. Todos los posibles eventos identificados durante el periodo de seguimiento fueron objeto de una valoración formal («adjudicación») de los datos fuente originales anonimizados por consenso de 2 investigadores con experiencia a los que se ocultaron el año y el tipo de iP2Y12 incluido en el TAPD del paciente. Además, se evaluó a intervalos regulares la adherencia a la medicación, con independencia del estado clínico; para ello se empleó la tasa de posesión de la medicación (medication possession ratio) (métodos 2 del material adicional). Para los fines de este estudio, el término interrupción prematura hace referencia a cualquier suspensión no programada del TAPD antes de los 12 meses, definida como transitoria (< 14 días) o definitiva, del ticagrelor o el clopidogrel durante más de 3 días, con o sin interrupción del tratamiento con ácido acetilsalicílico. En concordancia con el registro PARIS5, se consideraron 2 modos de interrupción prematura: la interrupción indicada por el médico y la disrupción debida a falta de adherencia, efectos adversos o sangrado. La interrupción del tratamiento a causa de una intervención quirúrgica o la necesidad de procedimientos invasivos se clasificó como interrupción prematura recomendada por un médico. También se subdividió la falta de adherencia en función de la cronología de la interrupción prematura de la medicación desde la fecha del alta hospitalaria como interrupción temprana (< 90 días) o tardía (> 90 días) y en función del tipo de iP2Y12 en el momento de la interrupción prematura. Asimismo se registraron por sistema las razones específicas de la interrupción prematura y se clasificaron en función de los modos de interrupción prematura predefinidos.
Análisis estadísticoLas características basales de los pacientes y los procedimientos según se produjera o no una interrupción prematura del TAPD se describen mediante frecuencias y porcentajes (variables cualitativas) y media ± desviación estándar o mediana [intervalo intercuartílico] (variables continuas) según corresponda. Las características de los pacientes de cada grupo de interrupción prematura se compararon mediante la prueba de la χ2 para las variables cualitativas y las pruebas de la t de Student de muestras independientes, la U de Mann-Whitney o la de Kruskal-Wallis para las variables continuas según procediera. Se utilizó el enfoque de ponderación de la probabilidad inversa de censura (IPCW) para tener en cuenta la censura dependiente motivada por los potenciales factores de confusión que varían con el tiempo18 (métodos 2 del material adicional). La incidencia acumulada de los diferentes patrones de falta de adherencia se resumió en estimadores de Kaplan-Meier ponderados. Los factores predictivos de la interrupción prematura se evaluaron en modelos de regresión de Cox multivariantes actualizados en el tiempo con el enfoque de polinomios fraccionales multivariante19. El riesgo ajustado de MACE asociados con la interrupción prematura del TAPD se analizó tomando la muerte como evento competitivo y ajustando modelos de regresión de Cox multivariantes actualizados a lo largo del tiempo en los que se introdujo cada modo de interrupción prematura como una covariable dependiente del tiempo. Los modelos incluyeron estimadores de IPCW doblemente robustos con la introducción de los hospitales participantes como variable de efectos aleatorios agrupada; se emplearon estimadores robustos para tener en cuenta la falta de independencia inducida por los datos ponderados, así como la potencial variabilidad interhospitalaria de tratamiento clínico (métodos 2 del material adicional). Los resultados se expresan en forma de hazard ratio ajustada (HRa) con sus intervalos de confianza del 95% (IC95%). Se llevó a cabo un análisis de subgrupos para las diversas categorías de falta de adherencia estratificadas según el tipo de iP2Y12 con la prueba (de Wald) formal para interacciones, tomando la ausencia de interrupción del TAPD como grupo de referencia. Además, los términos de interacción se evaluaron en la escala aditiva a través del exceso de riesgo relativo debido a la interacción (RERI) y la proporción atribuible, con sus IC95% calculados mediante el método delta20. Todos los análisis de subgrupos se consideraron exploratorios y no se aplicaron ajustes por multiplicidad. A fin de garantizar la robustez de los resultados principales, se realizó una serie de análisis de sensibilidad: a) en cohortes selectivas a fin de abordar la posible causalidad inversa, excluidos los pacientes en los que era más probable una interrupción prematura del TAPD; b) con modelos de supervivencia paramétricos flexibles que emplean funciones spline cúbicas para modelizar la duración del TAPD como covariable continua, y c) según los modos de falta de adherencia del registro PARIS, considerando por separado la interrupción prematura del TAPD a causa de una intervención quirúrgica. Todas las pruebas fueron bilaterales y se estableció un valor de alfa del 5%. Los análisis se llevaron a cabo con el programa Stata 14.2 (Stata Corp, 2016; Stata Statistical Software, Estados Unidos).
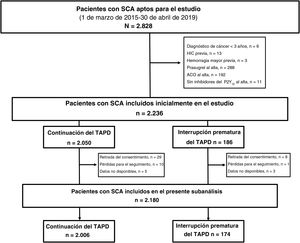
RESULTADOSCaracterísticas de los pacientesDe los 2.828 pacientes examinados para su posible inclusión, se incluyó en el presente análisis a 2.180. De ellos, en 174 (8,3%) interrumpieron el TAPD —126 (6,0%) indicadas por el médico y 48 (2,4%) por disrupción- (figura 1). La tasa anual de interrupción prematura del TAPD se redujo significativamente a lo largo del periodo de estudio (ptendencia = 0,035) (figura 1 del material adicional). En la tabla 1 y la tabla 2 se resumen los parámetros demográficos de los pacientes, las características clínicas y de los procedimientos y el uso de medicación según el TAPD se interrumpiera o no. En comparación con los pacientes que continuaron con el TAPD, los que interrumpieron prematuramente este tratamiento eran de más edad, tenían con mayor frecuencia antecedentes de sangrado, deterioro de la función renal, enfermedad pulmonar obstructiva crónica o anemia y era más probable que tuvieran un infarto agudo de miocardio sin lesiones coronarias obstructivas y estuvieran tratados de manera conservadora (tratamiento médico) por el SCA índice. En cambio, estos pacientes recibieron con menor frecuencia stents farmacoactivos y tratamientos médicos basados en las recomendaciones de las guías en el momento del alta hospitalaria, como el uso de iP2Y12 potentes. No se observaron diferencias entre los grupos por lo que respecta a la forma de presentación clínica al ingreso, la prevalencia de enfermedad multivaso o la consecución de una revascularización completa ni hubo diferencias importantes al analizar los distintos modos de interrupción prematura (tablas 1 y 2 del material adicional).
Características basales de los pacientes según el estado de interrupción prematura del tratamiento antiagregante plaquetario doble
| Cohorte total(N = 2.180) | Sin interrupción(n = 2.006) | Interrupción(n = 174) | pa | |
|---|---|---|---|---|
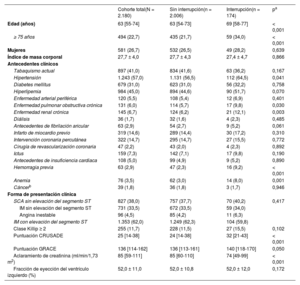
| Edad (años) | 63 [55-74] | 63 [54-73] | 69 [58-77] | < 0,001 |
| ≥ 75 años | 494 (22,7) | 435 (21,7) | 59 (34,0) | < 0,001 |
| Mujeres | 581 (26,7) | 532 (26,5) | 49 (28,2) | 0,639 |
| Índice de masa corporal | 27,7 ± 4,0 | 27,7 ± 4,3 | 27,4 ± 4,7 | 0,866 |
| Antecedentes clínicos | ||||
| Tabaquismo actual | 897 (41,0) | 834 (41,6) | 63 (36,2) | 0,167 |
| Hipertensión | 1.243 (57,0) | 1.131 (56,5) | 112 (64,5) | 0,041 |
| Diabetes mellitus | 679 (31,0) | 623 (31,0) | 56 (32,2) | 0,758 |
| Hiperlipemia | 984 (45,0) | 894 (44,6) | 90 (51,7) | 0,070 |
| Enfermedad arterial periférica | 120 (5,5) | 108 (5,4) | 12 (6,9) | 0,401 |
| Enfermedad pulmonar obstructiva crónica | 131 (6,0) | 114 (5,7) | 17 (9,8) | 0,030 |
| Enfermedad renal crónica | 145 (6,7) | 124 (6,2) | 21 (12,1) | 0,003 |
| Diálisis | 36 (1,7) | 32 (1,6) | 4 (2,3) | 0,485 |
| Antecedentes de fibrilación aricular | 63 (2,9) | 54 (2,7) | 9 (5,2) | 0,061 |
| Infarto de miocardio previo | 319 (14,6) | 289 (14,4) | 30 (17,2) | 0,310 |
| Intervención coronaria percutánea | 322 (14,7) | 295 (14,7) | 27 (15,5) | 0,772 |
| Cirugía de revascularización coronaria | 47 (2,2) | 43 (2,0) | 4 (2,3) | 0,892 |
| Ictus | 159 (7,3) | 142 (7,1) | 17 (9,8) | 0,190 |
| Antecedentes de insuficiencia cardiaca | 108 (5,0) | 99 (4,9) | 9 (5,2) | 0,890 |
| Hemorragia previa | 63 (2,9) | 47 (2,3) | 16 (9,2) | < 0,001 |
| Anemia | 76 (3,5) | 62 (3,0) | 14 (8,0) | 0,001 |
| Cáncerb | 39 (1,8) | 36 (1,8) | 3 (1,7) | 0,946 |
| Forma de presentación clínica | ||||
| SCA sin elevación del segmento ST | 827 (38,0) | 757 (37,7) | 70 (40,2) | 0,417 |
| IM sin elevación del segmento ST | 731 (33,5) | 672 (33,5) | 59 (34,0) | |
| Angina inestable | 96 (4,5) | 85 (4,2) | 11 (6,3) | |
| IM con elevación del segmento ST | 1.353 (62,0) | 1.249 (62,3) | 104 (59,8) | |
| Clase Killip ≥ 2 | 255 (11,7) | 228 (11,5) | 27 (15,5) | 0,102 |
| Puntuación CRUSADE | 25 [14-38] | 24 [14-38] | 32 [21-43] | < 0,001 |
| Puntuación GRACE | 136 [114-162] | 136 [113-161] | 140 [118-170] | 0,050 |
| Aclaramiento de creatinina (ml/min/1,73 m2) | 85 [59-111] | 85 [60-110] | 74 [49-99] | < 0,001 |
| Fracción de eyección del ventrículo izquierdo (%) | 52,0 ± 11,0 | 52,0 ± 10,8 | 52,0 ± 12,0 | 0,172 |
CRUSADE: Can Rapid risk stratification of Unstable angina patients Suppress ADverse outcomes with Early implementation of the ACC/AHA guidelines; GRACE: Global Registry of Acute Coronary Events; IM: infarto de miocardio; SCA: síndrome coronario agudo.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Características de los procedimientos, uso de la medicación y adherencia según el estado de interrupción del TAPD
| Total de pacientes(N = 2.180) | Sin interrupción(n = 2.006) | Interrupción(n = 174) | pa | |
|---|---|---|---|---|
| Características de la intervenciónb | ||||
| Acceso vascular radial | 1.440 (66,0) | 1.331 (66,4) | 109 (62,6) | 0,130 |
| Vaso culpable | ||||
| Tronco coronario izquierdo | 76 (3,5) | 74 (3,7) | 2 (1,1) | 0,091 |
| Arteria descendente anterior izquierda | 878 (40,3) | 819 (40,8) | 59 (34,0) | 0,074 |
| Coronaria derecha | 735 (33,7) | 671 (33,4) | 64 (36,8) | 0,371 |
| Circunfleja izquierda | 362 (16,6) | 335 (16,7) | 27 (15,5) | 0,689 |
| Injerto | 34 (1,6) | 30 (1,5) | 4 (2,3) | 0,343 |
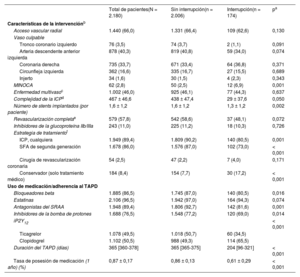
| MINOCA | 62 (2,8) | 50 (2,5) | 12 (6,9) | 0,001 |
| Enfermedad multivasoc | 1.002 (46,0) | 925 (46,1) | 77 (44,3) | 0,637 |
| Complejidad de la ICPd | 467 ± 46,6 | 438 ± 47,4 | 29 ± 37,6 | 0,050 |
| Número de stents implantados (por paciente) | 1,6 ± 1,2 | 1,6 ± 1,2 | 1,3 ± 1,2 | 0,002 |
| Revascularización completae | 579 (57,8) | 542 (58,6) | 37 (48,1) | 0,072 |
| Inhibidores de la glucoproteína IIb/IIIa | 243 (11,0) | 225 (11,2) | 18 (10,3) | 0,726 |
| Estrategia de tratamientof | ||||
| ICP, cualquiera | 1.949 (89,4) | 1.809 (90,2) | 140 (80,5) | 0,001 |
| SFA de segunda generación | 1.678 (86,0) | 1.576 (87,0) | 102 (73,0) | < 0,001 |
| Cirugía de revascularización coronaria | 54 (2,5) | 47 (2,2) | 7 (4,0) | 0,171 |
| Conservador (solo tratamiento médico) | 184 (8,4) | 154 (7,7) | 30 (17,2) | < 0,001 |
| Uso de medicación/adherencia al TAPD | ||||
| Bloqueadores beta | 1.885 (86,5) | 1.745 (87,0) | 140 (80,5) | 0,016 |
| Estatinas | 2.106 (96,5) | 1.942 (97,0) | 164 (94,3) | 0,074 |
| Antagonistas del SRAA | 1.948 (89,4) | 1.806 (92,7) | 142 (81,6) | 0,001 |
| Inhibidores de la bomba de protones | 1.688 (76,5) | 1.548 (77,2) | 120 (69,0) | 0,014 |
| iP2Y12 | < 0,001 | |||
| Ticagrelor | 1.078 (49,5) | 1.018 (50,7) | 60 (34,5) | |
| Clopidogrel | 1.102 (50,5) | 988 (49,3) | 114 (65,5) | |
| Duración del TAPD (días) | 365 [360-378] | 365 [365-375] | 204 [96-321] | < 0,001 |
| Tasa de posesión de medicación (1 año) (%) | 0,87 ± 0,17 | 0,86 ± 0,13 | 0,61 ± 0,29 | < 0,001 |
CABG: cirugía de revascularización coronaria; ICP: intervención coronaria percutánea; MINOCA: infarto agudo de miocardio sin lesiones coronarias obstructivas; SCA: síndrome coronario agudo; SFA: stent farmacoactivo; SRAA: sistema renina-angiotensina-aldosterona; TAPD: tratamiento antiagregante plaquetario doble.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico] según proceda.
Enfermedad multivaso definida como al menos 2 vasos principales afectos (diámetro ≥ 2 mm) de un territorio diferente con lesiones consideradas angiográficamente significativas (estenosis ≥ 50% del tronco principal izquierdo, estenosis ≥ 70% en otros vasos coronarios principales o estenosis del 30 al 70% con una reserva fraccional de flujo ≤ 0,8).
Complejidad de la ICP definida por la presencia de al menos 1 de las siguientes características: 3 vasos tratados, 3 o más stents implantados, 3 o más lesiones tratadas, bifurcación con 2 stents implantados, longitud total del stent > 60?mm, tratamiento de la oclusión total crónica, ICP de tronco principal izquierdo sin protección o ICP con injerto de bypass.
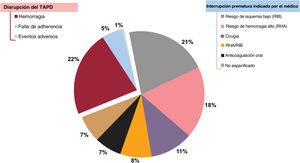
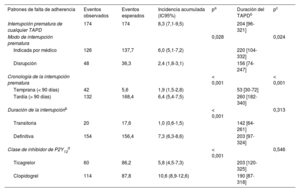
En la tabla 3 se presentan la incidencia acumulada y la cronología de la interrupción prematura del TAPD en función de las categorías de falta de adherencia predefinidas. De los 174 episodios de interrupción prematura no programada, la mayor parte (88,5%) se clasificaron como definitivas, mientras que las interrupciones transitorias ocurrieron en una minoría de pacientes, con una duración mediana de 5,5 [5-9,5] días. La mayor parte de las interrupciones prematuras (90%) fueron solo del iP2Y12, mientras que en una minoría de casos incluyeron tanto el ácido acetilsalicílico como el iP2Y12. En la cohorte total, la mayoría de las interrupciones prematuras del TAPD fueron por decisión médica (figura 2). La mediana de tiempo transcurrido hasta cualquier tipo de interrupción prematura del TAPD fue de 204 [96-321] días. En comparación con la interrupción prematura indicada por el médico, la disrupción del TAPD y en particular la debida a falta de adherencia del paciente se asociaron con duraciones del TAPD más cortas (tabla 3 del material adicional). La incidencia acumulada de interrupción prematura del clopidogrel duplicó la del ticagrelor, y ello se debió principalmente a una mayor frecuencia de interrupciones prematuras indicadas por el médico (tabla 3, figura 2 del material adicional). En cambio, las tasas de disrupción fueron proporcionalmente superiores en los pacientes tratados con ticagrelor en comparación con los tratados con clopidogrel, si bien estas diferencias solo se apreciaron en los primeros 90 días tras el alta (tabla 4 del material adicional). Un análisis más detallado de las razones de la interrupción prematura mostró que las diferencias entre los pacientes tratados con ticagrelor o con clopidogrel se debieron en gran parte a las mayores tasas observadas de disrupción por falta de cumplimiento en los primeros (figura 3 del material adicional). En general, la duración del TAPD no mostró diferencias significativas según el tipo de iP2Y12 (tabla 3), el modo o la cronología de la interrupción prematura (tabla 4 del material adicional). Sin embargo, la mediana de tiempo transcurrido hasta la disrupción del TAPD en los 90 días tras el alta fue significativamente inferior con ticagrelor que con clopidogrel (p = 0,035) (figura 4 del material adicional).
Incidencia acumulada y cronología de la interrupción del tratamiento antiagregante plaquetario doble según los patrones de falta de adherencia predefinidos
| Patrones de falta de adherencia | Eventos observados | Eventos esperados | Incidencia acumulada (IC95%) | pa | Duración del TAPDb | pc |
|---|---|---|---|---|---|---|
| Interrupción prematura de cualquier TAPD | 174 | 174 | 8,3 (7,1-9,5) | 204 [96-321] | ||
| Modo de interrupción prematura | 0,028 | 0,024 | ||||
| Indicada por médico | 126 | 137,7 | 6,0 (5,1-7,2) | 220 [104-332] | ||
| Disrupción | 48 | 36,3 | 2,4 (1,8-3,1) | 156 [74-247] | ||
| Cronología de la interrupción prematura | < 0,001 | < 0,001 | ||||
| Temprana (< 90 días) | 42 | 5,6 | 1,9 (1,5-2,8) | 53 [30-72] | ||
| Tardía (> 90 días) | 132 | 168,4 | 6,4 (5,4-7,5) | 260 [182-340] | ||
| Duración de la interrupciónb | < 0,001 | 0,313 | ||||
| Transitoria | 20 | 17,6 | 1,0 (0,6-1,5) | 142 [64-261] | ||
| Definitiva | 154 | 156,4 | 7,3 (6,3-8,6) | 203 [97-324] | ||
| Clase de inhibidor de P2Y12d | < 0,001 | 0,546 | ||||
| Ticagrelor | 60 | 86,2 | 5,8 (4,5-7,3) | 203 [120-325] | ||
| Clopidogrel | 114 | 87,8 | 10,6 (8,9-12,6) | 190 [87-318] |
IC95%: intervalo de confianza del 95%; TAPD: tratamiento antiagregante plaquetario doble.
Los valores expresan el número de eventos de interrupción prematura observados y esperados y la incidencia acumulada a 1 año de interrupciones prematuras del TAPD con sus correspondientes IC95% basados en el estimador de Kaplan-Meier ponderado con la censura.
Valores de p bilaterales basados en pruebas de orden logarítmico (log-rank tests) ponderadas para comparar la distribución del tiempo hasta la interrupción prematura del TAPD entre las distintas categorías de falta de adherencia al TAPD.
Duración del TAPD calculada mediante el tiempo en días transcurrido entre la fecha del ingreso índice hasta la interrupción definitiva del TAPD, expresada en mediana [intervalo intercuartílico].
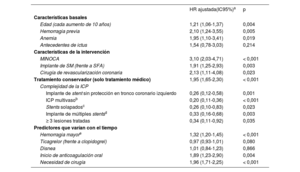
Es notable el solapamiento de la mayoría de los predictores de la interrupción prematura del TAPD y los factores de alto riesgo hemorrágico, mientras que ni la aparición de disnea ni la clase de iP2Y12 predijeron la interrupción prematura de la medicación (tabla 4).
Factores asociados con la interrupción prematura del TAPD
| HR ajustada(IC95%)a | p | |
|---|---|---|
| Características basales | ||
| Edad (cada aumento de 10 años) | 1,21 (1,06-1,37) | 0,004 |
| Hemorragia previa | 2,10 (1,24-3,55) | 0,005 |
| Anemia | 1,95 (1,10-3,41) | 0,019 |
| Antecedentes de ictus | 1,54 (0,78-3,03) | 0,214 |
| Características de la intervención | ||
| MINOCA | 3,10 (2,03-4,71) | < 0,001 |
| Implante de SM (frente a SFA) | 1,91 (1,25-2,93) | 0,003 |
| Cirugía de revascularización coronaria | 2,13 (1,11-4,08) | 0,023 |
| Tratamiento conservador (solo tratamiento médico) | 1,95 (1,65-2,30) | < 0,001 |
| Complejidad de la ICP | ||
| Implante de stent sin protección en tronco coronario izquierdo | 0,26 (0,12-0,58) | 0,001 |
| ICP multivasob | 0,20 (0,11-0,36) | < 0,001 |
| Stents solapadosc | 0,26 (0,10-0,83) | 0,023 |
| Implante de múltiples stentsd | 0,33 (0,16-0,68) | 0,003 |
| ≥ 3 lesiones tratadas | 0,34 (0,11-0,92) | 0,035 |
| Predictores que varían con el tiempo | ||
| Hemorragia mayore | 1,32 (1,20-1,45) | < 0,001 |
| Ticagrelor (frente a clopidogrel) | 0,97 (0,93-1,01) | 0,080 |
| Disnea | 1,01 (0,84-1,23) | 0,866 |
| Inicio de anticoagulación oral | 1,89 (1,23-2,90) | 0,004 |
| Necesidad de cirugía | 1,96 (1,71-2,25) | < 0,001 |
BARC: Bleeding Academic Research Consortium; CABG: cirugía de revascularización coronaria; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; MINOCA: infarto agudo de miocardio sin lesiones coronarias obstructivas; SFA: stent farmacoactivo; SM: stent metálico; TAPD: tratamiento antiagregante plaquetario doble.
Estimaciones ajustadas según un modelo de regresión de Cox dependiente del tiempo (puede consultarse información detallada de la selección de covariables y el modelo en métodos 2 del material adicional).
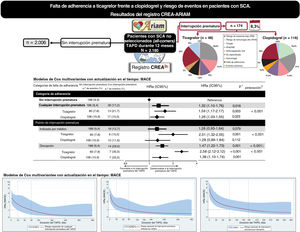
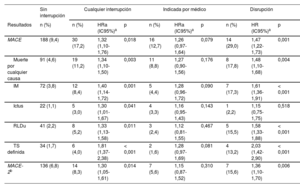
Al cabo de 1 año, 218 pacientes (10%) habían sufrido un MACE, de los que 188 (86%) estaban en tratamiento con TAPD y 30 (14%) lo habían interrumpido antes del evento (tabla 5). La incidencia de los eventos cardiacos adversos se concentró especialmente en los primeros 90 días tras el alta hospitalaria (n = 106, 48,5%) y se redujo progresivamente después. En los modelos multivariantes en los que se tuvieron en cuenta los factores de confusión fijos y los dependientes del tiempo, en comparación con los pacientes que mantuvieron la adherencia al tratamiento, los que interrumpieron prematuramente el TAPD presentaron un aumento del riesgo de MACE. Las diferencias observadas se debieron en gran parte al efecto de la disrupción del tratamiento, mientras que la interrupción prematura indicada por el médico no se asoció con mayor riesgo de MACE (tabla 5, figura 3). Los resultados se mantuvieron uniformes en cuanto a la dirección y la magnitud del efecto de cada uno de los componentes individuales del objetivo principal y también tras emplear una definición más restrictiva de los MACE.
Riesgo ajustado de eventos cardiacos adversos mayores asociado con los diferentes patrones de falta de adherencia al tratamiento antiagregante plaquetario doble 1 año tras un síndrome coronario agudo
| Sin interrupción | Cualquier interrupción | Indicada por médico | Disrupción | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Resultados | n (%) | n (%) | HRa (IC95%)a | p | n (%) | HRa (IC95%)a | p | n (%) | HR (IC95%)a | p |
| MACE | 188 (9,4) | 30 (17,2) | 1,32 (1,10-1,76) | 0,018 | 16 (12,7) | 1,26 (0,97-1,64) | 0,079 | 14 (29,0) | 1,47 (1,22-1,73) | 0,001 |
| Muerte por cualquier causa | 91 (4,6) | 19 (11,2) | 1,34 (1,10-1,50) | 0,003 | 11 (8,8) | 1,27 (0,90-1,56) | 0,176 | 8 (17,8) | 1,48 (1,10-1,68) | 0,004 |
| IM | 72 (3,8) | 12 (8,4) | 1,40 (1,14-1,72) | 0,001 | 5 (4,4) | 1,28 (0,96-1,72) | 0,090 | 7 (17,3) | 1,61 (1,36-1,91) | < 0,001 |
| Ictus | 22 (1,1) | 5 (3,0) | 1,30 (1,01-1,67) | 0,041 | 4 (3,3) | 1,16 (0,95-1,43) | 0,143 | 1 (2,2) | 1,15 (0,75-1,75) | 0,518 |
| RLDu | 41 (2,2) | 8 (5,2) | 1,33 (1,13-1,58) | 0,011 | 3 (2,4) | 1,12 (0,81-1,55) | 0,467 | 5 (15,5) | 1,58 (1,33-1,88) | < 0,001 |
| TS definida | 34 (1,7) | 6 (4,0) | 1,81 (1,37-2,38) | < 0,001 | 2 (1,6) | 1,28 (0,97-1,69) | 0,081 | 4 (13,2) | 2,03 (1,42-2,90) | < 0,001 |
| MACE-2b | 136 (6,8) | 14 (8,3) | 1,30 (1,05-1,61) | 0,014 | 7 (5,6) | 1,15 (0,87-1,52) | 0,310 | 7 (15,6) | 1,36 (1,10-1,70) | 0,006 |
HRa: hazard ratio ajustada; IC95%: intervalo de confianza del 95%; IM: infarto de miocardio; IPCW: ponderación de la probabilidad inversa de censura; MACE: eventos adversos cardiacos mayores; RLDu: revascularización de lesión diana urgente; TS: trombosis del stent.
Los valores muestran el número y la incidencia acumulada de eventos a 1 año por estimaciones de Kaplan-Meier ponderadas.
Valores de hazard ratio ajustada y sus IC95% según modelos de regresión de Cox actualizados en el tiempo con la interrupción prematura del TAPD como covariable dependiente del tiempo, incluyendo estimadores de IPCW doblemente robustos e introduciendo los hospitales participantes como variable de efectos aleatorios (puede consultarse información detallada sobre el ajuste multivariable y el modelo en métodos 2 del material adicional).
Figura central. Falta de adherencia al ticagrelor en comparación con el clopidogrel y resultados clínicos en pacientes con síndrome coronario agudo. Resultados del registro CREA-ARIAM. HRa: hazard ratio ajustada; IC95%: intervalo de confianza del 95%; IM: infarto de miocardio; IPCW: ponderación de la probabilidad inversa de censura; MACE: eventos adversos cardiacos mayores; RLDu: revascularización urgente de lesión diana; TAPD: tratamiento antiagregante plaquetario doble; TS: trombosis de stent.
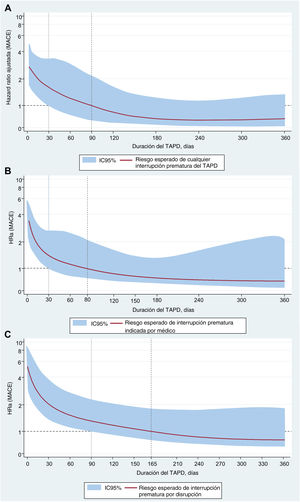
En un análisis de subgrupos, el riesgo ajustado de MACE tras la interrupción prematura del TAPD fue significativamente mayor con ticagrelor que con clopidogrel, independientemente del modo de interrupción prematura (pinteracción < 0,001) (figura 5 del material adicional), en especial en los primeros meses tras el alta (figura 6 del material adicional). Sin embargo, al considerar conjuntamente el modo y la cronología de la interrupción prematura, esta interacción solo fue evidente tras la disrupción del TAPD en los primeros 90 días después del alta (pinteracción < 0,001) (figura 7 del material adicional). Hubo un incremento gradual del riesgo de MACE según las razones subyacentes para la interrupción prematura, de tal manera que el riesgo máximo se observó tras la disrupción por falta de cumplimiento, en especial cuando esta se producía en los primeros 30 días tras el alta (figura 8 del material adicional, tabla 5 del material adicional). En el análisis paramétrico flexible basado en splines cúbicos restringidos, el riesgo de MACE tras la interrupción prematura aumentó exponencialmente a medida que se acortó la duración del TAPD y decreció de manera gradual con tandas de tratamiento más largas, fuesen cuales fueren el modo de interrupción prematura y el tipo de iP2Y12 (figura 4). No hubo indicios de una interacción dependiente del tiempo entre la interrupción prematura del TAPD y el tratamiento con iP2Y12 en cuanto al riesgo de MACE, independientemente de la duración del TAPD (tabla 5 del material adicional, figura 9 del material adicional). De igual modo, el análisis RERI reveló que, en comparación con el clopidogrel, mientras que la disrupción del ticagrelor se asoció con un aumento no significativo del 12% en el riesgo de MACE, los regímenes más abreviados de TAPD como consecuencia de una disrupción temprana resultaron en un aumento significativo del 64% en el riesgo de MACE relacionados con la interrupción prematura (tabla 6 del material adicional). Por último, los resultados de los análisis de sensibilidad en base a los modos de interrupción del registro PARIS (tabla 7 del material adicional) y sobre cohortes seleccionadas por exclusión (tabla 8 del material adicional) continuaron siendo coherentes con los resultados del análisis primario.
Las curvas de duración-respuesta muestran los valores de HRa (líneas rojas continuas) y los IC95% (bandas grises sombreadas) de los MACE como función continua de la duración del TAPD. En cada recuadro, las líneas verticales a trazos y continuas representadas sobre el eje x indican la duración de la exposición continua al TAPD en que las curvas suavizadas para la HRa y sus correspondientes IC95% cortan la línea a trazos horizontal del «efecto nulo» (HRa=1). IM: infarto de miocardio; HRa: hazard ratio ajustada; IC95%: intervalo de confianza del 95%; IPCW: ponderación de la probabilidad inversa de censura; MACE: eventos adversos cardiacos mayores; RLDu: revascularización urgente de lesión diana; TAPD: tratamiento antiagregante plaquetario doble; TS: trombosis del stent.
Los resultados de este subanálisis de un registro multicéntrico prospectivo de pacientes con SCA que debían recibir 12 meses de TAPD con ticagrelor o clopidogrel pueden resumirse como sigue: a) durante el primer año después del SCA índice, casi 1 de cada 12 pacientes interrumpió prematuramente el TAPD; b) en general, la interrupción prematura indicada por el médico fue el patrón más frecuente de falta de adherencia al TAPD, pero la disrupción fue más temprana y dio lugar a regímenes de tratamiento más cortos; c) los modos de interrupción prematura del TAPD mostraron diferencias significativas según el tipo de iP2Y12 utilizado, de tal manera que la indicada por el médico fue más frecuente en los pacientes tratados con clopidogrel, mientras que en los tratados con ticagrelor hubo más disrupciones, y d) la interrupción prematura del TAPD se asoció con un aumento del riesgo de MACE debido principalmente al efecto de la disrupción; este riesgo fue máximo en los 90 días siguientes al alta, sin que hubiera ningún indicio de que la elección del iP2Y12 tuviera un efecto modificador en esta asociación.
La falta de adherencia al régimen terapéutico es un factor determinante de la eficacia de las estrategias de prevención secundaria en relación con la enfermedad coronaria, sobre todo para los pacientes con SCA21. La guía de práctica clínica vigente ha establecido 12 meses de TAPD, preferentemente con un iP2Y12 potente, como el estándar de tratamiento antitrombótico después de un SCA1. Sin embargo, el beneficio actual de esta estrategia podría traducirse en una menor reducción del riesgo isquémico absoluto, al verse contrarrestada y superada por el aumento relativo del riesgo de sangrado y las tasas más altas de falta de adherencia observadas con los iP2Y12 más potentes en comparación con el clopidogrel4,10–12.
Hasta la fecha, la evidencia existente sobre la repercusión clínica de la interrupción prematura del TAPD después de un SCA en función del tipo de iP2Y12 es escasa. En un reciente metanálisis de 4 ECA, el riesgo relativo de interrupción prematura fue un 25% superior en los pacientes tratados con ticagrelor respecto a los tratados con el comparador, debido principalmente a las complicaciones hemorrágicas y la aparición de disnea4. En comparación, en estudios observacionales la falta de adherencia al clopidogrel fue casi idéntica, con tasas de interrupción prematura del TAPD que oscilan entre un 20 y un 29% en los primeros 12 meses tras el SCA índice22–25, mientras que las tasas de interrupción prematura del tratamiento con ticagrelor mostraron cifras más variables, entre el 5 y el 30%8–12,26–29.
En consonancia con lo observado en un subanálisis de los pacientes con SCA incluidos en el registro PARIS7, en el nuestro la interrupción prematura indicada por el médico fue el patrón de falta de adherencia al TAPD más frecuente. Por contra, mientras que en el registro PARIS la falta de adherencia por decisión del paciente fue la razón principal de la disrupción del TAPD, seguida por la hemorragia6, en el nuestro las complicaciones hemorrágicas fueron la causa de más de 2 tercios de las disrupciones, mientras solo una minoría de los pacientes reportaron una disrupción por falta de cumplimiento terapéutico. Al considerar el tipo de iP2Y12, al contrario que lo observado en estudios previos12,29 pero similar a lo descrito por Turgeon et al.11, se observaron tasas de interrupción prematura del TAPD más altas con clopidogrel que con ticagrelor, debido principalmente a una mayor frecuencia de interrupciones indicadas por el médico. Por el contrario, en un reciente subanálisis del registro PCI de Berna10, la disrupción por falta de adherencia y hemorragias fue más frecuente con ticagrelor que con clopidogrel. En este contexto, cabe destacar que los problemas de falta de cumplimiento asociados con una posología de administración 2 veces al día y los costes derivados del copago farmacéutico pueden ser factores determinantes de las tasas de interrupción prematura del tratamiento con ticagrelor observadas en la práctica clínica diaria8–10,12,28. Así, se observa que, en comparación con el clopidogrel, la interrupción del TAPD con ticagrelor fue más precoz y debida a la falta de cumplimiento de los pacientes, mayormente porque no pueden permitírselo. De hecho, confirma esta observación la mediana de tiempo transcurrido hasta la disrupción del TAPD por falta de adherencia, que fue de alrededor de 30 días; curiosamente, coincide con el plazo en el que se renovaría la prescripción del iP2Y12 después el alta.
El registro PARIS fue el primero en señalar que el riesgo isquémico después de la interrupción prematura del TAPD varía en función de la causa subyacente y de la cronología de la interrupción5. No obstante, estudios posteriores han reportado resultados aparentemente contradictorios3,8–11,22–26. Sin embargo, debe enfatizarse que gran parte de esta evidencia observacional previa en situaciones de práctica clínica habitual procede de estudios antiguos, que pueden no reflejar adecuadamente el tratamiento contemporáneo del SCA de nuestro estudio. A pesar de estas limitaciones, los resultados actuales vienen a confirmar los hallazgos del registro PARIS5. Estas similitudes demuestran que, a pesar de los avances sustanciales que se han producido en el tratamiento del SCA desde la publicación original del registro PARIS, la falta de adherencia al TAPD continúa siendo a día de hoy un factor determinante de la efectividad del tratamiento antitrombótico para mejorar el pronóstico de los pacientes con SCA en la práctica clínica cotidiana.
Las discrepancias observadas entre los estudios previos pueden explicarse por diferencias en el diseño, el periodo de inclusión, las poblaciones de estudio, la definición de la falta de adherencia y los objetivos clínicos de los distintos estudios. En comparación con la variabilidad de nuestra cohorte de pacientes no seleccionados, en estudios previos se incluyeron muestras más seleccionadas. Esto, unido a la falta de estandarización para definir y cuantificar la falta de adherencia, dificulta enormemente cualquier intento de generalizar los resultados de estos estudios previos. En cambio, aunque el diseño del presente estudio impide extraer conclusiones causales, el estricto protocolo de seguimiento prospectivo, que incluyó entrevistas telefónicas regulares intercaladas con visitas ambulatorias presenciales, podría haber ayudado a identificar potenciales conductas de falta de adherencia durante el periodo crítico de adherencia inmediatamente posterior al alta, lo que a su vez podría haber puesto en marcha mecanismos e intervenciones destinados a mejorar la persistencia en el TAPD. Así pues, es posible que la detección precoz de las causas de una adherencia subóptima al TAPD explique las tasas observadas de desescalada precoz del tratamiento antiagregante plaquetario inicial para pasar de ticagrelor a clopidogrel a causa de eventos hemorrágicos o la aparición de disnea, lo que de otro modo habría llevado a los pacientes a interrumpir prematuramente el tratamiento antiagregante plaquetario en el presente estudio. La evidencia que respalda esta hipótesis apunta que un retraso en el seguimiento ambulatorio más allá de las primeras 6 semanas después del SCA puede dar lugar a una menor adherencia a la medicación que derive en un peor resultado clínico a corto plazo30. Por último, es posible que los resultados observados reflejen las crecientes preocupación y concienciación respecto a los posibles efectos adversos de los iP2Y12 más potentes, con la correspondiente selección cuidadosa del tipo y una duración óptima del régimen antiagregante basada en el equilibrio más favorable entre los riesgos isquémico y hemorrágico.
En conjunto, nuestros resultados indican claramente que la cronología de la interrupción prematura del TAPD tiene parte crucial en el riesgo de eventos trombóticos recurrentes después de un SCA, cualesquiera sean el modo de abandono como el tipo de iP2Y12 que se suspenda durante el seguimiento. En consonancia con la evidencia existente10, se observa que esta asociación no es lineal a lo largo del tiempo, de tal manera que se evidencia un notable exceso del riesgo de eventos trombóticos durante los primeros meses tras el alta hospitalaria. Hasta la fecha, existen pocos estudios que hayan intentado esclarecer si la asociación entre la interrupción prematura del TAPD y el riesgo de eventos recurrentes después de un SCA estaría moderada por la clase de iP2Y12. Es interesante apuntar que, si bien la incidencia acumulada de MACE asociada con la disrupción del TAPD fue mayor con ticagrelor que con clopidogrel, tras ajustar la duración de la exposición a cada fármaco, se observó que esta asociación se modifica por el momento en que se produce la interrupción prematura del tratamiento, cualesquiera sean el modo de interrupción y el iP2Y12 que se interrumpió. En concordancia con lo reportado en estudios previos6,25, este riesgo fue máximo tras una disrupción del TAPD por falta de cumplimiento, en especial en los primeros 30 días posteriores al alta. Este hallazgo respalda la importancia clínica de la falta de adherencia al TAPD en las primeras semanas después de un SCA y abre interrogantes acerca de la seguridad de duraciones del TAPD ultracortas en situaciones de alto riesgo trombótico.
En este contexto, actualmente se desconoce si la reversibilidad de la unión al receptor P2Y12 y la reversión más rápida del efecto antiagregante tras la interrupción del ticagrelor podría traducirse en un mayor riesgo de eventos trombóticos en comparación con la interrupción del clopidogrel10–12. El presente análisis aporta nuevas evidencias respecto a esta controversia al no encontrar evidencia alguna de un mayor riesgo de eventos trombóticos tras la interrupción prematura y no programada del ticagrelor en comparación con la del clopidogrel durante los 12 meses siguientes a un SCA. Como novedad, el análisis basado en splines reveló que, en comparación con el clopidogrel, el aumento del riesgo de MACE observado después de la disrupción del ticagrelor fue atribuible en gran medida a los ciclos más cortos de TAPD asociados con el modo específico de interrupción del tratamiento, el abandono repentino, más que a una diferencia de efecto protrombótico de la interrupción prematura del ticagrelor en sí. Además, nuestro análisis indica la posibilidad de un punto de inflexión en el tiempo, que se situaría alrededor del tercer mes después del SCA, a partir del cual los riesgos asociados a una potencial interrupción prematura del TAPD podrían ser desdeñables. Estas observaciones, junto con los resultados de los estudios farmacodinámicos31, aportan una evidencia tranquilizadora en cuanto a que no parece que la reversibilidad de la inhibición plaquetaria con ticagrelor en comparación con clopidogrel se traduzca en un efecto rebote diferencial en la reactividad plaquetaria y el consiguiente incremento de riesgo de MACE tras su interrupción. No obstante, teniendo en cuenta el diferente impacto pronóstico asociado con el incumplimiento terapéutico a causa del copago farmacéutico en función de la clase de iP2Y12, deberán dedicarse más esfuerzos a la identificación temprana y la prevención de potenciales conductas de falta de adherencia por la carencia de medios de los pacientes tratados con ticagrelor. De igual modo, este estudio resalta que cualquier avance encaminado a mejorar el asesoramiento a los pacientes sobre la importancia de la adherencia a la medicación y el conocimiento del fundamento del TAPD pueden ser de capital importancia para reducir al mínimo los riesgos relacionados con la falta de adherencia al tratamiento antitrombótico después de un SCA. Todas estas peculiaridades hacen que el registro CREA-ARIAM (Safety and Effectiveness of Switching Between Antiplatelet Agents, identificador de ClinicalTrials.govNCT02500290) destaque respecto a sus predecesores al brindar una oportunidad única de profundizar en la excepcional e indiscutible relevancia pronostica de la interrupción prematura del TAPD en la práctica clínica contemporánea.
LimitacionesEs preciso reconocer algunas limitaciones de este estudio. En primer lugar, no pueden inferirse relaciones causales entre los patrones de interrupción prematura y los resultados clínicos, ya que no se puede descartar por completo la presencia de factores de confusión ocultos o no medidos ni un posible sesgo de detección. No obstante, los resultados de este estudio están respaldados por la gran granularidad de los datos obtenidos, que es difícil de alcanzar en la práctica para la inmensa mayoría de los estudios, y por el hecho de que los datos sobre adherencia fueran prospectivos e independientes del tratamiento asignado y la presencia de eventos clínicos. En segundo lugar, la falta de adherencia fue inicialmente reportada por los propios pacientes, lo que podría implicar una infradetección por sesgo de recuerdo. Sin embargo, para reducir al mínimo este sesgo de medición, el protocolo de estudio exigió una validación («adjudicación») mediante cualquier documentación fuente disponible de todos los potenciales eventos de interrupción prematura identificados durante todo el periodo de seguimiento del estudio. En tercer lugar, no se dispuso de información sobre el nivel socioeconómico y el porcentaje de copago farmacéutico, que son factores que pueden contribuir de manera sustancial a la falta de adherencia a la medicación. No obstante, no parece que esta limitación afectara de manera significativa a los resultados del estudio, dado que solo una pequeña proporción de pacientes notificaron una disrupción por falta de adherencia debida al coste de la medicación. Por último, los análisis de sensibilidad y en diferentes subgrupos no tuvieron la potencia estadística suficiente para mostrar diferencias entre los grupos de estudio, por lo que deben considerarse meros generadores de hipótesis.
CONCLUSIONESEn esta cohorte contemporánea de pacientes con SCA no seleccionados, 1 de cada 12 interrumpió prematuramente el TAPD en los primeros 12 meses tras el evento índice. La falta de adherencia al TAPD se asoció con mayor riesgo de MACE en función del modo y el motivo de la interrupción prematura. Esta asociación fue moderada por la duración del TAPD, que resultó ser el más potente factor predictivo del riesgo trombótico asociado con la interrupción prematura del TAPD. El desproporcionado exceso de eventos trombóticos observado tras la interrupción prematura y no programada del ticagrelor se atribuyó en gran medida a la mayor tasa de disrupción por incumplimiento terapéutico, que conllevó duraciones de TAPD más cortas en comparación con el clopidogrel. Estos resultados exploratorios justifican ahondar en esfuerzos para identificar y prevenir la disrupción temprana del TAPD debida a una potencial falta de adherencia, especialmente entre los pacientes tratados con ticagrelor.
- -
La falta de adherencia al TAPD continúa siendo un importante factor determinante del éxito del tratamiento y de mal pronóstico después de un SCA.
- -
El riesgo cardiovascular después de la interrupción prematura del TAPD varía en función del modo y la cronología de dicha interrupción. Sin embargo, esta evidencia no está exenta de limitaciones, dadas las diferencias existentes en el diseño y la definición de la falta de adherencia en los distintos estudios.
- -
No está claro que el riesgo isquémico después de la interrupción prematura del TAPD difiera en funcióndel iP2Y12 elegido.
- -
En este registro multicéntrico contemporáneo de pacientes con SCA no seleccionados (all-comers), 1 de cada 12 interrumpió prematuramente el TAPD.
- -
La interrupción prematura del TAPD se asoció con un aumento del riesgo de MACE, determinado principalmente por el modo y la cronología de la interrupción, de tal manera que el riesgo máximo fue el observado tras la disrupción por incumplimiento terapéutico en los 90 días posteriores al alta.
- -
Como resultado novedoso, al modelizar el efecto de la interrupción prematura del TAPD en el riesgo de MACE como una función continua de la duración de la exposición al tratamiento, la elección del iP2Y12 no afectó de manera significativa a esta asociación.
La obtención de los datos para este subanálisis contó en parte con el apoyo de una subvención de investigación no condicionada (ESR-17–13127) de AstraZeneca Pharmaceuticals España, SA. Esta empresa no tuvo intervención alguna en el diseño del estudio, la obtención, el análisis o la interpretación de los datos, la redacción del manuscrito ni con la decisión de presentarlo a publicación.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores participaron en la obtención de los datos, tuvieron acceso a los datos pertinentes, realizaron una revisión crítica del manuscrito en cuanto a contenido intelectual importante y participaron en la redacción de la versión inicial, la revisión y la aprobación del manuscrito final para su presentación a publicación. M. Almendro-Delia, J.C. García-Rubira y J.A. Arboleda-Sánchez tuvieron pleno acceso a todos los datos del estudio y asumieron la responsabilidad de la integridad de dichos datos y de la exactitud de su análisis. Concepto y diseño del estudio: M. Almendro-Delia, J.C. García-Rubira; análisis e interpretación de los datos: M. Almendro-Delia, J.C. García-Rubira; validación de criterios de valoración con enmascaramiento: J.C. García-Rubira/M. Almendro-Delia/J.A. Arboleda-Sánchez; versión inicial del manuscrito: M. Almendro-Delia; coordinador del estudio: M. Almendro-Delia; supervisión del estudio: J.C. García-Rubira y J.A. Arboleda-Sánchez.
CONFLICTO DE INTERESESM. Almendro-Delia ha recibido honorarios (pequeños) por conferencias formativas para Eli Lilly Co, Daiichi Sankyo y AstraZeneca y declara haber recibido pagos por consultoría de AstraZeneca y Daiichi Sankyo. Los demás autores no declaran ningún conflicto de intereses.