Las personas con COVID persistente pueden presentar alteraciones de la frecuencia cardiaca (FC), como una FC en reposo (FC-reposo) elevada o una disminución de la variabilidad de la FC, entre otras anomalías. Se cree que estas alteraciones de la dinámica de la FC están ligadas a una disfunción latente del sistema nervioso autónomo y se asocian con un mayor número de síntomas referidos por los pacientes1,2.
En condiciones fisiológicas normales, el diafragma desempeña un papel fundamental en la modulación de la variabilidad de la FC y en la regulación del tono simpático3. La evidencia previa ha sugerido que una mejora de la función muscular podría tener un efecto beneficioso en la función cardiovascular y en el restablecimiento del equilibrio simpaticovagal facilitado por la modulación del ergorreflejo4. Teniendo en cuenta estas consideraciones, se plantea la hipótesis de que, en las personas con COVID persistente que tienen indicadores indirectos de un tono simpático inicial más elevado, la mejora de la función de los músculos respiratorios mediante el entrenamiento de musculatura inspiratoria (EMI) podría aumentar en mayor medida la tolerancia a la actividad física gracias a una regulación de la activación simpática. El objetivo de este subestudio a posteriori del ensayo InsCOVID fue evaluar la influencia de la FC-reposo sobre la capacidad de respuesta a un programa de EMI de 12 semanas por lo que respecta al consumo máximo de oxígeno (VO2 máximo) en pacientes con COVID persistente.
El ensayo InsCOVID fue un ensayo clínico llevado a cabo en un solo centro, con un diseño enmascarado para los evaluadores, en el cual participaron 26 pacientes con COVID persistente. En este ensayo se investigó la repercusión de un EMI domiciliario de 12 semanas, en comparación con la asistencia habitual en práctica clínica sobre el VO2 máximo en personas con síntomas persistentes tras una hospitalización por neumonía grave causada por el coronavirus del síndrome respiratorio agudo 2 (SARS-CoV-2). El diseño y los objetivos principales del ensayo se registraron en Clinical Trials (NCT05279430) y se han publicado con anterioridad5,6. Se obtuvo el consentimiento informado de todos los participantes y el ensayo fue aprobado por el comité de ética de investigación local según lo establecido en la Declaración de Helsinki y en la normativa nacional.
Los criterios de inclusión para los participantes en el estudio fueron los siguientes: a) adultos sintomáticos que hubieran sido hospitalizados con anterioridad a causa de una neumonía por SARS-CoV-2; b) un mínimo de 3 meses después del alta hospitalaria, y c) consentimiento informado. Los criterios de exclusión principales fueron los siguientes: a) incapacidad de realizar una prueba de esfuerzo cardiopulmonar (PECP) máxima basal; b) cardiopatía estructural, valvulopatía o disfunción diastólica estimada mediante ecocardiografía bidimensional; c) enfermedad pulmonar importante; d) existencia de angina o isquemia durante la PECP; e) enfermedad renal crónica (filtración glomerular <60ml/min/1,73 m2); f) anemia (concentración de hemoglobina <12g/dl en mujeres y <13g/dl en hombres), y g) tratamiento con fármacos cronotrópicos negativos o personas portadoras de un marcapasos.
La intervención de EMI se inició con unas instrucciones de respiración diafragmática inicial utilizando un dispositivo que ofrece resistencia a la musculatura inspiratoria. A continuación, los pacientes siguieron un programa de entrenamiento domiciliario que incluía 2 sesiones diarias de 20 minutos a lo largo de 12 semanas, con un nivel de resistencia fijado en el 25-30% de su presión inspiratoria máxima. Las evaluaciones semanales realizadas por un fisioterapeuta permitieron introducir ajustes en los parámetros de resistencia.
Se evaluó la capacidad funcional máxima con el empleo de una PECP incremental y limitada por los síntomas en una bicicleta ergonómica. Se determinó la FC en reposo y en el esfuerzo máximo (FC-esfuerzo). La respuesta de la FC durante la PECP se evaluó mediante la fórmula del índice cronotrópico (IxC)=FC-máxima - FC-reposo/[(220-edad) - FC-reposo)].
Se utilizó un modelo de regresión lineal mixto para analizar los cambios del VO2 máximo entre los tratamientos. Se incluyeron como covariables los valores de edad inicial, sexo, hemoglobina, índice de masa corporal (IMC), presión inspiratoria máxima inicial y los valores iniciales de VO2 máximo. Todos los análisis se llevaron a cabo con el programa STATA 17.0 (StataCorp LP, College Station, EE. UU.).
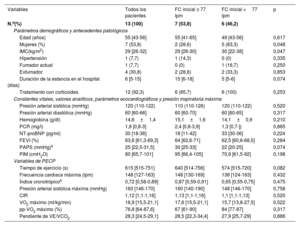
No hubo diferencias significativas basales entre los diversos grupos de tratamiento en el ensayo InsCOVID6. En la tabla 1 se presentan las características basales según la mediana de FC-reposo de los pacientes asignados al grupo de EMI. La mediana de edad fue de 55 (43-56) años y el 46,2% de los participantes fueron mujeres. Globalmente, los pacientes con una FC-reposo más alta eran predominantemente hombres y tenían un IMC inferior, sin que se apreciaran otras diferencias significativas.
Características basales de los pacientes a quienes se aplicó el EMI estratificados según la mediana de frecuencia cardiaca inicial
| Variables | Todos los pacientes | FC inicial ≥ 77 lpm | FC inicial <77 lpm | p |
|---|---|---|---|---|
| N.o(%) | 13 (100) | 7 (53,8) | 6 (46,2) | |
| Parámetros demográficos y antecedentes patológicos | ||||
| Edad (años) | 55 [43-56] | 55 [41-65] | 49 [43-56] | 0,617 |
| Mujeres (%) | 7 (53,8) | 2 (28,6) | 5 (83,3) | 0,048 |
| IMC(kg/m2) | 29 [26-32] | 29 [26-30] | 30 [22-38] | 0,047 |
| Hipertensión | 1 (7,7) | 1 (14,3) | 0 (0) | 0,335 |
| Fumador actual | 1 (7,7) | 0 (0) | 1 (16,7) | 0,250 |
| Exfumador | 4 (30,8) | 2 (28,6) | 2 (33,3) | 0,853 |
| Duración de la estancia en el hospital (días) | 6 [5-15] | 15 [6-18] | 5 [5-6] | 0,074 |
| Tratamiento con corticoides | 12 (92,3) | 6 (85,7) | 6 (100) | 0,253 |
| Constantes vitales, valores analíticos, parámetros ecocardiográficos y presión inspiratoria máxima | ||||
| Presión arterial sistólica (mmHg) | 120 (110-122) | 110 (110-126) | 120 (110-122) | 0,520 |
| Presión arterial diastólica (mmHg) | 60 [60-66] | 60 [60-70] | 60 [60-65] | 0,317 |
| Hemoglobina (g/dl) | 14,6±1,4 | 15,1±1,6 | 14,1±0,9 | 0,210 |
| PCR (mg/l) | 1,8 [0,8-3] | 2,4 [0,8-3,9] | 1,3 [0,7-]) | 0,865 |
| NT-proBNP (pg/ml) | 30 [18-36] | 18 [11-42] | 33 [30-36] | 0,224 |
| FEVI (%) | 63,6 [61,3-69,3] | 64 [62,6-71] | 62,5 [60,6-68,5] | 0,284 |
| PAPS (mmHg)a | 25 [22,5-31,5] | 30 [25-33] | 22 [20-25] | 0,074 |
| PIM (cmH2O) | 80 [65,7-101] | 95 [66,4-105] | 70,9 [61,5-92] | 0,198 |
| Variables de PECP | ||||
| Tiempo de ejercicio (s) | 615 [515-751] | 640 [514-756] | 574 [515-720] | 0,082 |
| Frecuencia cardiaca máxima (lpm) | 148 [127-163] | 148 [130-169] | 138 [124-163] | 0,432 |
| Índice cronotrópicob | 0,72 [0,58-0,89] | 0,87 [0,59-0,91] | 0,65 [0,55-0,75] | 0,475 |
| Presión arterial sistólica máxima (mmHg) | 160 [146-170] | 160 [140-190] | 148 [146-170] | 0,758 |
| CIR | 1,12 [1,1-1,16] | 1,13 [1,1-1,16] | 1,1 [1,1-1,13] | 0,520 |
| VO2 máximo (ml/kg/min) | 16,9 [15,5-21,1] | 17,6 [15,5-21,1] | 15,7 [13,8-27,5] | 0,522 |
| pp-VO2 máximo (%) | 76,8 [64-87,6] | 67 [61-90] | 84 [77-87] | 0,317 |
| Pendiente de VE/VCO2 | 28,3 [24,5-29,1] | 28,5 [22,3-34,4] | 27,9 [25,7-29] | 0,886 |
CIR, cociente de intercambio respiratorio; FC, frecuencia cardiaca; FEVI, fracción de eyección ventricular izquierda; IMC, índice de masa corporal; lpm, latidos por minuto; NT-proBNP, propéptido natriurético tipo B aminoterminal; PAPS, presión arterial pulmonar sistólica; PCR, proteína C reactiva; PECP, prueba de esfuerzo cardiopulmonar; PIM, presión inspiratoria máxima; pp-VO2 máximo, porcentaje del consumo máximo de oxígeno predicho; VE/VCO2, eficiencia ventilatoria; VO2 máximo, consumo máximo de oxígeno.
Los datos se expresan en forma de número (%), media±desviación estándar o mediana [intervalo intercuartílico]. Se compararon las variables iniciales de los distintos grupos de tratamiento con la prueba de la t de Student para datos no emparejados, la prueba de la U de Mann-Whitney o la prueba de la χ2 según procediera.
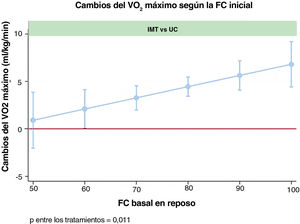
En comparación con los pacientes del grupo de asistencia habitual, los pacientes asignados al grupo de EMI mostraron un mayor incremento del VO2 máximo a las 12 semanas si presentaban una FC-reposo más alta en la situación basal (valor de p para la comparación de los grupos =0,011), como se muestra en la figura 1.
Por lo que respecta a la respuesta de la FC al tratamiento, se observó un aumento estadísticamente significativo tanto de la FC-máxima como del IxC (Δ+11,42; intervalo de confianza del 95% [IC95%], 0,33-22,5; p=0,044 y Δ+0,13, IC95%, 0,01-0,26; p=0,046, respectivamente) en el grupo de EMI en comparación con el grupo de AH. A las 12 semanas no hubo diferencias significativas con el tratamiento por lo que respecta a la FC-reposo en el grupo de EMI en comparación con el grupo de AH (Δ-3,85; IC95%,-15,8 a 8,06; p=0,509).
El resultado principal de este subestudio es que la FC-reposo inicial está relacionada con la respuesta de mejora de la capacidad aerobia máxima tras un EMI. Además, se observó una mejora significativa de la respuesta de la FC al ejercicio. Globalmente, estos resultados resaltan el papel del EMI como tratamiento sencillo y útil para mejorar la capacidad aerobia en los pacientes con COVID persistente, sobre todo en los que tienen una FC-reposo más alta. Cabe destacar que los pacientes que presentaron una FC-reposo más alta y una mayor mejora de la capacidad funcional fueron, en su mayor parte, hombres con un IMC más bajo. Los resultados presentados en este caso aportan una perspectiva importante respecto a los trabajos previos6 ya que esclarecen qué pacientes obtienen un mayor beneficio con el empleo del EMI.
A pesar de la falta de un conocimiento claro de los mecanismos precisos a través de los cuales el EMI mejora la capacidad de ejercicio en las personas con COVID persistente, se presupone que el EMI, facilitado por la modulación del sistema nervioso autónomo cardiaco y periférico, puede mejorar la respuesta de la FC al ejercicio, así como el ergorreflejo muscular3,4, con la consiguiente mejora de la tolerancia al esfuerzo a corto plazo.
La principal limitación de este subestudio a posteriori es su pequeño tamaño muestral, que aumenta el riesgo de error de tipo II y reduce la potencia estadística para la detección de efectos significativos. No obstante, los resultados de este estudio aportan una perspectiva útil y justifican la realización de nuevas investigaciones sobre los mecanismos fisiopatológicos subyacentes a través de los cuales el EMI mejora la tolerancia al esfuerzo en los pacientes con COVID persistente y su posible aplicación en otros trastornos cardiovasculares.
FINANCIACIÓNEste trabajo fue financiado en parte por una subvención de la Sociedad Española de Cardiología, Investigación Clínica en Cardiología, subvención SEC 2021.
CONSIDERACIONES ÉTICASSe obtuvo el consentimiento informado de todos los participantes y el comité de ética de investigación local aprobó el ensayo en consonancia con los principios establecidos en la Declaración de Helsinki y la normativa nacional. En la elaboración de este artículo se han tenido en cuenta los posibles sesgos de sexo/género.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se utilizó ninguna herramienta de inteligencia artificial.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores han leído y aprobado el original.
CONFLICTO DE INTERESESNinguno.