En la actualidad, un gran número de pacientes con cardiopatía congénita (CC) ha alcanzado la edad adulta, por lo que la problemática de la anticoncepción y los riesgos en caso de embarazo deberían abordarse en todas las jóvenes con estas enfermedades y ofrecerles, en el momento adecuado (posiblemente al inicio de la adolescencia), consejo preconcepcional con el objetivo de prevenir riesgos evitables y ayudarlas en la planificación de su futuro. Para ello, a la vez que para lograr un cuidado adecuado del embarazo, el feto, el parto y el posparto, es importante que un equipo multidisciplinario, constituido por cardiólogos, obstetras, ginecólogos, anestesiólogos, neonatólogos y expertos en medicina fetal, elabore y ponga en práctica unos protocolos de actuación consensuados.
Palabras clave
Actualmente, el 85-90%1 de los pacientes que nacen con una anomalía cardiaca alcanzan la edad adulta, y es cada vez mayor el número de mujeres con una CC, algunas de ellas complejas y sólo parcialmente reparadas, que alcanzan la edad de procrear. En consecuencia, el cardiólogo dedicado al control de este tipo de pacientes, en colaboración con el ginecólogo y/u obstetra, tendrá que asumir el reto de valorar e informar sobre el riesgo materno y fetal que un embarazo puede suponer y, cuando sea necesario, participar en la elección del método de anticoncepción más adecuado, o en el control de la gestación, el parto y el posparto, intentando minimizar posibles complicaciones tanto maternas como fetales. Para facilitar la descripción de toda esta temática, dividimos este capítulo en: a) sistema cardiovascular y embarazo; b) riesgo materno y fetal de un embarazo; c) consejo preconcepcional; d) control del embarazo, parto y puerperio, y e) métodos de anticoncepción.
SISTEMA CARDIOVASCULAR Y EMBARAZOEl embarazo comporta una serie de cambios fisiológicos en el sistema cardiovascular (tabla 1)2, que se inician ya en el primer trimestre y alcanzan su máximo al final del segundo y el inicio del tercero, pero que se prolongan hasta 1,5-2 meses tras el parto; cambios que, ante la presencia de una cardiopatía, pueden ser mal tolerados y conducir al desarrollo de complicaciones, que podemos resumirlas en:
- 1.
Descenso de las resistencias vasculares sistémicas (RVS), presente ya desde el primer trimestre (30% a las 8 semanas), y relacionada con el desarrollo de un lecho de baja resistencia, como la placenta. El resultado es una ligera disminución de la presión arterial (PA) sistémica media, secundaria fundamentalmente a un descenso de las cifras diastólicas. Ello, junto con la disminución del retorno venoso por compresión del útero grávido, explica la clínica de hipotensión postural tan frecuente en mujeres embarazadas.
- 2.
Progresivo incremento del gasto cardiaco (GC), el cual llega a sus valores máximos (40-43% por encima de los valores antes del embarazo) hacia el final del segundo trimestre, principios del tercero. Obedece a un incremento del volumen sistólico (30%) y, en menor medida, a un incremento de la frecuencia cardiaca (FC) (10–15 lat/min).
- 3.
Incremento del volumen plasmático y, en menor proporción, del volumen de glóbulos rojos, lo que explica la anemia relativa de la embarazada.
- 4.
Hipercoagulabilidad sanguínea, que evita fenómenos hemorrágicos durante el desarrollo trofoblástico y, especialmente, durante el parto, pero ocasiona un aumento del riesgo tromboembólico (6 veces más alto a lo largo de la gestación y 11 veces más elevado durante el puerperio).
Adaptación cardiovascular durante el embarazo
| Media de cambio | |
| Volumen sanguíneo | +35% |
| Gasto cardiaco | +40-43% |
| Volumen sistólico | +30% |
| Frecuencia cardiaca | +15-17% |
| Resistencia vascular sistémica | −15-21% |
| Presión arterial media | Cambio no significativo |
| Presión arterial sistólica | −3-5mmHg |
| Presión arterial diastólica | −5-10mmHg |
| Presión venosa central | Cambio no significativo |
| Presión oncótica del plasma | −14% |
| Hemoglobina | −2,1g/dl |
Modificado de Abbas et al2.
Durante el parto, el dolor y la ansiedad, a la vez que cada contracción uterina, con la consiguiente autotransfusión de 300-500ml de sangre a la circulación sistémica, conducen a un nuevo aumento del GC (y consecuentemente de la PA), que puede elevarse un 80% por encima del GC previo al embarazo, con un nuevo incremento tras el alumbramiento, al cesar la compresión de la vena cava inferior y producirse una nueva autotransfusión a partir de los sinusoides placentarios, con la expulsión de la placenta.
La situación hemodinámica no vuelve a la situación previa al embarazo hasta 8-12 semanas después del parto, especialmente si éste ha sido vía cesárea o va seguido de un periodo de lactancia, dato que obliga a prolongar el control cardiológico durante ese periodo.
Es importante tener en cuenta que si practicamos un ecocardiograma a una mujer gestante, podremos encontrar una ligera dilatación de cavidades, a la vez que si está afecta de una estenosis valvular, podemos registrar por Doppler un aumento de la velocidad y del gradiente transobstrucción, en relación con el estudio pregestacional, sin que ello se corresponda con una reducción del área valvular.
RIESGO MATERNO Y FETAL DE UN EMBARAZO: CONSEJO PRECONCEPCIONALCreemos que es importante subrayar que la presencia de una CC no es sinónimo de «contraindicación absoluta para un embarazo». Los facultativos a cargo de estas pacientes deberían proporcionar el consejo adecuado, evitando situaciones como las comunicadas por Kovacs et al3, en donde en un 18% de 116 mujeres con una CC a las que se había aconsejado evitar o posponer un embarazo, no había una razón médica para ello, y en el 50% en las que no se había desaconsejado, existía contraindicación para éste. No obstante, teniendo en cuenta los cambios que el embarazo produce en el sistema cardiovascular, no es difícil entender que ante determinadas cardiopatías, y dependiendo de su corrección4, situación clínica y clase funcional, el embarazo puede representar una situación de riesgo y una fuente de posibles complicaciones, tanto para la madre como para el feto, en el que, además, hay que tener en cuenta la posible recurrencia de una anomalía cardiaca.
En el artículo de Siu et al5, basado en un estudio prospectivo, multicéntrico (Canadian CARPREG trial), donde se incluyó a 562 mujeres cardiópatas, se comunicó que un 13% de los embarazos se acompañó de diversas complicaciones cardiacas maternas: edema agudo de pulmón, arritmias, accidente vascular cerebral y/o muerte cardiaca. Los autores identificaron una serie de variables previas al embarazo, y establecieron una puntuación para calcular el riesgo de complicaciones cardiacas maternas, durante o inmediatamente después de una gestación, las cuales son: a) eventos cardiacos previos o arritmias; b) clase funcional (CF) elevada (> II de la NYHA) y/o cianosis (saturación arterial de oxígeno [SaO2] < 90%); c) lesiones obstructivas a nivel del corazón izquierdo (área valvular mitral < 2cm2, área valvular aórtica < 1,5cm2, gradiente pico a la eyección ventricular izquierda > 30mmHg), y d) disfunción sistólica del ventrículo sistémico (FE < 40%); puntuación que ellos mismos validaron mediante la comprobación de que el riesgo estimado era muy similar al observado. Ante la ausencia de cualquiera de estos predictores, el riesgo de que la madre presente un evento cardiaco se sitúa alrededor del 5%, que se eleva al 27% si existe un predictor, y al 75% cuando hay dos o más predictores. Un estudio posterior6 puso de manifiesto que se podía mejorar el «índice de CARPREG»5 mediante la inclusión, dentro de la puntuación del riesgo, de otras variables, como baja contractilidad del ventrículo subpulmonar y/o insuficiencia valvular pulmonar severa. A todo ello hay que añadir, ya que es uno de los factores de riesgo más importante, una posible hipertensión arterial pulmonar (HAP), que cuando supera el 75% de las cifras de PA sistémica, la mortalidad tanto fetal como materna alcanza el 30-50%7. En cuanto al riesgo en el hijo, aparte de la posible recurrencia de una cardiopatía, las complicaciones suelen concentrarse en: aborto, retraso de crecimiento intrauterino y prematuridad, con todas las complicaciones que de ello puedan derivarse (distrés respiratorio, hemorragia intracraneal, enterocolitis necrosante, etc.). En el mismo estudio de Siu et al5, un 20% de las gestaciones presentaron diferentes tipos de complicaciones fetales o neonatales, especialmente prematuridad y bajo peso para la edad gestacional, relacionados también con factores de riesgo que, en gran parte, coincidían con los mencionados previamente: a) CF elevada (> II de la NYHA) y/o cianosis; b) cardiopatías que cursan con obstrucción a nivel del corazón izquierdo; c) anticoagulación; d) tabaquismo, y e) gestación múltiple. Su ausencia se asoció a una mortalidad fetal/neonatal del 2%, que se elevó al 4% ante la presencia de uno o más de ellos. No obstante, las pérdidas fetales/neonatales pueden llegar hasta un 40% en madres con síndrome de Eisenmenger7–11 y los abortos, especialmente durante el primer trimestre de embarazo, hasta un 39-50% tras una intervención tipo Fontan11–13. Así pues, la identificación de estas variables o predictores de complicaciones, una edad materna < 20 o > 35 años14 y la necesidad de tratamiento farmacológico durante el embarazo son puntos clave y de gran ayuda para dar un consejo pregestacional.
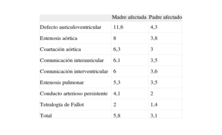
El riesgo de recurrencia de una cardiopatía congénita en el hijo es muy variable (tabla 2)15, dependiendo del tipo de cardiopatía y de qué progenitor es el afectado, siendo mayor cuando la portadora de la anomalía cardiaca es la madre. Puede oscilar desde un 1,4%, como ocurre en la tetralogía de Fallot (TF), cuando el afectado es el padre15, a un 50% en enfermedades de transmisión autosómica dominante, como es el síndrome de Marfan, o CC asociadas al síndrome de microdeleción del cromosoma 22q11. En estas últimas, es muy importante identificar la presencia de algunas alteraciones extracardiacas para sospechar la presencia de la mutación y solicitar el correspondiente estudio genético16,17.
Riesgo de recurrencia (%) en hijos de progenitores con una cardiopatía congénita
| Madre afectada | Padre afectado | |
| Defecto auriculoventricular | 11,6 | 4,3 |
| Estenosis aórtica | 8 | 3,8 |
| Coartación aórtica | 6,3 | 3 |
| Comunicación interauricular | 6,1 | 3,5 |
| Comunicación interventricular | 6 | 3,6 |
| Estenosis pulmonar | 5,3 | 3,5 |
| Conducto arterioso persistente | 4,1 | 2 |
| Tetralogía de Fallot | 2 | 1,4 |
| Total | 5,8 | 3,1 |
Modificado de Nora15.
Por problemas de espacio no podemos abordar de forma individualizada las posibles complicaciones tanto maternas como fetales y/o neonatales que cada CC puede conllevar, por lo que sólo vamos a referirnos a algunas de ellas, ya sea por su mayor frecuencia o por estar incluidas, según la clasificación de la OMS (tabla 3), en los grupos con moderado y alto riesgo (grupos 3 y 4) (tabla 4)18,19 y requerir un control especializado en centros de referencia.
Clasificación de la OMS del riesgo de un embarazo en una mujer con una cardiopatía congénita
| Clase | Respecto a población general (morbimortalidad) |
| 1 | Riesgo similar |
| 2 | Riesgo ligeramente superior |
| 3 | Incremento significativo del riesgo |
| 4 | Muy alto riesgo (embarazo contraindicado) |
Modificado de Thorne et al18,19.
Clasificación del riesgo de un embarazo según el tipo de cardiopatía congénita
| Riesgo | Tipo de cardiopatía |
| Clase 1 |
|
| Clase 2 | CIA no corregidaTF corregida y no complicadaMuchas arritmias |
| Clase 2 o 3 (individualizar) | Alteración ligera de la función ventricularMiocardiopatía hipertróficaValvulopatía no incluible en clase 4Prótesis valvulares biológicas no incluibles en clase 4Síndrome de Marfan sin dilatación aórticaTrasplante cardiaco |
| Clase 3 | Prótesis valvulares mecánicasVentrículo derecho sistémicoTras intervención tipo FontanCC cianóticaOtras CC complejas |
| Clase 4 |
|
AO: aorta; CAP: conducto arterioso persistente; CC: cardiopatía congénita; CF (NYHA): clase funcional de la New York Heart Association; CIA: comunicación interauricular; CIV: comunicación interventricular; DVPA: drenaje venoso pulmonar anómalo; Ea: extrasístole auricular; EP: estenosis pulmonar; Ev: extrasístole ventricular; FE: fracción de eyección; HP: hipertensión pulmonar; IM: insuficiencia mitral; TF: tetralogía de Fallot; VI: ventrículo izquierdo. Adaptada de Thorne et al18.
En las CC con cortocircuito e hiperaflujo pulmonar, la disminución de las RVS y, en consecuencia, la disminución del cortocircuito izquierdaderecha pueden explicar que, en ausencia de HAP, la gestación sea bien tolerada. Ello es especialmente aplicable a mujeres con una CIA, especialmente de tipo ostium secundum, situación de la que se dispone de mucha información. No obstante, es necesario recordar el mayor riesgo de arritmias supraventriculares, especialmente ante defectos grandes y en mujeres de mayor edad, y la posibilidad de embolias paradójicas, más teniendo en cuenta la mayor prevalencia de los fenómenos tromboembólicos en la mujer gestante20. En consecuencia, si está indicado, se recomienda el cierre del defecto antes de la gestación.
Valvulopatía aórticaNos referiremos únicamente a la estenosis aórtica (EA), generalmente secundaria a una válvula aórtica bicúspide, dado que la insuficiencia aórtica, debido a la disminución de la RVS y el incremento de la FC propios del embarazo, suele ser mejor tolerada. En cambio, en la EA, el aumento de la FC y del volumen sanguíneo pueden conducir a un aumento de las presiones telediastólicas del ventrículo izquierdo y a la aparición de signos de insuficiencia cardiaca e isquemia miocárdica; además, dada la incapacidad de aumentar el GC que la lesión comporta, la caída de las RVS y/o los posibles cambios en la precarga pueden facilitar la aparición de episodios de hipotensión. Es importante una correcta valoración de la severidad de la EA previa al embarazo. Ante una obstrucción significativa, se recomendará la práctica de una valvuloplastia aórtica (ya sea vía percutánea o quirúrgica) o, en caso necesario, la sustitución valvular por una prótesis que, en principio, debería ser biológica (véase «Prótesis y anticoagulación»). En general, si la paciente está asintomática y el gradiente sistólico máximo pregestacional es < 80mmHg o el gradiente medio es < 50mmHg, el embarazo suele ser bien tolerado. La práctica de una prueba de esfuerzo con un ascenso adecuado de la PA y/o ausencia de arritmias y/o cambios del ST puede ser de ayuda19,21.
En cuanto a los hijos de madres con EA moderada y/o severa, se han publicado mayor incidencia de prematuridad, retraso de crecimiento intrauterino y menor peso al nacer22, a lo que se debe añadir el alto porcentaje de recurrencia propio de la válvula aórtica bicúspide23,24.
Su posible asociación con una dilatación de la raíz aórtica/aorta ascendente es un dato importante, ya que la observación de un diámetro > 4,5cm, según las últimas guías de American College of Cardiology/American Heart Association publicadas25, si bien con un nivel de evidencia C, comporta informar a la paciente de una importante elevación del riesgo.
Coartación aórticaNo nos referiremos a la coartación aórtica (CoA) nativa, ya que actualmente la mayoría de las mujeres en edad de procrear han sido sometidas a una corrección de la anomalía, y es importante valorar el resultado de ésta, a la vez que las posibles anomalías asociadas, especialmente una valvulopatía aórtica por válvula aórtica bicúspide, y/o una dilatación de la raíz aórtica/aorta ascendente; debemos recordar los cambios que la gestación produce en la pared de los vasos y consecuentemente en la aorta.
Los estudios con un número aceptable de pacientes se han llevado a cabo en mujeres con CoA corregida por técnicas quirúrgicas (no por técnicas percutáneas) y han puesto de manifiesto que el embarazo suele ser bien tolerado, aunque la incidencia de hipertensión arterial (HTA) sistémica e incluso, según algunos autores, de preeclampsia es más alta que en la población general26. Un dato relevante es que el riesgo de rotura y disección aórtica, aunque bajo, no desaparece totalmente después de su corrección, especialmente si coexiste una dilatación de aorta ascendente, y suele presentarse durante el tercer trimestre de embarazo o en el parto y/o el puerperio. Los bloqueadores beta-adrenérgicos pueden ser una buena opción ante la existencia de HAS y/o dilatación aórtica.
En cuanto al feto/neonato, se ha publicado27 un mayor número de abortos espontáneos, pero el dato más importante es el porcentaje de recurrencia de la cardiopatía, que según Nora15 alcanza el 6,3%.
Síndrome de MarfanEl consejo pregestacional debe abordar: a) el 50% de riesgo de recurrencia del síndrome (transmisión autosómica dominante), y b) el riesgo de complicaciones cardiovasculares, especialmente disección y/o rotura aórtica, con la consecuente repercusión en la viabilidad del feto. En el síndrome de Marfan, incluso sin dilatación de la aorta, el riesgo de disección aórtica se sitúa alrededor del 1%19, y es del 10% en caso de dilatación aórtica; si se produce y requiere intervención quirúrgica (disección tipo A), la mortalidad materna es elevada (22%)28 y la fetal, dada la necesidad de circulación extracorpórea, alcanza el 50%. Como variables que en una paciente con síndrome de Marfan contraindicarían una gestación, podemos citar: un diámetro de la raíz aórtica > 40mm (algunos autores29,30 indican 44mm); dilatación progresiva de la aorta; disección aórtica previa; historia familiar de disección aórtica, y posible valvulopatía severa asociada. Los bloquadores beta-adrenérgicos están indicados si hay dilatación aórtica.
Cardiopatías congénitas cianóticasNo corregidasLa caída de las RVS propia del embarazo conlleva un aumento del cortocircuito derecha-izquierda y, consecuentemente, un incremento del grado de hipoxemia arterial. Ello puede repercutir tanto en la madre como en el hijo, pero según el trabajo de Presbitero et al31, en el que no se incluyó a pacientes con síndrome de Eisenmenger, el hijo es el más perjudicado, con un número elevado de abortos y prematuridad. Un marcador indirecto del pronóstico puede ser la SaO2 e, indirectamente, la hemoglobina (Hb) en sangre previas al embarazo. Si la SaO2 es > 85% y la Hb no supera los 19-20g/ dl, el embarazo suele llegar a término31.
Entre las CC cianóticas, un capítulo aparte corresponde al síndrome de Eisenmenger, en el que el embarazo está totalmente contraindicado, dado el alto índice de complicaciones tanto fetales como maternas9. Según la recopilación de datos publicados en la revisión que sobre el síndrome de Eisenmeger hicieron Vongpatanasin et al10, la mortalidad materna relacionada con el embarazo se sitúa alrededor del 45%. La muerte suele producirse durante el parto o en la primera semana del puerperio, y es secundaria a fenómenos trombembólicos (44%), hipovolemia (26%) o preeclampsia (18%); no parece que el tipo de parto, vaginal o por cesárea, modifique este porcentaje. Confirmando dichos hallazgos, Weiss et al7, en su artículo sobre embarazo en mujeres con una vasculopatía arterial pulmonar, basado también en la suma de información publicada entre 1978 y 1996 por distintos centros de diversos países, publicaron una mortalidad materna del 36% en las pacientes con síndrome de Eisenmenger, del 30% cuando el diagnóstico era hipertensión arterial pulmonar idiopática y del 56% en otros tipos de hipertensión arterial pulmonar secundaria. De las 26 muertes, 23 ocurrieron en los primeros 30 días del puerperio, y sus causas fueron crisis de hipertensión pulmonar e insuficiencia cardiaca refractaria en 13 casos, muerte súbita en 7, tromboembolia pulmonar en 3, tromboembolia cerebral en 1 y rotura de la arteria pulmonar en 1.
En cualquier caso, si la paciente quiere seguir adelante con la gestación, es necesario un control muy estricto, con la participación de diferentes especialistas (obstetras, cardiólogos, anestesiólogos, etc.).
CorregidasComentaremos únicamente la TF tras corrección anatómica, en la que, si la corrección ha sido buena, el embarazo suele ser bien tolerado32. No ocurre lo mismo cuando hay lesiones residuales o secuelas de la intervención con repercusión hemodinámica significativa, como puede ser una insuficiencia valvular pulmonar severa y, especialmente, una disfunción ventricular derecha más que leve6.
La tasa de recurrencia de cardiopatía congénita se sitúa alrededor del 2–4,8%15,32 si se excluye a los pacientes afectos de síndrome de DiGeorge. Ciertamente, es necesario poner énfasis en que, ante pacientes con anomalías troncoconales, es importante descartar la microdeleción 22q11, puesto que ello comporta un riesgo de recurrencia del 50%.
Prótesis valvulares y anticoagulación33Uno de los problemas todavía no resueltos es qué tipo de válvula aconsejar a una enferma en edad de procrear (biológica o mecánica), más teniendo en cuenta que durante la gestación hay un estado de hipercoagulabilidad que facilita el desarrollo de fenómenos tromboembólicos. Las bioprótesis valvulares tienen la ventaja de no necesitar anticoagulación, pero tienen el problema de su deterioro progresivo y la necesidad de recambio valvular. Sin duda, y como han puesto de manifiesto diferentes estudios, este deterioro es más rápido en el enfermo joven que en el viejo, y según algunos estudios, se ve facilitado por el embarazo34. Las prótesis mecánicas requieren anticoagulación crónica, lo que, independientemente del tipo de fármaco utilizado, es un factor de riesgo de prematuridad y bajo peso. Además, los antagonistas de la vitamina K cruzan la placenta y desde hace años es conocido su efecto teratógenico, especialmente si se administran entre las semanas 6 y 12 de gestación (embriopatía warfarínica; riesgo total, 6%), si bien el riesgo de embriopatía parece que depende de la dosis, de tal forma que en pacientes que requieren dosis de warfarina < 5mg el riesgo es < 3%35. Las heparinas no fraccionadas no atraviesan la barrera placentaria y, por lo tanto, no tienen ningún efecto teratogénico para el feto, pero la incidencia de complicaciones trombóticas, aun con controles de anticoagulación óptimos, es mayor que con los dicumarínicos, y es superior la mortalidad registrada durante la gestación. En cuanto a las heparinas de bajo peso molecular (HBPM), tampoco atraviesan la barrera placentaria, por lo que no implican riesgo de embriopatía, pero estudios preliminares demostraron que la incidencia de complicaciones trombóticas es muy alta, incluso mayor que con las otras heparinas, por lo que en caso de utilización es fundamental el control mediante anti-Xa.
En presencia de prótesis mecánica no hay ningún tipo de anticoagulación idónea para madre y feto. No hay consenso entre expertos excepto que, sea cual fuere el anticoagulante utilizado, se deben utilizar las dosis plenas para conseguir el efecto anticoagulante terapéutico indicado y monitorizarlo de forma adecuada. Las guías de práctica clínica europeas36,37, sobre todo para mujeres que necesitan dosis bajas de anticoagulantes orales, indican la posibilidad de mantener los anticoagulantes orales durante el primero, el segundo y parte del tercer trimestre, hasta la semana 36; seguidamente se cambia a heparina, fármaco que se suspendería durante el parto, se reiniciaría a las 4-6h del expulsivo (12h después si el parto ha sido por cesárea) y se mantendría hasta que los anticoagulantes orales, que se empezarían a dar de nuevo, aproximadamente a las 24h del parto, lograsen un INR adecuado.
CONTROL DE EMBARAZO, PARTO Y PUERPERIOLa planificación se producirá en una primera visita, que debe realizarse en cuanto se confirme la gestación.
Primera visitaIdealmente la paciente ya conoce el riesgo gestacional ligado a su cardiopatía por el consejo gestacional realizado en la consulta de asesoramiento reproductivo38, aunque aprovechamos esta primera visita para asegurar que los conoce y asume. Se reevalúa el estado funcional y la situación basal de la paciente mediante exploración física completa, SaO2, ECG y ecocardiograma. Si la paciente recibe algún tratamiento farmacológico, se evalúa la necesidad de su administración y, en caso de perfil no seguro, la conveniencia de suspenderlo o sustituirlo39 (véase el apartado de fármacos y gestación).
Seguimiento durante la gestaciónDado que la mayoría de los obstetras tienen poca experiencia con pacientes con cardiopatía, es aconsejable derivar a las pacientes a un centro con experiencia o mejor a una unidad de obstetricia especializada en pacientes con esta patología. Se realizará control estricto de peso y se descartará la aparición de complicaciones inherentes a la gestación que puedan suponer mayor riesgo para la paciente (anemia, preeclampsia y diabetes gestacional)38. Las ecografías para valorar el crecimiento fetal se realizarán mensualmente a partir de la semana 28, así como para el control del bienestar fetal en las últimas semanas de la gestación. Se debe realizar ecografía fetal precoz y estudiar el pliegue nucal entre las semanas 11 y 13 y, dado el mayor riesgo de cardiopatía, ecocardiograma fetal precoz a las 14-16 semanas, confirmándolo a la semana 20, con ecocardiografía completa de la anatomía cardiaca. Si se produce amenaza de parto pretérmino, se debe evitar los betamiméticos.
Fármacos durante la gestación, el parto y el pospartoDurante la gestación, dados los cambios en el volumen plasmático y en las proteínas, las propiedades farmacocinéticas se pueden modificar y puede ser necesario el ajuste de dosis. La mayoría de los fármacos utilizados en cardiología atraviesan la placenta, con lo que se expone al feto a los efectos farmacológicos no deseables y/o teratogénicos (tabla 5); algunos fármacos pueden llegar a la leche materna y exponer al neonato a sus efectos. Así, antes de administrar un fármaco a una gestante debe evaluarse la relación riesgo-beneficio y administrarlo sólo en caso de indicación clara39, estricta necesidad y ausencia de otra opción terapéutica.
Fármacos y gestación
| Fármacos seguros | Fármacos contraindicados |
| Vasodilatadores | |
| Nitratos | IECA |
| Hidralazina | ARA-II |
| Antiarrítmicos | |
| Atenolol, propanolol | Amiodarona |
| Digoxina | |
| Flecainida | |
| Antiagregantes | |
| Aspirina | |
| Diuréticos | |
| Hidroclorotiazida | Espironolactona |
| Furosemida | |
| Antihipertensivos | |
| Labetalol | No aplicar guías generales HTA esencial |
| Hidralazina | |
Adaptada de Uebing et al41.
En caso de taquicardia supraventricular, las maniobras vagales y la adenosina son seguras. La cardioversión eléctrica no está contraindicada y debe realizarse si hay inestabilidad hemodinámica materna. Como profilaxis de taquicardias supraventriculares o ventriculares, los bloqueadores beta-adrenérgicos son los fármacos de elección. La presencia de un desfibrilador automático implantado no contraindica la gestación40.
Insuficiencia cardiacaLos IECA y los ARA-II, especialmente durante el segundo y el tercer trimestre de gestación, están totalmente contraindicados, ya que pueden producir malformaciones renales graves en el feto; en caso necesario, deben sustituirse por hidralazina y nitratos. Tampoco se puede utilizar la espironolactona.
En caso de decompensaciones no manejables médicamente y en pacientes severamente sintomáticas, puede contemplarse el intervencionismo, con protección abdominal. Si se requiere cirugía, se considera que el porcentaje de pérdida fetal es del 50%.
Manejo durante parto y pospartoTanto el parto como la monitorización posparto deben planificarse cuidadosamente, de antemano y de forma multidisciplinaria. En comparación con la cesárea, el parto vaginal implica menos complicaciones maternas y fetales, ya que causa menos cambios de volemia, sangrado y riesgo de complicaciones trombóticas. En general, el parto vaginal de inicio espontáneo es el de elección, siempre con anestesia epidural y monitorización materna y evitando periodos expulsivos prolongados mediante la instrumentalización41,42.
Sólo se indicará cesárea cuando haya un motivo obstétrico o en pacientes con síndrome de Marfan y dilatación aórtica, en pacientes en las que la situación clínica impida cualquier tipo de esfuerzo y/o que llegan al parto con tratamiento anticoagulante oral, con el consiguiente aumento del riesgo de hemorragia intracraneal neonatal en relación con el traumatismo del canal del parto.
Sin embargo, la mayoría de las complicaciones no se producen durante el parto, sino durante el puerperio, especialmente en las primeras 24-48h, cuando los cambios de volumen plasmático en relación con la contracción uterina pueden descompensar a las pacientes. Es fundamental la monitorización continua de la paciente y de su balance hídrico, evitando la administración de oxitocina en bolo (debe administrase en perfusión). En casos de alto riesgo, especialmente en el síndrome de Eisenmenger, la monitorización hospitalaria debería prolongarse 1 semana43.
No existe contraindicación para la lactancia materna y, en caso de que se desee inhibirla, deben evitarse los tratamientos farmacológicos en dosis única, por la posible hipotensión arterial que puede ser deletérea en pacientes con hipertensión arterial pulmonar severa.
Tras las 12h de retirada del catéter peridural, se recomienda, tanto en parto vaginal como en cesárea, la administración de HBPM a dosis profilácticas. Aunque las guías no recomiendan la profilaxis de la endocarditis excepto en casos de muy alto riesgo44, su uso en la práctica clínica es frecuente.
MÉTODOS ANTICONCEPTIVOSLos métodos de barrera pueden ser una alternativa en situaciones puntuales y con relaciones sexuales esporádicas; además, tienen el valor añadido de prevenir las enfermedades venéreas, pero también el inconveniente de un alto riesgo de fallo, es decir, una eficacia muy baja (se aumenta su eficacia si se añade una crema espermicida), por lo que en pacientes en alto riesgo no son recomendables. En caso de fallo en el uso del preservativo, la anticoncepción poscoital o «del día después» es segura, independientemente de la cardiopatía, dado que el componente es únicamente un progestágeno (levonorgestrel) sin riesgo trombogénico.
Los anticonceptivos orales combinados no deben utilizarse en las pacientes con cardiopatías de alto riesgo, dado el potencial efecto trombogénico.
Los anticonceptivos del tipo minipíldora, con sólo componente progestágeno, presentan un perfil seguro para el sistema cardiovascular, con una tasa de fallos ligeramente superior al de los anticonceptivos orales combinados. Su forma de presentación habitual es oral (Cerazet®), pero las inyecciones depot están especialmente indicadas en adolescentes con mal cumplimiento terapéutico. A las pacientes en que vemos una buena respuesta al progestágeno vía oral, se les puede ofrecer la posibilidad de implante intradérmico con una duración de 2 años.
La opción de dispositivo intrauterino con progesterona (Mirena) es una opción válida, especialmente en pacientes con gestación previa.
La contracepción definitiva mediante ligadura tubárica puede ser una opción en casos de riesgo prohibitivo. No se recomienda la esterilización del varón de la pareja (vasectomía), dada la práctica irreversibilidad de la técnica y la posibilidad de que cambios futuros, como separación, divorcio, muerte, etc., y la formación de una nueva pareja puedan conducir al deseo de ser padre.
CONCLUSIONESComo conclusión de todo lo comentado en los apartados anteriores, es fácil deducir la importancia de proporcionar a las pacientes con una cardiopatía congénita un óptimo asesoramiento y un máximo control en todos los aspectos ligados a la reproducción. Para ello, en la UCCAA Vall d'Hebron se aconseja a todas las adolescentes y mujeres jóvenes con una CC hemodinámicamente significativa realizar una consulta a la Unidad de Asesoramiento Reproductivo, donde un cardiólogo experto en CC y un ginecólogo, en función de su cardiopatía, su estado funcional y sus condiciones obstétricas, evaluarán conjuntamente el presumible riesgo que para la paciente y su hijo puede conllevar una gestación y, en su caso, si es necesario o no realizar ajustes terapéuticos médicos o quirúrgicos previos, y el momento idóneo para la misma. Asimismo, si la paciente manifiesta ser sexualmente activa y tiene contraindicación y/o rechaza temporal y/o definitivamente la posibilidad de embarazo, se planifica una anticoncepción segura y adecuada a su cardiopatía. En caso de gestación, y establecido el riesgo de la paciente en función del tipo de cardiopatía y su estado funcional, se diseña el control gestacional en la Unidad de Embarazo de Alto Riesgo para Mujeres con Cardiopatía Congénita (unidad multidisciplinaria y constituida por obstetras, cardiólogos, anestesiólogos, neonatólogos y expertos en medicina fetal), donde además se planifica el parto y el posparto con el objetivo de minimizar los riesgos maternos, fetales y neonatales.