Actualmente hay cada vez más interés en el tejido adiposo epicárdico (TAE) como marcador de enfermedad cardiovascular. Nuestro objetivo es describir el TAE medido por ecocardiograma, y determinar su asociación con el síndrome metabólico (SM), dentro del estudio poblacional RIVANA.
MétodosSe incluyó a 880 sujetos de 45 a 74 años (492 con SM según la definición armonizada). Se realizó una exploración física y se tomó una muestra sanguínea para obtener el perfil bioquímico. Se midió el espesor del TAE con ecocardiografía transtorácica al final de la sístole.
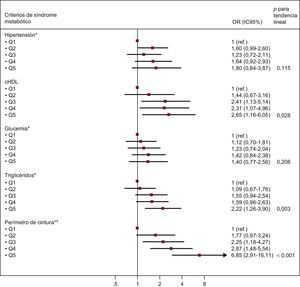
ResultadosEntre los sujetos sin SM, la prevalencia de TAE ≥ 5 mm aumentaba significativamente con la edad (> 65 frente a 45–54 años, OR=8,22; IC95%, 3,90-17,35; p lineal<0,001). El TAE se asoció significativamente con el SM (5.o frente a 1.er quintil, OR=3,26; IC95%, 1,59-6,71; p lineal=0,001). Respecto a los criterios individuales, el TAE se asoció independientemente con los criterios colesterol unido a lipoproteínas de alta densidad bajo (5.o frente a 1.er quintil, OR=2,65; IC95%, 1,16-6,05; p lineal=0,028), triglicéridos altos (5.o frente a 1.er quintil, OR=2,22; IC95%, 1,26-3,90; p lineal=0,003) y elevado perímetro abdominal (5.o frente a 1.er quintil, OR=6,85; IC95%, 2,91-16,11; p lineal<0,001).
ConclusionesEn una submuestra de la población general, la grasa epicárdica aumentó significativa e independientemente con la edad, y su incremento se asoció independientemente con el SM, el colesterol unido a lipoproteínas de alta densidad bajo, los triglicéridos altos y un elevado perímetro abdominal.
Palabras clave
La obesidad es actualmente una de las principales causas de enfermedad cardiovascular (ECV) y muerte en todo el mundo. Junto con el sobrepeso, la obesidad causa al menos 2,8 millones de muertes en todo el mundo cada año, además de un 3-9% de pérdida de posibles años de vida, y es el origen de al menos un 35% de los casos de enfermedad coronaria1–3. Está íntimamente ligada al desarrollo de la ateroesclerosis y al posterior aumento del riesgo cardiovascular4. Sin embargo, este riesgo depende de la localización que tenga el exceso de tejido adiposo. Se ha descrito que la adiposidad ectópica implica un riesgo cardiovascular superior al que conlleva la adiposidad subcutánea5. En consecuencia, actualmente hay cada vez más interés por la adiposidad ectópica.
Se ha demostrado que el depósito de grasa visceral de cada órgano concreto tiene unas características anatómicas y funcionales diferentes6–8; además, dada su proximidad a órganos vitales, el depósito de grasa visceral puede desempeñar un papel de regulación local además de tener un efecto sistémico5. Concretamente, el tejido adiposo epicárdico (TAE) es anatómica y funcionalmente contiguo al miocardio y está en contacto directo con los vasos coronarios. Puede producir y secretar moléculas bioactivas, que pueden modular el miocardio adyacente a través de diferentes mecanismos y puede ejercer efectos mecánicos, termogénicos y metabólicos9,10.
Sin embargo, el papel del TAE en la ECV no está completamente esclarecido y los mecanismos por los que puede producir la ateroesclerosis son complejos y no del todo conocidos8. No obstante, hay evidencia científica sólida que indica que el aumento del TAE se asocia a los casos prevalentes11 e incidentes12 de síndrome metabólico (SM), resistencia a la insulina en las personas obesas y las mujeres posmenopáusicas13,14, adiposidad visceral14–17, anomalías estructurales cardiacas18–20 y, además, una mayor frecuencia de casos incidentes y prevalentes de enfermedad coronaria y eventos cardiovasculares21–23. Sin embargo, los estudios que describen el TAE medido ecocardiográficamente en la población general son escasos12,20 y existen diferencias sustanciales entre distintos grupos étnicos11,24. El objetivo de este estudio es: a) describir el TAE según la edad y el sexo en una muestra sana de la población general, y b) determinar la asociación entre el TAE y el SM y sus diversos componentes.
MÉTODOSPoblación del estudioEl presente trabajo forma parte del estudio RIVANA25,26, que se diseñó para investigar la prevalencia de los factores de riesgo cardiovascular y el SM en la provincia de Navarra, así como su relación con la ECV asintomática y su repercusión en la enfermedad vascular tras un seguimiento de 10 años. Inicialmente, se seleccionó aleatoriamente a 5.682 participantes de entre 35 y 84 años de edad, a partir del registro electoral de Navarra, y se obtuvo una respuesta del 73,4%. En consecuencia, el tamaño muestral final fue de 4.168. Se seleccionó una submuestra de 1.100 participantes de 45 a 74 años para constituir una cohorte que permitiera abordar la incidencia del SM y la ECV subclínica, según diferentes marcadores del riesgo cardiovascular: 550 con SM elegidos al azar de entre los participantes con SM según los criterios del Adult Treatment Panel III27 y 550 elegidos al azar de entre los que no tenían SM, todos ellos sin ECV en la situación inicial. Este tamaño de la muestra se calculó partiendo de una relación 1:1 entre expuestos y no expuestos, una incidencia acumulada de 0,045 a 0,05 para los eventos cardiovasculares, una hazard ratio estimada de 2 para el SM, una potencia estadística del 80% y un error alfa definido a priori de 0,05. Se aumentó el tamaño de la muestra en un 10% por encima del calculado. Finalmente, se incluyó a 900 participantes (435 con SM y 465 sin SM) a los que se practicó una ecocardiografía transtorácica (ETT). Se excluyó a 20 participantes debido a una fibrilación auricular basal u otros trastornos cardiacos cuya existencia desconocían antes del examen inicial. En consecuencia, el tamaño muestral efectivo resultante para el análisis fue de 880 participantes (423 con SM y 457 sin SM según la definición de SM del Adult Treatment Panel III). Todos los participantes dieron su consentimiento informado y el protocolo del estudio fue aprobado por el Comité de Ética del Gobierno de Navarra (España).
Determinación del síndrome metabólicoSegún lo indicado anteriormente, se clasificó a los participantes al inicio según la definición del SM de 2001 del Adult Treatment Panel III27, que eran los criterios predominantes cuando se realizó este estudio. Se optó por reclasificar a los pacientes según la clasificación de la International Diabetes Federation establecida en 200628 y armonizada más tarde29, que es la que hoy se usa más ampliamente. Según esta clasificación, los participantes deben tener al menos 3 de los siguientes criterios: perímetro de cintura ≥ 102 cm los varones o ≥ 88 cm las mujeres; triglicéridos ≥ 150 mg/dl (1,69 mmol/l) o tratamiento con un fármaco reductor de los triglicéridos; colesterol unido a lipoproteínas de alta densidad (cHDL) < 40 mg/dl (1,04 mmol/l) los varones o 50 mg/dl (1,29 mmol/l) las mujeres o tratamiento con un fármaco para el cHDL bajo; presión arterial sistólica/diastólica ≥ 130/85mmHg o tratamiento con fármacos hipotensores; glucosa en ayunas ≥ 100 mg/dl (5,6 mmol/l) o prescripción de un tratamiento para la diabetes establecida. Según la definición armonizada, la muestra final utilizada para el análisis incluía a 492 participantes con SM y 388 sin SM.
Evaluación del tejido adiposo epicárdicoEn la situación inicial, se examinó a todos los participantes con mediciones en modo M guiadas por ecocardiografía bidimensional y se obtuvieron imágenes bidimensionales y mediciones por ecografía Doppler (Phillips 7500; Andover, Massachusetts, Estados Unidos) según las normas publicadas30. En la ecocardiografía se midió el grosor del TAE en la pared libre anterior del ventrículo derecho en telesístole, según lo recomendado por Iacobellis15,31. Un cardiólogo altamente capacitado realizó todas las exploraciones ecocardiográficas.
Exploración física y determinación de parámetros biológicosPor último, se realizó una exploración física a todos los participantes, con medición del perímetro de la cintura, la talla, el peso y la presión arterial. Se calculó el índice de masa corporal dividiendo el peso en kilos por el cuadrado de la estatura en metros y se clasificó como peso normal (< 25), sobrepeso (25 a < 30) y obesidad (≥ 30). Se obtuvo una muestra de sangre en ayunas y se efectuaron determinaciones de la glucosa en ayunas, el cHDL, los triglicéridos en plasma y la proteína C reactiva de alta sensibilidad.
Evaluación de otras covariablesSe obtuvo información sobre los factores sociodemográficos y el tabaquismo en la entrevista basal y se clasificó el tabaquismo en 3 categorías (fumador actual, exfumador, nunca fumador).
Análisis estadísticoLas características basales se presentan en forma de media±desviación estándar o número absoluto (porcentaje), por separado para los varones y las mujeres. Con objeto de evaluar la asociación entre la edad y el aumento del TAE (valor umbral, 5 mm), se utilizaron modelos de regresión logística no condicionada y se consideró el sexo, el tabaquismo, el área de superficie corporal (terciles), la proteína C reactiva de alta sensibilidad (variable dicotómica), el índice de masa corporal y el índice cintura/estatura (variable dicotómica) como posibles factores de confusión; en otro modelo adicional, se introdujo también un ajuste respecto a los criterios de SM, según publicaciones previas y la relevancia clínica de los posibles factores de confusión21. Asimismo se evaluó la interacción entre edad y sexo en cuanto a su asociación con el TAE, con el test de razón de verosimilitud (likelihood ratio). Las diferencias medias del TAE según la edad de varones y mujeres sin SM se evaluaron con modelos de regresión lineal brutos y multivariables ajustados.
Para evaluar la asociación entre los quintiles del TAE y la prevalencia del SM o de sus diferentes componentes, se utilizaron también modelos de regresión logística no condicionada con el TAE como variable independiente y el SM o sus componentes como variables dependientes, teniendo en cuenta los mismos factores de confusión potenciales, basándose en publicaciones previas y en su relevancia clínica12,16,21. Se evaluó la bondad de ajuste con la prueba de Hosmer-Lemeshow y la especificación del modelo con la prueba de vinculación (link test). Todos los análisis se realizaron con el programa STATA/SE 13.1 (StataCorp LP; College Station, Texas, Estados Unidos). Todos los valores de p fueron bilaterales y se estableció a priori un umbral de significación estadística de p < 0,05.
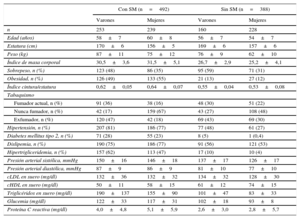
RESULTADOSEste estudio incluyó un total de 880 participantes. Las características basales según la presencia del SM se muestran en la tabla 1, por separado para varones y mujeres. En los participantes sin SM, las mujeres tenían menor prevalencia de sobrepeso y tabaquismo y valores más bajos de índice de masa corporal, índice cintura/estatura, presión arterial sistólica y diastólica y concentración sérica de colesterol unido a lipoproteínas de baja densidad, glucosa en ayunas y triglicéridos. Además, las mujeres tenían cifras de cHDL más altas.
Características basales de los participantes en el RIVANA según SM y sexo
| Con SM (n=492) | Sin SM (n=388) | |||
|---|---|---|---|---|
| Varones | Mujeres | Varones | Mujeres | |
| n | 253 | 239 | 160 | 228 |
| Edad (años) | 58±7 | 60±8 | 56±7 | 54±7 |
| Estatura (cm) | 170±6 | 156±5 | 169±6 | 157±6 |
| Peso (kg) | 87±11 | 75±12 | 76±9 | 62±10 |
| Índice de masa corporal | 30,5±3,6 | 31,5±5,1 | 26,7±2,9 | 25,2±4,1 |
| Sobrepeso, n (%) | 123 (48) | 86 (35) | 95 (59) | 71 (31) |
| Obesidad, n (%) | 126 (49) | 133 (55) | 21 (13) | 27 (12) |
| Índice cintura/estatura | 0,62±0,05 | 0,64±0,07 | 0,55±0,04 | 0,53±0,08 |
| Tabaquismo | ||||
| Fumador actual, n (%) | 91 (36) | 38 (16) | 48 (30) | 51 (22) |
| Nunca fumador, n (%) | 42 (17) | 159 (67) | 43 (27) | 108 (48) |
| Exfumador, n (%) | 120 (47) | 42 (18) | 69 (43) | 69 (30) |
| Hipertensión, n (%) | 207 (81) | 186 (77) | 77 (48) | 61 (27) |
| Diabetes mellitus tipo 2, n (%) | 71 (28) | 55 (23) | 8 (5) | 1 (0,4) |
| Dislipemia, n (%) | 190 (75) | 186 (77) | 91 (56) | 121 (53) |
| Hipertrigliceridemia, n (%) | 157 (62) | 113 (47) | 17 (10) | 10 (4) |
| Presión arterial sistólica, mmHg | 150±16 | 146±18 | 137±17 | 126±17 |
| Presión arterial diastólica, mmHg | 87±9 | 86±9 | 81±10 | 77±10 |
| cLDL en suero (mg/dl) | 132±36 | 132±32 | 134±32 | 128±30 |
| cHDL en suero (mg/dl) | 50±11 | 58±15 | 61±12 | 74±15 |
| Triglicéridos en suero (mg/dl) | 190±137 | 155±90 | 101±47 | 83±33 |
| Glucemia (mg/dl) | 122±33 | 117±31 | 102±18 | 93±8 |
| Proteína C reactiva (mg/dl) | 4,0±4,8 | 5,1±5,9 | 2,6±3,0 | 2,8±5,7 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; SM: síndrome metabólico.
Salvo que se indique lo contrario, los valores se expresan en forma de media ±desviación estándar.
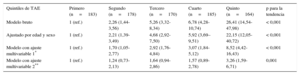
En la tabla 2 se muestra la asociación entre la edad y el TAE en los participantes sin SM. La presencia de un TAE ≥ 5 mm aumentaba significativamente con la edad. En comparación con los participantes de 45-54 años, los de 55-64 presentaban una probabilidad 4,11 veces superior de tener un TAE elevado (intervalo de confianza del 95% [IC95%], 2,32-7,28; p para la tendencia < 0,001) y los participantes de edad ≤ 65 años tenían una probabilidad 8,22 superior de tener un TAE alto (IC95%, 3,90-17,35; p para la tendencia < 0,001). La media de TAE según la edad y el sexo se presenta en la . Tanto en los varones como en las mujeres, los participantes de más edad presentaron valores del TAE superiores a los de los más jóvenes y la tendencia lineal fue estadísticamente significativa. Estos resultados apenas se modificaron con un ajuste adicional respecto a los criterios del SM. En promedio, los varones presentaban un TAE superior al de las mujeres (varones, 5,75 [IC95%, 5,50-5,99] mm; mujeres, 5,43 [IC95%, 5,21-5,64] mm; diferencia media ajustada, 0,46 [IC95%, 0,10-0,82] mm; p = 0,011).
Tejido adiposo epicárdico ≥ 5mm de los pacientes sin síndrome metabólico según la edad
| 45-54 años (n=197) | 55-64 años (n=136) | ≥ 65 años (n=55) | p para la tendencia | |
|---|---|---|---|---|
| Bruta | 1 (ref.) | 3,22 (1,96-5,27) | 6,02 (3,16-11,46) | < 0,001 |
| Ajustada por sexo | 1 (ref.) | 3,23 (1,97-5,29) | 6,05 (3,17-11,54) | < 0,001 |
| Modelo con ajuste multivariable* | 1 (ref.) | 4,11 (2,32-7,28) | 8,22 (3,90-17,35) | < 0,001 |
Los valores se expresan en forma de odds ratio (intervalo de confianza del 95%).
Los quintiles superiores del TAE se asociaban a un aumento de la prevalencia de SM (tabla 3). Tras aplicar un ajuste respecto al sobrepeso, la obesidad y el índice cintura/estatura, la asociación seguía siendo estadísticamente significativa (quinto quintil respecto al primero, odds ratio =3,26; IC95%, 1,59-6,71; p para la tendencia = 0,001).
Síndrome metabólico por quintiles de TAE
| Quintiles de TAE | Primero (n=183) | Segundo (n=178) | Tercero (n=170) | Cuarto (n=185) | Quinto (n=164) | p para la tendencia |
|---|---|---|---|---|---|---|
| Modelo bruto | 1 (ref.) | 2,26 (1,44-3,56) | 5,26 (3,32-8,34) | 6,78 (4,28-10,74) | 26,41 (14,54-47,98) | < 0,001 |
| Ajustado por edad y sexo | 1 (ref.) | 2,21 (1,39-3,49) | 4,68 (2,92-7,50) | 5,92 (3,69–9,51) | 22,15 (12,05-40,72) | < 0,001 |
| Modelo con ajuste multivariable 1* | 1 (ref.) | 1,70 (1,05-2,77) | 2,92 (1,76-4,84) | 3,07 (1,84-5,12) | 8,52 (4,42-16,43) | < 0,001 |
| Modelo con ajuste multivariable 2** | 1 (ref.) | 1,24 (0,73-2,13) | 1,64 (0,94-2,86) | 1,57 (0,89-2,78) | 3,26 (1,59-6,71) | 0,001 |
TAE: tejido adiposo epicárdico.
Los valores se expresan en forma de odds ratio (intervalo de confianza del 95%).
En la figura se presenta la asociación entre los quintiles de TAE creciente y cada uno de los criterios del SM. Se observó que los valores crecientes de TAE se asociaban menores cifras de cHDL, hipertrigliceridemia y presencia de obesidad abdominal tras introducir un ajuste respecto a posibles factores de confusión.
Odds ratio (intervalo de confianza del 95%) para los diferentes componentes de síndrome metabólico según la definición del Adult Treatment Panel III/International Diabetes Federation, en función de los quintiles de grasa epicárdica. cHDL: colesterol unido a lipoproteínas de alta densidad; IC95%: intervalo de confianza del 95%; OR: odds ratio; Q: quintil. *Ajustado por edad, sexo, tabaquismo, área de superficie corporal (variable continua), proteína C reactiva (variable continua), sobrepeso, obesidad e índice cintura/estatura (variable continua). **Ajustado por edad, sexo, tabaquismo, área de superficie corporal (variable continua), proteína C reactiva (variable continua), sobrepeso y obesidad.
En todos los modelos, la prueba de Hosmer-Lemeshow mostró una adecuada bondad de ajuste.
DISCUSIÓNEl presente estudio indica que el TAE aumenta con la edad en los participantes sin SM. Además, el aumento del TAE se asoció a mayor prevalencia de SM, menor concentración de cHDL, hipertrigliceridemia y presencia de obesidad abdominal.
El SM constituye un problema de salud importante en España, puesto que su prevalencia estimada es del 22,7%32 y, como es bien sabido, se ha asociado a un deterioro del perfil metabólico e inflamatorio33.
Ha generado mucho interés el TAE como posible marcador y modulador de la función cardiovascular, debido a su ubicación y proximidad al miocardio y a los vasos sanguíneos coronarios. La medición del TAE mediante ETT, como marcador objetivo de la cantidad de grasa visceral14,16,31 y como predictor efectivo del riesgo de sufrir SM12,14,34, podría utilizarse para identificar a los individuos en riesgo.
No se han establecido aún valores de corte generales por varias razones. Se sabe que el TAE presenta diferencias considerables entre los distintos grupos étnicos11,24, debido a sus diferencias en la distribución de la grasa corporal y el riesgo cardiovascular. Otra cuestión controvertida es el momento del ciclo cardiaco en que se mide con mayor exactitud el grosor del TAE. Algunos autores son partidarios de medir el TAE al final de la sístole, como es nuestro caso, debido a la deformación del TAE y la subestimación que se produce durante la diástole. Otros miden el TAE durante la telediástole con objeto de ser coherentes con lo que se hace en las mediciones de la tomografía computarizada y la resonancia magnética cardiacas. Por último, hay escasa información acerca del comportamiento de la grasa epicárdica, su distribución con la edad y su asociación con marcadores de enfermedad cardiovascular subclínica en la población general.
En este análisis, se optó por el valor de 5 mm como punto de corte; a pesar de que no haya consenso, varios autores han propuesto que los valores > 5 mm deben constituir un umbral relevante para definir el aumento del TAE, sobre todo en las poblaciones de bajo riesgo, si bien estos valores deberán confirmarse en estudios más amplios35,36.
Actualmente hay abundante evidencia científica que respalda la relación del TAE con un deterioro del perfil cardiometabólico11 y un aumento del riesgo cardiovascular21–23, pero la mayor parte de la investigación se ha llevado a cabo en poblaciones seleccionadas o en pacientes remitidos a un médico. Hasta donde nosotros sabemos, es escasa la evidencia existente respecto al TAE medido con ETT en la población general, y aún es menor la disponible respecto a participantes caucásicos. En la población general, el volumen del TAE se ha medido anteriormente con tomografía computarizada en caucásicos21,24,37–39. Solo en unos pocos estudios se ha medido el grosor del TAE ecocardiográfico en la población general no caucásica12,40, mientras que, hasta donde sabemos, solo un estudio recientemente publicado ha medido antes ecocardiográficamente el grosor del TAE y su asociación con el SM en participantes caucásicos de la población general20. Sin embargo, en este último estudio, el aumento del TAE no se asoció a mayor edad y la asociación entre el TAE y el SM solamente fue significativa en las mujeres. Además, en el estudio PLIC20, las mujeres presentaron un TAE significativamente mayor que los varones (varones, 4,00 mm, IC95%, 0,10-8,00; frente a mujeres, 4,5 mm; IC95%, 0,20-9,00; p = 0,013), mientras que en nuestro estudio se observó lo contrario. La razón de estas diferencias podría estar en que en el estudio PLIC participaron principalmente mujeres posmenopáusicas, con una mediana de edad de 68 [intervalo intercuartílico, 50-77,6] años.
Se observó que el aumento del grosor del TAE se asociaba con hipertrigliceridemia, cHDL bajo y obesidad abdominal. Por otro lado, en comparación con el tejido adiposo subcutáneo, el TAE es rico en ácidos grasos saturados6 y tiene más capacidad de liberación y captación de ácidos grasos libres que otros depósitos de grasa visceral41. En consecuencia, se ha propuesto que el TAE aporta energía al miocardio y al mismo tiempo actúa como amortiguador para proteger al corazón de una exposición a cantidades excesivamente altas de ácidos grasos. Sigue sin estar claro si el TAE está aumentado a causa de la dislipemia, con objeto de proteger al corazón de altas concentraciones de triglicéridos y colesterol o si refleja simplemente el exceso de tejido adiposo visceral que causa finalmente el SM y la resistencia a la insulina.
Limitaciones y fortalezasEste estudio tiene varias limitaciones. En primer lugar, nuestra submuestra no puede considerarse exactamente una muestra representativa de la población, ya que se seleccionó a los participantes a partir de la muestra original en función de la presencia de SM, según lo descrito en el apartado «Métodos». En segundo lugar, es cierto que la tomografía computarizada multidetectores y la resonancia magnética cardiaca, considerada el patrón de referencia, pueden evaluar con mayor exactitud que la ETT la grasa epicárdica, puesto que miden la totalidad del volumen del TAE en vez del espesor. En cambio, la ecocardiografía, a pesar de ser menos precisa, es más accesible y menos costosa, tiene una reproducibilidad excelente34 y ha mostrado una buena correlación con la tomografía computarizada y la resonancia magnética15,16,42.
Nuestro estudio tiene también varios puntos fuertes. En primer lugar, se realizó en más de 800 participantes asintomáticos de la población general que no presentaban ECV. En segundo lugar, se optó por reclasificar a los pacientes con SM según la definición armonizada de la International Diabetes Federation29, en vez de usar la clasificación del Adult Treatment Panel III27 como se había previsto inicialmente cuando se realizó el estudio. La definición armonizada se utiliza más actualmente y puede reducir el sesgo derivado de los errores de clasificación. En tercer lugar, un cardiólogo altamente capacitado llevó a cabo todas las ETT.
CONCLUSIONESEn una muestra de un estudio de base poblacional, el grosor del TAE medido ecocardiográficamente aumentó con la edad y mostró una asociación directa con el SM y el cHDL bajo, la hipertrigliceridemia y la presencia de obesidad abdominal como componentes individuales del SM. Se necesitan más estudios para determinar la fisiopatología del TAE, su asociación con la ECV y su utilidad para detectar a los pacientes con riesgo cardiovascular alto.
FINANCIACIÓNEstudio financiado por el Gobierno de Navarra y el Ministerio de Salud y Asuntos Sociales de España, Instituto de Salud Carlos III (Fondo de Investigación Sanitaria Pl 05/2364).
CONFLICTO DE INTERESESNinguno.
- –
La grasa epicárdica es el depósito de grasa visceral del corazón y puede secretar moléculas bioactivas que tienen efectos moduladores en el miocardio.
- –
La grasa epicárdica se ha asociado a MS y a la incidencia y la prevalencia de la enfermedad coronaria.
- –
Hay pocos datos sobre el grosor de la grasa epicárdica medida mediante ecocardiografía en la población general.
- –
Este estudio aporta información sobre el comportamiento del grosor de la grasa epicárdica en los participantes sin ECV asintomáticos de la población general y su relación con el perfil cardiometabólico.
- –
Hasta donde sabemos, este es el primer estudio en el que se mide el grosor de la grasa epicárdica ecocardiográficamente en una submuestra obtenida a partir de una muestra representativa de la población caucásica.
Los autores desean expresar su agradecimiento a todo el equipo de investigación del estudio RIVANA, que hizo posible la obtención de los datos; al Gobierno de Navarra por su apoyo y financiación del estudio RIVANA y, por último, a todos los participantes, especialmente a quienes colaboraron directamente en la fase II del estudio RIVANA, por su participación altruista.