Por segunda vez, la Sociedad Europea de Cardiología (ESC) y la European Association for the Study of Diabetes (EASD) unen sus fuerzas para redactar una Guía de Práctica Clínica sobre el manejo de la diabetes mellitus (DM), la prediabetes y la enfermedad cardiovascular, diseñada para asistir a los clínicos y otros profesionales de la salud a la hora de tomar decisiones basadas en la evidencia. La conciencia creciente de la estrecha relación biológica entre DM y enfermedad cardiovascular (ECV) ha lle v ado a es tas dos gr andes or g anizaciones a colaborar para generar una guía relevante a sus mutuos intereses, la primera de las cuales se publicó en 2007. Hay quien afirma que se están elaborando demasiadas guías, pero en este campo continuamente cambiante 5 años de desarrollo de ciencia básica y clínica es mucho tiempo; además, se han publicado importantes estudios clínicos en este periodo, lo que ha hecho necesario actualizar las guías previas.
El proceso que se ha seguido para generar esta guía ya se ha descrito previamente y se puede encontrar en: http://www.escardio.org/ guidelines-surveys/esc-guidelines/about/Pages/rules-writing.aspx. Brevemente, la EASD y la ESC han nombrado unos moderadores para representar a cada organización y dirigir las actividades del Grupo de Trabajo. Se eligió a cada uno de los miembros de acuerdo con su especialidad y su conocimiento para abordar los diferentes aspectos de la guía, por su reputación en el campo y para representar la diversidad que caracteriza la Europa moderna. Cada miembro estuvo de acuerdo en declarar —y actualizar regularmente— cualquier conflicto de intereses, cuyos detalles se encuentran en la European Heart House y están disponibles en: http://www.escardio.org/guidelines. Los miembros del Grupo de Trabajo suelen preparar sus contribuciones por pares y el desarrollo de la guía se ha hecho siguiendo las recomendaciones de la ESC, utilizando las clases de recomendaciones estándar, que se muestran más abajo, para aportar consistencia a las recomendaciones del comité (Tablas 1 y 2).
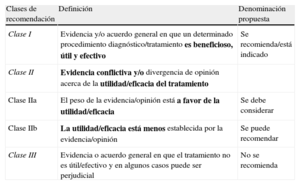
Clases de recomendación
| Clases de recomendación | Definición | Denominación propuesta |
| Clase I | Evidencia y/o acuerdo general en que un determinado procedimiento diagnóstico/tratamiento es beneficioso, útil y efectivo | Se recomienda/está indicado |
| Clase II | Evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del tratamiento | |
| Clase IIa | El peso de la evidencia/opinión está a favor de la utilidad/eficacia | Se debe considerar |
| Clase IIb | La utilidad/eficacia está menos establecida por la evidencia/opinión | Se puede recomendar |
| Clase III | Evidencia o acuerdo general en que el tratamiento no es útil/efectivo y en algunos casos puede ser perjudicial | No se recomienda |
Niveles de evidencia
| Nivel de evidencia A | Datos procedentes de múltiples ensayos clínicos aleatorizados o metanálisis |
| Nivel de evidencia B | Datos procedentes de un único ensayo clínico aleatorizado o de grandes estudios no aleatorizados |
| Nivel de evidencia C | Consenso de opinión de expertos y/o pequeños estudios, estudios retrospectivos, registros |
La redacción inicial y la revisión de los manuscritos tuvo lugar durante las reuniones del Grupo de Trabajo, donde se realizaron revisiones sistemáticas y se tuvo en cuenta los comentarios aportados por el Comité de la ESC para las Guías de Práctica Clínica y el Panel de la EASD para la Supervisión de las Guías y las Declaraciones.
Esta guía es el fruto de innumerables horas de trabajo arduo, tiempo aportado de manera voluntaria y entusiasta por los miembros del Grupo de Trabajo, el personal administrativo y los comités de supervisión de ambas organizaciones. Esperamos que este enorme esfuerzo haya generado una guía que aporte un mayor conocimiento de la relación entre estas dos enfermedades complejas, así como una herramienta accesible y útil en el proceso de toma de decisiones clínicas que pueda facilitar y mejorar su manejo.
El objetivo de la elaboración de las Guías de Práctica Clínica no se limita a integrar la investigación más reciente, también es la creación de instrumentos educativos y programas de implementación para las recomendaciones. Para ayudar a la difusión de las guías, se producen versiones reducidas de bolsillo, diapositivas con resúmenes, folletos con los principales mensajes y versiones electrónicas para aplicaciones digitales (smartphones, etc.). Se trata de versiones abreviadas, por lo que, cuando sea necesario, hay que acudir al texto íntegro original, disponible gratuitamente en la página web de la ESC.
2INTRODUCCIÓNLa prevalencia creciente de la DM en todo el mundo ha llevado a una situación en que aproximadamente 360 millones de personas tenían DM en 2011 y de ellas, más del 95% tendría DM tipo 2 (DM2). Se calcula que este número va a aumentar hasta 552 millones en el año 2030 y que alrededor de la mitad de ellos desconocerán su diagnóstico. Además, se calcula que otros 300 millones de personas tienen características que indican riesgo de sufrir DM2 en el futuro, como hiperglucemia en ayunas, intolerancia a la glucosa (IG), DM gestacional y resistencia a la insulina (RI) en euglucemia1. La mayoría de los casos nuevos de DM2 ocurren en un contexto de estilo de vida occidental, dietas ricas en grasas y poco ejercicio físico, lo que conduce a aumento de la obesidad, RI, hiperinsulinemia compensadora y, finalmente, insuficiencia de las células beta y DM2. La asociación observada entre riesgo vascular y RI, a menudo denominada síndrome metabólico (SM), ha llevado a pensar que el riesgo cardiovascular aparece precozmente, antes de que se desarrolle la DM2, mientras que la relación estrecha entre hiperglucemia y enfermedad microvascular (retinopatía, nefropatía, neuropatía) indica que este riesgo no se vuelve aparente hasta que aparece una hiperglucemia franca. Estos conceptos ponen de manifiesto la naturaleza progresiva tanto de la DM2 como del riesgo cardiovascular asociado, lo que comporta desafíos específicos en las distintas fases de la vida de una persona con DM. Los efectos de la edad avanzada, las comorbilidades y los problemas asociados con cada grupo específico indican la necesidad de enfocar el riesgo individualizadamente y permitiendo al paciente tener un papel importante en el manejo de su propia enfermedad.
De la misma manera que el mundo en general, y Europa en particular, está cambiando en respuesta a los cambios demográficos y culturales de la sociedad, también varían las formas de presentación de la enfermedad y sus implicaciones. Las regiones de Oriente Medio, la cuenca Asia Pacífico y ciertas zonas de Norteamérica y Sudamérica han experimentado un aumento enorme en la prevalencia de DM en los últimos 20 años, unos cambios que se han reflejado en la población europea durante el mismo periodo. El conocimiento de determinados aspectos asociados con el sexo y la raza y, en particular, de los efectos de la DM en las mujeres —incluidas las influencias epigenéticas e in utero de enfermedades no transmisibles— está adquiriendo gran importancia. En 2011, se estimaba que tenían DM unos 60 millones de europeos adultos, la mitad de ellos diagnosticados, y los efectos de esta enfermedad en la salud cardiovascular de las personas y sus descendientes representan un desafío de salud pública que los correspondientes organismos están tomando en consideración.
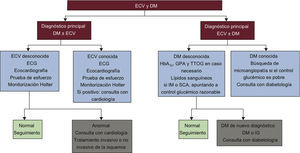
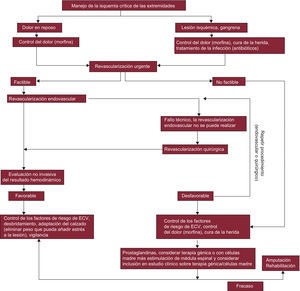
La DM y las ECV se desarrollan en paralelo a ciertas anomalías metabólicas que reflejan y causan cambios en la vasculatura. Más de la mitad de la mortalidad y gran parte de la morbilidad de la población con DM está relacionada con las ECV, lo que hace que los médicos que trabajan en el campo de la DM y la medicina cardiovascular unan sus fuerzas para investigar y manejar estas enfermedades (fig. 1). Al mismo tiempo, esto ha animado a ciertas organizaciones como la ESC y la EASD a trabajar conjuntamente, y la presente guía es reflejo de esta fructífera colaboración.
Algoritmo de investigación en el que se destacan los principios para el diagnóstico y manejo de la ECV en pacientes con DM que tienen un diagnóstico primario de DM o de ECV. Lo estudios recomendados deben considerarse según las necesidades individuales y el juicio clínico, no como una recomendación general que deba cumplirse con todos los pacientes. DM: diabetes mellitus; ECG: electrocardiograma; ECV: enfermedad cardiovascular; GPA: glucosa plasmática en ayunas; HbA1c: glucohemoglobina; IG: intolerancia a la glucosa; IM: infarto de miocardio; SCA: síndrome coronario agudo; TTOG: test de tolerancia oral a la glucosa.
El principal objetivo de esta guía es proporcionar información del conocimiento actual sobre la manera de prevenir y tratar de manera integral los diversos problemas asociados con los efectos de la DM en el corazón y la vasculatura. Al describir los mecanismos de la enfermedad, esperamos proporcionar una herramienta educativa; al describir las últimas novedades sobre el enfoque terapéutico, esperamos aportar un algoritmo para conseguir la mejor atención médica individualizada posible para los pacientes. Es importante señalar que esta guía está redactada para abordar el manejo de la combinación de ECV (o riesgo de ECV) y DM, no como guías separadas para cada condición. Este aspecto es importante si tenemos en cuenta que los profesionales que tratan a este tipo de pacientes en su práctica diaria suelen tener su mayor experiencia en DM o ECV o en la medicina general. Si se precisa un análisis más detallado de aspectos específicos discutidos en las presentes guía, se puede obtener más información a partir de otras guías específicas publicadas por varias organizaciones profesionales como la ESC, la European Atherosclerosis Society y la EASD, por ejemplo, sobre manejo de la enfermedad coronaria aguda, intervenciones coronarias, hiperlipemia o tratamientos de reducción de la glucosa, por mencionar solo algunas.
Ha sido un privilegio para los moderadores haber tenido la oportunidad de desarrollar esta guía a través de un trabajo conjunto con algunos de los más reconocidos expertos en el campo. Queremos extender nuestro agradecimiento a todos los miembros del Grupo de Trabajo que han dedicado su tiempo y su conocimiento, a los evaluadores que han contribuido de manera decisiva al manuscrito final y a los miembros de los comités de la ESC y la EASD que han supervisado este proyecto. Finalmente, expresamos nuestra gratitud al equipo de las Guías de la European Heart House, en particular a Catherine Després, Veronica Dean y Nathalie Cameron, que han hecho posible que este proceso se desarrolle adecuadamente.
Estocolmo y Leeds, abril de 2014, Lars Ryden y Peter Grant
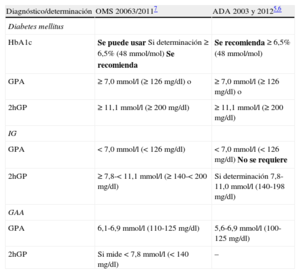
3TRASTORNOS DEL METABOLISMO DE LA GLUCOSA Y ENFERMEDAD CARDIOVASCULAR3.1Definición, clasificación y diagnósticoLa DM es una condición definida por una concentración alta de glucosa en sangre. La clasificación de DM está basada en las recomendacones de la Organización Mundial de la Salud (OMS) y la American Diabetes Association (ADA). Se recomienda utilizar la glucohemoglobina como el test diagnóstico de DM7,8, aunque existe cierta preocupación en cuanto a su sensibilidad para predecir DM, y los valores de HbA1c < 6,5% no excluyen la DM, que puede detectarse mediante la determinación de glucosa7,8,9,10, tal como se discute más adelante en la sección 3.3. Se han identificado cuatro categorías etiológicas principales de DM: tipo 1 (DM1), DM2, «otras formas específicas» de DM y DM «gestacional» (tabla 3)2.
Comparación de los criterios diagnósticos de la Organización Mundial de la Salud de 2006 y la American Diabetes Association de 2003/2011 y 2012
| Diagnóstico/determinación | OMS 20063/20117 | ADA 2003 y 20125,6 |
| Diabetes mellitus | ||
| HbA1c | Se puede usar Si determinación ≥ 6,5% (48 mmol/mol) Se recomienda | Se recomienda ≥ 6,5% (48 mmol/mol) |
| GPA | ≥ 7,0 mmol/l (≥ 126 mg/dl) o | ≥ 7,0 mmol/l (≥ 126 mg/dl) o |
| 2hGP | ≥ 11,1 mmol/l (≥ 200 mg/dl) | ≥ 11,1 mmol/l (≥ 200 mg/dl) |
| IG | ||
| GPA | < 7,0 mmol/l (< 126 mg/dl) | < 7,0 mmol/l (< 126 mg/dl) No se requiere |
| 2hGP | ≥ 7,8-< 11,1 mmol/l (≥ 140-< 200 mg/dl) | Si determinación 7,8-11,0 mmol/l (140-198 mg/dl) |
| GAA | ||
| GPA | 6,1-6,9 mmol/l (110-125 mg/dl) | 5,6-6,9 mmol/l (100-125 mg/dl) |
| 2hGP | Si mide < 7,8 mmol/l (< 140 mg/dl) | – |
2hGP: glucosa plasmática a las 2 h poscarga; GAA: glucosa alterada en ayunas; GPA: glucosa plasmática en ayunas; HbA1c: glucohemoglobina; IG: intolerancia a la glucosa.
La DM1 se caracteriza por una deficiencia de insulina debida a la destrucción de las células beta pancreáticas, que progresa hacia una deficiencia absoluta de insulina. Típicamente, la DM1 ocurre en personas jóvenes y delgadas que sufren poliuria, sed y pérdida de peso, con propensión a cetosis. No obstante, la DM1 puede aparecer a cualquier edad11, a veces con una progresión lenta. En este último caso, se produce una DM autoinmunitaria latente en adultos (LADA) y se desarrolla dependencia de la insulina en pocos años. Las personas con autoanticuerpos contra las proteínas de las células beta pancreáticas, como la descarboxilasa del ácido glutámico, la proteína tirosinfosfatasa, la insulina o la proteína transportadora de cinc, tienen propensión a adquirir dependencia de la insulina, ya sea de aparición aguda o lentamente progresiva12,13. Los autoanticuerpos que se dirigen a las células beta pancreáticas son un marcador de DM1, aunque no son detectables en todos los pacientes y disminuyen con la edad. En comparación con otras etnias y grupos geográficos, la DM1 es más común entre los caucásicos14.
La DM2 se caracteriza por una combinación de RI y fallo de las células beta, asociada a obesidad (típicamente de distribución abdominal) y estilo de vida sedentario, importantes factores de riesgo de DM2. La RI y la alteración de la secreción de insulina de la primera fase que causa hiperglucemia posprandial son características de la fase inicial de la DM2. Esto se sigue de una respuesta disminuida de insulina de segunda fase e hiperglucemia persistente en ayunas15,16. La DM2 se desarrolla típicamente en la segunda mitad de la vida y afecta a más del 90% de los adultos con DM. Sin embargo, con el aumento de la obesidad entre los jóvenes y en poblaciones no europeas, existe una tendencia hacia una disminución de la edad de inicio.
La DM gestacional se desarrolla durante el embarazo. Después del parto, en la mayoría de los casos se produce un retorno al estado euglucémico, pero persiste un riesgo elevado de sufgrir DM2 franca en el futuro. Un metanálisis ha descrito que la posterior progresión a DM está considerablemente aumentada después de la DM gestacional17. Un estudio clínico canadiense de gran tamaño ha descrito que la probabilidad de sufrir DM después de una DM gestacional es del 4% a los 9 meses del parto y el 19% a los 9 años18.
Otras formas específicas de DM incluyen: a) mutaciones genéticas puntuales que producen formas raras de DM, como la DM del joven que se inicia en la vida adulta; b) la DM secundaria a otras enfermedades (pancreatitis, traumatismos o cirugía de páncreas), y c) DM inducidas por fármacos o sustancias químicas.
Los trastornos del metabolismo de la glucosa, glucosa alterada en ayunas (GAA) e IG, a menudo conocidas como «prediabetes», reflejan la historia natural de la progresión desde la normoglucemia a la DM2. Es habitual que en estos casos se produzca una oscilación entre diferentes estados glucémicos, tal como se espera cuando la variable continua glucosa plasmática está dicotomizada. La IG solo se puede reconocer a partir de los resultados de un test de tolerancia oral a la glucosa (TTOG): glucosa a las 2 h poscarga (2hGP) ≥ 7,8 y < 11,1 mmol/l (≥ 140 y < 200 mg/dl). Se realiza un TTOG por la mañana después de una noche en ayunas (8-14 h). Se debe tomar una muestra de sangre antes de ingerir, en 5 min, 75 g de glucosa disuelta en 250-300 ml de agua y otra muestra de sangre después de 120 min (es importante tener en cuenta que la prueba se inicia cuando el paciente empieza a beber). Los criterios clínicos actuales están definidos por la OMS y la ADA3,8. Los criterios de la OMS se basan en la glucosa plasmática en ayunas (GPA) y la 2hGP. Se recomienda el uso del TTOG en ausencia de hiperglucemia franca3. La ADA fomenta el uso de la HbA1c, la GPA y el TTOG, en este orden8. El argumento para usar GPA o HbA1c sobre 2hGP se basa fundamentalmente en su factibilidad. Las ventajas y desventajas del uso de la prueba de glucosa y la prueba de la HbA1c se resumen en un informe de la OMS de 20117 y siguen siendo objeto de debate (véase la sección 3.3). Los criterios diagnósticos adoptados por la OMS y la ADA (tabla 3) para valores de hiperglucemia intermedios son similares para la IG, pero difieren en la GAA. El umbral más bajo de la ADA para la GAA es de 5,6 mmol/l (101 mg/dl)8, mientras que la OMS recomienda el punto de corte original de 6,1 mmol/l (110 mg/dl)3.
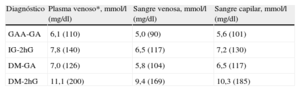
Para estandarizar las determinaciones de glucosa, se han recomendado las determinaciones en plasma venoso3,8. Las determinaciones basadas en sangre venosa total tienden a dar resultados de 0,5 mmol/l (9 mg/dl) más bajos que los valores plasmáticos. Debido a que la sangre capilar a menudo se usa para medir la eficacia del tratamiento, es importante subrayar que los valores capilares pueden diferir más de los valores plasmáticos después de la poscarga que en la fase de ayuno. Por lo tanto, un estudio comparativo reciente indica que los puntos de corte para DM, GAA e IG difieren cuando según se use sangre venosa o sangre capilar, tal como se indica en la Tabla 419.
Puntos de corte para el diagnóstico de diabetes mellitus, intolerancia a la glucosa y glucosa alterada en ayunas, basadas en muestras de sangre diferentes del plasma venoso estándar recomendado
| Diagnóstico | Plasma venoso*, mmol/l (mg/dl) | Sangre venosa, mmol/l (mg/dl) | Sangre capilar, mmol/l (mg/dl) |
| GAA-GA | 6,1 (110) | 5,0 (90) | 5,6 (101) |
| IG-2hG | 7,8 (140) | 6,5 (117) | 7,2 (130) |
| DM-GA | 7,0 (126) | 5,8 (104) | 6,5 (117) |
| DM-2hG | 11,1 (200) | 9,4 (169) | 10,3 (185) |
2hG: glucosa a las 2h poscarga; DM: diabetes mellitus; GA: glucosa en ayunas; GAA: glucosa alterada en ayunas; IG: intolerancia a la glucosa.
*Estándar.
La clasificación depende de si solo se determina la GPA o se combina con 2hGP. Una persona con GAA puede tener IG o incluso DM si se investiga con un TTOG. Una GPA normal refleja capacidad para mantener una secreción insulínica basal adecuada, junto con una sensibilidad hepática a la insulina suficiente para controlar la liberación de glucosa hepática. Un valor de glucosa poscarga dentro de la normalidad requiere una correcta respuesta secretora de insulina y una sensibilidad adecuada a la insulina en los tejidos periféricos. Es importante tener en cuenta el método analítico a la hora de interpretar las muestras. Esto se aplica tanto a la determinación de glucosa como a la de HbA1c.
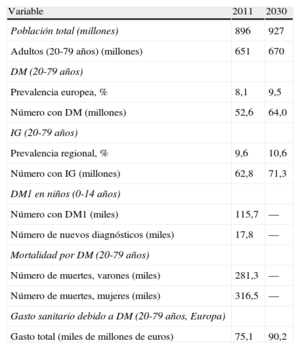
3.2EpidemiologíaLas estimaciones generales de la International Diabetes Federation para 2011 (tabla 5) indican que 52 millones de europeos de 20 a 79 años de edad tienen DM y que esta cifra va a aumentar a más de 64 millones hacia 20301. En 2011, 63 millones de europeos tenían IG. En 2011 murieron 281.000 varones y 317.000 mujeres con DM de todo el mundo, la mayoría por ECV. El gasto sanitario de la DM en Europa fue de alrededor de 75.000 millones de euros en 2011 y se calcula que va a aumentar hasta 90.000 millones hacia 2030.
Carga de diabetes mellitus en Europa en 2011 y predicciones para 20301
| Variable | 2011 | 2030 |
| Población total (millones) | 896 | 927 |
| Adultos (20-79 años) (millones) | 651 | 670 |
| DM (20-79 años) | ||
| Prevalencia europea, % | 8,1 | 9,5 |
| Número con DM (millones) | 52,6 | 64,0 |
| IG (20-79 años) | ||
| Prevalencia regional, % | 9,6 | 10,6 |
| Número con IG (millones) | 62,8 | 71,3 |
| DM1 en niños (0-14 años) | ||
| Número con DM1 (miles) | 115,7 | — |
| Número de nuevos diagnósticos (miles) | 17,8 | — |
| Mortalidad por DM (20-79 años) | ||
| Número de muertes, varones (miles) | 281,3 | — |
| Número de muertes, mujeres (miles) | 316,5 | — |
| Gasto sanitario debido a DM (20-79 años, Europa) | ||
| Gasto total (miles de millones de euros) | 75,1 | 90,2 |
DM: diabetes mellitus; IG: intolerancia a la glucosa.
Uno de los problemas a la hora de diagnosticar DM2 es la ausencia de un único marcador biológico —aparte de la glucosa plasmática posprandial— que pueda diferenciar la GAA, la IG o la DM2 del metabolismo normal de la glucosa. La DM2 se desarrolla después de un largo periodo de RI euglucémica que progresa, junto con el desarrollo de un fallo de las células beta, hacia una DM franca con aumento del riesgo de complicaciones vasculares. La presente definición de DM se basa en la concentración de glucosa con que se produce retinopatía, pero las complicaciones macrovasculares como las enfermedades coronaria, cerebrovascular o arterial periférica aparecen más tempranamente, y cuando se usan los criterios glucémicos actuales suelen estar presentes en el momento de diagnosticarse la DM2. Más del 60% de las personas con DM2 contrae una ECV, una complicación más grave y costosa que la retinopatía. Por lo tanto, el riesgo de ECV debería tener mayor prioridad a la hora de definir los puntos de corte de la hiperglucemia, que deberían reevaluarse según el riesgo de padecer ECV.
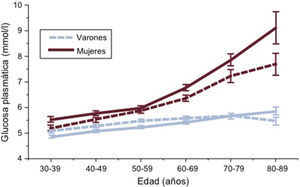
El estudio DECODE20 (fig. 2) ha aportado información sobre los trastornos del metabolismo de la glucosa en la población europea. El escaso número de datos sobre HbA1c en esta población indica la existencia de discrepancias importantes en relación con los resultados del TTOG21, aunque esto no se ha confirmado en el estudio DETECT-222, tal como se discute en la sección 3.3. Entre los europeos, la prevalencia de DM aumenta con la edad en ambos sexos. Así, menos del 10% de las personas de menos de 60 años, un 10-20% de las de 60-69 años y un 15-20% de los mayores de 70 años tenían DM previamente conocida, y se han detectado proporciones similares de DM asintomática20 a partir de chequeos generales. Esto significa que el riesgo de DM a lo largo de la vida es de un 30-40% en las poblaciones europeas. De manera parecida, la prevalencia de IG aumenta linealmente desde el 15% aproximadamente en adultos hasta un 35-40% de los europeos de edad avanzada. Incluso la HbA1c aumenta linealmente desde el 15% aproximadamente en adultos hasta un 35-40% de los europeos de edad avanzada. Incluso la HbA1c aumenta con la edad en ambos sexos23.
Concentración media de glucosa plasmática en ayunas (GPA) (las dos líneas inferiores) y glucosa plasmática a las 2 h poscarga (2hGP) (las dos líneas superiores) (intervalos de confianza del 95% mostrados por las barras verticales) en 13 cohortes poblacionales europeas incluidas en el estudio DECODE20. La 2hGP media aumenta especialmente después de los 50 años de edad. Las mujeres tienen una concentración media de 2hGP significativamente superior que los varones, una diferencia que se hace más pronunciada por encima de los 70 años de edad. La GPA media aumenta solo ligeramente con la edad.
La DM2 no produce síntomas específicos durante muchos años, lo que explica que aproximadamente la mitad de los casos de DM2 queden sin diagnóstico20,23. No se recomienda realizar pruebas de glucosa sanguínea a la población para determinar el riesgo cardiovascular debido a la falta de evidencia que confirme que el pronóstico de la ECV relacionada con DM2 pueda mejorarse con la detección y el tratamiento precoces24,25. El cribado de la hiperglucemia con el objeto de determinar el riesgo cardiovascular se debe dirigir, por lo tanto, a individuos de alto riesgo. El estudio ADDITION ha proporcionado evidencia de que el riesgo de padecer eventos cardiovasculares es bajo para las personas con DM2 detectadas mediante cribado. No obstante, el cribado puede facilitar la reducción de riesgo de ECV y la detección precoz puede beneficiar contra la progresión de la enfermedad microvascular, lo que puede hacer que el cribado de DM2 sea beneficioso26. Además, hay interés en identificar a las personas con IG, ya que la mayoría de ellas va a progresar a DM2, y esta progresión puede retrasarse con intervenciones sobre el estilo de vida27,28,29,30,31. El diagnóstico de DM se ha basado tradicionalmente en las cifras de glucosa en sangre, que se relacionan con el riesgo de sufrir enfermedad microvascular (más que macrovascular). El estudio DETECT-2 ha analizado los resultados de 44.000 personas de nueve estudios en cinco países22. Este estudio concluye que la HbA1c > 6,5% (4 8 mmol/l) y la GPA > 6,5 mmol/l (117 mg/dl) juntas proporcionan una mejor discriminación que el punto de vista —adoptado por la ADA6 y la OMS7— de que, para la población general, la HbA1c > 6,5% es diagnóstica de DM, pero que cuando la HbA1c está en un 6,0-6,5%, se debe realizar determinación de GPA para establecer el diagnóstico. Existen dudas en relación con esta posición, tal como han revisado extensamente Hare et al32. Puede haber problemas relacionados con la gestación, síndrome del ovario poliquístico33, hemoglobinopatías y enfermedad aguda, que reducen su uso en estas circunstancias. Además, la probabilidad de obtener falsos negativos, en comparación con el TTOG, es considerable cuando se intenta detectar DM midiendo únicamente la GPA o la HbA1c en la población asiática34. Un estudio realizado en sujetos españoles de alto riesgo, es decir > 12/26 puntos de acuerdo con el estudio FINDRISC, ha revelado que el 8,6% de los casos tenía DM2 no diagnosticada mediante TTOG, mientras que solo el 1,4% tenía HbA1c > 6,5%, lo que indica la necesidad de evaluar el uso de la HbA1c como la prueba diagnóstica principal en poblaciones específicas9. Sigue siendo controvertido el enfoque basado en el uso de la HbA1c para detectar DM no diagnosticada en el contexto de la enfermedad coronaria y el manejo del riesgo cardiovascular7,8,9,10,32, aunque los defensores argumentan que la HbA1c en la franja del 6,0-6,5% requiere aconsejar sobre cambios en el estilo de vida y controlar los factores de riesgo individuales únicamente y que la información adicional aportada por la 2hGP no altera este tipo de manejo.
Los enfoques para la detección precoz de DM2 y otras anomalías del metabolismo de la glucosa son: a) medir la GP o la HbA1c para determinar de manera explícita la prevalencia de DM2 y la deficiencia en la regulación de glucosa; b) utilizar las características demográficas y clínicas y las pruebas de laboratorio previas para determinar la probabilidad de DM2, y c) recoger datos a partir de cuestionarios para tener información sobre la existencia de factores de riesgo etiológicos de DM2. Las dos últimas aproximaciones dejan ambiguo el estado glucémico actual y es necesario realizar pruebas de glucemia en los tres enfoques, para definir con precisión si hay DM2 u otras anomalías del metabolismo de la glucosa. Sin embargo, los resultados de este cribado de primer nivel tan sencillo pueden reducir significativamente el número de personas que tienen que someterse a pruebas adicionales de glucemia y de otros factores de riesgo de ECV. La segunda opción está especialmente indicada para casos de ECV preexistente y mujeres que ya han tenido una DM gestacional, mientras que la tercera opción es más adecuada para la población general y también para las personas con sobrepeso/obesas.
Se han desarrollado diversos índices de riesgo de sufrir DM. La mayoría de ellos funciona bien y no importa cuál se utilice, tal como se subraya en una revisión sistemática reciente35. El índice de riesgo The FINnish Diabetes RIsk SCore (www.diabetes.fi/english) es el más utilizado para el cribado de riesgo de DM en Europa (fig. 3).
FINnish Diabetes RIsk SCore (FINDRISC) para evaluar el riesgo a 10 años de diabetes mellitus tipo 2 en adultos (modificado de Lindstrom et al36, disponible en: www.diabetes.fi/english).
Esta herramienta, disponible en casi todas las lenguas europeas, predice el riesgo de DM2 —incluidas la DM asintomática y la IG— a 10 años con una precisión del 85%36,37. Se ha validado en la mayoría de las poblaciones europeas. Es necesario separar a los sujetos en tres escenarios diferentes: a) la población general; b) personas con trastornos asumidos (p. ej, obesos, hipertensos o con historia familiar de DM), y c) pacientes con ECV prevalente. Para la población general y las personas con trastornos asumidos, la estrategia de cribado adecuada es empezar con un índice de riesgo de DM e investigar a los sujetos que tengan un valor elevado con TTOG o una combinación de HbA1c y GPA36,37. En pacientes con ECV, no es necesario un índice de riesgo de DM, pero está indicado el TTOG cuando la HbA1c o la GPA no sean concluyentes, ya que a menudo la gente que pertenece a este grupo puede tener DM que se pone de manifiesto únicamente por la elevación de la 2hGP38,39,40,41.
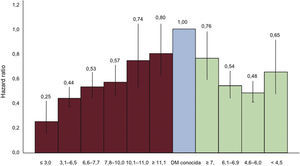
3.4Trastornos del metabolismo de la glucosa y enfermedad cardiovascularTanto la DM2 como otros trastornos del metabolismo de la glucosa son factores de riesgo de ECV. La evidencia más convincente de esta asociación la ha aportado el estudio colaborativo DECODE, que ha analizado varias cohortes europeas que tenían datos sobre el TTOG basal42,43,44. En este estudio se observó un aumento de la mortalidad en pacientes con DM e IG, identificada por 2hGP, pero no en sujetos con GAA. Un valor elevado de 2hGP predijo la mortalidad de cualquier causa y la mortalidad de causa cardiovascular después de ajustar por otros FRCV mayores, mientras que la GPA sola no fue predictora una vez tomado en cuenta el valor de 2hGP. El exceso de mortalidad cardiovascular en la población se observó en sujetos con IG, especialmente aquellos con GPA normal44. La asociación entre 2hGP y mortalidad fue lineal, pero esta relación no se observó con la GPA (fig. 4).
Hazard ratio y sus intervalos de confianza del 95% (barras verticales) de la mortalidad por ECV para los intervalos de GPA (barras rayadas) y 2hGP (barras punteadas), usando la DM previamente diagnosticada (barra oscura) como categoría de referencia. Los resultados están ajustados por edad, sexo, cohorte, índice de masa corporal, presión arterial sistólica, colesterol total y tabaquismo (adaptado del estudio DECODE42,43). DM: diabetes mellitus; ECV: enfermedad cardiovascular; GPA: glucosa plasmática en ayunas.
Diversos estudios han demostrado que el aumento de HbA1c se asocia a un aumento del riesgo de ECV45,46,47. Los estudios que han comparado los tres parámetros glucémicos —GPA, 2hGP y HbA1c– simultáneamente para la mortalidad y el riesgo de ECV han revelado que la asociación es más fuerte con 2hGP y que el riesgo observado con GPA y HbA1c deja de ser significativo después de controlar el efecto de 2hGP48,49.
Las mujeres a las que se diagnostica por primera vez DM2 tienen un riesgo relativo de muerte de causa cardiovascular más elevado que los varones20,50,51,52. Una revisión que ha analizado el impacto del sexo en la ocurrencia de mortalidad por ECV ha descrito que el riesgo relativo general (el cociente riesgo en mujeres/riesgo en varones) fue 1,46 (intervalo de confianza del 95% [IC95%], 1,21-1,95) en sujetos con DM y 2,29 (IC95%, 2,05-2,55) en sujetos sin DM, lo que indica que el bien conocido diferencial debido al sexo en cuanto a riesgo coronario está reducido en la DM53. Un metanálisis de 37 estudios de cohorte prospectivos (n = 447.064 pacientes con DM) dirigido a calcular el riesgo relacionado con el sexo de tener enfermedad coronaria fatal ha descrito mayor mortalidad entre los pacientes con DM que entre aquellos sin ella (el 5,4 y el 1,6% respectivamente)54. El riesgo relativo o hazard ratio (HR) entre sujetos con y sin DM fue significativamente más elevado entre las mujeres (HR = 3,50; IC95%, 2,70-4,53) que entre los varones (HR = 2,06; IC95%, 1,81-2,34). Por lo tanto, la diferencia debida al sexo en cuanto al riesgo cardiovascular observada en la población general es mucho menor entre las personas con DM, por motivos que siguen sin esclarecerse. Un estudio británico reciente, HOMA-IR, ha revelado una mayor influencia adversa de la DM per se en la adiposidad y la presión arterial (PA), los lípidos, la disfunción endotelial y la inflamación sistémica en las mujeres, en comparación con los varones, que puede contribuir a este aumento del riesgo relativo de enfermedad coronaria55. Además, parece ser que las mujeres tienen que tener mayor sobrepeso que los varones —y, por lo tanto, sufrir mayores cambios en su estado de riesgo— para que se desarrolle DM56.
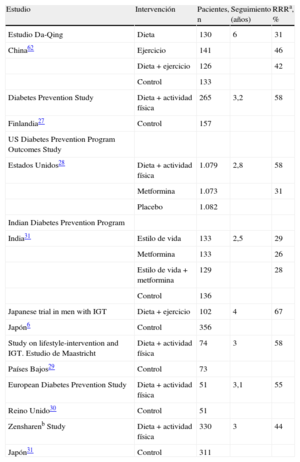
3.5Cómo retrasar la conversión a diabetes mellitus tipo 2Los malos hábitos dietéticos y un estilo de vida sedentario tienen gran importancia en el desarrollo de la DM257,58. Tal como se ha revisado en las guías europeas basadas en la evidencia sobre prevención de la DM259, los estudios clínicos aleatorizados demuestran que una modificación en el estilo de vida, basada en una pérdida de peso moderada y un aumento de la actividad física, previene o retrasa la progresión en sujetos de alto riesgo con IG. Por lo tanto, cuando haya alto riesgo de DM2 o IG establecida, se debe dar consejo sobre cuáles son los hábitos de vida más adecuados (tabla 6). Recientemente se ha desarrollado un kit que incluye consejos prácticos por personal sanitario60. La aparentemente menor reducción de riesgo observada en los estudios clínicos indios y chinos se debe a una mayor incidencia de DM2 en esas poblaciones, aunque la reducción de riesgo absoluta es sorprendentemente parecida en todos los estudios: aproximadamente 15-20 casos cada 100 personas-año. Se ha calculado que la intervención sobre el estilo de vida tiene que llevarse a cabo en 6,4 sujetos de alto riesgo durante una media de 3 años para prevenir 1 caso de DM. Así pues, se puede considerar que este tipo de intervención es muy eficiente31. El seguimiento de 12 años de pacientes varones con IG que participaron en el Malmö Feasibility Study61 ha revelado que la mortalidad por cualquier causa entre los varones del grupo que recibió una intervención sobre el estilo de vida era menor (y similar a la de los varones con tolerancia a la glucosa normal) que la de los varones que recibieron un «manejo habitual» (6,5 frente a 14,0/1.000 personas-año; p = 0,009). En el estudio chino Da Qing, los participantes con IG que pertenecían al grupo de intervención sobre el estilo de vida durante 6 años, al cabo de 20 años presentaron una reducción persistente en la incidencia de DM2 y una reducción no significativa del 17% en la mortalidad por ECV, comparados con los participantes del grupo control62. Además, la incidencia ajustada de retinopatía grave fue un 47% más baja en el grupo de intervención que en el grupo control, lo que se interpretó como un efecto relacionado con la reducción de la incidencia de DM263. En un seguimiento de 7 años del estudio finlandés DPS27, se produjo una reducción marcada y persistente de la incidencia de DM2 entre los sujetos que participaron en el grupo de intervención sobre el estilo de vida (durante un periodo medio de 4 años). En el seguimiento a 10 años no hubo diferencias entre el grupo que recibió intervención y el grupo control en cuanto a la mortalidad total y la incidencia de ECV, pero los participantes del estudio DPS que tenían IG basal presentaron tasas de mortalidad por cualquier causa y mortalidad por ECV menores que una cohorte finlandesa basada en la población de sujetos que tenían IG64. En el seguimiento a 10 años del US Diabetes Prevention Programme Outcomes Study, la incidencia de DM2 en el grupo que recibió intervención sobre el estilo de vida se mantuvo más baja que en el grupo control65.
Prevención de la diabetes mellitus tipo 2 mediante intervenciones sobre el estilo de vida: evidencia
| Estudio | Intervención | Pacientes, n | Seguimiento (años) | RRRa, % |
| Estudio Da-Qing | Dieta | 130 | 6 | 31 |
| China62 | Ejercicio | 141 | 46 | |
| Dieta + ejercicio | 126 | 42 | ||
| Control | 133 | |||
| Diabetes Prevention Study | Dieta + actividad física | 265 | 3,2 | 58 |
| Finlandia27 | Control | 157 | ||
| US Diabetes Prevention Program Outcomes Study | ||||
| Estados Unidos28 | Dieta + actividad física | 1.079 | 2,8 | 58 |
| Metformina | 1.073 | 31 | ||
| Placebo | 1.082 | |||
| Indian Diabetes Prevention Program | ||||
| India31 | Estilo de vida | 133 | 2,5 | 29 |
| Metformina | 133 | 26 | ||
| Estilo de vida + metformina | 129 | 28 | ||
| Control | 136 | |||
| Japanese trial in men with IGT | Dieta + ejercicio | 102 | 4 | 67 |
| Japón6 | Control | 356 | ||
| Study on lifestyle-intervention and IGT. Estudio de Maastricht | Dieta + actividad física | 74 | 3 | 58 |
| Países Bajos29 | Control | 73 | ||
| European Diabetes Prevention Study | Dieta + actividad física | 51 | 3,1 | 55 |
| Reino Unido30 | Control | 51 | ||
| Zensharenb Study | Dieta + actividad física | 330 | 3 | 44 |
| Japón31 | Control | 311 |
IGT: intolerancia a la glucosa; RRR: reducción del riesgo relativa.
a Los números de reducción absoluta del riesgo tienen valor añadido, pero no puede mostrarse debido a que esta información está ausente en varios de los estudios.
b El estudio Zensharen incluyó a sujetos con glucosa alterada en ayunas, mientras que los otros estudios han incluido a sujetos con intolerancia a la glucosa.
Diagnóstico de los trastornos del metabolismo de la glucosaRecomendacionesClaseaNivelbRef.cSe recomienda que el diagnóstico de diabetes se base en la HbA1c y la GPA en ayunas o en el TTOG si existen dudasIB2-5,8,10Se recomienda usar el TTOG para diagnosticar la IGIB2-5,8,10Se recomienda iniciar la búsqueda de posible DM en personas con ECV con HbA1c y GPA y añadir TTOG si la HbA1c y la GPA no son concluyentesIA36-41Se debe prestar una atención especial a la aplicación de medidas preventivas en mujeres con trastornos del metabolismo de la glucosaIIaC—Se recomienda que las personas con riesgo elevado de DM2 reciban asesoramiento adecuado sobre cambios en su estilo de vida para reducir el riesgo de DMIA59,60
DM: diabetes mellitus; DM2: diabetes mellitus tipo 2; ECV: enfermedad cardiovascular; GPA: glucosa plasmática en ayunas; HbA1c: glucohemoglobina; IG: intolerancia a la glucosa; TTOG: test de tolerancia oral a la glucosa.
a Clase de recomendación.
b Nivel de evidencia.
c Referencias en que se apoya el nivel de evidencia.
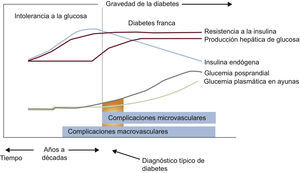
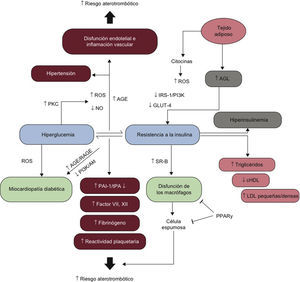
4BASES MOLECULARES DE LA ENFERMEDAD CARDIOVASCULAR EN LA DIABETES MELLITUS4.1El continuo cardiovascular en la diabetes mellitusLa DM2 se caracteriza por un largo tiempo de RI, hiperinsulinemia compensadora y grados variables de elevación de la GP, asociados con aumento del riesgo cardiovascular y de aparición de enfermedad macrovascular antes del diagnóstico (fig. 5). La alteración glucometabólica precoz se caracteriza por una disminución progresiva de la sensibilidad a la insulina y un aumento de la concentración de glucosa que permanece por debajo del umbral necesario para el diagnóstico de DM2, un estado conocido como IG.
Los mecanismos fisiopatológicos en que se apoya el concepto de «continuo glucémico» a través del espectro de GAA, IG, DM y ECV se tratan en las siguientes secciones. La aparición de ECV en sujetos con RI es un proceso progresivo, caracterizado por disfunción endotelial precoz e inflamación vascular que conducen a la movilización de monocitos, la formación de células espumosas y el posterior desarrollo de estrías grasas. A lo largo de muchos años, estos fenómenos favorecen la formación de placas ateroscleróticas, las cuales, en presencia de un entorno inflamatorio aumentado, se convierten en placas inestables y se rompen, lo que promueve la formación de trombos oclusivos. Los ateromas de las personas con DM tienen más lípidos, cambios inflamatorios y trombos que los de aquellos sin DM. Estos cambios ocurren en un periodo de 20-30 años y se producen en paralelo a una serie de anomalías moleculares observadas en sujetos con RI no tratada y DM2.
4.2Fisiopatología de la resistencia a la insulina en la diabetes mellitus tipo 2La RI tiene un papel importante en la fisiopatología de la DM2 y la ECV, y tanto los factores genéticos como los ambientales facilitan su desarrollo. Más del 90% de las personas con DM2 son obesas67 y la liberación de ácidos grasos libres (AGL) y citocinas desde el tejido adiposo disminuye la sensibilidad a la insulina (fig. 6). En el músculo esquelético y el tejido adiposo, la producción de especies reactivas del oxígeno (ROS) inducida por los AGL impide la activación del sustrato 1 del receptor de insulina (IRS-1) y de la señalización por PI3K-Akt, lo que produce una regulación a la baja del transportador 4 de glucosa (GLUT-4) sensible a la insulina68,69.
Hiperglucemia, resistencia a la insulina y enfermedad cardiovascular. AGE: productos de glucación avanzada; AGL: ácidos grasos libres; APT: activador del plasminógeno tisular; cHDL: colesterol unido a las lipoproteínas de alta densidad; GLUT-4: transportador 4 de glucosa; LDL: partículas de lipoproteínas de baja densidad; NO: óxido nítrico; PAI-1: inhibidor 1 del activador de plasminógeno; PI3K: cinasas del fosfatidilinositol 3; PKC: proteincinasa C; PPARy: receptor gamma activado por proliferadores de peroxisoma; RAGE: receptor de productos avanzados de la glucación; ROS: especies reactivas del oxígeno; SR-B: receptor scavenger tipo B.
La disminución inducida por AGL de la vía de señalización de PI3K impide la activación de Akt y la fosforilación de la sintasa del óxido nítrico endotelial (eNOS) en la Ser1177, lo que produce una disminución de la síntesis de NO, disfunción endotelial70 y remodelado vascular (aumento del grosor intimomedial), importantes predictores de ECV (fig. 6)71,72. A su vez, la acumulación de ROS activa el factor de transcripción NF-κB, lo que produce un aumento de la expresión de moléculas de adhesión inflamatorias y citocinas69. La RI crónica estimula la secreción pancreática de insulina, lo que da lugar a un fenotipo complejo que incluye disfunción progresiva de las células beta68, disminución de la concentración de insulina y aumento de la GP. La evidencia respalda el concepto de que la hiperglucemia disminuye aún más la disponibilidad del NO producido en el endotelio y afecta a la función endotelial por diversos mecanismos, muchos de ellos relacionados con el exceso de producción de ROS (fig. 6)73. La cadena mitocondrial de transporte electrónico es una de las primeras dianas de la glucosa elevada, lo que produce un aumento neto de la formación de anión superóxido (O2). Además, se produce un incremento adicional de la producción de O2 debido a la formación de un círculo vicioso secundario a la activación inducida por ROS de la proteincinasa C (PKC)74.
La activación de la PKC por la glucosa induce un aumento de la expresión de la oxidasa de NADPH, del adaptador mitocondrial p66Shc y de la ciclooxigenasa (COX) 2, así como de la producción de tromboxano, y una disminución de la liberación de NO (fig. 6)75,76,77. Los ROS mitocondriales, a su vez, activan cascadas de señalización involucradas en la patogenia de las complicaciones cardiovasculares, como el flujo de poliol, los productos de glucación avanzada (AGE) y sus receptores (RAGE), la PKC y la vía de la hexosamina (HSP) (fig. 6). Evidencias recientes indican que la generación de ROS inducida por la hiperglucemia está involucrada en la persistencia de la disfunción vascular incluso después de que se normalice la concentración de glucosa. Este fenómeno se ha denominado «memoria metabólica» y puede explicar la progresión de las complicaciones macrovasculares y microvasculares a pesar de un control glucémico estricto de los pacientes con DM. Los cambios epigenéticos derivados de los ROS están especialmente involucrados en este proceso74,78.
4.4Disfunción de los macrófagosEl aumento en la acumulación de macrófagos que tiene lugar en el tejido adiposo de los obesos se ha reconocido recientemente como uno de los procesos esenciales de la inflamación metabólica y la RI79. Además, los macrófagos resistentes a la insulina aumentan la expresión de la forma oxidada del receptor scavenger tipo B (SR-B) de las lipoproteínas de baja densidad (LDL) y promueven la formación de células espumosas y aterosclerosis. Estos cambios se pueden revertir por la activación del receptor gamma activado por proliferadores de peroxisoma (PPARγ), que aumenta la señalización de la insulina en los macrófagos (fig. 6). En este sentido, parece ser que las alteraciones de los macrófagos proporcionan un enlace celular entre la DM y la ECV aumentando la RI y contribuyendo al desarrollo de estrías grasas y daño vascular.
4.5Dislipemia aterogénicaLa resistencia a la insulina produce un aumento de la liberación de AGL hacia el hígado debido a la existencia de lipolisis. Por lo tanto, el aumento de la producción hepática de lipoproteínas de muy baja densidad (VLDL) se produce como consecuencia de un incremento de la disponibilidad de sustrato, una disminución de la degradación de apolipoproteína B-100 (ApoB) y un aumento de la lipogénesis. En la DM2 y el SM, estos cambios conducen a un perfil lipídico caracterizado por una concentración elevada de triglicéridos (TG), baja concentración de colesterol unido a lipoproteínas de alta densidad (cHDL) y un aumento de lipoproteínas residuales, síntesis de ApoB y partículas de LDL pequeñas y densas (fig. 6)80. Este subtipo de LDL desempeña un papel importante en la aterogénesis, ya que es más propenso a la oxidación. Por otra parte, las evidencias recientes indican que el papel protector de las HDL puede perderse en los pacientes con DM2 debido a alteraciones de una parte de la proteína, lo que da lugar a un fenotipo prooxidativo inflamatorio81. En los pacientes con DM2, la dislipemia aterogénica es un predictor independiente del riesgo cardiovascular, más fuerte que la concentración elevada de TG o la concentración baja de cHDL80.
4.6Coagulación y función plaquetariaEn los pacientes con DM2, la RI y la hiperglucemia contribuyen a la patogenia de un estado protrombótico caracterizado por un aumento de la concentración de inhibidor 1 del activador de plasminógeno (PAI-1), factores VII y XII y fibrinógeno, y una reducción del activador de plasminógeno tisular (APT) (fig. 6)82. Entre los factores que contribuyen al aumento del riesgo de eventos coronarios en la DM, la hiperreactividad plaquetaria tiene una relevancia capital83. Existen múltiples mecanismos que contribuyen a la disfunción plaquetaria y afectan a la adhesión, la activación y la agregación de las plaquetas, fases involucradas en la trombosis. La hiperglucemia altera la homeostasis del Ca2+ de las plaquetas produciendo anomalías en su citoesqueleto y estimulando la secreción de factores proagregantes. Además, la activación de glucoproteínas (Ib y IIb/IIIa) y P-selectina inducida por la hiperglucemia y su efecto estimulador de la señalización de P2Y12 son procesos clave que subyacen al riesgo aterotrombótico en la DM1 y 2 (fig. 6).
4.7Miocardiopatía diabéticaEn pacientes con DM2, la disminución de la sensibilidad a la insulina predispone a una alteración de la función y la estructura miocárdicas y explica en parte la prevalencia aumentada de la insuficiencia cardiaca (IC) en esta población. La miocardiopatía diabética es una condición clínica diagnosticada cuando ocurre disfunción ventricular en ausencia de aterosclerosis coronaria e hipertensión. Los pacientes con miocardiopatía dilatada de causa desconocida tienen una probabilidad de tener DM un 75% mayor que los controles de la misma edad84. La RI disminuye la contractilidad miocárdica debido a una reducción del influjo del Ca2+ a través de los canales de Ca2+ de tipo L y el intercambio inverso Na2+/Ca2+. La alteración de la vía de señalización de las fosfatidilinositol 3-cinasas (PI3K)/Akt ulterior a la hiperinsulinemia crónica tiene un papel esencial en la disfunción cardiaca de la DM285.
Junto con la RI, la hiperglucemia contribuye a las anomalías cardiacas funcionales y estructurales a través de la acumulación de ROS, señalización por AGE/RAGE y flujo de hexosamina84,86. La activación de las vías de señalización mediadas por ROS afecta a la circulación coronaria y conduce al desarrollo de hipertrofia miocárdica y fibrosis con rigidez ventricular y disfunción de las cavidades (fig. 6)86.
4.8El síndrome metabólicoEl SM se define como un conjunto de factores de riesgo de ECV y DM2, incluidos aumento de la PA, dislipemia (TG elevados y cHDL bajo), aumento de GP y obesidad central. Aunque hay acuerdo en que el SM merece atención, se ha producido un debate intenso en relación con la terminología y los criterios diagnósticos relacionados con su definición87. No obstante, la comunidad médica está de acuerdo en que el término SM es adecuado para representar la combinación de múltiples factores de riesgo. Aunque el SM no incluye factores de riesgo establecidos (p. ej., edad, sexo, tabaquismo), los pacientes con SM tienen el doble de riesgo de sufrir ECV y 5 veces más riesgo de DM2.
4.9Células progenitoras endoteliales y reparación vascularLas células circulantes derivadas de la médula ósea se han reconocido recientemente como un elemento fundamental de la reparación endotelial. Las células progenitoras endoteliales (EPC), una subpoblación de células madre adultas, están involucradas en el mantenimiento de la homeostasis endotelial y contribuyen a la formación de vasos sanguíneos nuevos. Aunque no están claros los mecanismos por los que las EPC protegen el sistema cardiovascular, la evidencia indica que la reducción de EPC y la disminución de su función son características de la DM1 y 2. Por lo tanto, estas células pueden llegar a convertirse en dianas terapéuticas potenciales para el manejo de las complicaciones vasculares relacionadas con la DM88.
4.10ConclusionesEl estrés oxidativo desempeña un papel crucial en el desarrollo de complicaciones microvasculares y macrovasculares. La acumulación de radicales libres en la vasculatura de los pacientes con DM causa la activación de rutas bioquímicas perjudiciales que conducen a la inflamación vascular y la generación de ROS. Debido a que la carga de riesgo cardiovascular no se suprime mediante el control glucémico intensivo combinado con un tratamiento multifactorial óptimo, es necesario desarrollar estrategias terapéuticas basadas en los mecanismos. En particular, la inhibición de enzimas clave involucradas en el daño vascular inducido por hiperglucemia o la activación de vías de señalización que mejoren la sensibilidad a la insulina pueden ser enfoques terapéuticos prometedores.
5EVALUACIÓN DEL RIESGO CARDIOVASCULAR EN PACIENTES CON GLUCEMIA MAL CONTROLADAEl objetivo de la evaluación del riesgo es clasificar a la población en sujetos en riesgo de ECV bajo, moderado, alto o muy alto, con el fin de intensificar los enfoques preventivos de manera individualizada. La Guía de Práctica Clínica de 2012 sobre prevención de ECV de la Joint European Society recomendaba que se debía considerar de muy alto riesgo a los pacientes con DM y al menos un FRCV o daño de un órgano diana y al resto de los pacientes, de alto riesgo89. El desarrollo de índices de riesgo que puedan aplicarse de manera general es difícil, porque los factores de confusión asociados a la etnia, diferencias culturales, marcadores metabólicos e inflamatorios y, sobre todo, los índices de enfermedad coronaria y accidentes cerebrovasculares son diferentes. Todos estos aspectos sirven para subrayar la enorme importancia de manejar a los pacientes con DM de acuerdo con enfoques basados en la evidencia, dirigidos a dianas específicas y hechos a la medida de las necesidades individuales del paciente.
5.1Índices de riesgo desarrollados para personas sin diabetesLas ecuaciones de riesgo del estudio de Framingham basadas en edad, sexo, PA, colesterol total, cHDL y tabaquismo, con la DM como variable categórica90, se han validado de forma prospectiva en varias poblaciones91,92. En pacientes con DM, los resultados son inconsistentes, pues subestiman el riesgo cardiovascular en la población de Reino Unido y lo sobrestiman en la población española93,94. Los resultados recientes del Framingham Heart Study demuestran que los factores de riesgo estándar, incluida la DM medida en condiciones basales, están relacionados con la incidencia de eventos cardiovasculares después de 30 años de seguimiento95.
El European Systematic Coronary Risk Evaluation (SCORE®) de enfermedad coronaria fatal y ECV no se desarrolló para aplicarlo a pacientes con DM89,93.
El grupo de estudio DECODE ha desarrollado una ecuación de riesgo de muerte cardiovascular incorporando la tolerancia a la glucosa y la GPA96. Este índice de riesgo se ha asociado a un 11% de subestimación del riesgo cardiovascular93.
El esquema de riesgo Prospective Cardiovascular Münster (PROCAM)97 ha tenido una calibración pobre, con un cociente de eventos observados/previstos de 2,79 para la ECV y 2,05 para la cardiopatía isquémica (CI)98.
Las tablas del Registre Gironí del Cor (REGICOR)99 subestiman el riesgo de ECV cuando se aplican a la población mediterránea (española)94.
5.2Evaluación del riesgo cardiovascular en personas con prediabetesLos resultados del estudio DECODE han mostrado que la elevación de la 2hGP, pero no de la GPA, ha sido capaz de prever la mortalidad por cualquier causa, ECV y CI tras ajustar por otros FRCV mayores (para más detalles, véase la sección 3.2)43,100.
5.3Instrumentos de valoración del riesgo desarrollados para personas con diabetesEl índice de riesgo de CI del United Kingdom Prospective Diabetes Study (UKPDS) ha tenido buena sensibilidad (90%) en la población de Reino Unido101,102, pero ha sobrestimado el riesgo en la población española94 y ha tenido una especificidad moderada en la población griega103. Además, este índice de riesgo se desarrolló antes de la aparición de las estrategias modernas para la prevención de ECV.
El Swedish National Diabetes Register (NDR) se ha aplicado a una población sueca homogénea y ha mostrado buena calibración104.
El Framingham Study para ictus solo se ha sometido a validación en un grupo español de 178 pacientes y ha sobrestimado el riesgo105,106.
El UKPDS para accidente cerebrovascular ha subestimado el riesgo de accidente cerebrovascular fatal en una población estadounidense107.
El Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation (ADVANCE) es un modelo contemporáneo para la predicción del riesgo cardiovascular desarrollado a partir de la cohorte internacional ADVANCE108. Este modelo, que incorpora la edad en el momento del diagnóstico, la duración conocida de la DM, el sexo, la presión del pulso, la hipertensión tratada, la fibrilación auricular, la retinopatía, la HbA1c, el cociente albumina:creatinina urinaria y el colesterol no-HDL basal, ha mostrado una discriminación aceptable y buena calibración en la validación interna. La aplicabilidad externa del modelo se ha comprobado en una cohorte independiente de sujetos con DM2, en la que se ha demostrado un grado de discriminación similar.
Un metanálisis reciente ha revisado 17 índices de riesgo, 15 de ellos en poblaciones predominantemente caucásicas (Estados Unidos y Europa) y dos en una población china (Hong Kong). Hay poca evidencia de que el uso de índices de riesgo específicos para DM proporcione una estimación más precisa del riesgo de ECV109. Los índices de riesgo para la evaluación de DM dan buenos resultados en las poblaciones en que se han desarrollado, aunque es necesario realizar una validación en otras poblaciones.
5.4Evaluación del riesgo basado en biomarcadores e imagenEl estudio ARIC ha evaluado prospectivamente si la inclusión de la proteína C reactiva o cada uno de otros 18 nuevos factores de riesgo a un modelo básico de riesgo puede mejorar la predicción de la incidencia de ECV en varones y mujeres de mediana edad. Ninguno de estos marcadores nuevos ha mejorado el índice de riesgo110. Un estudio holandés que incluyó a 972 pacientes con DM ha evaluado el índice de riesgo UKPDS basal y la acumulación de AGE en la piel11 utilizando autofluorescencia. La inclusión de AGE en la piel al índice de riesgo UKPDS ha dado lugar a una reclasificación del 27% de los pacientes desde el grupo de bajo riesgo al de alto riesgo. La tasa de eventos cardiovasculares a los 10 años fue más elevada en los pacientes con un índice UKPDS > 10% cuando los AGE de la piel estaban por encima de la mediana (el 56 frente al 39%)112. Esta técnica puede convertirse en una herramienta útil en la estratificación del riesgo de DM, pero se necesita más información para poder validarla.
En pacientes con DM2, la albuminuria es un factor de riesgo de eventos cardiovasculares futuros, IC y mortalidad por cualquier causa, incluso después de ajustar por otros factores de riesgo113. La concentración elevada de segmento aminoterminal del propéptido natriurético cerebral (NT-proBNP) circulante también es un fuerte predictor del exceso de mortalidad cardiovascular y total, independiente de la albuminuria y de los factores de riesgo convencionales114.
La aterosclerosis subclínica, medida a partir de técnicas de imagen del calcio coronario, se ha demostrado superior que los factores de riesgo establecidos para predecir la isquemia miocárdica silente y los resultados clínicos a corto plazo. El calcio coronario y la escintigrafía de perfusión miocárdica tienen efectos sinérgicos en la predicción de eventos cardiovasculares a corto plazo115.
El índice tobillo-brazo116, el grosor intimomedial carotídeo y la detección de placas carotídeas117, la rigidez arterial cuantificada por la velocidad de la onda de pulso118 y la neuropatía autonómica cardiaca determinada a partir de pruebas estándar de reflejos119 pueden considerarse marcadores cardiovasculares útiles, capaces de añadir valor predictivo a los cálculos de riesgo habituales.
La CI suele ser silente en los pacientes con DM y hasta un 60% de los infartos de miocardio pueden ser asintomáticos y diagnosticarse únicamente a partir del cribado sistemático mediante electrocardiograma (ECG)120. La isquemia miocárdica silente (IMS) puede detectarse mediante un ECG de estrés, escintigrafía miocárdica o ecocardiografía de estrés. La IMS afecta a un 20-35% de los pacientes con DM que tienen factores de riesgo adicionales y un 35-70% de pacientes con IMS tienen estenosis coronaria significativa en la angiografía, mientras que en los demás pacientes la IMS puede ser consecuencia de alteraciones de la función del endotelio coronario o de la microcirculación coronaria. La IMS es un factor de riesgo cardiaco mayor, sobre todo cuando se asocia a estenosis coronaria en la angiografía, y el valor predictivo de la IMS y las estenosis coronarias silentes mejora el cálculo de riesgo habitual121. No obstante, sigue siendo discutible la necesidad de buscar sistemáticamente CI en pacientes asintomáticos. No está recomendado por la ADA, ya que no mejora los resultados mientras se traten los FRCV122. Sin embargo, esta opinión es controvertida y sería necesario definir las características de los pacientes a los que se debería estudiar la presencia de CI123. Se necesita evidencia adicional que respalden la búsqueda de IMS en todos los pacientes de alto riesgo que tengan DM. La búsqueda de CI puede llevarse a cabo en pacientes que tengan un riesgo especialmente elevado, como aquellos con evidencia de enfermedad arterial periférica (EAP) o con un índice de calcio coronario elevado o proteinuria y en sujetos que deseen iniciar un programa de ejercicio vigoroso124.
El daño de órganos diana cardiovasculares, como índice tobillobrazo bajo, aumento del grosor intimomedial carotídeo, rigidez arterial o calcio coronario, neuropatía autonómica cardiaca e IMS, puede ser causa de una parte del riesgo cardiovascular residual que permanece incluso después de controlar los factores de riesgo convencionales. La detección de estos trastornos contribuye a cuantificar el riesgo de manera más precisa, y debería promover un control más intensivo de los factores de riesgo modificables, especialmente un objetivo más estricto del colesterol unido a LDL (cLDL) de < 1,8 mmol/l (∼70 mg/dl)125. En pacientes con IMS, se puede proponer un tratamiento médico o revascularización coronaria según las necesidades individuales. Sin embargo, es necesario evaluar el coste-efectividad de esta estrategia.
5.5Aspectos de conocimiento incompleto- •
Es necesario averiguar cómo prevenir o retrasar la DM1.
- •
Es necesario encontrar nuevos biomarcadores y estrategias diagnósticas útiles para la detección precoz de CI en pacientes asintomáticos.
- •
El conocimiento sobre la predicción del riesgo cardiovascular de los sujetos prediabéticos es pobre.
Recomendaciones sobre la evaluación del riesgo cardiovascular en la diabetesRecomendacionesClaseaNivelbRef.cSe debe considerar clasificar a los pacientes con DM en muy alto riesgo o alto riesgo de ECV según la presencia de factores de riesgo concomitantes y daño de órganos dianaIIaC—No se recomienda evaluar el riesgo de ECV en pacientes con DM basándose en puntuaciones de riesgo desarrolladas para la población generalIIIC—Se recomienda calcular la tasa de excreción urinaria de albúmina al estratificar el riesgo de pacientes con DMIB113Se puede considerar la búsqueda de isquemia miocárdica silente en pacientes diabéticos de alto riesgo seleccionadosIIbC—
DM: diabetes mellitus; ECV: enfermedad cardiovascular.
a Clase de recomendación.
b Nivel de evidencia.
c Referencias en que se apoya el nivel de evidencia.
6PREVENCIÓN DE LA ENFERMEDAD CARDIOVASCULAR EN PACIENTES CON DIABETES6.1Estilo de vidaUna declaración científica conjunta de la ADA y la EASD propone el manejo de los hábitos de vida (que incluye dieta saludable, actividad física y abandono del tabaquismo) como la primera medida de prevención y manejo de la DM2, con el objeto de perder peso y reducir el riesgo cardiovascular126. Otras organizaciones también recomiendan el enfoque individualizado para la DM2127. Una revisión Cochrane reciente ha concluido que los resultados sobre la eficacia de la intervención dietética en la DM2 son escasos y de una calidad relativamente pobre128. La declaración de posición de la ADA, «Nutrition Recommendations and Interventions for Diabetes», proporciona una revisión más detallada sobre estos temas129,130.
La mayoría de los europeos con DM2 son obesos y se considera que el control del peso es uno de los componentes principales de la intervención sobre el estilo de vida. El Look AHEAD es un estudio clínico de gran tamaño que analizó los efectos a largo plazo de la pérdida de peso en la glucemia y la prevención de eventos cardiovasculares en la DM2. Los resultados al cabo de 1 año de la intervención intensiva sobre el estilo de vida mostraron una media de pérdida de peso del 8,6%, una disminución significativa de la HbA1c y una reducción de varios FRCV, unos beneficios que se mantenían después de 4 años131,132. No obstante, el estudio se interrumpió en 2012 por considerárselo inútil, ya que no se detectaron diferencias en la incidencia de eventos cardiovasculares entre los grupos. La reducción de peso (o al menos la estabilización del peso de personas con sobrepeso o moderadamente obesas) va a seguir siendo un componente importante en un programa sobre hábitos de vida y puede tener efectos pleotrópicos. En los sujetos muy obesos, la cirugía bariátrica produce una pérdida de peso a largo plazo y reduce las tasas de incidencia de DM2 y mortalidad133.
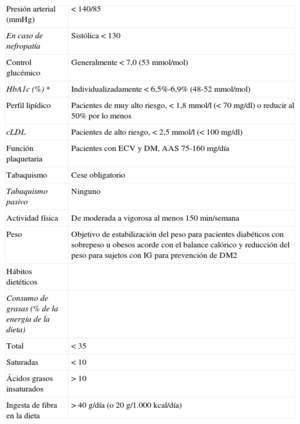
6.1.1DietaLas intervenciones dietéticas recomendadas por el Diabetes and Nutrition Study Group de la EASD son menos estrictas que muchas otras recomendaciones dietéticas anteriores57. En ellas se reconoce que se puede adoptar diversas estrategias de alimentación y se hace hincapié en el concepto de que un consumo adecuado de energía total y una dieta en que predomine el aporte de frutas, verduras, cereales integrales y proteínas con escasez de grasas es más importante que las proporciones exactas de energía total aportada por los principales macronutrientes. También se indica que el consumo de sal debe restringirse.
Se ha señalado que no hay beneficio en las dietas hiperproteicas respecto a las dietas con alto contenido en hidratos de carbono en la DM2134. Las recomendaciones dietéticas específicas incluyen la restricción de grasas saturadas y tipo trans y del consumo de alcohol, la monitorización del consumo de hidratos de carbono y el aumento del consumo de fibra. No está recomendada la suplementación sistemática con antioxidantes, como las vitaminas E y C y los carotenos, debido a la ausencia de eficacia y las dudas sobre su seguridad a largo plazo135. Para quienes prefieran un mayor consumo de grasas, se considera aceptable la dieta de tipo mediterráneo siempre que las fuentes de grasa se deriven principalmente de aceites monoinsaturados, como se ha demostrado en el estudio PREDIMED, que ha utilizado aceite de oliva virgen136.
Distribución recomendada de macronutrientes57:
Proteínas: un 10-20% de la energía total para pacientes sin nefropatía (si la hay, se reducen las proteínas).
Ácidos grasos saturados y transinsaturados: combinados, menos del 10% de la energía total diaria. Un consumo < 8% puede ser beneficioso cuando el cLDL esté elevado.
Los aceites ricos en ácidos grasos monoinsaturados son fuentes de grasa útiles y pueden aportar un 10-20% de la energía total siempre que el consumo total de grasas no exceda el 35% del total de energía.
Ácidos grasos poliinsaturados: hasta un 10% de la energía diaria total.
El consumo total de grasas no debe superar el 35% de la energía total. Para quienes tengan sobrepeso, un consumo de grasas < 30% puede ayudar a perder peso. Se recomienda consumir pescado, preferiblemente azul, dos o tres veces por semana y vegetales que sean fuente de ácidos grasos n-3 (como aceite de colza, aceite de soja, nueces y algunas verduras) para asegurar una ingesta adecuada de estos. La ingesta de colesterol debe ser < 300 mg/día y debe reducirse aún más si el cLDL está elevado. El consumo de ácidos grasos trans debe reducirse tanto como sea posible tratando de no consumir ninguno de origen industrial y limitándolo a menos del 1% del total del consumo energético de origen natural.
Los hidratos de carbono pueden oscilar entre el 45 y el 60% del total de energía. Las características metabólicas indican que el consumo más adecuado para los sujetos con DM se encuentra en esa banda. No existe justificación para recomendar dietas muy bajas en hidratos de carbono en la DM. Las cantidades de estos, su origen y su distribución deben seleccionarse para permitir un control glucémico a largo plazo próximo a la normalidad. Las personas que estén en tratamiento con insulina o hipoglucemiantes orales deben ajustar el momento y la dosis de la medicación de acuerdo con la cantidad y la naturaleza de la fuente de hidratos de carbono. Cuando del consumo de hidratos de carbono se encuentre en el límite superior de la franja recomendada, es importante aumentar la ingesta de alimentos ricos en fibra que tengan un índice glucémico bajo.
Verduras, legumbres, frutas y cereales integrales deben formar parte de la dieta.
El consumo de fibra debe ser > 40 g/día (o 20 g/1.000 kcal/día) y aproximadamente la mitad debe ser fibra soluble. El consumo de al menos 5 raciones diarias de verduras ricas en fibra o fruta y al menos 4 raciones semanales de legumbres puede aportar los requerimientos mínimos de fibra. Los alimentos basados en cereales deben ser integrales y ricos en fibra.
El consumo de alcohol en cantidades moderadas, que no sobrepasen los dos vasos o 20 g/día los varones y un vaso o 10 g/día las mujeres89, se asocia a menor riesgo de ECV respecto a los abstemios o los bebedores importantes tanto con DM como sin DM137. El consumo excesivo de alcohol se asocia a hipertrigliceridemia e hipertensión89.
Consumo de café: más de 4 tazas/día se asocia a menor riesgo de ECV en sujetos con DM2138, pero es importante señalar que el café hervido sin filtrar aumenta la concentración de cLDL y se debe evitar139.
6.1.2Actividad físicaLa actividad física es importante para la prevención de la DM2 para las personas con IG y para controlar la glucemia y las complicaciones cardiovasculares relacionadas140,141. El ejercicio aeróbico y de resistencia mejora la acción de la insulina y tiene efectos favorables en GP, lípidos, PA y riesgo cardiovascular142. El ejercicio regular es necesario para que se mantenga el beneficio.
No se conoce bien cuál es la mejor manera de promover la actividad física; sin embargo, los resultados de varios estudios clínicos controlados y aleatorizados respaldan la necesidad de que los profesionales de la salud animen a sus pacientes a practicar ejercicio físico143,144,145. Las revisiones sistemáticas143,144 han descrito que el ejercicio aeróbico estructurado o el ejercicio de resistencia reducen la HbA1c en aproximadamente un 0,6% en la DM2. Puesto que la disminución de la HbA1c se asocia a una reducción a largo plazo de los eventos cardiovasculares y reducción de las complicaciones microvasculares146, los programas de ejercicio a largo plazo que conducen a un mejor control glucémico pueden reducir la aparición de complicaciones vasculares. El entrenamiento combinado aeróbico y de resistencia tiene un impacto en la HbA1c mayor que el entrenamiento aeróbico o de resistencia por separado147. En un metanálisis reciente de 23 estudios, el entrenamiento estructurado se asoció a una reducción de HbA1c del 0,7% rspecto a los controles143. El ejercicio estructurado > 150 min/semana se ha asociado a una reducción de la HbA1c del 0,9% y del 0,4% practicado menos de 150 min/semana. En conjunto, las intervenciones dirigidas a aconsejar la práctica de actividad física se han asociado a menor concentración de HbA1c solo cuando se combinan con recomendaciones dietéticas147.
6.1.3TabaquismoEl tabaquismo aumenta el riesgo de DM2148, ECV y muerte prematura149, por lo que se debe evitar. El abandono del tabaco reduce el riesgo de ECV150. Se debe ofrecer a los sujetos fumadores con DM un programa estructurado para dejar de fumar que incluya apoyo farmacológico si es necesario (p. ej., bupropión y vareniclina). Se debe proporcionar instrucciones detalladas sobre abandono del hábito tabáquico según los principios de las cinco A (tabla 7), tal como se detalla en la guía Joint European Prevention de 201289.
La estrategia de «las 5 A» para dejar de fumar
| A: ASK (preguntar) | Interrogar sistemáticamente sobre el consumo de tabaco en cada oportunidad |
| A: ADVISE (aconsejar) | Instar de forma inequívoca a todos los fumadores a abandonar el tabaco |
| A: ASSESS (evaluar) | Determinar el grado de adicción y la disposición para dejar el hábito |
| A: ASSIST (ayudar) | Acordar una estrategia para dejar de fumar, incluida una fecha concreta, asesoramiento conductual y apoyo farmacológico |
| A: ARRANGE (organizar) | Organizar un calendario de seguimiento |
Los hábitos de vida que tienen influencia en el riesgo de ECV de las personas con DM están cambiando continuamente y es necesario seguirlos.
Se desconoce cuál es el riesgo de ECV causado por el aumento de la prevalencia de DM2 entre los jóvenes debido a formas de vida no saludables.
No se sabe si la remisión de DM2 observada después de la cirugía bariátrica conduce a una reducción del riesgo de ECV.
6.1.5Recomendaciones sobre modificaciones en el estilo de vida en la diabetesRecomendaciones sobre modificaciones en el estilo de vida en la diabetesRecomendacionesClaseaNivelbRef.cSe recomienda el abandono del tabaco guiado por un consejo estructurado a todos los sujetos con DM e IGIA148Se recomienda una ingesta de grasas < 35% de la energía total, de grasas saturadas < 10% y de ácidos grasos monoinsaturados > 10% para la prevención de la DM2 y el control de la DMIA57,129, 132,134Se recomienda una ingesta de fibra > 40 g/día (o 20 g/1.000 kcal/día) para prevenir la DM2 y controlar la DMIA57,129, 132,134Se puede recomendar cualquier dieta con aporte energético reducido para disminuir el exceso de peso corporal en la DMIB129,132No se recomiendan los suplementos vitamínicos o de micronutrientes para reducir el riesgo de DM2 o ECV en la DMIIIB129,135Se recomienda la actividad física de intensidad moderada a vigorosa al menos 150 min/semana para la prevención y el control de la DM2 y la prevención de ECV en la DMIA141,142Se recomienda el ejercicio aeróbico y el entrenamiento de resistencia en la prevención de la DM2 y el control de la DM, preferiblemente combinadosIA144
DM: diabetes mellitus; DM2: diabetes mellitus tipo 2; ECV: enfermedad cardiovascular.
a Clase de recomendación.
b Nivel de evidencia.
c Referencias en que se apoya el nivel de evidencia.
6.2Control de la glucosaLos estudios controlados y aleatorizados proporcionan una evidencia abrumadora de que las complicaciones microvasculares de la DM se reducen mediante un control glucémico estricto151,152,153, que también ejerce un influencia positiva, aunque menor, en la ECV, que se pone de manifiesto después de muchos años154,155. No obstante, el control intensivo de la glucosa, combinado con un control eficaz de la PA y una reducción de los lípidos, parece acortar significativamente el tiempo necesario para obtener una mejoría en la tasa de eventos cardiovasculares156.
6.2.1Enfermedad microvascular (retinopatía, nefropatía y neuropatía)La reducción intensiva de la glucosa, con un objetivo de HbA1c de un 6,0-7,0% (42 53 mmol/mol)157, se ha asociado de manera consistente a una reducción de la frecuencia y la gravedad de las complicaciones microvasculares. Esto es aplicable tanto a la DM1 como a la DM2, aunque los resultados clínicos son menos aparentes en la DM2 con complicaciones establecidas, para la que el número de pacientes que es necesario tratar (NNT) es alto158,159,160,161,162. Los análisis realizados a partir de los estudios DCCT y UKPDS han demostrado una relación continua entre el aumento de la HbA1c y las complicaciones microvasculares, sin que haya un umbral aparente146,163. En el estudio DCCT, una disminución de la HbA1c del 2% (21,9 mmol/mol) redujo significativamente el riesgo de aparición y progresión de retinopatía y nefropatía151, aunque el riesgo absoluto fue bajo para una reducción de HbA1c < 7,5% (58 mmol/mol). El estudio UKPDS ha documentado una relación similar en sujetos con DM2146,152.
6.2.2Enfermedad macrovascular (enfermedad cerebral, coronaria y arterial periférica)A pesar la estrecha relación existente entre glucemia y enfermedad microvascular, la situación es más confusa en la enfermedad macrovascular. La hiperglucemia en la banda alta de la normalidad, con una elevación menor de la HbA1c 164,165, se ha asociado a un aumento del riesgo cardiovascular que es dependiente de la concentración. Sin embargo, los efectos en el riesgo cardiovascular de mejorar la glucemia siguen siendo inciertos y algunos recientes estudios clínicos controlados y aleatorizados no han aportado evidencia clara en esta área159-162. Entre las muchas razones están las comorbilidades múltiples de los pacientes que tienen DM2 desde hace tiempo y la existencia de un fenotipo de riesgo complejo generado en presencia de RI (para más detalles, véase la sección 4).
6.2.3Efectos a medio plazo del control glucémicoEstudio Action to Control Cardiovascular Risk in Diabetes (ACCORD): se aleatorizó a 10.251 participantes con DM2 y riesgo cardiovascular alto a recibir control intensivo de glucosa para alcanzar una HbA1c del 6,4% (46 mmol/mol) o un tratamiento estándar para alcanzar una HbA1c del 7,5% (58 mmol/mol)159. Después de un seguimiento medio de 3,5 años, el estudio se finalizó debido a un aumento de la mortalidad en el grupo de tratamiento intensivo (14 frente a 11 muertes/1.000 pacientes/año), que era más pronunciado entre los pacientes con múltiples FRCV y se debía fundamentalmente a mortalidad cardiovascular. Tal como se esperaba, la tasa de hipoglucemia era mayor en el grupo de tratamiento intensivo y en los pacientes con peor control glucémico, aunque el papel de la hipoglucemia en los resultados clínicos de la ECV no está claro. Análisis posteriores han revelado que la mayor mortalidad podría deberse a fluctuaciones de la glucosa, combinadas con la incapacidad para controlar la glucosa hasta el objetivo propuesto, a pesar de un tratamiento agresivo de reducción de glucosa166. El recientemente prolongado seguimiento del estudio ACCORD no ha podido dar apoyo a la hipótesis de que la hipoglucemia sintomática grave estuviera relacionada con la mayor tasa de mortalidad167.
Estudio Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation (ADVANCE): se aleatorizó a 11.140 participantes con DM2 y alto riesgo cardiovascular a recibir un tratamiento intensivo o uno convencional de reducción de la glucosa160. El grupo de tratamiento intensivo alcanzó una HbA1c del 6,5% (48 mmol/mol), comparado con el 7,3% (56 mmol/mol) del grupo estándar. El objetivo principal (complicaciones macrovasculares o microvasculares mayores) se redujo en el grupo de tratamiento intensivo (HR = 0,90; IC95%, 0,82-0,98) debido a una reducción de la nefropatía. El control glucémico intensivo no fue capaz de influir en el componente macrovascular del objetivo principal (HR = 0,94; IC95%, 0,84-1,06). Contrariamente a lo ocurrido en el estudio ACCORD, no se produjo un aumento de la mortalidad (HR = 0,93; IC95%, 0,83-1,06) a pesar de una disminución de la HbA1c parecida. La hipoglucemia grave se redujo en dos tercios en el grupo de tratamiento intensivo del estudio ADVANCE, comparada con el estudio ACCORD, y la reducción de la HbA1c hasta el objetivo propuesto se alcanzó a un ritmo más lento que en el estudio ACCORD. Además, estos estudios tuvieron diferentes perfiles basales de riesgo cardiovascular, con una tasa de eventos mayor en el grupo control del estudio ADVANCE.
Estudio VADT: se aleatorizó a 1.791 pacientes con DM2 a recibir un control intensivo o un control estándar de la glucosa; el grupo de tratamiento intensivo alcanzó una HbA1c del 6,9% (52 mmol/mol), frente al 8,4% (68 mmol/mol) del grupo de tratamiento estándar161. No hubo una reducción significativa del objetivo cardiovascular principal combinada en el grupo de tratamiento intensivo (HR = 0,88; IC95%, 0,74-1,05).
El estudio ORIGIN aleatorizó a 12.537 pacientes (media de edad, 63,5 años) con riesgo cardiovascular elevado más GAA, IG o DM2 a recibir insulina glargina (con un objetivo de glucosa plasmática en ayunas de 5,3 mmol/l [≤ 95 mg/dl]) o tratamiento estándar. Después de un seguimiento medio de 6,2 años, las tasas de incidencia de eventos cardiovasculares fueron similares en los grupos de insulina glargina y de tratamiento estándar. Las tasas de hipoglucemia grave fueron de 1,00 frente a 0,31/100 personas-año. El peso corporal medio aumentó en 1,6 kg en el grupo de insulina glargina y se redujo en 0,5 kg en el grupo de tratamiento estándar. No hubo indicios de que la insulina glargina se asociara a cáncer168.
ConclusionesUn metanálisis de los resultados cardiovasculares basado en los estudios VADT, ACCORD y ADVANCE ha señalado que una reducción de la HbA1c de ∼1% se asocia a un 15% de reducción del riesgo relativo (RRR) de IM no fatal, pero sin beneficios en los accidentes cerebrovasculares o la mortalidad de cualquier causa169. No obstante, los pacientes con DM2 de corta duración, con una concentración basal de HbA1c más baja en el momento de la aleatorización y sin historia clínica de ECV, parecen beneficiarse de estrategias de reducción de glucosa más intensivas. Esta interpretación se apoya en los resultados del estudio ORIGIN, que no ha demostrado efectos beneficios ni perjudiciales en las variables cardiovasculares con la instauración precoz de tratamientos basados en la insulina, aunque la insulina glargina se asoció a un aumento de la hipoglucemia. Esto indica que el control glucémico intensivo se debe aplicar de manera adecuada e individualizada teniendo en cuenta la edad, la duración de la DM2 y la historia de ECV.
6.2.4Efectos a largo plazo del control glucémicoEstudios DCCT y EDIC: en el estudio DCCT, la tasa de eventos cardiovasculares no se modificó significativamente en el grupo de tratamiento intensivo151. Después de concluir ese estudio, se siguió en el estudio EDIC al 93% de la cohorte durante 11 años adicionales, durante los cuales las diferencias en HbA1c desaparecieron154. Durante el seguimiento combinado de 17 años, el riesgo de cualquier episodio cardiovascular se redujo en el grupo intensivo en un 42% (9-63%; p < 0,01).
Estudio UKPDS: aunque se produjo una clara reducción de las complicaciones microvasculares, la reducción de IM fue solo del 16% (p = 0,052). En la fase de prolongación del estudio, la reducción del riesgo de IM se mantuvo en un 15%, una cifra que llegó a ser significativa a medida que el número de casos aumentaba. Además, los efectos beneficiosos persistieron para cualquier variable relacionada con la DM; el IM y la mortalidad por cualquier causa se redujeron en un 13%155. Es importante destacar que este estudio se realizó cuando la reducción de lípidos y PA se manejaba de manera menos efectiva, en parte debido a la ausencia de los potentes fármacos actualmente disponibles. Por lo tanto, el estudio UKPDS se llevó a cabo en un momento en que otros aspectos importantes del manejo multifactorial eran menos eficaces. Se podría especular que verificar el efecto beneficioso de los fármacos hipoglucemiantes en aquel momento habría sido más sencillo que en los estudios clínicos posteriores.
ConclusionesLos estudios DCCT y UKPDS han demostrado que en la DM1 y la DM2: a) el control glucémico es importante para reducir las complicaciones macrovasculares a largo plazo; b) es necesario realizar un seguimiento muy largo para demostrar efecto, y c) el control precoz de la glucosa es importante (memoria metabólica).
6.2.5Objetivos glucémicosSe puede considerar el objetivo de HbA1c < 7,0% (< 53 mmol/mol) como generalmente aceptado para reducir la enfermedad microvascular151,152,153,155,159. Las evidencias que relacionan un objetivo de concentración de HbA1c y el riesgo macrovascular son menos claras, en parte debido a la complejidad que rodea a la naturaleza crónica y progresiva de la DM y los efectos de la memoria metabólica153,155,169. Hay consenso en que se debería alcanzar una HbA1c ≤ 7%, pero reconociendo la necesidad de prestar atención a los requerimientos individuales de cada paciente. Idealmente, el control estricto debe iniciarse precozmente en el transcurso de la enfermedad para las personas jóvenes que no tengan comorbilidades. La GPA debe ser < 7,2 mmol/l (< 120 mg/dl) y la posprandial, < 9-10 mmol/l (< 160-180 mg/dl) en términos individualizados. Un tratamiento exitoso de reducción de glucosa debe llevarse a cabo con ayuda de autodeterminaciones de la glucosa sanguínea, sobre todo en pacientes diabéticos tratados con insulina170. Cuando el objetivo sea aproximarse a la normoglucemia, se debe tener en cuenta la hiperglucemia posprandial además de la glucemia en ayunas. Sin embargo, aunque la hiperglucemia posprandial se asocia a un aumento de la incidencia de eventos de ECV (véase la sección 3.4), sigue siendo controvertido que los tratamientos dirigidos a la hiperglucemia posprandial añadan algún beneficio a los resultados clínicos de ECV171,172,173,174.
Se puede considerar objetivos más restrictivos (p. ej., HbA1c 6,0-6,5% [42-48 mmol/mol]) para pacientes seleccionados con una enfermedad de corta duración, esperanza de vida larga y ECV no significativa, siempre que se pueda alcanzarlos sin hipoglucemia u otros efectos adversos. Como ya se ha discutido, los resultados acumulados a partir de estudios cardiovasculares de DM2 indican que no todos los pacientes se benefician de un manejo agresivo de la glucosa. De todo ello se deduce que es importante establecer unos objetivos de tratamiento individualizados126.
6.2.6Fármacos hipoglucemiantesLa elección del fármaco, la combinación utilizada y los potenciales efectos secundarios están relacionados con el mecanismo de acción del fármaco. La elección del fármaco, las condiciones de su uso y el papel del tratamiento combinado son aspectos que escapan a los objetivos de este documento y se han revisado extensamente en las guías conjuntas de ADA/EASD126. De forma resumida, los agentes terapéuticos para el manejo de la hiperglucemia se caracterizan, en general, por pertenecer a uno de estos tres grupos: a) fármacos que aportan insulina o estimulan su liberación (insulina, sulfonilureas, meglitinidas, agonistas del receptor 1 del péptido glucagonoide [GLP1] e inhibidores de la dipeptidilpeptidasa-4 [DPP-4]); b) sensibilizadores a la insulina (metformina, pioglitazona), y c) inhibidores de la absorción de glucosa (inhibidores de la alfaglucosidasa e inhibidores del cotransportador 2 de sodio-glucosa [SGLT2]). Sulfonilureas, meglitinidas y miméticos de las incretinas (agonistas del receptor GLP-1 e inhibidores de la DPP-4) actúan estimulando las células beta pancreáticas para aumentar la secreción de insulina endógena. Los agonistas del receptor GLP-1 y los inhibidores de la DPP-4 tienen efectos adicionales en el tracto gastrointestinal y el cerebro, con efectos beneficiosos en la saciedad (peso neutro para los inhibidores de la DPP-4, pérdida de peso asociada a los agonistas del receptor de GLP1), aunque en alrededor del 20% de los pacientes tratados pueden producirse náuseas transitorias, que pueden persistir durante 46 semanas después de iniciar el tratamiento. La pioglitazona es un agonista de PPARγ, con efectos parciales de PPARα, que reduce la glucosa mejorando la RI, mientras que la metformina es una biguanida que ejerce efectos parecidos a través de la activación de la adenosina monofosfato cinasa. Los dos fármacos tienden a reducir los requerimientos de insulina en pacientes con DM2 tratados con insulina; en el estudio PROActive, el uso de pioglitazona se asoció a una reducción duradera de los requerimientos de insulina175. La acarbosa reduce la absorción de glucosa desde el tracto gastrointestinal, mientras que los inhibidores del SGLT2 actúan en el túbulo renal proximal para reducir la absorción de glucosa. La reducción esperable de HbA1c con cada uno de los tratamientos orales, o con una administración subcutánea de agonistas del receptor de GLP-1 como monoterapia, es generalmente de alrededor del 0,5-1,0%, aunque puede variar entre individuos dependiendo de la duración de la DM y otros factores. Es habitual necesitar un tratamiento triple (metformina más dos fármacos a elegir entre pioglitazona, sulfonilurea, miméticos de las incretinas, meglitinidas e inhibidores de la absorción de glucosa) a medida que la enfermedad progresa.
En la DM1, el tratamiento intensivo de reducción de glucosa mediante un régimen de un bolo basal, ya sea liberado mediante múltiples inyecciones de insulina o utilizando una bomba de insulina, está considerado como el tratamiento de referencia151. En la DM2, la metformina es el tratamiento de elección, sobre todo para pacientes con sobrepeso126. Un aspecto preocupante del uso de metformina es el riesgo de acidosis láctica, especialmente en pacientes con función renal deprimida y enfermedad hepática. En las revisiones sistemáticas de los resultados de los ensayos clínicos con pacientes seleccionados, la acidosis láctica no está sobrerrepresentada176. A pesar de ello, la metformina no está recomendada cuando la TFG sea < 50 ml/min177. Actualmente se está debatiendo si estos valores de corte son demasiado restrictivos. Las guías del National Institute for Health and Clinical Excellence (NICE) de Reino Unido son más flexibles y permiten su uso hasta una TFG de 30 ml/min, y aconsejan una reducción de la dosis cuando sea 45 ml/min127.
Para alcanzar los objetivos de glucosa, se suele necesitar una combinación de fármacos hipoglucemiantes precozmente tras el diagnóstico. El tratamiento agresivo precoz parece tener un papel en la reducción de las complicaciones cardiovasculares, pero no se ha demostrado formalmente en estudios clínicos prospectivos.
Seguridad cardiovascular de los fármacos hipoglucemiantesOpciones en el tratamiento farmacológico de la diabetes mellitus tipo 2
| Clase de fármaco | Efecto | Cambio en el peso | Hipoglucemia (monoterapia) | Comentarios |
| Metformina | Sensibilización a la insulina | Neutro/disminución | No | Efectos secundarios gastrointestinales, acidosis láctica, déficit de B12. Contraindicaciones, TFG baja, hipoxia, deshidratación |
| Sulfonilureas | Aumento de la secreción de insulina | Aumento | Sí | Alergia. Riesgo de hipoglucemia y ganancia de peso |
| Meglitinidas | Aumento de la secreción de insulina | Aumento | Sí | Dosificaciones frecuentes. Riesgo de hipoglucemia |
| Inhibidores de la alfaglucosidasa | Inhibición de la absorción de glucosa | Neutro | No | Efectos secundarios gastrointestinales. Dosificaciones frecuentes |
| Pioglitazona | Sensibilización a la insulina | Aumento | No | Insuficiencia cardiaca, edema, fracturas, cáncer de vejiga (?) |
| Agonistas del GLP-1 | Aumento de la secreción de insulina | Disminución | No | Efectos secundarios gastrointestinales. Pancreatitis. Inyectable |
| Inhibidores de la DPP-4 | Aumento de la secreción de insulina | Neutro | No | Pancreatitis |
| Insulina | Aporte de insulina | Aumento | Sí | Inyectable. Riesgo de hipoglucemia y ganancia de peso |
| Inhibidores del SGLT2 | Bloqueo la absorción renal de glucosa en los túbulos proximales | Disminución | NoInfecciones urinarias |
DPP-4: dipeptilpeptidasa 4; GLP-1: péptido similar al glucagón tipo 1; SGLT2: cotransportador-2 de sodio-glucosa; TFG: tasa de filtrado glomerular.
La preocupación surgida por los posibles efectos cardiovasculares adversos de la rosiglitazona178 ha planteado dudas sobre la seguridad cardiovascular de los fármacos hipoglucemiantes, especialmente cuando se usan en combinación. El seguimiento de 10 años tras finalizar el estudio UKPDS ha revelado que los pacientes tratados con sulfonilurea-insulina tenían una reducción del riesgo (RR) de IM de 0,85 (IC95%, 0,74-0,97; p = 0,01) y de muerte de 0,87 (IC95%, 0,79-0,96;
p < 0,007)153,155. Para metformina en pacientes con sobrepeso fueron RR = 0,67 (IC95%, 0,51-0,89; p = 0,005) y RR = 0,73 (IC95%, 0,59-0,89; p = 0,002). Aunque el estudio UKPDS indicaba que la metformina tiene efecto beneficioso en los resultados clínicos de ECV —lo que llevó a adoptar la metformina como tratamiento de elección para pacientes con DM2 y sobrepeso—, es importante subrayar que, en general, no existe evidencia clara que respalde este punto de vista y se señala que, en combinación con sulfonilurea, pueden producirse efectos perjudiciales relacionados tanto con la morbilidad como con la mortalidad. No obstante, los resultados de este metanálisis también indican beneficio después de un tratamiento prolongado para pacientes jóvenes179. La pioglitazona ha reducido el objetivo combinado secundario de mortalidad por cualquier causa, IM fatal y accidente cerebrovascular en el estudio PROactive (HR = 0,84;IC95%, 0,72-0,98; p = 0,027) en pacientes con DM2 y alto riesgo de enfermedad macrovascular175. Sin embargo, debido a que el objetivo principal del estudio PROactive no alcanzó significación estadística, la interpretación de estos resultados sigue siendo controvertida. El uso de pioglitazona se asocia a retención de fluidos secundaria a los efectos renales y este efecto se asocia a edema periférico y empeoramiento de la IC establecida en sujetos susceptibles. Se puede iniciar tratamiento diurético para mejorar estos efectos secundarios. En el estudio STOP-NIDDM, la acarbosa, administrada a pacientes con IG, redujo el número de eventos de ECV, incluida la muerte cardiovascular172. Las meglitinidas no se han comprobado formalmente en la DM2, pero en los pacientes con IG de alto riesgo, la nateglinida no redujo los eventos cardiovasculares fatales y no fatales180. Hasta el momento no se han publicado datos clínicos procedentes de estudios clínicos controlados y aleatorizados sobre los agonistas del receptor de GLP-1, los inhibidores de la DPP4 o los inhibidores del SGLT2, pero están en marcha estudios clínicos prospectivos de gran tamaño que analizan variables cardiovasculares con ellos.
6.2.7Consideraciones especiales6.2.7.1HipoglucemiaLa reducción intensiva de glucosa aumenta la incidencia de hipoglucemia 3-4 veces, tanto en la DM1 como en la DM2151,162. La alteración de la percepción de la hipoglucemia aumenta con la duración de la DM y es un importante factor de riesgo de hipoglucemia que debe tenerse en cuenta cuando se considera instaurar un tratamiento de reducción de glucosa181. Además de los riesgos a corto plazo de tener arritmias cardiacas y eventos cardiovasculares, entre los riesgos a largo plazo se cuenta el desarrollo de demencia y disfunción cognitiva182,183. Los resultados clínicos de los estudios de reducción de glucosa han planteado la cuestión de si la hipoglucemia es un importante factor de riesgo de IM para los pacientes con DM. Frier et al182 han revisado extensamente este tema y han proporcionado evidencias de un gran número de efectos adversos de la hipoglucemia en el sistema cardiovascular, especialmente en caso de neuropatía autonómica. La insulina, las meglitinidas y las suflonilureas se asocian particularmente con la hipoglucemia, que ocurre frecuentemente tanto en la DM1 como en la DM2. Se debe prestar atención a la prevención de la hipoglucemia mientras se alcanzan los objetivos glucémicos individualizados.
Fármacos hipoglucemiantes en la enfermedad renal crónicaAlrededor del 25% de las personas con DM2 se encuentran en fase 3-4 (TFG < 50 ml/min) de la enfermedad renal crónica. Aparte del aumento del riesgo cardiovascular asociado a esta enfermedad, el uso de fármacos hipoglucemiantes puede requerir algún tipo de modificación, ya sea porque un fármaco particular está contraindicado en la enfermedad renal crónica o porque hay que corregir las dosis184. Se deb e e vitar la me tformina, la acarbosa y la ma y oría de las sulfonilureas en las fases 3-4 de la enfermedad renal cónica, mientras que el tratamiento con insulina y pioglitazona se puede usar en su lugar. Los inhibidores de la DPP-4 precisan un ajuste de dosis en la enfermedad renal crónica progresiva, con excepción de la linagliptina, que se tolera bien en estas circunstancias. Los inhibidores del SGLT2 no se han evaluado en la enfermedad renal crónica.
Pacientes ancianosLas personas de edad avanzada tienen mayor carga de enfermedad aterosclerótica, una función renal disminuida y más comorbilidades. La esperanza de vida está disminuida, sobre todo cuando hay complicaciones a largo plazo. Los objetivos glucémicos para las personas de edad avanzada con enfermedad complicada o de larga duración deben ser menos ambiciosos que los de las personas más jóvenes y más sanas. Si no se puede alcanzar estos objetivos más bajos con intervenciones simples, puede ser aceptable una HbA1c < 7,5-8,0% (< 58-64 mmol/mol), con una transición progresiva al alza a medida que aumenta la edad y disminuyen las capacidades de autocuidado, cognitivas y psicológicas y se reducen la situación económica y los sistemas de apoyo126.
Atención individualizadaSe debe evaluar cuidadosa e individualizadamente las influencias en la calidad de vida, los efectos adversos de la polifarmacia y las molestias de los programas intensivos de reducción de glucosa para pacientes con DM (para más información, véase la sección 9). Desde la perspectiva de la salud pública, incluso reducciones menores de la glucemia media pueden ser ventajosas. Por otra parte, el tratamiento intensivo de reducción de glucosa puede imponer al enfermo una carga considerable y un posible perjuicio. Se debe animar a cada paciente individual a alcanzar el mejor compromiso entre el control de la glucosa y el riesgo vascular y, cuando se instaure un tratamiento intensivo, se debe informar a los pacientes para que comprendan los riesgos y los beneficios que conlleva.
6.2.8Aspectos de conocimiento incompletoSe desconocen los resultados a largo plazo en ECV de la mayoría de los tratamientos de reducción de glucosa.
No se conoce bien las consecuencias de la polifarmacia en la calidad de vida ni cuál es el tratamiento más adecuado para pacientes con DM y comorbilidades, sobre todo ancianos.
Se desconoce el nivel de glucemia (GPA, 2hGP, HbA1c) en el cual se pueden observar beneficios cardiovasculares en la DM2, ya que no se han llevado a cabo estudios con este objetivo.
6.2.9Recomendaciones sobre el control glucémico en la diabetesRecomendaciones sobre el control glucémico en la diabetesRecomendacionesClaseaNivelbRef.cSe recomienda establecer un régimen individualizado de reducción de glucosa teniendo en cuenta duración de la DM, comorbilidades y edadIC—Se recomienda el control estricto de la glucosa con un objetivo de HbA1c casi normal (< 7,0% o < 53 mmol/mol) para reducir las complicaciones microvasculares en la DM1 y 2IA151-153, 155,159Se debe considerar un objetivo de HbA1c ≤ 7,0% (≤ 53 mmol/mol) para la prevención de la ECV en DM1 y 2IIaC—Se recomienda un régimen con bolo basal de insulina combinado con monitorización frecuente de la glucosa para optimizar el control glucémico en la DM1IA151,154Se debe considerar la metformina como tratamiento de primera elección para pacientes con DM2 tras evaluar la función renalIIaB153
DM: diabetes mellitus; DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2; ECV: enfermedad cardiovascular; HbA1c: glucohemoglobina.
a Clase de recomendación.
b Nivel de evidencia.
c Referencias en que se apoya el nivel de evidencia.
6.3Presión arterialLa prevalencia de hipertensión es mayor entre los pacientes con DM1 que en la población general (hasta un 49% en DCCT/EDIC)185,186 y más del 60% de los pacientes diagnosticados de DM2 tienen hipertensión arterial187. Según las consideraciones fisiopatológicas actuales, esto está relacionado con que: a) la hiperinsulinemia está vinculada a un aumento de la reabsorción renal de sodio; b) hay un aumento del tono simpático, y c) se produce un aumento de la actividad del sistema renina-angiotensina-aldosterona (SRAA)188. La obesidad, el envejecimiento y la aparición de enfermedad renal aumentan aún más la prevalencia de la hipertensión. La DM y la hipertensión son factores de riesgo de ECV aditivos. Mientras que contraer DM2 duplica el riesgo cardiovascular de los varones y triplica el de las mujeres, la hipertensión multiplica por 4 el riesgo cardiovascular de los sujetos con DM189,190. Aunque se presentan los objetivos del tratamiento, es necesario tener presente que el manejo de la PA debe aplicarse individualizadamente. Por ejemplo, la existencia de múltiples comorbilidades, el aumento de la edad, las interacciones farmacológicas y el patrón de enfermedad vascular, son todos ellos factores que influyen en el enfoque terapéutico y los objetivos individuales.
6.3.1Objetivos terapéuticosEn la DM, el nivel de PA recomendado se ha debatido mucho. En general, las medidas encaminadas a reducir la PA elevada deben aplicarse a todos los pacientes con DM, debido a que la PA alta implica un riesgo cardiovascular sustancialmente elevado para estos pacientes. Los estudios clínicos controlados y aleatorizados en DM2 han demostrado efectos positivos en los resultados cardiovasculares a partir de la reducción de la PA sistólica a ≤ 140 mmHg y la PA diastólica ≤ 85 mmHg191,192,193,194. El estudio HOT ha demostrado que el riesgo disminuye cuando el objetivo diastólico es < 80 mmHg195. Sin embargo, la PA diastólica media en este grupo seguía estando por encima de 80 y la sistólica llegaba hasta 144 mmHg. El estudio UKPDS ha demostrado que el control «estricto» (media, 144/82 mmHg), comparado con el «menos estricto» (154/87 mmHg) reduce los eventos macrovasculares en un 24%. En un análisis observacional post-hoc del estudio UKPDS, la mortalidad relacionada con la DM se redujo un 15% con cada reducción de 10 mmHg hasta una PA sistólica de 120 mmHg, sin indicación de un valor umbral196. En el más reciente estudio ACCORD, se asignó a más de 4.700 pacientes a recibir tratamiento intensivo (PA sistólica alcanzada, 119 mmHg) o tratamiento estándar (PA sistólica media, 134 mmHg) durante un seguimiento medio de 4,7 años. La reducción relativa del objetivo combinado (IM no fatal, accidente cerebrovascular no fatal o muerte por ECV) obtenida con el tratamiento intensivo no alcanzó significación estadística192. El número medio de fármacos reductores de la PA fue 3,5 en el grupo intensivo, frente a 2,1 en el grupo estándar. La proporción de pacientes con efectos secundarios importantes (como hipotensión y reducción progresiva de la función renal) aumentó desde el 1,3 al 3,3% con el tratamiento agresivo. Puesto que el cociente riesgo-beneficio se inclinó hacia un efecto perjudicial, este estudio no aporta evidencia que respalde una estrategia de reducción de la PA sistólica a < 130 mmHg. Bangalore et al197 han publicado un metanálisis de 13 estudios clínicos controlados y aleatorizados a partir de 37.736 pacientes con DM, GAA o IG que, en el grupo intensivo, alcanzaron una PA sistólica ≤ 135 mmHg y, en el grupo estándar, ≤ 140 mmHg. El análisis indica que el control más intensivo se asocia a un 10% de reducción de la mortalidad por cualquier causa (IC95%, 0,83-0,98), un 17% de reducción de los accidentes cerebrovasculares y un 20% de aumento de los eventos adversos importantes. Una PA sistólica ≤ 130 mmHg se relaciona con mayor reducción de los accidentes cerebrovasculares, pero no tiene efecto en otros eventos cardiovasculares.
En resumen, la evidencia disponible indica que es razonable reducir la PA de los pacientes con DM hasta < 140/85 mmHg. Es importante señalar que una reducción adicional puede conllevar un aumento de los eventos adversos graves, sobre todo en pacientes de edad avanzada y con mayor duración de la DM2. Por lo tanto, se debe considerar cuidadosamente los riesgos y los beneficios individuales del control intensivo de la PA.
6.3.2Manejo de la reducción de la presión arterialLas intervenciones sobre el estilo de vida, que incluyen la restricción de la ingesta de sal y la pérdida de peso, son la base terapéutica para todos los pacientes con hipertensión; no obstante, a menudo estas intervenciones son insuficientes para un control adecuado de la PA (para más detalles, véase la sección 6.1).
Tratamiento farmacológico: el efecto en resultados cardiovasculares del tratamiento farmacológico se ha verificado en muy pocos estudios clínicos controlados y aleatorizados que hayan comparado la eficacia de los fármacos reductores de la PA dirigidos específicamente a pacientes con DM191,198,199. No obstante, existen bastantes estudios clínicos controlados y aleatorizados con subgrupos de DM de un tamaño considerable que han publicado resultados específicos de este subgrupo200,201,202,203,204,205,206,207. Parece ser que el bloqueo del SRAA mediante un inhibidor de la enzima de conversión de la angiotensina (IECA) o un antagonista del receptor de la angiotensina II (ARA-II), ofrece unos resultados particularmente positivos, especialmente en el tratamiento de la hipertensión de pacientes con DM de alto riesgo cardiovascular200,201,205,206,207. La evidencia también respalda la eficacia de los IECA, más que los antagonistas de los canales del calcio, como tratamiento inicial cuando la intención sea prevenir o retrasar la ocurrencia de microalbuminuria en pacientes hipertensos con DM208. El bloqueo doble del SRAA combinando un IECA con un ARA-II no ha demostrado beneficios adicionales en el estudio ONTARGET y, sin embargo, se ha asociado a un mayor número de eventos adversos. En el estudio ALTITUDE, la adición de aliskiren al bloqueo del SRAA en pacientes con DM2 con riesgo elevado de eventos cardiovasculares y renales no ha disminuido los eventos cardiovasculares e incluso puede haber sido perjudicial209,210. Puesto que los pacientes con DM tienden a tener PA elevada durante la noche, se debe considerar la administración de los fármacos antihipertensivos en el momento de irse a dormir, idealmente después de una evaluación ambulatoria del perfil de PA de 24 h del paciente.
Un aspecto que ha sido objeto de discusión en las décadas pasadas es si las acciones metabólicas de varios fármacos reductores de la PA son importantes para los resultados cardiovasculares a largo plazo. Está bien establecido que el uso de tiacidas y bloqueadores beta se asocia a aumento del riesgo de sufrir DM2, en comparación con los antagonistas de los canales del calcio y los inhibidores del SRAA211. No se sabe si el tratamiento con bloqueadores beta y tiacidas, o con diuréticos similares a la tiacida, en pacientes con DM2 establecida produce algún efecto metabólico adverso de importancia clínica. La observación del estudio UKPDS de que el control de la hiperglucemia —contrariamente al control eficaz de la PA— tiene una influencia relativamente menor en los resultados clínicos cardiovasculares indica que los efectos metabólicos negativos pueden ser menos importantes cuando se trata la hipertensión de los pacientes con DM, al menos en lo que se refiere a las complicaciones macrovasculares. Por lo tanto, mientras que se debe evitar el uso de fármacos con efectos metabólicos negativos —particularmente la combinación de un diurético y un bloqueador beta— como tratamiento de primera elección para pacientes hipertensos con SM, el objetivo de reducir la PA parece más importante que las alteraciones menores del estado metabólico en los pacientes con DM establecida. Un metanálisis reciente ha enfatizado la prioridad de reducir la PA sobre la elección de la clase de fármaco212. En ausencia de comorbilidad cardiaca, los bloqueadores beta no son la primera elección para el tratamiento de la hipertensión205,206. El control adecuado de la PA a menudo requiere un tratamiento combinado con un inhibidor del SRAA y un antagonista de los canales del calcio o un diurético. El estudio ACCOMPLISH ha indicado que la combinación del antagonista de los canales del calcio amlodipino más IECA es superior a la combinación de hidroclorotiazida más IECA207. En 6.946 pacientes con DM, el número de eventos primarios fue 307 en el grupo tratado con amlodipino más un IECA y 383 en el grupo tratado con hidroclorotiazida añadida al benazepril (p = 0,003), a pesar de una reducción de la PA similar en ambos grupos.
6.3.3ConclusionesEl objetivo principal del tratamiento de la hipertensión de los pacientes con DM debe ser reducir la PA a valores < 140/85 mmHg. Para alcanzar este objetivo, la mayoría de los pacientes requieren una combinación de fármacos hipotensores. Para pacientes con hipertensión y nefropatía con proteinuria franca, se puede considerar un valor de PA aún más bajo (sistólica < 130 mmHg) si el paciente lo tolera bien (véase la sección 8). Se puede usar cualquiera de los fármacos reductores de PA actualmente disponibles, pero la evidencia da fuerte respaldo a la inclusión de un inhibidor del SRAA (IECA/ARA-II) en caso de proteinuria. Es necesario tener presente que muchos pacientes con DM no alcanzan el objetivo de PA recomendado213. También es importante mencionar que, contrariamente a lo publicado sobre control glucémico y estatinas155, no existe un legado de hipertensión o efecto memoria194. En consecuencia, se recomienda un control con monitorización continua y un ajuste médico adecuado.
Estas conclusiones principales en relación con el tratamiento de los pacientes con DM e hipertensión son coherentes con la «Reevaluación de las Guías Europeas de Práctica Clínica sobre Hipertensión» de 2009 (Re-appraisal of the European Guidelines on Hypertension 2009)214 y con la actualización de la guía de práctica clínica europea sobre hipertensión de 2013 (European Guidelines for Hypertension 2013)215.
6.3.4Aspectos de conocimiento incompletoNo se conoce bien las consecuencias de las combinaciones multifarmacológicas para reducir la PA de los pacientes ancianos.
La evidencia sobre eficacia o perjuicio en cuanto a complicaciones macrovasculares con los fármacos reductores de la PA, administrados solos o en combinación, es débil.
La comprensión del papel de la rigidez arterial para predecir el riesgo cardiovascular, más allá de los factores de riesgo convencionales, en pacientes con DM es pobre.
No se conoce los objetivos óptimos de PA.
¿Son clínicamente relevantes los efectos secundarios metabólicos de los bloqueadores beta o los diuréticos?
6.3.5Recomendaciones sobre el control de la presión arterial en la diabetesRecomendaciones sobre el control de la presión arterial en la diabetesRecomendacionesClaseaNivelbRef.cSe recomienda el control de PA de los pacientes con DM e hipertensión para reducir el riesgo de eventos cardiovascularesIA189-191, 193-195Se recomienda el tratamiento individualizado de los pacientes con hipertensión y DM, con un objetivo de PA < 140/85 mmHgIA191-193, 195Se recomienda el uso de varios fármacos antihipertensivos combinados para conseguir el control de la PAIA192-195, 205-207Se recomienda un inhibidor del SRAA (IECA o ARA-II) para el tratamiento de la hipertensión en la DM, especialmente en presencia de proteinuria o microalbuminuriaIA200, 205-207Se debe evitar la administración simultánea de dos inhibidores del SRAA en pacientes con DMIIIB209,210
ARA-II: antagonista del receptor de la angiotensina II; DM: diabetes mellitus; IECA: inhibidor de la enzima de conversión de la angiotensina; PA: presión arterial; SRAA: sistema renina-angiotensina-aldosterona.
a Clase de recomendación.
b Nivel de evidencia.
c Referencias en que se apoya el nivel de evidencia.
6.4Dislipemia6.4.1FisiopatologíaEn sujetos con DM1 y buen control glucémico, el patrón de anomalías lipídicas contrasta con el de la DM2, ya que en la DM1 los TG séricos son normales y el cHDL está en la banda superior de la normalidad o ligeramente elevado. Este patrón está ligado al tratamiento con insulina, que aumenta la actividad de la lipoproteinlipasa en el tejido adiposo y la tasa de recambio de las partículas de lipoproteínas de muy baja densidad (VLDL). Sin embargo, los cambios cualitativos de las partículas de lipoproteínas de baja densidad (LDL) y alta densidad (HDL) podrían ser aterogénicos.
Hay un conjunto de anomalías de lípidos y lipoproteínas que acompañan a la DM2 y afectan a todas las clases de lipoproteínas (tabla 9). Los dos componentes principales son la elevación moderada de los TG en ayunas y posprandiales y el cHDL bajo. Otras características comprenden la elevación de lipoproteínas ricas en TG (TRL), incluidos los restos de quilomicrones y VLDL, así como partículas pequeñas de LDL.
Características de la dislipemia en la diabetes mellitus tipo 2
| • La dislipemia es un importante factor de riesgo de ECV |
| • La dislipemia es un grupo de trastornos lipídicos y lipoproteicos, entre ellos aumentos de TG en ayunas y posprandial, ApoB, partículas de LDL pequeñas y densas y reducción de cHDL y ApoA |
| • El aumento del perímetro de la cintura y la elevación de los TG son una herramienta sencilla para identificar a los sujetos de alto riesgo con síndrome metabólico |
Apo: apolipoproteína; cHDL: colesterol unido a lipoproteínas de alta densidad; ECV: enfermedad cardiovascular; LDL: lipoproteínas de baja densidad; TG: triglicéridos.
Todos estos componentes no son anomalías aisladas, sino que tienen vínculos metabólicos. La sobreproducción de partículas de VLDL de gran tamaño junto con el aumento de la secreción de TG y ApoB-100 conducen a la generación de partículas pequeñas y densas de LDL y la disminución de cHDL. Como las partículas de VLDL, las partículas de LDL y las partículas residuales transportan una única molécula de ApoB-100, la dislipemia se caracteriza por una elevación de la concentración de ApoB. En consecuencia, la naturaleza maligna de la dislipemia en la DM2 no siempre se pone de manifiesto mediante una determinación lipídica habitual, ya que el cLDL permanece dentro de la normalidad y a menudo se puede caracterizar mejor utilizando el colesterol no-HDL. Hay considerable evidencia de que el desequilibrio entre la captación y la liberación hepática de lípidos produce una acumulación excesiva de grasa en el hígado (esteatosis hepática no alcohólica). El aumento del flujo de AGL procede tanto de los AGL sistémicos como de la lipogénesis de novo en el contexto de la RI216,217. Por lo tanto, el contenido de las grasas del hígado y la RI hepática parecen ser causa de la sobreproducción de partículas de VLDL de gran tamaño en sujetos con DM2.
La menor eliminación de las partículas de VLDL de gran tamaño junto con el aumento de la concentración de ApoC contribuye a una hipertrigliceridemia más intensa218. Así pues, los defectos metabólicos duales participan en el desarrollo de la hipertrigliceridemia de las personas con DM2. Los datos recientes indican que parte del exceso del aporte lipídico al hígado en presencia de obesidad puede deberse a una respuesta de mala adaptación del tejido adiposo a las reservas de AGL circulantes, que produce el depósito graso ectópico y la lipotoxicidad subyacentes a la dislipemia de la DM y la RI219.
6.4.2EpidemiologíaEl registro European Action on Secondary Prevention through Intervention to Reduce Events (EUROASPIRE III)220,221 ha documentado que la prevalencia global de la elevación de TG y disminución de cHDL es casi el doble que la prevalencia observada en el EUROASPIRE II, debido al aumento de la DM2 y la obesidad. Un estudio poblacional de 75.048 pacientes con DM2 basado en el registro nacional de diabetes de Suecia ha publicado que el 49% de los pacientes no recibían fármacos hipolipemiantes. El 55% de los pacientes tratados tenían cifras de TG < 1,7 mmol/l y alrededor de dos tercios tenían cifras de cHDL normales222. Los resultados del mismo registro han revelado que dos tercios de los pacientes que recibían tratamiento hipolipemiante alcanzaron concentraciones de cLDL < 2,5 mmol/l223. No obstante, más del 70% de los pacientes con historia de ECV tenían cLDL > 1,8 mmol/l. Es importante señalar que solo se usaron dosis moderadas de las diferentes estatinas, lo que pone de manifiesto la necesidad de intensificar el tratamiento y corregir este problema del manejo terapéutico.
Dislipemia y riesgo vascular en la diabetes mellitus tipo 2Hay gran cantidad de datos de casos y controles, estudios mecanísticos, genéticos y observacionales de gran tamaño que indican una asociación causal entre la elevación de partículas ricas en TG y sus partículas residuales, la reducción de cHDL y el riesgo de ECV224,225. Los resultados de los estudios con estatinas refuerzan el concepto de que la concentración baja de HDL es un marcador independiente de riesgo de ECV, incluso en pacientes que no tienen una elevación importante del cLDL226,227. Los datos de los estudios FIELD y ACCORD han demostrado que la tasa de eventos cardiovasculares es significativamente mayor en los pacientes con dislipemia (cLDL, 2,6 mmol/l [100 mg/dl]; TG ≥ 2,3 mmol/l y cHDL ≤ 0,88 mmol/l)228,229. En el estudio FIELD230, las variables basales que mejor predecían los eventos cardiovasculares durante un seguimiento de 5 años fueron los cocientes lipídicos (colesterol no-HDL/cHDL y colesterol total/cHDL). El cociente ApoB/ApoA está relacionado con los resultados cardiovasculares, pero este cociente no fue superior a los cocientes de lípidos tradicionales. Entre las concentraciones de lípidos y lipoproteínas basales individuales, cHDL, ApoA, colesterol no-HDL y ApoB predijeron individualmente los eventos cardiovasculares, aunque ApoA y ApoB no fueron mejores que cHDL o colesterol no-HDL. La potencia de los TG séricos para predecir eventos de ECV estaba atenuada por el ajuste por cHDL. Estos resultados fueron inesperados, ya que la dislipemia de la DM es un conjunto de anomalías caracterizadas por elevaciones de ApoB y partículas pequeñas y densas de LDL. Sin embargo, estos datos están totalmente de acuerdo con los resultados del estudio ERFC231, basado en 68 estudios, que incluyó a 302.430 participantes sin historia de ECV. En este análisis, el colesterol no-HDL y la ApoB, por separado, presentaron una asociación similar con la enfermedad coronaria independientemente de la presencia de DM. El estudio ERFC ha descrito que un aumento de 1 desviación estándar en el cHDL (0,38 mmol/l o 15 mg/dl) estaba asociado a una reducción del 22% del riesgo de enfermedad coronaria. Las HR del colesterol no-HDL y el cHDL fueron similares a los observados para ApoB y ApoA y el colesterol no-HDL fue el mejor marcador para identificar el riesgo asociado a la elevación de proteínas ricas en TG en la práctica clínica. También se está apoyando el uso de ApoB y ApoB/ApoA como marcadores de riesgo de ECV en la DM2.
6.4.3Manejo de la dislipemia6.4.3.1Diabetes mellitus tipo 2Se dispone de datos exhaustivos y consistentes sobre el mecanismo de acción y la eficacia de las estatinas en la prevención de eventos cardiovasculares en la DM2232. Los beneficios del tratamiento con estatinas en reducción de cLDL y eventos cardiovasculares se han observado en todos los análisis de subgrupos de los principales estudios controlados y aleatorizados233. En un metanálisis de 14 estudios controlados y aleatorizados que incluyeron a 18.686 sujetos con DM, la duración media del seguimiento ha sido de 4,3 años, con 3.247 eventos vasculares mayores. El estudio ha descrito un 9% de reducción en la mortalidad por cualquier causa y un 21% de reducción en la incidencia de eventos vasculares mayores por cada 1 mmol/l de reducción de cLDL (RR = 0,79; IC99%, 0,72-0,87; p < 0,0001), similar a lo observado en pacientes no diabéticos. La magnitud del beneficio se asocia a la reducción absoluta de cLDL, lo que subraya la relación positiva entre cLDL y riesgo de ECV y ya se pone de manifiesto con un valor basal de cLDL tan bajo como 2,6 mmol/l234.
Los resultados del primer metanálisis de eventos cardiovasculares sobre tratamiento con estatinas intensivo frente a moderado muestran un 16% de reducción de riesgo de muerte coronaria o IM235. Los resultados de 10 estudios clínicos controlados y aleatorizados, que incluyeron a 41.778 pacientes seguidos durante 2,5 años, han demostrado que la dosis intensiva de estatina reduce el objetivo combinado de enfermedad coronaria en un 10% (IC95%, 0,84-0,96; p < 0,0001), pero no reduce la mortalidad por ECV232. En un subgrupo de pacientes con SCA, el tratamiento intensivo con estatinas redujo la mortalidad por cualquier causa y la mortalidad por ECV. La reducción intensiva de cLDL con estatinas tuvo efecto beneficioso en la progresión del ateroma en pacientes diabéticos y no diabéticos236.
La intensificación de la reducción de cLDL también se puede conseguir añadiendo ezetimiba a una estatina, aunque todavía no hay resultados de ningún estudio clínico controlado y aleatorizado que demuestre que esta combinación tiene un impacto significativo en los resultados de ECV. No obstante, el estudio IMPROVE-IT (ClinicalTrials. gov: ***N**C**T**00202878) está en marcha. Un análisis de los resultados agrupados sobre seguridad, que compara el perfil de eficacia y seguridad del tratamiento combinado con ezetimiba/estatina frente a la monoterapia con estatina en pacientes diabéticos y no diabéticos (n = 21.794)237, ha documentado que el tratamiento combinado se asocia a mayor efecto en todas las determinaciones lipídicas principales. El estudio SHARP ha descrito una reducción del 17% de todos los eventos ateroscleróticos mayores en la enfermedad renal crónica tratada con simvastatina más ezetimiba diariamente frente a placebo238. En este contexto, es necesario subrayar que, aunque la reducción relativa de eventos puede ser similar para las personas con y sin DM, el beneficio absoluto es mayor para los pacientes diabéticos debido a que tienen mayor riesgo.
Diabetes mellitus tipo 1El metanálisis CTT incluyó a 1.466 pacientes con DM1 y una media de edad de 55 años y en la mayoría de los casos con eventos previos de ECV. Este análisis ha demostrado una reducción del riesgo de eventos de ECV similar (RR = 0,79; IC95%, 0,62-1,01) a la observada en la DM2 (p para interacción = 1), verificándose el resultado a pesar de una diferencia estadística en el límite de la significación en el subgrupo234. Hay que mencionar que no se dispone de datos sobre la eficacia del tratamiento con estatinas en poblaciones más jóvenes con DM1. No obstante, en la DM1 el tratamiento con estatinas de los pacientes con alto riesgo de ECV se debe evaluar caso a caso, independientemente de la concentración de cLDL (p. ej., pacientes con DM1 y alteración renal).
Prevención primariaEl estudio CARDS ha evaluado los beneficios de una estatina en pacientes con DM2 y al menos uno de los siguientes factores de riesgo: hipertensión, tabaquismo activo, retinopatía o albuminuria239. En este estudio, se aleatorizó a 2.838 pacientes con DM2 a recibir atorvastatina 10 mg/día o placebo. Se tuvo que interrumpir el estudio prematuramente porque se produjo una reducción del 37% (IC95%, –52 a –17; p = 0,0001) del objetivo principal (primer evento coronario agudo). El estudio HPS ha incluido a 2.912 pacientes (principalmente con DM2) sin ECV previa. La simvastatina (40 mg/día) redujo el objetivo principal combinado en un 33% (p = 0,0003; IC95%, 17-46)240. En el análisis de subgrupos del estudio ASCOT de los pacientes diabéticos que no tenían ECV, la administración de 10 mg de atorvastatina redujo la tasa de eventos cardiovasculares mayores y procedimientos en un 23% (IC95%, 0,61-0,98; p = 0,04)241.
Seguridad del tratamiento con estatinasLos resultados publicados de los principales estudios clínicos controlados y aleatorizados demuestran que las estatinas son seguras y se toleran bien242. La frecuencia de eventos adversos, excepto en el caso de síntomas musculares, es rara. En la mayor parte de los casos de miopatía o rabdomiolisis, hay interacciones farmacológicas y administración de dosis de estatinas superiores a las estándar243. Se debe evitar la combinación de gemfibrozilo y estatinas debido a la interacción farmacológica, pero no hay problemas de seguridad con el fenofibrato y las estatinas228,229.
Un metanálisis que incluyó a 91.140 participantes ha descrito que el tratamiento con estatinas se asocia a riesgo de DM2 de nueva aparición (OR = 1,09; IC95%, 1,0-1,2; I2 = 11%), que aumenta con la edad244. Los resultados se traducen en 1 caso de DM2 después de haber tratado a 255 pacientes durante 4 años. En un tiempo similar, las estatinas podrían prevenir 5,4 eventos cardiovasculares por cada 1 mmol/l de reducción de cLDL. Un metanálisis de cinco estudios con estatinas ha descrito que el riesgo de DM de nueva aparición aumenta con el tratamiento intensivo (atorvastatina o simvastatina 80 mg/día) (OR = 1,12; IC95%, 1,04-1,22; I2 = 0%), comparado con el tratamiento de dosis moderada (simvastatina 20 mg o pravastatina 40 mg)245. En el grupo intensivo, se observaron 2 casos adicionales de DM de nueva aparición cada 1.000 pacientes-año, mientras que el número de eventos de ECV fue de 6,5 casos menos. Recientemente, la Food and Drug Administration (FDA) de Estados Unidos ha aprobado modificaciones en el prospecto relativas al aumento de la glucosa sanguínea y la HbA1c para los fármacos que pertenecen a la clase de las estatinas (www.fda.gov/downloads/Drugs/DrugSafety/UCM293474.pdf). La FDA sigue considerando que el pequeño riesgo de sufrir DM está claramente superado por el beneficio que supone la reducción de los eventos cardiovasculares245,246. Un metanálisis de 27 estudios aleatorizados aporta más evidencia sobre la seguridad de las estatinas al demostrar que, en sujetos con un riesgo de eventos vasculares mayores a 5 años < 10%, cada 1 mmol/l de reducción de cLDL produce una reducción absoluta en los eventos vasculares mayores de aproximadamente 11/1.000 durante 5 años sin aumento de la incidencia de cáncer o muerte por otras causas. Este beneficio excede ampliamente cualquier peligro conocido relacionado con el tratamiento con estatinas247.
Riesgo residual en personas que reciben tratamiento reductor de LDLLos pacientes con DM2 que consiguen el objetivo de cLDL siguen presentando alto riesgo de ECV224, este riesgo residual tiene relación con muchos factores, como la elevación de proteínas rica en TG, el cHDL bajo y la presencia de partículas pequeñas y densas de LDL. Se ha propuesto que tratar los TG elevados (> 2,2 mmol/l) y el cHDL bajo (< 1,0 mmol/l) puede proporcionar beneficios adicionales. En el estudio FIELD, el tratamiento con fenofibrato no redujo el objetivo principal (muerte por enfermedad coronaria e IM no fatal), pero los eventos por ECV se redujeron de 14 a 12,5% (HR = 0,9; IC95%, 0,80-0,99; p = 0,035)228,248. En el estudio ACCORD, se asignó a 5.518 pacientes a recibir fenofibrato más simvastatina (20-40 mg diarios) o placebo, sin ningún efecto adicional en el objetivo principal. En un análisis de subgrupos preespecificado de sujetos con TG > 2,3 mmol/l (> 204 mg/dl) y cHDL < 0,9 mmol/l (< 34 mg/dl), el riesgo cardiovascular se redujo en un 31% en el grupo de fenofibrato más simvastatina (interacción entre pacientes con y sin este perfil lipídico, p = 0,06)229. Un análisis de subgrupos de personas dislipémicas (TG > 2,3 mmol/l y cHDL < 0,9 mmol/l) del estudio FIELD ha revelado una reducción del 27% del riesgo de ECV228. Tanto en el estudio FIELD como en el ACCORD, el tratamiento con fenofibrato se ha asociado a una reducción considerable de los TG (22%), mientras que el aumento del cHDL ha sido menor de lo esperado (+2% y +2,4% respectivamente). Un metanálisis ha confirmado los beneficios clínicos de los fibratos en los eventos cardiovasculares mayores, pero no en la mortalidad cardiovascular249,250. Los efectos parecen relacionados con el efecto beneficioso en los TG250.
Estrategias dirigidas a aumentar el colesterol unido a lipoproteínas de alta densidadSegún los estudios epidemiológicos y la evidencia aportada por muchos estudios clínicos sobre estatinas218, la concentración de cHDL se correlaciona inversamente con la ECV. Una concentración baja de cHDL se asocia a un aumento de la concentración de TG y se observa frecuentemente en pacientes con SM o DM. A pesar de esto, el tratamiento del cHDL bajo para la prevención de ECV no se apoya en la evidencia. Dos estudios clínicos controlados y aleatorizados recientes, que han usado los inhibidores de la proteína transportadora de ésteres de colesterol (CETP) torcetrapib y dalcetrapib251,252, no han podido demostrar su eficacia para reducir los eventos cardiovasculares a pesar de aumentar el cHDL en un 30-40%. Una posible explicación de estos hallazgos puede estar relacionada con las características funcionales anómalas de las partículas de HDL. Si esto es cierto, el mero aumento de estas partículas, sin que se produzca ninguna mejoría en su función, no debería modificar el riesgo de ECV.
Las herramientas farmacológicas actualmente disponibles para aumentar el cHDL en los pacientes diabéticos son escasas. El fenofibrato tiene una eficacia insignificante en este sentido, mientras que la niacina (N-ER) posee propiedades potencialmente interesantes y es capaz de aumentar el cHDL en un 15-30% con un aumento asociado de la ApoA-1224,253, además de reducir los TG (hasta un 35%), el cLDL (alrededor de un 20%) y la ApoB y lipoproteína(a) (Lp(a)) (alrededor de un 30%). Aunque un estudio ha demostrado que tiene efectos favorables en parámetros angiográficos y la reducción del área de la pared carotídea cuantificada por imagen con resonancia magnética después de 1 año de tratamiento254, dos estudios clínicos recientes no han confirmado la utilidad de la N-ER para la prevención cardiovascular. El estudio AIM-HIGH no ha demostrado beneficio adicional de la N-ER en pacientes con SM255. En el estudio HPS-2 THRIVE, se aleatorizó a 25.673 pacientes con vasculopatía conocida a recibir placebo o N-ER/laropiprant sobre un tratamiento de estatina o estatina/ezetimiba. Este estudio tuvo que interrumpirse prematuramente después de un seguimiento medio de 3,9 años. En ese momento, el 15,0% de los pacientes del grupo control y el 14,5% del grupo N-ER/laropiprant (diferencias no significativas) habían alcanzado el objetivo principal combinado de muerte cardiaca, IM no fatal, accidente cerebrovascular o revascularización coronaria. Además, se produjo un significativo (3,7%) exceso de riesgo absoluto de complicaciones diabéticas y un significativo (1,8%) exceso de riesgo de DM de nueva aparición. Asimismo, el tratamiento con N-ER causó un 1,4% más riesgo de infección y un 0,7% más riesgo de sangrado, incluido un riesgo aumentado de ictus hemorrágico256. Basándose en estos resultados, la Agencia Europea del Medicamento retiró la licencia de marketing para la combinación N-ER/laropiprant.
Hasta ahora, las intervenciones sobre el estilo de vida, como el abandono del tabaquismo, el aumento de la actividad física, la reducción de peso y la disminución del consumo de hidratos de carbono de absorción rápida, sigue siendo la piedra angular del tratamiento para incrementar la concentración de HDL.
Para pacientes con TG elevados (> 5,4 mmol/l), las recomendaciones sobre los hábitos de vida (con especial atención a la reducción de peso corporal y al abuso en el consumo de alcohol, cuando sea relevante) y la mejora en el control de la glucosa son los objetivos principales. Los riesgos asociados a los TG son el desarrollo de pancreatitis aguda y polineuropatía. En un análisis agrupado de resultados procedentes de estudios aleatorizados, el uso de estatinas se asoció a menor riesgo de pancreatitis en pacientes con TG normales o ligeramente aumentados. Los fibratos no son protectores e incluso pueden aumentar el riesgo257. Los ácidos grasos n-3 (2-4 g/día) pueden utilizarse para bajar la concentración de TG en personas que los tengan elevados258, aunque no hay evidencia de que este tipo de suplementos tenga beneficios cardiovasculares para los pacientes diabéticos.
6.4.4Lagunas en el conocimiento actualSe tiene que estudiar más profundamente el papel de las partículas de HDL en la regulación de la secreción de insulina por las células beta.
No se conoce bien qué eficacia y seguridad tienen los fármacos que aumentan o mejoran las partículas de cHDL.
Es preciso aclarar las contribuciones relativas de la función de HDL y la concentración plasmática de HDL en la patogenia de la ECV.
6.4.5Recomendaciones sobre el manejo de la dislipemia en la diabetesRecomendaciones sobre el manejo de la dislipemia en la diabetesRecomendacionesClaseaNivelbRef.cSe recomienda tratamiento con estatinas para pacientes con DM1 y 2 de muy alto riesgo (es decir, DM combinada con ECV, enfermedad renal crónica grave o uno o más FRCV o daño en órgano diana) con un objetivo de cLDL < 1,8 mmol/l (< 70 mg/dl) o, cuando ese objetivo terapéutico no pueda alcanzarse, al menos una reducción de cLDL ≥ 50%IA227,234, 238Se recomienda tratamiento con estatinas para pacientes con DM2 de alto riesgo (sin ningún otro FRCV ni daño en órganos diana) con un objetivo de cLDL < 2,5 mmol/l (< 100 mg/dl)IA227,234Se puede considerar las estatinas para pacientes con DM1 alto riesgo de eventos cardiovasculares independientemente de la concentración basal de cLDLIIbC—Se puede considerar un objetivo secundario de colesterol no-HDL < 2,6 mmol/l (< 100 mg/dl) para pacientes con DM de muy alto riesgo y < 3,3 mmol/l (< 130 mg/dl) para pacientes de alto riesgoIIbC—Se debe considerar la intensificación del tratamiento con estatinas antes de introducir un tratamiento combinado con ezetimibaIIaC—No se recomienda el uso de fármacos que aumentan el cHDL para prevenir la ECV en la DM2IIIA251,252, 256
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2; ECV: enfermedad cardiovascular; FRCV: factores de riesgo cardiovascular.
a Clase de recomendación.
b Nivel de evidencia.
c Referencias en que se apoya el nivel de evidencia.
6.5Función plaquetariaLa activación plaquetaria desempeña un papel esencial en la iniciación y la progresión de la aterotrombosis259. Numerosos grupos260 han descrito las alteraciones en la agregación de las plaquetas en la DM ex vivo, y se ha identificado tanto la hiperglucemia posprandial como la persistente como determinantes principales de la activación plaquetaria in vivo en las fases precoces y tardías de la historia natural de la DM2261,262.
6.5.1Ácido acetilsalicílicoEl ácido acetilsalicílico (AAS) inhibe la activación y la agregación plaquetarias dependientes del tromboxano (TX) A2 mediante la inactivación irreversible de la actividad de la COX-1263. No hay estudios formales que hayan examinado específicamente la dependencia de la dosis y la duración de su efecto antiplaquetario en pacientes con DM2, actualmente se recomienda el uso de AAS en dosis de 75-162 mg una vez al día, es decir, iguales dosis e intervalo que para los sujetos sin DM263,264. No obstante, la administración de una dosis baja de AAS una vez al día puede producir una inhibición incompleta de la actividad plaquetaria de COX-1 y de la función plaquetaria dependiente de TXA2 265–267, posiblemente debido a un aumento del recambio plaquetario en diabéticos268. La evidencia de esta posibilidad demuestra efectos potencialmente beneficiosos, en cuanto a eficacia duradera, con AAS dos veces al día para pacientes con DM y ECV268,269.
Prevención secundariaLa primera revisión colaborativa de la Antiplatelet Trialists’ Collaboration demostró que el tratamiento antiplaquetario (principalmente con AAS) es igualmente efectivo en pacientes con ECV preexistente sintomática, independientemente de la presencia de DM270. En esta revisión se analizaron los datos individuales en cuanto a «eventos vasculares graves» (IM no fatal, accidente cerebrovascular no fatal o muerte vascular) de aproximadamente 4.500 pacientes diabéticos incluidos en los estudios aleatorizados, y se vio que el tratamiento con fármacos antiplaquetarios producía una reducción proporcional de aproximadamente un cuarto270. Por lo tanto, no hay una razón clara para tratar a los pacientes con DM y ECV de modo diferente que a los pacientes no diabéticos, y la dosis baja de AAS está recomendada tanto para el tratamiento agudo de los síndromes isquémicos como para la prevención secundaria263.
Prevención primariaLa dosis baja de AAS está recomendada por diversas organizaciones norteamericanas en la prevención primaria de eventos cardiovasculares en adultos con DM264,271. No obstante, no se dispone de evidencia directa sobre su eficacia y su seguridad en este contexto y la que hay no es concluyente272,273. En consecuencia, en el metanálisis más actualizado, que incluye tres estudios llevados a cabo específicamente en pacientes con DM y otros seis estudios en los que estos pacientes son un subgrupo dentro de una población más amplia, el AAS se ha asociado a una reducción no significativa del 9% del riesgo de eventos coronarios (RR = 0,91; IC95%, 0,79-1,05) y a una reducción no significativa del 15% del riesgo de accidente cerebrovascular (RR = 0,85; IC95%, 0,66-1,11)264. Es importante destacar que el número total de pacientes con DM incluidos en estos nueve estudios clínicos era 11.787, con unas tasas de eventos coronarios extrapoladas a 10 años que variaban desde un valor tan bajo como el 2,5% a uno tan alto como el 33,5%264. De la interpretación de estos resultados, se desprende que el AAS puede producir una moderada reducción del riesgo de eventos cardiovasculares, aunque la escasez de datos disponibles impide hacer una estimación precisa del tamaño del efecto. Debido a esta incertidumbre, el tratamiento antiplaquetario con AAS para adultos con bajo riesgo de ECV no está recomendado por el Quinto Grupo de Trabajo de la ESC y Otras Sociedades para la Prevención de ECV en la Práctica Clínica89.
Cociente riesgo/beneficio del ácido acetilsalicílicoSegún los resultados de un metanálisis de los seis estudios clínicos principales sobre prevención, el AAS se asocia a un aumento del 55% de riesgo de sangrado extracraneal (principalmente gastrointestinal) tanto en sujetos sin DM (la mayoría) como en diabéticos274. En cuanto al balance entre el beneficio potencial del AAS y su riesgo en el contexto de la prevención primaria, estos resultados posiblemente sean el mejor escenario, ya que se han excluido los pacientes con mayor riesgo de sangrado gastrointestinal y los pacientes ancianos están infrarrepresentados274. En el mismo análisis, la presencia de DM en condiciones basales se ha asociado al doble de eventos vasculares pero también a un riesgo de hemorragia extracraneal grave un 50% mayor durante el seguimiento274.
Tanto la guía de práctica clínica de la Endocrine Society como el posicionamiento científico de ADA/AHA/ACCF están a favor del uso de AAS en adultos con DM cuando el riesgo de eventos cardiovasculares a 10 años sea > 10%271,264. No obstante, se hace poco énfasis en ambos documentos sobre la necesidad de valorar la variable riesgo de sangrado del paciente. Mientras que el riesgo anual de eventos cardiovasculares de los pacientes con DM264 puede variar aproximadamente en 10 veces, se calcula que el riesgo anual de hemorragia del tracto gastrointestinal superior de la población general puede variar en hasta 100 veces, dependiendo de la edad y la historia clínica de úlcera péptica263,275.
6.5.2Bloqueadores de los receptores P2Y12El clopidogrel, un bloqueador irreversible del receptor P2Y12 de ADP, es una alternativa válida para los pacientes con intolerancia a AAS o vasculopatía periférica sintomática, debido a que tiene un amplio espectro de indicaciones en la prevención secundaria a largo plazo, de forma parecida al AAS276,277. Además, el clopidogrel (75 mg una vez al día) ha mostrado efectos cardioprotectores aditivos cuando se combina con una dosis baja de AAS (75-160 mg una vez al día) para pacientes con SCA y para quienes se someten a ICP276. Sin embargo, hay evidencia procedente del estudio CHARISMA de que el clopidogrel, cuando se añade al tratamiento con AAS, puede tener efectos deletéreos en pacientes con nefropatía avanzada278. Otros bloqueadores de P2Y12 más efectivos son el prasugrel y el ticagrelor, un bloqueador de P2Y12 reversible276. En el estudio TRITON-TIMI 38, el prasugrel (60 mg de dosis de carga, seguidos de 10 mg diarios) ha mostrado clara superioridad sobre el clopidogrel (300 mg de dosis de carga, seguidos de 75 mg diarios) en la prevención de los eventos isquémicos recurrentes tras un SCA: no obstante, en la cohorte general, este beneficio conllevó un aumento del riesgo de hemorragia grave de la clasificación TIMI (trombolisis en el infarto de miocardio)279. En un subestudio de DM, se observó una reducción similar en los eventos isquémicos recurrentes, pero en la cohorte de pacientes diabéticos este efecto no se acompañó de un aumento de sangrados280. El ticagrelor (180 mg de dosis de carga, seguidos de 90 mg dos veces al día) también fue más efectivo que el clopidogrel (300-600 mg dosis de carga, seguidos de 75 mg diarios) en la reducción de muerte por causa cardiovascular y mortalidad total a los 12 meses en la cohorte general tras SCA281 y se ha asociado a una reducción de los eventos isquémicos en pacientes diabéticos sin causar un aumento de los sangrados282. Un aspecto importante es que el ticagrelor resultó ser superior al clopidogrel en pacientes con SCA y deterioro renal283. No hay evidencia convincente de que el clopidogrel u otros fármacos más nuevos sean más o menos efectivos en los pacientes diabéticos que en los no diabéticos276. Para el uso de estos fármacos en relación con ICP, véase la sección 7.2.
6.5.3Aspectos de conocimiento incompletoNo está establecido el régimen antitrombótico óptimo para la prevención primaria de ECV en la DM.
6.5.4Recomendaciones sobre el tratamiento antiplaquetario en pacientes con diabetesRecomendaciones sobre el tratamiento antiplaquetario en pacientes con diabetesRecomendacionesClaseaNivelbRef.cNo se recomienda el tratamiento antiagregante con AAS para pacientes diabéticos con bajo riesgo de ECVIIIA272-274Se puede considerar el tratamiento antiagregante individualizado en la prevención primaria para pacientes diabéticos de alto riesgoIIbC—Se recomienda el tratamiento con AAS en dosis de 75-160 mg/día como prevención secundaria en la DMIA270Se recomienda usar durante 1 año un inhibidor del receptor P2Y12 para pacientes con DM y SCA y para los sometidos a ICP (la duración depende del tipo de stent). Para pacientes con ICP por SCA, se debe administrar preferiblemente prasugrel o ticagrelorIA276,277, 280,282, 284Se recomienda clopidogrel como tratamiento antiplaquetario alternativo en caso de intolerancia al AASIB280,285
AAS: ácido acetilsalicílico; DM: diabetes mellitus; ECV: enfermedad cardiovascular; ICP: intervención coronaria percutánea; SCA: síndrome coronario agudo.
a Clase de recomendación.
b Nivel de evidencia.
c Referencias en que se apoyan el nivel de evidencia.
6.6Enfoques multifactoriales6.6.1Principios del manejo multifactorialLos pacientes con alteraciones de la glucosa necesitan someterse a una evaluación precoz del riesgo para identificar las comorbilidades y los factores que incrementan el riesgo cardiovascular. Esto incluye una valoración de: a) factores de riesgo (p. ej., hábitos de vida, como tabaquismo, hipertensión y dislipemia); b) enfermedad microvascular y macrovascular y disfunción autonómica; c) comorbilidades (p. ej., IC y arritmias); d) isquemia inducible mediante prueba de esfuerzo, ecocardiografía de estrés o escintigrafía miocárdica, y e) viabilidad miocárdica y función del VI mediante eco-Doppler o imagen por resonancia magnética286. La fiabilidad de la prueba de esfuerzo, la ecocardiografía de estrés o la escintigrafía miocárdica es motivo de especial preocupación para la detección de la isquemia en la DM. Los factores de confusión son un umbral alto de dolor debido a disfunción autonómica, la naturaleza multivaso de la enfermedad coronaria, las anomalías electrocardiográficas, la coexistencia de EAP y el uso de múltiples medicaciones.
El riesgo total de complicaciones cardiovasculares está relacionado, en gran medida, con las interacciones sinérgicas entre la RI, la disfunción de las células beta y la consiguiente hiperglucemia, pero también con la acumulación de FRCV. Por consiguiente, la prevención adecuada del riesgo depende de la detección y el manejo exhaustivos de todos los factores de riesgo modificables, como se ha demostrado mediante el uso de calculadoras de riesgo (p. ej. en UKPDS)101. Es necesario recordar, sin embargo, que este tipo de calculadoras requiere actualizarlas continuamente287. Se puede obtener información adicional en la sección 5.
El ensayo ADDITION288 ha estudiado la factibilidad del tratamiento multifactorial intensificado en pacientes con DM2 en la práctica general. La incidencia de un primer evento cardiovascular fue del 7,2% (13,5/1.000 personas-año) del grupo de manejo intensivo y el 8,5% (15,9/1.000 personas-año) del grupo de manejo habitual (HR = 0,83; IC95%, 0,65-1,05), la incidencia de mortalidad por cualquier causa fue del 6,2% (11,6/1.000 personas-año) y el 6,7% (12,5/1.000 personas-año) respectivamente (HR = 0,91; IC95%, 0,69-1,21). La conclusión del estudio fue que una intervención dirigida a promover un manejo intensivo precoz en pacientes con DM2 se asocia a una reducción pequeña y no significativa de la incidencia de eventos cardiovasculares y muerte26,289. Cabe advertir de que en el grupo intensivo del estudio ADDITION la mejoría en el control de importantes FRCV (HbA1c, concentraciones de colesterol y PA) fue apenas leve. Por el contrario, el valor de la intervención multifactorial en pacientes con DM y microalbuminuria establecida se ha demostrado en el estudio STENO 2, que aleatorizó en un contexto altamente especializado a 160 participantes a recibir un tratamiento multifactorial intensivo dirigido a objetivos o recibir un tratamiento convencional. Los objetivos en el grupo de tratamiento intensivo fueron HbA1c < 6,5%, colesterol total < 4,5 mmol/l (175 mg/dl) y PA < 130/80 mmHg. Todos los pacientes de este grupo recibieron bloqueadores del SRAA y dosis baja de AAS. Aunque no se pudo alcanzar los objetivos del tratamiento en todos los casos del grupo de tratamiento intensivo, su manejo general fue considerablemente mejor que el de los pacientes en tratamiento convencional. Esto produjo una reducción de los eventos microvasculares y macrovasculares de alrededor del 50% tras 7,8 años de seguimiento. El objetivo más logrado es el de colesterol, lo que probablemente haga de las estatinas un elemento crucial en la estrategia de prevención integral290,291. Posteriormente, se recomendó el tratamiento dirigido a objetivos a los pacientes de ambos grupos. Se siguió a los pacientes durante 13 años tras la aleatorización. Para entonces los pacientes originalmente aleatorizados al grupo de tratamiento intensivo habían tenido una reducción absoluta de la mortalidad del 20% y la HR de muerte, comparado con el del grupo convencional, fue 0,54 (IC95%, 0,3-0,9; p < 0,02). La reducción absoluta de riesgo de eventos cardiovasculares fue del 29%. Además, se produjo una reducción sustancial en la nefropatía diabética (RR = 0,4; IC95%, 0,3-0,8; p < 0,004) y en la progresión de la retinopatía (RR = 0,6; IC95%, 0,4-0,9; p = 0,01)156. En un análisis de economía de la salud, el manejo intensivo de los pacientes se ha descrito como un tratamiento con mejor relación coste-efectividad que el tratamiento convencional. Debido a que el aumento del coste derivado del manejo intensivo se debe a gastos farmacéuticos y costes de consulta, este tratamiento sería dominante (es decir, permitiría ahorrar costes y salvar vidas usando fármacos genéricos en atención primaria)292.
Los resultados del registro Euro Heart Survey on Diabetes and the Heart respaldan el uso de un enfoque multifactorial como la piedra angular del tratamiento del paciente. De 1.425 pacientes con DM2 conocida y enfermedad coronaria, el 44% recibió tratamiento farmacológico basado en la evidencia, definido como una combinación de AAS, bloqueadores beta, inhibidores del SRAA y estatinas en ausencia de contraindicaciones. Tras 1 año de seguimiento, los pacientes que recibieron esta combinación farmacológica presentaron una mortalidad por cualquier causa significativamente menor (el 3,5 frente al 7,7%; p = 0,001) y menos eventos cardiovasculares combinados (el 11,6 frente al 14,7%; p = 0,05) que quienes no recibieron una combinación completa de estos fármacos213. La HR ajustada para la interacción entre DM y tratamiento reveló que el uso de un tratamiento basado en la evidencia en la DM2 tiene un efecto protector independiente (HR para muerte = 0,4). Un ejemplo de la insuficiente eficacia del enfoque basado en un único fármaco para reducir la incidencia de ECV procede de un estudio que aleatorizó a 37 participantes insulinorresistentes con sobrepeso/obesos que todavía no tenían DM a fenofibrato, rosiglitazona o dieta con restricción calórica. Ninguno de los tratamientos estudiados se demostró como una intervención terapéutica capaz de normalizar, por sí sola y aisladamente, todos o, al menos, la mayoría de los trastornos metabólicos (p. ej., peso, sensibilidad a la insulina, colesterol, TG o GP poscarga) en estos pacientes con riesgo cardiovascular muy aumentado293.Los objetivos del tratamiento se resumen en la tabla 10.
Resumen de los objetivos terapéuticos para el manejo de los pacientes con diabetes mellitus o intolerancia a la glucosa y enfermedad coronaria
| Presión arterial (mmHg) | < 140/85 |
| En caso de nefropatía | Sistólica < 130 |
| Control glucémico | Generalmente < 7,0 (53 mmol/mol) |
| HbA1c (%) * | Individualizadamente < 6,5%-6,9% (48-52 mmol/mol) |
| Perfil lipídico | Pacientes de muy alto riesgo, < 1,8 mmol/l (< 70 mg/dl) o reducir al 50% por lo menos |
| cLDL | Pacientes de alto riesgo, < 2,5 mmol/l (< 100 mg/dl) |
| Función plaquetaria | Pacientes con ECV y DM, AAS 75-160 mg/día |
| Tabaquismo | Cese obligatorio |
| Tabaquismo pasivo | Ninguno |
| Actividad física | De moderada a vigorosa al menos 150 min/semana |
| Peso | Objetivo de estabilización del peso para pacientes diabéticos con sobrepeso u obesos acorde con el balance calórico y reducción del peso para sujetos con IG para prevención de DM2 |
| Hábitos dietéticos | |
| Consumo de grasas (% de la energía de la dieta) | |
| Total | < 35 |
| Saturadas | < 10 |
| Ácidos grasos insaturados | > 10 |
| Ingesta de fibra en la dieta | > 40 g/día (o 20 g/1.000 kcal/día) |
cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; DM2: diabetes mellitus tipo 2; ECV: enfermedad cardiovascular; HbA1c: glucohemoglobina; IG: intolerancia a la glucosa.
*Estándar según el Diabetes Control and Complication Trial.
Aún no se comprende del todo los efectos pleotrópicos de los tratamientos de reducción de glucosa en los resultados en ECV.
6.6.3Recomendaciones sobre el manejo multifactorial del riesgo en la diabetesRecomendaciones sobre el manejo multifactorial del riesgo en la diabetesRecomendacionesClaseaNivelbRef.cSe debe considerar la estratificación del riesgo como parte de la evaluación de los pacientes con DM e IGIIaC—Se recomienda evaluar el riesgo cardiovascular de los sujetos con DM e IG como base del manejo multifactorialIB156,213Se debe considerar los objetivos terapéuticos enumerados en la Tabla 10 para los pacientes con DM e IG con ECVIIaB156,213
DM: diabetes mellitus; ECV: enfermedad cardiovascular; IG: intolerancia a la glucosa.
a Clase de recomendación.
b Nivel de evidencia.
c Referencias en que se apoya el nivel de evidencia.
7MANEJO DE LA ENFERMEDAD CORONARIA ESTABLE E INESTABLE DE PACIENTES CON DIABETES7.1Tratamiento médico óptimo para pacientes con enfermedad coronaria crónica y diabetesLa DM se asocia con peor pronóstico en pacientes con enfermedad coronaria tanto estable como aguda294,295,296. Esto es más aparente en pacientes con DM de nuevo diagnóstico e IG297 y, aunque el riesgo absoluto es más alto para los varones, el aumento proporcional del riesgo es más alto para las mujeres, en las que la DM produce una pérdida de la cardioprotección298. Todos los pacientes con enfermedad coronaria, sin perturbaciones de la glucosa previamente conocidas, deberían someterse a una evaluación de su estado glucémico, con el objeto de hacer una estratificación de riesgo y ajustar el tipo de manejo que deben recibir. El aumento de la concentración de HbA1c y GPA puede establecer el diagnóstico de DM299, aunque un valor normal no excluye posibles anomalías de la glucosa. En consecuencia, como se detalla en la sección 3.3, el método adecuado para el cribado es el TTOG3,38, que no debería realizarse antes de 4-5 días después del evento coronario agudo (SCA) (es decir, IM o angina inestable) para minimizar los falsos positivos300,301. La mortalidad hospitalaria y a largo plazo del IM ha disminuido, pero el resultado clínico sigue siendo pobre entre los pacientes con DM. Las razones de ello siguen sin estar claras, aunque la mayor prevalencia de complicaciones y la ausencia de adecuado tratamiento basado en la evidencia pueden ser factores contribuyentes302,303.
Debido a que hay muy pocos estudios farmacológicos dirigidos a los pacientes con DM, la información sobre la eficacia de los tratamientos suele basarse en análisis de subgrupos a partir de estudios clínicos existentes. La desventaja es el riesgo de analizar grupos de pacientes con DM considerados aptos para el estudio pero cuyos fenotipos diabéticos no están bien establecidos. Además, los pacientes con ECV suelen tener un SM o DM no detectada. Con estas limitaciones, la información disponible favorece una eficacia proporcionalmente similar del manejo del riesgo cardiovascular en pacientes diabéticos y no diabéticos. Si tenemos en cuenta el mayor riesgo de eventos cardiovasculares, el beneficio absoluto es considerablemente mayor para los pacientes diabéticos y el NNT para evitar un episodio cardiovascular es menor en esta población213.
7.1.1Bloqueadores beta-adrenérgicosComo se ha subrayado en la guía europea actual sobre pacientes con enfermedad coronaria, los bloqueadores beta se recomiendan para todo el espectro de la enfermedad coronaria, con diferentes niveles de recomendación y evidencia304,305,306,307,308. Los bloqueadores beta alivian los síntomas de isquemia miocárdica (angina pectoris) en pacientes con CI estable y pueden proporcionar beneficios pronósticos, como se ha apuntado a partir de análisis retrospectivos de estudios clínicos controlados con placebo305. Los bloqueadores beta son especialmente eficaces para mejorar el pronóstico de los pacientes diabéticos tras un IM al reducir la probabilidad de reinfarto, muerte súbita y arritmias ventriculares309,310. Los bloqueadores beta pueden tener efectos metabólicos negativos (como aumentar la RI y enmascarar los síntomas hipoglucémicos) y parece haber una diferencia entre los antagonistas beta-1 no vasodilatadores (metoprolol y atenolol) y los bloqueadores beta con propiedades vasodilatadoras (p. ej., los bloqueadores adrenérgicos beta/alfa carvedilol y labetalol y el bloqueador beta-1 con modulación de la síntesis de NO nebivolol), que son los que al parecer tienen el mejor perfil glucometabólico311. En conjunto, los efectos positivos en el pronóstico con el bloqueo beta compensan los efectos glucometabólicos negativos.
7.1.2Bloqueadores del sistema renina-angiotensina-aldosteronaEl tratamiento con IECA o ARA-II se debe iniciar durante la hospitalización en el SCA, proseguir después para los pacientes con DM y fracción de eyección del ventrículo izquierdo (FEVI) < 40%, hipertensión o enfermedad renal crónica304,306,307 y se debe considerar ante todo pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST). También se recomienda administrar IECA a los pacientes con DM y CI estable305. El estudio HOPE ha demostrado una reducción del 25% en IM, accidente cerebrovascular o muerte cardiovascular en pacientes con vasculopatía conocida o DM aleatorizados a placebo o ramipril. Este hallazgo concuerda con el del subgrupo preespecificado de pacientes con DM312. Una tendencia similarmente proporcional hacia el beneficio se ha observado en el subgrupo de pacientes con DM del estudio EUROPA, que incluyó a una población de menor riesgo cardiovascular313. El estudio ONTARGET comparó el IECA ramipril y el ARA-II telmisartán en una población de alto riesgo parecida a la del estudio HOPE. En esa comparación uno a uno, el telmisartán resultó equivalente al ramipril en cuanto al objetivo principal —combinado de muerte de causa cardiovascular, IM, accidente cerebrovascular u hospitalización por IC—, mientras que la combinación de los dos fármacos causó eventos adversos sin ningún incremento en el beneficio210.
7.1.3Fármacos hipolipemiantesEl efecto beneficioso de las estatinas en pacientes con CI y DM está firmemente establecido. Los detalles sobre el tratamiento hipolipemiante se presentan en la sección 6.4.
7.1.4Nitratos y antagonistas de los canales del calcioNo hay evidencia de que los nitratos tengan impacto en el pronóstico, pero se puede usarlos para el alivio sintomático304,306,307. Los antagonistas de los canales del calcio son eficaces para aliviar los síntomas isquémicos y el verapamilo y el diltiazem pueden prevenir reinfartos y muertes304,305,306,307. Estos fármacos pueden ser adecuados para el uso a largo plazo en pacientes sin IC, como una alternativa a los bloqueadores beta o cuando estos sean una elección menos atractiva, como en presencia de enfermedad pulmonar obstructiva. Se debe evitar la combinación de estos fármacos con bloqueadores beta, teniendo en cuenta el riesgo de bradicardia, trastornos de la conducción auriculoventricular o alteraciones de la función del VI. Una alternativa es usar un antagonista de los canales del calcio dihidropiridínico, como amlodipino, felodipino o nicardipino.
7.1.5IvabradinaLa ivabradina es un fármaco antianginoso específico y reductor de la frecuencia cardiaca que inhibe la corriente If, el principal modulador de la despolarización diastólica espontánea del nódulo sinusal. La ivabradina está indicada en el tratamiento de la angina estable crónica de pacientes con CI para quienes los bloqueadores beta estén contraindicados o en caso de intolerancia, o en combinación con los bloqueadores beta cuando el paciente permanezca sintomático o tenga una frecuencia cardiaca > 70 lpm, sobre todo si también hay disfunción ventricular izquierda. Se puede utilizar en pacientes seleccionados con SCA sin elevación del segmento ST si hay intolerancia a los bloqueadores beta o cuando se produzca una reducción insuficiente de la frecuencia cardiaca pese a usarse la dosis máxima tolerada de bloqueador beta305,306. La frecuencia cardiaca elevada se asocia a peor resultado clínico en pacientes con DM314 y la ivabradina es efectiva para prevenir la angina en estos pacientes, sin problemas de seguridad o efectos adversos en el metabolismo de la glucosa315.
7.1.6Fármacos antiplaquetarios y antitrombóticos (véase también las secciones 6.5 y 7.2)En la prevención secundaria, el tratamiento antiplaquetario en forma de dosis baja de AAS (75-160 mg) o clopidogrel (por separado o en combinación) reduce el riesgo de accidente cerebrovascular, IM o muerte vascular, aunque los beneficios son algo menores en la DM316. En pacientes con SCA sin elevación del segmento ST, los inhibidores del receptor de la glucoproteína IIb/IIIa parecen ser particularmente eficaces en pacientes diabéticos, aunque esto no se ha podido confirmar en el reciente estudio Early-ACS317.
Otros fármacos antiplaquetarios, como las tienopiridinas (ticlopidina, clopidogrel, prasugrel y ticagrelor) reducen el riesgo de eventos cardiovasculares de los pacientes con SCA cuando se añaden al AAS284,304,307. La incidencia de muerte cardiovascular, IM o accidente cerebrovascular descendió desde el 11,4 al 9,3% (RR = 0,80; IC95%, 0,72-0,90), un efecto que fue duradero en los pacientes con DM282. En el estudio CAPRIE, que incluyó a pacientes con accidente cerebrovascular isquémico reciente, IM reciente o EAP establecida, los diabéticos con enfermedad vascular estuvieron mejor protegidos contra eventos cardiovasculares graves con clopidogrel que con AAS. La tasa anual de eventos en pacientes con DM fue del 15,6% de los aleatorizados a clopidogrel y el 17,7% de quienes recibieron AAS, es decir, se produjo una reducción absoluta del riesgo del 2,1% (p = 0,042), lo que corresponde a una RRR del 13% (RR = 0,87; IC95%, 0,77-0,88), y con menos complicaciones hemorrágicas. Debido a las elevadas tasas de eventos en los pacientes diabéticos, el beneficio absoluto del clopidogrel está amplificado en este contexto clínico285. En un análisis de subgrupos del estudio TRITON, los pacientes con DM presentaron una tendencia a una reducción más acusada de los eventos isquémicos, sin aumento observado en el sangrado mayor, con prasugrel que con clopidogrel280.
Es importante tener presente que muchos estudios no describen separadamente los resultados clínicos de los pacientes con DM y que las recomendaciones se basan en la evidencia disponible a partir de estudios que incluyen a pacientes diabéticos y no diabéticos318.
7.1.7Control de la glucosa en el síndrome coronario agudoEl aumento de la GP durante un SCA se asocia con un pronóstico más grave para los pacientes diabéticos que para los no diabéticos319,320,321,322,323. La hiperglucemia puede relacionarse con alteraciones de la glucosa previamente no detectadas, pero también liberación de catecolaminas inducida por estrés que aumenta la concentración de AGL, producción de insulina disminuida y aumento de la RI y la glucogenolisis301, con impacto negativo en la función y el metabolismo miocárdicos (para más detalles, véase la sección 4). Se han probado dos estrategias que intentan mejorar el pronóstico de los pacientes con SCA.
La modulación metabólica mediante glucosa-insulina-potasio (GIK), independientemente de la DM o la GP, está basada en la presunción de que un aumento del potasio intracelular estabiliza los cardiomiocitos y facilita el transporte de glucosa al interior de las células324. Otros beneficios potenciales son la disminución de la oxidación de los AGL, aumento del uso de glucosa para la producción de energía y mejora de la función endotelial y la fibrinolisis301. Los estudios clínicos controlados y aleatorizados no han podido demostrar beneficios en mortalidad o morbilidad, como han revisado Kloner et al324. Esta ausencia de efecto puede deberse a una GP aumentada o efectos negativos de la carga de fluido inducidos por la infusión de GIK. El estudio IMMEDIATE, que aleatorizó a los pacientes, una media de 90 min tras la sospecha de SCA, a administración extrahospitalaria de GIK por los servicios de urgencias o placebo, ha demostrado una reducción del objetivo clínico combinado de parada cardiaca o muerte hospitalaria asociada al tratamiento con GIK, sin efectos en el objetivo principal preespecificado, es decir, la progresión del SCA a IM en las primeras 24 h325.
Los estudios clínicos controlados y aleatorizados DIGAMI 1326 y 2327 y HI-5328 pusieron a prueba el control glucémico. El primer estudio DIGAMI aleatorizó a 620 pacientes con DM e IAM a infusión de insulina-glucosa ≥ 24 h seguida de multidosis de insulina o al tratamiento reductor de glucosa habitual326. La mortalidad después de 3,4 años era del 33% del grupo de insulina y el 44% del grupo control (p = 0,011)329. El estudio DIGAMI 2 no pudo demostrar beneficios pronósticos. La razón más plausible para esta discrepancia es que, en el ingreso del estudio DIGAMI 1326,330 la HbA1c se redujo más (1,5%) y desde una concentración más alta (9,1%), si se compara con el 0,5 desde el 8,3% del estudio DIGAMI 2327. Además, el uso de bloqueo beta, estatinas y revascularización fue más amplio en el estudio DIGAMI 2.
La diferencia en la concentración de glucosa entre el grupo control y el grupo de insulina en el estudio HI-5 fue pequeña y no se produjo reducción en la mortalidad entre los pacientes tratados con insulina328. Los resultados agrupados de los tres estudios confirmaron que la infusión de insulina-glucosa no reduce la mortalidad en ausencia de control de la glucosa en pacientes con IAM y DM (RR = 1,07; IC95%, 0,85-1,36; p = 0,547)331. Debido a que ni el estudio DIGAMI 2 ni el estudio HI-5 alcanzaron una diferencia en el control de la glucosa entre el grupo tratado intensivamente y el grupo control, sigue siendo una incógnita si la reducción de la glucosa es beneficiosa.
El estudio Heart2D comparó los efectos del control glucémico prandial (insulina previa a la ingestión de comida tres veces al día; n = 557) respecto al control glucémico basal (insulina de larga duración una o dos veces diarias; n = 558) en los eventos cardiovasculares en pacientes con DM2. Los objetivos de glucosa fueron 7,5 mmol/l (135 mg/dl) para la glucosa posprandial y 6,7 mmol/l (121 mg/dl) para la glucosa en ayunas. El grupo basal presentó una GPA media más baja (7,0 frente a 8,1 mmol/l; p < 0,001), pero similares cociente diario GPA/glucosa previa a la ingestión de comida (7,7 frente 7,3 mmol/l; p = 0,233) y concentración de HbA1c que el grupo prandial. El estudio se interrumpió, después de un seguimiento medio de 963 días, debido a falta de eficacia173.
Algunos registros indican que puede haber una relación en J o en U entre la GP y el pronóstico320,322,323 con la implicación de que la hipoglucemia, así como la hiperglucemia, pueden ser desfavorables para el pronóstico. Los mecanismos compensatorios inducidos por la hipoglucemia, como la liberación de catecolaminas, pueden agravar la isquemia miocárdica y causar arritmias332,333. Resultados recientes indican que los eventos hipoglucémicos identifican a los pacientes que están en riesgo por otras razones (p. ej., IC, disfunción renal y desnutrición) y que la hipoglucemia deja de ser un factor de riesgo independiente cuando se corrige por este tipo de variables334,335.
Una conclusión razonable del estudio DIGAMI 1326,330 es que la DM y el IAM pueden beneficiarse del control glucémico cuando la hiperglucemia es significativa (> 10 mmol/l o > 180 mg/dl). Una aproximación hacia la normoglucemia, con objetivos menos estrictos para los pacientes con comorbilidades graves, es un objetivo razonable, aunque los valores exactos todavía no están definidos. La infusión de insulina es el modo más eficaz de alcanzar rápidamente el control de glucosa. El manejo de la glucosa a largo plazo se presenta en otra sección de esta guía (sección 6.2).
7.1.8Aspectos de conocimiento incompletoSigue sin establecerse el papel y el nivel óptimo del control glucémico en los resultados clínicos de los pacientes con SCA.
¿Es posible reducir el tamaño final del infarto mediante la administración muy precoz de GIK cuando haya síntomas de IM?
7.1.9Recomendaciones sobre el manejo de pacientes con enfermedad coronaria estable e inestable y diabetesRecomendaciones sobre el manejo de pacientes con enfermedad coronaria estable e inestable y diabetesRecomendacionesClaseaNivelbRef.cSe recomienda investigar posibles trastornos del metabolismo de la glucosa en los pacientes con ECVIA294,295Se debe considerar los bloqueadores beta para reducir la mortalidad y la morbilidad de los pacientes con DM y SCAIIaB309,310Están indicados los IECA y los ARA-II para pacientes con DM y enfermedad coronaria para reducir el riesgo de eventos cardiovascularesIA210,312, 313Está indicado el tratamiento con estatinas para pacientes con DM y enfermedad coronaria para reducir el riesgo de eventos cardiovascularesIA227Está indicado el AAS para pacientes con DM y enfermedad coronaria para reducir el riesgo de eventos cardiovascularesIA274,316Se recomienda añadir al AAS inhibidores del receptor plaquetario P2Y12 para los pacientes con DM y SCAIA280,282, 284,285, 304,307Se debe considerar el control glucémico con insulina en la hiperglucemia (> 10 mmol/l o > 180 mg/dl) con un objetivo terapéutico adaptado a las posibles comorbilidadesIIaC—Se debe considerar el control glucémico, que debe conseguirse con diferentes fármacos hipoglucemiantes, para pacientes con DM y SCAIIaB326,328, 330
AAS: ácido acetilsalicílico; ARA-II: antagonista del receptor de la angiotensina II; DM: diabetes mellitus; ECV: enfermedad cardiovascular; IECA: inhibidor de la enzima de conversión de la angiotensina; SCA: síndrome coronario agudo.
a Clase de recomendación.
b Nivel de evidencia.
c Referencias en que se apoya el nivel de evidencia.
7.2RevascularizaciónUna cuarta parta de los procedimientos de revascularización miocárdica se realiza en pacientes con DM. La revascularización en estos pacientes se ve dificultada por un patrón aterosclerótico de los vasos epicárdicos más difuso, una mayor propensión a las reestenosis tras la angioplastia y la oclusión del injerto de la vena safena tras la cirugía de revascularización coronaria (CABG) y por la progresión aterosclerótica incesante que causa nuevas estenosis336. Todo esto produce más riesgo, incluso mayor mortalidad a largo plazo, que el observado en pacientes no diabéticos, independientemente de la modalidad de revascularización (figs. 7 and 8)337. La evidencia sobre el efecto de la revascularización en pacientes con DM se ha obtenido en un contexto cambiante en el que ha habido un desarrollo continuo de ICP, CABG y tratamientos farmacológicos, lo que dificulta las comparaciones adecuadas308,338.
7.2.1Revascularización miocárdica en la enfermedad coronaria estable e inestable7.2.1.1Enfermedad coronaria estableEl estudio BARI 2D ha realizado una comparación aleatorizada de la revascularización miocárdica, con CABG e ICP, frente a TMO, en pacientes diabéticos considerados aptos para ICP o CABG339. Una vez escogido ICP o CABG como la posible técnica de revascularización más adecuada, se aleatorizó a los pacientes a recibir solo TMO o revascularización más TMO. Tras 5 años, no se observaron diferencias significativas en el objetivo combinado de muerte, IM o accidente cerebrovascular entre los grupos de TMO (12%) y revascularización (12%). En el grupo quirúrgico, la proporción de pacientes libres de eventos adversos cardiacos y cerebrovasculares mayores (MACCE) fue significativamente mayor con CABG (78%) que con TMO solo (70%; p = 0,01), pero no hubo diferencias en la supervivencia (CABG, 86%; TMO, 84%; p = 0,33). En el grupo de ICP, constituido por pacientes con enfermedad coronaria menos extensa que los del grupo de CABG, no hubo diferencias significativas en la tasa de MACCE o en la supervivencia entre ICP y TMO. Durante el posterior seguimiento, un 38% de los pacientes asignados a TMO se sometieron al menos a una revascularización por razones sintomáticas, comparado con el 20% del grupo de revascularización, lo que demuestra que la estrategia conservadora inicial con TMO ahorró alrededor de un 80% de las intervenciones en los siguientes 5 años. En conjunto, con excepción de situaciones específicas, como la estenosis ≥ 50% del tronco de la arteria coronaria izquierda, la estenosis proximal de la descendente anterior o enfermedad de tres vasos con deterioro de la función ventricular izquierda, la revascularización miocárdica en pacientes diabéticos no mejora la supervivencia respecto al TMO. A la hora de trasladar estos resultados a la práctica general, hay que tener presente que se han obtenido en una población seleccionada. Se ha excluido a los pacientes que requerían una revascularización inmediata o tenían enfermedad del tronco de la arteria coronaria izquierda, concentración de creatinina > 2,0 mg/dl (> 177 μmol/l), HbA1c > 13,0%, IC de clase III-IV de la New York Heart Association (NYHA) o ya se habían sometido a ICP o CABG en los 12 meses previos.
Síndrome coronario agudoNo se ha documentado ninguna interacción entre el efecto de la revascularización miocárdica y la presencia de DM en los estudios clínicos sobre manejo del SCA sin elevación del segmento ST340,341,342). La estrategia invasiva precoz ha mejorado los resultados clínicos en la población general de estos estudios303,340,342, con mayor beneficio para los pacientes diabéticos del estudio TACTICS-TIMI 18342. Sobre los pacientes con IAMCEST, un análisis agrupado de los resultados de los pacientes individuales (n = 6.315) procedentes de 19 estudios clínicos controlados y aleatorizados que compararon la angioplastia primaria con la fibrinolisis ha demostrado que los pacientes con DM (n = 877; 14%) que recibieron reperfusión tenían una mortalidad más elevada que los no diabéticos. Sin embargo, los beneficios de la angioplastia primaria, comparados con los de la fibrinolisis, concordaron entre pacientes diabéticos y no diabéticos343. Los pacientes diabéticos recibieron los tratamientos de reperfusión significativamente más tarde y tras tiempos isquémicos más largos, lo que probablemente se relaciona con la presencia de síntomas atípicos que causan retrasos significativos en el momento de iniciar el tratamiento de reperfusión. No obstante, la reducción en la mortalidad a los 30 días observada en los pacientes tratados con angioplastia fue más pronunciada en este grupo. Debido a un riesgo absoluto más alto, el NNT para salvar una vida a los 30 días fue significativamente menor en los pacientes diabéticos (NNT = 17; IC95%, 11-28) que en los no diabéticos (NNT = 48; IC95%, 37-60). Un análisis de subgrupos de los pacientes diabéticos incluidos en el estudio OAT ha confirmado que, tal como ocurre en los pacientes no diabéticos, la revascularización de una arteria ocluida relacionada con el infarto a los 3-28 días del IM no mejora el resultado344.
7.2.2Tipo de intervención: cirugía de revascularización coronaria frente a intervención percutáneaSe ha documentado repetidamente una mayor tasa de nuevas revascularizaciones tras ICP entre los pacientes con DM incluidos en los estudios clínicos aleatorizados que han comparado CABG e ICP. Un metanálisis basado en resultados individuales procedentes de 10 estudios clínicos controlados y aleatorizados (7.812 pacientes) que compararon ambas modalidades de revascularización indica que la ventaja para la CABG en la supervivencia es distinta en los pacientes diabéticos (fig. 7:1)337. La mortalidad a los 5 años era del 20% con ICP, frente al 12% de la CABG (OR = 0,7; IC95%, 0,6-0,9), mientras que no se encontraron diferencias en pacientes no diabéticos; la interacción entre la presencia de DM y el tipo de revascularización fue significativa. El estudio CARDia realizó una comparación específica de la eficacia y la seguridad de la ICP y la CABG en pacientes con DM345. La introducción de los stents farmacoactivos (SF) coincidió con el periodo de inscripción, lo que dio lugar al uso mixto de stents metálicos (31%) y SF (69%). Después de 1 año de seguimiento, hubo una tasa mayor, aunque no significativamente, del objetivo de muerte, IM y accidente cer ebr o v a scular (pr oducida por una ma y or tasa de IM) y tasas significativamente más elevadas de nuevas revascularizaciones en el grupo de ICP (el 2 frente al 12%; p < 0,001). Las conclusiones del estudio se vieron obstaculizadas por el escaso tamaño muestral (n = 510).
Mortalidad de los pacientes asignados a cirugía de revascularización coronaria (CABG) o intervención coronaria percutánea (ICP) según el estado diabético, en un análisis de 10 estudios clínicos aleatorizados. Reproducido con permiso de Hlatky et al337.
La bibliografía sobre CABG frente a ICP es confusa por el sesgo de confusión de los registros, el desarrollo concomitante de SF y, con excepción del estudio FREEDOM, la falta de estudios aleatorizados prospectivos. Esto tiene la implicación de que mucha de la información disponible se deriva de los análisis de subgrupos de estudios clínicos en los que los pacientes con DM pueden ser relativamente pocos o estar seleccionados. Como consecuencia del aumento de la tasa de nuevas revascularizaciones en el estudio SYNTAX346, realizado en la era de los SF (utilizando stents liberadores de paclitaxel), la tasa de MACCE a 1 año fue 2 veces mayor con ICP que con CABG. En el subgrupo preespecificado de pacientes diabéticos, el RR de repetir la revascularización después de 1 año era aún más alto (RR = 3,2; IC95%, 1,8-5,7; p < 0,001). En pacientes diabéticos con lesiones complejas, es decir, con puntuación SYNTAX elevada, la mortalidad a 1 año fue mayor en el grupo de stent liberador de paclitaxel (el 14 frente al 4%; p = 0,04)347. Tras 5 años de seguimiento, la tasa de MACCE fue significativamente más alta en los pacientes diabéticos al comparar ICP con CABG (ICP frente a CABG, el 46,5 frente al 29,0%; p < 0,001), así como la tasa de nuevas revascularizaciones (el 35,3 frente al 14,6%; p < 0,001). No hubo diferencias en el objetivo compuesto de mortalidad por cualquier causa/accidente cerebrovascular/IM (el 23,9 frente al 19,1%; p = 0,26). Se obtuvieron resultados parecidos (aunque con algo menos de eventos) entre los pacientes no diabéticos. Las conclusiones del estudio fueron que, aunque el ICP es una opción terapéutica posible para los pacientes con lesiones menos complicadas, la CABG debe ser el procedimiento de revascularización de elección para los pacientes con enfermedad anatómica compleja, sobre todo si son diabéticos348.
Por el contrario, un análisis de los pacientes diabéticos incluidos en el registro y estudio aleatorizado AWESOME, que incluyó a pacientes con alto riesgo para la CABG (CABG previa, IM reciente, FEVI < 30% o tratamiento con balón de contrapulsación), no ha demostrado diferencias significativas entre las técnicas de revascularización en la mortalidad a 3 años349. Los resultados obtenidos en registros recientes confirman el mejor resultado en pacientes diabéticos tratados con CABG, en comparación con SF, en cuanto a mortalidad, a expensas de una tasa de accidentes cerebrovasculares mayor350. En un análisis de 86.244 pacientes de edad ≥ 65 años sometidos a CABG y 103.549 sometidos a ICP desde 2004 a 2008, la supervivencia a los 4 años era significativamente mayor en el grupo de cirugía y la asociación de la cirugía con la mejora de la supervivencia fue más marcada en los pacientes diabéticos tratados con insulina351. El estudio MAIN COMPARE ha documentado el resultado a largo plazo de 1.474 pacientes con estenosis no protegida del tronco coronario izquierdo tratados con SF o CABG. En este contexto específico, se produjeron similares tasas del objetivo compuesto de muerte, MI con onda Q o accidente cerebrovascular en los grupos de ICP y CABG y tasas significativamente mayores de nuevas revascularizaciones en el grupo de SF. El análisis de subgrupos, que comparó a pacientes diabéticos (n = 507; 34%) con no diabéticos, no revela interacciones significativas entre los tratamientos y la presencia o ausencia de DM tras ajustar por las covariables352. En un estudio observacional a partir de pacientes del mundo real del Swedish Coronary Angiography and Angioplasty Registry, que comparó 94.384 implantes de stent consecutivos, la ICP con SF de nueva generación se asoció con una reducción del 38% del riesgo de reestenosis clínicamente relevante y una reducción del 23% en la tasa de muerte respecto a los SF más antiguos353. Respalda estos hallazgos el resultado de un metanálisis de 49 estudios controlados y aleatorizados, con 50.844 pacientes, que compararon los diferentes SF con los stents metálicos354. El estudio FREEDOM aleatorizó a 1.900 pacientes —la mayoría con enfermedad de tres vasos— a tratamiento con CABG o ICP con stents liberadores de sirolimus y paclitaxel. Los stents de nueva generación podrían utilizarse siempre que la FDA los apruebe. Se prescribió a todos los pacientes los tratamientos médicos actualmente recomendados para el control del cLDL, la PA sistólica y la HbA1c. El objetivo principal fue una combinación de mortalidad total e IM no fatal o accidente cerebrovascular. Tras un seguimiento medio de 3,8 años, el objetivo principal ocurrió más frecuentemente en el grupo de ICP (p = 0,005), con una tasa a 5 años del 26,6%, comparada con el 18,7% en el grupo de CABG. El beneficio de la CABG se debe a las diferencias tanto en IM (p < 0,0 01) como en mortalidad (p = 0,049) (fig. 7:2).
Curvas de Kaplan-Meier sobre el objetivo principal y la tasa de mortalidad. A: objetivo principal combinado de muerte, infarto de miocardio o accidente cerebrovascular. B: muerte por cualquier causa, interrumpida a los 5 años de la aleatorización. El valor de p se ha calculado mediante prueba de rangos logarítmicos sobre la base de todos los datos de seguimiento disponibles. Reproducido con permiso de Farkouh et al355. CABG: cirugía de evascularización coronaria; ICP: intervencion coronaria percutánea.
Las conclusiones son que la CABG es superior a la ICP en pacientes diabéticos y con enfermedad coronaria avanzada. No hubo interacción significativa basada en la puntuación SYNTAX, ya que la diferencia absoluta en los objetivos principales entre ICP y CABG fue similar en pacientes con puntuaciones SYNTAX bajas, intermedias y altas. Dada la amplia variedad de los pacientes incluidos en el estudio FREEDOM, este estudio es representativo de la práctica clínica real. Análisis posteriores han revelado que la CABG es una estrategia con buena relación coste-efectividad comparada con la ICP355,356. La conclusión que se puede extraer es que, antes de decidir el tipo de intervención, debería ser obligatorio tener una conversación con el paciente en la que se le explique el beneficio de la cirugía de revascularización sobre la mortalidad, así como realizar una evaluación individual del riesgo308.
7.2.3Aspectos específicos de la revascularización percutánea y quirúrgica en la diabetes mellitusEl estudio DIABETES ha demostrado una reducción del 75% de las revascularizaciones del vaso diana en pacientes diabéticos tratados con stents liberadores de sirolimus (7%) frente a los tratados con stents metálicos (31%)357. Este resultado ha recibido un apoyo adicional a partir de los resultados obtenidos en un metanálisis de 35 estudios clínicos que comparaban SF con stents metálicos358 y que han revelado una eficacia similar entre stents liberadores de sirolimus y liberadores de paclitaxel en este contexto (OR = 0,29 para sirolimus; OR = 0,38 para paclitaxel) siempre que se continúe más de 6 meses con la doble antiagregación después de implantar el SF. El riesgo de muerte asociado a los stents liberadores de sirolimus fue de más del doble que el asociado a los stents metálicos en ocho estudios clínicos que emplearon doble antiagregación durante periodos < 6 meses. Por el contrario, no hubo aumento del riesgo asociado al uso de SF en 27 estudios con doble antiagregación mantenida durante más de 6 meses. Un análisis de los datos del National Heart, Lung and Blood Institute Dynamic Registry ha demostrado que, comparados con los stents metálicos, los SF se asocian a menores tasas de nueva revascularización en un grado similar para los pacientes diabéticos tratados y no tratados con insulina359. Por último, los stents de segunda generación liberadores de everolimus no fueron superiores en cuanto a fallo de la lesión diana tras 1 año de seguimiento en una comparación uno a uno con los stents liberadores de paclitaxel, mientras que los stents liberadores de zotarolimus fueron inferiores a los liberadores de sirolimus en pacientes diabéticos360,361.
El tratamiento antitrombótico para pacientes diabéticos sometidos a revascularización coronaria por angina estable o SCA no es diferente del de los pacientes no diabéticos317,362,363. Los estudios iniciales sobre inhibidores de la glucoproteína IIb/IIIa describieron una interacción con la DM, pero esto no ha podido confirmarse en el reciente estudio ISAR-REACT 2, realizado en la era del clopidogrel364. El prasugrel es superior al clopidogrel en reducir el objetivo combinado de muerte cardiovascular, IM o accidente cerebrovascular, y no produce más hemorragias mayores. De modo parecido, el ticagrelor, que el estudio PLATO comparó con clopidogrel, redujo la incidencia de eventos isquémicos en pacientes con SCA, independientemente de la presencia o ausencia de DM y el control glucémico, sin producir un aumento en los eventos de sangrado mayor280,282.
Los pacientes con DM sometidos a CABG suelen tener enfermedad coronaria extensa y necesitan múltiples injertos. No hay evidencia procedente de estudios aleatorizados en cuanto al uso de uno frente a dos injertos de arteria torácica interna (ATI) en la DM. Aunque la evidencia observacional indica que el uso de ATI bilaterales mejora el resultado clínico sin comprometer la estabilidad esternal, su uso sigue estando en debate, debido a la mayor prevalencia de infección de herida y mediastinitis en los pacientes diabéticos365. Un metanálisis reciente ha demostrado que la obtención de ATI mediante esqueletización (sin venas satélites y fascia) reduce el riesgo de infección esternal, sobre todo en pacientes diabéticos sometidos a un injerto del ATI bilateral366, aunque no hay estudios aleatorizados sobre este tema. Un estudio monocéntrico no aleatorizado que comparó CABG con injerto de ATI bilateral e ICP en la DM ha descrito mejores resultados clínicos (ausencia de angina, reintervención o eventos cardiacos adversos mayores compuestos) en el grupo quirúrgico, pero sin diferencias en la supervivencia a los 6 años (el 86% con CABG y el 81% con ICP)367. Por último, más del 50% de los pacientes con un control glucémico de moderado a pobre después de la cirugía cardiaca pueden no haber sido diagnosticados como diabéticos durante la evaluación prequirúrgica368. Esto puede conducir a un control glucémico perioperatorio inadecuado, que es predictor de mortalidad y morbilidad hospitalarias.
7.2.4Revascularización miocárdica e hipoglucemiantesAunque los hipoglucemiantes pueden tener influencia en la seguridad de la angiografía coronaria y los resultados a corto y largo plazo de la revascularización con ICP o CABG, solo unos pocos estudios han abordado las interacciones con la revascularización miocárdica en la DM.
La vida media plasmática de la metformina es 6,2 h. No hay evidencia científica adecuada que respalde la práctica frecuente de interrumpir la metformina 24-48 h antes de la angiografía o ICP debido al potencial riesgo de acidosis láctica y reinicio del tratamiento 48 h después. Las recomendaciones más recientes son menos restrictivas308. Un enfoque más razonable que la interrupción del tratamiento de metformina en todos los pacientes sería una monitorización cuidadosa de la función renal después del procedimiento y suspender el tratamiento con metformina durante 48 h si se observa deterioro, hasta que la función renal se restablezca y alcance su nivel previo.
Los resultados observacionales ponen de manifiesto cierta preocupación en cuanto al uso de sulfonilureas en pacientes tratados con angioplastia primaria en el IAM: esto no se ha confirmado en un análisis post-hoc del estudio DIGAMI 2, aunque el número de pacientes sometidos a ICP en ese estudio es bajo369. Las arritmias y las complicaciones isquémicas también fueron menos frecuentes entre los pacientes tratados con gliclazida/glimepirida370. Las tiazolidinedionas pueden asociarse a menores tasas de reestenosis después de ICP con stents metálicos371, pero conllevan un riesgo aumentado de IC debido a retención renal de agua (véase también la sección 6.2.6).
Ningún estudio clínico ha demostrado que la administración de insulina o GIK mejore el resultado clínico de la ICP después de un IAMCEST. Los resultados observacionales en pacientes sometidos a CABG indican que el uso de una infusión intravenosa continua de insulina para alcanzar un control glucémico moderadamente estricto (6,6-9,9 mmol/l o 120-180 mg/dl) se asocia de manera independiente a menos mortalidad y complicaciones graves que lo observado con un control glucémico más estricto (< 6,6 mmol/l o < 120 mg/dl) o más laxo (> 9,9 mmol/l o > 180 mg/dl)372. En el estudio BARI 2D, los resultados fueron similares en pacientes que recibieron sensibilización a la insulina frente a los que recibieron una provisión de insulina para controlar la glucemia. En el grupo de CABG, la administración de insulina se asoció a más eventos cardiovasculares que la medicación de sensibilización a la insulina339,373.
7.2.5Aspectos de conocimiento incompleto- •
Sigue sin conocerse la pauta óptima del tratamiento con metformina para pacientes que se someten a ICP.
- •
Todavía no se ha establecido cuáles son el papel y el nivel óptimo de control glucémico en los resultados clínicos durante y después de una revascularización miocárdica.
Recomendaciones sobre la revascularización coronaria en los pacientes diabéticosRecomendacionesClaseaNivelbRef.cSe debe considerar el TMO como tratamiento de elección para los pacientes con enfermedad coronaria estable y DMIIaB339Se recomienda CABG para pacientes con DM y enfermedad coronaria multivaso o compleja (puntuación SYNTAX > 22) para mejorar la supervivencia libre de eventos cardiovasculares mayoresIA337,339, 346,350, 355,374Se puede considerar ICP para controlar los síntomas como alternativa a la CABG para pacientes con DM y enfermedad coronaria multivaso menos compleja (puntuación SYNTAX ≤ 22) que requieran revascularizaciónIIbB347,349, 350Se recomienda ICP, más que la fibrinolisis, para pacientes diabéticos que se presentan con IAMCEST si se realiza dentro de los límites de tiempo recomendadosIB343Se recomiendan los SFA, más que los stents metálicos, para pacientes diabéticos sometidos a ICP para reducir el riesgo de la revascularización del vaso dianaIA351,352Se debe monitorizar cuidadosamente la función renal después de la angiografía coronaria/ICP en todos los pacientes que reciben metforminaIC—Si se deteriora la función renal de pacientes sometidos a angiografía coronaria/ICP que toman metformina, se recomienda interrumpir el tratamiento durante 48 h o hasta que la función renal se haya recuperado hasta su nivel inicialIC—
CABG: cirugía de revascularización coronaria; DM: diabetes mellitus; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; SCA: síndrome coronario agudo; SFA: stent farmacoactivo; TMO: tratamiento médico óptimo.
a Clase de recomendación.
b Nivel de evidencia.
c Referencias en que se apoya el nivel de evidencia.
8INSUFICIENCIA CARDIACA Y DIABETESEs frecuente que la IC y la DM2 coexistan y que cada una de ellas afecte de manera adversa al curso natural de la otra. La prevalencia de los factores de riesgo de IC es común en los pacientes diabéticos, la enfermedad coronaria y la hipertensión son los más importantes. Además, la disglucemia por sí sola puede tener un efecto desfavorable en el miocardio. Esto ha llevado a reconocer una entidad clínica identificada como miocardiopatía diabética, en la que la función diastólica deteriorada es una característica que aparece tempranamente. Un análisis de 987 pacientes con IC y FEVI conservada incluidos en el estudio subordinado del Digitalis Investigation Group (DIG)375 ha revelado que la DM2 se asocia a un aumento significativo del riesgo de un desenlace adverso de la IC. El enfoque clínico de la miocardiopatía incluye la evaluación ecocardiográfica de la disfunción diastólica del VI, que puede empeorar durante el ejercicio físico376. La RI que caracteriza el síndrome de insuficiencia cardiaca, independientemente de la etiología, parece ser un factor importante subyacente al alto riesgo de DM de los pacientes con IC. Pese a haber evidencia firme que relaciona la IC y la DM, el manejo óptimo de estas dos condiciones coexistentes todavía no se basa plenamente en la evidencia, debido a la falta de estudios clínicos específicamente diseñados para esta población de pacientes.
8.1Prevalencia e incidencia de insuficiencia cardiaca en la diabetes mellitus tipo 2 y diabetes mellitus tipo 2 en la insuficiencia cardiacaPrevalencia e incidencia de insuficiencia cardiaca en la diabetes mellitusLa prevalencia de IC en la población general es de un 1-4% y un 0,3-0,5% de los pacientes tienen IC y DM2 simultáneamente. Los estudios en poblaciones con IC revelan una prevalencia de DM2 de un 12-30%, que aumenta con la edad377,378. La DM2 es un importante factor independiente de riesgo de IC. En el estudio de Framingham, el RR de IC de los pacientes con DM2 (edad, 45-74 años) fue el doble en varones y 6 veces mayor en mujeres379. La alta incidencia de IC en pacientes con DM2 también se ha confirmado en el National Health and Nutrition Examination Survey, que ha revelado que la DM2 es un factor independiente de riesgo de IC (pacientes diabéticos frente a no diabéticos, HR = 1,85; IC95%, 1,51-2,28)380. Boonman-de Winter et al381, que estudiaron a un grupo holandés de 581 pacientes con DM2 (edad > 60 años), han descrito que el 28% (IC95%, 24%-31%) tenía insuficiencia cardiaca no diagnosticada previamente; el 5% con FEVI reducida y el 23% con FEVI conservada. La prevalencia aumentaba rápidamente con la edad y la IC con FEVI conservada era más frecuente en las mujeres que en los varones. La disfunción ventricular izquierda estaba diagnosticada en el 26% (IC95%, 22%-29%) de los casos, y el 25% (IC95%, 22%-29%) presentaba disfunción diastólica. Estos datos ponen de relieve la importancia de buscar signos y síntomas de función miocárdica alterada en los pacientes con DM2.
Diversas correlaciones clínicas son factores independientes de riesgo de desarrollo IC en la DM2, como la concentración de HbA1c elevada, el aumento del índice de masa corporal, la edad avanzada, la enfermedad coronaria asociada, la retinopatía, la nefropatía y el uso de insulina. Además, en estudios recientes se ha demostrado que la enfermedad renal terminal, la nefropatía, la proteinuria y la albuminuria, la retinopatía y la duración de la DM2 se asocian con la IC y su progresión382.
Prevalencia e incidencia de diabetes mellitus en la insuficiencia cardiacaLa prevalencia de DM en la población general es de un 6-8% aunque, tal como han revisado McDonald et al., es mayor en sujetos con IC sintomática (12-30%) y aumenta hasta el 40% de los pacientes hospitalizados1,383. No obstante, la población con IC tiene edad más avanzada que la población general. Es importante señalar que la prevalencia de pacientes diabéticos es menor en los estudios clínicos sobre IC, lo que indica un sesgo de selección hacia pacientes diabéticos más jóvenes o menos graves. La información sobre la incidencia de DM en la población con IC es escasa, pero en la población italiana de edad avanzada, se reveló DM de nuevo diagnóstico en el 29% de los casos durante 3 años de seguimiento, comparado con el 18% de los controles sin IC384. Tras el seguimiento de más de 30 años de los pacientes con dos o más visitas del estudio de Reykjavik (n = 7.060), la DM y la IC no resultaron factores independientes predictores la una de la otra, aunque la glucosa en ayunas y el índice de masa corporal fueron factores de riesgo significativos, tanto de trastornos de la glucosa como de IC385.
Miocardiopatía diabéticaLa hiperglucemia de larga duración puede afectar (incluso en ausencia de otros factores de riesgo, como enfermedad coronaria, enfermedad valvular o hipertensión) al tejido miocárdico y aumentar el riesgo de disfunción. Una reducción de la distensibilidad del VI (un signo temprano de miocardiopatía diabética) puede detectarse precozmente en el curso de la DM386. La coexistencia frecuente de hipertensión y DM hace que sea difícil aislar la contribución del estado glucometabólico a la disfunción diastólica. Los mecanismos fisiopatológicos incluyen la acumulación de productos de glucación avanzada, formación de colágeno y fibrosis intersticial, que conducen a una alteración de la homeostasis del calcio y deficiencias en la señalización miocárdica dependiente de insulina (véase la sección 4 para más detalles y referencias). Estas perturbaciones aumentan la rigidez miocárdica y reducen la distensibilidad miocárdica387,388. Según las recomendaciones de la ESC, la disfunción diastólica del VI se identifica mediante estimación cuantitativa de las propiedades diastólicas del VI, usando parámetros Doppler convencionales del flujo transmitral de sangre e imágenes de Doppler tisular del anillo mitral. La disfunción diastólica que se va deteriorando se asocia a un aumento progresivo de la presión de llenado del VI que, a su vez, tiene impacto en el patrón de flujo transmitral389. Se ha afirmado —aunque no se ha verificado en los estudios longitudinales— que la disfunción miocárdica puede progresar con el tiempo tras iniciarse la disfunción diastólica, lo que conduce a disfunción sistólica y aparición de las características típicas de la IC. Debido a la coexistencia frecuente de DM, hipertensión y enfermedad coronaria, se ha debatido si la disfunción miocárdica se desencadena fundamentalmente por el trastorno glucometabólico en sí, más que por la acción sinérgica de estos factores. Desde una perspectiva clínica, prevenir la aparición de disfunción sistólica del VI y la consiguiente IC se centra actualmente en el tratamiento farmacológico de las comorbilidades. Esto puede explicar también por qué la disminución rigurosa de la PA parece ser especialmente eficaz en los pacientes diabéticos.
8.2Diabetes mellitus e insuficiencia cardiaca: morbilidad y mortalidadLa IC es la principal causa de hospitalización de los pacientes con DM2 incluidos en el estudio DIABHYCAR, que analizó las hospitalizaciones de los pacientes diabéticos con albuminuria382. A la inversa, la DM2 aumentó el riesgo de hospitalización de los pacientes con IC en el estudio BEST390 (RR = 1,16; IC95%, 1,02-1,32; p = 0,027). En el estudio MERIT-HF391, los pacientes con IC y DM2 tuvieron una tasa de hospitalizaciones a 1 año de seguimiento del 31%, comparado con el 24% de los pacientes no diabéticos.
En el estudio DIABHYCAR, la combinación de IC y DM2 produjo un aumento de 12 veces en la mortalidad anual respecto a los pacientes con DM2 sin IC (el 36 frente al 3%)382. El estudio BEST SOLVD ha descrito que la DM2 es un predictor independiente de mortalidad, sobre todo en la IC isquémica390,392. También, los estudios DIAMOND y CHARM han identificado la DM como predictora de mortalidad independientemente de la etiología393,394.
8.3Manejo farmacológico de la insuficiencia cardiaca en la diabetes mellitus tipo 2El arsenal farmacológico más importante para el tratamiento de los pacientes con IC sistólica, incluidos los diabéticos, está constituido por tres antagonistas neurohormonales (un IECA o ARA-II, un bloqueador beta y un antagonista del receptor de mineralocorticoides [ARM]). Se suele combinarlos con un diurético para aliviar la congestión y también pueden acompañarse de ivabradina389.
Inhibidores de la enzima de conversión de la angiotensina y antagonistas de los receptores de la angiotensina IILos IECA están indicados en la DM2 e IC, ya que mejoran los síntomas y reducen la mortalidad. El estudio SOLVD, que usó enalapril, ha demostrado una reducción significativa de la mortalidad en la DM con IC392. En el estudio ATLAS, la reducción del riesgo de muerte en los grupos de dosis alta frente a dosis baja de lisinopril fue del 14% en diabéticos y el 6% en no diabéticos395. En un metanálisis, el cociente de riesgo de muerte en el grupo de pacientes tratados con un IECA fue igual que en el grupo de placebo tanto con DM2 (n = 2.398) como sin DM2 (n = 10.188)396.
Los análisis de subgrupos de los estudios clínicos indican que los efectos beneficiosos de los ARA-II son equivalentes a los de los IECA397,398,399,400. Un ARA-II, por lo tanto, se puede utilizar como alternativa para pacientes con intolerancia a los IECA. Los IECA y los ARA-II no deben combinarse en pacientes con FEVI < 40% sintomáticos pese a recibir tratamiento óptimo con un IECA combinado con un bloqueador beta. Según la Guía de Práctica Clínica sobre Insuficiencia Cardiaca de la ESC de 2012, se debe prescribir a este tipo de pacientes un ARM (véase más adelante), que causa mayor reducción de la morbilidad y la mortalidad que la obtenida después de añadir un ARA-II389.
Cuando se usan IECA y ARA-II en pacientes diabéticos, es obligatorio monitorizar la función renal y el potasio, ya que la nefropatía es frecuente.
Bloqueadores betaSe debe administrar un bloqueador beta, además del IECA (o, si no se tolera bien, un ARA-II), a todos los pacientes con FEVI ≤ 40%. Como ejemplo, un análisis de subgrupos del estudio MERIT-HF ha demostrado que los bloqueadores beta reducen la mortalidad y los ingresos hospitalarios y mejoran los síntomas sin que haya diferencias significativas entre los pacientes diabéticos y no diabéticos391. Posteriormente, dos metanálisis de estudios clínicos importantes sobre IC han indicado que la RR de muerte en pacientes diabéticos que recibían un bloqueador beta mejoró significativamente (0,84 frente a 0,72)396,401. Los bloqueadores beta también reducen las hospitalizaciones por IC tanto en diabéticos como en no diabéticos390,391,402,403. A pesar de esto, los pacientes con DM2 tienen una probabilidad de recibir al alta hospitalaria tratamiento bloqueadores beta menor (OR = 0,72; IC95%, 0,55-0,94) que los no diabéticos con IC404. Los siguientes bloqueadores beta están recomendados para el tratamiento de la IC con DM2: succinato de metoprolol en la presentación de liberación lenta (MERIT-HF), bisoprolol (CIBIS y carvedilol (COPERNICUS) y COMET402,403,405,406.
Efectos indeseables de los bloqueadores beta en pacientes diabéticos con insuficiencia cardiaca:- •
Hipoglucemia. La evidencia indica que los bloqueadores beta en pacientes diabéticos alteran las respuestas contrarreguladoras de la hipoglucemia, con disminución de temblores y palpitaciones pero aumento de la sudoración407. La hipoglucemia prolongada se ha descrito con el bloqueo beta no cardioselectivo (propranolol), pero no con los bloqueadores beta-1 selectivos o el carvedilol408,409. Los pacientes diabéticos de edad avanzada en tratamiento con insulina (n = 13.559), sin IC, sufrieron un aumento del riesgo de hipoglucemia grave asociado al tratamiento con bloqueadores beta no selectivos (RR = 2,16; IC95%, 1,15-4,02), que no se ha producido con los fármacos beta-1 selectivos (RR = 0,86; IC95%, 0,36-1,33)410.
- •
Efectos metabólicos negativos. En pacientes hipertensos sin IC, los diferentes tipos de bloqueadores beta pueden tener efectos variables en los índices glucémicos, disminuir la sensibilidad a la insulina y aumentar el riesgo de DM2410. El importante beneficio clínico de los bloqueadores beta en pacientes diabéticos con IC supera los riesgos de hipoglucemia y dislipemia o la disminución de la sensibilidad a la insulina.
Está indicada la administración de una dosis baja de ARM a todos los pacientes con síntomas persistentes (NYHA II-IV) y FEVI ≤ 35% pese a recibir tratamiento con un IECA (o, si no se tolera bien, un ARA-II) y un bloqueador beta, con el fin de reducir el riesgo de hospitalización y la muerte prematura411. El beneficio con la espironolactona412 y la eplerenona413 en la mortalidad no ha diferido entre los pacientes con y sin DM e IC. Es obligatorio monitorizar la función renal y el postasio, teniendo en cuenta el riesgo aumentado de nefropatía de los pacientes diabéticos.
DiuréticosEl efecto de los diuréticos en la mortalidad y la morbilidad no se ha estudiado, pero estos fármacos son útiles para el alivio de la disnea y el edema en la IC con sobrecarga de fluidos, independientemente de la FE. Los diuréticos de asa están recomendados, más que las tiacidas, que se ha demostrado que favorecen la hiperglucemia.
IvabradinaEn un estudio clínico de gran tamaño aleatorizado, a doble ciego y controlado con placebo que incluyó a 6.558 pacientes con IC en ritmo sinusal y frecuencia cardiaca ≥ 70 lpm (3.241 con ivabradina; el 30% con DM2), la ivabradina redujo significativamente el objetivo compuesto de muerte cardiovascular e ingreso hospitalario por empeoramiento de la IC. La diferencia en el beneficio ha sido similar que la obtenida en un análisis de subgrupos preespecificados de pacientes con y sin DM414.
8.4Tratamientos no farmacológicos para la insuficiencia cardiaca en la diabetes mellitusTratamiento de resincronización cardiaca y desfibriladores implantablesEl tratamiento de resincronización cardiaca es un tratamiento para la IC recomendado en las guías, pues se ha demostrado que reduce la mortalidad de los pacientes en NYHA III-IV y con FEVI ≤ 35% pese a recibir TMO, ritmo sinusal y QRS ancho (≥ 120-130ms)415. A pesar de no haber análisis de subgrupos, no hay razón para creer que el efecto del tratamiento de resincronización deba ser diferente en pacientes con y sin DM. Además, no se ha producido beneficio adicional con desfibriladores implantables en un subgrupo de pacientes con DM2 e IC respecto a los no diabéticos416.
El trasplante cardiaco es un tratamiento aceptado para la IC terminal. La presencia de DM no es una contraindicación, pero es necesario tomar en consideración los restrictivos criterios de selección. Se debe tener en cuenta el aumento de la probabilidad de enfermedad cerebrovascular, disminución de la función renal y riesgo elevado de infección, que pueden contraindicar más frecuentemente el trasplante cardiaco en los pacientes diabéticos que en los no diabéticos417. La DM resultó factor independiente de riesgo a 10 años de menor supervivencia en un registro de gran tamaño (n = 22.385) de pacientes trasplantados entre 1987 y 1999418.
8.5Tratamiento reductor de glucosa en pacientes con insuficiencia cardiacaGitt et al. han revisado sistemáticamente el impacto de varios fármacos hipoglucemiantes en el tratamiento de los pacientes diabéticos con IC419. Esos autores han observado que los únicos fármacos investigados en los estudios clínicos controlados y aleatorizados han sido las tiazolidinedionas, mientras que la evidencia sobre otros compuestos depende en gran medida de análisis de subgrupos de estudios de mayor tamaño de intervención sobre IC sistólica, estudios observacionales o registros.
El uso de metformina, que es el tratamiento hipoglucemiante de elección, antes estaba contraindicado para pacientes con IC debido al temor de que se produjera acidosis láctica. Sin embargo, se ha demostrado que este fármaco conlleva menores tasas de mortalidad y de ingreso hospitalario por cualquier causa y menos eventos adversos420,421, y el aumento de acidosis láctica no se ha verificado en un estudio de Masoudi et al., que han descrito que un 2,3% de los consumidores de metformina tenían acidosis metabólica, en comparación con el 2,6% de los pacientes no tratados con metformina422. En un estudio de casos y controles que incluyó a pacientes con IC y DM de nuevo diagnóstico que recibieron fármacos hipoglucemiantes o no, el uso de metformina (OR ajustada = 0,65; IC95%, 0,48-0,87) o metformina con o sin otros fármacos (ORa = 0,72; IC95%, 0,59-0,90) se asoció a menor mortalidad, mientras que otros fármacos hipoglucemiantes orales o la insulina fueron neutrales en esta variable423.
Las recomendaciones sobre sulfonilureas e IC se basan en estudios observacionales. No se ha observado relación alguna entre las sulfonilureas y la mortalidad por IC en el estudio UKPDS152, pero en un gran número de pacientes (n = 12.272) de la base de datos Saskatchewan Health, la mortalidad (el 52 frente al 33%) y las hospitalizaciones (el 85 frente al 77%) fueron más entre los pacientes tratados con sulfonilureas que entre los tratados con metformina durante un seguimiento medio de 2,5 años424. La desventaja de las sulfonilureas no se ha podido confirmar en un estudio de beneficiarios del sistema Medicare, lo que ha llevado a concluir que no había asociación alguna entre este tratamiento (HR = 0,99; IC95%, 0,91-1,08) o la insulina (HR = 0,96; IC95%, 0,88-1,05) y la mortalidad422.
Las tiazolidinedionas que activan los PPARγ inducen retención de sodio y expansión del volumen plasmático. La retención de fluidos resultante puede causar o empeorar la IC y aumentar el número de hospitalizaciones175,425,426. En la revisión de Gitt et al419 se indica que no se debe utilizar las tiazolidinedionas debido a que aumentan los eventos en los pacientes con DM2 e IC establecida y por el importante incremento de la incidencia de IC. De acuerdo con esto, se desaconseja esta clase de fármacos hipoglucemiantes para el tratamiento de pacientes con DM2 e IC.
No hay información sobre el impacto que tienen los análogos de GLP-1 o los inhibidores DPP-4 en los pacientes con IC, pero las observaciones experimentales y clínicas indican que tienen efectos favorables en la función miocárdica427.
En cuanto al uso de insulina, un estudio de cohorte retrospectivo de 16.417 pacientes con DM y diagnóstico de IC no ha revelado asociación alguna entre el uso de insulina y la mortalidad (HR = 0,96; IC95%, 0,88-1,05), en comparación con muchas otras clases de hipoglucemiantes422. En el estudio ORIGIN, los sujetos con alto riesgo de ECV más GAA, IG o DM2 recibieron insulina glargina o tratamiento estándar, que incluía principalmente metformina y sulfonilureas. Durante el largo periodo de seguimiento de 6,2 años, no hubo diferencias en las hospitalizaciones debidas a IC168.
8.6Aspectos de conocimiento incompleto- •
Se desconoce el impacto de los fármacos hipoglucemiantes, como metformina, análogos de GLP-1 e inhibidores de DPP-IV, en la prevención de la IC.
Recomendaciones sobre el manejo de la insuficiencia cardiaca en la diabetesRecomendacionesClaseaNivelbRef.cSe recomienda IECA además de bloqueadores beta para pacientes con insuficiencia cardiaca sistólica y DM2 para reducir la mortalidad y las hospitalizacionesIA391, 394-396Se puede usar un ARA-II como alternativa al IECA para pacientes con insuficiencia cardiaca sistólica y DM2 que tengan intolerancia clara a los IECA debido a efectos secundariosIA397-399Se recomienda un bloqueador beta además de un IECA (o un ARA-II si no se tolera el IECA) para todos los pacientes con insuficiencia cardiaca sistólica y DM2 para reducir la mortalidad y las hospitalizacionesIA391, 401-403, 405,406Se recomienda un ARM para todos los pacientes con síntomas persistentes (NYHA II-IV) y FEVI ≤ 35% pese a tratamiento con IECA (o ARA-IIsi no se tolera el IECA) y un bloqueador beta para reducir el riesgo de insuficiencia cardiaca, hospitalización o muerte prematuraIA411-413Se puede considerar añadir ivabradina a un IECA, bloqueador beta y ARM para pacientes en ritmo sinusal con DM2 que tengan insuficiencia cardiaca y FEVI < 40%, con síntomas persistentes (NYHA II-IV) y frecuencia cardiaca > 70 lpm pese a recibir dosis óptima y bien tolerada de bloqueador beta junto con IECA (o ARA-II) y ARMIIbB414,428No se debe usar las tiazolidinedionas para pacientes con insuficiencia cardiaca y DM2, ya que la retención de agua puede empeorar o causar insuficiencia cardiacaIIIB175,425, 426
ARA-II: antagonista del receptor de angiotensina II; ARM: antagonista del receptor de mineralocorticoides; DM2: diabetes mellitus tipo 2; IECA: inhibidor de la enzima de conversión de la angiotensina; NYHA: clase funcional de la New York Heart Association.
a Clase de recomendación.
b Nivel de evidencia.
c Referencias en que se apoya el nivel de evidencia.
9ARRITMIAS: FIBRILACIÓN AURICULAR Y MUERTE SÚBITA CARDIACA9.1Diabetes mellitus y fibrilación auricularLas personas con fibrilación auricular (FA) tienen un riesgo sustancialmente aumentado de sufrir un accidente cerebrovascular y tienen el doble de mortalidad por ECV que las que se encuentran en ritmo sinusal429,430. La DM es frecuente en los pacientes con FA. Los estudios con poblaciones extrahospitalarias demuestran la presencia de DM en el 13% de los pacientes con FA431. La DM y la FA comparten antecedentes comunes, como la hipertensión y la obesidad. Sin embargo, no se ha establecido el papel independiente de la DM como factor de riesgo de FA.
El Manitoba Follow-up Study ha estimado la incidencia de FA específica por edad en 3.983 varones432. La DM se asoció de manera significativa a FA con un RR = 1,82 en el análisis univariable. No obstante, la asociación con la DM no fue significativa en el modelo multivariable, lo que indica que el aumento del riesgo puede estar relacionado con CI, hipertensión o IC. En el Framingham Heart Study433 la DM se asoció de manera significativa a la FA en ambos sexos, incluso después de ajustar por edad u otros factores de riesgo (OR = 1,4 para los varones y OR = 1,6 para las mujeres). En el momento de desarrollar una puntuación de riesgo para la FA, el estudio de Framingham no incluyó la DM como predictor de FA significativa434. En otro estudio reciente, Nicholas et al. identificaron la DM como predictor independiente de FA solo en las mujeres435.
Un estudio multicéntrico reciente que incluyó a 11.140 pacientes diabéticos ha confirmado que la FA es relativamente común en la DM2 y ha demostrado que, cuando la DM2 y la FA coexisten, hay un riesgo notablemente aumentado de muerte por cualquier causa, muerte cardiovascular, accidente cerebrovascular e IC436. Estos hallazgos indican que la FA identifica a pacientes diabéticos que tienen más probabilidad de beneficiarse de un manejo agresivo de todos los FRCV. Puesto que la FA es asintomática (o levemente sintomática) en una importante proporción de pacientes (alrededor del 30%), se puede recomendar la búsqueda de FA en grupos seleccionados de pacientes con DM2 y sospecha de FA paroxística o permanente mediante palpación del pulso, ECG habitual de 12 derivaciones o registro Holter.
Diabetes mellitus y riesgo de accidente cerebrovascular en la fibrilación auricularDos revisiones sistemáticas recientes han abordado la evidencia existente sobre factores de riesgo de accidente cerebrovascular en la FA y han concluido que un accidente cerebrovascular/accidente isquémico transitorio (AIT)/tromboembolia previos, la edad, la hipertensión, la DM y la cardiomiopatía estructural son factores de riesgo importantes437,438.
Diabetes mellitus y esquemas de estratificación del riesgo de accidente cerebrovascularEl esquema más simple es el índice de riesgo CHADS2 (insuficiencia cardiaca, hipertensión, edad, DM, accidente cerebrovascular [doble]). La guía de la ESC de 2010 sobre manejo de la FA, actualizada en 2012, propuso un esquema nuevo. Según este esquema, recobra el énfasis el uso de riesgo «bajo», «moderado» y «alto», como reconocimiento de que el riesgo es un continuo439,440. El nuevo esquema se expresa con el acrónimo CHA2DS2-VASc (IC, hipertensión, edad ≥ 75 [doble], DM, accidente cerebrovascular [doble]-enfermedad vascular, edad 65-74 y sexo [mujer]). Se basa en un sistema de puntos en el que se asigna 2 puntos a la historia de accidente cerebrovascular o AIT o edad ≥ 75 años y 1 punto a las otras variables. La IC se define como IC clínica o disfunción sistólica del VI (FE < 40%), la enfermedad vascular se define como historia de IM, placa aórtica compleja o EAP.
Tratamiento antitrombótico para pacientes diabéticosSe ha realizado un metanálisis de 16 estudios controlados y aleatorizados con 9.874 pacientes para caracterizar la eficacia de los fármacos anticoagulantes y antiagregantes en la prevención de los accidentes cerebrovasculares en la FA441. La anticoagulación oral ha sido eficaz para la prevención primaria y secundaria de los accidentes cerebrovasculares en estudios que incluyeron a 2.900 pacientes, con una reducción del riesgo relativo total del 62% (IC95%, 48%-72%). La reducción de riesgo absoluta fue del 2,7% por año en prevención primaria y el 8,4% por año en prevención secundaria. Las hemorragias extracraneales mayores se vieron aumentadas por el tratamiento anticoagulante en un 0,3% por año. El AAS redujo el riesgo de accidente cerebrovascular solo en un 22% (IC95%, 2%-38%), con una reducción de riesgo absoluta del 1,5% por año en prevención primaria y el 2,5% por año en prevención secundaria. En cinco estudios clínicos que compararon el tratamiento anticoagulante con el tratamiento antiagregante en 2.837 pacientes, la warfarina se demostró más eficaz que el AAS, con una RRR del 36% (IC95%, 14%-52%). Estas respuestas se observaron tanto en la FA permanente como en la FA paroxística.
Con el apoyo de los resultados de diversos estudios clínicos y de la guía europea sobre manejo de la FA de 2010, actualizada en 2012439,440, se recomienda la anticoagulación oral con antagonistas de la vitamina K (AVK) —o con alguno de los nuevos anticoagulantes orales (NACO) (para más detalles, véase más adelante)— para pacientes con FA. La elección del tratamiento antitrombótico debe basarse en el riesgo absoluto de accidente cerebrovascular/tromboembolia y sangrado y en el beneficio clínico neto para el paciente concreto. El AAS solo no se recomienda para la prevención de enfermedad tromboembólica en pacientes diabéticos con FA, pero se debe considerar la combinación de AAS y clopidogrel para pacientes que no pueden o no desean tomar AVK o NACO442. El AVK o el NACO se debe usar cuando haya uno o más factores de riesgo de accidente cerebrovascular, siempre que no haya contraindicaciones después de una evaluación cuidadosa del cociente riesgo-beneficio y valorar las preferencias del paciente439,440. Se puede concluir que los AVK y los NACO deben usarse en todos los pacientes con FA y DM a menos que estén contraindicados y siempre que el paciente los acepte. Con el uso de AVK, la franja óptima de razón internacional normalizada (INR) para prevenir accidente cerebrovascular y embolia sistémica en pacientes diabéticos es 2,0-3,0. Se ha propuesto cifras de INR más bajas (1,8-2,5) para pacientes de edad avanzada, pero esto no se basa en la evidencia.
En el estudio ACTIVE W, la warfarina fu superior a la combinación de clopidogrel más AAS (RRR = 0,40; IC95%, 18-56), sin diferencias en las tasas de sangrado442. En el grupo de AAS del estudio ACTIVE A, se ha descrito una reducción de los eventos vasculares mayores en pacientes que recibieron AAS más clopidogrel respecto a los que recibieron monoterapia de AAS (RR = 0,89; IC95%, 0,81-0,98; p = 0,01)443. Por lo tanto, se puede considerar el tratamiento de AAS+clopidogrel como una medida provisional cuando no se pueda administrar un AVK, pero no como alternativa para pacientes con alto riesgo de sangrado. La combinación de AVK con tratamiento antiagregante no ofrece efectos beneficiosos añadidos en los accidentes isquémicos o los eventos vasculares, y conduce a mayor tasa de eventos de sangrado439, por lo que se debe evitar.
Se han desarrollado dos clases nuevas de anticoagulantes: los inhibidores directos de la trombina orales (p. ej., etexilato de dabigatrán) y los inhibidores orales del factor Xa (p. ej., rivaroxabán, apixabán, edoxibán y betrixibán). En el estudio RE-LY444, la administración de dabigatrán 110mg dos veces al día no fue inferior al AVK para la prevención de accidentes cerebrovasculares y embolia sistémica, con una tasa inferior de sangrado mayor. El dabigatrán 150mg dos veces al día se asoció a menores tasas de accidente cerebrovascular y embolia sistémica, con una tasa de hemorragias mayores similar, que el tratamiento con AVK. El estudio AVERROES se interrumpió precozmente debido a evidencia clara de reducción de accidentes cerebrovasculares y embolia sistémica con apixabán 5mg dos veces al día, comparado con AAS 81-324mg una vez al día445. Un estudio reciente, el ARISTOTLE, que comparaó la warfarina con apixabán en pacientes con FA y CHADS2 medio de 2,1, ha demostrado que el apixabán 5mg dos veces al día es superior a la warfarina en la prevención de accidentes cerebrovasculares y embolias sistémicas, causa menos sangrados y disminuye la mortalidad446. El 24% de los pacientes tenían DM. El estudio ROCKET, que comparó warfarina con rivaroxabán, ha demostrado la no inferioridad del rivaroxabán respecto a la warfarina en la prevención de accidentes cerebrovasculares, embolias sistémicas o sangrado mayor en pacientes con FA y CHADS2 relativamente alto (valor medio, 3,5)447. Estos fármacos nuevos tienen un uso potencial como alternativa a la warfarina, sobre todo para pacientes que no son adecuados para el tratamiento con AVK o no los toleran. En un análisis de subgrupos preespecificados del estudio ROCKET, los pacientes diabéticos tuvieron un grado de protección similar al de la población general de estudio.
Se debe evaluar el riesgo de sangrado antes de iniciar la anticoagulación. A partir de una cohorte de la práctica clínica real de 3.978 pacientes europeos con FA del Euro Heart Survey, se ha desarrollado un nuevo índice de sangrado simple, conocido como «hipertensión, función renal/hepática alterada (1 punto cada uno), accidente cerebrovascular, antecedente de sangrado (o predisposición a este), INR lábil, edad avanzada (> 65 años), consumo concomitante de drogas/alcohol (1 punto cada uno)» (HAS-BLED)448. Una puntuación ≥ 3 indica alto riesgo y precaución, con necesidad de revisar al paciente regularmente después de iniciar el tratamiento antitrombótico.
9.2Muerte súbita cardiacaEstudios clínicos de muerte súbita cardiaca en la diabetes mellitusLa muerte súbita cardiaca (MSC) causa aproximadamente el 50% de todas las muertes cardiovasculares. En su mayoría están causadas por taquiarritmia ventricular, a menudo desencadenada por un SCA, que puede tener lugar sin enfermedad cardiaca conocida o asociada a cardiopatía estructural449,450. Los estudios epidemiológicos en muestras de la población general publicados han demostrado que los diabéticos tienen más riesgo de MSC. En el estudio de Framingham, la DM se asoció con riesgo de MSC aumentado (casi 4 veces) en todas las edades y constantemente más en las mujeres que en los varones451. El Nurses’ Health Study452, que incluyó a 121.701 mujeres de 30-55 años seguidas 22 años, ha descrito que en el 69% de los casos la MSC tuvo lugar como primer signo de enfermedad cardiaca. La DM fue un firme factor de riesgo que conllevaba un aumento de 3 veces en el riesgo de muerte súbita, mientras que la hipertensión se asoció con un aumento del riesgo de 2,5 veces y la obesidad, 1,6 veces. La DM aumenta el RR de MSC en diferentes grupos étnicos453,454,455. Un estudio reciente de los investigadores ARIC ha demostrado que la magnitud del aumento relativo del riesgo asociado a la DM es similar para la MSC y la muerte cardiaca no súbita. En este estudio, la DM atenuó las diferencias de sexo en el riesgo absoluto de MSC456.
La DM aumenta la mortalidad cardiovascular de los pacientes con IC y los supervivientes a un IM. En un análisis del programa CHARM, la DM fue un predictor independiente de la mortalidad (incluida la MSC) de los pacientes con IC independientemente de la FE457. En una serie de 3.276 pacientes tras un IM de Alemania y Finlandia, la incidencia de MSC fue mayor en la DM2 (HR = 3,8; IC95%, 2,4-5,8; p < 0,001)458. La incidencia de MSC en pacientes tras un IM con DM y FEVI > 35% fue equivalente a la observada en pacientes no diabéticos con FE ≤ 35%. La incidencia de MSC aumentó sustancialmente en pacientes diabéticos con FE < 35%, lo que respalda el concepto de que los desfibriladores implantables profilácticos deben utilizarse en todos los pacientes diabéticos sintomáticos (NYHA II-IV) con FEVI < 35%, a menos que estén contraindicados. Se debe cuantificar la FEVI de todos los pacientes con DM2 e IC congestiva o tras un IM para identificar a los candidatos a tratamiento profiláctico con desfibrilador implantable. De modo parecido, la profilaxis secundaria mediante desfibrilador implantable está indicada para pacientes diabéticos recuperados de fibrilación ventricular o taquicardia ventricular sostenida, tal como se recomienda en la guía459. Todos los pacientes postinfartados con IC también tienen que tratarse con fármacos bloqueadores beta, cuyo efecto protector contra la MSC está bien establecido449,450.
Fisiopatología de la muerte súbita cardiaca en la diabetes mellitusLas causas que subyacen al aumento de la vulnerabilidad del sustrato eléctrico en la DM no están claras y es probable que aparezcan como consecuencia de diferentes factores concomitantes: a) oclusión coronaria aguda y presencia y extensión de CI; b) fibrosis miocárdica que produce alteración del llenado del VI (disfunción diastólica) e IC sistólica; c) enfermedad microvascular y nefropatía diabética; d) neuropatía autonómica diabética; e) anomalías en la propagación eléctrica en el miocardio que se ponen de manifiesto como trastornos electrocardiográficos de la repolarización y despolarización, y apnea obstructiva del sueño459,460,461,462,463,464,465,466. La hipoglucemia inducida experimentalmente también puede producir cambios en las propiedades electrofisiológicas cardiacas. El síndrome de «muerte en la cama» es un término que describe la muerte inesperada de una persona joven con DM1 mientras está durmiendo e indica que la hipoglucemia puede contribuir a la MSC en la DM467.
Jouven et al455 han estudiado el RR de MSC en grupos de pacientes con diferentes grados de disglucemia y han demostrado que los valores de glucemia más elevados conducen a mayor riesgo. Después de ajustar por edad, tabaquismo, PA sistólica, enfermedad cardiaca y tratamiento hipoglucemiante, incluso los pacientes que están en el límit e de la DM, una situación def inida por una GPA de 7,7-11,1 mmol/l (140-200mg/dl), presentaron un riesgo aumentado de MSC (OR = 1,24 frente a pacientes normoglucémicos). La presencia de enfermedad microvascular, definida como retinopatía o proteinuria, y el sexo femenino aumentaron el riesgo en todos los grupos. Este estudio hace hincapié en que la IG parece ser una variable continua directamente relacionada con el riesgo de MSC, más que apoyar la visión previa de que el riesgo se relaciona con un umbral específico de IG. Esto encaja con el concepto actual de que el riesgo cardiovascular aumenta por debajo del umbral de DM, incluso cuando las concentraciones de glucosa se encuentran en la franja considerada bastante normal hasta ahora.
Los investigadores de Framingham468 han demostrado, a partir de una población extrahospitalaria de gran tamaño, que tras ajustar por las covariables los reducidos índices de variabilidad de la frecuencia cardiaca estaban influidos por la GP. La hiperglucemia (incluso leve) puede asociarse a menos variabilidad de la frecuencia cardiaca469. El estudio ARIC ha obtenido unos hallazgos similares470 y demuestra que incluso los pacientes prediabéticos tienen trastornos de la función cardiaca autonómica y variaciones de la frecuencia cardiaca. Estos estudios corroboran que se debe considerar la concentración de glucosa como una variable continua con influencia en el control autonómico del corazón. Por desgracia, estos estudios no se diseñaron para responder a la pregunta de si la reducción de las variaciones de la frecuencia cardiaca en la DM es un predictor independiente de MSC. Un estudio reciente ha demostrado que la determinación de marcadores autonómicos, como la variabilidad de la frecuencia cardiaca y la capacidad de deceleración a partir de registros Holter de 24h, predice la ocurrencia de muerte cardiaca y MSC en pacientes diabéticos con IM reciente471.
En un metanálisis de 15 estudios, la neuropatía autonómica cardiovascular se asoció de manera significativa a la posterior mortalidad de pacientes diabéticos472. El estudio Rochester DM neuropathy se diseñó para definir los factores de riesgo de MSC y el papel de la neuropatía autonómica diabética en una población de 462 pacientes diabéticos con un seguimiento de 15 años473. Los resultados obtenidos indican que la disfunción renal y la enfermedad cardiaca aterosclerótica son los principales determinantes del riesgo de MSC, mientras que la neuropatía autonómica y el QTc no fueron predictores independientes. Este estudio no incluyó la variabilidad de la frecuencia cardiaca u otras variables de riesgo entre los parámetros introducidos en el análisis multivariable. Por el contrario, los resultados del estudio MONICA/KORA han descrito que el QTc es un predictor independiente de muerte cardiaca, asociado a un aumento de 3 veces en pacientes diabéticos y de 2 veces en los no diabéticos474. La determinación de la variabilidad de la frecuencia cardiaca y el QTc pueden llegar a ser valiosos predictores de MSC de los pacientes diabéticos, pero todavía no hay evidencia que lo respalde para una recomendación general.
Sobre la base de la evidencia disponible, parece ser que todos los grados de IG se asocian con el desarrollo progresivo de gran variedad de trastornos que afectan a la supervivencia de forma adversa y predisponen a la MSC. La identificación de los predictores independientes de muerte cardiaca en la DM no ha progresado hasta un nivel que permita recomendar un esquema de estratificación del riesgo para prevenirla.
ConclusionesLa MSC es una importante causa de muerte de pacientes diabéticos. Aunque existen algunos factores de riesgo de MSC que pueden relacionarse específicamente con la DM, como la enfermedad microvascular y la neuropatía autonómica, se debe centrar la atención en la prevención primaria de la DM, la aterosclerosis y la enfermedad coronaria, y en la prevención secundaria de las consecuencias cardiovasculares de estas enfermedades tan comunes.
9.3Aspectos de conocimiento incompleto- •
Falta información sobre el impacto a largo plazo del control glucémico en el intervalo QTc.
- •
¿Cuál es el papel de la hipoglucemia y otros predictores en la MSC?
Recomendaciones sobre el manejo de arritmias en pacientes con diabetes mellitusRecomendacionesClaseaNivelbRef.cSe debe considerar la búsqueda de FA, ya que es frecuente en los diabéticos y aumenta la morbilidad y la mortalidadIIaC—Se recomienda la anticoagulación oral con AVK o NACO (p. ej., dabigatrán, rivaroxabán o apixabán) para pacientes diabéticos con FA (paroxística y persistente), salvo contraindicaciónIA439,440, 442,443, 445-447Se debe considerar la evaluación del riesgo de sangrado (puntuación HAS-BLED) cuando se prescriba tratamiento antitrombótico a pacientes con FA y DMIIaC—Se debe considerar la búsqueda de factores de riesgo de muerte súbita cardiaca en pacientes con DMIIaC—Se recomienda desfibrilador implantable para pacientes con DM, miocardiopatía isquémica y FEVI < 35% y para los reanimados de fibrilación ventricular o taquicardia ventricular sostenidaIA459Se recomiendan los bloqueadores beta para pacientes diabéticos con insuficiencia cardiaca y tras un IAM para prevenir la muerte súbita cardiacaIA391, 401-403, 405,406, 449,450
AVK: antagonista de la vitamina K; DM: diabetes mellitus; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; NACO: nuevos anticoagulantes orales.
a Clase de recomendación.
b Nivel de evidencia.
c Referencias en que se apoya el nivel de evidencia.
10ENFERMEDAD PERIFÉRICA Y CEREBROVASCULARLa definición de EAP utilizada en la guía europea vigente incluye las lesiones ateroscleróticas de las arterias caróticas, vertebrales, de las extremidades superiores e inferiores, mesentéricas y renales475. Esta misma definición es la que se va a utilizar en el presente documento. Aunque el aneurisma aórtico abdominal es frecuente en los pacientes diabéticos, no está incluido en la actual definición de EAP. Además, el diagnóstico y el manejo del aneurisma aórtico abdominal son independientes de la presencia o ausencia de DM.
10.1Enfermedad arterial periféricaLa DM es un factor de riesgo de desarrollo de aterosclerosis en cualquier localización vascular, pero sobre todo de enfermedad de extremidades inferiores, en la que aumenta el riesgo 2-4 veces, y enfermedad carotídea. En la enfermedad de extremidades inferiores, el tabaquismo, la DM y la hipertensión son factores de riesgo importantes. Aunque la asociación de DM con enfermedad de extremidades inferiores es inconsistente en los análisis multivariables parece ser que la duración y la gravedad de la DM tienen una especial influencia en el riesgo de gangrena y ulceración476,477. En los estudios de población, la presencia de estenosis de la arteria carotídea se ha asociado con DM y otros factores de riesgo clásicos independientemente de la edad478,479,480. La DM está presente en una proporción significativa de los pacientes con aterosclerosis difusa, que tienen peor pronóstico que los que tienen la lesión en una única localización481,482. Los pacientes diabéticos deben someterse a una búsqueda exhaustiva de EAP en distintas localizaciones vasculares. La historia médica y la exploración física (tablas 11 y 12) son la piedra angular del trabajo diagnóstico y deben incluir revisión de los diferentes lechos vasculares y sus síntomas específicos475, aunque muchos pacientes permanecen asintomáticos. Se debe realizar evaluación diagnóstica y tratamiento adicionales según las recomendaciones de la guía europea sobre EAP475. De manera resumida, a todos los pacientes diabéticos se les debe realizar anualmente una búsqueda clínica para detectar EAP y animarlos a realizar cambios en los hábitos de vida483. Todos los pacientes con EAP deben recibir tratamiento hipolipemiante, antihipertensivo y antiagregante adecuado125,274,484,485, con un control glucémico óptimo154,291,486.
Antecedentes relevantes en la enfermedad arterial periférica475
| • Antecedente familiar de enfermedad cardiovascular |
| • Síntomas de posible angina |
| • Cualquier trastorno de la marcha, como fatiga, molestias, calambres o dolor, localizados en nalgas, muslos, pantorrillas o pies, particularmente cuando los síntomas se alivian rápidamente en reposo |
| • Cualquier dolor en reposo localizado en pantorrillas o pies y su relación con la verticalidad o el decúbito |
| • Heridas mal cicatrizadas en las extremidades |
| • Dolor de esfuerzo en extremidades superiores, especialmente cuando se añade a mareo o vértigo |
| • Cualquier síntoma neurológico transitorio |
| • Antecedente de hipertensión de comienzo abrupto, hipertensión resistente (que puede deberse a estenosis arterial renal) o insuficiencia renal |
| • Dolor abdominal posprandial o inesperado, especialmente si se relaciona con la ingestión y se asocia con pérdida de peso. |
| • Disfunción eréctil |
Exploración física relevante en la enfermedad arterial periférica475
| • Determinar la presión arterial en ambos brazos y ponderar la asimetría entre los brazos |
| • Auscultar y palpar las áreas carotídea y cervical |
| • Palpar los pulsos de las extremidades superiores y, si es necesario, realizar la prueba de Allen. Inspeccionar cuidadosamente las manos |
| • Palpación abdominal y auscultación en diferentes niveles, incluidos los costados y la región iliaca |
| • Auscultar las arterias femorales |
| • Palpar las arterias femorales, poplíteas, dorsales del pie y tibiales posteriores |
| • Observar el color, la temperatura y la integridad de la piel de los pies. Anotar la presencia de ulceraciones |
| • Tener en cuenta posibles hallazgos adicionales que apunten a enfermedad arterial de extremidades inferiores, como pérdida de vello en las pantorrillas y cambios en la piel |
| • ITB, que se calcula dividiendo la presión arterial sistólica en la arteria tibial o dorsal del pie por la presión braquial. Un índice < 0,9 indica enfermedad arterial de extremidades inferiores |
ITB: índice tobillo-brazo.
En los pacientes diabéticos, las obstrucciones vasculares suelen localizarse distalmente, con lesiones típicas en la arteria poplítea o en los vasos de las extremidades inferiores. En una cohorte de 6.880 pacientes de más de 65 años, 1 de cada 5 pacientes tenía enfermedad de extremidades inferiores, aunque solo el 10% estaba sintomático487. La incidencia y la prevalencia de enfermedad de extremidades inferiores aumentan con la edad y la duración de la DM. El National Health and Nutrition Examination Survey (NHANES II) ha determinado las amplitudes de pulso en adultos y ha encontrado pulsaciones disminuidas o ausentes de la arteria dorsal del pie en un 16% de los adultos con DM de 35-54 años y un 24% de los de 55-74 años488. En muchos pacientes de más edad, la enfermedad de extremidades inferiores ya estaba presente en el momento del diagnóstico de DM. La progresión de la enfermedad de extremidades inferiores puede dar lugar a ulceraciones en los pies, gangrena y, finalmente, amputación de parte de la extremidad afectada. La DM causa aproximadamente el 50% de todas las amputaciones no traumáticas en Estados Unidos y es habitual que se requiera una segunda amputación. La mortalidad está aumentada en los pacientes con enfermedad de extremidades inferiores y la supervivencia a los 3 años de una amputación está por debajo del 50%485. El diagnóstico precoz de la enfermedad de extremidades inferiores en los pacientes diabéticos es importante para prevenir la progresión de la enfermedad, así como para predecir el riesgo cardiovascular total.
DiagnósticoLos síntomas de claudicación son alteraciones en la marcha, como fatiga, molestias, calambres o dolor localizados en nalgas, muslos, pantorrillas o pies, especialmente cuando los síntomas se alivian rápidamente con reposo. La palpación de los pulsos y la inspección visual de los pies son fundamentales. El rubor o la palidez dependientes de la elevación de la extremidad, la hiperemia retrasada cuando se baja el pie, la ausencia de crecimiento de vello y la presencia de uñas distróficas en los pies son signos de isquemia de las extremidades. Una medida objetiva de la enfermedad de extremidades inferiores es el índice tobillo-brazo (ITB), que se calcula dividiendo el valor de PA sistólica en la tibia posterior o dorsal del pie por la PA sistólica braquial. Un índice < 0,9 indica enfermedad de extremidades inferiores, especialmente en presencia de síntomas o hallazgos clínicos como soplos o ausencia de pulsos. Un ITB < 0,8 indica EAP, independientemente de los síntomas. La sensibilidad del ITB puede aumentar después del ejercicio. El ITB tras ejercicio puede identificar enfermedad de extremidades inferiores significativa, incluso en personas que tienen ITB normal en reposo489. Un ITB > 1,40 indica vasos poco compresibles como resultado de la rigidez de la pared arterial (calcinosis de la media), lo que puede impedir la correcta estimación de la presión en la arteria, incluso en caso de isquemia grave de las extremidades.
La prevención primaria y secundaria de la enfermedad de extremidades inferiores en pacientes diabéticos consiste en cambios en los hábitos de vida (que se dirijan a corregir obesidad, tabaquismo y ausencia de ejercicio físico) y control de los factores de riesgo, incluidas la hiperglucemia, la hiperlipemia y la hipertensión.
TratamientoSegún una revisión sistemática de estudios clínicos controlados y aleatorizados sobre programas de ejercicio en la claudicación sintomática, el ejercicio supervisado se ha demostrado eficaz para aumentar el tiempo de marcha, comparado con el tratamiento estándar490. Es habitual utilizar un tratamiento combinado que incluye fármacos y ejercicio físico. Aunque diversos fármacos, como cilostazol, naftidrofurilo y pentoxifilina, aumentan la distancia que el paciente puede andar en presencia de claudicación intermitente, su papel sigue siendo incierto. También se ha descrito que el tratamiento con estatinas es beneficioso para aumentar la distancia de marcha en pacientes con EAP475,491. Cuando el tratamiento conservador no funcione, se debe considerar la revascularización. En caso de claudicación incapacitante con lesiones causales localizadas en aorta/iliacas, la revascularización debe ser el tratamiento de primera elección, junto con el manejo de los factores de riesgo475. En la figura 8 se muestra un algoritmo para el tratamiento de la claudicación intermitente.
Algoritmo para el tratamiento de la claudicación intermitente (con permiso de Tendera et al475).
La isquemia crítica de las extremidades (ICE) se define por la presencia de dolor isquémico en reposo y lesiones isquémicas o gangrena atribuibles a enfermedad arterial oclusiva, que es crónica y distinguible de la isquemia aguda de las extremidades. En la figura 9 se presenta un algoritmo para el manejo de la ICE.
Algoritmo para el manejo de la isquemia crítica de las extremidades (con permiso de Tendera et al475). ECV: enfermedad cardiovascular.
Es importante recordar que los bloqueadores beta no están contraindicados para los pacientes con enfermedad arterial de extremidades inferiores y DM. Un metanálisis de 11 estudios aleatorizados ha encontrado que los bloqueadores beta no empeoran la capacidad de marcha o los síntomas de claudicación intermitente de los pacientes con EAP leve-moderada492. A los 32 meses de seguimiento de 490 pacientes con EAP e IM previo, los bloqueadores beta produjeron una reducción significativa e independiente del 53% en la tasa de aparición de nuevos eventos coronarios493.
El manejo general requiere un tratamiento multidisciplinario para controlar los factores de riesgo aterosclerótico, revascularización cuando sea posible, optimización de la cura de las heridas, calzar zapatos adecuados, tratamiento de las infecciones y realización de programas de rehabilitación475. La piedra angular del tratamiento es la reconstrucción arterial y salvar las extremidades, que se debe intentar sin demora en todos los pacientes con ICE cuando sea técnicamente posible. La búsqueda (o evaluación) de enfermedad coronaria o cerebrovascular no debe retrasar el manejo de los pacientes con ICE si están clínicamente estables. El tratamiento médico básico, incluidos los antiagregantes plaquetarios y las estatinas, debe iniciarse de acuerdo con los principios subrayados en otros apartados de este documento475,494,495.
La elección de la estrategia de revascularización depende fundamentalmente de la anatomía de la lesión arterial. Se ha descrito que los resultados clínicos de la reparación endovascular de la arteria iliaca de los pacientes diabéticos son similares o peores que los de los pacientes no diabéticos, y que la permeabilidad a largo plazo es menor496. Las tasas de permeabilidad a largo plazo de las intervenciones intravasculares en la región tibioperoneal son bajas en pacientes con y sin DM, pero pueden ser suficientes a corto plazo para facilitar la curación de las úlceras de los pies496.
El pie diabético es una entidad clínica específica que puede incluir neuropatía, traumatismos, enfermedad arterial, infección e inflamación, a menudo combinados. Las consecuencias más graves son ulceración, gangrena y una tasa elevada de amputaciones. Típicamente, la EAP de extremidades inferiores es difusa y especialmente grave en los vasos distales. Cuando se sospecha de enfermedad arterial, está indicada la exploración clínica de los pulsos con determinación del ITB para evaluar la isquemia. Si el ITB no es concluyente por una pared arterial fuertemente calcificada, se puede evaluar el estado arterial mediante presión en el dedo del pie, análisis de las ondas Doppler distales u oxígeno transcutáneo. Cuando haya isquemia, se deben realizar técnicas de imagen para planificar la revascularización, que debe aplicarse siguiendo los mismos criterios que para la ICE. Es importante tener un flujo directo hacia el pie para mejorar la curación de las úlceras. Es necesario realizar una amputación suficiente que garantice una perfusión adecuada para, junto con la revascularización, detener el proceso isquémico, inflamatorio e infeccioso.
El seguimiento debe incluir la realización de programas de educación del paciente, abandono del tabaco, utilización de calzado protector, cuidados periódicos de los pies y cirugía reconstructiva de los pies cuando sea necesario. Es obligatorio el manejo de los factores de riesgo con control glucémico y supervisión de la revascularización497.
10.3Enfermedad arterial carotídeaLa enfermedad cerebrovascular es una de las principales causas de morbilidad y mortalidad en Europa. La DM es un factor independiente de riesgo de accidente cerebrovascular, con una incidencia 2,5-3,5 mayor que en no diabéticos498,499. En este documento, la discusión sobre la prevención de accidentes cerebrovasculares y AIT se limita a los aspectos relacionados con la enfermedad arterial carotídea. Es importante señalar que se puede establecer relación causal con una estenosis de la carótida solo en un 20% aproximadamente de todos los accidentes cerebrovasculares isquémicos500. Aunque la presencia de DM aumenta la probabilidad de enfermedad carotídea, no cambia el enfoque diagnóstico y terapéutico general.
DiagnósticoLos soplos carotídeos son habituales en los pacientes con estenosis carotídea, aunque muchos se mantienen asintomáticos independientemente de la gravedad de la lesión. Aunque el espectro de síntomas es amplio, se considera sintomáticos solo a quienes han sufrido un accidente cerebrovascular o AIT en los últimos 6 meses501,502. En este grupo de pacientes, la probabilidad de accidente cerebrovascular o AIT recurrente es alto503, por lo que es obligatorio realizar pruebas de imagen urgentes del cerebro y los vasos supraaórticos de los pacientes que se presentan con AIT o accidente cerebrovascular. Para la evaluación de la estenosis carotídea está indicada la realización de ultrasonografía dúplex, angiografía por tomografía computarizada e imagen por resonancia magnética.
TratamientoEl manejo depende de los síntomas, la gravedad de la lesión, el pronóstico de supervivencia a 5 años y el resultado clínico de los procedimientos de revascularización. En la figura 10 se muestra un algoritmo de manejo.
Algoritmo para el manejo de la enfermedad arterial carotídea extracraneal (con permiso de Tendera et al475). AIT: accidente isquémico transitorio; angio-RM: angiografía por resonancia magnética; angio-TC: angiografía por tomografía computarizada; TMO: tratamiento médico óptimo.aEl manejo de la enfermedad carotídea se debe decidir lo antes posible (antes de 14 días tras el inicio de los síntomas). bDespués de una discusión multidisciplinaria que incluya a neurólogos.
Aunque la endarterectomía carotídea parece ofrecer una ventaja clara sobre el tratamiento conservador para pacientes con enfermedad carotídea sintomática, el papel de la revascularización de los pacientes asintomáticos sigue siendo dudoso475. Es necesario recalcar que la mayor parte de los resultados en pacientes sin síntomas se obtuvo antes de que las estatinas y los antiagregantes plaquetarios se convirtieran en el tratamiento estándar. Por otra parte, los resultados de la endarterectomía y los stents carotídeos han mejorado con el tiempo, por lo que sería necesario reevaluar el papel de la revascularización en esta cohorte de pacientes.
10.4Aspectos de conocimiento incompleto- •
En comparación con AAS y clopidogrel, no se conoce bien la eficacia de los nuevos fármacos antiplaquetarios en pacientes diabéticos con EAP.
- •
Es necesario comparar las intervenciones endovasculares y quirúrgicas en los diferentes subgrupos de pacientes diabéticos que tengan concomitantemente enfermedad arterial carotídea o EAP de extremidades inferiores.
Recomendaciones sobre el manejo de la enfermedad arterial periférica en la diabetesRecomendacionesClaseaNivelbRef.cSe recomienda someter a los pacientes con DM a una exploración anual para detectar EAP y determinar el ITB para detectar EAP de extremidades inferioresIC—Se recomienda que todos los pacientes con EAP y DM que fumen reciban consejo para abandonar el tabacoIB483Se recomienda que los pacientes con EAP y DM reduzcan la concentración de cLDL hasta < 1,8 mmol/l (< 70 mg/dl) o, cuando este objetivo no pueda alcanzarse, una reducción ≥ 50%IA125Se recomienda que los pacientes con EAP y DM tengan la PA controlada hasta < 140/85 mmHgIC—Se recomienda tratamiento antiagregante para todos los pacientes con EAP sintomática y DM sin contraindicacionesIA274
cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; EAP: enfermedad arterial periférica; ITB: índice tobillo-brazo; PA: resión arterial.
a Clase de recomendación.
b Nivel de evidencia.
c Referencias en que se apoya el nivel de evidencia.
11ENFERMEDAD MICROVASCULAR EN OJOS Y RIÑONESLa DM es un importante factor de riesgo de complicaciones renales y cardiovasculares y el deterioro renal —en forma de excreción urinaria de albúmina aumentada o alteración de la tasa de filtrado glomerular (TFG)— es, por sí solo, un predictor independiente de los resultados clínicos cardiovasculares161,504,505. La excreción urinaria de albúmina y la caída de la TFG pueden beneficiarse, al menos parcialmente, de intervenciones que reducen la GP y la PA.
La retinopatía es la complicación microvascular más frecuente de la DM. Aunque su incidencia ha disminuido lentamente tras la implementación de regímenes terapéuticos intensivos, la retinopatía proliferativa que pone en riesgo la visión afecta al 50% de las personas con DM1, y el 29% de las personas con DM2 sufren edema macular que pone en riesgo la visión506,507,508. La retinopatía de progresión rápida indica un riesgo cardiovascular aumentado y la combinación de retinopatía y nefropatía predice un exceso de morbilidad y mortalidad cardiovascular. En la DM2, la retinopatía avanzada aumenta en más del doble el riesgo de eventos cardiovasculares509.
11.1Fisiopatología de la enfermedad microvascularLas complicaciones microvasculares neuropáticas renales y oculares comparten algunos mecanismos fisiopatológicos que también afectan al endotelio macrovascular. La hiperglucemia crónica induce trastornos bioquímicos que causan glucaciones proteicas y sobreproducción de ROS, lo que conduce a la aparición de daño vascular y, como consecuencia, la activación de sistemas de reparación/crecimiento específico tisular510. Las características fenotípicas del daño microvascular en la DM son la oclusión vascular progresiva y el aumento de la permeabilidad vascular. En la retina, la oclusión vascular progresiva promueve una neovascularización reactiva aberrante, lo que causa el desarrollo de retinopatía proliferativa como complicación avanzada. En cualquier fase de la vasorregresión progresiva, el aumento de la permeabilidad vascular produce engrosamiento de la retina, que es clínicamente significativo cuando se afecta la mácula central.
En el riñón, la disfunción endotelial y el aumento de la permeabilidad vascular están clínicamente representados por la microalbuminuria, y la oclusión vascular se corresponde con la disminución progresiva de la función renal medida por la TFG.
11.2Tratamiento y objetivos del tratamientoIntervención sobre los hábitos de vidaNo hay estudios clínicos que demuestren que las intervenciones sobre los hábitos de vida por sí solas tengan efecto en la prevención de la nefropatía, la neuropatía o la retinopatía.
Control glucémico (véase la sección 6.2.1)Como intervención primaria, el control glucémico estricto es capaz de prevenir las complicaciones microvasculares y cardiovasculares, con un efecto beneficioso a largo plazo, tanto en la DM1 como en la DM2151,152,154,155. En prevención secundaria, el control glucémico estricto previene la progresión del deterioro renal en ambos grupos160,511.
RetinopatíaEl objetivo de HbA1c recomendado en DM1 y DM2 es < 7% (< 53 mmol/mol)152,512,513,514. Por encima de cierto grado de daño en la retina, la euglucemia no puede proporcionar beneficio adicional alguno contra la progresión de la retinopatía. En la DM1, este nivel de daño está definido de manera precisa (retinopatía diabética no proliferativa moderada), mientras que en la DM2 no se conoce cuál es el punto de no retorno515. En la DM1, el empeoramiento transitorio de la retinopatía debido a reentrada euglucémica (es decir, tratamiento intensivo de insulina después de un largo periodo de control glucémico insuficiente) está compensado por el beneficio a largo plazo del correcto control glucémico515. Por el contrario, en la DM2, un deterioro similar no es una característica acorde con la mejoría del control glucémico. La retinopatía progresiva mejora con un tratamiento multifactorial156. Para más detalles, véase la sección 7.1.
Presión arterial: nefropatíaComo intervención primaria, el control intensivo de la PA mediante bloqueadores del SRAA previene el inicio de la microalbuminuria en la DM2191,193, pero no en la DM1516,517,518. Como intervención secundaria, se ha demostrado que el control intensivo de la PA con IECA para bloquear el SRAA reduce la progresión de la enfermedad renal en la DM1 y reduce la insuficiencia renal terminal519,520. No se ha podido demostrar una reducción concomitante de los eventos cardiovasculares en estos pacientes jóvenes, aunque sería esperable, considerando los efectos renales de los IECA. En la DM2, las dosis elevadas de ramipril evitan eventos renales y cardiovasculares521. Los ARA-II reducen la progresión desde microalbuminuria a proteinuria y previenen los eventos renales pero no la muerte cardiovascular522,523. El objetivo de PA actualmente recomendado es < 140/85mmHg, aunque en los pacientes hipertensos con nefropatía y proteinuria franca se puede considerar un objetivo aún más bajo (< 130mmHg) si el paciente lo tolera (véase la sección 6.3.3)523.
Presión arterial: retinopatíaEl control de la PA tiene efectos beneficiosos en la progresión de la retinopatía. El umbral recomendado es < 140/85 mmHg191,524, aunque la concomitancia de otras condiciones, como la nefropatía, puede hacer necesario un control más intensivo de la PA (sistólica < 130mmHg). La reducción de la PA hasta este objetivo no tiene efectos adversos en la retinopatía. Los estudios DIRECT han investigado los efectos de la reducción de PA con candesartán en el desarrollo y la progresión de retinopatía. Los resultados indican una tendencia no significativa hacia menor progresión de la retinopatía tanto en la DM1 como en la DM2524,525.
Tratamiento hipolipemiante y antiagregante: nefropatíaNo se ha documentado que las intervenciones sobre los lípidos sanguíneos y la agregación plaquetaria alteren la enfermedad renal de los pacientes diabéticos. Los fibratos y los agonistas PPARα pueden reducir la función renal526. En el estudio FIELD, el fenofibrato redujo la albuminuria y enlenteció la pérdida de la TFG estimada durante 5 años, a pesar de que inicialmente aumenta la creatinina plasmática en la DM2 de manera reversible527.
Recientemente, el tratamiento de estatina + ezetimiba ha proporcionado protección cardiovascular a pacientes con función renal disminuida, como los diabéticos238.
Tratamiento hipolipemiante y antiagregante: retinopatíaNo hay objetivos claros de concentración de lípidos (colesterol, TG) para la prevención o retraso de la retinopatía. En la DM2, el estudio FIELD ha documentado que el fenofibrato se asocia a una reducción del requerimiento de tratamiento con láser, aunque este efecto parece independiente de los efectos en la concentración lipídica. El estudio ACCORD ha puesto a prueba el resultado clínico de la reducción de lípidos usando una combinación de estatinas y fenofibrato en la progresión de la retinopatía. La progresión se definió como un aumento en tres fases del grado de retinopatía según la escala de gravedad del Early Treatment of Diabetic Retinopathy Study, evaluado mediante fotografía del fondo de ojo desde basal hasta el objetivo final de 4 años del estudio o hasta intervenciones preespecificadas de tratamiento (fotocoagulación o vitrectomía). Para la reducción de la progresión de retinopatía mediante tratamiento hipolipemiante, resultó OR = 0,60 (IC95%, 0,42-0,86; p < 0,0056). Después de 4 años, las tasas de progresión de retinopatía fueron del 7,3% con el tratamiento glucémico intensivo frente al 10,4% con el tratamiento estándar (OR ajustada = 0,67; IC95%, 0,51-0,87; p = 0,003)513.
Los pacientes con DM2 necesitan tomar antiagregantes plaquetarios para la prevención secundaria de ECV. No hay contraindicaciones específicas sobre el uso de AAS u otros antiagregantes, ya que ninguno de ellos aumenta la incidencia de hemorragias intravítreas528. Es poco probable que la AAS, administrada a las dosis utilizadas en la prevención secundaria de la ECV, mejore el curso clínico de la retinopatía. El tratamiento con eritropoyetina para pacientes con enfermedad renal diabética requiere una monitorización estricta de la progresión de la retinopatía y el riesgo cardiovascular528,529.
Retinopatía que pone en riesgo la visiónSe debe derivar inmediatamente a un oftalmólogo con experiencia la retinopatía no proliferativa o proliferativa grave o cualquier grado de e dema macular relacionado con la DM. La retinopatía proliferativa que pone en riesgo la visión y el edema macular se tratan mediante fotocoagulación con láser528,530. En casos seleccionados de retinopatía no proliferativa grave relacionada con la DM, la fotocoagulación con láser también puede estar indicada. Algunos casos seleccionados de edema macular con edema subfoveal y deterioro de la visión < 20/40 pueden beneficiarse de una administración intravítrea de ranibizumab, un inhibidor del factor de crecimiento endotelial vascular (FCEV). En cuatro estudios clínicos controlados y aleatorizados (RESOLVE, RESTORE, RIDE y RISE), el tratamiento durante 1-2 años con ranibizumab fue más eficaz que el placebo o el tratamiento con láser focal/en rejilla para mejorar la agudeza visual máxima y para reducir el engrosamiento central de la retina en pacientes con deterioro visual asociado a edema macular diabético531,532,533.
11.3Aspectos de conocimiento incompleto- •
Sigue sin conocerse el balance entre el beneficio del control glucémico estricto en el riesgo microvascular y el riesgo de eventos cardiovasculares adversos.
Recomendaciones sobre el manejo de la enfermedad microvascular en la diabetesRecomendacionesClaseaNivelbRef.cSe debe considerar la detección anual de presencia de retinopatía en pacientes con DM2IIaB530Se recomienda tratamiento multifactorial cuando la retinopatía progrese rápidamenteIB156Se recomienda HbA1c < 7% y PA < 140/85 mmHg para la prevención primaria de la retinopatía relacionada con la DMIA152,161, 191, 512-514, 524Se puede considerar la reducción de lípidos para disminuir la progresión de retinopatía y la necesidad de tratamiento con láser y vitrectomíaIIaB513Se recomienda tratar la retinopatía diabética proliferativa mediante fotocoagulación con láser panretinianoIA530Se debe considerar la fotocoagulación con láser en rejilla en caso de edema macular clínicamente significativoIIaB532Se debe considerar el tratamiento intravítreo con factor de crecimiento endotelial antivascular para pacientes con pérdida de visión y edema macular clínicamente significativo que afecte a la fóveaIIaB531,532
DM: diabetes mellitus; DM2: diabetes mellitus tipo 2; HBA1c: glucohemoglobina; PA: presión arterial.
a Clase de recomendación.
b Nivel de evidencia.
c Referencias en que se apoya el nivel de evidencia.
12ATENCIÓN CENTRADA EN EL PACIENTE12.1Aspectos generalesEn secciones previas de este documento se ha recalcado la importancia de la valoración multifactorial del riesgo y de las intervenciones sobre los hábitos de vida, como la dieta y el ejercicio físico, en la prevención y el tratamiento de la DM y la ECV. No obstante, el apoyo individualizado a los pacientes para alcanzar y mantener los cambios en su estilo de vida utilizando objetivos terapéuticos y estrategias definidas sigue siendo un reto importante. El enfoque intensivo que se ha usado con éxito en los estudios clínicos para prevenir y tratar la DM y la ECV es difícil de llevar a cabo en la práctica. Una vez que se interrumpen las intervenciones intensivas, los cambios positivos en el estilo de vida y los factores de riesgo pueden acabarse, aunque se puede mantener los efectos mediante sesiones de refuerzo65.
Se debe recomendar estrategias eficaces para dar apoyo a los pacientes con el fin de conseguir cambios positivos en sus hábitos de vida y mejorar el autocuidado. El tratamiento centrado en el paciente es un enfoque que facilita el control compartido y la toma de decisiones entre el paciente y el profesional sanitario que le atiende, se centra en la persona y en su experiencia de la enfermedad dentro de un contexto social, más que en una enfermedad o un órgano determinados y permite desarrollar una alianza entre ambos534. La atención centrada en el paciente fomenta un enfoque multifactorial, trabajando en el contexto de las prioridades y los objetivos del paciente, y permite que los cambios en su estilo de vida y los tratamientos se adapten e implementen respetando sus creencias culturales y su comportamiento. Los profesionales sanitarios deben tener en cuenta la edad, las posibles diferencias debidas a raza y sexo en la DM y la ECV, incluidas las diferencias en estilo de vida, prevalencia y presentación de la enfermedad, respuesta al tratamiento y curso clínico.
La comprensión de la perspectiva del paciente y sus prioridades permite a profesionales sanitarios y pacientes desarrollar de manera conjunta objetivos realistas y aceptables y programas para el cambio de conductas y el autocuidado. Una revisión sistemática de la Colaboración Cochrane de 11 estudios clínicos (n = 1.532) ha concluido que la educación basada en el grupo (al menos 6 participantes) y centrada en el paciente se asocia a una mejoría significativa y clínicamente relevante del control glucémico y mejor conocimiento de la DM, concentración de TG, PA, reducción de la medicación y autocuidado durante 12-14 meses. Los beneficios en 2-4 años, como la disminución de la retinopatía diabética, fueron más aparentes cuando las clases de grupo se impartían anualmente535. Las estrategias cognitivo-conductuales que incluyen la resolución de problemas, el establecimiento de objetivos, la automonitorización, el apoyo continuado y el refuerzo por feedback positivo en sesiones individuales o en grupo son eficaces para facilitar un cambio en el comportamiento, sobre todo cuando se usan múltiples estrategias536,537,538. Sin embargo, una revisión sistemática de estudios sobre el aumento de la actividad física ha descrito que el efecto positivo de estas estrategias es de corta duración (6 meses) y luego se reduce538; esto puede indicar simplemente la necesidad de hacer ulteriores sesiones de refuerzo, que deben iniciarse alrededor de los 6 meses. Estrategias similares de educación cognitiva centradas en el paciente, junto con una simplificación de las pautas terapéuticas y aumento de la comodidad, pueden ser eficaces para mejorar la adherencia al tratamiento539,540,541. Es preciso investigar las combinaciones estratégicas más eficaces y la duración, la intensidad y la frecuencia de las sesiones.
Para los pacientes renuentes o que se resisten a cambiar su conducta, la entrevista motivacional es una orientación centrada en el paciente que tiene por objetivo trabajar mediante la ambivalencia el fomento de un programa dirigido por el propio paciente. Las entrevistas motivacionales son eficaces para ayudar a los pacientes a reducir el índice de masa corporal y la PA y aumentar la actividad física y el consumo de frutas y verduras542. Se suele adaptar las técnicas de entrevistas motivacionales e incorporarlas a los programas de prevención537.
Las estrategias multifacéticas se aplican de modo más eficaz a través de equipos multidisciplinarios. La International Diabetes Federation, la Diabetes Roundtable y la Global Partnership for Effective Diabetes Management son asociaciones defensoras de los equipos multidisciplinarios para el manejo de la DM543, este tipo de equipos es esencial para el éxito de los programas de manejo de la ECV544. Los programas multidisciplinarios conducidos por enfermeras, incluido el manejo de casos, se han demostrado eficaces en la reducción de múltiples FRCV y en la mejora de la adherencia de pacientes con ECV y DM en la atención primaria y secundaria536,537,545,546.
La atención centrada en el paciente hace hincapié en las personas, sus experiencias, prioridades y objetivos a la hora de manejar varias condiciones y en la asociación que se establece entre el profesional sanitario y los pacientes. Cuando un equipo multidisciplinario con habilidades en estrategias cognitivo-conductuales emplea este enfoque, aumenta el éxito en el apoyo que se da a los pacientes para conseguir cambios en sus hábitos de vida y manejar sus problemas con autonomía. También es importante reconocer que las intervenciones aisladas o limitadas y las sesiones dirigidas a aplicar cambios conductuales no bastan para mantener los cambios en los hábitos de vida, por lo que es necesario dar apoyo continuo y sesiones de refuerzo para un cambio persistente.
12.2Aspectos de conocimiento incompleto- •
No se conoce qué efectos tienen las intervenciones centradas en el paciente respecto a resultados clínicos como las complicaciones microvasculares y macrovasculares.
Recomendaciones sobre la atención centrada en el paciente en la diabetesRecomendacionesClaseaNivelbRef.cSe recomienda atención centrada en el paciente para facilitar el control compartido y la toma de decisiones en el contexto de las prioridades y objetivos del pacienteIC—Se recomiendan las estrategias cognitivo-conductuales para ayudar a los pacientes a cumplir con los cambios en estilo de vida y la práctica del autocuidadoIB536-538, 544Se debe considerar las estrategias cognitivo-conductuales centradas en el paciente combinadas con la simplificación de los regímenes terapéuticos para mejorar la adherencia al tratamiento farmacológicoIIaB539-541Se debe considerar los equipos multidisciplinarios y los programas dirigidos por enfermeras para dar apoyo a los cambios en el estilo de vida y el autocuidado del pacienteIIaB536-537, 544-545
a Clase de recomendación.
b Nivel de evidencia.
c Referencias en que se apoya el nivel de evidencia.
El texto CME «Guía de práctica clínica de la ESC sobre diabetes, prediabetes y enfermedad cardiovascular, en colaboración con la European Society for the Study of Diabetes» está acreditado por el European Board for Accreditation in Cardiology (EBAC). El EBAC trabaja según los estándares de calidad del European Accreditation Council for Continuing Medical Education (EACCME), que es una institución de la European Union of Medical Specialists (UEMS). En cumplimiento de las guías del EBAC/EACCME, todos los autores que han participado en este programa han declarado cualquier conflicto de intereses que pueda causar un sesgo en el artículo. El Comité Organizador es responsable de asegurar que todos los potenciales conflictos de intereses relevantes al programa sean declarados a los participantes antes de las actividades del CME.
Las preguntas CME para este artículo están disponibles en: European Heart Journal (http://cme.oxfordjournals. org/cgi/hierarchy/oupcme_node;ehj) y European Society of Cardiology (http://www.escardio.org/guidelines).
REFERENCIAS NO CITADASLas declaraciones de conflictos de intereses de autores y revisores están disponibles en la página web de la ESC: www.escardio.org/guidelines.
Otras entidades de la ESC que han participado en la elaboración de este documento:
Asociaciones: Acute Cardiovascular Care Association (ACCA), European Association of Cardiovascular Imaging (EACVI), European Association for Cardiovascular Prevention & Rehabilitation
(EACPR), European Association of Percutaneous Cardiovascular Interventions (EAPCI), European Heart Rhythm Association (EHRA) y Heart Failure Association (HFA). Grupos de Trabajo: Coronary Pathophysiology and Microcirculation, Thrombosis, Cardiovascular Surgery.
Consejos: Cardiovascular Nursing and Allied Professions, Council for Cardiology Practice, Council on Cardiovascular Primary Care, Cardiovascular Imaging.
El contenido de esta Guía de Práctica Clínica de la Sociedad Europea de Cardiología (ESC) ha sido publicado para uso exclusivamente personal y educativo. No está autorizado su uso comercial. No se autoriza la traducción o reproducción en ningún formato de las Guías de la ESC ni de ninguna de sus partes sin un permiso escrito de la ESC. El permiso puede obtenerse enviando una solicitud por escrito a Oxford University Press, la empresa editorial de European Heart Journal y representante autorizada de la ESC para gestionar estos permisos.
Descargo de responsabilidad. Las Guías de Práctica Clínica recogen la opinión de la ESC y la EASD y se han elaborado tras una consideración minuciosa de las evidencias disponibles al momento de redactarlas. Se anima a los profesionales de la sanidad a que las tengan en plena consideración cuando ejerzan su juicio clínico. No obstante, las Guías de Práctica Clínica no deben invalidar la responsabilidad individual de los profesionales de la salud a la hora de tomar decisiones adecuadas a las circunstancias individuales de cada paciente, consultando con el propio paciente y, cuando sea necesario y pertinente, con su tutor o representante legal. También es responsabilidad del profesional de la salud verificar las normas y los reglamentos que se aplican a los fármacos o dispositivos en el momento de la prescripción.