La Sociedad Española de Cardiología (SEC) avala las guías de práctica clínica (GPC) de la Sociedad Europea de Cardiología (ESC). Además, con el objetivo de mejorar su difusión y facilitar su implementación, las GPC de la ESC se traducen al español y se publican en formato electrónico en Revista Española de Cardiología1. Esta publicación se acompaña de un comentario editorial, generado por un grupo de expertos españoles, en el que se destacan las aportaciones más relevantes de cada GPC, detallando sus cambios y novedades con respecto a las previas y discutiendo sus aspectos más controvertidos y sus posibles limitaciones. Finalmente, las recomendaciones se valoran y adaptan atendiendo al contexto real de la organización sanitaria y la práctica clínica nuestro país.
Esta GPC de la ESC2 sobre infarto agudo de miocardio con elevación del segmento ST (IAMCEST) actualiza la guía previa de 20123 y presenta 159 recomendaciones (el 58% de clase I, el 24% de clase IIa, el 8% de clase IIb, el 10% de clase III) basadas en diferentes grados de evidencia (el 23% A, el 28% B, el 49% C), apoyándose en 477 referencias. Los principales cambios con respecto a las guías previas se resumen en la tabla. Hay que destacar el esfuerzo realizado por mantener coherencia con las GPC anteriores.
ASPECTOS GENERALESEl infarto agudo de miocardio (IAM) se define por la elevación de troponinas cardiacas en un contexto clínico compatible con isquemia miocárdica; el diagnóstico presuntivo de IAMCEST se basa en la coexistencia de síntomas persistentes que indican síntomas persistentes de isquemia y elevación del segmento ST en 2 derivaciones contiguas4. Se confirma el descenso en la incidencia poblacional de IAMCEST, así como la reducción progresiva de su mortalidad, un hecho también documentado en España5, probablemente en relación con el mayor uso de terapias de reperfusión y otros tratamientos recomendados. Se subrayan la elevada prevalencia y las dificultades para el diagnóstico del IAMCEST en ancianos y mujeres.
En la atención urgente, la guía no aconseja utilizar la respuesta a la nitroglicerina como maniobra diagnóstica y discute las implicaciones de patrones electrocardiográficos difíciles. Se establece que a los pacientes con síntomas persistentes de isquemia con bloqueo de rama (ya fuera conocido o no o de rama derecha o izquierda) hay que tratarlos como cualquier IAMCEST, es decir, con coronariografía inmediata e intervención coronaria percutánea (ICP) primaria si se requiere. Se definen las presentaciones electrocardiográficas «atípicas», que incluyen los bloqueos de rama, la presencia de estimulación ventricular, las ondas T hiperagudas, la depresión aislada del segmento ST en derivaciones anteriores y la depresión difusa del segmento ST junto con elevación en aVR.
La ampliación de las indicaciones de cateterismo emergente para los pacientes con síntomas de IAM pero con manifestaciones electrocardiográficas atípicas puede tener implicaciones importantes. La consideración del bloqueo de rama derecha como criterio para indicar coronariografía inmediata se basa en un estudio que mostró una incidencia elevada (67%) de flujo TIMI < 3 en la arteria responsable en pacientes con IAM y bloqueo de rama derecha sin elevación del ST6. Sin embargo, se trata de un estudio retrospectivo sin información sobre los síntomas de los pacientes o la presencia de descenso del ST que indicara IAM posterior. En presencia de síntomas de isquemia persistente ya está indicada la coronariografía inmediata, sea cual sea la presentación electrocardiográfica, pero en presencia de síntomas equívocos, esta nueva recomendación podría aumentar el número de coronariografías emergentes7.
La administración de oxígeno queda restringida a los pacientes con saturación arterial de O2 (SaO2) < 90% o presión arterial de O2 < 60mmHg, y se desaconseja su administración sistemática a pacientes con SaO2 ≥ 90%. En las guías previas, la administración de oxigeno se recomendaba en pacientes con SaO2 < 95%, dificultad respiratoria o insuficiencia cardiaca. Este cambio concuerda con la falta de evidencia del beneficio de administrar sistemáticamente oxígeno a los pacientes con IAMCEST8. La recomendación de administrar opiáceos es ahora menos categórica por su posible interferencia con la absorción de los antiagregantes orales.
Principales novedades en la GPC ESC 20172 sobre el IAMCEST
| 2012 | 2017 | |||
|---|---|---|---|---|
| Atención inicial | ||||
| Oxígeno si SaO2 > 95% (20122); SaO2 < 90% (2017) | I | C | I | C |
| Opioides para alivio del dolor | I | C | IIa | C |
| Procedimiento de reperfusión | ||||
| Acceso radial | IIa | B | I | A |
| SF mejor que SM | IIa | A | I | A |
| Revascularización completa durante el ingreso | III | B | IIa | A |
| Revascularización completa sistemática en el shock cardiogénico | IIa | B | IIa | C |
| Tromboaspiración sistemática | IIa | B | III | A |
| Bivalirudina | I | B | IIa | A |
| Enoxaparina | IIb | B | IIa | A |
| Tenecteplasa, media dosis para mayores de 75 años | — | — | IIa | B |
| Tratamiento de complicaciones | ||||
| BCIA sistemático en shock | IIb | B | III | B |
| Fármacos inotrópicos y vasopresores en shock | IIa | C | IIb | C |
| Ultrafiltración en insuficiencia cardiaca | IIa | B | IIb | B |
| Tratamiento hospitalario y al alta | ||||
| RMC (o SPECT) si ecocardiograma subóptimo | — | — | IIa | C |
| Traslado precoz a hospital de referencia | IIb | C | IIa | C |
| Alta precoz para IAMCEST bajo riesgo | IIb | B | IIa | A |
| Ezetimiba o anti-PCSK9 si cLDL > 1,8 mmol/l (70 mg/dl) a pesar de estatinas a dosis máximas | — | — | IIa | A |
| Cangrelor | — | — | IIb | A |
| Cambio a ticagrelor o prasugrel pasadas 48 h de la fibrinolisis | — | — | IIb | C |
| TAPD con AAS y ticagrelor hasta 36 meses para pacientes en alto riesgo | — | — | IIb | B |
| Policomprimido para aumentar la adherencia al tratamiento | — | — | IIb | B |
AAS: ácido acetilsalicílico; anti-PCSK9: inhibidor de la proproteína convertasa subtilisina/kexina 9; BCIA: balón de contrapulsación intraaórtico; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; RMC: resonancia magnética cardiaca; SF: stent farmacoactivo; SM: stent metálico sin recubrimiento; SPECT: tomografía computarizada por emisión monofotónica; TAPD: tratamiento antiagregante plaquetario doble.
La recomendación de coronariografía urgente en ausencia de elevación del ST se complementa proponiendo realizar las exploraciones necesarias para descartar diagnósticos alternativos y se modula en función del pronóstico neurológico. Se especifican los factores que indican mal pronóstico neurológico y deben considerarse antes de indicar un abordaje invasivo. Entre ellos destacan la ausencia de testigos en el momento inicial, la llegada tardía del equipo prehospitalario, un ritmo inicial no desfibrilable y la administración prolongada (> 20min) de maniobras de reanimación sin recuperación de la circulación espontánea.
No se recomienda iniciar la hipotermia con infusión de suero frío en la atención prehospitalaria (III B)9. Estudios controlados10 no han logrado demostrar la superioridad de la hipotermia terapéutica (33°C) respecto a la normotermia (36°C). Por esto, esta guía toma una posición neutra en este aspecto, y deja abierta la posibilidad de controlar la temperatura mediante enfriamiento controlado entre 32 y 36°C, siempre evitando retrasar la ICP. Se recomienda el control estricto de la temperatura de todos los pacientes en coma reanimados de una parada cardiaca extrahospitalaria (I B). El debate sigue abierto sobre el nivel óptimo al que debe mantenerse la temperatura, pero siempre hay que evitar la hipertermia.
REDES ASISTENCIALESSe insiste en que la atención del IAMCEST se debe basar en redes de atención regionales. Los centros de ICP primaria deben ofrecer una cobertura ininterrumpida las 24 horas del día, los 7 días de la semana. Se debe llevar a los pacientes directamente a la sala de hemodinámica y evitar el paso por hospitales sin ICP o por urgencias. Además, se debe registrar y auditar todos los tiempos para conseguir y mantener unos estándares de calidad adecuados. Esta guía supone un impulso renovado para mantener y mejorar, y crear donde no las haya, las redes regionales de atención al IAMCEST. El objetivo es favorecer una reperfusión lo más precoz y eficaz posible y que el máximo número de pacientes se beneficie de una ICP primaria. Es importante que las redes existentes en nuestro país revisen y adapten sus pautas de actuación atendiendo a estas nuevas recomendaciones.
Se presenta un nuevo apartado de «valoración de la calidad asistencial» que utiliza indicadores. Se describen 16 indicadores que incluyen medidas organizativas, de reperfusión, valoración del riesgo, tratamiento hospitalario y al alta y pronósticas. El reciente desarrollo de múltiples programas de ICP primaria en España no se ha acompañado de registros que analicen estos indicadores. La medida de indicadores es imprescindible para determinar la calidad y el grado de adecuación de los distintos programas.
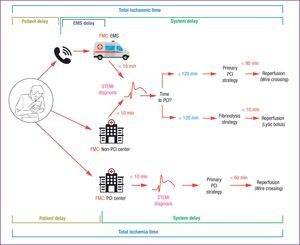
ELECCIÓN DE LA ESTRATEGIA DE REPERFUSIÓNEsta guía incluye una excelente tabla con definiciones muy precisas de los términos relacionados con la estrategia de reperfusión, y aclara términos antes confusos. Es el caso del «primer contacto médico» (PCM) definido como el momento en que el paciente es atendido por un sanitario (médico u otro profesional entrenado) capaz de obtener e interpretar un ECG y que, además, puede ejecutar las intervenciones iniciales necesarias (p. ej., una desfibrilación). El PCM puede ser en el entorno extrahospitalario (llegada de la ambulancia) o en el hospital, cuando el paciente acude por sus propios medios, pero no puede establecerse con un simple contacto telefónico, ya que no permite implementar ningún tratamiento. Un cambio importante es una clara definición del momento en que el «reloj» de la estrategia de reperfusión debe ponerse en marcha: cuando un ECG (dentro de un contexto clínico adecuado) se interpreta como con elevación del segmento ST. Previamente, la estrategia de reperfusión se basaba en el cálculo de tiempos desde un PCM ambiguamente definido.
Se recomienda obtener un ECG en menos de 10min tras el PCM y se establece el momento del diagnóstico de IAMCEST como esencial para decidir la estrategia de reperfusión: ICP primaria si se prevé una reperfusión (paso de guía) en un plazo ≤ 120min (indicador de calidad, < 90min) o trombolisis inmediata (en menos de 10min) y transporte inmediato a un centro con capacidad de ICP. Para pacientes atendidos en un hospital con ICP, el límite para la reperfusión es de 60min (figura).
Modos de presentación de los pacientes, componentes del tiempo de isquemia y gráfico de flujo para la selección de la estrategia de reperfusión. IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; PCM: primer contacto médico; SEM: sistema de emergencias médicas. Traducido y reproducido de Ibañez et al.2 con permiso de Oxford University Press en nombre de la Sociedad Europea de Cardiología.
La decisión sobre la estrategia de reperfusión (ICP primaria o fibrinolisis) se basa en el tiempo transcurrido desde el inicio de los síntomas y en el cálculo del tiempo necesario para implementar una ICP primaria desde el diagnóstico del IAMCEST.
- 1.
En las «primeras 12 h» tras el inicio de los síntomas, la decisión se basa en el cálculo del tiempo a la reperfusión con ICP. Inmediatamente después de establecer el diagnóstico de IAMCEST, se debe de estimar el tiempo que tardaría una reperfusión mediante ICP primaria (definido como el paso de guía a través de la lesión responsable). Si se estima que ese tiempo es ≤ 120min, se recomienda una ICP primaria. Si se calcula que el tiempo «diagnóstico de IAMCEST-paso de guía» es > 120min, se debe administrar fibrinolisis lo antes posible (objetivo, < 10min). Este tiempo máximo para implementar la fibrinolisis representa un cambio respecto a guías anteriores, que proponían como objetivo 30min desde el PCM hasta el bolo del fibrinolítico. El cambio se debe a la mejor definición de cuándo debe empezar a contar el tiempo para decidir la estrategia de reperfusión (ahora, es el momento del diagnóstico de IAMCEST) y a los datos del ensayo clínico STREAM11, en el que la media desde la aleatorización hasta la administración del bolo de fibrinolítico fue de solo 9min. Además, el documento actual no diferencia entre pacientes con poco tiempo de síntomas o IAM evolucionados. Si se estima que se puede estar cruzando la lesión con la guía en menos de 120min, se recomienda una estrategia de ICP primaria incluso para pacientes que se presentan muy precozmente en el curso del infarto.
- 2.
Si el diagnóstico de IAMCEST se establece «después de 12 h» desde el inicio de los síntomas, no se recomienda la fibrinolisis y se debe considerar la ICP primaria en los siguientes 2 supuestos: a) siempre que haya síntomas, inestabilidad hemodinámica o eléctrica (indicación clase I C), y b) para todo paciente que lleve entre 12 y 48h de síntomas (indicación de clase IIa B). La indicación de ICP primaria hasta las 48 es un cambio importante respecto a las guías previas (para los pacientes asintomáticos no se recomendaba más allá de las 24h) y se basa en los resultados del ensayo BRAVE-212.
- 3.
A los pacientes estables y asintomáticos «después de 48 h» tras el inicio de los síntomas, se les debe realizar una coronariografía para conocer la anatomía coronaria, pero no está indicado abrir por sistema la arteria responsable del IAM (indicación de clase III A).
Para facilitar una rápida decisión sobre la estrategia de reperfusión, esta guía presenta mensajes muy claros y concisos. Respecto a las previas, se rectifica la confusión generada por el objetivo de reperfusión de 60min en el caso de IAM muy precoz (duración de los síntomas ≤ 2h). Ahora se clarifica que el objetivo es sencillamente realizar la ICP primaria lo antes posible, con un objetivo de 90min como indicador de calidad en todos los casos. Así pues, la fibrinolisis solo se debe administrar cuando se calcula un tiempo «diagnóstico de IAMCEST-paso de guía» > 120min, y no está indicada en ningún caso cuando este tiempo sea menor, ni siquiera en los IAMCEST que se diagnostican muy precozmente. También parece acertado eliminar el concepto de tiempo puerta-balón, heterogéneo en función de si el paciente llega a la sala de hemodinámica o a urgencias. Ahora tampoco se utiliza el tiempo puerta-puerta.
La simplificación del algoritmo de reperfusión es muy positiva. Sin embargo, a la hora de decidir entre una y otra estrategia puede echarse en falta una valoración algo más detallada de las implicaciones del «tiempo total de isquemia», intervalo crítico para reducir el tamaño del infarto13. Así, parece difícil que la fibrinolisis sea preferible a la ICP primaria para los pacientes con muchas horas de evolución, incluso aunque esta no se pueda hacer en menos de 120min, mientras que 120min podría ser una demora excesiva para una ICP en pacientes con alto riesgo que se presentan en la primera hora del inicio del cuadro clínico. También se echa en falta una mención (que existía en la guía previa) a que en los pacientes con presentación muy precoz es trascendental acortar el tiempo a la ICP primaria, y ya no se considera el concepto de infarto abortado.
ASPECTOS DEL PROCEDIMIENTO Y FARMACOLÓGICOS EN LA ICP PRIMARIALos cambios más significativos son una recomendación más fuerte de acceso radial (clase I A, comparado con IIa B en 2012), y de implante de stents farmacoactivos de nueva generación en todos los casos (clase I A; en 2012 era IIa A). De hecho, incluso para los pacientes en los que se anticipe que el tratamiento antiagregante plaquetario doble (TAPD) deberá acortarse (cirugías pendientes, biopsias, etc.), también está indicado utilizar stents farmacoactivos. Estos cambios se basan en los resultados a largo plazo de estudios que han comparado los stents farmacoactivos de segunda generación con los convencionales14, y han demostrado una superior eficacia y seguridad de los primeros. Además, un reciente estudio económico a escala nacional en pacientes con IAMCEST15 demostró que los stents farmacoactivos, comparados con los convencionales, son coste-efectivos. Por lo tanto, hoy tampoco existe una justificación económica para no utilizarlos en este contexto.
También merece una mención especial el cambio de recomendación de la tromboaspiración sistemática durante ICP primaria (IIa B en la guía anterior, actualmente clase III A). Este cambio se basa en los resultados de 2 grandes ensayos clínicos, con más de 17.000 pacientes en total, donde no se encontró ningún beneficio con la tromboaspiración sistemática (incluso uno de los ensayos documentó un incremento de accidentes cerebrovasculares). No obstante, el uso de tromboaspiración está muy arraigado en la comunidad intervencionista. Aunque la nueva guía contraindica su utilización sistemática, se deja la puerta abierta a su uso restringido (indicación de clase IIb) a pacientes con alta carga trombótica residual tras abrir la arteria. Sin embargo, este punto sigue siendo conflictivo, ya que ningún ensayo ha mostrado su beneficio en ningún subgrupo de pacientes. Otra novedad es que ahora se desaconseja la estrategia de diferir habitualmente el implante del stent tras la apertura de la arteria con el paso de la guía o con el balón (indicación de clase III B). No se ha logrado confirmar en estudios específicos la posibilidad de que una estrategia de implante de stents diferida pudiera reducir la tasa de complicaciones agudas.
También se detalla mejor el abordaje de las estenosis coronarias significativas en la arteria no responsable del infarto. Según los resultados de 4 ensayos clínicos, se propone considerar la realización de ICP en las arterias no responsables antes del alta hospitalaria (incluso durante el procedimiento de ICP primaria si así lo considera el operador), con una indicación IIa A. Este es un cambio significativo respecto a las guías previas, que desaconsejaban una revascularización completa por sistema. En el tratamiento de estas lesiones graves en arterias no responsables, se propone su revascularización durante el ingreso debido a que todos los ensayos han utilizado ese momento. Sin embargo, parece razonable pensar que una ICP electiva de estas lesiones semanas después del alta pudiera ofrecer el mismo resultado clínico. Un caso particular lo representan los pacientes con IAMCEST en shock cardiogénico con lesiones graves en arterias no responsables. En este contexto, la revascularización de todas las lesiones graves se debe considerar siempre durante el procedimiento inicial. No obstante, tras la publicacion de esta guía, el estudio CULPRIT-SHOCK16 ha cuestionado recientemente la estrategia de revascularización completa al asociarla a una mayor mortalidad.
Con referencia al tratamiento farmacológico durante la ICP primaria, el tipo de anticoagulante que se utiliza también ha experimentado cambios significativos. La recomendación más fuerte indica utilizar heparina no fraccionada (clase I C), y se considera la enoxaparina y la bivalirudina como alternativas con menor fuerza de recomendación (clase IIa A). La enoxaparina mejora su recomendación respecto a las guías previas (IIb B), mientras que la indicación de bivalirudina se ha rebajado (previamente era I B). La terapia antiagregante queda similar a la guía previa, y los inhibidores potentes del P2Y12 (prasugrel y ticagrelor) son los recomendados como de primera línea, mientras que el clopidogrel se reserva para cuando estos están contraindicados o no disponibles. Una nueva recomendación es la posibilidad de utilizar el inhibidor del P2Y12 intravenoso cangrelor cuando no se haya administrado previamente prasugrel, ticagrelor o clopidogrel (indicación IIb A). Esta posibilidad podría ser interesante en algunos subgrupos específicos (pacientes intubados). Los inhibidores del receptor de la glucoproteína plaquetaria IIb/IIIa solo deben considerarse como terapia de rescate en casos de fenómeno de ausencia de reperfusión (no-reflow) o complicaciones trombóticas (indicación IIa C). Desaparece la indicación de guías anteriores de considerar el pretratamiento con este fármaco para pacientes en riesgo transferidos para ICP primaria.
ASPECTOS SOBRE LA FIBRINOLISISEn los casos en que se realice fibrinolisis, debe realizarse en menos de 10min tras el diagnóstico del IAMCEST y debe derivarse de inmediato al paciente a un centro con ICP primaria. La reducción a 10min del límite recomendado para la fibrinolisis desde el diagnóstico de IAMCEST es razonable, dada la factibilidad de administrar los fibrinolíticos actuales en bolo endovenoso11. Si pasados 60-90min desde el bolo de fibrinolítico no hay criterios de reperfusión, se debe realizar inmediatamente una ICP de «rescate». En caso de que haya criterios de reperfusión, está indicado realizar una coronariografía (e ICP del vaso responsable si procede) entre 2 y 24h tras el bolo de fibrinolítico (indicación I A; previamente el inervalo era de 3-24h, IIa A). Este cambio del momento para realizar una coronariografía tras fibrinolisis exitosa basado en la evidencia es muy práctico, ya que en la mayoría de los casos permite realizar la coronariografía en cuanto el paciente llega al hospital. Esto puede ser óptimo si el equipo de hemodinámica está presente (horas de oficina) mientras que si no lo está, se puede programar el estudio para la mañana siguiente.
Al igual que en las guías previas, se recomienda el uso de agentes líticos fibrinoespecíficos, el cóctel antitrombótico de elección en este contexto es la combinación de ácido acetilsalicílico, clopidogrel (carga de 300mg o 75mg para pacientes de 75 o más años) y enoxaparina (intravenosa + subcutánea). Existe una nueva recomendación que indica reducir a la mitad la dosis de tenecteplasa de los pacientes de edad ≥ 75 años (indicación de clase IIa B) basándose en los resultados del ensayo STREAM11. En ese ensayo, el exceso de sangrado intracraneal se atenuó tras el cambio de protocolo a dosis reducida. El cambio de dosis de fibrinolítico, asociado con la eliminación de la carga de clopidogrel, permite anticipar una reducción de hemorragias cerebrales en pacientes ancianos. Otro aspecto nuevo es la posibilidad de cambiar, después de un mínimo de 48h, de clopidogrel a prasugrel/ticagrelor como mantenimiento para los pacientes sometidos a una estrategia farmacoinvasiva (indicación IIb C)
ABORDAJE DE LA INSUFICIENCIA CARDIACA Y LAS ARRITMIAS EN EL IAMLa guía aborda detalladamente el tratamiento de los pacientes con distintos grados de insuficiencia cardiaca por disfunción ventricular. Se simplifica la tabla de recomendaciones en el IAM complicado con insuficiencia cardiaca y no se estratifica el tratamiento según la clase Killip. La recomendación del uso de opiáceos en pacientes con edema pulmonar y disnea grave pasa a IIb C (I C en la guía previa). Además, se elimina la recomendación del uso endovenoso de antagonistas del calcio para el control de la frecuencia en la fibrilación auricular (FA) y el uso endovenoso de bloqueadores beta para tal fin pasa de I A a I C. Se recomienda el uso de fármacos antialdosterónicos para los pacientes con fracción de eyección ≤ 40% e insuficiencia cardiaca, aunque en el encabezado de la tabla de recomendaciones correspondiente se refiere al tratamiento agudo, subagudo y a largo plazo. En este sentido, quizá hubiera sido adecuado detallar mejor el uso de antialdosterónicos.
En pacientes con shock cardiogénico, el uso de inotrópicos y agentes vasopresores pasa de una indicación previa IIa C a la IIb C actual. De modo similar, para estos pacientes la indicación de ultrafiltración se reduce de IIa B a IIb B. El abordaje de las complicaciones mecánicas del IAM debe discutirse en el equipo multidisciplinario y realizarse lo antes posible (I C). Como ya se ha indicado, en el shock cardiogénico esta guía recomienda una revascularización coronaria completa (IIa C). Sin embargo, se restringe el uso de balón de contrapulsación intraórtico a situaciones de inestabilidad hemodinámica o shock cardiogénico por complicación mecánica (IIa C), pero no se recomienda su uso sistemático en el shock cardiogénico, por disfunción ventricular (III B).
El abordaje de las complicaciones arrítmicas está en línea con las correspondientes guías de la ESC. Se recomienda el desfibrilador implantable (I A) para la prevención de la muerte súbita cardiaca de pacientes en clase funcional de la New York Heart AssociationII-III y fracción de eyección ≤ 35% transcurridas al menos 6 semanas del IAM, siempre que el paciente tenga una esperanza de vida de al menos 1 año y buen estado funcional. También puede considerarse el desfibrilador implantable, o el chaleco desfibrilador, durante los primeros 40 días tras el IAM para pacientes seleccionados con riesgo de muerte súbita arrítmica (IIb C).
ATENCIÓN DURANTE LA HOSPITALIZACIÓN Y AL ALTALos aspectos logísticos de la atención hospitalaria inicial del paciente con IAMCEST tras la reperfusión no han cambiado mucho. Se definen mejor los pacientes considerados de riesgo arrítmico candidatos a una monitorización prolongada (> 24h) del ECG: inestabilidad hemodinámica, presencia de arritmias graves, fracción de eyección < 40%, tratamiento de reperfusión fallido, estenosis coronarias adicionales críticas no tratadas o complicaciones relacionadas con la ICP. Ahora se indica con recomendación IIa C (previamente era IIb) que es apropiado el traslado de los pacientes estables revascularizados con éxito el mismo día al hospital de referencia sin capacidad de ICP. Se propone el alta precoz (48-72h) de pacientes en bajo riesgo (edad < 70 años, fracción de eyección > 45%, enfermedad de 1 o 2 vasos, ICP con éxito y ausencia de arritmias persistentes). Se aconseja el alta precoz (48-72h) para los pacientes en bajo riesgo cuando se pueda organizar una rehabilitación precoz y un seguimiento adecuado16. En conjunto, la guía es más agresiva para considerar un alta precoz (48-72h) para pacientes en bajo riesgo (clase IIa; previamente se consideraba el alta en 72h como clase IIb).
Una importante novedad de esta guía es la descripción de algunos subgrupos especiales de pacientes, no bien definidos en la guía anterior:
- 1.
Infarto de miocardio con coronarias normales (MINOCA). Se incluye una nueva sección dedicada a pacientes con IAMCEST y sin estenosis coronarias significativas en la coronariografía urgente. Se definen las posibles etiologías (miocarditis, enfermedades miocárdicas, afección coronaria epicárdica y microvascular, embolia pulmonar, desequilibrio entre la demanda y la disponibilidad de O2) y las exploraciones complementarias recomendadas para encontrar la causa subyacente.
- 2.
Pacientes que requieren anticoagulación oral. Estos pacientes son cada vez más frecuentes en nuestros hospitales, sobre todo en relación con la FA no valvular. Se revisa su tratamiento agudo y crónico. Actualmente las principales recomendaciones son: a) tratamiento de reperfusión con ICP primaria evitando la fibrinolisis por el riesgo hemorrágico; b) administrar anticoagulación parenteral independientemente de la última dosis de anticoagulante oral; c) uso de ácido acetilsalicílico y clopidogrel como antiagregantes (evitando el prasugrel, el ticagrelor y los inhibidores de la glucoproteína IIb/IIIa), y d) continuar con triple terapia antitrombótica (que combina anticoagulantes orales, aspirina y clopidogrel) durante 6 meses. No obstante, a la luz de los recientes resultados de los estudios PIONEER18 y RE-DUAL-PCI19, diseñados para evaluar seguridad, esta última recomendación deberá valorarse frente a la opción de doble terapia que combine un antiagregante con un anticoagulante de acción directa (rivaroxabán o dabigatrán).
- 3.
Ancianos. Se hace hincapié en la dificultad del diagnóstico del IAMCEST en ancianos, por los síntomas atípicos, y en el riesgo hemorrágico ligado al tratamiento antitrombótico. No obstante, no se formulan recomendaciones específicas para ancianos frágiles o con comorbilidades, que suponen un problema de decisión en el tratamiento del IAMCEST.
- 4.
Insuficiencia renal. La guía recomienda estimar precozmente el filtrado glomerular, mantener una hidratación adecuada, reducir al máximo la cantidad de contraste durante la ICP y ajustar las dosis de los tratamientos antitrombóticos en función de la edad y el filtrado glomerular. En este sentido, resulta útil la aplicación móvil de las GPC, que facilita los cambios de dosis en función del grado de insuficiencia renal.
- 5.
Diabetes. La selección del tratamiento antitrombótico y de reperfusión debe ser la misma para diabéticos que para no diabéticos. Se comenta que, en el análisis de subgrupos de los estudios aleatorizados, en los diabéticos se observó una mayor reducción del riesgo absoluto con prasugrel o ticagrelor que con clopidogrel. Ahora bien, la interacción entre diabetes y beneficio del prasugrel o ticagrelor no fue significativa, lo que indica que el beneficio ocurre tanto en diabéticos como en no diabéticos. También se destaca la importancia de un adecuado control de la glucemia, con especial énfasis en evitar las hipoglucemias. En los pacientes en tratamiento con metformina o inhibidores de SGLT2, se aconseja monitorizar la función renal hasta 3 días después de la ICP.
Para la estratificación del riesgo, se comenta la importancia de las variables clínicas, en particular la puntuación GRACE, y los test de imagen. El ecocardiograma es una exploración sistemática esencial tras la ICP primaria. Sin embargo, se considera que algunas técnicas de imagen, como la tomografía computarizada por emisión monofotónica (SPECT), la resonancia magnética cardiaca (RMC) o la tomografía por emisión de positrones (PET), son superiores al ecocardiograma para evaluar la viabilidad miocárdica y la isquemia residual. Así, estas técnicas, preferiblemente la RMC, pasan a tener una recomendación IIa cuando el ecocardiograma es de calidad subóptima o no concluyente (previamente eran IIb). Esto es relevante para pacientes con afección multivaso en quienes, tras la ICP primaria, se dejan las estenosis coronarias no responsables para un segundo procedimiento. En esta situación, si no se ha evaluado la gravedad de la lesión con la reserva fraccional de flujo (FFR), una decisión guiada por un test de isquemia podría ser más aconsejable que completar la revascularización guiada por el reflejo «oculoestenótico». No obstante, hay que reconocer que en los hospitales de nuestro país la disponibilidad y el coste de las técnicas de imagen diferentes del ecocardiograma puede suponer una limitación importante para su adopción más generalizada.
TRATAMIENTO TRAS EL ALTA Y A LARGO PLAZOSe ha reforzado el nivel de evidencia para las recomendaciones de rehabilitación cardiaca y terapias de deshabituación del tabaquismo (clase I), incluidas las farmacológicas (sustitutos de nicotina, vareniclina o bupropión), ambas infrautilizadas en España. Respecto al tratamiento farmacológico, no hay cambios en las recomendaciones para los tratamientos clave: bloqueadores beta, inhibidores de la enzima de conversión de angiotensina y antagonistas de la aldosterona. Pese a las dudas sobre la eficacia del tratamiento crónico con bloqueadores beta para pacientes sin disfunción ventricular o insuficiencia cardiaca, su recomendación no se ha modificado. Por otra parte, se ha reforzado (I B) la indicación de protección gástrica con inhibidores de la bomba de protones para pacientes con riesgo de sangrado digestivo. Se han actualizado las indicaciones para el tratamiento hipolipemiante, y se ha mantenido la recomendación de obtener un perfil lipídico precoz (ahora se obvia que deba ser en ayunas, lo que facilita la logística) y usar estatinas a dosis altas como tratamiento de base desde el inicio. Actualmente se recomiendan objetivos terapéuticos específicos para el control del colesterol unido a lipoproteínas de baja densidad (cLDL) a largo plazo, congruentes con las recomendaciones de las GPC de prevención. En concreto, se recomienda como objetivo de cLDL < 70mg/dl, o al menos una reducción ≥ 50% del cLDL si estaba basalmente entre 70 y 135mg/dl (I B). Basándose en los resultados de estudios previos, actualmente se recomienda (IIa A) el uso de terapia concomitante con ezetimiba o inhibidores de la PCSK9 para los pacientes en alto riesgo que no logran valores de cLDL < 70mg/dl pese al tratamiento con la máxima dosis de estatinas tolerada. No se dan, sin embargo, indicaciones concretas sobre qué fármaco, en qué momento o en qué pacientes deben emplearse estas terapias.
Finalmente, se han cambiado varias recomendaciones respecto al tratamiento antitrombótico a largo plazo, adaptándolas a la nueva GPC de la ESC sobre TAPD20. Se sigue recomendando el tratamiento sistemático con antiagregación plaquetaria doble durante 12 meses, y ahora se añade que se considere también para los pacientes no tratados con ICP (IIa C) (es decir, que no sea el stent la única indicación para establecer la duración del TAPD). Por el contrario, se aconseja interrumpir a partir de los 6 meses el TAPD de los pacientes con alto riesgo de sangrado (IIa B). Además, para los pacientes tras IAM con alto riesgo isquémico que no hayan sangrado en los primeros 12 meses, se puede considerar prolongar el ticagrelor (60mg/12h) hasta un máximo de 3 años (IIb B). En línea con guías previas de la ESC, se incluye la propuesta de utilizar el policomprimido como forma de mejorar la adherencia terapéutica (IIb B).
Dada la complejidad del tema, es interesante la atención prestada a los pacientes que requieren anticoagulación oral, para los que se sigue recomendando la antiagregación simultánea (I C), con triple terapia inicial con una duración de entre 1 y 6 meses (IIa C) según el equilibrio entre riesgo coronario y riesgo de sangrado. Sin embargo, deben evitarse (III C) el ticagrelor o prasugrel en la triple terapia. Son indicaciones de nueva anticoagulación en el IAMCEST la aparición de trombo ventricular izquierdo, hasta 6 meses de duración con control por imagen (IIa C) y la FA documentada en la fase aguda del IAM cuando, según la puntuación CHA2DS2-VASc, se deba considerar la anticoagulación a largo plazo (IIa C). Esta recomendación se basa en la evidencia de que episodios autolimitados de FA en la fase aguda del IAMCEST se asocian con mayor incidencia de accidentes cerebrovasculares durante el seguimiento.
CONFLICTO DE INTERESESE. Abu-Assi es Editor Asociado de Revista Española de Cardiología; E. López de Sá ha recibido honorarios por consultoría de Servier, Pfizer y Novartis.
ANEXO. AUTORESGrupo de Trabajo de la SEC para la guía ESC 2017 sobre el tratamiento del infarto agudo de miocardio en pacientes con elevación del segmento ST: Fernando Alfonso, Alessandro Sionis, Héctor Bueno, Borja Ibáñez, Manel Sabaté, Ángel Cequier, José Barrabés, Juan Sanchis, Emad Abu-Assi y Jaime Aboal.
Revisores expertos para la guía ESC 2017 sobre el tratamiento del infarto agudo de miocardio en pacientes con elevación del segmento ST: Esteban López de Sá, Roberto Martín Asenjo, Manuel Pan, Soledad Ojeda, Armando Pérez de Prado, Pilar Jiménez Quevedo y Ana Serrador.
Comité de Guías de la SEC: Alberto San Román, Fernando Alfonso, Arturo Evangelista, Ignacio Ferreira-González, Manuel Jiménez Navarro, Francisco Marín, Leopoldo Pérez de Isla, Luis Rodríguez Padial, Pedro Luis Sánchez Fernández, Alessandro Sionis y Rafael Vázquez García.
Grupo de Trabajo de la SEC para la guía ESC 2017 sobre el tratamiento del infarto agudo de miocardio en pacientes con elevación del segmento ST, revisores expertos para la guía ESC 2017 sobre el tratamiento del infarto agudo de miocardio en pacientes con elevación del segmento ST y Comité de Guías de la SEC.
En el anexo se relacionan los nombres de todos los autores del artículo.