Las guías de práctica clínica (GPC) tienen como objetivo reunir y evaluar toda la evidencia relevante disponible durante el proceso de elaboración sobre un tema particular para ayudar a los médicos a seleccionar la mejor estrategia posible de tratamiento para un paciente en particular que sufre una enfermedad determinada. Las GPC deben ayudar a los profesionales de la salud en la toma de decisiones clínicas en su ejercicio diario. No obstante, la decisión final sobre un paciente concreto la debe tomar el médico responsable de su salud, en consulta con el propio paciente y, si fuera necesario, con su representante legal.
En los últimos años, la Sociedad Europea de Cardiología (ESC), además de otras sociedades y organizaciones científicas, han publicado un gran número de GPC. Debido al impacto de las GPC, se han establecido criterios de calidad para su elaboración de modo que todas las decisiones se presenten de manera clara y transparente al usuario. Las recomendaciones de la ESC para la elaboración y publicación de GPC están disponibles en la sección de guías de la página web de la ESC (https://www.escardio.org/Guidelines/Clinical-Practice-Guidelines/Guidelines-development/Writing-ESC-Guidelines). Las GPC representan la postura oficial de la ESC sobre un tema particular y se actualizan con regularidad.
La ESC lleva a cabo el EurObservational Research Programme sobre registros internacionales que son esenciales para evaluar los procesos diagnósticos y terapéuticos, el uso de recursos y la adherencia a las recomendaciones de las guías. El objetivo de estos registros es comprender mejor la práctica clínica en Europa y en el mundo con base en los datos recogidos en la práctica clínica cotidiana.
La guía incluye un paquete de indicadores de calidad desarrollado por la ESC para que los hospitales, proveedores de atención sanitaria, profesionales de la salud y la ESC puedan evaluar el grado de implementación de las GPC y medir la calidad de la práctica clínica, y se incorporen a programas educativos. Los mensajes clave de la guía tienen el objetivo de mejorar la calidad de la atención sanitaria y los resultados clínicos.
Los miembros de este Grupo de Trabajo, entre los que se incluyen representantes de los grupos de subespecialidades, fueron seleccionados por la ESC en representación de los profesionales de la salud dedicados a los cuidados médicos de la patología tratada en el presente documento. Los expertos seleccionados realizaron una revisión exhaustiva de la evidencia publicada sobre el diagnóstico, el tratamiento y la prevención de esta entidad concreta según las normas establecidas por el Comité de la ESC para la Elaboración de GPC.
Se realizó una evaluación crítica de los procedimientos diagnósticos y terapéuticos, además de la relación entre el riesgo y el beneficio. Se valoraron el nivel de evidencia y la fuerza de la recomendación de una opción terapéutica particular de acuerdo con escalas predefinidas, tal como se indica en las tablas 1 y 2.
Clases de recomendación
| Clase de recomendación | Definición | Expresiones propuestas |
|---|---|---|
| Clase I | Evidencia y/o acuerdo general de que determinado procedimiento diagnóstico/tratamiento es beneficioso, útil y efectivo | Se recomienda/está indicado |
| Clase II | Evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del tratamiento | |
| Clase IIa | El peso de la evidencia/opinión está a favor de la utilidad/eficacia | Se debe considerar |
| Clase IIb | La utilidad/eficacia está menos establecida por la evidencia/opinión | Se puede recomendar |
| Clase III | Evidencia o acuerdo general de que el tratamiento no es útil/efectivo y en algunos casos puede ser perjudicial | No se recomienda |
Niveles de evidencia
| Nivel de evidencia A | Datos procedentes de múltiples ensayos clínicos aleatorizados o metanálisis |
| Nivel de evidencia B | Datos procedentes de un único ensayo clínico aleatorizado o grandes estudios no aleatorizados |
| Nivel de evidencia C | Consenso de opinión de expertos y/o pequeños estudios, estudios retrospectivos, registros |
Implicaciones clínicas de la determinación de troponinas cardiacas de alta sensibilidad
| Comparadas con las determinaciones convencionales de troponina cardiaca, las pruebas de alta sensibilidad:• Tienen mayor valor predictivo negativo de IAM• Reducen el intervalo «ciego a la troponina» y permiten detectar más rápidamente el IAM• Resultan en un aumento absoluto de un ∼4% y un aumento relativo de un ∼20% en la detección del infarto de tipo 1 y una reducción correspondiente del diagnóstico de angina inestable• Se asocian con un aumento al doble en la detección del infarto de tipo 2 |
| Las concentraciones de troponina de alta sensibilidad deben interpretarse como marcadores cuantitativos de daño de cardiomiocitos (es decir, a mayor valor, mayor posibilidad de IAM):• Las elevaciones 5 veces mayores que el límite superior de referencia tienen un valor predictivo positivo alto (> 90%) para el IAM de tipo 1• Las elevaciones 3 veces mayores que el límite superior de referencia tienen un valor predictivo positivo moderado (50-60%) para el IAM y se pueden asociar con un amplio espectro de afecciones• Es frecuente detectar cierta concentración de troponina cardiaca circulante en individuos sanos |
| La subida o la caída de las concentraciones de troponina cardiaca diferencian el daño miocardiocitario agudo (como en el IAM) del crónico (cuanto más pronunciado es el cambio, mayor es la probabilidad de IAM) |
IAM: infarto agudo de miocardio; Hs-cTn: troponina cardiaca de alta sensibilidad.
Entidades distintas del infarto agudo de miocardio de tipo 1 asociadas con daño cardiomiocitario (= elevación de troponinas cardiacas)
| Taquiarritmiasa |
| Insuficiencia cardiacaa |
| Urgencias hipertensivasa |
| Enfermedades críticas (p. ej., shock/sepsis/quemaduras)a |
| Miocarditisa,b |
| Miocardiopatía de tako-tsuboa |
| Cardiopatía estructural (p. ej., estenosis aórtica)a |
| Disección aórticaa |
| Embolia o hipertensión pulmonara |
| Disfunción renal y cardiopatías asociadasa |
| Evento neurológico agudo (p. ej., ictus o hemorragia subaracnoidea)a |
| Contusión cardiaca o procedimientos cardiacos (CABG, ICP, ablación, marcapasos, cardioversión o biopsia endomiocárdica) |
| Hipotiroidismo e hipertiroidismo |
| Enfermedades infiltrativas (p. ej., amiloidosis, hemocromatosis, sarcoidosis, escleroderma) |
| Toxicidad farmacológica o envenenamiento (doxorubinina, 5-fluorouracilo, herceptina, veneno de serpiente) |
| Esfuerzo físico extremo |
| Rabdomiolisis |
CABG: cirugía de revascularización coronaria; ICP: intervención coronaria percutánea.
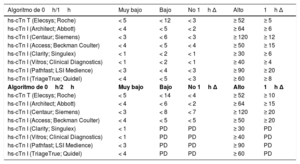
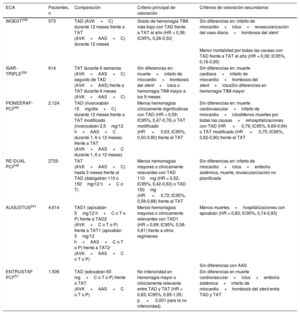
Puntos de corte específicos en ng/l para distintas pruebas y los algoritmos de 0h/1h y 0h/2h
| Algoritmo de 0h/1h | Muy bajo | Bajo | No 1h Δ | Alto | 1h Δ |
|---|---|---|---|---|---|
| hs-cTn T (Elecsys; Roche) | < 5 | < 12 | < 3 | ≥ 52 | ≥ 5 |
| hs-cTn I (Architect; Abbott) | < 4 | < 5 | < 2 | ≥ 64 | ≥ 6 |
| hs-cTn I (Centaur; Siemens) | < 3 | < 6 | < 3 | ≥ 120 | ≥ 12 |
| hs-cTn I (Access; Beckman Coulter) | < 4 | < 5 | < 4 | ≥ 50 | ≥ 15 |
| hs-cTn I (Clarity; Singulex) | < 1 | < 2 | < 1 | ≥ 30 | ≥ 6 |
| hs-cTn I (Vitros; Clinical Diagnostics) | < 1 | < 2 | < 1 | ≥ 40 | ≥ 4 |
| hs-cTn I (Pathfast; LSI Medience) | < 3 | < 4 | < 3 | ≥ 90 | ≥ 20 |
| hs-cTn I (TriageTrue; Quidel) | < 4 | < 5 | < 3 | ≥ 60 | ≥ 8 |
| Algoritmo de 0h/2h | Muy bajo | Bajo | No 1h Δ | Alto | 1h Δ |
| hs-cTn T (Elecsys; Roche) | < 5 | < 14 | < 4 | ≥ 52 | ≥ 10 |
| hs-cTn I (Architect; Abbott) | < 4 | < 6 | < 2 | ≥ 64 | ≥ 15 |
| hs-cTn I (Centaur; Siemens) | < 3 | < 8 | < 7 | ≥ 120 | ≥ 20 |
| hs-cTn I (Access; Beckman Coulter) | < 4 | < 5 | < 5 | ≥ 50 | ≥ 20 |
| hs-cTn I (Clarity; Singulex) | < 1 | PD | PD | ≥ 30 | PD |
| hs-cTn I (Vitros; Clinical Diagnostics) | < 1 | PD | PD | ≥ 40 | PD |
| hs-cTn I (Pathfast; LSI Medience) | < 3 | PD | PD | ≥ 90 | PD |
| hs-cTn I (TriageTrue; Quidel) | < 4 | PD | PD | ≥ 60 | PD |
Estos puntos de corte son independientes de la edad y la función renal. Se han evaluado puntos de corte óptimos para pacientes mayores de 75 años y aquellos con disfunción renal, pero no se ha demostrado que proporcionen un mejor balance entre seguridad y eficacia comparados con estos puntos de corte universales35,36,69. Están en desarrollo algoritmos para pruebas adicionales.
hs-cTn: troponina cardiaca de alta sensibilidad; PD: por determinar35–37,39,40,68,69,75–84.
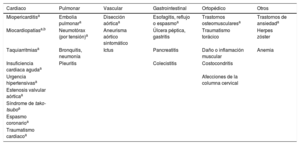
Diagnóstico diferencial de los síndromes coronarios agudos en el contexto del dolor torácico agudo
| Cardiaco | Pulmonar | Vascular | Gastrointestinal | Ortopédico | Otros |
|---|---|---|---|---|---|
| Miopericarditisa | Embolia pulmonara | Disección aórticaa | Esofagitis, reflujo o espasmoa | Trastornos osteomuscularesa | Trastornos de ansiedada |
| Miocardiopatíasa,b | Neumotórax (por tensión)a | Aneurisma aórtico sintomático | Úlcera péptica, gastritis | Traumatismo torácico | Herpes zóster |
| Taquiarritmiasa | Bronquitis, neumonía | Ictus | Pancreatitis | Daño o inflamación muscular | Anemia |
| Insuficiencia cardiaca agudaa | Pleuritis | Colecistitis | Costocondritis | ||
| Urgencia hipertensivasa | Afecciones de la columna cervical | ||||
| Estenosis valvular aórticaa | |||||
| Síndrome de tako-tsuboa | |||||
| Espasmo coronarioa | |||||
| Traumatismo cardiacoa |
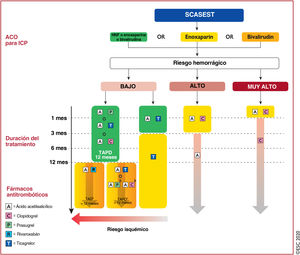
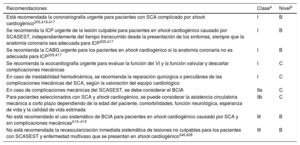
Criterios mayores y menores de riesgo hemorrágico alto según la clasificación de la Academic Research Consortium en el momento de una intervención coronaria percutánea (el riesgo hemorrágico es alto si se cumplen al menos 1 criterio mayor o 2 criterios menores)
| Criterios mayores | Criterios menores |
|---|---|
| Se prevé ACO a largo plazoa | Edad ≥ 75 años |
| ERC avanzada o grave (TFGe<30ml/min) | ERC moderada (TFGe 30-59ml/min) |
| Hemoglobina<11g/dl | Hemoglobina 11-12,9g/dl los varones u 11-11,9g/dl las mujeres |
| Sangrado espontáneo que requiera hospitalización y/o transfusión sanguínea en los últimos 6 meses o en cualquier momento si es recurrente | Sangrado espontáneo que requiera hospitalización y/o transfusión sanguínea en los últimos 12 meses y no cumple criterios mayores |
| Trombocitopenia basal moderada o gravea (recuento plaquetario<100-109/l) | Toma crónica de antiinflamatorios no esteroideos orales o esteroides |
| Diátesis hemorrágica crónica | Todo evento de ictus isquémico en cualquier momento y que no cumpla criterios mayores |
| Cirrosis hepática con hipertensión portal | |
| Malignidad activac (excepto el cáncer de piel distinto de melanoma) en los últimos 12 meses | |
| Antecedente de hemorragia intracraneal espontánea (en cualquier momento) | |
| Antecedente de hemorragia intracraneal por traumatismo en los últimos 12 meses | |
| Presencia de malformación cerebral arteriovenosa | |
| Ictus isquémico moderado o grave en los últimos 6 meses | |
| Cirugía mayor reciente o traumatismo importante en los 30 días previos a la ICP | |
| Cirugía mayor que no se pueda retrasar en pacientes en TAPD |
ACO: anticoagulación oral; ERC: enfermedad renal crónica; ICP: intervención coronaria percutánea; TAPD: tratamiento antiagregante plaquetario doble; TFGe: tasa de filtrado glomerular estimada.
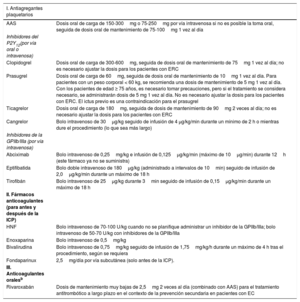
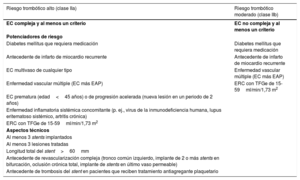
Régimen de tratamiento antiagregante plaquetario y anticoagulante para pacientes con síndrome coronario agudo sin elevación del segmento STa
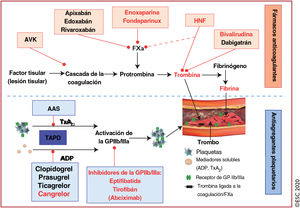
| I. Antiagregantes plaquetarios | |
|---|---|
| AAS | Dosis oral de carga de 150-300mg o 75-250mg por vía intravenosa si no es posible la toma oral, seguida de dosis oral de mantenimiento de 75-100mg 1 vez al día |
| Inhibidores del P2Y12(por vía oral o intravenosa) | |
| Clopidogrel | Dosis oral de carga de 300-600mg, seguida de dosis oral de mantenimiento de 75mg 1 vez al día; no es necesario ajustar la dosis para los pacientes con ERC |
| Prasugrel | Dosis oral de carga de 60mg, seguida de dosis oral de mantenimiento de 10mg 1 vez al día. Para pacientes con un peso corporal < 60 kg, se recomienda una dosis de mantenimiento de 5 mg 1 vez al día. Con los pacientes de edad ≥ 75 años, es necesario tomar precauciones, pero si el tratamiento se considera necesario, se administrarán dosis de 5 mg 1 vez al día. No es necesario ajustar la dosis para los pacientes con ERC. El ictus previo es una contraindicación para el prasugrel |
| Ticagrelor | Dosis oral de carga de 180mg, seguida de dosis de mantenimiento de 90mg 2 veces al día; no es necesario ajustar la dosis para los pacientes con ERC |
| Cangrelor | Bolo intravenoso de 30μg/kg seguido de infusión de 4 μg/kg/min durante un mínimo de 2 h o mientras dure el procedimiento (lo que sea más largo) |
| Inhibidores de la GPIIb/IIIa (por vía intravenosa) | |
| Abciximab | Bolo intravenoso de 0,25mg/kg e infusión de 0,125μg/kg/min (máximo de 10μg/min) durante 12h (este fármaco ya no se suministra) |
| Eptifibatida | Bolo doble intravenoso de 180μg/kg (administrado a intervalos de 10min) seguido de infusión de 2,0μg/kg/min durante un máximo de 18 h |
| Tirofibán | Bolo intravenoso de 25μg/kg durante 3min seguido de infusión de 0,15μg/kg/min durante un máximo de 18 h |
| II. Fármacos anticoagulantes (para antes y después de la ICP) | |
| HNF | Bolo intravenoso de 70-100 U/kg cuando no se planifique administrar un inhibidor de la GPIIb/IIIa; bolo intravenoso de 50-70 U/kg con inhibidores de la GPIIb/IIIa |
| Enoxaparina | Bolo intravenoso de 0,5mg/kg |
| Bivalirudina | Bolo intravenoso de 0,75mg/kg seguido de infusión de 1,75mg/kg/h durante un máximo de 4 h tras el procedimiento, según se requiera |
| Fondaparinux | 2,5mg/día por vía subcutánea (solo antes de la ICP). |
| III. Anticoagulantes oralesb | |
| Rivaroxabán | Dosis de mantenimiento muy bajas de 2,5mg 2 veces al día (combinado con AAS) para el tratamiento antitrombótico a largo plazo en el contexto de la prevención secundaria en pacientes con EC |
AAS: ácido acetilsalicílico; ACO: anticoagulación oral; AVK: antagonistas de la vitamina K; EC: enfermedad coronaria; ERC: enfermedad renal crónica; FA: fibrilación auricular; GP: glucoproteína; HNF: heparina no fraccionada; ICP: intervención coronaria percutánea; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K.
Todos los regímenes de tratamiento se refieren a las dosis de cada fármaco administradas para la protección contra la trombosis dentro del sistema arterial.
La sección III muestra las dosis de rivaroxabán en un contexto de prevención secundaria para pacientes con EC. El sumario completo sobre las dosis de ACO (NACO y AVK) en el contexto de dosis completas de anticoagulación se puede consultar en The 2018 European Heart Rhythm Association Practical Guide on the use of NOACs in patients with AF168.
Inhibidores del P2Y12 para pacientes con síndrome coronario agudo sin elevación del segmento ST
| Administración oral | Administración intravenosa | |||
|---|---|---|---|---|
| Clopidogrel | Prasugrel | Ticagrelor | Cangrelor | |
| Clase de fármaco | Tienopiridina | Tienopiridina | Ciclopentil-triazolopirimidina | Análogo del ATP |
| Reversibilidad | Irreversible | Irreversible | Reversible | Reversible |
| Bioactivación | Sí (profármaco, dependiente del CYP, 2 pasos) | Sí (profármaco, dependiente del CYP, 1 paso) | No* | No |
| Dosis (pretratamiento) | 600mg, después 75mg/día | 60mg, después 10 (5) mg | 180mg, después 90 (60) mg 2 veces al día | Bolo intravenoso de 30μg/kg e infusión de 4μg/kg/min para ICP |
| Inicio del efecto | Diferido: 2-6h | Rápido: 0,5-4h | Rápido: 0,5-2h | Inmediato: 2min |
| Duración del efecto | 3-10 días | 5-10 días | 3-4 días | 30-60min |
| Interrupción antes de la cirugía | 5 días | 7 días | 5 días | Interrupción no significativa |
| Insuficiencia renal | Sin ajuste de dosis | Sin ajuste de dosis | Sin ajuste de dosis | Sin ajuste de dosis |
| Diálisis o AclCr<15ml/min | Datos insuficientes | Datos insuficientes | Datos insuficientes | Datos insuficientes |
AclCr: aclaramiento de creatinina; CYP: citocromo P450; ICP: intervención coronaria percutánea.
El espectro clínico de los síndromes coronarios agudos (SCA) es muy amplio e incluye desde la parada cardiaca, la inestabilidad eléctrica o hemodinámica con shock cardiogénico causado por isquemia o complicaciones mecánicas, como la insuficiencia mitral (IM) grave, hasta pacientes cuyo dolor torácico ya ha desaparecido cuando llegan al hospital1. El síntoma principal que pone en marcha el proceso diagnóstico y terapéutico de los pacientes con sospecha de SCA es el dolor torácico, descrito como dolor, presión o pesadez y quemazón. Otros síntomas equivalentes al dolor torácico son la disnea, el dolor epigástrico y el dolor que irradia hacia el brazo izquierdo. Basándose en el electrocardiograma (ECG), se puede diferenciar 2 grupos de pacientes:
- 1.
Pacientes con dolor torácico agudo y elevación persistente (> 20min) del segmento ST. Esta entidad se denomina SCA con elevación del segmento ST y generalmente refleja una oclusión coronaria aguda total o subtotal. La mayoría de estos pacientes sufrirán, en último término, un infarto de miocardio con elevación del segmento ST (IAMCEST). En estos casos, el objetivo del tratamiento es la reperfusión inmediata mediante una intervención coronaria percutánea (ICP) o, si no es posible realizarla en un plazo adecuado, mediante el tratamiento fibrinolítico2.
- 2.
Pacientes con dolor torácico agudo, pero sin elevación persistente del segmento ST (SCASEST), y cambios electrocardiográficos como la elevación transitoria del segmento ST, la depresión transitoria o persistente del segmento ST, la inversión de las ondas T, ondas T planas o seudonormalización de las ondas T, aunque el ECG puede ser normal.
La correlación patológica en el miocardio es la necrosis de cardiomiocitos (IAMSEST) o, menos frecuentemente, la isquemia miocárdica sin daño celular (angina inestable). Un pequeño porcentaje de pacientes pueden sufrir isquemia miocárdica caracterizada por uno o más de los siguientes síntomas: dolor torácico persistente o recurrente, depresión significativa del segmento ST en el ECG de 12 derivaciones, insuficiencia cardiaca (IC) e inestabilidad hemodinámica o eléctrica1. Debido a la cantidad de miocardio en riesgo y el riesgo de shock cardiogénico o arritmias ventriculares potencialmente mortales, está indicada la coronariografía inmediata y, si procede, revascularización (véase la sección 6).
2.1.1Definición universal del infarto de miocardioEl infarto agudo de miocardio (IAM) se define como la necrosis de cardiomiocitos en un contexto clínico consistente con isquemia miocárdica aguda1,3. El diagnóstico de IAM requiere que se cumpla una combinación de criterios, entre ellos, la detección de un aumento o una disminución de un biomarcador cardiaco, preferiblemente troponina cardiaca de alta sensibilidad (hs-cTn) con al menos un valor por encima del percentil 99 del límite superior de lo normal, y al menos uno de los siguientes parámetros:
- •
Síntomas de isquemia miocárdica.
- •
Nuevos cambios indicativos de isquemia en el ECG.
- •
Aparición de ondas Q patológicas en el ECG.
- •
Evidencia por imagen de pérdida de miocardio viable o una nueva anomalía regional en la motilidad de la pared coherente con un patrón de etiología isquémica.
- •
Detección de un trombo coronario mediante angiografía o autopsia.
El infarto de miocardio de tipo 1 se caracteriza por la rotura, ulceración, fisura o erosión de una placa ateroesclerótica que produce la formación de un trombo intraluminal en una o más arterias coronarias, con la consiguiente reducción del flujo miocárdico o embolización distal y la ulterior necrosis miocárdica. Los pacientes pueden presentar enfermedad coronaria (EC) subyacente grave, pero en algunas ocasiones (un 5-10% de los casos) puede tratarse de ateroesclerosis coronaria no obstructiva o que no haya evidencia angiográfica de EC, especialmente en mujeres1,3–5.
2.1.1.2Infarto de miocardio de tipo 2El IM de tipo 2 es la necrosis miocárdica producida por una entidad distinta de la inestabilidad de la placa coronaria que contribuye al desajuste entre el aporte y la demanda miocárdica de oxígeno3. Entre sus mecanismos se incluyen la hipotensión, la hipertensión, las taquiarritmias, las bradiarritmias, la anemia, la hipoxemia y, por definición, el espasmo arterial coronario, la disección arterial coronaria espontánea, la embolia coronaria y la disfunción microvascular6–8.
2.1.1.3Infarto de miocardio de tipos 3-5La definición universal de infarto de miocardio incluye además el tipo 3, que se define como el infarto de miocardio con desenlace mortal cuando no se dispone de biomarcadores, y los tipos 4 y 5, que se relacionan con la ICP y la cirugía de revascularización coronaria (CABG) respectivamente3.
2.1.2Angina inestable en la era de la determinación de troponinas cardiacas de alta sensibilidadLa angina inestable se define como la isquemia miocárdica en reposo o con mínimo esfuerzo en ausencia de daño agudo o necrosis de cardiomiocitos. Entre pacientes no seleccionados con sospecha de SCASEST ingresados en el servicio de urgencias, la introducción de las determinaciones de hs-cTn, en lugar de las determinaciones estándar, resultó en un aumento de la detección de infartos de miocardio (aumento absoluto de un–4% y aumento relativo del 20%) y en una disminución recíproca del diagnóstico de angina inestable9–13. Comparados con los pacientes con IAMSEST, los pacientes con angina inestable no presentan daño o necrosis de cardiomiocitos, tienen un riesgo de muerte sustancialmente menor y obtienen menos beneficios del tratamiento antiagregante plaquetario intensivo y del tratamiento invasivo en las primeras 72 h1,3–5,9–19. Su fisiopatología y su epidemiología se tratan detalladamente en otro documento1.
2.2EpidemiologíaEl porcentaje de pacientes con IAMSEST en los registros sobre IM aumentó desde un tercio en 1995 a más de la mitad en 2015, debido fundamentalmente a una mayor precisión del diagnóstico del IAMSEST20. Comparada con la población con IAMCEST, en la población con IAMSEST no se observaron cambios significativos en las características basales relativas a la edad y el hábito tabáquico, mientras que la diabetes, la hipertensión y la obesidad aumentaron sustancialmente. El uso temprano de la angiografía (≤ 72h desde el ingreso) aumentó del 9% en 1995 al 60% en 2015 (OR ajustada [ORa]=16,4; intervalo de confianza del 95% [IC95%], 12,0-22,4; p<0,001) y la ICP durante la hospitalización inicial aumentó del 12,5 al 67%. Las consecuencias más importantes de estos cambios fueron la reducción de la mortalidad a los 6 meses del 17,2 al 6,3% y la hazard ratio (HR) ajustada (HRa) se redujo a HRa=0,40 (IC95%, 0,30-0,54) en 2010 y permaneció estable en HRa=0,40 (0,30-0,52) en 201520.
2.3¿Qué hay nuevo en la edición de 2020?| Recomendaciones nuevas más importantes | ||
| Diagnóstico | ||
| Como alternativa al algoritmo 0h/1h, está recomendado el uso del algoritmo 0h/2h con la toma de muestras de sangre a las 0h y 2h, siempre que el centro disponga de pruebas de hs-cTn con un algoritmo 0h/2h validado | ||
| No está recomendado determinar sistemáticamente biomarcadores adicionales, como CK, CK-MB, PUAG-C o copeptina, además de hs-cTn, con objetivos diagnósticos | ||
| Estratificación del riesgo | ||
| Se debe considerar la determinación de concentraciones plasmáticas de BNP o NT-proBNP para obtener información pronóstica | ||
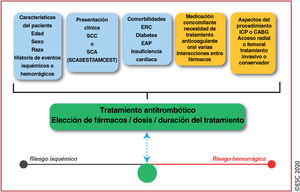
| Tratamiento antitrombótico | ||
| Se debe considerar el uso de prasugrel, antes que ticagrelor, para pacientes con SCASEST que se someten a una ICP | ||
| No está recomendado el pretratamiento sistemático con un inhibidor del P2Y12 cuando se planea una estrategia invasiva temprana en pacientes con anatomía coronaria desconocida | ||
| Dependiendo del riesgo hemorrágico, se puede considerar el pretratamiento con un inhibidor del P2Y12 para pacientes con SCASEST que no pueden someterse a una estrategia invasiva temprana | ||
| Se puede considerar la reducción del tratamiento con inhibidores del P2Y12 (p. ej., cambiar de prasugrel o ticagrelor a clopidogrel) como una alternativa al TAPD, especialmente para pacientes con SCA a los que no se considera candidatos a tratamiento de inhibición plaquetaria potente. La reducción del tratamiento se puede hacer guiada únicamente por el juicio médico o por pruebas de la función plaquetaria o la determinación del genotipo del CYP2C19, dependiendo del perfil de riesgo del paciente y de la disponibilidad de estas pruebas | ||
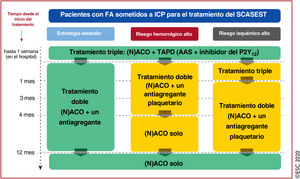
| Para pacientes con FA (puntuación CHA2DS2-VASc ≥ 1 los varones y ≥ 2 las mujeres), y tras un corto periodo de TAT (hasta 1 semana desde el evento agudo), está recomendado el TAD como estrategia estándar con un NACO en las dosis recomendadas para la prevención del ictus y un antiagregante plaquetario oral (preferiblemente clopidogrel) | ||
| Para pacientes que toman ACO, está recomendado interrumpir el tratamiento antiagregante plaquetario después de 12 meses | ||
| Se puede considerar el TAD con un ACO y ticagrelor o prasugrel como alternativa al TAT con un ACO, AAS y clopidogrel para pacientes con riesgo moderado o alto de trombosis del stent, independientemente del tipo de stent implantado | ||
| Tratamiento invasivo | ||
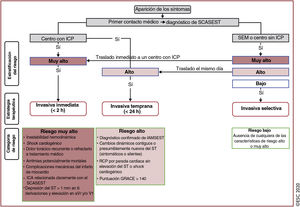
| Está recomendada una estrategia invasiva en las primeras 24h para los pacientes con cualquiera de los siguientes criterios de riesgo alto:• Diagnóstico de IAMSEST• Cambios dinámicos contiguos o presumiblemente nuevos en el segmento ST/T indicativos de isquemia• Elevación transitoria del segmento ST• Puntuación GRACE>140 | ||
| Está recomendada una estrategia invasiva selectiva tras la realización de pruebas de isquemia o la detección de EC obstructiva mediante ATC para pacientes considerados en riesgo bajo | ||
| Se debe considerar el aplazamiento de la angiografía, en contraposición a la angiografía inmediata, para los pacientes hemodinámicamente estables sin elevación del segmento ST reanimados con éxito tras una parada cardiaca extrahospitalaria | ||
| Se debe considerar la revascularización completa para pacientes con SCASEST sin shock cardiogénico y con EC multivaso | ||
| Se puede considerar la revascularización completa durante la ICP inicial para pacientes con SCASEST y EC multivaso | ||
| Se puede considerar la revascularización guiada por RFF de las lesiones no culpables del SCASEST durante la ICP inicial | ||
| Cambios más importantes en las recomendaciones | ||
| 2015 | 2020 | |
| Diagnóstico | ||
| Está recomendado un protocolo rápido a las 0h y 3h para descartar el diagnóstico si se dispone de pruebas de hs-cTn | Se debe considerar un protocolo rápido con toma de muestras de sangre a las 0h y 3h para confirmar o descartar el diagnóstico, si se dispone de pruebas de hs-cTn con un algoritmo de 0h/3h validado | |
| Se debe considerar la coronariografía mediante TCMD como alternativa a la angiografía invasiva para descartar el SCA cuando la probabilidad de EC sea baja-intermedia y cuando la concentración de troponina cardiaca o el ECG no sean concluyentes | Está recomendada la ATC como alternativa a la angiografía invasiva para descartar el SCA cuando la probabilidad de EC sea baja-intermedia y cuando la concentración de troponina cardiaca o el ECG sean normales o no concluyentes | |
| Se debe considerar la monitorización del ritmo hasta 24h o ICP (lo que suceda antes) para los pacientes con IAMSEST y bajo riesgo de arritmias cardiacas | Está recomendada la monitorización del ritmo hasta 24h o ICP (lo que suceda antes) para los pacientes con IAMSEST y bajo riesgo de arritmias cardiacas | |
| Se debe considerar la monitorización del ritmo durante más de 24h para los pacientes con IAMSEST y riesgo de arritmias cardiacas intermedio-alto | Está recomendada la monitorización del ritmo durante más de 24h para los pacientes con IAMSEST y riesgo de arritmias cardiacas aumentado | |
| Evaluación del riesgo | ||
| Está recomendado el uso de escalas de riesgo establecidas para la estimación del pronóstico | Se debe considerar el uso de modelos de riesgo basados en la escala GRACE para la estimación del pronóstico | |
| Tratamientos farmacológicos | ||
| Está recomendada la administración de bivalirudina (bolo i.v. de 0,75mg/kg seguido de 1,75mg/kg/h durante un máximo de 4h tras el procedimiento) como alternativa a la HNF, además de un inhibidor de la GPIIb/IIIa durante la ICP | Se puede considerar la administración de bivalirudina como alternativa a la HNF | |
| Se puede considerar la administración de un inhibidor del P2Y12 además de AAS durante más de 1 año tras la evaluación del riesgo isquémico y hemorrágico del paciente | Se debe considerar la adición de un segundo fármaco antitrombótico al AAS para la prevención secundaria a largo plazo en pacientes con alto riesgo de eventos isquémicos y sin riesgo aumentado de hemorragia mayor o potencialmente mortal | |
| Clase I | Clase IIa | Clase IIb |
| Secciones nuevasMINOCADACEIndicadores de calidad del tratamiento de los SCASEST | ||
| Conceptos nuevos o revisadosAlgoritmos rápidos para descartar o confirmar el diagnósticoEstratificación del riesgo para un abordaje invasivo tempranoDefinición de alto riesgo hemorrágicoDefinición de riesgo isquémico alto y muy altoLagunas en la evidencia y ECA correspondientes que es necesario realizar |
AAS: ácido acetilsalicílico; ACO: anticoagulación oral; ATC: angiotomografía computarizada; BNP: péptido natriurético cerebral; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 (doble), diabetes, ictus (doble)-enfermedad vascular, edad 65-74, sexo (mujer); CK-MB: creatincinasa miocárdica; CK: creatincinasa; EC: enfermedad coronaria; ECA: ensayo clínico aleatorizado; DACE: disección arterial coronaria espontánea; ECG: electrocardiograma; ESC: Sociedad Europea de Cardiología; FA: fibrilación auricular; GP: glucoproteína; GRACE: Global Registry of Acute Coronary Events; HNF: heparina no fraccionada; Hs-cTn: troponina cardiaca de alta sensibilidad; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; MINOCA: infarto de miocardio sin enfermedad coronaria obstructiva; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; NT-proBNP: fracción N-terminal del propéptido natriurético cerebral; PUAG-C: proteína de unión a ácidos grasos de tipo cardiaco; RFF: reserva fraccional de flujo; SCA: síndrome coronario agudo; SCASEST: síndrome coronario agudo sin elevación del segmento ST; TAD: tratamiento antitrombótico doble; TAPD: tratamiento antiagregante plaquetario doble; TAT: tratamiento antitrombótico triple; TCMD: tomografía computarizada multidetectores.
Consulte el material adicional disponible en European Heart Journal.org.
El número total de recomendaciones es de 131. El desglose de las recomendaciones según las clases de recomendación y el nivel de evidencia de la ESC se encuentran resumidos en la figura 1 del material adicional.
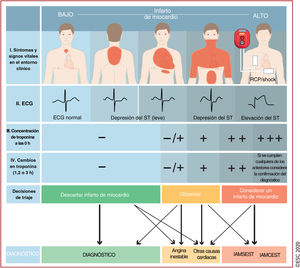
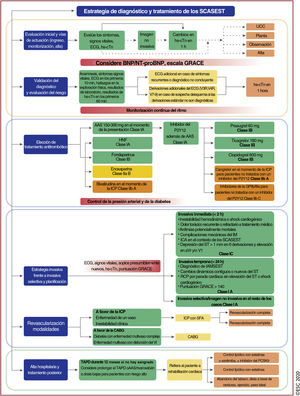
Algoritmo diagnóstico y triaje en los síndromes coronarios agudos. La evaluación inicial se basa en características de baja y/o alta probabilidad observadas en el entorno clínico (síntomas y signos vitales), el ECG de 12 derivaciones y la concentración de troponina cardiaca determinada en el momento del ingreso en la unidad de urgencias y las determinaciones seriadas que se realicen posteriormente. «Otras causas cardiacas incluye miocarditis, síndrome de tako-tsubo o insuficiencia cardiaca congestiva, entre otras. Las «causas no cardiacas» se refieren a enfermedades torácicas como la neumonía y el neumotórax. La concentración de troponina cardiaca y sus cambios en muestras seriadas se deben interpretar como un marcador cuantitativo: cuánto más alta es la concentración a las 0h o mayor es el cambio absoluto en las muestras seriadas, mayor es la probabilidad de IM. La ecocardiografía, realizada e interpretada inmediatamente después del ECG de 12 derivaciones por médicos entrenados, está recomendada para pacientes en parada cardiaca o inestabilidad hemodinámica de origen probablemente cardiovascular. En caso de sospecha de disección aórtica o embolia pulmonar, está recomendado determinar el dímero D y realizar ATC, según algoritmos específicos1,29–33. ECG: electrocardiograma; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; IM: infarto de miocardio; RCP: reanimación cardiopulmonar. Escuche on-line la audioguía de esta figura.
Consulte el material adicional.
3.2ExploraciónConsulte el material adicional.
3.3Instrumentos diagnósticos3.3.1ElectrocardiogramaEl ECG de 12 derivaciones en reposo es el principal instrumento diagnóstico para la evaluación de los pacientes con sospecha de SCA (figura 1). Se debe realizar en los primeros 10min de la llegada del paciente a urgencias o, preferiblemente, durante el primer contacto prehospitalario con los servicios médicos de urgencias y debe interpretarlo inmediatamente un médico cualificado21. Aunque el ECG en el contexto de los SCASEST puede ser normal en más del 30% de los pacientes, las alteraciones electrocardiográficas características incluyen la depresión del segmento ST, la elevación transitoria del segmento ST y cambios en la onda T6–8,10–13,22. Si las derivaciones estándar no son concluyentes y el paciente tiene signos o síntomas indicativos de isquemia miocárdica, deben registrarse derivaciones adicionales; la oclusión de la arteria circunfleja izquierda solo es detectable en las derivaciones V7-V9 y el infarto de miocardio ventricular derecho, solo en las derivaciones V3R y V4R3. En pacientes con signos y síntomas indicativos de isquemia, la elevación persistente del segmento ST indica un diagnóstico de IAMCEST que requiere reperfusión inmediata2. Es útil comparar el ECG con registros anteriores, sobre todo en pacientes con alteraciones electrocardiográficas preexistentes. Se recomienda obtener registros adicionales de ECG de 12 derivaciones en caso de síntomas persistentes o recurrentes o de diagnóstico incierto. En los pacientes con bloqueo de rama izquierda (BRI), el uso de criterios electrocardiográficos específicos (criterios de Sgarbossa) puede ayudar a identificar a los pacientes candidatos a coronariografía inmediata23,24. Los pacientes con sospecha clínica alta de isquemia miocárdica y BRI deben recibir la misma atención que los pacientes con IAMCEST, independientemente de si el BRI se conocía previamente2.
Por el contrario, los pacientes hemodinámicamente estables que se presentan con dolor torácico y BRI solo tienen un riesgo de infarto de miocardio ligeramente más alto que los pacientes sin BRI. En estos casos se debe tener en cuenta la concentración de hs-cTn para tomar decisiones sobre la coronariografía inmediata24.
En los pacientes con bloqueo de rama derecha (BRD), la elevación del segmento ST indica IAMCEST, mientras que la depresión del ST en las derivaciones I, aVL y V5-6 indica SCASEST25. En los pacientes con marcapasos ventricular el ECG no sirve de ayuda para el diagnóstico de SCASEST. Se están desarrollando nuevos algoritmos que incorporan datos electrocardiográficos digitales26–28. En general, es recomendable la interpretación del ECG mediante tecnología a distancia en la fase prehospitalaria.
Es importante señalar que más del 50% de los pacientes que se presentan con dolor torácico agudo y BRI en el servicio de urgencias o en unidades de dolor torácico finalmente no tendrán un diagnóstico de infarto de miocardio24. Del mismo modo, más del 50% de los pacientes con dolor torácico agudo y BRD que llegan al servicio de urgencias tendrán también un diagnóstico diferente del infarto de miocardio y deben esperar el resultado de la determinación de hs-cTn T/I25.
3.3.2Biomarcadores: troponina cardiaca de alta sensibilidadLos biomarcadores complementan a la evaluación inicial y al ECG de 12 derivaciones para el diagnóstico, la estratificación del riesgo y el tratamiento de los pacientes con sospecha de SCASEST. La determinación de un biomarcador de daño miocárdico, preferiblemente hs-cTn, es obligatoria en todos los pacientes con sospecha de SCASEST1,3,10–13. Las troponinas cardiacas son biomarcadores de daño cardiomiocitario más sensibles y específicos que la creatincinasa (CK), su isoenzima miocárdica (CK-MB) y la mioglobina1,3,4,10–13,29,30. Si la presentación clínica es compatible con isquemia miocárdica, la elevación dinámica de troponinas cardiacas por encima del percentil 99 de individuos sanos indica infarto de miocardio. En los pacientes con IM, las concentraciones de troponina cardiaca aumentan rápidamente tras la aparición de los síntomas (normalmente durante la primera hora si se emplean determinaciones de alta sensibilidad) y permanecen elevadas durante un tiempo variable (normalmente varios días)1,3,4,10–13,29,30.
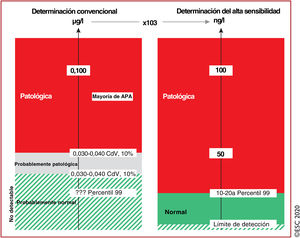
Los avances tecnológicos han mejorado la determinación de troponinas cardiacas y han aumentado la capacidad de detección y cuantificación del daño cardiomiocitario1,3,4,6–8,10–13,29,30,34–36. Los datos de grandes estudios multicéntricos muestran que la determinación de hs-cTn aumenta la precisión diagnóstica del infarto de miocardio en el momento de la presentación, comparada con la determinación convencional de troponina (figura 2), particularmente en los pacientes que se presentan poco tiempo después de la aparición de los síntomas, y permiten confirmar o descartar más rápidamente el infarto de miocardio (véase la sección 3.3.3 y la tabla 3)1,3,4,6–8,10–13,29,30,35,36. En general la determinación de hs-cTn T o I parece proporcionar una precisión diagnóstica comparable para el diagnóstico temprano del infarto de miocardio37–40.
Valor de la troponina cardiaca de alta sensibilidad (hs-cTn). La determinación de hs-cTn (derecha) se informa en ng/l y proporciona información idéntica a la determinación convencional (izquierda, en μg/l) siempre que la concentración sea sustancialmente elevada, por ejemplo, concentraciones>100ng/l. Sin embargo, únicamente la hs-cTn permite diferenciar con precisión un aumento «normal» de otro «leve». Por ello, la hs-cTn puede identificar un porcentaje relevante de pacientes con concentraciones de troponina cardiaca que previamente no se detectaban con las determinaciones convencionales y que tienen concentraciones de hs-cTn superiores al percentil 99 probablemente relacionadas con el IAM.? ? ?: desconocido debido a la incapacidad de la prueba de medir en el intervalo de normalidad6–8,10–13,29–31; APA: análisis en el punto de atención médica; CdV: coeficiente de variación; hs-cTn: troponina cardiaca de alta sensibilidad; IAM: infarto agudo de miocardio.
aEl límite de detección varía entre 1 y 5ng/l en distintos tests de hs-cTn. Igualmente, el percentil 99 también varía dependiendo del tipo de prueba de hs-cTn, fundamentalmente entre 10 y 20ng/l. Escuche online la audioguía de esta figura.
La gran mayoría de las determinaciones de troponina cardiaca que se realizan en plataformas automatizadas en los laboratorios centrales son sensibles (permiten detectar troponinas cardiacas en ∼20-50% de los individuos sanos) o ultrasensibles (detección en un ∼50-95% de los individuos sanos). Las determinaciones ultrasensibles son más recomendables que las de menor sensibilidad, ya que tienen mayor precisión diagnóstica y el mismo bajo coste1,3,4,6–8,10–13,29,30,33,35,36.
La mayoría de los análisis que se emplean en los puntos de atención al paciente no pueden considerarse sensibles ni ultrasensibles41. Por ello, la ventaja potencial de estos análisis (mayor rapidez en la obtención de los resultados) se ve contrarrestada por sus menores sensibilidad, precisión diagnóstica y valor predictivo negativo. En términos generales, los análisis automatizados se han estudiado en más profundidad que los análisis en el punto de atención de pacientes y, por el momento, parecen ser la opción preferible1,3,4,6–8,10–13,29,30,33,35,36.
Dado que estas técnicas continúan mejorando y los parámetros de rendimiento dependen tanto del propio análisis como del hospital, es importante volver a evaluar estas 2 opciones una vez que se disponga en el punto de atención a pacientes de análisis ultrasensibles que hayan sido ampliamente validados42. Recientemente, se ha demostrado que el primer análisis de hs-cTn en el punto de atención a pacientes tiene los mismos parámetros de rendimiento que las determinaciones realizadas en el laboratorio central43,44.
Numerosas cardiopatías distintas del infarto de miocardio también producen daño cardiomiocitario y, consecuentemente, elevaciones de la troponina cardiaca (tabla 4). Las más frecuentes son las taquiarritmias, la IC, las emergencias hipertensivas, las enfermedades críticas, la miocarditis, el síndrome de tako-tsubo y las valvulopatías cardiacas. En pacientes ancianos con insuficiencia renal, la elevación de troponina cardiaca no debe atribuirse en primer lugar a un aclaramiento disminuido y considerarse inofensiva, ya que algunas cardiopatías, como los síndromes coronarios crónicos (SCC) o la cardiopatía hipertensiva, son las causas más frecuentes de la elevación de troponina en este contexto35,45. Otras entidades potencialmente mortales que se presentan con dolor torácico, como la disección aórtica y la embolia pulmonar, también pueden producir el aumento de las concentraciones de troponina cardiaca y se deben considerar en el diagnóstico diferencial (tabla 4).
3.3.2.2Otros biomarcadoresEntre los múltiples biomarcadores evaluados para el diagnóstico de los SCASEST, solo la CK-MB, la proteína C de unión a la miosina46 y la copeptina47–58 parecen tener importancia clínica en contextos específicos cuando se usan en combinación con troponina cardiaca T/I. Comparada con la troponina cardiaca, la CK-MB disminuye más rápidamente tras el infarto de miocardio y puede ser más útil para determinar el momento en que se produjo daño miocárdico y detectar el reinfarto precoz1. Sin embargo, es importante subrayar que se conoce muy poco sobre cómo diagnosticar el reinfarto precoz. Está recomendado realizar una evaluación clínica completa que incluya las características del dolor torácico (las mismas que en el evento inicial), el ECG de 12 derivaciones para detectar nuevos cambios del segmento ST o la inversión de las ondas T y la determinación seriada de troponina cardiaca T/I y CK-MB. La proteína C de unión a la miosina es más abundante que la troponina cardiaca y, por lo tanto, puede ser útil como alternativa o combinada con troponina cardiaca46. La determinación de copeptina (extremo terminal carboxílico de la prohormona vasopresina) permite cuantificar el nivel de estrés endógeno en distintas afecciones, incluido el infarto de miocardio. Dado que el nivel de estrés endógeno suele estar elevado en la mayoría de los pacientes al inicio del infarto de miocardio, el valor añadido de la copeptina, comparada con la determinación convencional de troponina cardiaca (menos sensible) es considerable49,50,53. Por lo tanto, se recomienda el uso sistemático de la determinación de copeptina como biomarcador adicional para descartar rápidamente el diagnóstico de infarto de miocardio, en el caso cada vez menos frecuente de que no sea posible la determinación de hs-cTn. La copeptina no tiene un valor añadido relevante en los hospitales que dispongan de protocolos rápidos validados y basados en la hs-cTn para el diagnóstico precoz del infarto de miocardio47,48,51,52,54–58. Otras pruebas de laboratorio ampliamente disponibles son la tasa de filtrado glomerular estimada (TFGe), la glucosa y el BNP, que proporcionan información pronóstica adicional y pueden ayudar a estratificar el riesgo59. La determinación del dímero D está recomendada en la atención ambulatoria o en el servicio de urgencias para los pacientes con una probabilidad clínica baja o intermedia, o cuando la embolia pulmonar sea poco probable, para evitar la realización de pruebas de imagen innecesarias y la exposición a radiación. El dímero D es un elemento diagnóstico clave cuando se sospecha de embolia pulmonar32,60.
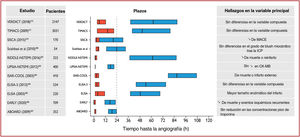
3.3.3Algoritmos rápidos de confirmación o exclusiónDebido a sus altas sensibilidad y precisión diagnóstica para la detección del infarto de miocardio durante su presentación, las determinaciones de hs-cTn permiten acortar el tiempo hasta la realización de la segunda determinación de troponina cardiaca. Esto reduce sustancialmente el retraso en el diagnóstico, lo cual se traduce en estancias más cortas en urgencias y menos costes11,56,61–66. Se recomienda usar el algoritmo de 0h/1h (la mejor opción, toma de muestras de sangre a las 0h y 1h) o el algoritmo de 0h/2h (segunda opción, toma de muestras de sangre a las 0h y 2h) (figura 3). Estos algoritmos fueron diseñados y validados en grandes estudios diagnósticos en los que se empleó la adjudicación central del diagnóstico final para todas las determinaciones de hs-cTn33,35,36,39,67–69.
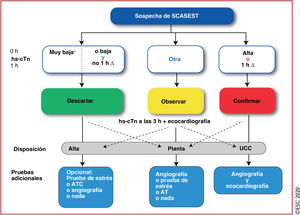
Algoritmo de 0h/1h para descartar o confirmar el diagnóstico mediante la determinación de hs-cTn para pacientes con sospecha de SCASEST atendidos en el servicio de urgencias. Las 0h y 1h se refieren al tiempo transcurrido desde la obtención de la primera muestra de sangre. Si la concentración de hs-cTn es muy baja, se puede descartar inmediatamente el IAMSEST. También se puede descartar este diagnóstico si los valores basales son bajos y no aumentan significativamente durante la primera hora (no 1h Δ). Los pacientes tienen una probabilidad alta de IAMSEST si la concentración basal de hs-cTn es al menos moderadamente alta o aparece un claro aumento durante la primera hora (1h Δ)1,6–8,10–13,29–31,33. Los valores de corte son específicos para cada tipo de prueba (véase la tabla 3) y se derivan de criterios predefinidos de sensibilidad y especificidad para el IAMSEST. ATC: angiotomografía computarizada; hs-cTn: troponina cardiaca de alta sensibilidad; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; SCASEST: síndrome coronario agudo sin elevación del segmento ST; UCC: unidad de cuidados coronarios.
*Solo aplicable en caso de dolor torácico>3h. Escuche online la audioguía de esta figura.
Se seleccionaron los valores de corte más adecuados para descartar o confirmar el diagnóstico con sensibilidad y valor predictivo negativo (VPN) mínimos del 99% y con un valor predictivo positivo mínimo del 70%. Estos algoritmos se desarrollaron en grandes cohortes de derivación y después se validaron en cohortes de validación independientes. Como alternativa, se puede considerar el algoritmo de 0h/3h de la ESC1,70. Sin embargo, recientemente 3 grandes estudios diagnósticos mostraron que este algoritmo es menos eficaz y seguro que los protocolos más rápidos que usan concentraciones más bajas para descartar el diagnóstico, como el algoritmo de 0h/1h de la ESC71–73. Además, el muy alto grado de seguridad y el alto grado de eficacia del algoritmo de 0h/1h de la ESC se confirmaron recientemente en varios estudios de implementación llevados a cabo en la práctica cínica real y en un ensayo clínico aleatorizado66,73,74.
Los algoritmos de 0h/1h y 0h/2h se basan en 2 conceptos: primero, la hs-cTn es una variable continua y la probabilidad de infarto de miocardio aumenta cuanto mayores sean las concentraciones de hs-cTn35,36,39,68,69,75,76, y segundo, los cambios absolutos de las concentraciones en la primera o la segunda hora (1h, 2h) pueden emplearse como sustitutos de los cambios absolutos durante 3 o 6h y proporcionan un valor diagnóstico añadido a la determinación inicial de troponina33,35,36,39,68,69,75,76. Los valores de corte para los algoritmos de 0h/1h y 0h/2h son específicos para cada prueba (tabla 5)33,35,36,39,68,69,75,76. El valor predictivo negativo para el infarto de miocardio en pacientes en los que se descartó el diagnóstico (asignados al grupo «descartar») superó el 99% en varias cohortes de validación35,36,39,68,69,77. El uso combinado de los algoritmos de 0h/1h y 0h/2h con los hallazgos clínicos y electrocardiográficos permite identificar a los pacientes candidatos a alta precoz y a tratamiento ambulatorio. Dependiendo de la evaluación clínica, podría estar indicado realizar pruebas electivas de imagen, invasivas o no invasivas, incluso después de descartar el infarto de miocardio. La coronariografía invasiva es la mejor opción para los pacientes con una probabilidad clínica alta de angina inestable, incluso después de que se descarte el IAMSEST, mientras que la prueba de estrés con imagen o la angiotomografía computarizada (ATC) son la mejor opción para los pacientes con una probabilidad baja-intermedia de angina inestable. No es necesario realizar pruebas en pacientes con un diagnóstico alternativo claro.
El valor predictivo positivo para el infarto de miocardio en los pacientes que cumplían los criterios de confirmación fue aproximadamente del 70-75%35,36,39,69. La mayoría de los pacientes que cumplían estos criterios pero cuyo diagnóstico fue diferente del infarto de miocardio sufrían enfermedades que normalmente requieren una coronariografía o una resonancia magnética cardiaca (RMC) para un diagnóstico más preciso, como el síndrome de tako-tsubo y la miocarditis35,36,39,68,69,75,76. Por lo tanto, la gran mayoría de los pacientes seleccionados para el grupo de confirmación del diagnóstico son candidatos a coronariografía temprana e ingreso en la unidad de cuidados coronarios.
Estos algoritmos deben integrarse siempre con una evaluación clínica completa y el ECG de 12 derivaciones, y en caso de dolor torácico persistente o recurrente, es imprescindible tomar nuevas muestras de sangre.
Este concepto se aplica también al algoritmo de 0h/2h. Los valores de corte son específicos para cada prueba y se resumen en la tabla 5. Se están desarrollando otros valores de corte para otras determinaciones de hs-cTn.
3.3.4ObservaciónLos pacientes que no cumplen los criterios de descarte o confirmación del diagnóstico deben permanecer en observación. Estos pacientes representan un grupo heterogéneo que normalmente requiere una tercera determinación de troponina cardiaca a las 3h y ecocardiografía, como pasos a seguir85. Se debe considerar la angiografía invasiva para los pacientes con sospecha clínica alta de SCASEST (p. ej., un aumento significativo de troponina cardiaca desde la presentación hasta 3h), mientras que en los pacientes con una probabilidad baja-intermedia de este diagnóstico según el juicio clínico, se debe considerar la imagen no invasiva mediante ATC o prueba de estrés (ecocardiografía de estrés, tomografía por emisión de positrones [PET], tomografía computarizada por emisión monofotónica [SPECT] o RMC para detectar características del SCA, como edema, realce tardío de gadolinio, defectos de perfusión, etc.) tras el traslado del paciente del servicio de urgencias a la planta. No están indicadas pruebas adicionales cuando se haya identificado un diagnóstico alternativo, como la respuesta de frecuencia ventricular rápida a fibrilación auricular o una emergencia hipertensiva.
3.3.4.1Advertencias sobre el uso de algoritmos rápidosCuando se emplea cualquier algoritmo, deben tenerse en cuenta los siguientes aspectos:
- •
Los algoritmos solo se deben usar en combinación con toda la información clínica disponible, incluida la evaluación de las características del dolor torácico y el ECG.
- •
Los algoritmos de 0h/1h y 0h/2h de la ESC se deben aplicar a todos los pacientes, independientemente del momento de presentación del dolor torácico. La seguridad (cuantificada por el VPN) y la sensibilidad son muy altas (> 99%), incluso para el subgrupo de pacientes que llegan muy pronto al hospital (< 2h)69. Sin embargo, debido a la dependencia temporal de la liberación de troponina y el moderado número de pacientes que se presentan menos de 1h después de la aparición del dolor torácico en estudios anteriores, se debe considerar la determinación adicional de troponina cardiaca a las 3h para los pacientes que se presentan en menos de 1h y son seleccionados para descartar el diagnóstico.
- •
Dado que se han descrito elevaciones tardías de troponinas cardiacas en ∼1% de los pacientes, se deben realizar determinaciones seriadas de troponina si la sospecha clínica sigue siendo alta o cuando el paciente sufre dolor torácico recurrente35,36,39,68,69,75,76,86.
En pacientes que se presentan con sospecha de SCASEST, independientemente de la presencia o la ausencia de IM, cuatro variables clínicas afectan a las concentraciones de hs-cTn35,36,39,69,79,87–93:
- •
La edad (en gran medida como sustituta de la cardiopatía preexistente).
- •
La disfunción renal (en gran medida como sustituta de la cardiopatía preexistente).
- •
El tiempo transcurrido desde la aparición del dolor torácico.
- •
El sexo.
La edad (las diferencias de la concentración entre individuos sanos muy jóvenes e individuos sanos muy mayores son de hasta el 300%), la disfunción renal (las diferencias de la concentración entre pacientes sin otras afecciones con una TFGe muy alta frente a una TFGe muy baja son de hasta el 300%) y la aparición de dolor torácico (> 300%) tienen un efecto sustancial, mientras que el sexo tiene un efecto discreto (diferencias de ∼40%)11,35,36,39,69,79,88–93. Hasta que se disponga de herramientas tecnológicas que permitan la incorporación de estas 4 variables, el empleo de valores de corte uniformes para las concentraciones de troponina cardiaca debe seguir siendo el procedimiento estándar para el diagnóstico temprano del infarto de miocardio35,36,39,68,69,75,76.
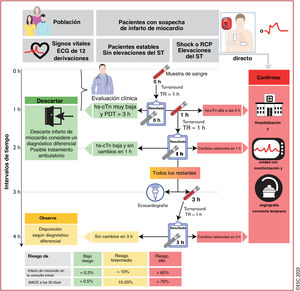
3.3.4.3Guía práctica para la implementación del algoritmo 0h/1h de la Sociedad Europea de CardiologíaPara maximizar la seguridad y la viabilidad del proceso, el personal de enfermería debe obtener las muestras de sangre para la determinación de hs-cTn a las 0h y 1h sin tener en cuenta otros aspectos clínicos ni resultados pendientes. Esto implica la determinación innecesaria de troponina cardiaca en alrededor del 10-15% de los pacientes con concentraciones muy bajas a las 0h y presentación del dolor torácico>3h, pero facilita en gran medida el proceso y aumenta la seguridad de los pacientes. Documentar la hora de la toma de la muestra de sangre de las 0h permite determinar con exactitud (± 10min) el intervalo de tiempo hasta la segunda toma de sangre después de 1h. Cuando no sea posible tomar la muestra de sangre después de 1h, se debe tomar la muestra a las 2h y aplicar el algoritmo de 0h/2h de la ESC.
3.3.4.4Evitar confusiones: la hora de la toma de decisiones=la hora de la extracción de la muestra de sangre+el tiempo de procesado de la muestraEl uso del algoritmo de 0h/1h de la ESC no tiene en cuenta el tiempo requerido por el centro para la obtención de los resultados. Las 0h y 1h se refieren al momento de obtención de las muestras de sangre (figura 1).
Algoritmo de 0h/1h de la ESC: momento en que se obtienen las muestras de sangre y se toman decisiones clínicas. Las 0h y 1h se refieren al momento en que se toma la muestra de sangre. El «tiempo requerido» es el periodo de tiempo desde la obtención de la muestra de sangre hasta que el médico recibe los resultados del análisis. Normalmente se requiere aproximadamente 1h si se emplea una plataforma automatizada. Este intervalo de tiempo incluye: el traslado de la muestra hasta el laboratorio central, escaneado de la probeta, centrifugado, colocación de plasma en la plataforma automatizada, el análisis en sí mismo y la comunicación del resultado a través de la tecnología informática del hospital o en la historia médica electrónica del paciente. El tiempo requerido es idéntico tanto para un análisis de hs-cTn como uno convencional, siempre que se use una plataforma automatizada. La suma del tiempo requerido más la hora en que se toma la muestra de sangre determina el tiempo mínimo necesario para tomar una decisión clínica basada en la concentración de hs-cTn. Por ejemplo, si la muestra se obtiene en el punto 0h, el tiempo hasta la decisión clínica es de 1h si el tiempo requerido del centro es de 1h; si la muestra se obtiene en el punto 1h, el informe de los resultados se recibe a las 2h (1h+1h) si el tiempo requerido del centro es de 1h. Los cambios relevantes de las concentraciones en 1h dependen del tipo de análisis (véase la tabla 3). ECG: electrocardiograma; hs-cTn: troponina cardiaca de alta sensibilidad; MACE: eventos cardiacos adversos graves; PDT: presentación de dolor torácico; RCP: reanimación cardiopulmonar; TR: tiempo requerido. Escuche online la audioguía de esta figura.
Por lo tanto, los beneficios clínicos y económicos del algoritmo de 0h/1h de la ESC frente al algoritmo de 0h/3h u otros algoritmos en los que la segunda muestra de sangre se toma después de 1h son independientes del tiempo requerido por el centro para la obtención de los resultados61.
3.3.5Imagen no invasiva3.3.5.1Evaluación funcionalLos servicios de urgencias y unidades de dolor torácico deben disponer siempre de ecocardiografía transtorácica, que médicos cualificados deben realizar e interpretar en todos los pacientes hospitalizados por SCASEST. Esta modalidad de imagen permite identificar alteraciones que indican isquemia miocárdica o necrosis (p. ej., hipocinesia segmentaria o acinesia). En caso de que no haya alteraciones significativas de la movilidad de la pared, la detección de una disminución de la perfusión miocárdica por ecocardiografía de contraste o una reducción de la función regional mediante imágenes de strain y strain rate pueden mejorar el valor diagnóstico y pronóstico de la ecocardiografía convencional94–96. Además, la ecocardiografía puede ayudar a detectar otras enfermedades relacionadas con el dolor torácico, como la disección aórtica aguda, el derrame pericárdico, la estenosis valvular aórtica, la miocardiopatía hipertrófica, el prolapso de la válvula mitral o la dilatación del ventrículo derecho, compatible con embolia pulmonar aguda. Asimismo, la ecocardiografía es el instrumento diagnóstico de elección para los pacientes con inestabilidad hemodinámica de origen probablemente cardiaco96,97. La evaluación de la función sistólica del VI, que se realizará como muy tarde antes del alta hospitalaria, es importante para estimar el pronóstico; la ecocardiografía y también otras modalidades de imagen pueden proporcionar esta información.
A los pacientes sin cambios isquémicos en el ECG de 12 derivaciones y concentraciones normales de hs-cTn que no tienen dolor torácico durante varias horas, se les puede realizar una prueba de imagen con estrés durante el ingreso o poco después del alta. La prueba de imagen con estrés es preferible al ECG de esfuerzo por su mayor precisión diagnóstica98. Varios estudios han mostrado que la ecocardiografía de esfuerzo o de estrés (con dobutamina o dipiridamol) con resultados normales tiene un alto VPN de isquemia y se asocia con una excelente evolución de los pacientes99,100. Asimismo, se ha demostrado que la ecocardiografía de estrés tiene mayor valor pronóstico que el ECG de esfuerzo101. Si la ventana acústica no permite evaluar las alteraciones regionales de la movilidad de la pared, se recomienda el contraste ecocardiográfico para mejorar la precisión del estudio y facilitar la detección de isquemia98,101–103.
La RMC permite evaluar al mismo tiempo la perfusión y las alteraciones de la movilidad de la pared, y los pacientes con dolor torácico agudo y una RMC de estrés normal tienen un excelente pronóstico a corto y medio plazo104. La RMC también permite identificar tejido cicatricial (mediante realce tardío de gadolinio) y diferenciarlo de un infarto reciente (mediante imágenes potenciadas en T2 para delinear el edema miocárdico)98. Además, la RMC facilita el diagnóstico diferencial entre el infarto y la miocarditis o el síndrome de tako-tsubo, entre otros98. En un reciente estudio aleatorizado sobre pacientes con diagnóstico incierto de IAMSEST, el empleo inicial de imagen por RMC redujo la necesidad de angiografía invasiva y proporcionó un diagnóstico alternativo en un porcentaje de pacientes relevante105.
Del mismo modo, se ha demostrado que la SPECT es útil para la estratificación del riesgo de los pacientes con dolor torácico agudo indicativo de SCA. La gammagrafía miocárdica en reposo, mediante la detección de defectos fijos de perfusión que indican necrosis miocárdica, puede ser útil en la clasificación inicial de los pacientes con dolor torácico sin cambios electrocardiográficos ni troponinas cardiacas elevadas98. La combinación de imagen en estrés/reposo o la imagen de estrés sola aumentan la capacidad de evaluación de la isquemia; el resultado normal de estas pruebas se asocia con una excelente evolución del paciente106,107. Las modalidades de imagen en estrés/reposo no suelen estar disponibles en servicios de atención las 24h y algunas de estas pruebas (p. ej., SPECT) se asocian con una importante exposición a la radiación.
3.3.5.2Evaluación anatómicaLa ATC permite la visualización de las arterias coronarias y un resultado normal excluye una EC. La ATC tienen un alto VPN para excluir el SCA (al descartar EC) y un resultado excelente para los pacientes que se presentan en urgencias con una probabilidad pretest baja o intermedia de SCA y una ATC normal108. Siete ensayos clínicos aleatorizados han investigado la ATC frente a la atención médica habitual para el triaje de pacientes con riesgo bajo-intermedio que llegan al servicio de urgencias con dolor torácico agudo sin signos de isquemia en el ECG y troponinas cardiacas normales109. En la mayoría de los estudios, solo se usaron determinaciones de troponina convencionales y menos sensibles110–113. En el seguimiento a 1-6 meses no se observó ninguna muerte y un metanálisis obtuvo resultados comparables entre las 2 estrategias (sin diferencias en la incidencia de infarto de miocardio, las consultas en urgencias después del alta o las rehospitalizaciones), y además mostró que la ATC se asoció con una reducción de los costes del servicio de urgencias y de la duración de la hospitalización114. Ninguno de estos estudios empleó la determinación de troponina cardiaca de alta sensibilidad, que también reduce la duración de la hospitalización. En un estudio aleatorizado en el que la atención estándar incluía la determinación de hs-cTn, la ATC no fue capaz de mejorar el flujo de pacientes115. También se observó que la ATC se asoció con un aumento de angiografías invasivas114. Por el contrario, en un reciente estudio aleatorizado sobre el diagnóstico del IAMSEST, el empleo inicial de ATC redujo la necesidad de angiografía invasiva105. Se observaron resultados similares en un subanálisis de estudio VERDICT, en el que la ATC inicial en pacientes con SCASEST tuvo un VPN del 90,9%116. Sin embargo, un grupo relativamente numeroso de pacientes fue excluido del análisis por razones específicas y un VPN del 90,9% no se considera completamente perfecto116. Por ello, la ATC se puede usar para descartar EC y es menos útil en pacientes con EC diagnosticada. Otros factores que limitan el uso de ATC son la presencia de calcificación extensa (puntuación de calcio alta) y la frecuencia cardiaca elevada o irregular; además, esta técnica no está disponible actualmente las 24h. Por último, no se ha validado el uso de la ATC en el contexto agudo de pacientes con stents o CABG previa. Es importante señalar que la imagen de tomografía computarizada (TC) permite excluir eficientemente otras causas de dolor torácico que, si no se tratan, se asocian con una mortalidad alta, como la embolia pulmonar y la disección aórtica.
3.4Diagnóstico diferencialEntre pacientes no seleccionados que llegan al servicio de urgencias con dolor torácico agudo, cabe esperar las siguientes prevalencias: IAMCEST, 5-10%; IAMSEST, 15-20%; angina inestable, 10%; otras cardiopatías, 15% y enfermedades no cardiacas, 50%35,36,39,69,79,87–93. Algunas entidades cardiacas y no cardiacas se pueden parecer al SCASEST (tabla 6).
Las entidades que siempre se debe considerar en el diagnóstico diferencial del SCASEST, porque son potencialmente mortales pero también tratables, son la disección aórtica, la embolia pulmonar y el neumotórax por tensión. Debe realizarse urgentemente una ecocardiografía a todos los pacientes con inestabilidad hemodinámica de posible origen cardiovascular. Recientemente, se ha observado más frecuentemente el síndrome de tako-tsubo como diagnóstico diferencial, que requiere angiografía coronaria para descartar el SCA117.
Se recomienda realizar una radiografía de tórax a todos los pacientes con probabilidad baja de SCASEST para detectar neumonía, neumotórax, fractura de costillas u otros trastornos torácicos. El ictus puede acompañarse de cambios electrocardiográficos, alteraciones de la movilidad de la pared miocárdica y daño cardiomiocitario (elevación de las concentraciones de troponina cardiaca). En la mayoría de los pacientes que llegan a urgencias con dolor torácico agudo, este no tiene una causa cardiaca35,36,39,69,79,87–93. En muchos casos, el dolor es osteomuscular y, por lo tanto, benigno y autolimitado y no requiere hospitalización. Las características del dolor torácico pueden ayudar en cierta medida a la pronta identificación de estos pacientes.
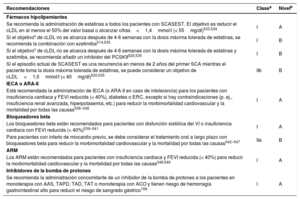
Recomendaciones sobre diagnóstico, estratificación del riesgo, técnicas de imagen y monitorización del ritmo para pacientes con sospecha de síndrome coronario agudo sin elevación del segmento ST
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Diagnóstico y estratificación del riesgo | ||
| Se recomienda que el diagnóstico y la estratificación inicial del riesgo a corto plazo se base en la historia clínica, los síntomas, los signos vitales, otros hallazgos físicos, ECG y resultados de laboratorio, incluida la hs-cTn3 | I | B |
| Se recomienda determinar las troponinas cardiacas con pruebas de alta sensibilidad inmediatamente después del ingreso y obtener los resultados en los primeros 60min tras la obtención de la muestra de sangre3,10–13,29–31,34 | I | B |
| Se recomienda realizar un ECG de 12 derivaciones durante los primeros 10min del primer contacto médico; el ECG debe ser interpretado inmediatamente por un médico con experiencia21 | I | B |
| Se recomienda realizar un ECG de 12 derivaciones adicional en caso de síntomas recurrentes o diagnóstico incierto | I | C |
| Se recomienda usar el algoritmo de 0h/1h de la ESC con la obtención de muestras de sangre a las 0h y 1h, si está disponible la determinación de hs-cTn con un algoritmo validado de 0h/1 h300,33,35,36,39,68,69,75,76 | I | B |
| Está recomendado realizar una prueba adicional después de 3h si las primeras 2 determinaciones de troponina cardiaca del algoritmo 0h/1h no son concluyentes y la condición clínica sigue siendo indicativa de SCA85 | I | B |
| Como alternativa al algoritmo de 0h/1h de la ESC, está recomendado el algoritmo de 0h/2h con obtención de muestras de sangre a las 0h y 2h, si está disponible la determinación de hs-cTn con un algoritmo de 0h/2h validado33,39,75,78,84 | I | B |
| Está recomendado usar derivaciones electrocardiográficas adicionales (V3R, V4R, V7-V9) si se sospecha de isquemia y las derivaciones estándar no son concluyentes | I | C |
| Como alternativa al algoritmo de 0h/1h de la ESC, se debe considerar un protocolo rápido de exclusión o confirmación con obtención de muestras de sangre a las 0h y 3h si está disponible la determinación de troponina cardiaca de alta sensibilidad (o convencional) con un algoritmo de 0h/3h validado70–73 | IIa | B |
| Se debe considerar el uso de escalas de riesgo establecidas para la estimación del pronóstico | IIa | C |
| No se recomienda la determinación sistemática de biomarcadores adicionales, como PUAG-C o copeptina, además de hs-cTn, para el diagnóstico inicial47,48,51,52,54,118 | III | B |
| Técnicas de imagen | ||
| La ecocardiografía, realizada inmediatamente después del ECG de 12 derivaciones por médicos entrenados, está recomendada para pacientes con parada cardiaca o inestabilidad hemodinámica de origen probablemente cardiovascular | I | C |
| Para los pacientes sin dolor torácico recurrente, con hallazgos ECG normales y valores normales de troponina (preferiblemente de alta sensibilidad), pero en los que todavía se sospecha SCA, se recomienda una prueba de estrés no invasiva (preferiblemente con imagen) para la isquemia inducible o ATC, antes de decidir sobre una estrategia invasiva91,92,98,101,105–108 | I | B |
| La ecocardiografía está recomendada para evaluar la función regional y global del VI y para confirmar o descartar un diagnóstico diferencialc | I | C |
| Está recomendada la ATC como alternativa a la ACI para descartar el SCA cuando existe una probabilidad baja-intermedia de EC y cuando la troponina cardiaca o el ECG son normales o no concluyentes105,108,110–114 | I | A |
| Monitorización | ||
| Está recomendada la monitorización continua del ritmo hasta que se establezca o se descarte el diagnóstico de IAMSEST | I | C |
| Está recomendado ingresar a los pacientes con IAMSEST en una unidad con monitorización | I | C |
| Está recomendada la monitorización del ritmo hasta 24h o ICP (lo que suceda antes) para los pacientes con IAMSEST y riesgo bajo de arritmias cardiacasd | I | C |
| Está recomendada la monitorización del ritmo durante más de 24h de los pacientes con IAMSEST y riesgo aumentado de arritmias cardiacase | I | C |
| En la angina inestable y en ausencia de signos o síntomas de isquemia, se puede considerar la monitorización del ritmo de algunos pacientes seleccionados (p. ej., con sospecha de espasmo coronario o síntomas asociados indicativos de eventos arrítmicos) | IIb | C |
0h: hora de la primera muestra de sangre; 1h, 2h, 3h: 1, 2 o 3h después de la primera muestra de sangre; ACI: angiografía coronaria invasiva; ATC: angiotomografía computarizada; EC: enfermedad coronaria; ECG: electrocardiograma; ESC: Sociedad Europea de Cardiología; FEVI: fracción de eyección del ventrículo izquierdo; GRACE: Global Registry of Acute Coronary Events; Hs-cTn: troponina cardiaca de alta sensibilidad; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; PUAG-C: proteína de unión a ácidos grasos de tipo cardiaco; SCA: síndrome coronario agudo; VI: ventrículo izquierdo.
Si no se cumple ninguno de los siguientes criterios: inestabilidad hemodinámica, arritmias importantes, FEVI<40%, reperfusión fallida, estenosis coronarias críticas adicionales en vasos importantes, complicaciones relacionadas con la revascularización percutánea o puntuación GRACE>140, si se ha evaluado.
Consulte el material suplementario.
4.2BiomarcadoresLa determinación inicial de troponina cardiaca, además de su utilidad diagnóstica, aporta información pronóstica adicional a las variables clínicas y electrocardiográficas en términos de mortalidad a corto y largo plazo. Mientras que la hs-cTn T y la hs-cTn I tienen una precisión diagnóstica comparable, la hs-cTn T tiene mayor precisión pronóstica38,119. Las determinaciones seriadas son útiles para detectar las concentraciones pico y estratificar el riesgo de los pacientes con infarto de miocardio diagnosticado. Cuanto más elevadas son las concentraciones de hs-cTn, mayor es el riesgo de muerte12,76,120. No obstante, la evidencia disponible no permite establecer el momento óptimo para realizar las determinaciones seriadas de hs-cTn. Se debe determinar la concentración de creatinina sérica y la TFGe porque afectan al pronóstico y son elementos clave del método Global Registry of Acute Coronary Events (GRACE) para la estimación del riesgo (véase la sección 4.3). Igualmente, los péptidos natriuréticos (BNP y NT pro-BNP) proporcionan información pronóstica adicional a la troponina cardiaca sobre el riesgo de muerte, IC aguda y desarrollo de FA121. Además, identificar la presencia y cuantificar el grado de estrés hemodinámico e IC mediante la determinación de BNP o NT pro-BNP en pacientes con enfermedad coronaria multivaso o en el tronco común izquierdo sin SCASEST puede ayudar al equipo cardiológico a seleccionar el tratamiento de revascularización más adecuado (ICP o CABG)122-124. Esta estrategia tiene que confirmarse en ECA y, hasta la fecha, no se ha probado en pacientes con SCASEST. Los péptidos natriuréticos proporcionan información pronóstica adicional a la troponina cardiaca121,125,126. Otros biomarcadores, como la proteína C reactiva de alta sensibilidad, la región media de proadrenomedulina, el factor 15 de diferenciación de crecimiento (GDF-15), la proteína de unión a ácidos grasos de tipo cardiaco (h-FABP) y la copeptina, también pueden tener algún valor pronóstico50,118,127–132. Sin embargo, no se ha demostrado que determinar estos biomarcadores mejore el tratamiento de los pacientes y su valor añadido a la estimación del riesgo mediante la escala GRACE y la determinación de BNP/NT pro-BNP parece ser marginal. Por el momento no se puede recomendar el uso sistemático de estos biomarcadores para la evaluación pronóstica.
4.3Escalas clínicas para la evaluación del riesgoConsulte el material adicional. Se han desarrollado distintos modelos pronósticos cuyo objetivo es estimar el riesgo de mortalidad por todas las causas o el riesgo combinado de mortalidad por todas las causas e infarto de miocardio. Con base en estos modelos, se han formulado escalas clínicas de riesgo y, entre ellas, la escala GRACE tiene el mayor poder de discriminación133–135. Es importante señalar que el método GRACE tiene distintas escalas de riesgo y cada una se refiere a un grupo de pacientes distinto y predice distintos resultados136–139. Las escalas de riesgo GRACE se han validado externamente mediante datos observacionales140. La sección 4.3, la tabla 1 y la figura 3 del material adicional proporcionan información detallada sobre las escalas del método GRACE. El nomograma para calcular la escala GRACE original, que estima el riesgo de muerte durante la hospitalización, se muestra en la figura 3 del material adicional. La calculadora de riesgo para otras escalas GRACE está disponible en: https://www.outcomes-umassmed.org/risk_models_grace_orig.aspx (GRACE 1.0) y www.outcomes-umassmed.org/grace/acs_risk2/index.html (GRACE 2.0).
Dado que la escala GRACE predice variables clínicas, es posible clasificar a los pacientes según el riesgo estimado de eventos isquémicos en el futuro. Se ha demostrado que la evaluación del riesgo basada en la escala GRACE es superior a la evaluación (subjetiva) del médico para la mortalidad y el infarto de miocardio141,142. Además, está ampliamente establecido que la prestación de atención médica basada en las GPC tiene una relación inversa con el riesgo estimado de los pacientes con SCASEST143, la denominada «paradoja del tratamiento del riesgo»144,145. La atención basada en las guías se asocia con una supervivencia proporcionalmente mayor entre los pacientes con un riesgo basal más alto, por lo que la evaluación objetiva del riesgo puede ayudar a identificar a los pacientes con SCASEST que se beneficiarían de intervenciones terapéuticas determinadas por el riesgo144,145. Los estudios AGRIS146 y UKGRIS (en desarrollo)147 investigan por primera vez de forma aleatorizada el impacto de la utilización de la escala de riesgo GRACE en los resultados de los pacientes con SCASEST. El estudio AGRIS, diseñado con aleatorización por grupos, no logró demostrar ningún valor añadido, particularmente para los tratamientos basados en GPC y el empleo sistemático de la escala de riesgo GRACE. Este hallazgo se puede explicar en gran medida por un rendimiento mejor de lo previsto de los hospitales de control. Debido a que ha mejorado la mortalidad temprana de los SCASEST148, la predicción del riesgo a largo plazo es importante. Las muertes en la fase temprana después de un SCASEST se suelen atribuir a eventos isquémicos o trombóticos, mientras que posteriormente es más probable que se asocien con la progresión de la ateroesclerosis y causas no cardiovasculares149–152.
4.4Evaluación del riesgo hemorrágicoLas complicaciones hemorrágicas mayores se asocian con un aumento de la mortalidad en los SCASEST157. Para estimar el riesgo hemorrágico en este contexto se desarrollaron las escalas CRUSADE de las GPC de ACC/AHA (https://www.mdcalc.com/crusade-score-post-mibleeding-risk) y ACUITY. En términos generales, ambas escalas tienen un valor predictivo razonable para el sangrado mayor en pacientes con SCA que se someten a una angiografía coronaria, aunque la escala CRUSADE tiene mayor poder de discriminación155–157. Los cambios introducidos en cardiología intervencionista, como el acceso radial para la angiografía y la ICP, y en el tratamiento antitrombótico podrían modificar el valor predictivo de las escalas de riesgo. Además, en los pacientes que reciben tratamiento farmacológico o anticoagulantes orales (ACO), el valor predictivo de estas escalas no está establecido. Dadas estas limitaciones, se puede considerar la escala de riesgo CRUSADE para cuantificar el riesgo hemorrágico de los pacientes sometidos a coronariografía.
Una alternativa a estas escalas puede ser la evaluación del riesgo hemorrágico según la clasificación ARC-HBR (tabla 7)158. Esta definición de consenso sobre los pacientes con riesgo hemorrágico alto se desarrolló recientemente para dar coherencia a los ensayos clínicos que evalúan la seguridad y la eficacia de dispositivos y regímenes de tratamiento para pacientes sometidos a ICP158. La propuesta ARC-HBR propone un enfoque pragmático e integra los datos de estudios recientes sobre la duración y la intensidad del tratamiento antiagregante plaquetario doble (TAPD) (tabla 7) para pacientes con riesgo alto de sangrado, que previamente se excluían de los estudios159–161. Sin embargo, la evaluación del riesgo hemorrágico según los criterios ARC-HBR puede ser compleja en la práctica clínica, ya que algunos de estos criterios son muy detallados y, por el momento, esta clasificación no ha sido validada.
Recomendaciones sobre la determinación de biomarcadores para la estimación del pronóstico
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Aparte de su utilidad diagnóstica, las determinaciones seriadas de hs-cTn están recomendadas para la estimación del pronóstico12,13,119,120 | I | B |
| Se debe considerar la determinación de concentraciones plasmáticas de BNP o NT-proBNP para obtener información pronóstica121,125,126 | IIa | B |
| No está recomendada la determinación de biomarcadores adicionales, como la fracción media del propéptido natriurético de tipo A, proteína C reactiva del alta sensibilidad, fracción media de la proadrenomedulina, GDF-15, copeptina y PUAG-C, para la evaluación sistemática del riesgo y la estimación del pronóstico50,127,129 | III | B |
| Escala para la estratificación del riesgo en los SCASEST | ||
| Se debe considerar el uso de modelos de riesgo basados en la escala GRACE para la estimación del pronóstico137–139 | IIa | B |
| Se puede considerar el uso de escalas de riesgo diseñadas para evaluar los beneficios y los riesgos de diferentes duraciones del TAPD153,154 | IIb | A |
| Se puede considerar el uso de escalas para estimar el riesgo hemorrágico de pacientes que se someten a angiografía coronaria155,156 | IIb | B |
BNP: péptido natriurético cerebral; GDF-15: factor de diferenciación de crecimiento 15; GRACE: Global Registry of Acute Coronary Events; Hs-cTn: troponina cardiaca de alta sensibilidad; NT-proBNP: fracción N-terminal del propéptido natriurético cerebral; PUAG-C: proteína de unión a ácidos grasos de tipo cardiaco; SCASEST: síndrome coronario agudo sin elevación del segmento ST; TAPD: tratamiento antiagregante plaquetario doble.
Los eventos hemorrágicos mayores afectan al pronóstico del mismo modo que las complicaciones isquémicas espontáneas163,164. Como siempre que se prescribe un régimen de tratamiento antitrombótico es necesario buscar un equilibrio entre el riesgo isquémico y el riesgo hemorrágico, podrían ser útiles escalas para ajustar la duración y la intensidad del tratamiento antitrombótico de forma que se optimice la protección contra eventos isquémicos y se minimice el riesgo hemorrágico de cada paciente. Se han desarrollado escalas de riesgo específicas para los pacientes que reciben TAPD después de una ICP, en el contexto de los SCC y SCA. Hasta la fecha no se ha probado ninguna escala de riesgo en pacientes que requieren anticoagulación a largo plazo. Las escalas DAPT y PRECISE-DAPT se diseñaron para guiar la toma de decisiones sobre la duración del TAPD153,154. La escala PRECISE-DAPT se calcula en el momento del alta hospitalaria, mientras que la escala DAPT es una estimación del riesgo hemorrágico que se calcula 1 año después del evento inicial. La utilidad de la escala PRECISE-DAPT se evaluó retrospectivamente en pacientes asignados aleatoriamente a distintas duraciones de TAPD (n=10.081) para establecer el efecto del tratamiento a largo plazo (12-14 meses) o a corto plazo (3-6 meses) en los eventos isquémicos y hemorrágicos en relación con el riesgo hemorrágico inicial154. Entre los pacientes con riesgo hemorrágico alto según la clasificación PRECISE-DAPT (puntuación ≥ 25), el TAPD prolongado no se asoció con beneficios en cuanto a los eventos isquémicos, pero se asoció con una gran carga de eventos hemorrágicos154. Por el contrario, los tratamientos más largos para pacientes sin riesgo hemorrágico alto (puntuación<25) no se asociaron con un aumento de los eventos hemorrágicos y sí con una reducción significativa de la variable compuesta de infarto de miocardio, trombosis confirmada del stent, ictus y revascularización del vaso diana. Estos hallazgos se confirmaron también en el análisis restringido a los SCA. Para la mayoría de los pacientes incluidos en el estudio, el TAPD consistió en AAS y clopidogrel. Un validación externa de la escala PRECISE-DAPT (en 4.424 pacientes con SCA sometidos a ICP y tratados con prasugrel o ticagrelor) mostró un discreto valor predictivo de hemorragia mayor durante un seguimiento medio de 14 meses (estadístico C=0,653)165. Por otra parte, ninguno de estos modelos de predicción de riesgo se probó prospectivamente en ECA y, por lo tanto, su valor para mejorar los resultados de los pacientes no está claro. El estudio DAPT está menos validado, con un análisis retrospectivo en 1.970 pacientes y el cálculo de la escala en distintos momentos (a los 6 y 12 meses), comparado con la cohorte de derivación que se usó para generar la escala166.
5Tratamientos farmacológicos5.1Tratamiento antitrombóticoEl tratamiento antitrombótico es obligatorio para los pacientes con SCASEST, se sometan o no a tratamiento invasivo. La elección del tratamiento, la combinación de fármacos, el momento de inicio y la duración dependen de varios factores intrínsecos y extrínsecos (relacionados con el procedimiento) (figura 25). Es importante destacar que las complicaciones isquémicas y hemorrágicas tienen una influencia importante en la evolución de los pacientes con SCASEST y en el riesgo total de muerte167. Por lo tanto, a la hora de elegir el tratamiento se debe tener en cuenta tanto el riesgo isquémico como el riesgo hemorrágico de los pacientes.
Factores que determinan el tratamiento antitrombótico en la enfermedad coronaria. Variables intrínsecas (en azul: características del paciente, presentación clínica y comorbilidades) y extrínsecas (en amarillo: medicación concomitante y aspectos del procedimiento) que influyen en la elección, la dosis y la duración del tratamiento antitrombótico. CABG: cirugía de revascularización coronaria; EAP: enfermedad arterial periférica; ERC: enfermedad renal crónica; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; SCA: síndrome coronario agudo; SCASEST: síndrome coronario agudo sin elevación del segmento ST; SCC: síndrome coronario crónico.
Los fármacos anticoagulantes y antiagregantes plaquetarios y las dosis recomendadas que se deben administrar durante y después de los SCASEST se resumen en la figura 6 y la tabla 8.
Tratamientos antitrombóticos para pacientes con síndrome coronario agudo sin elevación del segmento ST: objetivos del tratamiento farmacológico. Los fármacos de administración oral se muestran en letras negras y los de administración preferentemente parenteral, en letras rojas. El abciximab (entre paréntesis) ya no se suministra. AAS: ácido acetilsalicílico; ADP: adenosina difosfato; AVK: antagonistas de la vitamina K; FXa: factor Xa; GP: gluproteína; HNF: heparina no fraccionada; TAPD: tratamiento antiagregante plaquetario doble; TxA2: tromboxano A2.
La activación plaquetaria y la cascada de la anticoagulación tienen un papel clave en la fase inicial y la evolución de los SCASEST. Por ello, es esencial una inhibición plaquetaria y anticoagulación (temporal) suficientes para los pacientes con SCASEST, particularmente para aquellos que se someten a revascularización coronaria mediante ICP. El AAS se considera la piedra angular del tratamiento para inhibir la generación de tromboxano A2 (figura 6), que normalmente es completa con una dosis ≥ 75mg/día. El tratamiento con AAS se inicia con una dosis de carga seguida de tratamiento de mantenimiento (tabla 8). La evidencia actual apoya la administración de una dosis de mantenimiento de 75-100mg 1 vez al día169. Basándose en los resultados de los estudios de fase III PLATO y TRITON-TIMI 38170,171, el TAPD con AAS y un inhibidor potente del P2Y12 (ticagrelor o prasugrel) es el tratamiento estándar recomendado para los pacientes con SCASEST. El clopidogrel, que se caracteriza por ser un inhibidor plaquetario menos potente y más variable172,173, solo se debe usar cuando el prasugrel o el ticagrelor estén contraindicados, no estén disponibles o no se toleren por un riesgo hemorrágico excesivamente alto. Los inhibidores del P2Y12 tienen distintas propiedades farmacocinéticas y farmacodinámicas. En la tabla 9 se resumen las características más importantes de los fármacos orales e intravenosos. Para más información sobre estudios recientes sobre el TAPD, consulte el documento 2017 ESC focused update on DAPT in CAD169.
El estudio aleatorizado y sin enmascaramiento ISAR-REACT 5 proporcionó datos sobre la comparación directa entre prasugrel y ticagrelor174. El estudio incluyó a 4.018 pacientes con SCA (SCASEST o IAMCEST) programados para evaluación invasiva. El estudio demostró que el tratamiento con prasugrel, comparado con ticagrelor, redujo significativamente la tasa de la variable compuesta de muerte, IM o ictus (el 6,9 frente al 9,3%; p=0,006) sin un aumento de las complicaciones hemorrágicas (el 4,8 frente al 5,4%; p=0,46).
Las limitaciones del estudio, entre otras, incluyen su diseño sin enmascaramiento y los escasos datos sobre pacientes que recibieron tratamiento farmacológico o CABG, que tuvieron una mayor presencia en el estudio PLATO170. El ticagrelor también se asoció con la interrupción más frecuente del tratamiento debido a sus efectos secundarios. En más del 80% de los pacientes aleatorizados, la estrategia de tratamiento fue la ICP y, consecuentemente, el prasugrel se debe considerar como el inhibidor del P2Y12 de primera línea para los pacientes con SCASEST que se someten a esta intervención. El posible beneficio del prasugrel, frente a ticagrelor o clopidogrel, podría estar relacionado con una mejor función endotelial175. Las recomendaciones sobre algoritmos de tratamiento, la duración y las opciones de tratamiento prolongado (> 12 meses) para los pacientes con SCASEST se encuentran en la figura 7.
Algoritmo de tratamiento antitrombótico para pacientes con síndrome coronario agudo sin elevación del segmento ST y sin fibrilación auricular que se someten a intervención coronaria percutánea. El riesgo hemorrágico alto se define como el riesgo aumentado de sangrado espontáneo durante el TAPD (puntuación PRECISE-DAPT ≥ 25 o presencia de criterios ARC-HBR158). El código de colores se refiere a las clases de recomendación de la ESC (verde=clase I; amarillo=clase IIa; anaranjado=clase IIb). El riesgo hemorrágico muy alto se define como sangrado reciente (< 1 mes) y/o cirugía planificada que no se puede retrasar. ACO: anticoagulantes orales; ARC-HBR: Academic Research Consortium-High Bleeding Risk; ESC: Sociedad Europea de Cardiología; HNF: heparina no fraccionada; ICP: intervención coronaria percutánea; PRECISE-DAPT: Predicting bleeding Complications In patients undergoing Stent implantation and subsequent Dual Anti Platelet Therapy; SCASEST: síndrome coronario agudo sin elevación del segmento ST; TAD: tratamiento antitrombótico doble (aquí: ácido acetilsalicílico+rivaroxabán); TAPD: tratamiento antiagregante plaquetario doble; TFGe: tasa de filtrado glomerular estimada.
aClopidogrel durante 12 meses de TAPD si el paciente no es candidato a tratamiento con prasugrel o ticagrelor o en caso de reducción del TAPD con cambio a clopidogrel (clase IIb).
bClopidogrel o prasugrel si el paciente no es candidato a tratamiento con ticagrelor.
cIndicación de clase IIa de TAD o TAPD durante>12 meses para pacientes con riesgo alto de eventos isquémicos (véase las definiciones en la tabla 9) y sin riesgo aumentado de sangrado mayor (historia de hemorragia intracraneal o ictus isquémico, historia de otras enfermedades intracraneales, hemorragia gastrointestinal reciente o anemia causada posiblemente por pérdida gastrointestinal de sangre, otras afecciones gastrointestinales asociadas con un aumento del riesgo hemorrágico, insuficiencia hepática, diátesis sanguínea o coagulopatía, edad muy avanzada o fragilidad, insuficiencia renal que requiere diálisis o TFGe<15ml/min/1,73 m2); indicación de clase IIb de TAD o TAPD durante>12 meses para pacientes con riesgo moderadamente aumentado de eventos isquémicos (véase las definiciones en la tabla 9) y sin riesgo aumentado de sangrado mayor. Escuche online la audioguía de esta figura.
El pretratamiento es la estrategia terapéutica en la que se administran fármacos antiagregantes plaquetarios, normalmente un inhibidor del P2Y12, antes de la coronariografía y cuando se desconoce la anatomía coronaria176. Aunque los principios del pretratamiento en los SCASEST parecen obvios, pues se trata de lograr una inhibición plaquetaria suficiente en el momento de la ICP, no se han realizado estudios aleatorizados a gran escala que apoyen el uso sistemático del pretratamiento con clopidogrel o un inhibidor potente del P2Y12 (prasugrel y ticagrelor). En pacientes con SCASEST, el estudio aleatorizado ACCOAST177 no demostró ningún beneficio del pretratamiento con prasugrel en eventos isquémicos, en cambio el riesgo hemorrágico fue sustancialmente más alto. Estos resultados coinciden con los datos observacionales sobre el pretratamiento con ticagrelor, prasugrel y clopidogrel del Swedish Coronary Angiography and Angioplasty Registry, que incluyó a 64.857 pacientes con SCASEST178. A partir de esta gran base de datos, se observó que el pretratamiento con inhibidores del P2Y12 para pacientes con SCASEST no se asoció con mejores resultados isquémicos, mientras que el riesgo hemorrágico aumentó significativamente. Con respecto al pretratamiento con ticagrelor, el reciente estudio ISAR-REACT 5 mostró que una estrategia basada en la administración de prasugrel después de conocerse la anatomía coronaria en pacientes con SCASEST fue superior a una estrategia basada en el pretratamiento sistemático con ticagrelor174. Hay que señalar que en este estudio no se observó ningún beneficio aparente con la estrategia de pretratamiento (ticagrelor).
Con base en la evidencia disponible174,177, no se recomienda la administración sistemática de pretratamiento con un inhibidor del P2Y12 para los pacientes con SCASEST en los que se desconoce la anatomía coronaria y se planifica una estrategia invasiva temprana. En caso de una estrategia invasiva aplazada, se puede considerar el pretratamiento con un inhibidor del P2Y12 para algunos pacientes seleccionados y teniendo en cuenta el riesgo hemorrágico del paciente.
Por su rápida acción (tabla 9), el tratamiento con inhibidores potentes del P2Y12 (ticagrelor o prasugrel) se puede administrar después de la coronariografía diagnóstica y directamente antes de la ICP. Hay que destacar que el pretratamiento sistemático puede ser perjudicial para un porcentaje significativo de pacientes que tienen un diagnóstico distinto del SCASEST (p. ej., disección aórtica o complicaciones hemorrágicas, incluida la hemorragia intracraneal) y puede aumentar el riesgo hemorrágico o retrasar la cirugía de los pacientes que requieren CABG después de la coronariografía diagnóstica.
Recomendaciones sobre el tratamiento antitrombótico de los pacientes con síndrome coronario agudo sin elevación ST y sin fibrilación auricular que se someten a una intervención coronaria percutánea
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Tratamiento antiagregante plaquetario | ||
| El AAS está recomendada para todos los pacientes sin contraindicaciones a una dosis oral de carga de 150-300mg (o 75-250mg i.v.), seguida de 75-100mg/día para el tratamiento a largo plazo179–181 | I | A |
| Está recomendada la administración de un inhibidor del P2Y12, además de AAS, durante 12 meses, excepto en caso de contraindicaciones o riesgo hemorrágico excesivo170,171,182Las opciones son: | I | A |
| • Prasugrel para pacientes no tratados con un inhibidor del P2Y12 que se someten a ICP (dosis de carga de 60mg, seguida de 10mg/día como dosis estándar o 5mg/día para pacientes ≥ 75 años o con peso corporal<60kg)171 | I | B |
| • Ticagrelor independientemente de la estrategia de tratamiento (invasiva o conservadora) (dosis de carga de 180mg, seguida de 90mg 2 veces al día)170 | I | B |
| • Clopidogrel (dosis de carga de 300-600mg, seguida de 75mg/día), solo cuando el prasugrel o el ticagrelor no estén disponibles, no se toleren o estén contraindicados182,183 | I | C |
| Se debe considerar la administración de prasugrel antes que ticagrelor para pacientes con SCASEST que se someten a ICP174 | IIa | B |
| Se debe considerar el uso de inhibidores de la GPIIb/IIIa como tratamiento de rescate en caso de evidencia de fenómeno de no reflujo o de una complicación trombótica | IIa | C |
| Se puede considerar el cangrelor para pacientes no tratados con un inhibidor del P2Y12 que se someten a ICP184–187 | IIb | A |
| Se puede considerar el pretratamiento con un inhibidor del P2Y12 para pacientes con SCASEST para los que no se planifica una estrategia invasiva temprana y que no tienen riesgo hemorrágico alto | IIb | C |
| No se recomienda el tratamiento con un inhibidor de la GPIIb/IIIa para pacientes con anatomía coronaria desconocida188,189 | III | A |
| No se recomienda la administración sistemática de pretratamiento con un inhibidor del P2Y12 para pacientes con anatomía coronaria desconocida cuando se planifica una estrategia invasiva temprana174,177,178,190,191 | III | A |
| Tratamiento anticoagulante periprocedimiento | ||
| Está recomendada la anticoagulación parenteral, además de tratamiento antiagregante plaquetario, para todos los pacientes en el momento del diagnóstico y, especialmente, durante los procedimientos de revascularización según los riesgos isquémico y hemorrágico192,193 | I | A |
| Para pacientes que se someten a ICP, está recomendada la administración de HNF (bolo intravenoso ajustado al peso durante la ICP de 70-100 UI/kg, o 50-70 UI/kg en combinación con un inhibidor de la GPIIb/IIIa; intervalo de tiempo de coagulación activada de 250-350 s, o 200-250 s si se administra un inhibidor de la GPIIb/IIIa) | I | A |
| En los casos de tratamiento farmacológico o limitaciones logísticas para trasladar al paciente a un centro con ICP en el plazo requerido, se recomienda la administración de fondaparinux y, en estos casos, se recomienda administrar un único bolo de HNF en el momento de la ICP183 | I | B |
| Se recomienda seleccionar la anticoagulación según los riesgos isquémico y hemorrágico, además del perfil de eficacia y seguridad del fármaco | I | C |
| Se debe considerar la administración de enoxaparina (i.v.) para pacientes pretratados con enoxaparina subcutánea194–196 | IIa | B |
| Se debe considerar interrumpir la anticoagulación parenteral inmediatamente después de un procedimiento invasivo | IIa | C |
| Se puede considerar la bivalirudina como una alternativa a la HNF189,197,198 | IIb | A |
| No está recomendado el cambio de HNF a HBPM196 | III | B |
AAS: ácido acetilsalicílico; GP: glucoproteína; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; ICP: intervención coronaria percutánea; i.v.: intravenoso; SCASEST: síndrome coronario agudo sin elevación del segmento ST.
El tratamiento periprocedimiento de los pacientes con SCASEST incluye la anticoagulación para inhibir la generación o la actividad de trombina (figura 6). La anticoagulación está recomendada para todos los pacientes, además del tratamiento antiagregante plaquetario, durante los procedimientos invasivos para los SCASEST192. En la tabla 8 se encuentran los fármacos más relevantes y sus dosis para el tratamiento de los pacientes con SCASEST. La heparina no fraccionada (HNF) es el fármaco de elección para los pacientes con SCASEST por su favorable perfil de riesgo-beneficio. En general, se debe evitar el cambio de anticoagulantes (particularmente entre HNF y heparina de bajo peso molecular [HBPM]), con la excepción de añadir HNF a fondaparinux cuando un paciente se somete a una ICP después de recibir tratamiento con fondaparinux196,199. Se debe interrumpir la administración de estos fármacos inmediatamente después de la ICP, a excepción de algunas situaciones clínicas, como la presencia confirmada de aneurisma del VI con formación de trombos o FA que requiere anticoagulación, que normalmente se realiza con HNF en contextos agudos.
En los últimos años se han producido cambios en el tratamiento adjuntivo (como los inhibidores de la GPIIb/IIIa) y en algunos aspectos de los procedimientos (p. ej., acceso radial frente a acceso femoral). Al contrario que en estudios más antiguos, los estudios contemporáneos se han centrado en un uso más equilibrado y selectivo de los inhibidores de la GPIIb/IIIa, con bivalirudina y HNF. Estos estudios fueron revisados extensamente en varios metanálisis200–203. Un metanálisis reciente, que incluyó el estudio MATRIX197, no mostró un beneficio significativo de la bivalirudina frente a la HNF para los eventos isquémicos202. La bivalirudina se asoció con un aumento significativo del riesgo de trombosis del stent y una reducción significativa del riesgo hemorrágico. La reducción del riesgo hemorrágico estuvo relacionada con una falta de equilibrio en el uso de inhibidores de la GPIIb/IIIa, predominantemente con HNF. Recientemente, el estudio VALIDATE-SWEDEHEART204 comparó la HNF frente a bivalirudina en un contexto de acceso radial y uso limitado de inhibidores de la GPIIb/IIIa. El estudio demostró tasas similares de isquemia y sangrado al comparar ambos fármacos. Otro metanálisis, actualizado con los datos del estudio VALIDATE-SWEDEHEART, confirmó que la bivalirudina, frente a HNF, se asoció con una incidencia similar de muerte por todas las causas y eventos isquémicos tras la ICP de los SCA203. Solo se encontró una asociación entre la bivalirudina y una reducción del riesgo hemorrágico con la administración de inhibidores de la GPIIb/IIIa combinados con HNF.
En resumen, y basándose en los estudios referidos antes, la HNF es el anticoagulante de elección recomendado para las ICP. La bivalirudina, debido a su vida media corta y a los resultados favorables en algunos estudios, se puede considerar como una alternativa a la HNF para casos seleccionados.
Para una descripción detallada y un resumen histórico de estudios más antiguos que compararon la HNF frente a bivalirudina (en los que se administraron inhibidores de la GPIIb/IIIa), consulte la GPC de ESC/EACTS 2018 sobre revascularización miocárdica205.
Tras una fase de tratamiento conservador, los pacientes podrían someterse a cateterismo cardiaco, y durante este periodo se puede administrar fondaparinux. Este régimen de tratamiento está basado en el estudio OASIS206. La formación de trombos por el catéter fue más frecuente con fondaparinux, por lo que se debe añadir una dosis completa de HNF para prevenir la formación de trombos cuando los pacientes se someten a ICP.
La enoxaparina, una HBPM con una relación dosis-efecto predecible y menos riesgo de trombocitopenia inducida por heparina que la HNF, se debe considerar como un anticoagulante para la ICP de los pacientes pretratados con enoxaparina subcutánea. En un metanálisis194 que incluyó a pacientes con SCASEST, se observó un beneficio de la enoxaparina frente a la HNF (reducción de la mortalidad y de complicaciones hemorrágicas), pero son necesarios estudios aleatorizados que comparen la enoxaparina frente a la HNF en este contexto.
5.1.3Tratamiento antiagregante plaquetario antes, durante y después de la intervenciónEntre los fármacos intravenosos para el tratamiento antiagregante plaquetario periprocedimiento, se incluyen el cangrelor y los inhibidores de la GPIIb/IIIa (abciximab, eptifibatida y tirofibán). La mayoría de los estudios que evaluaron los inhibidores de la GPIIb/IIIa para pacientes con SCA tratados con ICP son anteriores a la era del empleo sistemático del TAPD, que incluye un inicio temprano y la administración de una dosis de carga de un inhibidor del P2Y12205,207. Actualmente, con el empleo sistemático de inhibidores orales del P2Y12, no se puede afirmar que el pretratamiento sistemático con inhibidores de la GPIIb/IIIa aporte un beneficio adicional a los pacientes con SCASEST programados para coronariografía188,189. Aun más, en un contexto de inhibición plaquetaria potente con ticagrelor o prasugrel, en el que los datos sobre el uso de inhibidores de la GPIIb/IIIa son escasos, no se puede recomendar la administración sistemática de estos fármacos. No obstante, los inhibidores de la GPIIb/IIIa pueden considerarse para situaciones de rescate o en caso de complicaciones trombóticas y se podría considerar para las ICP de riesgo alto de pacientes que no recibieron tratamiento previo con inhibidores del P2Y12 (para más información, consulte la GPC de ESC/EACTS 2018 sobre revascularización miocárdica205).
El cangrelor es un inhibidor directo del P2Y12 reversible y de acción corta que fue evaluado durante las ICP de SCC estables y SCA en ensayos clínicos que compararon el cangrelor frente al clopidogrel, administrado antes de la ICP (estudio CHAMPION) o después de la ICP (CHAMPION PLATFORM Y CHAMPION PHOENIX)185–187. Un metanálisis de estos estudios mostró un beneficio con respecto a la variable principal de eventos isquémicos que fue contrarrestado por un aumento de complicaciones hemorrágicas menores184. Además, el beneficio del cangrelor con respecto a la variable de eventos isquémicos fue menor en el estudio CHAMPION PCI con la administración previa de clopidogrel, mientras que los datos de la combinación con ticagrelor o prasugrel son escasos. Debido a que se ha probado su eficacia para la prevención de la trombosis del stent durante y después del procedimiento en pacientes que no recibieron previamente tratamiento con inhibidores del P2Y12, se puede valorar de manera individualizada la administración de cangrelor a estos pacientes (para más información, consulte la GPC de ESC/EACTS 2018 sobre revascularización miocárdica205).
5.1.4Tratamiento después de la intervención y de mantenimientoDespués de las ICP de los SCASEST, se recomienda el TAPD con un inhibidor del P2Y12 y AAS durante 12 meses, independientemente del tipo de stent implantado, excepto si hay contraindicaciones170,171,182. En algunas situaciones clínicas, la duración del TAPD se puede acortar (< 12 meses), prolongar (> 12 meses; véase la figura 7 y las tablas 10) o modificar (cambio de TAPD o reducción gradual). Estas decisiones dependen del juicio médico individual, que debe estar basado en los riesgos isquémico y hemorrágico del paciente, la aparición de eventos adversos, las comorbilidades, la medicación concomitante y la disponibilidad de los respectivos fármacos. Para una descripción más detallada de los numerosos estudios que compararon diferentes duraciones del TAPD (especialmente 3-6 meses frente a 12 meses en pacientes con SCASEST), consulte el documento 2017 ESC focused update on DAPT in CAD169 y otros estudios publicados recientemente208,209. Para pacientes con SCASEST sometidos a implante de stents que tienen un riesgo hemorrágico alto (p. ej., una puntuación PRECISE-DAPT ≥ 25 o que cumplen los criterios ARC-HBR), se debe considerar la interrupción del tratamiento con inhibidores del P2Y12 después de 3-6 meses154. Para pacientes con riesgo hemorrágico muy alto, definido como un episodio hemorrágico en el último mes o cirugía programada no aplazable en el futuro próximo, se debe considerar el tratamiento con AAS y clopidogrel durante 1 mes.
Opciones de tratamiento antitrombótico o antiagregante plaquetario doble a largo plazo
| Fármaco | Dosis | Indicación | NNT (eventos isquémicos) | NNH (eventos hemorrágicos) |
|---|---|---|---|---|
| Regímenes de TAD prolongado (incluido AAS 75-100mg/día) | ||||
| Rivaroxabán (estudio COMPASS) | 2,5mg 2 veces al día | Pacientes con EC o EAP sintomática y riesgo alto de eventos isquémicos | 77 | 84 |
| Regímenes de TAPD prolongado (incluido AAS 75-100mg/día) | ||||
| Clopidogrel (estudio DAPT) | 75mg/día | Tras infarto de miocardio, pacientes que toleraron el TAPD durante 1 año | 63 | 105 |
| Prasugrel (estudio DAPT) | 10mg/día (5mg/día en caso de peso corporal < 60kg o edad > 75 años) | Tras la ICP para el infarto de miocardio, pacientes que toleraron el TAPD durante 1 año | 63 | 105 |
| Ticagrelor (PEGASUS-TIMI 54) | 60/90mg 2 veces al día | Tras infarto de miocardio, pacientes que toleraron el TAPD durante 1 año | 84 | 81 |
AAS: ácido acetilsalicílico; COMPASS: Cardiovascular Outcomes for People using Anticoagulation Strategies; EC: enfermedad coronaria; EAP: enfermedad arterial periférica; ICP: intervención coronaria percutánea; NNH: número que es necesario tratar para que se produzca un efecto perjudicial; NNT: número que es necesario tratar para que se produzca un efecto beneficioso; PEGASUS-TIMI 54: Prevention of Cardiovascular Events in Patients With Prior Heart Attack Using Ticagrelor Compared to Placebo on a Background of Aspirin-Thrombolysis In Myocardial Infarction 54; TAD: tratamiento antitrombótico doble; TAPD: tratamiento antiagregante plaquetario doble.
Los fármacos para el TAPD (además de AAS 75-100mg/día) aparecen en orden alfabético. Para las indicaciones y definiciones de riesgo moderado/alto y riesgo hemorrágico, consulte la tabla 9 y la figura 7. El NNT se refiere a la variable de valoración de eventos isquémicos de los estudios respectivos y el NNH, a la variable de seguridad (hemorragia). Los valores de NNT y NNH del estudio DAPT corresponden a los datos conjuntos sobre clopidogrel y prasugrel.
Cuatro estudios recientes (n=29.089) evaluaron el beneficio de una duración del TAPD más corta (1-3 meses)208–211. Se incluyó a pacientes con riesgos isquémico y hemorrágico bajos y se administró monoterapia temprana con clopidogrel o ticagrelor. Hubo una reducción de todos los eventos hemorrágicos y una tendencia hacia menos eventos isquémicos, incluido el infarto de miocardio. Hay que destacar que más del 50% de los pacientes presentaron SCA como uno de los criterios de inclusión. El estudio TWILIGHT211 evaluó el efecto del ticagrelor solo frente a ticagrelor combinado con AAS en relación con los eventos hemorrágicos clínicamente relevantes en pacientes con alto riesgo hemorrágico o de eventos isquémicos que se sometieron a ICP, de acuerdo con los criterios de inclusión. Sin embargo, estos pacientes no tenían riesgo hemorrágico alto según los criterios actuales y las tasas de eventos en el seguimiento.
Basándose en esto y a pesar de que más de 2 tercios de los pacientes tuvieron SCA, estos pacientes conformaban una cohorte de riesgo hemorrágico e isquémico relativamente bajo. Después de 3 meses de tratamiento con ticagrelor y AAS, los pacientes que no sufrieron ningún evento isquémico o hemorrágico mayor continuaron el tratamiento con ticagrelor y se los aleatorizó a tratamiento con AAS o placebo durante 1 año. La variable principal de sangrado BARC de tipo 2, 3 o 5 se redujo significativamente al omitir el AAS (el 4,0 frente al 7,1%; HR=0,56; IC95%, 0,45-0,68; p<0,001), con una interacción significativa según la presentación del SCA. El estudio no tenía suficiente potencia para evaluar la variable compuesta de muerte por todas las causas, infarto de miocardio no mortal o ictus no mortal. Sin embargo, en las pruebas de la hipótesis de no inferioridad del tratamiento experimental, no se observó ningún indicio de un aumento del riesgo isquémico211. Hay que señalar que la tasa de eventos isquémicos en el estudio TWILIGHT fue baja comparada con las de otros estudios que incluyeron a pacientes considerados en riesgo alto para ICP.
Por el contrario, y basándose en los resultados de los estudios DAPT y PEGASUS-TIMI 54, para pacientes con SCA que han tolerado el TAPD sin complicaciones hemorrágicas, se puede considerar el TAPD prolongado durante más de 12 meses para aquellos con riesgo trombótico alto y sin riesgo aumentado de hemorragia mayor o potencialmente mortal, y se podría considerar para los pacientes con riesgo trombótico moderadamente alto (véase la figura 7 y las tablas 10 y 11)212,213. Hay que señalar que la dosis de ticagrelor 60mg 2 veces al día se toleró mejor que la de 90mg 2 veces al día214,215 y esta dosis está aprobada en muchos países, aunque no todos, para esta indicación.
El cambio entre inhibidores orales del P2Y12 es frecuente y está dictado por complicaciones hemorrágicas (o riesgo hemorrágico), por efectos secundarios no relacionados con el sangrado (p. ej., disnea con ticagrelor, reacciones alérgicas) y también por factores socioeconómicos216,217. Se puede considerar el cambio de inhibidores orales del P2Y12 en algunos casos seleccionados. Para una descripción detallada del cambio del tratamiento antiagregante plaquetario consulte los documentos International Expert Consensus on Switching Platelet P2Y12Receptor-Inhibiting Therapies217 y 2017 ESC DAPT focused update169.
Se puede considerar la reducción de la intensidad del TAPD (cambio de un fármaco potente como prasugrel o ticagrelor a clopidogrel) para pacientes con SCASEST como un régimen de tratamiento alternativo216,217. Sin embargo, es importante recordar que la reducción uniforme del tratamiento con inhibidores del P2Y12 después de la ICP se puede asociar con un aumento del riesgo isquémico, especialmente si ocurre poco tiempo después del evento inicial (< 30 días). Son necesarios estudios a gran escala sobre la reducción uniforme y no guiada del TAPD, ya que los datos disponibles sobre esta estrategia son contradictorios218,219. Con base en los resultados de los estudios TROPICAL-ACS y POPULAR Genetics220,221, se puede considerar la reducción de la intensidad del TAPD guiada por pruebas de la función plaquetaria (TROPICAL-ACS: pacientes con SCASEST o IAMCEST) o por la determinación del genotipo del CYP2C19 (POPULAR Genetics: pacientes con IAMCEST) en pacientes con SCASEST como una alternativa al tratamiento de inhibición plaquetaria potente durante 12 meses, especialmente para los pacientes no considerados buenos candidatos para el tratamiento prolongado. Para más información, consulte el documento de consenso de expertos sobre pruebas genéticas y de la función plaquetaria para guiar el tratamiento con inhibidores del P2Y12 en las ICP222.
Recientemente se ha propuesto una nueva estrategia de tratamiento antitrombótico doble (TAD) que combina un inhibidor del factor Xa con dosis muy bajas de rivaroxabán (2,5mg/12h) y AAS. Este régimen se debe considerar como opción de tratamiento de mantenimiento durante más de 12 meses desde la ICP de los SCA. En un contexto de prevención secundaria, el estudio COMPASS162,223 evaluó la administración de dosis muy bajas de rivaroxabán (2,5mg/12h) combinado con AAS frente a AAS solo o rivaroxabán solo a dosis de 5mg. El rivaroxabán (2,5mg/12h) más AAS (100mg/día) redujo el riesgo de la variable compuesta de eventos isquémicos, mortalidad total (sin alcanzar el valor umbral de p según el procedimiento de Hochberg) y la mortalidad cardiovascular aislada, mientras que esta combinación de tratamiento aumentó el riesgo de hemorragias mayores sin un aumento significativo de eventos hemorrágicos mortales, intracraneales o de órganos críticos. La reducción absoluta del riesgo fue mayor en los pacientes con riesgo alto, incluidos los pacientes con diabetes o enfermedad vascular múltiple (EC y enfermedad arterial periférica [EAP]). Por lo tanto, se debe considerar el tratamiento con rivaroxabán (2,5mg/12h) y AAS (75-100mg/día) para los pacientes con riesgo trombótico alto y sin riesgo aumentado de hemorragia potencialmente mortal y se podría considerar para los pacientes con riesgo trombótico moderadamente elevado (véase la figura 7 y las tablas 10 y 11 para los criterios de selección y las definiciones de riesgo isquémico y hemorrágico).
Recomendaciones sobre el tratamiento tras el procedimiento y a largo plazo para pacientes con síndrome coronario agudo sin elevación ST
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para pacientes con SCASEST tratados con implante de stents, está recomendado el TAPD con un inhibidor del P2Y12 y AAS durante 12 meses, excepto cuando haya contraindicaciones, como un riesgo hemorrágico excesivo170,171,225 | I | A |
| Prolongación del tratamiento antitrombótico | ||
| Se debe considerar la administración de un segundo fármaco antitrombótico además de AAS para la prevención secundaria a largo plazo para pacientes con riesgo alto de eventos isquémicos y sin riesgo aumentado de sangrado mayor o potencialmente mortal (véanse las tablas 9 y 11 para las opciones de tratamiento)162,212–214,223 | IIa | A |
| Se puede considerar la administración de un segundo fármaco antitrombótico además de AAS para la prevención secundaria a largo plazo para pacientes con riesgo moderadamente aumentado de eventos isquémicos y sin riesgo aumentado de sangrado mayor o potencialmente mortal (véanse las tablas 9 y 11 para las opciones de tratamiento)162,212–214,223 | IIb | A |
| Para pacientes con SCA y sin ictus/AIT previo que tienen riesgo isquémico alto y riesgo hemorrágico bajo y reciben tratamiento con AAS y clopidogrel, se puede considerar la administración de rivaroxabán a dosis bajas (2,5mg 2 veces al día durante 1 año aproximadamente) tras la interrupción de la anticoagulación parenteral224 | IIb | B |
| Reducción de la duración del tratamiento antitrombótico | ||
| Tras el implante de stents en pacientes con riesgo hemorrágico alto (p. ej., puntuación PRECISE-DAPT ≥ 25 o si se cumplen los criterios ARC-HBR), se debe considerar la interrupción del tratamiento con un inhibidor del P2Y12 después de 3 meses154,226 | IIa | B |
| Tras el implante de stents en pacientes que reciben TAPD, se debe considerar la interrupción de la AAS después de 3-6 meses, dependiendo del balance entre los riesgos isquémico y hemorrágico208,209,227 | IIa | A |
| Se puede considerar la reducción del tratamiento de inhibición del P2Y12 (p. ej., cambiar de prasugrel o ticagrelor a clopidogrel) como una alternativa al TAPD, especialmente para pacientes con SCA no considerados candidatos a tratamiento de inhibición plaquetaria potente. La reducción del tratamiento se puede hacer guiada únicamente por el juicio médico o por pruebas de la función plaquetaria o la determinación del genotipo del CYP2C19, dependiendo del perfil de riesgo del paciente y de la disponibilidad de estas pruebas218,220,221 | IIb | A |
AAS: ácido acetilsalicílico; AIT: ataque isquémico transitorio; ARC-HBR: Academic Research Consortium-High Bleeding Risk; PRECISE-DAPT: Predicting bleeding Complications In patients undergoing Stent implantation and subsequent Dual Anti Platelet Therapy; SCA: síndrome coronario agudo; SCASEST: síndrome coronario agudo sin elevación del segmento ST; TAPD: tratamiento antiagregante plaquetario doble.
El estudio ATLAS ACS 2-TIMI 51 evaluó la administración de rivaroxabán a pacientes tratados con clopidogrel. El estudio mostró una reducción de los eventos isquémicos y la mortalidad cardiovascular, junto con un mayor riesgo hemorrágico224. Sin embargo, los datos sobre pacientes que toman ticagrelor o prasugrel son muy escasos y, por lo tanto, es difícil extrapolar los resultados de los estudios a la práctica clínica contemporánea que incluye el uso de inhibidores potentes del P2Y12.
5.2Tratamiento farmacológico de la isquemiaConsulte el material adicional.
5.2.1Tratamiento farmacológico de apoyoConsulte el material adicional.
5.2.2Nitratos y bloqueadores betaConsulte el material adicional.
Recomendaciones sobre el uso de fármacos antiisquémicos en la fase aguda de los síndromes coronarios agudos sin elevación del ST
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda la administración i.v. o sublingual de nitratos y el tratamiento precoz con bloqueadores beta para pacientes con síntomas isquémicos si no hay contraindicaciones | I | C |
| Se recomienda continuar el tratamiento con bloqueadores beta, excepto en los casos de insuficiencia cardiaca manifiesta | I | C |
| Están recomendados los nitratos i.v. para pacientes con hipertensión incontrolada o signos de insuficiencia cardiaca | I | C |
| Para pacientes con angina vasoespástica sospechada/confirmada, se considerará el tratamiento con bloqueadores de los canales de calcio y nitratos y se evitará el uso de bloqueadores beta231 | IIa | B |
i.v.: intravenoso.
En el 6-8% de los pacientes sometidos a ICP, está indicada la ACO a largo plazo y no se debe suspender durante el procedimiento, ya que su interrupción y el tratamiento puente con anticoagulantes parenterales pueden llevar a un aumento de episodios tromboembólicos y hemorrágicos232–234. En pacientes que se someten a ICP, no se sabe si es seguro cambiar la anticoagulación con NACO por el tratamiento puente con anticoagulación parenteral o continuar con NACO sin anticoagulación parenteral adicional, mientras que esta no es necesaria si la INR es>2,5 en los pacientes tratados con antagonistas de la vitamina K (AVK)235–237. Las estrategias para minimizar el riesgo de complicaciones relacionadas con la ICP en pacientes que toman ACO se presentan en la tabla 12.
Estrategias para reducir el riesgo hemorrágico relacionado con las intervenciones coronarias percutáneas
| Ajuste de la dosis de anticoagulación según peso y función renal, especialmente en mujeres y pacientes ancianos |
| Acceso radial como acceso vascular preferido |
| Administración de un inhibidor de la bomba de protones en combinación con TAPD para pacientes con un riesgo de hemorragia gastrointestinal aumentado (antecedentes de úlcera/hemorragia gastrointestinal, tratamiento anticoagulante, toma crónica de antiinflamatorios no esteroideos/corticoides) o 2 o más de los siguientes:• Edad ≥ 65 años• Dispepsia• Enfermedad por reflujo gastroesofágico• Infección por Helicobacter pylori• Consumo crónico de alcohol |
| Pacientes con anticoagulación oral:• La ICP debe realizarse sin interrupción de los AVK o NACO• No administrar HNF a los pacientes tratados con AVK si la INR es>2,5• A los pacientes tratados con NACO, independientemente de la hora de la última dosis, se les administra una dosis baja de un anticoagulante parenteral (p. ej., enoxaparina i.v. 0,5mg/kg o HNF 60 UI/kg) |
| Está indicado el AAS, pero debe evitarse el pretratamiento con inhibidores del P2Y12 |
| Los inhibidores de la GPIIb/IIIa solo se deben emplear como tratamiento de rescate o en caso de complicaciones periprocedimiento |
AAS: ácido acetilsalicílico; ACO: anticoagulación oral; AVK: antagonistas de la vitamina K; GP: glucoproteína; HNF: heparina no fraccionada; i.v.: intravenoso; ICP: intervención coronaria percutánea; INR: razón internacional normalizada; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; TAPD: tratamiento antiagregante plaquetario doble.
La evidencia sobre el tratamiento de los pacientes con SCASEST sometidos a ICP que requieren ACO a largo plazo se deriva de subgrupos de ECA (véase la tabla 13 y la sección 5.3.1. del material adicional)238–242.
Ensayos clínicos aleatorizados que incluyeron a pacientes con síndrome coronario agudo sin elevación del segmento ST que requerían tratamiento anticoagulante y antiagregante plaquetario
| ECA | Pacientes, n | Comparación | Criterio principal de valoración | Criterios de valoración secundarios |
|---|---|---|---|---|
| WOEST239 | 573 | TAD (AVK+C) durante 12 meses frente a TAT (AVK+AAS+C) durante 12 meses | Grado de hemorragia TIMI más bajo con TAD frente a TAT al año (HR = 0,36; IC95%, 0,26-0,50) | Sin diferencias en: infarto de miocardio+ictus+revascularización del vaso diana+trombosis del stent |
| Menor mortalidad por todas las causas con TAD frente a TAT al año (HR = 0,39; IC95%, 0,16-0,93) | ||||
| ISAR-TRIPLE250 | 614 | TAT durante 6 semanas (AVK+AAS+C) seguido de TAD (AVK+AAS) frente a TAT durante 6 meses (AVK+AAS+C) | Sin diferencias en: muerte+infarto de miocardio+trombosis del stent+ictus o hemorragia TIMI mayor a los 9 meses | Sin diferencias en: muerte cardiaca+infarto de miocardio+trombosis del stent+ictusSin diferencias en hemorragia TIMI mayor |
| PIONEERAF-PCI240 | 2.124 | TAD (rivaroxabán 15mg/día+C) durante 12 meses frente a TAT modificado (rivaroxabán 2,5mg/12 h+AAS+C durante 1, 6 o 12 meses) frente a TAT (AVK+AAS+C durante 1, 6 o 12 meses) | Menos hemorragias clínicamente significativas con TAD (HR = 0,59; IC95%, 0,47-0,76) o TAT modificado (HR = 0,63; IC95%, 0,50-0,80) frente al TAT | Sin diferencias en: muerte cardiovascular+infarto de miocardio+ictusMenos muertes por todas las causas+rehospitalizaciones con TAD (HR = 0,79; IC95%, 0,69-0,94) o TAT modificado (HR = 0,75; IC95%, 0,62-0,90) frente al TAT |
| RE-DUAL PCI238 | 2725 | TAT (AVK+AAS+C) hasta 3 meses frente al TAD (dabigatrán 110 o 150mg/12 h+C o T) | Menos hemorragias mayores o clínicamente relevantes con TAD 110mg (HR = 0,52; IC95%, 0,42-0,63) o TAD 150mg (HR = 0,72; IC95%, 0,58-0,88) frente al TAT | Sin diferencias en: infarto de miocardio+ictus+embolia sistémica, muerte, revascularización no planificada |
| AUGUSTUS241 | 4.614 | TAD1 (apixabán 5mg/12 h+C o T o P) frente a TAD2 (AVK+C o T o P) frente a TAT1 (apixabán 5mg/12 h+AAS+C o T o P) frente a TAT2 (AVK+AAS+C o T o P) | Menos hemorragias mayores o clínicamente relevantes con TAD1 (HR = 0,69; IC95%, 0,58-0,81) frente a otros regímenes | Menos muertes+hospitalizaciones con apixabán (HR = 0,83; IC95%, 0,74-0,93) |
| Sin diferencias con AAS | ||||
| ENTRUSTAF PCI251 | 1.506 | TAD (edoxabán 60 mg+C o T o P) frente a TAT (AVK+AAS+C o T o P) | No inferioridad en hemorragia mayor o clínicamente relevante entre TAD y TAT (HR = 0,83; IC95%, 0,65-1,05; p = 0,001 para la no inferioridad) | Sin diferencias en muerte cardiovascular+ictus+embolia sistémica+infarto de miocardio+trombosis del stent entre TAD y TAT |
AAS: ácido acetisalicílico; ACO: anticoagulación oral; AUGUSTUS: Antithrombotic Therapy after Acute Coronary Syndrome or PCI in Atrial Fibrillation; AVK: antagonistas de la vitamina K; C: clopidogrel; ECA: ensayo clínico aleatorizado; ENTRUST-AF PCI: Edoxaban Treatment versus VKA in patients with AF undergoing PCI; FA: fibrilación auricular; HR: hazard ratio; IC: intervalo de confianza; ISAR-TRIPLE: Triple Therapy in Patients on Oral Anticoagulation After Drug Eluting Stent Implantation; P: prasugrel; PIONEER AF-PCI: Open-Label, Randomized, Controlled, Multicenter Study Exploring Two Treatment Strategies of Rivaroxaban and a Dose-Adjusted Oral Vitamin K Antagonist Treatment Strategy in Subjects with Atrial Fibrillation who Undergo Percutaneous Coronary Intervention; RE-DUAL PCI: Randomized Evaluation of Dual Antithrombotic Therapy with Dabigatran versus Triple Therapy with Warfarin in Patients with Nonvalvular Atrial Fibrillation Undergoing Percutaneous Coronary Intervention; T: ticagrelor; TAD: tratamiento antitrombótico doble; TAT: tratamiento antitrombótico triple; TIMI: Thrombolysis In Myocardial Infarction; WOEST: What is the Optimal antiplatelet and anticoagulant therapy in patients with oral anticoagulation and coronary stenting.
En general, para los pacientes con FA sin válvula protésica mecánica o con estenosis mitral moderada-avanzada, la evidencia respalda el empleo de NACO en lugar de AVK por su seguridad (menos riesgo hemorrágico). El TAD con un NACO a las dosis recomendadas para la prevención del ictus y un antiagregante plaquetario (preferiblemente clopidogrel, que es el fármaco de elección en más del 90% de los estudios realizados) está recomendado como tratamiento estándar durante 12 meses tras un periodo corto (1 semana) de tratamiento antitrombótico triple (NACO+TAPD) (figura 8). Aunque ningún estudio fue diseñado para detectar pequeñas diferencias en los eventos isquémicos, el riesgo numéricamente más alto de trombosis del stent o infarto de miocardio observado en algunos estudios podría estar contrarrestado por el mayor riesgo hemorrágico, lo que resulta en un efecto neutro en los eventos cardiovasculares adversos mayores (MACE) o en la mortalidad total243,244. A diferencia de la estrategia estándar, para los pacientes con riesgo hemorrágico alto, el TAD se debe reducir a 6 meses retirando el tratamiento antiagregante en curso, mientras que para los pacientes con riesgo isquémico coronario alto, el TAT se debe prolongar hasta 1 mes, seguido de TAD durante 12 meses. Actualmente no hay suficiente evidencia que respalde el empleo de ACO con ticagrelor o prasugrel como tratamiento doble después de la ICP y como alternativa al TAT241,245. Durante las primeras 4 semanas después del implante de stents coronarios, se puede considerar el TAPD con AAS y ticagrelor o prasugrel, sin ACO, como alternativa al TAT para pacientes con SCASEST con riesgo isquémico alto y FA y un factor de riesgo no relacionado con el sexo. El estudio AFIRE evaluó la necesidad de continuar con algún tratamiento antiagregante después de 12 meses en 2.236 pacientes con FA tratados con ICP o CABG 1 año antes o con EC confirmada a los que se aleatorizó a monoterapia con rivaroxabán o tratamiento combinado con rivaroxabán y un antiagregante plaquetario246. La monoterapia con rivaroxabán (15mg/día o 10mg/día en caso de aclaramiento de creatinina 15-49ml/min) no fue inferior al tratamiento combinado para la variable principal de eficacia compuesta de ictus, embolia sistémica, infarto de miocardio, angina inestable que requiere revascularización o mortalidad total (HR=0,72; IC95%, 0,55-0,95).
Algoritmo de tratamiento antitrombótico para pacientes con síndrome coronario agudo sin elevación del segmento ST y fibrilación auricular sometidos a una intervención coronaria percutánea o que reciben tratamiento farmacológico. Los colores denotan las clases de recomendación (verde=clase I y amarillo=clase IIa). Para la ACO, preferiblemente un NACO en lugar de AVK como estrategia estándar y en todos los casos si no hay contraindicaciones. Para los regímenes de TAT y TAD, las dosis recomendadas de NACO son: a) apixabán 5mg 2 veces al día241; b) dabigatrán 110 o 150mg 2 veces al día238; c) edoxabán 60mg/día, y d) rivaroxabán 15 o 20mg/día240. Está recomendada la reducción de la dosis de NACO para pacientes con insuficiencia renal y se puede considerar para pacientes que cumplen los criterios ARC-HBR (véase la tabla 7)158. Para la monoterapia antiagregante plaquetaria, preferiblemente un inhibidor del P2Y12 en lugar de AAS. Se puede considerar el ticagrelor para pacientes con riesgo isquémico alto y riesgo hemorrágico bajo. Para el tratamiento más de 1 mes, se puede considerar el tratamiento con ACO+TAPD (TAT) hasta 6 meses para algunos pacientes seleccionados con riesgo isquémico alto (IIaC). Para el tratamiento más de 12 meses, se puede considerar ACO+un antiagregante plaquetario para pacientes seleccionados con riesgo isquémico alto. El riesgo hemorrágico alto se define según los criterios ARC-HBR (véase la tabla 7) y una puntuación PRECISE-DAPT ≥ 25. Los riesgos trombótico e isquémico altos se definen en la tabla 11. AAS: ácido acetilsalicílico; ACO: anticoagulantes orales; ARC-HBR: Academic Research Consortium-High Bleeding Risk; AVK: antagonistas de la vitamina K; FA: fibrilación auricular; ICP: intervención coronaria percutánea; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; PRECISE-DAPT: Predicting bleeding Complications In patients undergoing Stent implantation and subsequent Dual Anti Platelet Therapy; SCASEST: síndrome coronario agudo sin elevación del segmento ST; TAD: tratamiento antitrombótico doble; TAPD: tratamiento antiagregante plaquetario doble; TAT: tratamiento antitrombótico triple. Escuche online la audioguía de esta figura.
Para los pacientes con SCASEST en tratamiento farmacológico, los datos disponibles respaldan el TAD en lugar del triple con un solo antiagregante plaquetario (frecuentemente clopidogrel) durante al menos 6 meses247. En un registro, el riesgo hemorrágico aumentó con el TAT, comparado con un AVK combinado con un antiagregante a los 90 días, pero no al año, y no se observaron diferencias en los eventos isquémicos248. Además, la warfarina combinada con clopidogrel dio como resultado una reducción no significativa de sangrados mayores, comparada con el TAT, con una reducción no significativa del infarto de miocardio o la muerte cardiovascular249. En el estudio AUGUSTUS241, aproximadamente el 23% de los pacientes incluidos tenían SCA en tratamiento médico. En estos pacientes, el apixabán redujo significativamente las complicaciones hemorrágicas comparado con un AVK (HR=0,44; IC95%, 0,28-0,68) y la muerte o la hospitalización (HR=0,71; IC95%, 0,54-0,92), mientras que no se observaron diferencias significativas en la muerte o los eventos isquémicos (HR=0,71; IC95%, 0,46-1,09]). El AAS comparado con placebo presentó una fuerte tendencia hacia más eventos hemorrágicos (HR=1,49; IC95%, 0,98-2,26), pero sin diferencias significativas en la muerte o la hospitalización (HR=1,16; IC95%, 0,90-1,51) o los eventos isquémicos (HR=1,01; IC95%, 0,66-1,55).
5.3.2Pacientes que requieren antagonistas de la vitamina K o que van a someterse a cirugía de revascularización coronariaPara pacientes que requieren tratamiento con un AVK (p. ej., pacientes con válvula mecánica protésica), está indicado el TAD con un AVK y un antiagregante plaquetario (preferiblemente clopidogrel) tras un periodo corto de TAT en el hospital (con AAS y clopidogrel)239. Comparado con el TAT (que consistió en AVK más AAS y clopidogrel), el TAD (AVK más clopidogrel) se asoció con una tendencia hacia la reducción del sagrado mayor TIMI (OR=0,58; IC95%, 0,31-1,08) en un metanálisis en red, mientras que no hubo diferencias significativas en los MACE (OR=0,96; IC95%, 0,60-1,46)243.
La CABG en pacientes anticoagulados se asocia con un riesgo hemorrágico aumentado, por lo que se recomienda la interrupción de los AVK antes de la CABG cuando esta no sea urgente. En los casos de cirugía urgente, es necesario administrar un concentrado de complejo de protrombina de 4 factores inactivados (25 UI/kg) y vitamina K oral para lograr rápidamente una hemostasia adecuada en el momento de la cirugía252. Aunque la experiencia con cirugía mayor urgente en pacientes tratados con NACO es escasa, para estos casos se ha propuesto emplear un concentrado de complejo de protrombina con factores activados para restaurar la hemostasia253. En estos pacientes, los agentes de reversión pueden ser una opción adicional254. En el contexto de la CABG programada, se recomienda la interrupción del tratamiento con NACO durante 48h (podría ser necesario un periodo más largo para los pacientes con insuficiencia renal). Para los pacientes con SCA y una indicación establecida de ACO, se debe reanudar la anticoagulación, posiblemente combinada con un antiagregante plaquetario, después de la CABG en cuanto se controle el sangrado, mientras que se debe evitar el TAT. Para el tratamiento antitrombótico y la CABG, véase Valgimigli et al.169.
Recomendaciones sobre el tratamiento combinado antiagregante plaquetario y anticoagulante para pacientes con síndrome coronario agudo que requieren anticoagulación oral
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Está recomendada la prevención del ictus para pacientes con FA y al menos 1 factor de riesgo CHA2DS2-VASc no relacionado con el sexo (puntuación ≥ 1 los varones y ≥ 2 las mujeres). Para pacientes con 2 o más factores de riesgo CHA2DS2-VASc no relacionados con el sexo, está recomendada la ACO255–259 | I | A |
| Para pacientes con 1 factor de riesgo no relacionado con el sexo, se debe considerar la ACO y prescribir tratamiento individualizado dependiendo del beneficio clínico neto y teniendo en cuenta los valores y preferencias del paciente260–263 | IIa | B |
| Se debe considerar la realización temprana de angiografía coronaria a los pacientes con riesgo hemorrágico alto, independientemente de la exposición a ACO, para agilizar la asignación de tratamiento (tratamiento médico o ICP o CABG) y determinar el régimen antitrombótico óptimo | IIa | C |
| Pacientes sometidos a implante destents | ||
| Anticoagulación | ||
| Durante la ICP se recomienda la anticoagulación parenteral adicional, independientemente de la hora de la última dosis de NACO y si la INR es<2,5 para los pacientes tratados con AVK | I | C |
| Para pacientes con una indicación de ACO con AVK combinado con AAS o clopidogrel, se debe regular cuidadosamente la dosis de AVK con un objetivo para la INR de 2,0-2,5 y un tiempo en rango terapéutico>70%236,238–241 | IIa | B |
| Se debe considerar continuar la anticoagulación terapéutica con AVK o NACO durante la fase periprocedimiento | IIa | C |
| Tratamiento antiagregante plaquetario | ||
| Para pacientes con FA y una puntuación CHA2DS2-VASc ≥ 1 los varones y ≥ 2 las mujeres, tras un periodo corto de TAT (hasta 1 semana desde el evento agudo), está recomendado el TAD como estrategia estándar con un NACO a la dosis recomendada para la prevención del ictus y un antiagregante plaquetario oral (preferiblemente clopidogrel)238–241,244,245 | I | A |
| Se recomienda la administración periprocedimiento de TAPD con AAS y clopidogrel hasta 1 semana238–241,244,245 | I | A |
| Se recomienda interrumpir el tratamiento antiagregante plaquetario después de 12 meses de los pacientes tratados con un anticoagulante236–239,246 | I | B |
| Para pacientes tratados con un AVK (p. ej., pacientes con válvula cardiaca mecánica), se debe considerar la monoterapia con clopidogrel en algunos casos seleccionados (HAS-BLED ≥ 3 o pacientes que cumplen los criterios ARC-HBR y tienen riesgo bajo de trombosis del stent) durante 12 meses236 | IIa | B |
| Cuando se administra rivaroxabán y el riesgo hemorrágico alto prevalece sobre los riesgos de trombosis del stent o ictus isquémico, se debe considerar la administración de dosis de rivaroxabán de 15mg/día en lugar del 20mg/día mientras dure el tratamiento antiagregante en monoterapia o doble240,245 | IIa | B |
| Para pacientes con riesgo hemorrágico alto (HAS-BLED ≥ 3), se debe considerar la administración de dabigatrán 110mg/12h en lugar de 150mg/12h mientras dure el tratamiento antiagregante en monoterapia o doble para mitigar el riesgo hemorrágico238 | IIa | B |
| Para pacientes tratados con un anticoagulante, se debe considerar la administración de AAS y clopidogrel durante más de 1 semana y hasta 1 mes en los casos de riesgo isquémico alto u otras características anatómicas o del procedimiento que superen el riesgo hemorrágico (tabla 11) | IIa | C |
| Se puede considerar el TAD (con un anticoagulante y ticagrelor o prasugrel) como alternativa al TAT (con un anticoagulante, AAS y clopidogrel) para pacientes con riesgo moderado o alto de trombosis del stent, independientemente del tipo de stent implantado | IIb | C |
| No está recomendado el uso de ticagrelor o prasugrel como parte del TAT | III | C |
| Pacientes en tratamiento médico | ||
| Se debe considerar la administración de un antiagregante y un anticoagulante durante 1 año241,247 | IIa | C |
| Para pacientes con FA se puede considerar el tratamiento con apixabán 5mg/12h y un antiagregante plaquetario (clopidogrel) durante un mínimo de 6 meses241,247 | IIb | B |
AAS: ácido acetilsalicílico; ACI: angiografía coronaria invasiva; ACO: anticoagulación oral; ARC-HBR: Academic Research Consortium-High Bleeding Risk; AVK: antagonistas de la vitamina K; CABG: cirugía de revascularización coronaria; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 (doble), diabetes, ictus (doble)-enfermedad vascular, edad 65-74, sexo (mujer); FA: fibrilación auricular; HAS-BLED: hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, ancianos, drogas/alcohol; ICP: intervención coronaria percutánea; INR: razón internacional normalizada; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; TAD: tratamiento antitrombótico doble; TAPD: tratamiento antiagregante plaquetario doble; TAT: tratamiento antitrombótico triple.
Criterios de riesgo del tratamiento con un segundo fármaco antitrombótico
| Riesgo trombótico alto (clase IIa) | Riesgo trombótico moderado (clase IIb) |
|---|---|
| EC compleja y al menos un criterio | EC no compleja y al menos un criterio |
| Potenciadores de riesgo | |
| Diabetes mellitus que requiera medicación | Diabetes mellitus que requiera medicación |
| Antecedente de infarto de miocardio recurrente | Antecedente de infarto de miocardio recurrente |
| EC multivaso de cualquier tipo | Enfermedad vascular múltiple (EC más EAP) |
| Enfermedad vascular múltiple (EC más EAP) | ERC con TFGe de 15-59ml/min/1,73 m2 |
| EC prematura (edad<45 años) o de progresión acelerada (nueva lesión en un periodo de 2 años) | |
| Enfermedad inflamatoria sistémica concomitante (p. ej., virus de la inmunodeficiencia humana, lupus eritematoso sistémico, artritis crónica) | |
| ERC con TFGe de 15-59ml/min/1,73 m2 | |
| Aspectos técnicos | |
| Al menos 3 stents implantados | |
| Al menos 3 lesiones tratadas | |
| Longitud total del stent>60mm | |
| Antecedente de revascularización compleja (tronco común izquierdo, implante de 2 o más stents en bifurcación, oclusión crónica total, implante de stents en último vaso permeable) | |
| Antecedente de trombosis del stent en pacientes que reciben tratamiento antiagregante plaquetario |
EC: enfermedad coronaria; EAP: enfermedad arterial periférica; ERC: enfermedad renal crónica; TFGe: tasa de filtrado glomerular estimada.
En consonancia con las recomendaciones de las GPC, los pacientes con EC se clasifican en 2 grupos de riesgo diferentes (riesgo trombótico o isquémico alto frente a riesgo moderadamente aumentado). La clasificación de los pacientes en relación con la EC compleja o no compleja se basa en el juicio clínico individual que debe tener en cuenta la historia cardiovascular del paciente y/o la anatomía coronaria. La selección y la composición de los factores potenciadores del riesgo se basan en la evidencia obtenida en ensayos clínicos sobre el tratamiento antitrombótico extendido para pacientes con EC162,212,214 y en los datos de registros relacionados228–230.
Consulte el material adicional.
5.4.1Medidas generales de apoyoConsulte el material adicional.
5.4.2Complicaciones hemorrágicas durante el tratamiento antiagregante plaquetarioConsulte el material adicional.
5.4.3Complicaciones hemorrágicas durante el tratamiento con antagonistas de la vitamina KConsulte el material adicional.
5.4.4Complicaciones hemorrágicas durante el tratamiento con anticoagulantes orales no dependientes de la vitamina KConsulte el material adicional.
5.4.5Complicaciones hemorrágicas no relacionadas con la zona de acceso percutáneoConsulte el material adicional.
5.4.6Complicaciones hemorrágicas relacionadas con intervención coronaria percutáneaConsulte el material adicional.
5.4.7Complicaciones hemorrágicas relacionadas con la cirugía de revascularización coronariaConsulte el material adicional.
5.4.8TransfusiónConsulte el material adicional.
5.4.9Recomendaciones sobre el tratamiento del sangrado y transfusiones sanguíneas para pacientes anticoagulados con síndrome coronario agudo sin elevación del segmento ST.Consulte el material adicional.
6Tratamientos invasivos6.1Coronariografía y revascularización invasivasLa coronariografía permite saber si el dolor torácico está originado por isquemia miocárdica causada por una lesión culpable. En caso afirmativo, la lesión culpable se puede tratar después mediante ICP durante el mismo procedimiento o mediante CABG, dependiendo de la morfología de la lesión y el perfil de riesgo del paciente (véase la sección 6.4). En caso negativo, la exclusión de una lesión culpable abre el camino a pruebas diagnósticas adicionales que pueden revelar en último caso la causa del dolor torácico y la presencia de daño miocárdico (véase la sección 7). Sin embargo, la coronariografía conlleva cierto riesgo de complicaciones relacionadas con el procedimiento, que se debe tener en cuenta a la hora de tomar decisiones terapéuticas.
6.1.1Estrategia invasiva sistemática frente a una estrategia invasiva selectivaConsulte el material adicional. En la estrategia invasiva sistemática se considera que siempre se debe realizar angiografía invasiva, mientras que en la estrategia selectiva la angiografía invasiva solo se realiza en caso de síntomas recurrentes, si existe evidencia objetiva de isquemia inducible en pruebas no invasivas o se detecta EC obstructiva mediante ATC. Numerosos ensayos clínicos compararon la estrategia invasiva sistemática con la estrategia selectiva y varios metanálisis analizaron sus resultados en conjunto266–270. La evidencia disponible (véase el material adicional) indica que la estrategia invasiva sistemática:
- •
No reduce el riesgo de mortalidad por todas las causas en la población total de los pacientes con SCASEST.
- •
Aumenta el riesgo de complicaciones periprocedimiento, como el infarto de miocardio periprocedimiento y el sangrado.
- •
Reduce el riesgo de las variables compuestas que incluyen eventos isquémicos, particularmente en pacientes con riesgo alto.
Recomendaciones sobre el tratamiento de hemorragias y transfusiones sanguíneas para pacientes con síndrome coronario agudo sin elevación del ST anticoagulados
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para pacientes con hemorragia potencialmente mortal asociada con dabigatrán, se debe considerar la administración de un antídoto específico para el dabigatrán (idarucizumab)264 | IIa | B |
| Para pacientes con hemorragia potencialmente mortal asociada con AVK, se debe considerar la rápida reversión de la anticoagulación con un concentrado de complejo de protrombina de 4 factores, en lugar de plasma fresco congelado, o con factor VII recombinante activado. Además, se debe administrar repetidamente inyecciones i.v. lentas de 10mg de vitamina K | IIa | C |
| Para pacientes con hemorragia potencialmente mortal asociada con NACO, se debe considerar la administración de un concentrado de complejo de protrombina o complejo de protrombina activado si no se dispone de un antídoto específico | IIa | C |
| Para pacientes con hemorragia potencialmente mortal asociada con rivaroxabán, apixabán o edoxabán, se puede considerar la administración de un antídoto específico (andexanet-alfa)265 | IIb | B |
| Para pacientes con anemia y sin evidencia de hemorragia activa, se puede considerar la transfusión sanguínea en caso de deterioro hemodinámico, hematocrito<25% o concentración de hemoglobina<8g/dl | IIb | C |
i.v.: intravenoso; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K.
Sin embargo, esta evidencia se basa en estudios antiguos previos a la introducción de cambios relevantes relativos al diagnóstico y EL tratamiento, como el acceso radial, el uso de stents farmacoactivos (SFA) de última generación, la revascularización funcional completa en la EC multivaso, el TAPD moderno, el tratamiento hipolipemiante intensivo, las determinaciones contemporáneas de biomarcadores y los valores de corte para diagnosticar el infarto de miocardio espontáneo o periprocedimiento.
En resumen, los resultados de estudios clínicos y sus metanálisis subrayan el papel de la estratificación del riesgo en el proceso de toma de decisiones y respaldan la estrategia invasiva sistemática para los pacientes con riesgo alto.
6.1.2Planificación de la estrategia invasiva6.1.2.1Estrategia invasiva inmediata (< 2h)Normalmente se ha excluido de los ensayos clínicos a los pacientes con SCASEST y riesgo muy alto (con al menos uno de los factores de riesgo muy alto de la figura 9). Debido al mal pronóstico a corto y largo plazo si se deja a estos pacientes sin tratamiento, se recomienda seguir una estrategia invasiva inmediata (< 2h desde la llegada al hospital, similar al IAMCEST) con la intención de realizar la revascularización, independientemente del ECG o de los resultados de biomarcadores. Los centros sin un programa de ICP las 24h deben trasladar al paciente de inmediato.
Selección y planificación de la estrategia de tratamiento en los síndromes coronarios agudos sin elevación del segmento ST según la estratificación inicial del riesgo. GRACE: Global Registry of Acute Coronary Events; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICA: insuficiencia cardiaca aguda; ICP: intervención coronaria percutánea; RCP: reanimación cardiopulmonar; SCASEST: síndrome coronario agudo sin elevación del segmento ST; SEM: servicio de emergencias médicas. Escuche online la audioguía de esta figura.
La estrategia invasiva temprana se define como la coronariografía que se realiza durante las primeras 24h desde el ingreso en el hospital y está recomendada para los pacientes con riesgo alto según los criterios de la figura 9. En numerosos ensayos clínicos y metanálisis se ha investigado cuál es el momento más adecuado para realizar la coronariografía invasiva y la revascularización de los pacientes con SCASEST (figura 10 de este documento y tabla 3 del material adicional). Una limitación importante para la interpretación de los resultados de estos estudios es el cálculo del tiempo transcurrido hasta la realización de la angiografía invasiva, que en lugar de basarse en el momento en que aparece el dolor torácico o el del ingreso en el hospital, se basó en el momento de la aleatorización. Mientras que la angiografía invasiva se realizó prácticamente siempre en las primeras 24h desde la aleatorización en los grupos de estrategia invasiva temprana, el tiempo transcurrido desde la aleatorización hasta la angiografía invasiva fue más heterogéneo en los grupos de estrategia invasiva aplazada (figura 10). Los estudios más grandes, que incluyeron a más de 1.000 pacientes en cada grupo de tratamiento, son el TIMACS y el más reciente VERDICT271,272.
Intervalos de tiempo hasta la angiografía coronaria en los grupos asignados a estrategia invasiva temprana/inmediata incluidos en estudios clínicos271,272,279–287. Las barras representan los intervalo intercuartílicos y la media de los tiempos desde la aleatorización hasta la angiografía coronaria en el grupo de estrategia invasiva temprana (rojo) y aplazada (azul). Además, se describen los hallazgos más importantes de la variable principal de valoración con la estrategia invasiva temprana frente a la aplazada. Adaptada y actualizada de Jobs et al277. Basándose en el metanálisis de datos individuales de pacientes con concentraciones elevadas de biomarcadores, puntuación GRACE>140, edad>75 años y diabetes, se observó una reducción de la mortalidad con la estrategia invasiva temprana277. ABOARD: Angioplasty to Blunt the Rise of Troponin in Acute Coronary Syndromes Randomized for an Immediate or Delayed Intervention; CK-MB: creatincinasa miocárdica; EARLY: Early or Delayed Revascularization for Intermediate- and High-Risk Non-ST-Segment Elevation Acute Coronary Syndromes?; ELISA: Early or Late Intervention in unstable Angina; GRACE: Global Registry of Acute Coronary Events; ICP: intervención coronaria percutánea; ISAR-COOL: Intracoronary Stenting and Antithrombotic Regimen - Cooling off strategy; LIPSIA-NSTEMI: Leipzig Immediate versus early and late Percutaneous coronary Intervention trial in NSTEMI; MACE: eventos cardiacos adversos mayores; RIDDLE-NSTEMI: Randomized Study of Immediate Versus Delayed Invasive Intervention in Patients With Non-ST-Segment Elevation Myocardial Infarction; SISCA: Comparison of Two Treatment Strategies in Patients With an Acute Coronary Syndrome Without ST Elevation; TIMACS: Timing of Intervention in Patients with Acute Coronary Syndromes; VERDICT: Very Early vs Deferred Invasive evaluation using Computerized Tomography.
Se pueden extraer varios mensajes importantes de estos estudios:
- •
Entre los pacientes con SCASEST no seleccionados, la estrategia invasiva temprana no es superior a la estrategia aplazada con respecto a la variable clínica compuesta (tabla 3 del material adicional) 271,272.
- •
El beneficio de una estrategia invasiva temprana tiene una fuerte relación con el perfil de riesgo del paciente. En un análisis de subgrupos preespecificado, los pacientes con una puntuación GRACE>140 se beneficiaron de la estrategia invasiva temprana, mientras que los pacientes con una puntuación<140 no se beneficiaron (estudio TIMACS, HR=0,65; IC95%, 0,48-0,89; frente a HR=1,12; IC95% 0,81-1,56; pinteracción=0,01271; estudio VERDICT, HR=0,81, IC95%, 0,67-1,00; frente a HR=1,21; IC95%, 0,92-1,60; pinteracción=0,02)272. Con respecto a la escala GRACE, hay que señalar que en ambos estudios se calculó la escala GRACE original para la muerte hospitalaria (véase la figura 3 del material adicional)139. Debido al diferente peso de las variables, la puntuación de otras escalas GRACE (véase la tabla 1 del material adicional para más información) puede variar considerablemente en el mismo paciente, lo cual podría llevar a decisiones diferentes sobre el tratamiento. Además, en ambos estudios la escala GRACE se basó en las elevaciones de CK-MB o troponina cardiaca convencional. No se ha determinado el valor de una puntuación GRACE>140 para guiar el momento más adecuado de la angiografía invasiva y la revascularización en la era de la hs-cTn.
- •
El beneficio de una estrategia invasiva temprana no se modifica por la presencia de cambios en el segmento ST o las ondas T, a pesar del hecho de que la depresión del segmento ST se ha identificado consistentemente como un predictor de resultados adversos (figura 2 del material adicional).
En pacientes con una elevación transitoria del segmento ST y alivio de los síntomas, la estrategia invasiva inmediata no redujo el tamaño del infarto evaluado mediante RMC, comparada con una estrategia invasiva temprana273.
Varios metanálisis analizaron los datos conjuntos de numerosos ensayos clínicos que investigaron distintos intervalos de tiempo hasta la realización de angiografía invasiva (tabla 4 del material adicional). En ninguno de ellos se observó un beneficio de la estrategia invasiva temprana con respecto a las variables muerte, infarto de miocardio no mortal o ictus en pacientes con SCASEST no seleccionados274–278. Sin embargo, en un metanálisis colaborativo que comparó la estrategia invasiva inmediata o temprana frente a una estrategia aplazada mediante el análisis de datos individuales de pacientes, se observó un beneficio para la supervivencia de los pacientes con riesgo alto, aunque las pruebas para la interacción no fueron concluyentes277. Solo en el estudio VERDICT se investigó el impacto del tiempo transcurrido en la variable relativa a los ingresos hospitalarios por IC y se observó una tendencia hacia menos hospitalizaciones por IC a favor de la estrategia invasiva temprana (HR=0,78; IC95%, 0,60-1,01)272. Los metanálisis realizados observaron constantemente que la estrategia invasiva temprana se asocia con un menor riesgo de isquemia recurrente o refractaria e ingresos hospitalarios más cortos274–276,278. Teniendo en cuenta lo expuesto anteriormente, se recomienda la estrategia invasiva temprana para los pacientes que cumplen al menos un criterio de riesgo alto (figura 9).
6.1.2.3Estrategia invasiva selectivaA los pacientes sin síntomas recurrentes y sin ninguno de los criterios de riesgo alto o muy alto que se describen en las recomendaciones sobre el momento adecuado para la estrategia invasiva, se les debe considerar pacientes con riesgo bajo de eventos isquémicos agudos a corto plazo (figura 9). Para el tratamiento de estos pacientes, se debe seguir la GPC de la ESC 2019 sobre el diagnóstico y el tratamiento de los síndromes coronarios crónicos231. En este contexto, la ecocardiografía/RMC de estrés pueden ser preferibles a las pruebas anatómicas no invasivas109. Con la determinación sistemática de hs-cTn y el uso de algoritmos diagnósticos para la evaluación de los SCASEST se puede detectar daño miocárdico, aunque este sea muy leve. Por lo tanto, a los pacientes que anteriormente se consideraba que tenían un riesgo intermedio (p. ej., aquellos con historia de revascularización o diabetes mellitus), que ahora se desestima según el algoritmo diagnóstico basado en la hs-cTn, ahora se los debe considerar pacientes con riesgo bajo y aplicarles una estrategia invasiva selectiva1.
6.1.3Patrón de la enfermedad coronaria en el síndrome coronario agudo sin elevación del segmento STConsulte el material adicional.
6.1.4¿Cómo identificar la lesión culpable?Consulte el material adicional.
6.1.5Disección arterial coronaria espontáneaLa disección arterial coronaria espontánea (DACE) se define como la separación de origen no traumático, no ateroesclerótico ni iatrogénico de las capas de la pared arterial, secundaria a hemorragia de vasa vasorum o desgarro en la íntima, que crea una luz falsa, compresión coronaria e isquemia miocárdica por el flujo distal afectado288,289.
La disección coronaria espontánea causa hasta el 4% de los SCA, pero su incidencia es mucho más alta (un 22-35% de los SCA) en mujeres de edad<60 años, en el infarto de miocardio relacionado con el embarazo y en pacientes con historia de displasia fibromuscular, ansiedad, depresión o trastornos neurológicos o psiquiátricos previos290,291. La presentación clínica puede variar considerablemente, pero la elevación de biomarcadores cardiacos y el dolor torácico suele ser la presentación típica292. Se han descrito 3 tipos angiográficos de disección espontánea, que abarcan desde la ausencia de obstrucción a la oclusión completa de las arterias coronarias afectadas. La disección de tipo 1 (retención de contraste en la pared arterial con opacificación de varias luces vasculares) y la disección de tipo 2 (estrechamiento difuso, largo y uniforme) con arterias coronarias sin obstrucción (estenosis<50%) se describen como causas posibles del infarto de miocardio sin enfermedad obstructiva (MINOCA) (véase la sección 7), mientras que la disección de tipo 3 (estenosis focal o tubular que se asemeja a la ateroesclerosis) se debe considerar separadamente. Dado que la disección espontánea podría no ser visible o detectable en la ATC, no se debe descartar el diagnóstico basándose en una ATC negativa293. En caso de incertidumbre, la imagen intracoronaria (tomografía de coherencia óptica [OCT] y el ultrasonido intravascular [IVUS]) podría ser la opción más adecuada para probar la presencia de hematoma intramural o luz doble294. Esto podría ser fundamental para llegar a un diagnóstico correcto294.
El tratamiento óptimo de la disección coronaria espontánea no está claro, ya que ningún ensayo clínico ha comparado el tratamiento farmacológico frente a estrategias de revascularización. Los datos disponibles indican que, a excepción de los pacientes con un perfil de riesgo muy alto, el tratamiento conservador es la estrategia preferida295–297. La decisión de tratar siguiendo un enfoque farmacológico conservador o realizar ICP o CABG se debe tomar de forma individualizada y con base en factores clínicos y angiográficos. En la figura 11 se presenta un posible algoritmo de tratamiento. El tratamiento farmacológico óptimo para los pacientes con disección coronaria espontánea no se ha determinado todavía, pero dado que la hipertensión es un predictor independiente de disección recurrente292,295,298, se debe considerar un tratamiento antihipertensivo agresivo para garantizar el control adecuado de la presión arterial. Por su asociación con la reducción significativa del riesgo de eventos recurrentes, los bloqueadores beta son la clase preferida de fármacos antihipertensivos para este grupo de pacientes298.
Diagnóstico y tratamiento de los pacientes con síndrome coronario agudo sin elevación del segmento ST relacionado con disección arterial coronaria espontánea. ACI: angiografía coronaria invasiva; ATC: angiotomografía computarizada; CABG: cirugía de revascularización coronaria; DACE: disección arterial coronaria espontánea; EC: enfermedad coronaria; ICP: intervención coronaria percutánea; IVUS: ultrasonido intravascular; OCT: tomografía de coherencia óptica; TAPD: tratamiento antiagregante plaquetario doble; TMO: tratamiento médico óptimo.
aSelección de la estrategia de revascularización para pacientes con características anatómicas de riesgo alto según la experiencia del centro.
bSe recomienda el tratamiento con bloqueadores beta, mientras que el TAPD es cuestionable.
cDACE multivaso en tronco común izquierdo o descendente izquierda anterior proximal o circunfleja o coronaria derecha.
Escuche online la audioguía de esta figura.
No hay consenso sobre el beneficio del tratamiento antitrombótico en estos pacientes292,298, pero para los pacientes sometidos a ICP, se debe seguir el algoritmo de tratamiento antiagregante doble descrito en la sección 5. Para los pacientes con disección espontánea tratados farmacológicamente que presentan síntomas persistentes o recurrentes, incluso en ausencia de infarto de miocardio o isquemia recurrentes, se debe considerar la ATC en el seguimiento.
6.1.6Reserva fraccional de flujo, índice diastólico instantáneo sin ondas y otros índices en reposoConsulte el material adicional.
6.1.6.1Reserva fraccional de flujoLa reserva fraccional de flujo (RFF) es la prueba estándar para la evaluación funcional de las lesiones en pacientes con estenosis de grado intermedio (40-90%) sin evidencia de isquemia en pruebas no invasivas o en pacientes con enfermedad multivaso. La presencia de obstrucción microvascular299 puede llevar a subestimar la relevancia hemodinámica de la lesión culpable en los SCASEST 300. Sin embargo, la estimación en lesiones no culpables parece fiable cuando se toman como referencia mediciones de RFF ulteriores, la RMC de perfusión o la SPECT301–304. En pacientes con SCA, el aplazamiento de la revascularización basado en la RFF o en el índice diastólico instantáneo sin ondas (iFR) se asocia con peores resultados clínicos que en los pacientes con EC estable305–308. La inestabilidad persistente de las estenosis hemodinámicamente no significativas o la presencia de más de una lesión inestable indicarían un riesgo más alto.
La mayoría de los datos relacionados con el valor de la RFF en los SCASEST procede de subgrupos de registros y pequeños estudios aleatorizados (tabla 5 del material adicional). En el estudio FAMOUS-NSTEMI309, un número significativamente mayor de pacientes con IAMSEST se asignó a tratamiento farmacológico basándose en la RFF, comparado con los pacientes asignados a estrategia de ICP guiada por angiografía (el 22,7 frente al 13,2%; p=0,022). Esta estrategia de revascularización basada en la evaluación funcional parece que es segura y no tiene impacto en los resultados clínicos de los SCASEST. No obstante, son necesarios ECA con suficiente potencia y diseñados específicamente.
6.1.6.2Índice diastólico instantáneo sin ondas y otros índices en reposoRecientemente se ha renovado el interés por los índices derivados únicamente de gradientes en reposo (cociente de presión distal y presión proximal [Pd/Pa], iFR, reserva de flujo coronario [RFC], cociente de ciclo completo en reposo [RFR] o el índice de resistencia microcirculatoria). Dos grandes estudios aleatorizados mostraron resultados comparables entre la estrategia de revascularización guiada por RFF o por iFR en pacientes con estenosis de grado intermedio310,311. En estos estudios, los pacientes con SCA fueron un 15-17%, se evaluaron las lesiones no culpables y el seguimiento se limitó a 1 año. No hay datos de ensayos aleatorizados sobre otros índices en reposo distintos del iFR.
6.1.7Imagen intracoronariaDos métodos de imagen intracoronaria (IVUS y OCT) permiten la evaluación tomográfica en tiempo real del tamaño del vaso, el área de la luz, la composición y el volumen de la placa y el grado de expansión y cobertura del stent312.
En el estudio aleatorizado ULTIMATE, la ICP guiada por IVUS redujo el fallo del vaso diana a los 12 meses de la ICP, comparado con la ICP guiada por angiografía: el 2,9 frente al 5,4% respectivamente (HR=0,53; IC95%, 0,31-0,90; p=0,019)313. La revascularización de la lesión diana indicada clínicamente o la trombosis del stent confirmada fueron menos con la estrategia guiada por IVUS (el 1,2 frente al 2,6%; riesgo relativo [RR]=0,46; IC95%, 0,21-1,03; p=0,05). No obstante, solo el 12% de los pacientes incluidos tenían IAMCEST o SCASEST, lo cual limita su valor en el contexto de los SCASEST313.
La ICP guiada por OCT es segura y permite alcanzar un área mínima del stent similar a la ICP guiada por IVUS314. Además, la ICP guiada por OCT resulta en una mayor RFF tras la ICP que la ICP guiada por angiografía en los pacientes con SCASEST315. No obstante, son necesarios estudios con suficiente potencia para evaluar variables clínicas. En pacientes con MINOCA (véase la sección 7), la OCT es un instrumento diagnóstico para evaluar la disección coronaria espontánea, las erosiones y la rotura de la placa312.
6.2Tratamiento conservadorEl beneficio asociado con la revascularización coronaria de los pacientes con SCASEST está bien establecido, lo que ha llevado a que menos pacientes reciban tratamiento farmacológico solo (del 60% hace 2 décadas al 10-30% en la era contemporánea de la ICP)170,225,316–319. El tratamiento farmacológico incluye a los pacientes a los que no se practica revascularización coronaria y también a los que tienen EC extensa no tratable con revascularización o EC no obstructiva (MINOCA; véase la sección 7).
6.2.1Pacientes que no son candidatos a coronariografía invasivaSe trata de un grupo pequeño de pacientes cuyos datos de beneficio potencial de la estrategia invasiva son escasos. Dependiendo de diferencias específicas entre países y regiones geográficas, las razones para descartar la angiografía diagnóstica incluyen edad avanzada, sexo femenino, enfermedad renal crónica (ERC), diabetes mellitus, IC o revascularización previas, antecedente de cáncer y fragilidad170,225,316,318,319. Estas características se superponen en gran medida a los predictores de hemorragia y eventos isquémicos adversos320 y explican el mal pronóstico de esta población que tiene tasas de mortalidad hospitalaria de un 6-9% que ascienden al 20 y el 50% a los 6 meses y los 3 años respectivamente321.
El tratamiento médico se debe elegir tras una evaluación minuciosa del riesgo, recordando que la angiografía invasiva con acceso radial es un procedimiento de riesgo bajo, que el deterioro de la función del VI aumenta el riesgo de mortalidad y que la anatomía coronaria y la presencia de diabetes son factores importantes para la estratificación del riesgo y la elección del tratamiento farmacológico (véase las figuras 5-7). La edad avanzada y el sexo femenino por sí solos, en ausencia de comorbilidades graves o fragilidad, no son razones de peso para descartar la realización de una coronariografía; tampoco se debe denegar la coronariografía por cuestiones logísticas322,323.
6.2.2Pacientes con enfermedad coronaria no tratable mediante revascularizaciónLos pacientes con un diagnóstico de EC grave no tratable mediante ningún tipo de revascularización tienen un riesgo muy alto de eventos isquémicos recurrentes324. La mayoría de estos pacientes son mujeres, personas de edad avanzada o con ERC grave, EC multivaso e historia de infarto de miocardio o revascularización. La decisión de no realizar una ICP es un predictor independiente de mayor mortalidad cardiovascular, tanto en el hospital como a largo plazo188,318. Consecuentemente, la decisión de no intentar la revascularización solo se debe tomar en casos muy seleccionados y cuando haya consenso en que el riesgo es mayor que el beneficio basándose en factores clínicos o anatómicos. Estos pacientes deben recibir tratamiento agresivo de prevención secundaria con antiagregantes plaquetarios potentes (véase las figuras 5-8) y fármacos antianginosos, teniendo en cuenta también la presencia de comorbilidades325,326.
6.3Aspectos técnicos6.3.1Aspectos técnicos y retosLos aspectos técnicos más importantes de las ICP para los pacientes con SCASEST no difieren de la estrategia de evaluación y revascularización invasivas en otras manifestaciones de EC. Para los pacientes que ingresan con SCASEST considerados aptos para una ICP en uno o varios vasos, el implante de SFA de nueva generación es el tratamiento estándar159,327,328, mientras que no se ha demostrado el beneficio de la trombectomía en este contexto329,330. La combinación y la duración del tratamiento antitrombótico se describen en la sección 5.
6.3.2Acceso vascularLa realización de ICP en el momento adecuado y la administración de fármacos antitrombóticos potentes han reducido el riesgo isquémico de los pacientes con SCASEST. Sin embargo, este abordaje se asocia invariablemente con un riesgo hemorrágico aumentado, que afecta al pronóstico en la misma medida que las complicaciones isquémicas y se asocia con una menor supervivencia331–333. Entre los pacientes sometidos a ICP, el sangrado relacionado con el acceso vascular representa un 30-70% de todos los eventos hemorrágicos334. La evidencia acumulada muestra que la reducción de los sangrados relacionados con el acceso vascular empleando el acceso radial se traduce en beneficios clínicos significativos. Dos grandes estudios aleatorizados, el RIVAL (7.021 pacientes con SCA) y el MATRIX (8.404 pacientes con SCA)335,336, demostraron tasas significativamente más bajas de sangrado relacionado con el acceso vascular, reparación quirúrgica de la zona de acceso vascular y transfusión sanguínea con el acceso radial, comparado con el acceso femoral. Un metanálisis sobre la comparación por pares del acceso radial frente al acceso femoral en todo el espectro de pacientes con EC, incluido el seguimiento a los 30 días del estudio MATRIX, mostró una reducción significativa de hemorragias mayores, muerte, infarto de miocardio o ictus y mortalidad por todas las causas a favor del acceso radial337. Aunque este efecto desapareció al año de seguimiento, la tasa de eventos clínicos adversos netos siguió siendo más baja con el acceso radial que con el acceso femoral336. Por lo tanto, está recomendado el acceso radial como estrategia preferida para los pacientes con SCASEST a quienes se practica una angiografía invasiva, seguida de ICP o no. No obstante, dependiendo de la situación hemodinámica durante la ICP inicial y de aspectos técnicos del procedimiento, se podría elegir selectivamente el acceso femoral en lugar del acceso radial.
6.3.3Estrategias de revascularizaciónSegún datos de estudios observacionales sobre pacientes con SCASEST, para lograr el beneficio de una intervención temprana (comparada con un tratamiento conservador), puede ser necesaria una estrategia de revascularización completa, independientemente de la posibilidad de identificar y tratar la lesión culpable268,277,338–340. Recientemente, los datos sobre ICP de la base de datos de la British Cardiac Intervention Society mostraron tasas acumuladas de mortalidad significativamente más bajas con la revascularización completa en un solo procedimiento comparado con la ICP únicamente de la lesión culpable (el 22,5 frente al 25,9%; p=0,0005) durante un seguimiento medio de 4,1 [intervalo intercuartílico, 2,2-5,8] años en 21.857 pacientes con SCASEST y EC multivaso sometidos a ICP. Este beneficio a largo plazo se mantuvo a pesar del aumento inicial de la mortalidad hospitalaria asociada con la revascularización completa en un solo procedimiento (el 2,3 frente al 1,5%; p=0,002)341. Es necesario investigar si este aumento inicial del riesgo de la revascularización completa en un solo procedimiento se podría reducir con la revascularización completa en varios procedimientos.
Al contrario que en el contexto de los IAMCEST342–344, en pacientes con SCASEST solo se ha realizado un estudio aleatorizado que evaluó específicamente el papel de la ICP de la enfermedad multivaso realizada en un solo procedimiento frente a varios procedimientos (estudio SMILE)345. La revascularización coronaria completa en un solo procedimiento se asoció con menos eventos cardiovasculares y cerebrovasculares adversos mayores (definidos como muerte cardiaca, muerte por todas las causas, reinfarto, rehospitalización por angina inestable, repetición de la revascularización coronaria e ictus al año), comparada con la revascularización coronaria completa en varios procedimientos durante la hospitalización inicial (HR=0,55; IC95%, 0,36-0,83; p=0,004)345. Este beneficio estuvo determinado en gran medida por una reducción significativa de la repetición de la revascularización con la ICP multivaso en un solo procedimiento (HR=0,52; IC95%, 0,31-0,88; p=0,01)345. Sin embargo, dado que en algunos pacientes con anatomía coronaria compleja el intento de revascularización completa puede aumentar el riesgo de la ICP o requerir CABG, y debido a que no hay datos clínicos firmes, la decisión sobre la necesidad de revascularización completa y el momento más adecuado para realizarla se debe tomar teniendo en cuenta la importancia funcional de todas las estenosis, la edad, el estado general del paciente, las comorbilidades y la función del VI. Además, en la elección de la modalidad de revascularización hay que tener en cuenta también las preferencias del paciente. Para los pacientes con SCASEST que ingresan en shock cardiogénico, los datos de estudios aleatorizados no apoyan la ICP sistemática de la enfermedad multivaso (véase la sección 8.1)346.
6.4Cirugía de revascularización coronariaAproximadamente el 5-10% de los pacientes con SCASEST requieren CABG347, y estos pacientes representan un grupo complejo por sus características de riesgo alto comparados con los pacientes sometidos a CABG electiva. Debido a que no hay datos de estudios aleatorizados, el momento óptimo para la CABG no urgente en pacientes con SCASEST se debe determinar de manera individualizada348. El riesgo de eventos isquémicos, posiblemente relacionados con un tratamiento antiagregante plaquetario insuficiente mientras se espera a la cirugía es<0,1%, mientras que las complicaciones hemorrágicas periprocedimiento asociadas con la inhibición plaquetaria es>10%349. Para los pacientes con isquemia o inestabilidad hemodinámica y una indicación de CABG, se debe indicar cirugía urgente y no aplazar el procedimiento debido a la exposición al tratamiento antiagregante plaquetario.
En caso de realizarse la CABG, se debe evitar en la medida de lo posible la manipulación de la aorta y la circulación extracorpórea si hay calcificación en la aorta o el paciente tiene riesgo alto; asimismo, se debe realizar una revascularización completa y utilizar mediciones de flujo en los injertos realizados.
6.5Intervención coronaria percutánea frente a cirugía de revascularización coronariaNo se han realizado estudios aleatorizados para comparar la ICP con la CABG en el contexto específico de los SCASEST. En el análisis de los datos individuales de los pacientes incluidos en los estudios BEST, PRECOMBAT y SYNTAX, que compararon la ICP frente a la CABG, de los 3.280 pacientes con EC multivaso o enfermedad del tronco común izquierdo, solo 77 pacientes (2,2%) ingresaron por IAMSEST y 1.169 (35,7%), por angina inestable350. En los pacientes con SCASEST, el riesgo de muerte, infarto de miocardio o ictus se redujo significativamente con la CABG que con la ICP en el seguimiento a los 5 años (HR=0,74; IC95%, 0,56-0,98; p=0,036). Esta diferencia se produjo por una reducción de las tasas de infarto de miocardio con CABG (el 3,8 frente al 7,5%; HR=0,50; IC95%, 0,31-0,82, p=0,006)350. En un análisis poblacional, el beneficio de la CABG frente a la ICP se confirmó en pacientes con diabetes que ingresaron por SCA. A los 3 años de seguimiento, la incidencia combinada de mortalidad por todas las causas, infarto de miocardio no mortal o ictus no mortal fue más baja con CABG que con ICP (el 20,8 frente al 33,4%; p<0,01)351. En total, la evidencia recabada en los estudios mencionados no es suficiente para apoyar una u otra estrategia de revascularización, especialmente para los pacientes con SCASEST.
La evidencia disponible hoy indica indirectamente que los criterios aplicados a los pacientes con EC estable para guiar la decisión sobre la modalidad de revascularización (GPC de ESC/EACTS 2018 sobre revascularización miocárdica)205 se deben aplicar a los pacientes con SCASEST estabilizados, particularmente aquellos con diabetes350–354.
Para casos complejos, se recomienda la valoración del equipo cardiológico y el uso de la escala SYNTAX por su capacidad de predicción de muerte, infarto de miocardio y revascularización de los pacientes con SCASEST y enfermedad multivaso que se someten a una ICP355. Además, se recomienda calcular la escala de la Society of Thoracic Surgeons (STS) para evaluar la mortalidad hospitalaria y a los 30 días y la morbilidad hospitalaria tras la CABG en pacientes con riesgo alto356. Las características clínicas y anatómicas que favorecen a la CABG son la diabetes, la FEVI reducida (< 40%), las contraindicaciones para el TAPD, la reestenosis del stent difusa y recurrente, las características anatómicas y los aspectos técnicos que indican una revascularización incompleta con ICP y la necesidad de cirugía cardiovascular concomitante. Entre los factores que favorecen a la ICP, se incluyen características clínicas y anatómicas, como una comorbilidad grave (no se refleja en las escalas), la edad avanzada, la fragilidad o la esperanza de vida reducida, la movilidad restringida, las enfermedades que afectan al proceso de rehabilitación, las características anatómicas y los aspectos técnicos que indican una revascularización incompleta con CABG, como la mala calidad o ausencia de conductos, una deformación torácica muy acusada o escoliosis, las secuelas de la radiación torácica y la aorta de porcelana.
6.6Situaciones específicas6.6.1Tratamiento de los pacientes con isquemia miocárdicaEstos pacientes se caracterizan por tener un riesgo de IAMCEST inminente, desarrollo de arritmias potencialmente mortales, IC aguda y shock cardiogénico. Se deben practicarles una coronariografía en las primeras 2h tras el ingreso en el hospital con la intención de revascularizar. Según datos publicados, esta estrategia reduce la mortalidad hospitalaria y a corto y medio plazo281,357, además de reducir el riesgo de un nuevo infarto de miocardio durante el periodo de espera al cateterismo y el ingreso hospitalario278.
6.6.2Tratamiento de los pacientes en parada cardiacaLos pacientes con SCASEST reanimados de una parada cardiaca requieren un tratamiento individualizado que depende de su estado hemodinámico y neurológico.
En la parada cardiaca extrahospitalaria sin elevación del segmento ST ni shock cardiogénico, la estrategia invasiva inmediata por sistema no fue superior a la estrategia invasiva aplazada, como se demostró recientemente en el estudio aleatorizado COACT278. El estudio incluyó a 552 pacientes reanimados tras una parada cardiaca extrahospitalaria que no tenían signos de IAMCEST. No se observaron diferencias en la supervivencia a los 90 días entre las 2 estrategias, el 64,5% con la angiografía inmediata frente al 67,2% con la angiografía aplazada (OR=0,89; IC95%, 0,62-1,27; p=0,51)358. Por lo tanto, parece razonable retrasar la angiografía invasiva de los pacientes con SCASEST358. Sin embargo, varios estudios en desarrollo podrían mostrar un posible beneficio de la estrategia invasiva temprana359.
En el caso de supervivientes comatosos, se debe realizar inmediatamente una ecocardiografía para la evaluación de un diagnóstico diferencial. Cuando se sospeche disección aórtica o embolia pulmonar, está recomendada la TC360,361.
6.7Recomendaciones sobre la revascularización coronariaRecomendaciones sobre revascularización coronaria
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Momento adecuado para la estrategia invasiva | ||
| Se recomienda una estrategia invasiva inmediata (< 2h) para pacientes con al menos uno de los siguientes criterios de riesgo muy alto:• Inestabilidad hemodinámica o shock cardiogénico• Dolor torácico recurrente o refractario a tratamiento médico• Arritmias potencialmente mortales• Complicaciones mecánicas del infarto de miocardio• Insuficiencia cardiaca relacionada claramente con el SCASEST• Depresión del segmento ST>1mm en al menos 6 derivaciones, además de la elevación del segmento ST en aVR o V1 | I | C |
| Se recomienda una estrategia invasiva temprana (< 24h) para pacientes con al menos uno de los siguientes criterios de riesgo alto:• Diagnóstico de IAMSEST según el algoritmo diagnóstico propuesto en la sección 3• Cambios dinámicos contiguos o presumiblemente nuevos en el segmento ST/T indicativos de isquemia• Elevación transitoria del segmento ST273,362• Puntuación GRACE>140271,272,277 | I | A |
| Se recomienda una estrategia invasiva selectiva tras la realización de pruebas de isquemia o la detección de EC obstructiva mediante ATC para pacientes con riesgo bajo267,268,363 | I | A |
| Se debe considerar el aplazamiento de la angiografía, en contraposición a la angiografía inmediata, para los pacientes sin elevación del segmento ST hemodinámicamente estables y reanimados con éxito tras una parada cardiaca extrahospitalaria358,364 | IIa | B |
| Aspectos técnicos | ||
| Está recomendado el acceso radial como estrategia estándar, excepto cuando haya contraindicaciones importantes336,337 | I | A |
| Se recomiendan los SFA en lugar de los stents sin recubrir para cualquier ICP, independientemente de:• La presentación clínica• El tipo de lesión• Cirugía no cardiaca planificada• Duración del TAPD prevista• Tratamiento anticoagulante concomitante354,365,366 | I | A |
| La estrategia de revascularización (ICP ad hoc de la lesión culpable, ICP multivaso, CABG) debe estar basada en el estado clínico del paciente, las comorbilidades y la extensión de la enfermedad (distribución y características angiográficas de la lesión —puntuación SYNTAX—), de acuerdo con los principios de la EC estable350. La decisión sobre la ICP inmediata de la estenosis culpable no requiere la valoración del equipo cardiológico | I | B |
| Se debe considerar la revascularización completa en los pacientes con SCASEST, sin shock cardiogénico y con EC multivaso | IIa | C |
| Se debe considerar la imagen intracoronaria para el diagnóstico de DACE si se sospecha | IIa | C |
| Se puede considerar la revascularización completa durante la ICP inicial de los pacientes con SCASEST y enfermedad multivaso345 | IIb | B |
| Se puede usar la RFF para guiar la revascularización de una lesión no culpable en los SCASEST durante la ICP inicial302 | IIb | B |
ATC: angiotomografía computarizada; CABG: cirugía de revascularización coronaria; DACE: disección arterial coronaria espontánea; EC: enfermedad coronaria; GRACE: Global Registry of Acute Coronary Events; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; RFF: reserva fraccional de flujo; SCASEST: síndrome coronario agudo sin elevación del segmento ST; SFA: stents farmacoactivos; SYNTAX: Synergy between PCI with Taxus and cardiac surgery; TAPD: tratamiento antiagregante plaquetario doble.
Aunque el IAM sin EAC significativa se comunicó por primera vez hace casi 80 años367 y en 2006 se describieron resultados definitivos368, el término MINOCA solo se ha empezado a usar recientemente para referirse a estos pacientes369. El término MINOCA se emplea inicialmente en el momento de la angiografía como parte del proceso diagnóstico hasta que mediante pruebas adicionales se pueda descartar otras causas posibles de la elevación de troponina cardiaca. Esta clasificación incorpora un grupo heterogéneo de causas que pueden incluir enfermedades coronarias y no coronarias, y entre estas últimas, trastornos cardiacos y extracardiacos370. Comparados con los pacientes con EC obstructiva, los pacientes con SCASEST y diagnóstico de MINOCA probablemente sean más jóvenes y con más frecuencia mujeres, mientras que es menos probable en pacientes con diabetes, hipertensión o dislipemia371,372, lo cual indica que las etiologías no relacionadas con la ateroesclerosis y los factores de riesgo frecuentes o infrecuentes, como factores psicosociales, resistencia a la insulina e inflamación, tienen un papel predominante373. Sin embargo, todos los estudios que evaluaron el pronóstico de los pacientes con MINOCA son considerablemente heterogéneos en cuanto a los criterios de inclusión, la medición de variables de valoración y la duración del seguimiento; algunos comunican la prevalencia de variables principales, como la mortalidad o el reinfarto374,375, pero pocos informan sobre las variables de valoración de las poblaciones con MINOCA y EC376. Aunque, comparados con los pacientes con SCA y EC obstructiva, el pronóstico es mejor371,372,376–379, los pacientes con MINOCA tienen menos supervivencia que los individuos sanos emparejados por edad y sexo371,372,376–379. Cabe destacar que se ha observado un exceso de eventos adversos en el seguimiento a corto y a largo plazo371,372,376–379.
El término MINOCA se ha usado ampliamente en el pasado, pero a menudo erróneamente, lo cual limita la descripción, el diagnóstico y el tratamiento de la enfermedad. A pesar del documento contemporáneo de posición de la ESC y la AHA, existe una gran variabilidad en el diagnóstico y el tratamiento de los pacientes con sospecha de MINOCA380,381. Las estrategias diagnósticas y terapéuticas implementadas dependen a menudo de la práctica local en la que no se siguen protocolos estandarizados y, por ello, varían ampliamente.
En su declaración de posición sobre MINOCA, la ESC propone los siguientes criterios380:
- •
Criterios del IAM definidos en la Tercera definición universal del infarto de miocardio369.
- •
Arterias coronarias no obstruidas según criterios angiográficos, sin lesiones ≥ 50% en un vaso epicárdico mayor.
- •
Ninguna otra causa clínica específica y manifiesta que se pueda considerar como una causa alternativa de la presentación aguda.
Basándose en esta definición de la ESC, se ha clasificado a los pacientes con miocarditis o síndrome de tako-tsubo, entre otras entidades no isquémicas, como pacientes con MINOCA380.
Un aspecto fundamental para la definición de MINOCA es el diagnóstico de infarto de miocardio con elevación de biomarcadores cardiacos, típicamente elevación de troponina cardiaca superior al percentil 99 del límite superior de la normalidad, con caídas o elevaciones en determinaciones seriadas. Aunque las concentraciones de troponina cardiaca aumentadas indican daño miocárdico con la liberación de esta proteína intracelular en la circulación sistémica, el proceso no es específico de una enfermedad y puede ocurrir por mecanismos isquémicos o no isquémicos.
La declaración científica más reciente de la AHA, la «Cuarta definición universal del infarto de miocardio», proporciona una definición formal y actualizada para el término MINOCA381. En la tabla 14 se encuentran los criterios actuales para la definición de MINOCA, de la que por consenso se excluyen la miocarditis y el síndrome de tako-tsubo del diagnóstico final de MINOCA381. Curiosamente, en algunos pacientes, el síndrome de tako-tsubo se puede desencadenar por el infarto de miocardio con o sin elevación del segmento ST382. Con respecto a este síndrome, no hay datos de estudios aleatorizados que apoyen un tratamiento específico y, por lo tanto, las recomendaciones se basan en la opinión de expertos383.
Criterios diagnósticos del infarto de miocardio sin enfermedad coronaria obstructiva (MINOCA)
| El diagnóstico de MINOCA se realiza en pacientes con IAM que cumplen los siguientes criterios: |
| IAM (criterios modificados de la «Cuarta definición universal de infarto de miocardio»):• Detección de una elevación o una caída de troponina cardiaca con al menos un valor por encima del percentil 99 del límite superior de referencia y• Evidencia clínica de infarto corroborada por uno de los siguientes:–Síntomas de isquemia miocárdica–Nuevos cambios isquémicos electrocardiográficos–Desarrollo de ondas Q patológicas–Evidencia detectada por imagen de nueva pérdida de miocardio viable o anomalía en la motilidad de la pared con un patrón compatible con una causa isquémica–Identificación de un trombo coronario mediante angiografía o autopsia |
| • Arterias coronarias no obstruidas en la angiografía:–Definida como la ausencia de enfermedad obstructiva en la angiografía (ausencia de estenosis coronaria>50%) en cualquier vaso epicárdico importante*Esto incluye a pacientes con:–Arterias coronarias normales (ausencia de estenosis angiográfica)–Irregularidades luminales leves (estenosis angiográfica<30%)–Lesiones coronarias ateroescleróticas moderadas (estenosis>30% pero<50%) |
| • Ausencia de un diagnóstico alternativo para la presentación clínica:–El diagnóstico alternativo incluye pero no se limita a causas no isquémicas como sepsis, embolia pulmonar y miocarditis |
IAM: infarto agudo de miocardio; MINOCA: infarto de miocardio sin enfermedad coronaria obstructiva.
La definición también proporciona un marco clínico y algoritmos útiles para la evaluación diagnóstica y el tratamiento de estos pacientes, basándose fundamentalmente en el esquema clínico «de semáforo» (figura 12).
Algoritmo diagnóstico para la enfermedad coronaria no obstructiva basado en el «esquema de semáforo»: el color rojo indica un diagnóstico alternativo sin necesidad de pruebas adicionales; el color amarillo, un proceso diagnóstico inicial que puede concluir con un diagnóstico final de MINOCA o con un diagnóstico alternativo, y el verde, un diagnóstico final de MINOCA. DACE: disección arterial coronaria espontánea; EC: enfermedad coronaria; eco: ecocardiograma; IVUS: ultrasonido intravascular; LSN: límite superior de la normalidad; MINOCA: infarto de miocardio sin enfermedad coronaria obstructiva; OCT: tomografía de coherencia óptica; RMC: resonancia magnética cardiaca; VI: ventrículo izquierdo.
Escuche online la audioguía de esta figura.
Dependiendo del diagnóstico inicial, se debe realizar con prontitud la evaluación de la movilidad de la pared del VI en la fase aguda, mediante angiografía o ecocardiografía (según la función renal). Las anomalías en la movilidad regional de la pared pueden indicar una causa epicárdica para el MINOCA o identificar otras causas específicas que llevarían a descartar este diagnóstico. La RMC es una técnica clave para el diagnóstico diferencial del síndrome de tako-tsubo384, la miocarditis385,386 o el infarto de miocardio verdadero387. La RMC tiene la capacidad de identificar la causa subyacente en el 87% de los pacientes con MINOCA388. En el subendocardio, el realce tardío de gadolinio puede indicar una causa isquémica, mientras que una localización subepicárdica puede indicar miocardiopatías o miocarditis, y la ausencia de realce tardío de gadolinio con edema y anomalías específicas de la movilidad de la pared es un signo distintivo del síndrome de tako-tsubo387,388. En un metanálisis de 5 estudios que incluyeron a 556 pacientes con un diagnóstico inicial de MINOCA, se identificó mediante RMC la miocarditis como causa principal en el 33% de los pacientes389.
Cuando se sospeche espasmo coronario o microvascular, se puede emplear un test de provocación con acetilcolina o ergonovina390,391. La imagen intracoronaria por IVUS392 o OCT393,394 también puede ser útil para identificar causas que no se detectaron en la angiografía, especialmente cuando se sospecha de la presencia de trombos, rotura o erosión de la placa o disección coronaria espontánea.
La embolia pulmonar también puede ser un diagnóstico alternativo de daño miocárdico y este diagnóstico se puede descartar mediante la determinación de dímero D y BNP o ATC pulmonar361, según proceda. Además, se deben considerar otras entidades que comportan un desajuste entre el aporte y la demanda miocárdica de oxígeno o la elevación de troponina cardiaca como causas potenciales de daño miocárdico, como crisis hipertensivas, taquiarritmias, sepsis, anemia grave y contusión cardiaca, entre otras.
Los pacientes con un diagnóstico inicial de MINOCA y una causa subyacente identificada durante el proceso diagnóstico deben recibir tratamiento y seguimiento según las GPC del diagnóstico específico. Por ejemplo, los pacientes con MINOCA que reciben el alta con un diagnóstico final de SCASEST o MINOCA de etiología desconocida deben tener un seguimiento similar al de los pacientes con SCA y EC obstructiva.
Sin embargo, en un 8-25% de los pacientes no se logra identificar la causa del MINOCA a pesar de un proceso diagnóstico completo5,380,395. Esta entidad, identificada como «infarto de miocardio de causa desconocida o no determinada», representa un dilema terapéutico. El tratamiento debe estar dirigido a las causas más probables del MINOCA con pruebas de provocación y RMC negativas, concretamente angina vasoespástica, rotura de la placa coronaria y tromboembolia. Se debe considerar el beneficio del TAPD (AAS más un inhibidor del P2Y12) basándose en aspectos fisiopatológicos, aunque la evidencia es escasa. Se puede proponer el tratamiento con AAS, estatinas, inhibidores de la enzima de conversión de la angiotensina (IECA)/antagonistas del receptor de la angiotensina II (ARA-II) y bloqueadores de los canales del calcio (si aún se sospecha vasoespasmo) como tratamiento habitual396. Estos fármacos han mostrado efectos beneficiosos significativos a largo plazo en términos de mortalidad por todas las causas (estatinas, bloqueadores beta), muerte cardiovascular (estatinas), IAM (bloqueadores beta), ictus (estatinas) y MACE (estatinas, IECA/ARA-II) a los 12 meses en un registro nacional397. No obstante, en este registro no se aplicaron los criterios actualizados para el MINOCA397, por lo que las conclusiones deben interpretarse con precaución.
Recomendaciones sobre el infarto de miocardio sin enfermedad coronaria obstructiva
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| En todos los pacientes con un diagnóstico inicial de MINOCA se recomienda seguir un algoritmo diagnóstico que permita diferenciar este diagnóstico de otros alternativos | I | C |
| Se recomienda realizar RMC a todos los pacientes con MINOCA sin una causa subyacente obvia370 | I | B |
| En caso de diagnóstico inicial de MINOCA que finalmente se relaciona con una causa subyacente, se recomienda tratar al paciente según la guía específica de cada enfermedad | I | C |
| Los pacientes con un diagnóstico definitivo de MINOCA de causa desconocida pueden recibir tratamiento según la guía sobre prevención secundaria de la enfermedad ateroesclerótica | IIb | C |
MINOCA: infarto de miocardio sin enfermedad coronaria obstructiva; RMC: resonancia magnética cardiaca.
La IC aguda es una complicación frecuente de los SCASEST y se asocia con un aumento de 2-3 veces del riesgo de muerte hospitalaria respecto a los SCASEST sin IC aguda398–401.
El diagnóstico de los SCASEST en el contexto de la IC aguda es complejo debido a que: los pacientes pueden presentar dolor torácico, el daño miocárdico con elevación de troponina cardiaca puede ocurrir en ausencia de EC obstructiva3 y el ECG puede no ser interpretable (bloqueo completo de rama o marcapasos)402. En consecuencia, podría ser necesaria una angiografía para establecer el diagnóstico de SCASEST.
Se deben seguir las recomendaciones actuales de las guías para el tratamiento de la IC aguda403,404. Se debe realizar ecocardiografía urgente para obtener información sobre FEVI, alteraciones de la movilidad regional de la pared, función del ventrículo derecho, presencia de enfermedad valvular y carga de volumen96,205,405. La estrategia de revascularización debe basarse en la anatomía coronaria, la función del VI, las comorbilidades, la importancia funcional de las estenosis y el riesgo quirúrgico estimado según el consenso del equipo cardiológico y las recomendaciones actuales205.
La incidencia de shock cardiogénico es de alrededor del 4% de los pacientes con SCASEST406,407. La isquemia relacionada con IC, la insuficiencia mitral (IM) aguda grave y las complicaciones mecánicas son las causas desencadenantes más importantes. Se debe trasladar a estos pacientes lo antes posible a un centro terciario donde se pueda realizar una coronariografía. Para los pacientes que lleguen directamente a un centro terciario, está indicada la coronariografía inmediata y la ICP, si procede. Casi el 80% de estos pacientes presentan EC multivaso. Los resultados del estudio CULPRIT-SHOCK408 muestran que las lesiones no culpables no se deben tratar inmediatamente por sistema y que la estrategia de ICP inmediata se debe limitar a la lesión culpable únicamente. La estrategia de ICP solo de la lesión culpable llevó a una reducción significativa de la mortalidad por todas las causas y de la terapia de reemplazo renal a los 30 días; estos datos apoyan la estrategia de ICP de la lesión culpable seguida de la posible revascularización posterior en varios procedimientos (RR=0;83; IC95%, 0,71-0,96)408. El riesgo de mortalidad por todas las causas a los 30 días fue significativamente más bajo con la estrategia de ICP de la lesión culpable que con la ICP multivaso inmediata (RR=0,84; IC95%, 0,72-0,98; p=0,03). Los resultados de la variable compuesta se mantuvieron al año de seguimiento, mientras que la diferencia en la mortalidad se limitó fundamentalmente a los primeros 30 días346,408.
Para los pacientes con anatomía coronaria no tratable mediante ICP, está indicada la CABG urgente.
Se puede considerar el uso de dispositivos percutáneos de asistencia circulatoria mecánica u oxigenador extracorpóreo de membrana (ECMO) venoarterial en algunos pacientes seleccionados, dependiendo de la edad, las comorbilidades, la función neurológica y la gravedad del shock cardiogénico. Actualmente se están desarrollando varios ECA (véase la tabla 6 del material adicional). Hasta ahora no se ha demostrado beneficio en supervivencia con estos dispositivos comparados con el balón de contrapulsación intraaórtico (BCIA)409,410. En un registro retrospectivo que incluyó a 48.306 pacientes hemodinámicamente inestables (el 44% con IAMSEST) sometidos a ICP, se observaron tasas más altas de mortalidad y hemorragias con el dispositivo Impella comparado con un BCIA411. Se observaron resultados similares en otro registro sobre pacientes en shock cardiogénico en los que el dispositivo Impella se asoció con más complicaciones y mayor mortalidad incluso después del ajuste por tendencia412.
Como se demostró en el estudio IABP-SHOCK II, el BCIA no reduce la mortalidad a los 30 días, a 1 año o a los 6 años413–415. Por lo tanto, no está recomendado el uso sistemático de BCIA, pero se debe considerarlo en caso de complicaciones mecánicas relacionadas con los SCA.
Para los pacientes con SCASEST e IC estabilizada, están indicados los tratamientos farmacológicos basados en la evidencia, como bloqueadores beta, IECA o ARA-II y antagonistas del receptor de mineralocortidoides, siguiendo las recomendaciones de la GPC vigente404.
Recomendaciones para pacientes con SCASEST e insuficiencia cardiaca o shock cardiogénico
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Está recomendada la coronariografía urgente para pacientes con SCA complicado por shock cardiogénico205,416,417 | I | B |
| Se recomienda la ICP urgente de la lesión culpable para pacientes en shock cardiogénico causado por SCASEST, independientemente del tiempo transcurrido desde la presentación de los síntomas, siempre que la anatomía coronaria sea adecuada para ICP205,417 | I | B |
| Se recomienda la CABG urgente para los pacientes en shock cardiogénico si la anatomía coronaria no es adecuada para ICP205,417 | I | B |
| Se recomienda la ecocardiografía urgente para evaluar la función del VI y la función valvular y descartar complicaciones mecánicas | I | C |
| En caso de inestabilidad hemodinámica, se recomienda la reparación quirúrgica o percutánea de las complicaciones mecánicas del SCA, según la valoración del equipo cardiológico | I | C |
| En caso de complicaciones mecánicas del SCASEST, se debe considerar el BCIA | IIa | C |
| Para pacientes seleccionados con SCA y shock cardiogénico, se puede considerar la asistencia circulatoria mecánica a corto plazo dependiendo de la edad del paciente, comorbilidades, función neurológica, esperanza de vida y la calidad de vida estimada | IIb | C |
| No está recomendado el uso sistemático de BCIA para pacientes en shock cardiogénico causado por SCA y sin complicaciones mecánicas413–415 | III | B |
| No está recomendada la revascularización inmediata sistemática de lesiones no culpables para los pacientes con SCASEST y enfermedad multivaso que se presentan en shock cardiogénico346,408 | III | B |
BCIA: balón de contrapulsación intraaórtico; CABG: cirugía de revascularización coronaria; ICP: intervención coronaria percutánea; SCA: síndrome coronario agudo; SCASEST: síndrome coronario agudo sin elevación del segmento ST; VI: ventrículo izquierdo.
Los pacientes con diabetes presentan síntomas atípicos más frecuentemente que los pacientes sin diabetes. Más frecuentemente tienen EC multifocal418, reciben atención médica basada en las GPC con menos frecuencia y tienen peores resultados clínicos419. Sin embargo, la selección del tratamiento antitrombótico y la estrategia invasiva no debe ser diferente que para los pacientes sin diabetes. Los inhibidores plaquetarios potentes, comparados con el clopidogrel, se asocian con una mayor reducción absoluta del riesgo en los pacientes con diabetes420,421.
En el momento del ingreso está recomendado evaluar el estado glucémico de todos los pacientes con SCASEST, tengan o no antecedentes de diabetes, y monitorizar frecuentemente el estado glucémico de los pacientes con diabetes o hiperglucemia. Debido a que durante la fase aguda se puede producir hiperglucemia, esto puede llevar a un diagnóstico falso positivo de diabetes. Por ello, el diagnóstico de diabetes se debe confirmar después del alta hospitalaria. Los pacientes críticos están en riesgo de eventos relacionados con la hipoglucemia cuando se administra tratamiento intensivo con insulina422. En pacientes con SCASEST es razonable controlar la hiperglucemia manteniendo la concentración de glucosa en sangre<11,0mmol/l (o<200mg/dl), lo cual evita la hipoglucemia, y no emplear sistemáticamente el tratamiento intensivo con insulina, excepto cuando esté indicado. El tratamiento hipolipemiante intensivo está indicado para la prevención secundaria423. Para los pacientes con diabetes y enfermedad cardiovascular (ECV), se debe considerar un abordaje multifactorial de la diabetes mellitus que incluya objetivos de tratamiento.
Recomendaciones sobre la diabetes mellitus para pacientes con síndrome coronario agudo sin elevación del segmento ST
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda el cribado de la diabetes en todos los pacientes con SCASEST y la monitorización frecuente de la glucemia en los pacientes con diabetes diagnosticada o hiperglucemia en el momento del ingreso | I | C |
| Se debe evitar la hipoglucemia424–427 | I | B |
| Se debe considerar el tratamiento hipoglucemiante para pacientes con SCA y glucemia>10mmol/l (> 180mg/dl) con un objetivo de tratamiento adaptado a las comorbilidades y evitando los episodios de hipoglucemia422,428–430 | IIa | B |
| Se debe considerar un abordaje multifactorial con objetivos de tratamiento para la diabetes mellitus en pacientes con diabetes y ECV431–436 | IIa | B |
| Se debe considerar un control glucémico menos estricto tanto en la fase aguda como en el seguimiento de los pacientes con ECV más avanzada, edad avanzada, mayor duración de la diabetes y más comorbilidades | IIa | C |
ECV: enfermedad cardiovascular; SCA: síndrome coronario agudo; SCASEST: síndrome coronario agudo sin elevación del segmento ST.
Se debe evaluar la función renal de todos los pacientes con SCASEST mediante la TFGe para obtener información pronóstica e identificar a los pacientes con riesgo de nefropatía inducida por contraste. Aunque, en el contexto de los SCASEST, los pacientes con ERC tienen peor pronóstico que los pacientes con función renal normal, los tratamientos basados en la evidencia, como el antitrombótico, y la estrategia invasiva temprana se aplican con menos frecuencia a este grupo de pacientes437,438.
El diagnóstico de los pacientes con SCASEST y ERC puede presentar dificultades, ya que tanto las leves elevaciones de troponina cardiaca y las alteraciones electrocardiográficas (asociadas con alteraciones de electrolitos o cardiopatía hipertensiva) son comunes. Por lo tanto, se debe diferenciar entre nuevos cambios en el ECG de anomalías preexistentes y evaluar los cambios absolutos de troponina cardiaca (aumento o disminución) para diferenciar el infarto de miocardio de otras enfermedades asociadas con daño miocárdico crónico.
La determinación de hs-cTn tiene una buena capacidad diagnóstica y pronóstica y, por ello, es útil para los pacientes con disfunción renal35,89,439. En esta población un umbral<5ng/l permite descartar daño miocárdico89. Además, los pacientes con concentraciones de troponina superiores al percentil 99 tienen el doble de riesgo de eventos cardiacos al año, independientemente del diagnóstico89.
Los pacientes con enfermedad renal avanzada tienen menos probabilidades de tratarse con una estrategia invasiva440. Mientras que la mortalidad total al año es menor con una estrategia invasiva, el beneficio de este tratamiento disminuye cuanto mayor es el grado de disfunción renal, y el impacto en la mortalidad desaparece en los pacientes con una TFGe<15ml/min/1,73 m2 o que requieren diálisis.
Cuando se decide seguir una estrategia invasiva, se debe tomar medidas para prevenir la nefropatía inducida por contraste, y para ello una adecuada hidratación es fundamental441–446. Las estatinas a dosis altas, independientemente de la nefropatía inducida por contraste, están indicadas para la prevención secundaria442. Para más información sobre las recomendaciones para la prevención de la nefropatía inducida por contraste, consulte la sección 10.2 de la GPC de ESC/EACTS 2018 sobre revascularización miocárdica205.
Se debe prestar especial atención a la elección de los fármacos y las dosis del tratamiento antitrombótico para pacientes con ERC, ya que estos pacientes tienen un riesgo hemorrágico mayor. Mientras que la mayoría de los anticoagulantes requieren un ajuste de las dosis en presencia de insuficiencia renal, esto no es necesario en el caso de los antiagregantes plaquetarios orales447. Los datos sobre la seguridad y la eficacia de los inhibidores del P2Y12 en pacientes con ERC de fase 5 (TFGe<15ml/min/1,73 m2) son insuficientes.
Recomendaciones para pacientes con enfermedad renal crónica y síndrome coronario agudo sin elevación del segmento ST
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Estratificación del riesgo en la ERC | ||
| Se recomienda aplicar a los pacientes con ERC la misma estrategia diagnóstica y terapéutica (podría ser necesario un ajuste de la dosis) que para los pacientes con la función renal normal | I | C |
| Se recomienda evaluar la función renal de todos los pacientes mediante la TFGe | I | C |
| Revascularización miocárdica de pacientes con ERC | ||
| Se recomienda emplear contraste hipoosmolar o isoosmolar (al menor volumen posible) en las estrategias invasivas205,441,442,445,446 | I | A |
| Se recomienda la hidratación con salino isotónico antes y después de los procedimientos invasivos cuando el volumen esperado de contraste sea>100ml | IIa | C |
| Como alternativa a la hidratación antes y después de los procedimientos invasivos, se pueden considerar regímenes adaptados al paciente441,448 | IIb | B |
| La CABG puede ser más recomendable que la ICP para pacientes con EC multivaso cuyo perfil de riesgo quirúrgico sea aceptable y tengan esperanza de vida>1 año4490,450 | IIa | B |
CABG: cirugía de revascularización coronaria; EC: enfermedad coronaria; ERC: enfermedad renal crónica; ICP: intervención coronaria percutánea; TFGe: tasa de filtrado glomerular estimada.
La anemia es frecuente en los pacientes con SCASEST451. La anemia persistente o que empeora en pacientes con SCASEST se asocia con un aumento de la mortalidad, el infarto de miocardio recurrente y hemorragias mayores452. No obstante, se desconoce si la anemia en sí misma es el determinante de resultados peores o si es un marcador de comorbilidades.
Dado que el tratamiento de los SCASEST incluye el tratamiento antitrombótico (que podría exacerbar el sangrado) es importante identificar la causa de la anemia, especialmente si se debe a hemorragia oculta. Se debe valorar con especial cuidado la indicación de coronariografía, la vía de acceso (preferiblemente radial) y la necesidad de revascularización para evitar posteriores pérdidas de sangre453,454. Del mismo modo, en la elección del tratamiento antitrombótico se debe evaluar el riesgo isquémico y hemorrágico y preferir los fármacos con vida media corta o reversibles. En caso de anemia por una causa desconocida o no tratable, el uso de stents farmacoactivos se debe restringir a dispositivos de última generación con un perfil de seguridad probado y que requieren TAPD de corta duración455. La transfusión sanguínea se trata en la sección 5.4.9.
8.5TrombocitopeniaConsulte el material adicional.
8.5.1Trombocitopenia relacionada con inhibidores de la glucoproteína IIb/IIIaConsulte el material adicional.
8.5.2Trombocitopenia inducida por heparinaConsulte el material adicional.
8.6El paciente ancianoLa presentación clínica de los SCASEST en las personas de edad avanzada suele ser atípica. El síntoma más importante de la presentación atípica es la disnea, mientras que el síncope, el malestar y la confusión son menos frecuentes456. La elevación del segmento ST en el ECG es menos frecuente en pacientes mayores que en los más jóvenes457. La determinación de hs-cTn tiene un excelente rendimiento diagnóstico para la detección temprana del infarto de miocardio en pacientes mayores. Sin embargo, la especificidad de esta prueba es menor que en pacientes más jóvenes y las altas concentraciones de troponina cardiaca se asocian más frecuentemente con otras enfermedades distintas del SCA458.
En el contexto de los SCASEST, la edad es un predictor de mortalidad hospitalaria y a los 6 meses140,457. Las decisiones sobre el diagnóstico y el tratamiento de los pacientes de edad avanzada deben estar basadas en los riesgos isquémico y hemorrágico, la esperanza de vida previsible, las comorbilidades, la necesidad de cirugía no cardiaca, la calidad de vida, la fragilidad, el deterioro cognitivo y funcional, los valores y preferencias del paciente, y el riesgo y el beneficio estimados de la revascularización459,460.
La elección y las dosis del tratamiento antitrombótico se deben adaptar a la función renal y las contraindicaciones específicas461.
A pesar de que el beneficio de la revascularización parece mantenerse en la edad avanzada, los pacientes mayores tienen tasas más bajas de revascularización462,463. La eficacia de la estrategia invasiva en el contexto de los pacientes mayores con SCASEST sigue siendo objeto de investigación (estudio SENIOR-RITA, NCT 03052036). Datos recientes muestran que en pacientes con SCASEST y edad ≥ 80 años, la estrategia invasiva fue superior al tratamiento conservador para la reducción del infarto de miocardio, la revascularización urgente, el ictus y la muerte, sin un aumento de las complicaciones hemorrágicas464. En este estudio, la variable compuesta se determinó fundamentalmente por menos infartos de miocardio y revascularizaciones urgentes, pero el estudio no tuvo la potencia suficiente para probar la eficacia en variables individuales. Además, en el contexto de la revascularización (ICP y CABG), las complicaciones relacionadas con el procedimiento fueron más frecuentes en los pacientes ancianos, incluidos el infarto de miocardio, la IC, el ictus, la insuficiencia renal y las hemorragias457,465.
El tratamiento hipolipemiante intensivo está indicado para la prevención secundaria466.
Recomendaciones para pacientes de edad avanzada con síndrome coronario agudo sin elevación del segmento ST
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda emplear para los pacientes de edad avanzada las mismas estrategias diagnósticas que para pacientes más jóvenes458 | I | B |
| Se recomienda emplear para los pacientes de edad avanzada las mismas estrategias intervencionistas que para pacientes más jóvenes463,467 | I | B |
| La elección del fármaco y la dosis del tratamiento antitrombótico y el tratamiento de prevención secundaria deben adaptarse a la función renal, además de tener en cuenta las contraindicaciones específicas461 | I | B |
La fragilidad es un síndrome que se caracteriza por una reserva biológica reducida que lleva a la insuficiencia de los mecanismos homeostáticos en situaciones de estrés468,469. La combinación del envejecimiento de la población, la mayor supervivencia a enfermedades, el tratamiento de enfermedades y una mayor concienciación ha llevado al aumento de la prevalencia de la fragilidad470. Los pacientes frágiles con SCASEST reciben menos frecuentemente tratamiento farmacológico o invasivo para el SCA y tienen EC más compleja471,472, ingresos hospitalarios más largos y mayor riesgo de muerte459,473. Según datos publicados, los pacientes frágiles tienen tasas más altas de la variable compuesta de mortalidad por todas las causas, infarto de miocardio, ictus, revascularización no planificada y hemorragias mayores al año474. En ausencia de evidencia firme que proporcione a los profesionales médicos las bases del tratamiento de los pacientes frágiles con SCASEST475, se recomienda sopesar el riesgo de un tratamiento individual contra el beneficio, siendo conscientes de que una posible percepción errónea de los profesionales médicos sobre el riesgo llevaría a no ofrecer tratamiento. Después de la estratificación del riesgo, es razonable ofrecer tratamiento médico e invasivo óptimos a los pacientes frágiles con riesgo alto de eventos cardiovasculares en el futuro y riesgo bajo de complicaciones y ofrecer solo tratamiento médico óptimo a los pacientes con un riesgo de eventos futuros estimado bajo y un riesgo alto de complicaciones relacionadas con el procedimiento. En una revisión sistemática realizada por de Vries et al., se identificó una serie de variables para medir la fragilidad (véase la tabla 7 del material adicional)476.
8.8Disparidades entre sexosLos datos de registros y estudios muestran discrepancias en los resultados relativos al acceso a la atención sanitaria, la prescripción de tratamientos basados en la evidencia y los resultados clínicos entre varones y mujeres que ingresan con SCA477–483. Las mujeres suelen estar infrarrepresentadas en numerosos ECA.
Aunque existen varias técnicas no invasivas que podrían ser más apropiadas para detectar la EC microvascular en las mujeres484, el cateterismo continúa siendo el estándar de referencia en los SCASEST de riesgo alto y las recomendaciones de las GPC deberían aplicarse con independencia del sexo. Específicamente, las mujeres que ingresan con SCASEST deben recibir atención sanitaria, pruebas diagnósticas y tratamientos con iguales rapidez e intensidad que los varones. Hay que destacar que las mujeres con IAMSEST podrían recibir dosis más altas de tratamiento antitrombótico de lo que correspondería a su peso y su función renal (o ambos) y esto es en parte causa del mayor riesgo de hemorragias hospitalarias y complicaciones de la zona de acceso vascular después de las ICP en mujeres485. Para las recomendaciones sobre gestación y SCASEST, se refiere al lector a la GPC ESC 2018 sobre el diagnóstico y el tratamiento de las ECV durante el embarazo486.
9TRATAMIENTO a largo plazo del síndrome coronario agudo sin elevación del segmento ST9.1Modificación del estilo de vidaConsulte el material adicional.
9.1.1TabacoConsulte el material adicional.
9.1.2Dieta y alcoholConsulte el material adicional.
9.1.3Control del pesoConsulte el material adicional.
9.1.4Actividad físicaConsulte el material adicional.
9.1.5Rehabilitación cardiacaConsulte el material adicional.
9.1.6Factores psicosocialesConsulte el material adicional.
9.1.7Factores ambientalesConsulte el material adicional.
9.1.8Actividad sexualConsulte el material adicional.
9.1.9Adherencia y sostenibilidadConsulte el material adicional.
9.1.10Vacunación antigripalConsulte el material adicional.
9.2Tratamiento farmacológicoConsulte el material adicional.
9.2.1Fármacos antiisquémicosDespués del IAMSEST y la revascularización, a menudo los pacientes no sufren dolor torácico. Para el tratamiento antiisquémico se refiere al lector a la GPC ESC 2019 sobre síndromes coronarios crónicos231.
9.2.1.1Bloqueadores betaConsulte el material adicional.
9.2.2Fármacos antitrombóticosLa duración de los tratamientos antiagregante plaquetario y anticoagulante se trata en la sección 5.1.4.
9.2.3Inhibidores de la bomba de protonesConsulte el material adicional.
9.2.4Estatinas y otros hipolipemiantesLa dislipemia, según la GPC específica, se debe controlar con tratamiento farmacológico e intervenciones en el estilo de vida512. Se considera que los pacientes con EC estable tienen un riesgo muy alto de complicaciones cardiovasculares y, por ello, se debe valorar la administración de estatinas, con independencia de las concentraciones de colesterol unido a lipoproteínas de baja densidad (cLDL). El objetivo del tratamiento es reducir el cLDL a<1,4mmol/l (< 55mg/dl) o reducirlo en al menos un 50% si la concentración basal está en 1,8-3,5mmol/l (70-135mg/dl). Cuando no se pueda alcanzar este objetivo, se ha demostrado que la adición de ezetimiba reduce las concentraciones de colesterol y los eventos cardiovasculares en pacientes que han sufrido un SCA y en pacientes con diabetes513 sin un impacto adicional en la mortalidad514. Además del ejercicio, la dieta y el control del peso, que se deben recomendar a todos los pacientes, los suplementos dietéticos, como fitoesteroles, pueden reducir el cLDL pero en menor medida y no se ha demostrado que mejoren los resultados clínicos515. Se podrían recomendar (clase IIb) como terapia adyuvante al tratamiento farmacológico para pacientes de riesgo alto o muy alto que no alcanzan los objetivos del tratamiento con estatinas o no pueden recibir este tratamiento516. Los estudios publicados desde 2015 han demostrado que los inhibidores de la PCSK9 (evolocumab517 y alirocumab518–520) son muy eficaces para la reducción estable del colesterol hasta niveles cercanos a 50mg/dl (1,3mmol/l) o menos521.
Recomendaciones sobre las intervenciones en el estilo de vida después de un síndrome coronario agudo sin elevación del segmento ST
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda mejorar los factores relacionados con el estilo de vida, además de la administración de tratamiento farmacológico adecuado, para reducir la mortalidad cardiovascular y por todas las causas y la morbilidad y mejorar la calidad de vida relacionada con la salud487–497 | I | A |
| Se recomiendan intervenciones cognitivo-conductuales para ayudar a los sujetos a alcanzar un estilo de vida saludable498–500 | I | A |
| Se recomienda la rehabilitación cardiaca multidisciplinaria basada en el ejercicio para los pacientes con EC para alcanzar un estilo de vida saludable y controlar los factores de riesgo, con el objetivo de reducir la mortalidad cardiovascular y por todas las causas y la morbilidad y mejorar la calidad de vida relacionada con la salud487,497,501 | I | A |
| Se recomienda la participación de un equipo multidisciplinario (cardiólogos, médicos de familia, enfermería, dietistas, fisioterapeutas, psicólogos, farmacéuticos) para reducir la mortalidad cardiovascular y por todas las causas y la morbilidad y mejorar la calidad de vida relacionada con la salud492,499,502,503 | I | A |
| Se recomiendan las intervenciones psicológicas para mejorar los síntomas de depresión de los pacientes con EC, con el objetivo de mejorar la calidad de vida relacionada con la salud504,505 | I | B |
| Se recomienda la vacunación antigripal anual de los pacientes con EC, especialmente los de edad avanzada, para mejorar la morbilidad505–511 | I | B |
EC: enfermedad coronaria.
En estudios de resultados, se ha demostrado que estos fármacos reducen los eventos cardiovasculares, con un impacto nulo o leve en la mortalidad522. Las concentraciones de colesterol muy bajas generalmente se toleran bien y se asocian con menos eventos523, pero el alto coste de los inhibidores de la PCSK9, inasequible para muchos sistemas de salud524, y la falta de datos sobre su seguridad a largo plazo han limitado su generalización hasta ahora. La aféresis de lipoproteínas de baja densidad y otras terapias nuevas, como mipomersen y lomitapida, requieren más investigación. Para pacientes que se someten a una ICP, se ha demostrado que la administración de dosis altas de atorvastatina reduce la incidencia de eventos periprocedimiento tanto en pacientes que no han recibido antes tratamiento con estatinas como aquellos en tratamiento crónico con estatinas525. El reciente estudio REDUCE-IT, que incluyó a 8.179 participantes (el 70,7% para la prevención secundaria de eventos cardiovasculares) y tuvo un seguimiento de 4,9 años, demostró un efecto significativo de la administración de ácido graso omega 3 etil-eicosapentaenoico con un grado de pureza adecuado para la prescripción farmacológica en la variable compuesta de muerte cardiovascular, infarto de miocardio no mortal, ictus no mortal, revascularización coronaria o angina inestable, comparado con placebo (el 17,2 frente al 22,0%; HR=0,75; IC95%, 0,68-0,83). Hay que destacar que se usaron dosis muy altas de ácido etil-eicosapentaenoico (2g 2 veces al día)526. En la GPC ESC 2019 sobre dislipemias, el ácido etil-eicosapentaenoico tiene una recomendación de clase IIa512.
9.2.5Tratamiento hipoglucemiante para pacientes con diabetesEste tema va más allá del alcance de este documento y se ha tratado en una guía publicada recientemente231. Como norma general, cuanto más avanzada la ECV, más avanzada la edad del paciente, más larga la duración de la diabetes y mayor la presencia de comorbilidades, menos estricto debe ser el control de la glucosa.
Por primera vez en la historia de la diabetes mellitus se dispone de datos de varios ECA que muestran beneficios cardiovasculares con los fármacos hipolipemiantes en pacientes con ECV o riesgo cardiovascular alto o muy alto. Los resultados de estos estudios, en los que se administraron antagonistas del receptor del péptido similar al glucagón tipo 1527–529 e inhibidores del cotransportador de sodio-glucosa tipo 2530–532, indican claramente que estos fármacos se deben recomendar a los pacientes con diabetes mellitus de tipo 2 y ECV aterosclerótica.
9.2.6Bloqueadores del sistema renina-angiotensina-aldosteronaConsulte el material adicional.
9.2.7Tratamiento con antagonistas del receptor de mineralocorticoidesConsulte el material adicional.
9.2.8Tratamiento antihipertensivoConsulte el material adicional.
9.2.9Terapia de sustitución hormonalConsulte el material adicional.
Recomendaciones sobre el tratamiento farmacológico a largo plazo tras los síndromes coronarios agudos (a excepción del tratamiento antitrombótico)
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Fármacos hipolipemiantes | ||
| Se recomienda la administración de estatinas a todos los pacientes con SCASEST. El objetivo es reducir el cLDL en al menos el 50% del valor basal o alcanzar cifras<1,4mmol/l (< 55mg/dl)533,534 | I | A |
| Si el objetivoc de cLDL no se alcanza después de 4-6 semanas con la dosis máxima tolerada de estatinas, se recomienda la combinación con ezetimiba514,535 | I | B |
| Si el objetivoc de cLDL no se alcanza después de 4-6 semanas con la dosis máxima tolerada de estatinas y ezetimiba, se recomienda añadir un inhibidor del PCSK9520,535 | I | B |
| Si el episodio actual de SCASEST es una recurrencia en menos de 2 años del primer SCA mientras el paciente toma la dosis máxima tolerada de estatinas, se puede considerar un objetivo de cLDL<1,0mmol/l (< 40mg/dl)520,535 | IIb | B |
| IECA o ARA-II | ||
| Está recomendada la administración de IECA (o ARA-II en caso de intolerancia) para los pacientes con insuficiencia cardiaca y FEVI reducida (< 40%), diabetes o ERC, excepto si hay contraindicaciones (p. ej., insuficiencia renal avanzada, hiperpotasemia, etc.) para reducir la morbimortalidad cardiovascular y la mortalidad por todas las causas536–538 | I | A |
| Bloqueadores beta | ||
| Los bloqueadores beta están recomendados para pacientes con disfunción sistólica del VI o insuficiencia cardiaca con FEVI reducida (< 40%)539–541 | I | A |
| Para pacientes con infarto de miocardio previo, se debe considerar el tratamiento oral a largo plazo con bloqueadores beta para reducir la morbimortalidad cardiovascular y la mortalidad por todas las causas542–547 | IIa | B |
| ARM | ||
| Los ARM están recomendados para pacientes con insuficiencia cardiaca y FEVI reducida (< 40%) para reducir la morbimortalidad cardiovascular y la mortalidad por todas las causas548,549 | I | A |
| Inhibidores de la bomba de protones | ||
| Se recomienda la administración concomitante de un inhibidor de la bomba de protones a los pacientes en monoterapia con AAS, TAPD, TAD, TAT o monoterapia con ACO y tienen riesgo de hemorragia gastrointestinal alto para reducir el riesgo de sangrado gástrico169 | I | A |
AAS: ácido acetilsalicílico; ACO: anticoagulantes orales; ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocortidoides; cLDL: colesterol unido a lipoproteínas de baja densidad; ERC: enfermedad renal crónica; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima de conversión de la angiotensina; PCSK9: proproteína convertasa subtilisina/kexina tipo 9; SCA: síndrome coronario agudo; SCASEST: síndrome coronario agudo sin elevación del segmento ST; TAD: tratamiento antitrombótico doble; TAPD: tratamiento antiagregante plaquetario doble; TAT: tratamiento antitrombótico triple; VI: ventrículo izquierdo.
Los indicadores de calidad son grupos de medidas que permiten cuantificar la adherencia a las recomendaciones de las GPC e identificar oportunidades para mejorar la atención y los resultados cardiovasculares550. Los indicadores de calidad se derivan de la evidencia y deben ser viables, interpretables y utilizables551. Permiten identificar prácticas que pueden llevar a una asistencia sanitaria de alta calidad e ilustrar el modo en que se prestan los servicios; el uso de indicadores de calidad por las autoridades sanitarias, las organizaciones profesionales, los pagadores de servicios de salud y también la población aumenta progresivamente552–555.
Los indicadores de calidad se suelen dividir en indicadores estructurales, de procedimiento y de resultados, dependiendo del aspecto de la atención sanitaria que se mida556. Aunque la evidencia sobre la alta calidad tiende a apoyar el uso de indicadores de calidad de procedimientos557, la inclusión también de indicadores de calidad de resultados permite realizar una evaluación más completa558. Además, los resultados referidos por los pacientes (RRP), que quizá no tienen una recomendación de clase alta en las GPC, pueden tener un papel complementario combinados con otros indicadores de calidad559.
En 2016 la Association for Acute Cardiovascular Care (ACVC) de la ESC (denominada anteriormente Acute Cardiovascular Care Association) desarrolló un paquete de indicadores de calidad para el tratamiento del IAM con o sin elevación del segmento ST560. Estos indicadores se evaluaron externamente en registros clínicos internacionales y se demostró en la mayoría una asociación inversa con la mortalidad561–563. Para esta edición de la guía sobre el tratamiento del SCASEST, se han actualizado los indicadores de calidad de forma que se correspondan con las recomendaciones y abarquen todos los aspectos de la atención asistencial de los SCASEST. En resumen, los indicadores de calidad de la ACVC para el IAM comprenden 7 dominios que incluyen la evaluación de:
- 1.
La organización del centro.
- 2.
La reperfusión y la estrategia invasiva
- 3.
La evaluación del riesgo hospitalario
- 4.
El tratamiento antitrombótico durante la hospitalización
- 5.
Los tratamientos para la prevención secundaria después del alta
- 6.
La satisfacción del paciente.
- 7.
El indicador de calidad compuesto de riesgo ajustado de mortalidad a los 30 días.
Los indicadores de calidad compuestos son combinaciones de indicadores individuales en un número que resume múltiples dimensiones y facilita las comparaciones y la categorización de los centros y pueden ser utilizados por los proveedores de servicios sanitarios para tomar decisiones y realizar análisis comparativos. En este documento, sin embargo, solo se describen los indicadores de calidad relevantes al diagnóstico y el tratamiento de los SCASEST (véase la tabla 15).
Indicadores de calidad en la atención médica de los síndromes coronarios agudos sin elevación del segmento ST
| 1. Organización del centro | Clasea | Nivelb |
|---|---|---|
| Indicador principal de calidad: determinación de hs-cTn en el hospital | ||
| Indicador de calidad: la determinación de hs-cTn está disponible en el hospital | ||
| Recomendación correspondiente de la GPC de la ESC: está recomendado determinar las troponinas cardiacas con pruebas de alta sensibilidad inmediatamente después del ingreso y tener los resultados en los primeros 60min tras la extracción de la muestra de sangre | I | B |
| Indicador secundario de calidad: el centro debe participar en un registro o un programa regular de evaluación de la calidad | ||
| Indicador de calidad: centros que participan en un registro | ||
| Recomendación correspondiente de la GPC de la ESC: sin recomendación | NA | NA |
| 2. Estrategia invasiva | ||
| Indicador principal de calidad (1): porcentaje de pacientes con IAMSEST que se someten a ACI en las primeras 24h del diagnóstico | ||
| Numerador: número de pacientes con IAMSEST que se someten a ACI en las primeras 24h del diagnóstico | ||
| Denominador: todos los pacientes con IAMSEST sin contraindicaciones | ||
| Recomendación correspondiente de la GPC de la ESC: está recomendada una estrategia invasiva temprana en las primeras 24h para pacientes con alguno de los criterios de riesgo alto, incluido el diagnóstico de IAMSEST apuntado por un algoritmo diagnóstico | I | A |
| Indicador principal de calidad (2): acceso radial en caso de estrategia invasiva | ||
| Numerador: número de pacientes con IAMSEST que se someten a ACI con acceso radial | ||
| Denominador: número de pacientes con IAMSEST que se someten a ACI sin contraindicaciones importantes que impidan el acceso radial | ||
| Recomendación correspondiente de la GPC de la ESC: está recomendado el acceso radial como estrategia estándar, salvo que haya contraindicaciones importantes | I | A |
| 3. Evaluación hospitalaria del riesgo | ||
| Indicador principal de calidad (1): porcentaje de pacientes en los que se evalúa la FEVI antes del alta. Se debe evaluar la FEVI y registrar su valor numérico de todos los pacientes ingresados por SCASEST | ||
| Numerador: número de pacientes con SCASEST en los que se evalúa la FEVI antes del alta | ||
| Denominador: número de pacientes con SCASEST | ||
| Recomendación correspondiente de la GPC de la ESC: está recomendada la ecocardiografía para evaluar la función regional y global del VI y para confirmar o descartar otros diagnósticos diferenciales | I | C |
| Indicador principal de calidad (2): se debe determinar el cLDL durante la hospitalización | ||
| Numerador: número de pacientes con SCASEST en los que se determina el cLDL durante la hospitalización | ||
| Denominador: número de pacientes con SCASEST | ||
| Recomendación correspondiente de la GPC de la ESC: está recomendada la administración de estatinas a todos los pacientes con SCASEST. El objetivo es reducir el cLDL en al menos un 50% del valor basal y/o alcanzar un valor < 1,4mmol/l (< 55mg/dl) | I | A |
| 4. Tratamiento antitrombótico durante la hospitalización | ||
| Indicador principal de calidad: porcentaje de pacientes que reciben tratamiento «adecuado con inhibidores del P2Y12» | ||
| Numerador: número de pacientes con SCASEST a los que se prescribe tratamiento adecuado con inhibidores del P2Y12 en el momento del alta | ||
| Denominador: número de pacientes que sobrevivieron a un SCASEST y en el momento del alta tenían una indicación de prasugrel, ticagrelor o clopidogrel | ||
| Recomendación correspondiente de la GPC de la ESC: está recomendada la administración de un inhibidor del P2Y12 además de AAS durante 12 meses, salvo contraindicaciones o riesgo hemorrágico excesivo | I | A |
| 5. Tratamientos de prevención secundaria al alta | ||
| Indicador principal de calidad: porcentaje de pacientes a los que se prescribe tratamiento intensivo con estatinas (definido como atorvastatina ≥ 40mg o rosuvastatina ≥ 20mg) en el momento del alta, excepto cuando esté contraindicado | ||
| Numerador: número de pacientes con SCASEST a los que se prescribe tratamiento intensivo con estatinas en el momento del alta | ||
| Denominador: número de pacientes que sobrevivieron a un SCASEST que en el momento del alta no tenían contraindicaciones, efectos secundarios, alergia, antecedente de intolerancia al tratamiento intensivo con estatinas o rechazo de este tratamiento | ||
| Recomendación correspondiente de la GPC de la ESC: está recomendada la administración de estatinas a todos los pacientes con SCASEST. El objetivo es reducir el cLDL en al menos un 50% del valor basal y/o alcanzar un valor < 1,4mmol/l (< 55mg/dl) | I | A |
| Indicador secundario de calidad (1): porcentaje de pacientes con FEVI<40% a los que se prescriben IECA (o ARA-II en caso de intolerancia a los IECA) en el momento del alta | ||
| Numerador: número de pacientes con SCASEST y FEVI<40% a los que se prescriben IECA/ARA-II en el momento del alta | ||
| Denominador: número de pacientes con SCASEST y FEVI<40% supervivientes hasta el momento del alta y aptos para el tratamiento con IECA/ARA-II (sin insuficiencia renal avanzada, hiperpotasemia, otras contraindicaciones, efectos secundarios o alergia o que rechazan el tratamiento) | ||
| Recomendación correspondiente de la GPC de la ESC: está recomendada la administración de IECA (o ARA-II en caso de intolerancia) a pacientes con SCASEST e hipertensión, FEVI<40%, diabetes o ERC, excepto cuando esté contraindicado (p. ej., insuficiencia renal avanzada, hiperpotasemia, etc.) | I | A |
| Indicador secundario de calidad (2): porcentaje de pacientes con FEVI<40% a los que se prescriben bloqueadores beta en el momento del alta | ||
| Numerador: número de pacientes con SCASEST y FEVI<40% a los que se prescriben bloqueadores beta en el momento del alta | ||
| Denominador: número de pacientes con FEVI<40% supervivientes hasta el momento del alta y aptos para el tratamiento con bloqueadores beta | ||
| Recomendación correspondiente de la GPC de la ESC: está recomendada la administración de bloqueadores beta a los pacientes con disfunción sistólica del VI o insuficiencia cardiaca con FEVI reducida (< 40%) | I | A |
| 6. Satisfacción del paciente | ||
| Indicador principal de calidad: se debe recoger de manera sistemática y organizada la opinión de los pacientes sobre su experiencia, incluyendo los siguientes aspectos:• Las explicaciones proporcionadas por personal médico y enfermería (sobre la enfermedad coronaria, los riesgos y beneficios del tratamiento que se prescribe en el momento del alta y el seguimiento médico)• Información en el momento del alta sobre qué hacer en caso de recurrencia de los síntomas y planificación de las consultas | ||
| Numerador: número de pacientes con SCASEST supervivientes hasta el momento del alta de los que se recoge la información referida por el paciente | ||
| Denominador: número de pacientes con SCASEST supervivientes hasta el momento del alta | ||
| Recomendación correspondiente de la GPC de la ESC (1): sin recomendación | NA | NA |
| Indicador secundario de calidad: evaluación sistemática de la calidad de vida relacionada con la salud de todos los pacientes mediante un instrumento validado | ||
| Numerador: número de pacientes con SCASEST supervivientes hasta el momento del alta cuya calidad de vida relacionada con la salud se evalúa durante la hospitalización mediante un instrumento validado | ||
| Denominador: número de pacientes con SCASEST supervivientes hasta el momento del alta | ||
| Recomendación correspondiente de la GPC de la ESC: sin recomendación | NA | NA |
| 7. Indicador principal de calidad combinado | ||
| Indicador principal de calidad combinado (basado en la oportunidad): incluye los siguientes indicadores individuales de calidad (todos tienen el mismo peso):• El centro debe participar en un registro o un programa regular para la evaluación de la calidad• Tasa de pacientes con IAMSEST que se someten a ACI en las primeras 24 horas tras el diagnóstico• Porcentaje de pacientes cuya FEVI se evalúa antes del alta• Porcentaje de pacientes que reciben tratamiento «adecuado con inhibidores del P2Y12»• Porcentaje de pacientes a los que se prescribe tratamiento intensivo con estatinas en el momento del alta• Porcentaje de pacientes con FEVI<40% a los que se prescriben IECA/ARA-II en el momento del alta• Porcentaje de pacientes con FEVI<40% a los que se prescriben bloqueadores beta en el momento del alta• La opinión de los pacientes sobre su experiencia se recoge de manera sistemática y organizada | ||
| Numerador: todos los pacientes con SCASEST supervivientes en el momento del alta. Suma de puntos: 1 punto por cada indicador individual | ||
| Denominador: todos los pacientes con SCASEST supervivientes en el momento del alta. Suma de puntos: 1 punto por cada indicador aplicable según las características del paciente y del centro | ||
| Recomendación correspondiente de la GPC de la ESC: sin recomendación | NA | NA |
| Indicador secundario de calidad combinado (todos o ninguno) basado en 3 o 5 componentes según la FEVI:• Calculado sobre 3 indicadores individuales de calidad en pacientes con FEVI ≥ 40%:–Tasa de pacientes con IAMSEST sometidos a ACI en las primeras 24h tras el diagnóstico–Porcentaje de pacientes que reciben tratamiento «adecuado con inhibidores del P2Y12»–Porcentaje de pacientes a los que se prescribe tratamiento intensivo con estatinas en el momento del alta• Calculado sobre 5 indicadores individuales de calidad en pacientes con FEVI<40%:–Tasa de pacientes con IAMSEST sometidos a ACI en las primeras 24h tras el diagnóstico–Porcentaje de pacientes que reciben tratamiento «adecuado con inhibidores del P2Y12»–Porcentaje de pacientes a los que se prescribe tratamiento intensivo con estatinas en el momento del alta–Porcentaje de pacientes con FEVI<40% a los que se prescribe tratamiento con IECA/ARA-II–Porcentaje de pacientes con FEVI<40% a los que se prescribe tratamiento con bloqueadores beta | ||
| Numerador: todos los pacientes con SCASEST supervivientes en el momento del alta. Suma de puntos: 1 punto por cada indicador individual | ||
| Denominador: todos los pacientes con SCASEST supervivientes en el momento del alta. Suma de puntos: 1 punto por cada indicador aplicable según las características del paciente y del centro | ||
| 8. Indicadores de calidad de resultados | ||
| Indicadores secundarios de calidad: tasa de mortalidad a los 30 días ajustada por el riesgoc | ||
| Numerador: todos los pacientes con SCASEST que mueren durante los primeros 30 días del ingreso | ||
| Denominador: todos los pacientes con SCASEST y seguimiento a los 30 días | ||
| Recomendación correspondiente de la GPC de la ESC: sin recomendación | NA | NA |
AAS: ácido acetilsalicílico; ACI: angiografía coronaria invasiva; ARA-II: antagonistas del receptor de la angiotensina II; cLDL: colesterol unido a lipoproteínas de baja densidad; EC: enfermedad coronaria; ERC: enfermedad renal crónica; ESC: Sociedad Europea de Cardiología; FEVI: fracción de eyección del ventrículo izquierdo; GPC: guías de práctica clínica; hs-cTn: troponina cardiaca de alta sensibilidad; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; IECA: inhibidores de la enzima de conversión de la angiotensina; SCASEST: síndrome coronario agudo sin elevación ST; SCC: síndrome coronario crónico; VI: ventrículo izquierdo.
Los indicadores de calidad que se definen en esta guía están destinados a mejorar la calidad y medir el rendimiento mediante un sistema de vigilancia coherente, además de integrarse en registros diseñados específicamente para identificar áreas de mejora en la práctica clínica. Los indicadores de calidad primarios y secundarios representan, respectivamente, los componentes fundamentales y complementarios de la calidad de la atención de los SCASEST, y no están diseñados para clasificar a los profesionales/proveedores de la salud ni para el pago de incentivos. Los indicadores de calidad requieren una monitorización y una actualización continuas basadas en la información generada a partir de su aplicación y en los datos de registros clínicos, además de integrar los cambios en la evidencia y las recomendaciones de las guías.
11Estrategia de tratamientoLa figura 13 describe la estrategia de diagnóstico y tratamiento para los pacientes con SCASEST.
Ilustración central. Estrategia de diagnóstico y tratamiento para pacientes con SCASEST. BNP: péptido natriurético cerebral; CABG: cirugía de revascularización coronaria; ECG: electrocardiograma; GP: gluproteína; GRACE: Global Registry of Acute Coronary Events; HNF: heparina no fraccionada; hs-cTn: troponina cardiaca de alta sensibilidad; ICA: insuficiencia cardiaca aguda; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; NT-proBNP: fracción N-terminal del propéptido natriurético cerebral; PCSK9: proproteína convertasa subtilisina/kexina tipo 9; RCP: reanimación cardiopulmonar; SCASEST: síndrome coronario agudo sin elevación ST; SFA: stents farmacoactivos; TAPD: tratamiento antiagregante plaquetario doble; UCC: unidad de cuidados coronarios.
Escuche online la audioguía de esta figura.
Diagnóstico. El dolor torácico sin elevación persistente del segmento ST (SCASEST) es el síntoma principal que inicia el proceso diagnóstico y terapéutico. La correlación patológica en el miocardio es la necrosis de cardiomiocitos medida por la liberación de troponina o, menos frecuentemente, la isquemia miocárdica sin daño celular (angina inestable). Los pacientes con angina inestable tienen un riesgo de muerte significativamente menor y obtienen menos beneficio de un abordaje farmacológico o invasivo agresivo.
Determinación de troponina. Las determinaciones ultrasensibles de troponina son más recomendables que las de menor sensibilidad, ya que tienen mayor precisión diagnóstica y el mismo bajo coste. Hay que recordar que numerosas cardiopatías diferentes del infarto de miocardio también producen daño de cardiomiocitos y, por lo tanto, elevaciones de troponina cardiaca.
Otros biomarcadores. El uso de otros biomarcadores puede tener relevancia clínica en contextos específicos cuando se combinan con la determinación no ultrasensible de troponina cardiaca T/I. La CK-MB disminuye más rápidamente tras el infarto de miocardio y puede ser más útil para detectar el reinfarto precoz. La determinación sistemática de copeptina está recomendada como biomarcador adicional para descartar rápidamente el diagnóstico de infarto de miocardio en el caso cada vez menos frecuente de que no sea posible la determinación de hs-cTn.
Algoritmos rápidos de confirmación o exclusión. Debido a sus altas sensibilidad y precisión diagnóstica para la detección del infarto de miocardio durante su presentación, las determinaciones de hs-cTn permiten acortar el tiempo hasta la realización de la segunda determinación de troponina cardiaca. Se recomienda el algoritmo de 0h/1h (la mejor opción, toma de muestras de sangre a las 0h y 1h) o el algoritmo de 0h/2h (segunda opción, toma de muestras de sangre a las 0h y 2h). Se seleccionaron los valores de corte más adecuados para descartar o confirmar el diagnóstico con una sensibilidad y un VPN mínimo del 99% y con un valor predictivo positivo mínimo del 70%. El empleo de los algoritmos de 0h/1h y 0h/2h combinado con los hallazgos clínicos y electrocardiográficos permite identificar a los pacientes candidatos a alta precoz y tratamiento ambulatorio.
Factores de confusión de la concentración de troponinas cardiacas. Haya infarto de miocardio o no, 4 variables clínicas afectan a las concentraciones de hs-cTn. El efecto de la edad (las diferencias de la concentración entre individuos sanos muy jóvenes frente a individuos sanos muy mayores son de hasta el 300%), la disfunción renal (las diferencias de la concentración entre pacientes sin otras afecciones con una TFGe muy alta frente a una TFGe muy baja son de hasta el 300%) y la aparición de dolor torácico (> 300%) es sustancial, mientras que el sexo tiene un efecto discreto (diferencias de ∼40%).
Evaluación del riesgo isquémico. Las concentraciones iniciales de hs-cTn aportan información pronóstica adicional a las variables clínicas y electrocardiográficas en cuanto a la mortalidad a corto y largo plazo. Cuanto más elevadas estén las concentraciones de hs-cTn, mayor es el riesgo de muerte. También se debe determinar la creatinina sérica y la TFGe de todos los pacientes con SCASEST porque influyen en el pronóstico y son elementos clave de la escala GRACE; la evaluación del riesgo basada en la escala GRACE es superior a la evaluación (subjetiva) del médico para la mortalidad y el infarto de miocardio. Los péptidos natriuréticos pueden proporcionar información pronóstica adicional y ayudar a estratificar el riesgo.
Evaluación del riesgo hemorrágico. La clasificación ARC-HBR representa un enfoque pragmático que incluye los estudios más recientes en pacientes con riesgo hemorrágico alto, que previamente se excluían de los estudios sobre la duración y la intensidad del TAPD. La escala PRECISE-DAPT puede guiar la decisiones sobre la duración del TAPD, pero tiene un discreto valor predictivo de hemorragias mayores. No está clara la utilidad de estas escalas para mejorar los resultados de los pacientes.
Pruebas de imagen no invasivas. Dependiendo de la evaluación clínica, podría estar indicado realizar pruebas de imagen electivas, invasivas o no invasivas, incluso después de descartar el infarto de miocardio. La ATC es una opción para los pacientes con una probabilidad clínica baja-pequeña de angina inestable, ya que un resultado normal descarta la EC. La ATC tiene un VPN alto para descartar el SCA (al excluir la EC) y un resultado excelente en los pacientes que ingresan en urgencias con una probabilidad pretest baja-intermedia de SCA y una ATC normal. Además, en pacientes con riesgo alto, realizar primero la ATC reduce la necesidad de angiografía invasiva. La ecocardiografía/RMC de estrés o la imagen de cardiología nuclear también pueden ser una opción, dependiendo de la evaluación del riesgo.
Estrategia invasiva basada en la estratificación del riesgo. La estrategia invasiva sistemática en las primeras 24h tras el ingreso está recomendada para el IAMSEST basándose en las concentraciones de hs-cTn, una puntuación GRACE>140 y la presencia de cambios dinámicos o presumiblemente nuevos del segmento ST, ya que esta estrategia se asocia con una tasa menor de MACE y con una mayor supervivencia a corto plazo. La angiografía invasiva inmediata es necesaria para los pacientes muy inestables, dependiendo de su estado hemodinámico y de la presencia de arritmias, IC aguda o dolor torácico persistente. Para otras presentaciones clínicas, se puede seguir una estrategia invasiva selectiva, según los resultados de pruebas no invasivas o la evaluación clínica del riesgo.
Estrategias de revascularización. Los aspectos técnicos principales de las ICP en pacientes con SCASEST no difieren de la estrategia invasiva de evaluación y revascularización en otras manifestaciones de la EC. El acceso radial es la vía de acceso vascular preferida para los pacientes con SCASEST que se someten a una evaluación invasiva, seguida o no de ICP. La enfermedad multivaso es frecuente en los SCASEST, y la revascularización completa y su planificación temporal se deben decidir según la relevancia funcional de todas las estenosis, la edad, el estado general del paciente, las comorbilidades y la función del ventrículo izquierdo.
Infarto de miocardio sin enfermedad obstructiva (MINOCA). El término MINOCA abarca un grupo heterogéneo de causas subyacentes a afecciones coronarias y no coronarias y, de estas, enfermedades cardiacas y extracardiacas. Por consenso, de esta categoría se excluyen la miocarditis y el síndrome de tako-tsubo. La imagen por RMC es un instrumento diagnóstico clave, ya que permite identificar la causa subyacente en más del 85% de los casos y establecer el tratamiento apropiado.
Disección arterial coronaria espontánea. Se define como la separación de origen no traumático, no ateroesclerótico ni iatrogénico de las capas de la pared arterial, secundaria a hemorragia de vasa vasorum o desgarro de la íntima, que crea una luz falsa, compresión coronaria e isquemia miocárdica por el deterioro del flujo distal y causa hasta el 4% de los SCA, pero su incidencia es mucho más alta (22-35% de los SCA) en mujeres<60 años de edad. La imagen intracoronaria es muy útil para realizar el diagnóstico y orientar el tratamiento. No se ha establecido hasta ahora el tratamiento farmacológico óptimo.
Pretratamiento con inhibidores del P2Y12. Dada la falta de un beneficio demostrado, no está recomendado el pretratamiento sistemático con inhibidores del P2Y12 para los pacientes con SCASEST cuya anatomía coronaria se desconoce y tienen planificado un abordaje invasivo temprano. Se podría considerar para casos seleccionados y dependiendo del riesgo hemorrágico del paciente.
Tratamiento antiagregante plaquetario después de la ICP. En general, está recomendado el TAPD con un inhibidor potente del P2Y12 y AAS durante 12 meses, con independencia del tipo de stent implantado, excepto si existen contraindicaciones. En la actualidad se han implementado distintos regímenes de tratamiento. La duración del TAPD se puede acortar (< 12 meses), prolongar (> 12 meses), modificar con un cambio de antiagregantes plaquetarios o reducir. Las decisiones sobre el tratamiento dependen del juicio clínico, que debe estar basado en los riesgos isquémico y hemorrágico del paciente, la aparición de eventos adversos, las comorbilidades, la medicación concomitante y la disponibilidad de los respectivos fármacos.
Tratamiento antitrombótico triple. Al menos un 6-8% de los pacientes que se someten a una ICP tienen indicada la anticoagulación a largo plazo. Los NACO son preferibles a los AVK por su perfil de seguridad, si los pacientes son aptos para este tratamiento. El TAD con un NACO a las dosis recomendadas para la prevención del ictus y un antiagregante plaquetario (preferiblemente clopidogrel, fármaco elegido en el 90% de los casos en los estudios realizados) está recomendado como tratamiento estándar durante 12 meses tras 1 semana de TAT (con NACO y TAPD). El TAT se podría prolongar hasta 1 mes cuando el riesgo isquémico sea mayor que el hemorrágico.
13LAGUNAS EN LA EVIDENCIA SOBRE EL DIAGNÓSTICO Y EL TRATAMIENTO DEL SÍNDROME CORONARIO AGUDO SIN ELEVACIÓN DEL SEGMENTO ST E INVESTIGACIÓN EN EL FUTURO| Lagunas en la evidencia sobre el abordaje de los SCASEST | ECA necesarios |
|---|---|
| MODELOS DE PREDICCIÓN DEL RIESGO | |
| No está claro si la estratificación del riesgo de los pacientes con SCASEST basada en modelos multivariables mejora los resultados clínicos | Asignación aleatoria de pacientes a un algoritmo de tratamiento basado en escalas de riesgo calculadas en el punto de atención o a tratamiento habitual |
| Ningún ECA ha evaluado específicamente la utilidad de una estrategia basada en modelos de predicción del riesgo (escala PRECISE-DAPT, criterios ARC-HBR) para establecer la duración del TAPD tras la ICP en pacientes con SCASEST | Asignación aleatoria de pacientes a estrategias de tratamiento basadas en modelos de predicción del riesgo para la duración del TAPD comparado con el tratamiento habitual |
| ESTRATEGIAS DE TRATAMIENTO MÉDICO | |
| Se desconoce la seguridad y la eficacia del pretratamiento con un inhibidor del P2Y12 antes de la ACI en pacientes con SCASEST | ECA específico sobre el pretratamiento con ticagrelor (y separadamente clopidogrel) frente a placebo, comparado con la administración de una dosis de carga tras la angiografía en pacientes sometidos a ICP |
| Se sigue cuestionando la seguridad y la eficacia del uso temprano de bloqueadores beta i.v. antes de una estrategia invasiva temprana o tardía para pacientes con SCASEST | Asignación aleatoria de pacientes a tratamiento con bloqueadores beta o a tratamiento habitual antes de la ACI |
| El valor del tratamiento a largo plazo con bloqueadores beta para pacientes con FEVI>40% requiere investigación adicional | Pacientes con FEVI>40% después de 1 año de tratamiento con bloqueadores beta desde el evento inicial asignados aleatoriamente a tratamiento a largo plazo o no |
| BIOMARCADORES | |
| Es preciso definir el papel de las pruebas genéticas o de la función plaquetaria para la reducción del tratamiento con inhibidores del P2Y12 después del primer mes de tratamiento tras la ICP de los SCASEST | ECA con suficiente potencia para evaluar una estrategia de reducción del tratamiento basada en pruebas genéticas o de la función plaquetaria frente al tratamiento habitual basado en guías de práctica clínica |
| ¿Cuál es el valor añadido de la determinación de biomarcadores, aparte de la hs-cTn, para descartar rápidamente los SCASEST comparada con la estrategia habitual? | Asignación aleatoria de pacientes con SCASEST a procesos diagnósticos que incluyan o no la determinación de biomarcadores, además de las pruebas diagnósticas habituales |
| MOMENTO ADECUADO PARA REALIZAR ANGIOGRAFÍA Y REVASCULARIZACIÓN | |
| ¿Cuál es el momento más adecuado para realizar la angiografía invasiva en pacientes con alto riesgo y SCASEST? | Son necesarios ECA adicionales que evalúen distintos intervalos de tiempo para realizar la angiografía hasta llegar a las primeras 72h desde la presentación de los síntomas |
| ¿Los pacientes con SCASEST y riesgo bajo deben someterse a angiografía sistemática o selectiva? | Asignación aleatoria de pacientes a estrategia invasiva sistemática o selectiva tras la estratificación adecuada del riesgo |
| Se desconoce la estrategia invasiva más adecuada para mujeres con SCASEST | ECA con suficiente potencia para identificar posibles diferencias relacionadas con el sexo de las estrategias de tratamiento para pacientes con SCASEST |
| ¿Cuál es el papel de la ATC u otras pruebas de estrés con imagen para los pacientes con riesgo bajo y SCASEST o con un diagnóstico incierto de IAMSEST? | ECA sobre estrategias diagnósticas basadas en pruebas no invasivas anatómicas o funcionales antes del abordaje con ACI, que tengan suficiente potencia para evaluar criterios clínicos de valoración |
| ¿Cuál es el valor de la RFF-TC combinada con ATC para evaluar el impacto de las características adversas hemodinámicas y de la placa en la determinación de los SCA? | ECA que comparen el valor diagnóstico añadido de la RFF-TC en una estrategia de diagnóstico anatómico no invasivo (ATC) |
| Se requiere investigación adicional sobre la seguridad y la eficacia de la evaluación invasiva sistemática frente a la selectiva para pacientes frágiles con SCASEST | Asignación aleatoria a ACI sistemática o selectiva de pacientes frágiles con SCASEST, sin isquemia o inestabilidad hemodinámica |
| Debido fundamentalmente a dificultades de reclutamiento, los pacientes de edad avanzada no están suficientemente representados en los ensayos clínicos sobre estrategias invasivas para pacientes con SCASEST | ECA multicéntricos que evalúen la seguridad y la eficacia de diferentes estrategias de tratamiento en un número suficiente de pacientes mayores con SCASEST |
| Aparte de los criterios enumerados en la estrategia invasiva inmediata, no está claro si existen criterios adicionales que aconsejen actuar inmediatamente en la población con SCASEST | Sería necesaria más investigación sobre vías de estratificación del riesgo para identificar a las poblaciones más vulnerables que obtendrían un mayor beneficio de un evaluación invasiva temprana (y quizá de la inmediata también) |
| No está claro si se debe intentar solamente la revascularización de la lesión presumiblemente culpable o la revascularización completa en pacientes con SCASEST | ECA que comparen la ICP solo de la lesión presumiblemente culpable basada en pruebas de imagen no invasiva o coronariografía frente a la revascularización completa con ICP (o CABG) |
| No está claro el valor de la evaluación hemodinámica basada en la RFF de las lesiones no culpables para guiar la revascularización completa en los SCASEST | Asignación aleatoria de pacientes con SCASEST y enfermedad multivaso a ICP como está indicado, con o sin el uso de la RFF de lesiones no culpables |
| ¿La opción preferida para los SCASEST con enfermedad multivaso es la ICP o la CABG? | Estudios específicos sobre pacientes con SCASEST y enfermedad multivaso que se asignen aleatoriamente a ICP frente a CABG, que incluyan la evaluación invasiva o no invasiva |
| ¿Se debe lograr la revascularización completa en el procedimiento inicial o en varios procedimientos? | Son necesarios ECA que evalúen la revascularización inmediata frente a la revascularización completa en varias sesiones en pacientes con enfermedad multivaso |
| No está claro el papel y el tipo de dispositivo percutáneo de asistencia mecánica circulatoria para pacientes con SCASEST en shock cardiogénico | Se debe evaluar estrategias basadas en dispositivos percutáneos de asistencia circulatoria mecánica para pacientes con SCASEST en shock cardiogénico, comparadas con el abordaje convencional |
| TRATAMIENTO A LARGO PLAZO | |
| Es necesario determinar los programas de entrenamiento más adecuados tras el SCASEST | Asignación aleatoria de pacientes a diferentes programas de rehabilitación tras el SCASEST |
| Hay que determinar si los inhibidores de la neprilisina, para el grupo específico de pacientes con SCASEST y disfunción sistólica del VI, mejora los resultados clínicos y reduce las hospitalizaciones | Asignación aleatoria de pacientes con SCASEST y disfunción sistólica del VI a tratamiento con un inhibidor de la neprilisina comparado con el tratamiento estándar |
| ¿Cuál es el valor de los tratamientos a largo plazo con bloqueadores beta e IECA/ARA-II para los pacientes con función normal del VI y sin otras indicaciones para estos tratamientos? | ECA que comparen el tratamiento mantenido a largo plazo con bloqueadores beta e IECA/ARA-II frente a la suspensión de estos tratamientos para los pacientes con función normal del VI y sin otras indicaciones para estos tratamientos tras el SCASEST |
| ¿Cuál es el tratamiento antitrombótico óptimo a largo plazo para pacientes con SCASEST sometidos a revascularización coronaria percutánea? | Son necesarios estudios que comparen diferentes combinaciones de fármacos antitrombóticos potentes y evalúen la relación de riesgo-beneficio en cuanto a los eventos isquémicos y hemorrágicos |
| Se desconoce el impacto de las valvulopatías en los pacientes con EC y SCASEST y se requiere más investigación | Es necesario evaluar estrategias basadas en la revascularización sola frente a la revascularización combinada con el tratamiento de valvulopatías (valvulopatías cardiacas no avanzadas, incluida la estenosis aórtica y la insuficiencia mitral) |
ACI: angiografía coronaria invasiva; ARA-II: antagonistas del receptor de la angiotensina II; ARC-HBR: Academic Research Consortium-High Bleeding Risk; ATC: angiotomografía computarizada; CABG: cirugía de revascularización coronaria; EC: enfermedad coronaria; ECA: ensayo clínico aleatorizado; FEVI: fracción de eyección del ventrículo izquierdo; hs-cTn: troponina cardiaca de alta sensibilidad; i.v.: intravenoso; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; IECA: inhibidores de la enzima de conversión de la angiotensina; PRECISE-DAPT: Predicting bleeding Complications In patients undergoing Stent implantation and subsequent Dual Anti Platelet Therapy; RFF: reserva fraccional de flujo; RFF-TC: reserva fraccional de flujo mediante tomografía computarizada; SCA: síndrome coronario agudo; SCASEST: síndrome coronario agudo sin elevación del segmento ST; TAPD: tratamiento antiagregante plaquetario doble; VI: ventrículo izquierdo.
| Recomendaciones sobre diagnóstico, estratificación del riesgo, pruebas de imagen y monitorización del ritmo para pacientes con sospecha de síndrome coronario agudo sin elevación del segmento ST | Clasea | Nivelb |
|---|---|---|
| Diagnóstico y estratificación del riesgo | ||
| Se recomienda que el diagnóstico y la estratificación inicial del riesgo a corto plazo se base en la historia clínica, los síntomas, los signos vitales, otros hallazgos físicos, ECG y resultados de laboratorio, incluida la hs-cTn3 | I | B |
| Se recomienda determinar las troponinas cardiacas con pruebas de alta sensibilidad inmediatamente después del ingreso y tener los resultados en los primeros 60min tras la obtención de la muestra de sangre3,10–13,29–31,34 | I | B |
| Se recomienda realizar un ECG de 12 derivaciones durante los primeros 10min del primer contacto médico; el ECG debe ser interpretado inmediatamente por un médico con experiencia21 | I | B |
| Se recomienda realizar un ECG de 12 derivaciones adicional en caso de síntomas recurrentes o diagnóstico incierto | I | C |
| Se recomienda usar el algoritmo de 0h/1h de la ESC con la obtención de muestras de sangre a las 0h y 1h si está disponible la determinación de hs-cTn con un algoritmo validado de 0h/1 h300,33,35,36,39,68,69,75,76 | I | B |
| Se recomienda una prueba adicional después de 3h si las primeras 2 determinaciones de troponina cardiaca del algoritmo 0h/1h no son concluyentes y la condición clínica sigue siendo indicativa de SCA85 | I | B |
| Como alternativa al algoritmo de 0h/1h de la ESC, se recomienda el algoritmo de 0h/2h con obtención de muestras de sangre a las 0h y 2h si está disponible la determinación de hs-cTn con un algoritmo de 0h/2h validado33,39,75,78,84 | I | B |
| Se recomienda utilizar derivaciones electrocardiográficas adicionales (V3R, V4R, V7-V9) si se sospecha isquemia y las derivaciones estándar no son concluyentes | I | C |
| No se recomienda la determinación sistemática de biomarcadores como PUAG-C o copeptina además de hs-cTn para el diagnóstico inicial47,48,51,52,54,118 | III | B |
| Pruebas de imagen | ||
| La ecocardiografía, realizada inmediatamente después del ECG de 12 derivaciones por médicos entrenados, está recomendada para pacientes con parada cardiaca o inestabilidad hemodinámica de origen probablemente cardiovascular | I | C |
| Para pacientes sin dolor torácico recurrente, con hallazgos electrocardiográficos normales y cifras de troponina (preferiblemente de alta sensibilidad) normales, pero en los que todavía se sospecha un SCA, se recomienda una prueba de estrés no invasiva (preferiblemente con imagen) para la isquemia inducible o ATC antes de decidir sobre una estrategia invasiva91,92,98,101,105–108 | I | B |
| Se recomienda la ecocardiografía para evaluar la función regional y global del VI y confirmar o descartar un diagnóstico diferencialc | I | C |
| Está recomendada la ATC como alternativa a la ACI para descartar el SCA cuando la probabilidad de EC sea baja-intermedia y cuando la troponina cardiaca o el ECG sean normales o no concluyentes105,108,110–114 | I | A |
| Monitorización | ||
| Está recomendada la monitorización continua del ritmo hasta que se establezca o se descarte el diagnóstico de IAMSEST | I | C |
| Está recomendado ingresar a los pacientes con IAMSEST en una unidad con monitorización | I | C |
| Está recomendada la monitorización del ritmo hasta 24h o ICP (lo que suceda antes) para los pacientes con IAMSEST y riesgo bajo de arritmias cardiacasd | I | C |
| Está recomendada la monitorización del ritmo durante más de 24h en pacientes con IAMSEST y riesgo de arritmias cardiacas aumentadoe | I | C |
| Recomendaciones sobre la determinación de biomarcadores para la estimación del pronóstico | ||
| Aparte de su utilidad diagnóstica, las determinaciones seriadas de hs-cTn están recomendadas para la estimación del pronóstico12,13,119,120 | I | B |
| No está recomendada la determinación de biomarcadores adicionales, como la fracción media del propéptido natriurético tipo A, la proteína C reactiva de alta sensibilidad, la fracción media de la proadrenomedulina, GDF-15, copeptina y PUAG-C, para la evaluación sistemática del riesgo y la estimación del pronóstico50,127,129 | III | B |
| Recomendaciones sobre el tratamiento antitrombótico de los pacientes con síndrome coronario agudo sin elevación ST que se someten a intervención coronaria percutánea | ||
| Tratamiento antiagregante plaquetario | ||
| El AAS está recomendado para todos los pacientes sin contraindicaciones a una dosis oral de carga de 150-300mg (o 75-250mg i.v.) seguida de 75-100mg/día para el tratamiento a largo plazo179–181 | I | A |
| Está recomendada la administración de un inhibidor del P2Y12, además de AAS, durante 12 meses, excepto en caso de contraindicaciones o riesgo hemorrágico excesivo170,171,182Las opciones son: | I | A |
| • Prasugrel para pacientes no tratados con un inhibidor del P2Y12 que se someten a ICP (dosis de carga de 60mg seguida de 10mg/día como dosis estándar o 5mg/día para pacientes de edad ≥ 75 años o con peso corporal<60kg)171 | I | B |
| • Ticagrelor independientemente de la estrategia de tratamiento (invasiva o conservadora) (dosis de carga de 180mg seguida de 90mg 2 veces al día)170 | I | B |
| • Clopidogrel (dosis de carga de 300-600mg seguida de 75mg/día) solo cuando el prasugrel o el ticagrelor no estén disponibles, no se toleren o estén contraindicados182,183 | I | C |
| No se recomienda el tratamiento con un inhibidor de la GPIIb/IIIa para pacientes con anatomía coronaria desconocida188,189 | III | A |
| No se recomienda la administración sistemática de pretratamiento con un inhibidor del P2Y12 cuando se planifica una estrategia invasiva temprana para pacientes con anatomía coronaria desconocida174,177,178,190,191 | III | A |
| Tratamiento anticoagulante periprocedimiento | ||
| Está recomendada la anticoagulación parenteral, además del tratamiento antiagregante plaquetario, para todos los pacientes en el momento del diagnóstico y, especialmente, durante los procedimientos de revascularización según los riesgos isquémico y hemorrágico192,193 | I | A |
| Para pacientes que se someten a ICP, se recomienda la administración de HNF (bolo intravenoso ajustado al peso durante la ICP de 70-100 UI/kg o 50-70 UI/kg en combinación con un inhibidor de la GPIIb/IIIa; intervalo de tiempo de coagulación activada de 250-350 s o 200-250 s si se administra un inhibidor de la a GPIIb/IIIa) | I | A |
| En los casos de tratamiento farmacológico o limitaciones logísticas para trasladar al paciente a un centro con ICP en el plazo requerido, se recomienda la administración de fondaparinux y, en estos casos, se recomienda administrar un único bolo de HNF en el momento de la ICP183 | I | B |
| Se recomienda seleccionar la anticoagulación según los riesgos isquémico y hemorrágico, además del perfil de eficacia y seguridad del fármaco elegido | I | C |
| No está recomendado el cambio de HNF a HBPM196 | III | B |
| Recomendaciones sobre el tratamiento tras el procedimiento y a largo plazo para pacientes con síndrome coronario agudo sin elevación ST | ||
| Para pacientes con SCASEST tratados con implante de stents, se recomienda el TAPD con un inhibidor del P2Y12 y AAS durante 12 meses, excepto cuando haya contraindicaciones como un riesgo hemorrágico excesivo170,171,225 | I | A |
| Recomendaciones sobre fármacos antiisquémicos en la fase aguda de los síndromes coronarios agudos sin elevación ST | ||
| Se recomienda la administración i.v. o sublingual de nitratos y el tratamiento precoz con bloqueadores beta para los pacientes con síntomas isquémicos si no hay contraindicaciones | I | C |
| Se recomienda continuar el tratamiento con bloqueadores beta, excepto en los casos de insuficiencia cardiaca manifiesta | I | C |
| Se recomiendan los nitratos i.v. para pacientes con hipertensión incontrolada o signos de insuficiencia cardiaca | I | C |
| Recomendaciones sobre el tratamiento combinado antiagregante plaquetario y anticoagulante para pacientes con síndrome coronario agudo que requieren anticoagulación oral | ||
| Se recomienda la prevención del ictus para pacientes con FA y al menos 1 factor de riesgo CHA2DS2-VASc no relacionado con el sexo (puntuación ≥ 1 los varones y ≥ 2 las mujeres). Para los pacientes con 2 o más factores de riesgo CHA2DS2-VASc no relacionados con el sexo, se recomienda la ACO255–259 | I | A |
| Pacientes sometidos a implante destents | ||
| Anticoagulación | ||
| Durante la ICP se recomienda la anticoagulación parenteral adicional, independientemente de la hora de la última dosis de NACO y si la INR es<2,5 para los pacientes tratados con AVK | I | C |
| Tratamiento antiagregante plaquetario | ||
| Para pacientes con FA y una puntuación CHA2DS2-VASc ≥ 1 los varones y ≥ 2 las mujeres, tras un periodo corto de TAT (hasta 1 semana desde el evento agudo), se recomienda el TAD como estrategia estándar con un NACO a la dosis recomendada para la prevención del ictus y un antiagregante plaquetario oral (preferiblemente clopidogrel)238–241,244,245 | I | A |
| Se recomienda la administración periprocedimiento de TAPD con AAS y clopidogrel hasta 1 semana238–241,244,245 | I | A |
| Se recomienda interrumpir después de 12 meses el tratamiento antiagregante plaquetario de los pacientes tratados con un anticoagulante236–239,246 | I | B |
| No se recomiendan el ticagrelor o el prasugrel como parte del TAT | III | C |
| Recomendaciones sobre revascularización coronaria | ||
| Momento adecuado para la estrategia invasiva | ||
| Se recomienda una estrategia invasiva inmediata (< 2h) para pacientes con al menos uno de los siguientes criterios de riesgo muy alto:• Inestabilidad hemodinámica o shock cardiogénico• Dolor torácico recurrente o refractario a tratamiento médico• Arritmias potencialmente mortales• Complicaciones mecánicas del infarto de miocardio• Insuficiencia cardiaca relacionada claramente con el SCASEST• Depresión del segmento ST>1mm en 6 o más derivaciones, además de la elevación del segmento ST en aVR o V1 | I | C |
| Se recomienda una estrategia invasiva temprana (< 24h) para pacientes con al menos uno de los siguientes criterios de riesgo alto:• Diagnóstico de IAMSEST según el algoritmo diagnóstico propuesto en la sección 3• Cambios dinámicos contiguos o presumiblemente nuevos en el segmento ST/T indicativos de isquemia• Elevación transitoria del segmento ST273,362• Puntuación GRACE>140271,272,277 | I | A |
| Para los pacientes con riesgo bajo, se recomienda una estrategia invasiva selectiva tras la realización de pruebas de isquemia o la detección de EC obstructiva mediante ATC267,268,363 | I | A |
| Aspectos técnicos | ||
| Se recomienda el acceso radial como estrategia estándar, excepto cuando haya contraindicaciones importantes336,337 | I | A |
| Se recomiendan los SFA en lugar de los stents sin recubrir para cualquier ICP independientemente de:• La presentación clínica• El tipo de lesión• Una cirugía no cardiaca planificada• La duración del TAPD prevista• Un tratamiento anticoagulante simultáneo354,365,366 | I | A |
| La estrategia de revascularización (ICP ad hoc de la lesión culpable, ICP multivaso, CABG) debe basarse en el estado clínico del paciente, las comorbilidades y la extensión de la enfermedad (distribución y características angiográficas de la lesión —puntuación SYNTAX—), de acuerdo con los principios de la EC estable350. La decisión sobre la ICP inmediata de la estenosis culpable no requiere la valoración del equipo cardiológico | I | B |
| Recomendaciones sobre el infarto de miocardio sin enfermedad coronaria obstructiva | ||
| Para todos los pacientes con un diagnóstico inicial de MINOCA, se recomienda seguir un algoritmo diagnóstico que permita diferenciar este diagnóstico de otros alternativos | I | C |
| Se recomienda una RMC para todos los pacientes con MINOCA sin una causa subyacente obvia370 | I | B |
| En caso de diagnóstico inicial de MINOCA que finalmente se asocia con una causa subyacente, se recomienda tratar al paciente según la guía específica de cada enfermedad | I | C |
| Recomendaciones para pacientes con SCASEST e insuficiencia cardiaca oshockcardiogénico | ||
| Se recomienda una coronariografía urgente para pacientes con SCA complicado por shock cardiogénico205,416,417 | I | B |
| Se recomienda la ICP urgente de la lesión culpable para pacientes en shock cardiogénico causado por SCASEST, independientemente del tiempo transcurrido desde la presentación de los síntomas, siempre que la anatomía coronaria sea adecuada para ICP205,417 | I | B |
| Se recomienda la CABG urgente para los pacientes en shock cardiogénico si la anatomía coronaria no es adecuada para ICP205,417 | I | B |
| Se recomienda la ecocardiografía urgente para evaluar la función del VI y la función valvular y descartar complicaciones mecánicas | I | C |
| En caso de inestabilidad hemodinámica, se recomienda la reparación quirúrgica o percutánea de las complicaciones mecánicas del SCA según la valoración del equipo cardiológico | I | C |
| No se recomienda el empleo sistemático del BCIA para pacientes en shock cardiogénico causado por SCA y sin complicaciones mecánicas413–415 | III | B |
| No se recomienda la revascularización inmediata sistemática de lesiones no culpables para los pacientes con SCASEST y enfermedad multivaso que se presentan en shock cardiogénico346,408 | III | B |
| Recomendaciones sobre la diabetes mellitus para pacientes con síndrome coronario agudo sin elevación del segmento ST | ||
| Se recomienda el cribado de la diabetes en todos los pacientes con SCASEST y la monitorización frecuente de la glucemia de los pacientes con diabetes diagnosticada o hiperglucemia en el momento del ingreso | I | C |
| Se debe evitar la hipoglucemia424–427 | I | B |
| Recomendaciones para pacientes con enfermedad renal crónica y síndrome coronario agudo sin elevación del segmento ST | ||
| Estratificación del riesgo en la ERC | ||
| Se recomienda aplicar a los pacientes con ERC la misma estrategia diagnóstica y terapéutica (podría ser necesario un ajuste de la dosis) que para los pacientes con la función renal normal | I | C |
| Se recomienda evaluar la función renal de todos los pacientes mediante la TFGe | I | C |
| Revascularización miocárdica en pacientes con ERC | ||
| Se recomienda un contraste hipoosmolar o isoosmolar (al menor volumen posible) en las estrategias invasivas205,441,442,445,446 | I | A |
| Recomendaciones para pacientes de edad avanzada con síndrome coronario agudo sin elevación del segmento ST | ||
| Se recomienda utilizar las mismas estrategias diagnósticas para pacientes de edad avanzada que para los más jóvenes458 | I | B |
| Se recomienda usar las mismas estrategias intervencionistas para pacientes de edad avanzada que para los más jóvenes463,467 | I | B |
| La elección del fármaco y la dosis del tratamiento antitrombótico y el tratamiento de prevención secundaria deben adaptarse a la función renal, además de tener en cuenta las contraindicaciones específicas461 | I | B |
| Recomendaciones sobre las intervenciones en el estilo de vida después de un síndrome coronario agudo sin elevación del segmento ST | ||
| Se recomienda mejorar los factores relacionados con el estilo de vida, además de la administración de tratamiento farmacológico adecuado, para reducir la mortalidad cardiovascular y por todas las causas y la morbilidad y mejorar la calidad de vida relacionada con la salud487–497 | I | A |
| Se recomiendan intervenciones cognitivo-conductuales para ayudar a los sujetos a alcanzar un estilo de vida saludable498–500 | I | A |
| Para los pacientes con EC, se recomienda la rehabilitación cardiaca multidisciplinaria basada en el ejercicio para alcanzar un estilo de vida saludable y controlar los factores de riesgo, con el objetivo de reducir la mortalidad cardiovascular y por todas las causas y la morbilidad y mejorar la calidad de vida relacionada con la salud487,497,501 | I | A |
| Se recomienda la participación de un equipo multidisciplinario (cardiólogos, médicos de familia, enfermería, dietistas, fisioterapeutas, psicólogos, farmacéuticos) para reducir la mortalidad cardiovascular y por todas las causas y la morbilidad y mejorar la calidad de vida relacionada con la salud492,499,502,503 | I | A |
| Se recomiendan las intervenciones psicológicas para mejorar los síntomas de depresión de los pacientes con EC con el objetivo de mejorar la calidad de vida relacionada con la salud504,505 | I | B |
| Se recomienda la vacunación antigripal anual para los pacientes con EC, especialmente los de edad avanzada, para mejorar la morbilidad505–511 | I | B |
| Recomendaciones sobre el tratamiento farmacológico a largo plazo tras los síndromes coronarios agudos (a excepción del tratamiento antitrombótico) | ||
| Fármacos hipolipemiantes | ||
| Se recomienda la administración de estatinas a todos los pacientes con SCASEST. El objetivo es reducir el cLDL en al menos un 50% del valor basal o alcanzar valores<1,4mmol/l (< 55mg/dl)533,534 | I | A |
| Si el objetivof de cLDL no se alcanza después de 4-6 semanas con la dosis máxima tolerada de estatinas, se recomienda la combinación con ezetimiba514,535 | I | B |
| Si el objetivof de cLDL no se alcanza después de 4-6 semanas con la dosis máxima tolerada de estatinas y ezetimiba, se recomienda añadir un inhibidor del PCSK9520,535 | I | B |
| IECA o ARA-II | ||
| Se recomienda administrar IECA (o ARA-II en caso de intolerancia) a los pacientes con insuficiencia cardiaca y FEVI reducida (< 40%), diabetes o ERC, excepto si hay contraindicaciones (p. ej., insuficiencia renal avanzada, hiperpotasemia, etc.) para reducir la morbimortalidad cardiovascular y la mortalidad por todas las causas536–538 | I | A |
| Bloqueadores beta | ||
| Los bloqueadores beta están recomendados para pacientes con disfunción sistólica del VI o insuficiencia cardiaca con FEVI reducida (< 40%)539–541 | I | A |
| ARM | ||
| Los ARM están recomendados para pacientes con insuficiencia cardiaca y FEVI reducida (< 40%) para reducir la morbimortalidad cardiovascular y la mortalidad por todas las causas548,549 | I | A |
| Inhibidores de la bomba de protones | ||
| Está recomendado el tratamiento concomitante con un inhibidor de la bomba de protones para los pacientes en monoterapia con AAS, TAPD, TAD, TAT o monoterapia con ACO que tengan alto riesgo de hemorragia gastrointestinal para reducir el riesgo de sangrado gástrico169 | I | A |
AAS: ácido acetilsalicílico; ACI: angiografía coronaria invasiva; ACO: anticoagulación oral; ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocortidoides; ATC: angiotomografía computarizada; AVK: antagonistas de la vitamina K; BCIA: balón de contrapulsación intraaórtico; cLDL: colesterol unido a lipoproteínas de baja densidad; CABG: cirugía de revascularización coronaria; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 (doble), diabetes, ictus (doble)-enfermedad vascular, edad 65-74, sexo (mujer); EC: enfermedad coronaria; ECG: electrocardiograma; ERC: enfermedad renal crónica; ESC: Sociedad Europea de Cardiología; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; GDF-15: factor de diferenciación de crecimiento 15; GP: glucoproteína; GRACE: Global Registry of Acute Coronary Events; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; Hs-cTn: troponina cardiaca de alta sensibilidad; i.v.: intravenoso; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; IECA: inhibidores de la enzima de conversión de la angiotensina; INR: razón internacional normalizada; MINOCA: infarto de miocardio sin enfermedad coronaria obstructiva; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; PCSK9: proproteína convertasa subtilisina/kexina tipo 9; PUAG-C: proteína de unión a ácidos grasos de tipo cardiaco; RFF: reserva fraccional de flujo; RMC: resonancia magnética cardiaca; SCA: síndrome coronario agudo; SCASEST: síndrome coronario agudo sin elevación del segmento ST; SFA: stents farmacoactivos; TAD: tratamiento antitrombótico doble; TAPD: tratamiento antiagregante plaquetario doble; TAT: tratamiento antitrombótico triple; TFGe: tasa de filtrado glomerular estimada; VI: ventrículo izquierdo.
Si no se cumple ninguno de los siguientes criterios: inestabilidad hemodinámica, arritmias importantes, FEVI<40%, reperfusión fallida, estenosis coronarias críticas adicionales en vasos importantes, complicaciones relacionadas con la revascularización percutánea o puntuación GRACE>140 si se ha evaluado.
Para los pacientes con riesgo cardiovascular muy alto (como los pacientes con SCA), se recomienda una reducción de al menos el 50% del valor basal y un objetivo de cLDL<1,4mmol/l (< 55mg/dl)512.
El material adicional con tablas, figuras y texto que complementan el texto principal de la guía está disponible en la página web de European Heart Journal y la página web de la ESC (www.escardio.org/guidelines).
16ANEXOFiliaciones de los autores y miembros del Grupo de Trabajo: Emanuele Barbato, Advanced Biomedical Sciences, University Federico II, Nápoles, Italia; Olivier Barthélémy, Sorbonne Université, ACTION Study Group, Institut de Cardiologie, Hôpital Pitié-Salpêetrière (Assistance Publique- Hôpitaux de Paris) (AP-HP), París, Francia; Johann Bauersachs, Department of Cardiology and Angiology, Hannover Medical School, Hannover, Alemania; Deepak L. Bhatt, Brigham and Women's Hospital and Harvard Medical School, Boston, Estados Unidos; Paul Dendale, Faculty of Medicine and Life Sciences, Hasselt University, Hasselt, Bélgica; Maria Dorobantu, Cardiology, Carol Davila University of Medicine and Pharmacy, Bucarest, Rumanía; Thor Edvardsen, Cardiology, Oslo University Hospital, Oslo, Noruega; Thierry Folliguet, UPEC, Cardiac surgery, Hôpital Henri Mondor (Assistance Publique Hôpitaux de Paris), Créteil, Francia; Chris P. Gale, Leeds Institute of Cardiovascular and Metabolic Medicine, University of Leeds, Leeds, Reino Unido; Martine Gilard, Cardiology, CHU La Cavale Blanche, Brest, Francia; Alexander Jobs, Department of Internal Medicine/Cardiology, Heart Center Leipzig at University of Leipzig, Leipzig, Alemania; Peter Jüni, Li Ka Shing Knowledge Institute of St. Michael's Hospital, Toronto, Canadá; Ekaterini Lambrinou, Department of Nursing, School of Health Sciences, Cyprus University of Technology, Limassol, Chipre; Basil S. Lewis, Cardiovascular Clinical Trials Institute, Lady Davis Carmel Medical Center and the Ruth and Bruce Rappaport School of Medicine, Haifa, Israel; Julinda Mehilli, Munich University Clinic, Ludwig-Maximilians University, Múnich, Alemania; Emanuele Meliga, Interventional Cardiology, AO Mauriziano Umberto I, Turín, Italia; Béla Merkely, Heart and Vascular Center, Semmelweis University, Budapest, Hungría; Christian Mueller, Cardiovascular Research Institute Basel (CRIB) and Cardiology, University Hospital Basel, University of Basel, Basilea, Suiza; Marco Roffi, Geneva University Hospitals, Ginebra, Suiza; Frans H. Rutten, General Practice, Julius Center for Health Sciences and Primary Care, University Medical Center Utrecht, Utrecht University, Utrecht, Países Bajos; Dirk Sibbing, Privatklinik Lauterbacher Mühle am Ostersee, Múnich, Alemania; Ludwig-Maximilians Universität München, Múnich, Alemania, y George C.M. Siontis, Department of Cardiology, University Hospital of Bern, Inselspital, Berna, Suiza.
Comité de la ESC para las Guías de Práctica Clínica (GPC): Stephan Windecker (coordinador) (Suiza), Victor Aboyans (Francia), Colin Baigent (Reino Unido), Jean-Philippe Collet (Francia), Veronica Dean (Francia), Victoria Delgado (Países Bajos), Donna Fitzsimons (Reino Unido), Chris P. Gale (Reino Unido), Diederick E. Grobbee (Países Bajos), Sigrun Halvorsen (Noruega), Gerhard Hindricks (Alemania), Bernard Iung (Francia), Peter Jüni (Canadá), Hugo A. Katus (Alemania), Ulf Landmesser (Alemania), Christophe Leclercq (Francia), Maddalena Lettino (Italia), Basil S. Lewis (Israel), Béla Merkely (Hungría), Christian Mueller (Suiza), Steffen E. Petersen (Reino Unido), Anna Sonia Petronio (Italia), Dimitrios J. Richter (Grecia), Marco Roffi (Suiza), Evgeny Shlyakhto (Federación Rusa), Iain A. Simpson (Reino Unido), Miguel Sousa-Uva (Portugal) y Rhian M. Touyz (Reino Unido).
Sociedades nacionales de la ESC que han colaborado activamente en el proceso de revisión de la GPC ESC 2020 sobre el diagnóstico y tratamiento del síndrome coronario agudo en pacientes sin elevación persistente del segmento ST
Alemania:German Cardiac Society, Steffen Massberg; Argelia:Algerian Society of Cardiology, Mohammed Chettibi; Armenia:Armenian Cardiologists Association, Hamlet G. Hayrapetyan; Austria:Austrian Society of Cardiology, Bernhard Metzler; Azerbaiyán:Azerbaijan Society of Cardiology, Ruslan Najafov; Bélgica:Belgian Society of Cardiology, Marc Claeys; Bielorrusia:Belorussian Scientific Society of Cardiologists, Valeriy I. Stelmashok; Bosnia y Herzegovina:Association of Cardiologists of Bosnia and Herzegovina, Zumreta Kušljugić; Bulgaria:Bulgarian Society of Cardiology, Plamen Marinov Gatzov; Chipre:Cyprus Society of Cardiology, Georgios Panayi; Croacia:Croatian Cardiac Society, Bosko Skoric; Dinamarca:Danish Society of Cardiology, Rikke Sorensen; Egipto:Egyptian Society of Cardiology, Khaled Shokry; Eslovaquia:Slovak Society of Cardiology, Marek Orban; Eslovenia:Slovenian Society of Cardiology, Matjaž Bunc; España: Sociedad Española de Cardiología, Borja Ibáñez; Estonia: Estonian Society of Cardiology, Toomas Marandi; Federación Rusa:Russian Society of Cardiology, Dmitry Duplyakov; Finlandia:Finnish Cardiac Society, Olli A. Kajander; Francia:French Society of Cardiology, Philippe Commeau; Georgia:Georgian Society of Cardiology, Alexander Aladashvili; Grecia:Hellenic Society of Cardiology, Dimitrios Nikas; Hungría:Hungarian Society of Cardiology, Dávid Becker; Irlanda:Irish Cardiac Society, Aaron J. Peace; Islandia:Icelandic Society of Cardiology, Ingibjörg J. Guðmundsdöttir; Israel:Israel Heart Society, Roy Beigel; Italia:Italian Federation of Cardiology, Ciro Indolfi; Kazajistán:Association of Cardiologists of Kazakhstan, Nazipa Aidargaliyeva; Kirguistán:Kyrgyz Society of Cardiology, Medet Beishenkulov; Kosovo:Kosovo Society of Cardiology, Shpend Elezi; Letonia:Latvian Society of Cardiology, Aija Maca; Lituania:Lithuanian Society of Cardiology, Olivija Gustiene; Luxemburgo:Luxembourg Society of Cardiology, Philippe Degrell; Macedonia del Norte:North Macedonian Society of Cardiology, Sasko Kedev; Malta:Maltese Cardiac Society, Andrew Cassar Maempel; Moldavia:Moldavian Society of Cardiology, Victoria Ivanov; Noruega:Norwegian Society of Cardiology, Terje K. Steigen; Países Bajos:Netherlands Society of Cardiology, Peter Damman; Polonia:Polish Cardiac Society, Jacek Legutko; Portugal:Portuguese Society of Cardiology, João Morais; Reino Unido:British Cardiovascular Society, Nina Karia; República Checa:Czech Society of Cardiology, Martin Mates; Rumanía:Romanian Society of Cardiology, Dragos Vinereanu; San Marino:San Marino Society of Cardiology, Marco Zavatta; Serbia:CardiologySociety of Serbia, Milan Pavlović; Siria:Syrian Cardiovascular Association, Yassin Bani Marjeh; Suecia:Swedish Society of Cardiology, Robin Hofmann; Suiza:Swiss Society of Cardiology, Oliver Gaemperli; Túnez:Tunisian Society of Cardiology and Cardio-Vascular Surgery, Faouzi Addad; Turquía: Turkish Society of Cardiology, Eralp Tutar; Ucrania:Ukrainian Association of Cardiology, Alexander Parkhomenko.
Las filiaciones de los autores y miembros del Grupo de Trabajo se recogen en el anexo.Entidades de la ESC que han participado en la elaboración de este documento:Asociaciones: Association for Acute CardioVascular Care (ACVC), Association of Cardiovascular Nursing & Allied Professions (ACNAP), European Association of Cardiovascular Imaging (EACVI), European Association of Preventive Cardiology (EAPC), European Association of Percutaneous Cardiovascular Interventions (EAPCI), European Heart Rhythm Association (EHRA) y Heart Failure Association (HFA).Consejos: Council for Cardiology Practice.Grupos de Trabajo: Farmacoterapia Cardiovascular, Cirugía Cardiovascular, Fisiopatología y Microcirculación Coronaria, y Trombosis.El contenido de esta GPC de la ESC se publica exclusivamente para uso personal y educativo. No se autoriza su uso comercial. No se autoriza la traducción o reproducción de ningún fragmento de esta guía sin la autorización escrita de la ESC. La autorización se solicitará por escrito a Oxford University Press, editorial de European Heart Journal y representante autorizado de la ESC para estas cuestiones (journals.permissions@oup.com).Descargo de responsabilidad. Esta guía recoge la opinión de la ESC y se ha elaborado tras el estudio minucioso de los datos y la evidencia disponibles hasta la fecha. La ESC no es responsable en caso de que exista alguna contradicción, discrepancia o ambigüedad entre la GPC de la ESC y cualquier otra recomendación oficial o GPC publicada por autoridades relevantes de la sanidad pública, particularmente en lo que se refiere al buen uso de la atención sanitaria y las estrategias terapéuticas. Se espera que los profesionales de la salud tengan en consideración esta GPC a la hora de tomar decisiones clínicas, así como al implementar estrategias médicas preventivas, diagnósticas o terapéuticas. No obstante, esta guía no anula la responsabilidad individual de cada profesional al tomar las decisiones oportunas relativas a cada paciente, de acuerdo con dicho paciente y, cuando fuera necesario, con su tutor o representante legal. Además, las GPC de la ESC no eximen al profesional médico de su obligación ética y profesional de consultar y considerar atentamente las recomendaciones y GPC actualizadas emitidas por autoridades sanitarias competentes. Es también responsabilidad del profesional verificar la normativa y la legislación sobre fármacos y dispositivos médicos a la hora de prescribirlos.© The European Society of Cardiology 2020. Reservados todos los derechos. Para la solicitud de autorizaciones, contacte con: journals.permissions@oup.com.Las declaraciones de conflicto de intereses de los expertos que han participado en el desarrollo de esta guía están disponibles en la página web de la ESC: www.escardio.org/guidelines.El material adicional, con información de referencia y discusiones detalladas que sustentan esta guía, está disponible en la página web de European Heart Journal (Supplementary Data).Palabras clave:Angina inestable • Angioplastia • Antiagregantes plaquetarios • Anticoagulación • Apixabán • Ácido acetilsalicílico • Aterotrombosis • Bivalirudina • Bloqueadores beta • Cangrelor • Cirugía de revascularización coronaria • Clopidogrel • Cuidados cardiacos agudos • Dabigatrán • Diabetes • Edoxabán • Enoxaparina • Estrategia invasiva precoz • Fondaparinux • Guías de práctica clínica • Heparina • Infarto de miocardio • Infarto de miocardio sin elevación del segmento ST • Inhibición plaquetaria • Inhibidores de la glucoproteína IIb/IIIa • MINOCA • Isquemia miocárdica • Monitorización del ritmo • Nitratos • Prasugrel • Recomendaciones • Revascularización • Rivaroxabán • Sangrado • Síndrome coronario agudo • Sociedad Europea de Cardiología • Stent • Ticagrelor • Tratamiento antiagregante plaquetario triple • Tratamiento antitrombótico doble • Troponina de alta sensibilidad • Unidad de dolor torácico.