Las guías tienen como objetivo reunir y evaluar toda la evidencia relevante disponible durante el proceso de elaboración sobre un tema determinado para ayudar a los médicos a seleccionar la mejor estrategia posible de tratamiento para un paciente en particular que sufre una enfermedad concreta. Las guías y las recomendaciones deben ayudar a los profesionales de la salud en la toma de decisiones clínicas en su ejercicio diario. No obstante, la decisión final sobre un paciente concreto debe tomarla el médico responsable de su salud, en consulta con el propio paciente o, cuando proceda, con la persona encargada de sus cuidados.
En los últimos años, la Sociedad Europea de Cardiología (ESC), además de otras sociedades y organizaciones científicas, ha publicado un gran número de guías. Debido al impacto de estas, se han establecido criterios de calidad para su elaboración de modo que todas las decisiones se presenten de manera clara y transparente al usuario. Las recomendaciones de la ESC para la elaboración y publicación de guías están disponibles en el apartado de guías de la página web de la ESC (http://www.escardio.org/Guidelines). Las guías de la ESC representan la postura oficial de la ESC sobre un tema particular y se actualizan con regularidad.
Además de la publicación de las guías de práctica clínica, la ESC desarrolla el EurObservational Research Programme sobre registros internacionales de enfermedades e intervenciones cardiovasculares, que es esencial para evaluar los procesos diagnósticos/terapéuticos, el uso de los recursos y la adherencia a las guías. El objetivo de estos registros es mejorar la comprensión de la práctica médica en Europa y el mundo, basándose en datos de alta calidad recogidos durante el ejercicio clínico diario.
Además, la ESC ha desarrollado e incluido en este documento una serie de indicadores de calidad (IQ), que son herramientas que permiten evaluar el grado de implementación de las guías. La ESC, hospitales, servicios públicos y profesionales de la salud pueden utilizar estos indicadores para cuantificar la práctica clínica, así como en programas educativos junto con los mensajes clave de las guías para mejorar la calidad de la atención y los resultados clínicos.
Los miembros de este Grupo de Trabajo han sido seleccionados por la ESC y han incluido una representación de las subespecialidades más relevantes para representar a los profesionales dedicados a los cuidados médicos de los pacientes con esta enfermedad. Los expertos seleccionados llevaron a cabo una revisión exhaustiva de la evidencia publicada sobre la atención a una entidad concreta según las normas establecidas por el Comité de la ESC para la elaboración de las guías. Además, se llevó a cabo la evaluación crítica de los procedimientos diagnósticos y terapéuticos, incluida la valoración del cociente riesgo/beneficio. Se valoraron el nivel de evidencia y la fuerza de la recomendación de una opción terapéutica particular según escalas predefinidas, tal como se indica más adelante.
Los miembros del panel de redacción y los revisores del documento han declarado por escrito cualquier relación que se pueda considerar conflicto de intereses real o potencial. Estas declaraciones escritas están archivadas y disponibles en la página web de la ESC (http://www.escardio.org/guidelines) en un documento suplementario publicado simultáneamente a la guía. Este proceso garantiza la transparencia y evita posibles sesgos en los procesos de desarrollo y revisión. Durante el periodo de redacción, las modificaciones en las relaciones que se pudieran considerar conflicto de intereses se notificaron a la ESC y se actualizaron. El informe del Grupo de Trabajo fue financiado en su totalidad por la ESC y se desarrolló sin ninguna participación de la industria.
El Comité para la elaboración de las guías de la ESC supervisa y coordina la preparación de nuevas guías. El Comité es responsable también del proceso de aprobación de las guías. El Comité de la ESC y expertos externos revisaron exhaustivamente el documento, tras lo cual fue aprobado por todos los miembros del Grupo de Trabajo. Por último, el documento final fue aprobado por el Comité de la ESC para su publicación en European Heart Journal. La presente guía se elaboró tras la meticulosa evaluación del conocimiento científico y médico y de la evidencia disponible hasta la fecha de su redacción.
La tarea de elaboración de las guías incluye no solo la integración de la investigación más reciente, sino también la creación de herramientas educativas y programas de implementación de las recomendaciones. Para su implementación, se desarrollan ediciones de bolsillo, resúmenes en diapositivas y tarjetas, folletos con mensajes clave y versiones electrónicas para aplicaciones digitales (smartphones, etc.). Estas versiones son resumidas, por lo que en caso de necesidad debe consultarse la versión completa que se encuentra disponible gratuitamente en las páginas web de la ESC y EHJ. Se recomienda a las sociedades nacionales que forman parte de la ESC suscribir, traducir e implementar las guías de la ESC. Los programas de implementación son necesarios porque se ha demostrado que los resultados clínicos se ven favorablemente influidos por la aplicación de las recomendaciones clínicas.
Se recomienda a los profesionales de la salud que tengan en consideración la presente guía de la ESC en la toma de decisiones clínicas en su ejercicio diario, así como en la determinación y la implementación de estrategias preventivas, diagnósticas y terapéuticas; no obstante, la decisión final sobre el cuidado de un paciente concreto, en consulta con dicho paciente y, si fuera necesario, con su representante legal, debe tomarla el médico responsable de su cuidado. Además, es responsabilidad del profesional de la salud comprobar la normativa aplicable a fármacos y dispositivos médicos antes de su prescripción.
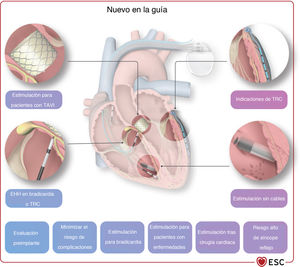
2INTRODUCCIÓNLa estimulación cardiaca es una parte importante de la electrofisiología y la cardiología en general. Aunque algunas situaciones que requieren estimulación cardiaca están claras y no han cambiado con los años, otras han evolucionado y han sido objeto de un exhaustivo trabajo de investigación reciente, como es el caso de la estimulación después del síncope (véase el apartado 5), la estimulación tras el implante percutáneo de válvula aórtica (TAVI) (véase el apartado 8), la terapia de resincronización cardiaca (TRC) para la insuficiencia cardiaca (IC) y la prevención de la miocardiopatía inducida por estimulación cardiaca (véase el apartado 6), y la estimulación en diversas cardiopatías infiltrativas e inflamatorias y en determinadas miocardiopatías (véase el apartado 8). Otros temas novedosos son las nuevas herramientas de diagnóstico para la toma de decisiones sobre estimulación (véase el apartado 4), así como un área completamente nueva de estimulación del haz de His y la rama izquierda (véase el apartado 7). Además, ha aumentado el interés por otras áreas de conocimiento, por ejemplo, cómo minimizar sistemáticamente el riesgo del procedimiento y evitar las complicaciones de la estimulación cardiaca (véase el apartado 9), cómo tratar a los pacientes portadores de marcapasos en situaciones especiales como la necesidad de una resonancia magnética (RM) o radioterapia (véase el apartado 11), cómo usar la monitorización a distancia para el seguimiento de pacientes con marcapasos y cómo incluir la toma de decisiones compartida en la atención a esta población de pacientes (véase el apartado 12).
La última guía de la ESC se publicó en 2013; por lo tanto, se ha considerado oportuno y necesario redactar una nueva versión actualizada. Para abordar estos temas, en la nueva guía se ha configurado un grupo de trabajo que ha recibido las aportaciones de los principales expertos en el campo de la estimulación cardiaca y representantes de diversas asociaciones, como la Association for Acute CardioVascular Care, la Heart Failure Association, la European Association of Cardiothoracic Surgery, la European Association of Percutaneous Cardiovascular Interventions, la Association of Cardiovascular Nursing & Allied Professions y el grupo de trabajo de la ESC de Myocardial and Pericardial Diseases.
2.1Revisión de la evidenciaEste documento está dividido en apartados, y cada uno de ellos tiene un coordinador y varios autores. Se pidió a los autores que revisaran minuciosamente la bibliografía reciente sobre sus temas y presentaran recomendaciones organizadas según la clasificación y el nivel de evidencia. Cuando los datos parecían controvertidos, se pidió a un metodólogo (Dipak Kotecha) que evaluara el grado de su solidez y ayudara a determinar la clase de recomendación y el nivel de evidencia. Todas las recomendaciones fueron votadas por todos los autores del documento y solo se aceptaron si estaban respaldadas por al menos el 75% de los coautores.
Los líderes (Jens Cosedis Nielsen y Michael Glikson) y los coordinadores (Yoav Michowitz y Mads Brix Kronborg) de este documento han sido los responsables de alinear las recomendaciones en los diversos apartados, y varios miembros del comité de redacción se han encargado de la superposición de las recomendaciones con otras guías de la ESC, como las guías de IC y valvulopatías.
2.2Relaciones con la industriaTodo el trabajo recogido en este documento ha sido voluntario y todos los coautores han tenido que declarar y demostrar que no tienen conflictos de intereses según lo definido recientemente por el Comité de Guías Científicas de la ESC y la junta de la ESC.
2.3Qué hay de nuevo en esta guía2.3.1Conceptos nuevos y secciones nuevasSee Table 3
2.3.2Recomendaciones nuevas en 2021See Table 4
2.3.3Cambios en las recomendaciones sobre estimulación cardiaca y terapia de resincronizaciónSee Table 5
3ANTECEDENTES3.1EpidemiologíaSe desconocen la prevalencia y la incidencia del implante de marcapasos en muchos países, aunque se han publicado algunas estimaciones basadas en el análisis de grandes estudios observacionales y bases de datos. Se ha descrito una amplia variabilidad entre los países europeos en cuanto al número de implantes de marcapasos, que oscila desde menos de 25 implantes/millón hab. en Azerbaiyán, Bosnia y Herzegovina y Kirguistán, a más de 1.000/millón en Francia, Italia y Suecia1. Esta disparidad en la tasa de implantes puede ser el resultado de un infratratamiento o sobretratamiento con marcapasos en algunos países o reflejar diferencias en las características sociodemográficas y la prevalencia de la enfermedad. Se está produciendo un crecimiento continuo del implante de marcapasos debido al aumento de la esperanza de vida y el envejecimiento poblacional2–8. El número estimado de pacientes sometidos a implante de marcapasos en todo el mundo ha aumentado de manera constante hasta una tasa anual de 1 millón de dispositivos2. La degeneración del sistema de conducción cardiaca y los cambios en la conducción intercelular pueden ser manifestaciones de una enfermedad cardiaca o no cardiaca y son muy prevalentes en los pacientes de edad avanzada. Por ello, la mayoría de las bradicardias que requieren estimulación cardiaca se observan en los ancianos y más del 80% de los marcapasos se implantan en pacientes mayores de 65 años.
3.2Historia naturalEl bloqueo auriculoventricular (BAV) de alto grado y la disfunción del nódulo sinusal (DNS) son las indicaciones más habituales para el tratamiento de estimulación cardiaca permanente. Los pacientes con BAV de alto grado tratados de manera conservadora (es decir, sin estimulación) tienen una supervivencia significativamente peor que los tratados con marcapasos9–12. Por el contrario, los pacientes con DNS tienen un curso impredecible, y no hay evidencia que indique que el tratamiento con marcapasos mejore su pronóstico13–15.
No obstante, la mejora de la esperanza de vida no es el único objetivo del tratamiento con estimulación cardiaca. La calidad de vida es una medida fundamental para cuantificar el estado y los resultados clínicos del paciente y proporciona una imagen holística de la eficacia del tratamiento clínico16. Los estudios demuestran unánimemente una mejor calidad de vida de los pacientes que reciben tratamiento de estimulación cardiaca17–22.
3.3Fisiopatología y clasificación de las bradiarritmias con indicación de terapia de estimulación cardiaca permanenteEn la tabla 1 del material adicional se presentan las definiciones de distintas anomalías de la conducción.
Clases de recomendación.
| Definición | Expresiones propuestas | |
|---|---|---|
| Clase I | Evidencia y/o acuerdo general en que un determinado procedimiento diagnóstico/tratamiento es beneficioso, útil y efectivo | Se recomienda/está indicado |
| Clase II | Evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia de un determinado tratamiento o procedimiento | |
| Clase IIa | El peso de la evidencia/opinión está a favor de su utilidad/eficacia | Se debe recomendar |
| Clase IIb | La utilidad/eficacia está menos establecida por la evidencia/opinión | Se puede recomendar |
| Clase III | Evidencia o acuerdo general en que un determinado tratamiento no es útil/efectivo y en algunos casos puede ser perjudicial | No se recomienda |
La bradicardia sinusal puede considerarse una respuesta fisiológica a situaciones específicas, como las de deportistas entrenados, individuos jóvenes y durante el sueño. Las bradiarritmias patológicas dependen de la causa subyacente y, en términos generales, pueden clasificarse en bradiarritmias de etiologías intrínsecas y de etiologías extrínsecas. La edad avanzada y los cambios degenerativos relacionados con la edad son causas intrínsecas importantes de modificaciones en la iniciación y la propagación del impulso eléctrico del sistema de conducción. Además, las mutaciones genéticas se han relacionado con trastornos de la conducción (véase el apartado 4.3.5), y la miocardiopatía auricular23 puede ser una enfermedad específica que dé lugar a taquiarritmia supraventricular, DNS y enfermedad del nódulo auriculoventricular (NAV)24.
Es fundamental diferenciar las causas reversibles de las irreversibles en la bradicardia. Las posibles causas reversibles de bradicardia incluyen efectos adversos de fármacos, infarto de miocardio (IM), exposición a sustancias tóxicas, infecciones, cirugía y trastornos electrolíticos. En un estudio que incluyó a 277 pacientes con bradicardia remitidos al servicio de urgencias, los trastornos electrolíticos fueron la causa subyacente en el 4%, la intoxicación en el 6%, el infarto agudo de miocardio en el 14% y los efectos adversos de los medicamentos en el 21%25.
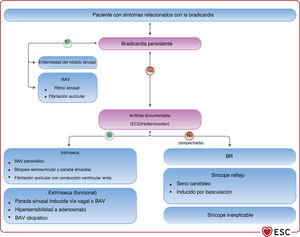
En el caso de causas patológicas de bradicardia irreversibles, la presencia y la gravedad de los síntomas son esenciales a la hora de considerar el tratamiento con estimulación cardiaca permanente. Esto puede constituir un desafío importante ante pacientes con mecanismos que compiten por los síntomas. En general, los candidatos a estimulación se pueden clasificar en 2 grupos: pacientes con bradicardia persistente y pacientes con bradicardia intermitente (con o sin electrocardiograma [ECG] documentado). La bradicardia persistente suele indicar una enfermedad intrínseca en el tejido del nódulo sinusal o el sistema de conducción auriculoventricular (AV), mientras que la bradicardia intermitente puede ser el resultado de una amplia variedad de procesos patológicos intrínsecos y extrínsecos, como se ilustra en la figura 226–31.
3.4Tipos y modos de estimulación cardiaca: descripción general3.4.1Estimulación cardiaca endocárdicaLos marcapasos endocárdicos basados en electrodos consisten en un generador de impulsos que se suele colocar en la región pectoral y unos cables transvenosos implantados en el miocardio que tienen la capacidad de detectar la actividad cardiaca y proporcionar estimulación cardiaca terapéutica. Desde la introducción de los marcapasos endocárdicos transvenosos en la década de los sesenta, se han producido grandes avances técnicos que han mejorado su eficacia y su seguridad. En general, el implante de marcapasos se considera un procedimiento de bajo riesgo, aunque no está exento de complicaciones y problemas de mal funcionamiento relacionados con el dispositivo y el procedimiento. El implante de marcapasos se trata en detalle en un documento de consenso de expertos reciente elaborado por la European Heart Rhythm Association (EHRA)34.
3.4.2Estimulación cardiaca endocárdicaEn algunos contextos clínicos es necesario implantar un marcapasos epicárdico, como en el caso de pacientes con anomalías congénitas que no tienen acceso venoso al corazón o presentan una derivación abierta entre los lados derecho e izquierdo de la circulación, infecciones recurrentes del dispositivo o venas ocluidas, y —hoy lo más habitual— junto con cirugía cardiaca abierta. Actualmente, los cables epicárdicos se implantan mediante diversas técnicas de toracotomía o toracoscopia y robótica (mínimamente invasivas)35.
3.4.3Terapia de resincronización cardiaca (endocárdica y epicárdica)La disincronía cardiaca es el desajuste temporal entre la activación eléctrica y la activación mecánica de los ventrículos, lo que puede causar un deterioro de la eficiencia cardiaca. La TRC proporciona una estimulación biventricular dirigida a corregir la disincronía electromecánica y así aumentar el gasto cardiaco36. Numerosos estudios clínicos han demostrado que la TRC mejora significativamente la morbimortalidad en grupos específicos de pacientes con fracción de eyección del ventrículo izquierdo (FEVI) reducida37–40.
3.4.4Métodos alternativos (estimulación del sistema de conducción, estimulación sin cables)3.4.4.1Estimulación del sistema de conducciónLa estimulación del haz de His (EHH) proporciona una activación eléctrica simultánea de los ventrículos a través del sistema de His-Purkinje que es más fisiológica que la estimulación del ventrículo derecho (VD). La EHH puede restaurar la conducción en un subgrupo de pacientes con BAV de alto grado y acortar la duración del QRS en algunos casos de bloqueo de rama izquierda (BRI) o bloqueo de rama derecha (BRD) 41–44. Son necesarios más estudios para evaluar si la EHH tiene mayores beneficios clínicos que la TRC o la estimulación del ventrículo derecho (VD). Además, la estimulación de la región de la rama izquierda del haz de His se está estudiando como modalidad de estimulación para pacientes en los que la enfermedad de conducción es demasiado distal para una EHH (véase el apartado 7.3).
3.4.4.2Estimulación sin cablesSe han desarrollado marcapasos intracardiacos miniaturizados sin cables. Estos dispositivos se insertan vía percutánea por la vena femoral y se implantan directamente en la pared del VD con unos sistemas de colocación personalizados basados en catéteres. Se ha demostrado que los marcapasos sin cables de primera generación brindan un tratamiento de estimulación unicameral eficaz45–50. Sin embargo, aunque se trata de una tecnología prometedora, la dificultad para retirar el dispositivo sin cables una vez que ha finalizado su servicio sigue siendo una limitación para que se generalice. Hasta el momento, no se dispone de ensayos controlados aleatorizados que permitan comparar los resultados clínicos entre la estimulación sin cables y la estimulación transvenosa unicameral.
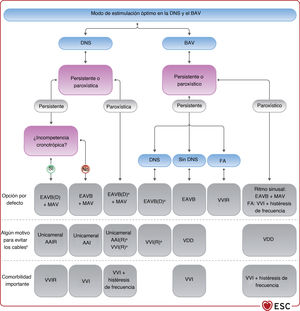
3.4.5Selección del modo de estimulación cardiacaLos avances tecnológicos en el tratamiento de estimulación cardiaca han dado lugar a una amplia variedad de modalidades terapéuticas. Los marcapasos pueden detectar la actividad eléctrica intrínseca del corazón y restaurar la frecuencia y la secuencia AV de la activación cardiaca. Los trastornos de la conducción y la automaticidad cardiaca pueden tratarse mediante detección/estimulación auricular de un solo cable, detección/estimulación ventricular de un solo cable, cables únicos que estimulan el VD y detectan tanto la aurícula como el ventrículo, y sistemas de cables dobles que detectan y estimulan la aurícula derecha (AD) y el VD. Los modos de estimulación habituales se presentan en la tabla 2 del material adicional. La elección del modo óptimo de estimulación en presencia de anomalías de la conducción depende de la morbilidad subyacente, el impacto del tratamiento de estimulación en la morbilidad y el posible efecto perjudicial de la modalidad de estimulación elegida. La elección de los modos de estimulación en situaciones específicas se analiza en el apartado 5.
Niveles de evidencia.
| Nivel de evidencia A | Datos procedentes de múltiples ensayos clínicos aleatorizados o metanálisis |
|---|---|
| Nivel de evidencia B | Datos procedentes de un único ensayo clínico aleatorizado o de grandes estudios no aleatorizados |
| Nivel de evidencia C | Consenso de opinión de expertos y/o pequeños estudios, estudios retrospectivos, registros |
El nódulo sinusal modula la frecuencia cardiaca durante diferentes tipos y niveles de esfuerzo (es decir, ejercicio físico, emociones, cambios posturales y fiebre) proporcionalmente a la demanda metabólica. Los sistemas de marcapasos con respuesta en frecuencia intentan producir una frecuencia cardiaca compensatoria adecuada durante la actividad emocional o física al detectar el movimiento/aceleración del cuerpo, la ventilación por minuto, la impedancia intracardiaca y otras variables relacionadas con el estrés físico y mental, y están indicados en casos de incompetencia cronotrópica51–57. La estimulación con respuesta en frecuencia de doble detección (por ejemplo, con acelerómetro y ventilación por minuto) puede ser útil en grupos de pacientes seleccionados58. En la tabla 3 del material adicional se ofrece una breve descripción de los sensores de estimulación con respuesta en frecuencia más utilizados.
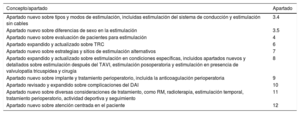
Conceptos y apartados nuevos de la guía.
| Concepto/apartado | Apartado |
|---|---|
| Apartado nuevo sobre tipos y modos de estimulación, incluidas estimulación del sistema de conducción y estimulación sin cables | 3.4 |
| Apartado nuevo sobre diferencias de sexo en la estimulación | 3.5 |
| Apartado nuevo sobre evaluación de pacientes para estimulación | 4 |
| Apartado expandido y actualizado sobre TRC | 6 |
| Apartado nuevo sobre estrategias y sitios de estimulación alternativos | 7 |
| Apartado expandido y actualizado sobre estimulación en condiciones específicas, incluidos apartados nuevos y detallados sobre estimulación después del TAVI, estimulación posoperatoria y estimulación en presencia de valvulopatía tricuspídea y cirugía | 8 |
| Apartado nuevo sobre implante y tratamiento perioperatorio, incluida la anticoagulación perioperatoria | 9 |
| Apartado revisado y expandido sobre complicaciones del DAI | 10 |
| Apartado nuevo sobre diversas consideraciones de tratamiento, como RM, radioterapia, estimulación temporal, tratamiento perioperatorio, actividad deportiva y seguimiento | 11 |
| Apartado nuevo sobre atención centrada en el paciente | 12 |
DAI: desfibrilador automático implantable; RM: resonancia magnética; TAVI: implante percutáneo de válvula aórtica; TRC: terapia de resincronización cardiaca.
Las indicaciones de estimulación cardiaca y las tasas de complicaciones difieren entre varones y mujeres. En los varones, el implante de un marcapasos suele estar más indicado para el BAV y menos para la DNS y la fibrilación auricular (FA) con bradicardia59,60. En las mujeres, la tasa de eventos adversos (corregida por edad y tipo de dispositivo) relacionados con el procedimiento es significativamente más alta, principalmente por mayor incidencia de neumotórax, derrame pericárdico y hematomas de bolsillo59–61. Esta diferencia puede deberse al menor tamaño corporal de las mujeres y otras diferencias anatómicas, como el menor diámetro de las venas y el VD.
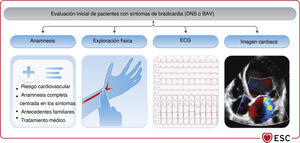
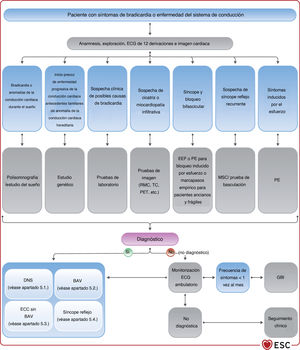
4EVALUACIÓN DEL PACIENTE CON BRADICARDIA O ENFERMEDAD DEL SISTEMA DE CONDUCCIÓN SOSPECHADAS O DOCUMENTADAS4.1Anamnesis y exploración físicaUna anamnesis y una exploración física adecuadas son esenciales para la evaluación de los pacientes con bradicardia sospechada o documentada (figura 3). La guía vigentee destaca la importancia de la anamnesis y la exploración física en la evaluación inicial, sobre todo para identificar a los pacientes con cardiopatía estructural62,63.
La anamnesis debe incluir los antecedentes familiares, la evaluación integral del riesgo cardiovascular y diagnósticos recientes/históricos que puedan causar bradicardia, y debe centrarse en la frecuencia, la gravedad y la duración de los síntomas que puedan indicar bradicardia o enfermedad del sistema de conducción. También se debe explorar la relación de los síntomas con actividad física, angustia emocional, cambios posturales, tratamiento médico (tabla 6) y desencadenantes típicos (p. ej., micción, defecación, tos, bipedestación prolongada y afeitado), así como la frecuencia del pulso si se mide durante un episodio.
Indicaciones nuevas en 2021.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Evaluación de pacientes con bradicardia o enfermedad del sistema de conducción sospechadas o documentadas | ||
| Monitorización | ||
| En pacientes con síncope inexplicable infrecuente (menos de uno al mes) u otros síntomas que puedan estar causados por la bradicardia, en los que la evaluación global no ha podido demostrar la causa, se recomienda monitorización ambulatoria a largo plazo con GBI. | I | A |
| Se recomienda monitorización ECG ambulatoria para la evaluación de pacientes con sospecha de bradicardia, con el fin de correlacionar las anomalías del ritmo con los síntomas | I | C |
| Masaje carotídeo | ||
| Se recomienda MSC después de excluir estenosis carotídea para pacientes con síncope de causa desconocida compatible con un mecanismo reflejo o síntomas relacionados con la presión/manipulación de la región del seno carotídeo | I | B |
| Prueba de basculación | ||
| Se debe considerar la prueba de mesa basculante para pacientes con sospecha de síncope reflejo recurrente | IIa | B |
| Prueba de esfuerzo | ||
| Se recomienda la prueba de esfuerzo para pacientes con síntomas sospechosos de bradicardia durante o inmediatamente después del esfuerzo | I | C |
| Para los pacientes con sospecha de incompetencia cronotrópica, se debe considerar las pruebas de esfuerzo para confirmar el diagnóstico | IIa | B |
| Para los pacientes con enfermedad de la conducción intraventricular o BAV de grado desconocido, se puede considerar la prueba de esfuerzo para exponer el bloqueo infranodular | IIb | C |
| Imagen | ||
| Se recomiendan pruebas de imagen cardiaca para pacientes con bradicardia sintomática sospechada o documentada para evaluar la presencia de cardiopatía estructural, determinar la función sistólica del VI y diagnosticar las posibles causas de las anomalías de la conducción | I | C |
| Se debe considerar la obtención de imágenes multimodales (RMC, TC, PET) para la caracterización del tejido miocárdico en el diagnóstico de afecciones específicas asociadas con anomalías de la conducción que requieran el implante de marcapasos, sobre todo en pacientes menores de 60 años | IIa | C |
| Pruebas de laboratorio | ||
| Además de las pruebas de laboratorio previas al implanted, se recomienda realizar pruebas de laboratorio específicas para pacientes con sospecha clínica de posibles causas de bradicardia subyacentes (p. ej., pruebas de función tiroidea, título de Lyme, concentraciones digitálicos, potasio, calcio y pH) para diagnosticar y tratar estas afecciones | I | C |
| Evaluación del sueño | ||
| Se recomienda el cribado de SAS en pacientes con síntomas de SAS y cuando haya bradicardia grave o BAV avanzado durante el sueño | I | C |
| Estudio electrofisiológico | ||
| Se debe considerar el EEF para los pacientes con síncope y bloqueo bifascicular cuando el síncope siga siendo inexplicable tras una evaluación no invasiva o cuando se precise una decisión inmediata sobre la estimulación debido a la gravedad, a menos que se prefiera el implante empírico de marcapasos (especialmente en ancianos y personas frágiles) | IIa | B |
| Para los pacientes con síncope y bradicardia sinusal, se puede considerar el EEF cuando las pruebas no invasivas no hayan demostrado una correlación entre el síncope y la bradicardia | IIb | B |
| Genética | ||
| Se debe considerar hacer pruebas genéticas a los pacientes con inicio precoz (menos de 50 años) de enfermedad de conducción cardiaca progresiva | IIa | C |
| Se debe considerar hacer pruebas genéticas a los familiares tras la identificación de una variante genética patogénica que explique el fenotipo clínico de la enfermedad de conducción cardiaca en un caso índice | IIa | C |
| Estimulación cardiaca para la bradicardia y la enfermedad del sistema de conducción | ||
| Está indicada la estimulación para los pacientes sintomáticos con DNS en forma de bradicardia-taquicardia para corregir las bradiarritmias y facilitar el tratamiento farmacológico, a menos que se prefiera la ablación de la taquiarritmia | I | B |
| Está indicada la estimulación para los pacientes con arritmia auricular (principalmente FA) y BAV permanente o paroxístico de tercer grado (o alto grado) independientemente de los síntomas | I | C |
| En pacientes con DNS y EAVB, se recomienda minimizar la estimulación ventricular innecesaria mediante la programación | I | A |
| La estimulación cardiaca bicameral está indicada para reducir el síncope recurrente en pacientes mayores de 40 años con síncopes recurrentes, impredecibles y graves que tengan: • Pausa asistólica sintomática documentada espontánea > 3 s o pausa/s asintomática/s > 6 s por parada sinusal o BAV o • Síndrome del seno carotídeo cardioinhibitorio o • Síncope asistólico durante la prueba de basculaciónA | ||
| Para los pacientes con caídas recurrentes inexplicables, se debe considerar la misma evaluación que para el síncope inexplicable | IIa | C |
| Debe considerarse la ablación de FA para evitar el implante de marcapasos en pacientes con bradicardia relacionada con FA o pausas de preautomatismo sintomáticas, tras la conversión de FA, teniendo en cuenta la situación clínica | IIa | C |
| Para lso pacientes con DNS en forma de bradicardia-taquicardia, se puede considerar la programación de EAT auricular | IIb | B |
| Se puede considerar la estimulación cardiaca bicameral para reducir las recurrencias de síncope en pacientes con las características clínicas de síncope sensible a la adenosina | IIb | B |
| Terapia de resincronización cardiaca | ||
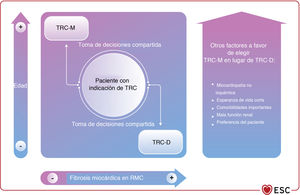
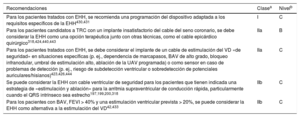
| Para los pacientes candidatos a DAI que tengan indicación de TRC, se recomienda implantar TRC-D | I | A |
| Para los pacientes candidatos a TRC, se debe considerar el implante de TRC-D tras la evaluación individual del riesgo con una estrategia de toma de decisiones compartida | IIa | B |
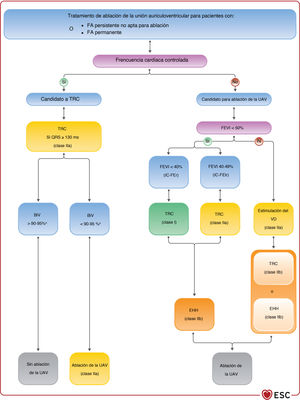
| Para los pacientes con FA sintomática y frecuencia cardiaca incontrolada que son candidatos a ablación de la UAV (independientemente de la duración del QRS), se debe considerar TRC en lugar de estimulación estándar VD si hay IC-FElr | IIa | C |
| Para los pacientes con FA sintomática y frecuencia cardiaca incontrolada que son candidatos a ablación de la UAV (independientemente de la duración del QRS), se debe considerar la estimulación VD si hay IC-FEr | IIa | B |
| Para los pacientes con FA sintomática y frecuencia cardiaca incontrolada que son candidatos a ablación de la UAV (independientemente de la duración del QRS), se puede considerar la TRC si hay IC-FEr | IIb | B |
| Estimulación de sitios alternativos | ||
| Estimulación del haz de His | ||
| Para los pacientes tratados con EHH, se recomienda una programación del dispositivo adaptada a los requisitos específicos de la EHH | I | C |
| Para los candidatos a TRC con un implante del cable del seno coronario no satisfactorio, la EHH debe considerarse como una opción de tratamiento junto con otras técnicas, como el cable epicárdico quirúrgico | IIa | B |
| Para los pacientes tratados con EHH, se debe considerar el implante de un cable de VD «de seguridad» para situaciones específicas (como dependencia de marcapasos, BAV de alto grado, bloqueo infranodular, umbral de estimulación alto, ablación de la UAV programada) o como sensor en caso de problemas de detección (p. ej., riesgo de subdetección ventricular o sobredetección de potenciales hisianos/auriculares) | IIa | C |
| Puede considerarse la EHH con cable ventricular de seguridad para los pacientes que tengan indicada una estrategia de «estimulación y ablación» para la arritmia supraventricular de conducción rápida, especialmente cuando el QRS intrínseco es estrecho | IIb | C |
| La EHH puede considerarse como alternativa a la estimulación del VD en pacientes con BAV y FEVI > 40% cuando se prevea una estimulación ventricular > 20% | IIb | C |
| Estimulación sin cables | ||
| Se debe considerar el uso de marcapasos sin cables como alternativa a los marcapasos transvenosos cuando no exista un acceso venoso en las extremidades superiores o cuando el riesgo de infección del bolsillo del dispositivo sea particularmente alto, como en el caso de pacientes que han tenido una infección previa y pacientes en hemodiálisis | IIa | B |
| Los marcapasos sin cables pueden considerarse como alternativa a la estimulación ventricular estándar de un solo cable teniendo en cuenta la esperanza de vida y utilizando una estrategia de toma de decisiones compartida | IIb | C |
| Indicaciones de estimulación en condiciones específicas | ||
| Estimulación en el infarto agudo de miocardio | ||
| Las recomendaciones para implante de marcapasos permanente son las mismas que para la población general (apartado 5.2) cuando el BAV no se resuelva en un plazo de espera ≥ 5 días tras el IM | I | C |
| Se puede considerar el implante precoz del dispositivo (TRC-D/TRC-M) para pacientes con BAV seleccionados en el contexto de IM de la pared anterior e IC aguda | IIb | C |
| Estimulación en cirugía cardiaca | ||
| BAV de alto grado o completo tras cirugía cardiaca. Está indicado un periodo de observación clínica de al menos 5 días para evaluar si la alteración del ritmo es transitoria y se resuelve espontáneamente. No obstante, en caso de BAV completo con ritmo de escape bajo o nulo, el periodo de observación puede acortarse si la resolución espontánea es poco probable | I | C |
| DNS después de cirugía cardiaca y trasplante de corazón. Antes de implantar un marcapasos permanente, se debe considerar un periodo de observación de hasta 6 semanas | IIa | C |
| Incompetencia cronotrópica después de trasplante de corazón. Se debe considerar la estimulación cardiaca en caso de incompetencia cronotrópica que persista más de 6 semanas después de un trasplante cardiaco para mejorar la calidad de vida | IIa | C |
| Cirugía por endocarditis valvular y BAV completo intraoperatorio. Se debe considerar el implante inmediato de un marcapasos epicárdico en pacientes sometidos a cirugía por endocarditis valvular y BAV completo si está presente uno de los siguientes predictores de persistencia: anomalía de la conducción preoperatoria, infección por Staphylococcus aureus, absceso intracardiaco, afección de la válvula tricúspide o cirugía valvular previa | IIa | C |
| Pacientes que requieren estimulación en el momento de la cirugía de la válvula tricúspide. Deben evitarse los cables transvalvulares y utilizar cables ventriculares epicárdicas. Durante la cirugía de la válvula tricúspide, se debe considerar la extracción de los cables transvalvulares preexistentes en lugar de coser el cable entre el anillo y la bioprótesis. En caso de anuloplastia tricuspídea aislada, se puede dejar el cable ventricular derecho preexistente en su sitio sin encerrarlo entre el anillo y el annulus después de valorar el riesgo-beneficio de forma individualizada | IIa | C |
| Pacientes que requieren estimulación después de sustitución biológica de la válvula tricúspide/reparación del anillo. Se debe considerar el implante transvenoso de un cable del seno coronario o la colocación mínimamente invasiva de un cable ventricular epicárdico cuando esté indicada la estimulación ventricular, con preferencia al abordaje transvenoso transvalvular | IIa | C |
| Pacientes que requieren estimulación después de la sustitución mecánica de la válvula tricúspide. Debe evitarse el implante de un cable de VD transvalvular | III | C |
| Estimulación en el implante percutáneo de válvula aórtica | ||
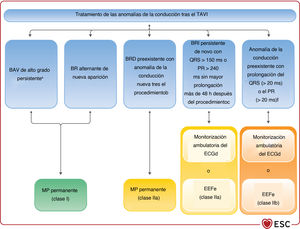
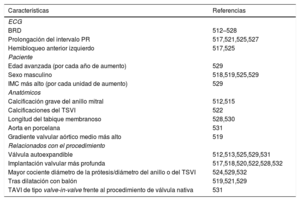
| Se recomienda la estimulación permanente para los pacientes con BAV completo o de alto grado que persista 24-48 h tras el TAVI | I | B |
| Se recomienda la estimulación permanente para los pacientes con BR alternante de nueva aparición después del TAVI | I | C |
| Se debe considerar la estimulación precoze permanente para los pacientes con BRD preexistente que desarrollen cualquier otra anomalía de la conducción durante o después del TAVIf | IIa | B |
| Se debe considerar monitorización con ECG ambulatoriag o EEFh para los pacientes con BRI nuevo con QRS > 150 ms o PR > 240 ms sin mayor prolongación más de 48 h tras el TAVI | IIa | C |
| Para el acceso venoso, la vena cefálica o axilar debe considerarse como primera opción. | IIa | C |
| Se deben considerar los electrodos cuadripolares como primera opción para la implantación de cables del seno coronario. | IIa | C |
| Se debe considerar el uso de múltiples proyecciones fluoroscópicas para confirmar la posición del electrodo ventricular. | IIa | C |
| Se debe considerar el lavado del bolsillo del dispositivo con solución salina para cerrar la herida. | IIa | C |
| En pacientes sometidos a un procedimiento de reintervención de DAI, se puede considerar el uso de un recubrimiento liberador de antibiótico. | IIb | B |
| Se puede considerar la estimulación del tabique medio ventricular en pacientes con alto riesgo de perforación (ancianos, perforación previa). | IIb | C |
| Se puede considerar un bolsillo submuscular para implante de marcapasos en pacientes con problemas de bolsillo, tales como mayor riesgo de erosión debido a IMC bajo, síndrome de Twiddler o razones estéticas. | IIb | C |
| No está recomendado el tratamiento puente con heparina en pacientes anticoagulados. | III | A |
| No se recomienda la implantación de marcapasos permanente en pacientes con fiebre. La implantación de marcapasos debe retrasarse hasta que el paciente haya estado afebril durante al menos 24 h. | III | B |
| Consideraciones sobre el manejo | ||
| Monitorización remota | ||
| Se recomienda el control remoto del dispositivo para reducir el número de visitas presenciales de seguimiento en pacientes portadores de marcapasos que tengan dificultades para acudir a la consulta médica (problemas de movilidad reducida o preferencias del paciente). | I | A |
| Se recomienda la monitorización remota en caso de que un componente del dispositivo haya sido retirado del mercado o vaya a retirarse próximamente, para permitir la detección precoz de episodios, especialmente en pacientes con mayor riesgo (por ejemplo, pacientes dependientes de marcapasos). | I | C |
| El seguimiento de rutina en consulta de los marcapasos monocamerales y bicamerales puede espaciarse hasta 24 meses en pacientes con control remoto del dispositivo. | IIa | A |
| Estimulación temporal | ||
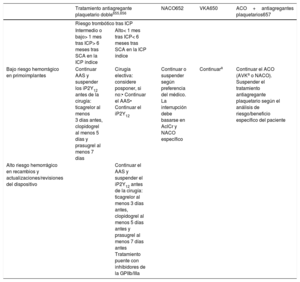
| Se recomienda la estimulación transvenosa temporal en casos de bradiarritmia con compromiso hemodinámico refractaria a fármacos cronotrópicos intravenosos. | I | C |
| La estimulación transcutánea debe considerarse en casos de bradiarritmia con compromiso hemodinámico cuando la estimulación transvenosa temporal no sea posible o no esté disponible. | IIa | C |
| Se debe considerar la estimulación transvenosa temporal cuando está indicada la estimulación inmediata y se espera que las indicaciones de estimulación sean reversibles, como en el contexto de isquemia miocárdica, miocarditis, alteraciones electrolíticas, exposición tóxica o después de cirugía cardiaca. | IIa | C |
| La estimulación transvenosa temporal debe considerarse como un tratamiento puente para la implantación de un marcapasos permanente, cuando este procedimiento no esté disponible de inmediato o no sea posible debido a una infección concomitante. | IIa | C |
| Para la estimulación transvenosa temporal a largo plazo, se debe considerar un cable de fijación activo insertado a través de la piel y conectado a un marcapasos externo. | IIa | C |
| Miscelánea | ||
| Cuando el marcapasos ya no esté indicado, la estrategia de manejo debe basarse en un análisis de riesgo-beneficio individual siguiendo un proceso de toma de decisiones compartido con el paciente. | I | C |
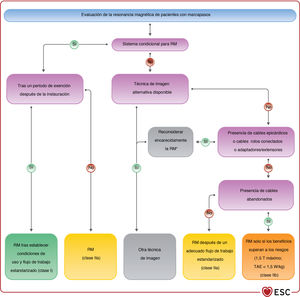
| Se puede considerar la IRM en pacientes con marcapasos con cables transvenosos abandonados si no se dispone de una modalidad de imagen alternativa. | IIb | C |
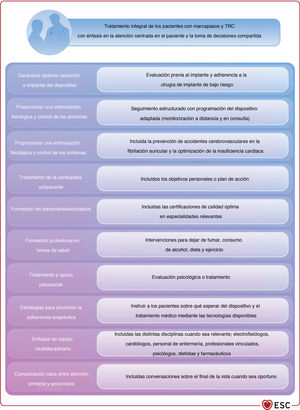
| Atención centrada en el paciente | ||
| En pacientes considerados para marcapasos o TRC, la decisión debe basarse en la mejor evidencia disponible teniendo en cuenta los riesgos-beneficios individuales de cada opción, las preferencias del paciente y los objetivos clínicos, y se recomienda seguir un abordaje integral utilizando los principios de la atención centrada en el paciente y la toma de decisiones compartida en la consulta. | I | C |
AV: auriculoventricular; BAV: bloqueo auriculoventricular; BR: bloqueo de rama; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; DAI: desfibrilador automático implantable; DNS: disfunción del nódulo sinusal; EAT: estimulación antitaquicárdica; EAVB: estimulación auriculoventricular bicameral; ECG: electrocardiograma; EEF: estudio electrofisiológico; EHH: estimulación del haz de His; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; GBI: grabador en bucle implantable; IC: insuficiencia cardiaca; IC-FElr: insuficiencia cardiaca con fracción de eyección ligeramente reducida; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; I-HV: intervalo His-ventricular; IM: infarto de miocardio; IMC: índice de masa corporal; MSC: masaje del seno carotídeo; PET: tomografía por emisión de positrones; PR: intervalo PR; QRS: ondas Q, R y S; RM: resonancia magnética; RMC: resonancia magnética cardiaca; RS: ritmo sinusal; SAS: síndrome de apnea del sueño; TAVI: implante percutáneo de válvula aórtica; TC: tomografía computarizada; TMO: tratamiento médico óptimo; TRC: terapia de resincronización cardiaca; TRC-M: terapia de resincronización cardiaca y marcapasos; TRD-D: terapia de resincronización cardiaca y desfibrilador; UAV: unión auriculoventricular; VD: ventrículo derecho; VI: ventrículo izquierdo.
aClase de recomendación.
bNivel de evidencia.
cNo se debe realizar MSC en pacientes con accidente isquémico transitorio previo, accidente cerebrovascular o estenosis carotídea conocida. La auscultación carotídea debe realizarse antes del MSC. Si hay soplo carotídeo, se debe realizar una ecografía carotídea para excluir enfermedad de la carótida.
dHemograma completo, tiempo de protrombina, tiempo de tromboplastina parcial, creatinina sérica y electrolitos.
eInmediatamente después del procedimiento o en las primeras 24h.
fBAV transitorio de alto grado, prolongación del intervalo PR, cambio del eje QRS.
gMonitorización elctrocardiográfica continua ambulatoria (implantable o externa) durante 7 a 30 días.
hEl estudio electrofisiológico con I-HV ≥ 70ms puede considerarse positivo para estimulación permanente.
iSiempre que esté indicada la estimulación en una enfermedad neuromuscular, se debe considerar un DAI de acuerdo con las guías correspondientes.
Cambios en las indicaciones de estimulación cardiaca y terapia de resincronización cardiaca desde 2013.
| 2013 | 2021 | |
|---|---|---|
| Clasea | ||
| Estimulación cardiaca para la bradicardia y la enfermedad del sistema de conducción | ||
| Se puede considerar la estimulación cardiaca para reducir el síncope recurrente cuando se documenten pausas asintomáticas > 6 s debidas a parada sinusal | IIa | IIb |
| Tratamiento de resincronización cardiaca | ||
| Los pacientes portadores de un marcapasos convencional o DAI que desarrollen IC sintomática con FEVI ≤ 35% a pesar de TMO y tengan una estimulación del VD significativab deben considerarse para progresar a TRC | I | IIa |
| Se recomienda TRC en lugar de estimulación VD para reducir la morbilidad de pacientes con IC-FEr (< 40%) independientemente de la clase funcional NYHA que tengan indicación de estimulación ventricular y BAV de alto grado. Esto incluye a pacientes con FA | IIa | I |
| Se debe considerar la TRC para los pacientes sintomáticos con IC en RS, FEVI ≤ 35%, QRS 130-149 ms y QRS con morfología de BRI a pesar del TMO para mejorar los síntomas y reducir la morbimortalidad | I | IIa |
| Para los pacientes con FA sintomática y frecuencia cardiaca incontrolada que son candidatos a ablación de la UAV (independientemente de la duración del QRS) se recomienda la TRC cuando haya IC-FEr | IIa | I |
| Indicaciones específicas para estimulación | ||
| Para los pacientes con cardiopatía congénita, se puede considerar la estimulación para el bloqueo bifascicular posoperatorio persistente asociado con BAV completo transitorio | IIa | IIb |
| Consideraciones sobre el tratamiento | ||
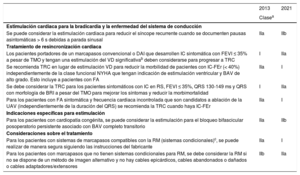
| Para los pacientes con sistemas de marcapasos compatibles con la RM (sistemas condicionales)c, se puede realizar de manera segura siguiendo las instrucciones del fabricante | IIa | I |
| Para los pacientes con marcapasos que no tienen sistemas condicionales para RM, se debe considerar la RM si no se dispone de un método de imagen alternativo y no hay cables epicárdicos, cables abandonados o dañados o cables adaptadores/extensores | IIb | IIa |
BAV: bloqueo auriculoventricular; BRI: bloqueo de rama izquierda; DAI: desfibrilador automático implantable; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; NYHA: New York Heart Association; RM: imagen por resonancia magnética; RS: ritmo sinusal; TMO: tratamiento médico óptimo; TRC: terapia de resincronización cardiaca; UAV: unión auriculoventricular; VD: ventrículo derecho.
aClase de recomendación.
bLos datos observacionales respaldan un valor límite de estimulación del VD del 20% para aplicar intervenciones dirigidas a la IC inducida por estimulación. Sin embargo, no hay datos que demuestren que el porcentaje de estimulación del VD defina un valor umbral de seguridad (por debajo del cual la estimulación sea segura y por encima del cual sea perjudicial).
cCombinación de generador con sistema condicional para RM y cables del mismo fabricante.
Fármacos que pueden causar bradicardia o anomalías de la conducción.
| Bradicardia del nódulo sinusal | BAV | |
|---|---|---|
| Bloqueadores beta | + | + |
| Antihipertensivos | ||
| Bloqueadores de los canales de calcio no dihidropiridínicos | + | + |
| Metildopa | + | – |
| Clonidina | + | – |
| Antiarrítmicos | ||
| Amiodarona | + | + |
| Dronedarona | + | + |
| Sotalol | + | + |
| Flecainida | + | + |
| Propafenona | + | + |
| Procainamida | – | + |
| Disopiramida | + | + |
| Adenosina | + | + |
| Digoxina | + | + |
| Ivabradina | + | – |
| Fármacos psicoactivos y neuroactivos | ||
| Donepezilo | + | + |
| Litio | + | + |
| Analgésicos opioides | + | – |
| Fenotiazina | + | + |
| Fenitoína | + | + |
| Inhibidores selectivos de la recaptación de serotonina | – | + |
| Antidepresivos tricíclicos | – | + |
| Carbamazepina | + | + |
| Otros | ||
| Relajantes musculares | + | – |
| Cannabis | + | – |
| Propofol | + | – |
| Ticagrelor | + | + |
| Corticoides a dosis altas | + | – |
| Cloroquina | – | + |
| Antagonistas H2 | + | + |
| Inhibidores de la bomba de protones | + | – |
| Quimioterapia | ||
| Trióxido de arsénico | + | + |
| Bortezomib | + | + |
| Capecitabina | + | – |
| Cisplatino | + | – |
| Ciclofosfamida | + | + |
| Doxorubicina | + | – |
| Epirubicina | + | – |
| 5-fluorouracilo | + | + |
| Ifosfamida | + | – |
| Interleucina 2 | + | – |
| Metotrexato | + | – |
| Mitroxantrona | + | + |
| Paclitaxel | + | – |
| Rituximab | + | + |
| Talidomida | + | + |
| Antraciclina | – | + |
| Taxano | – | + |
BAV: bloqueo auriculoventricular.
Los antecedentes familiares pueden ser especialmente importantes en pacientes jóvenes con enfermedad de conducción cardiaca progresiva, ya sea sola o junto con miocardiopatías o miopatías64,65.
La exploración física debe centrarse en las manifestaciones de bradicardia y los signos de cardiopatía estructural subyacente o trastornos sistémicos (tabla 7). Los pulsos periféricos lentos sintomáticos deben confirmarse con auscultación cardiaca o ECG para evitar un diagnóstico erróneo de bradicardia a partir de otras anomalías del ritmo (como contracciones ventriculares prematuras).
Causas de bradicardia intrínsecas y extrínsecas.
| Bradicardia sinusal o DNS | Anomalías de la UAV | |
|---|---|---|
| Intrínsecas | ||
| Idiopática (envejecimiento, degenerativa) | + | + |
| Infarto/isquemia | + | + |
| Miocardiopatías | + | + |
| Trastornos genéticos | + | + |
| Enfermedades infiltrativas | ||
| Sarcoidosis | + | + |
| Amiloidosis | + | + |
| Hemocromatosis | + | + |
| Enfermedades vasculares del colágeno | ||
| Artritis reumatoide | + | + |
| Escleroderma | + | + |
| Lupus eritematoso sistémico | + | + |
| Enfermedades de almacenamiento | + | + |
| Enfermedades neuromusculares | + | + |
| Enfermedades infecciosas | ||
| Endocarditis (absceso perivalvular) | – | + |
| Enfermedad de Chagas | + | + |
| Miocarditis | – | + |
| Enfermedad de Lyme | – | + |
| Difteria | – | + |
| Toxoplasmosis | – | + |
| Cardiopatías congénitas | + | + |
| Cirugía cardiaca | ||
| Cirugía coronaria | + | + |
| Cirugía valvular (incluido implante percutáneo de válvula aórtica) | + | + |
| Operación de Maze | + | – |
| Trasplante de corazón | + | + |
| Radioterapia | + | + |
| BAV provocado o iatrogénico | – | + |
| Ablación taquicardia sinusal | + | – |
| Extrínsecas | ||
| Entrenamiento físico (deportes) | + | + |
| Reflejo vagal | + | + |
| Efectos farmacológicos | + | + |
| BAV paroxístico idiopático | – | + |
| Desequilibrio electrolítico | ||
| Hipopotasemia | + | + |
| Hiperpotasemia | + | + |
| Hipercalcemia | + | + |
| Hipermagnesemia | + | + |
| Trastornos metabólicos | ||
| Hipotiroidismo | + | + |
| Anorexia | + | + |
| Hipoxia | + | + |
| Acidosis | + | + |
| Hipotermia | + | + |
| Trastornos neurológicos | ||
| Aumento de la presión intracraneal | + | + |
| Tumores del sistema nervioso central | + | + |
| Epilepsia temporal | + | + |
| Apnea obstructiva del sueño | + | + |
Las anomalías de la regulación autónoma son importantes para el diagnóstico diferencial de síncope o casi síncope; por lo tanto, los cambios ortostáticos en la frecuencia cardiaca y la presión arterial pueden ayudar a la evaluación de los pacientes.
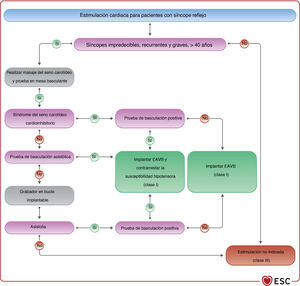
El masaje del seno carotídeo (MSC) puede ser útil para cualquier paciente de 40 o más años con síntomas que indiquen síndrome del seno carotídeo (SSC), es decir, aparición de síncope o casi síncope provocado por llevar un collar apretado, el afeitado o el giro de la cabeza66,67. La metodología y la respuesta al MSC se describen en el apartado 4.1 del material adicional. Para confirmar el diagnóstico de SSC, deben reproducirse los síntomas espontáneos durante el MSC y las características clínicas del síncope espontáneo compatible con un mecanismo reflejo68–70.
4.2ElectrocardiogramaJunto con la anamnesis y la exploración física, el ECG en reposo es un componente esencial de la evaluación inicial de los pacientes con bradicardia sospechada o documentada. El diagnóstico definitivo se puede obtener a partir de un ECG de 12 derivaciones o una tira de ritmo durante el episodio sintomático.
Cuando la exploración física apunte al diagnóstico de bradicardia, es útil disponer de un ECG de 12 derivaciones para confirmar el ritmo, la frecuencia, la naturaleza y la extensión de la alteración en la conducción (tabla 1 del material adicional). Además, un ECG puede proporcionar información sobre la existencia de cardiopatías estructurales o enfermedades sistémicas (hipertrofia del VI, ondas Q, intervalo QT prolongado o bajo voltaje) que predicen resultados clínicos adversos en pacientes sintomáticos62.
4.3Evaluación no invasivaRecomendaciones sobre la evaluación no invasiva
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Una vez descartada la estenosis carotídeac, se recomienda MSC para los pacientes con síncope de origen desconocido compatible con un mecanismo reflejo o con síntomas relacionados con la presión/manipulación de la región del seno carotídeo68–70 | I | B |
MSC: masaje del seno carotídeo.
La naturaleza intermitente de la mayoría de las bradicardias sintomáticas secundarias a una enfermedad del sistema de conducción suele requerir una monitorización ECG ambulatoria prolongada que permita correlacionar las alteraciones del ritmo con los síntomas. Esta monitorización puede detectar la interrupción de la conducción AV por enfermedad primaria del sistema de conducción, la presencia de un mecanismo vagal o neurocardiogénico o el BAV reflejo72,72a.
El ECG ambulatorio identifica defectos de automaticidad sinusal, que incluyen pausas sinusales, bradicardia sinusal, síndrome de bradicardia-taquicardia, asistolia posconversión de aleteo auricular o FA e incompetencia cronotrópica.
Recientemente se han revisado diferentes versiones de monitorización con ECG ambulatoria en un documento integral de consenso de expertos (tabla 4 del material adicional)73. La selección del ECG ambulatorio depende de la frecuencia y la naturaleza de los síntomas (tabla 8).
Elección de monitorización electrocardiográfica ambulatoria dependiendo de la frecuencia de los síntomas.
| Frecuencia de los síntomas | |
|---|---|
| Diaria | ECG Holter de 24h o monitorización telemétrica en hospital |
| Cada 48-72h | ECG Holter de 24-48-72h |
| Semanal | ECG Holter de 7 días/grabador en bucle externo/grabador de parche externo |
| Mensual | Grabador en bucle externo/grabador de parche externo/grabador de ECG de mano |
| < 1 al mes | Grabador en bucle implantable |
ECG: electrocardiograma.
Adaptado de Brignole et al.33.
Recomendaciones sobre monitorización electrocardiográfica ambulatoria
Recomendaciones sobre pruebas de esfuerzo
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda la prueba de esfuerzo para pacientes que tengan síntomas sospechosos de bradicardia durante o inmediatamente después delesfuerzo62,74–80 | I | C |
| Para los pacientes con sospecha de incompetencia cronotrópica, se debe considerar la realización de pruebas de esfuerzo para confirmar el diagnóstico74,75 | IIa | B |
| Para los pacientes con enfermedad de conducción intraventricular o BAV de grado desconocido, se puede considerar la prueba de esfuerzo para exponer el bloqueo infranodular76,77,79 | IIb | C |
BAV: bloqueo auriculoventricular.
La prueba de esfuerzo puede ser útil en pacientes seleccionados con sospecha de bradicardia durante o poco después del esfuerzo. Es probable que los síntomas que ocurren durante el ejercicio se deban a causas cardiacas, mientras que los síntomas que ocurren después del ejercicio se produzcan por un mecanismo reflejo.
La prueba de esfuerzo puede servir para el diagnóstico de incompetencia cronotrópica sintomática, definida como la incapacidad del corazón para aumentar la frecuencia cardiaca en proporción al aumento de la demanda metabólica durante la actividad física74,75. La definición más habitual de incompetencia cronotrópica es la imposibilidad de alcanzar el 80% esperable de la frecuencia cardiaca de reserva. La frecuencia cardiaca de reserva se define como la diferencia entre la frecuencia cardiaca máxima predicha por la edad (220–edad) y la frecuencia cardiaca en reposo. Sin embargo, algunos tratamientos médicos y comorbilidades causan intolerancia al ejercicio y dificultan el diagnóstico de incompetencia cronotrópica mediante la prueba de esfuerzo.
En pacientes con síntomas relacionados con el ejercicio, el desarrollo o la progresión de BAV puede ser la causa subyacente en algunos casos. El BAV completo y de segundo grado inducido por la taquicardia debida al ejercicio se localiza distalmente al NAV y predice la progresión a BAV permanente76–78. Por lo general, estos pacientes muestran alteraciones de la conducción intraventricular en el ECG de reposo, aunque también se ha descrito un ECG de reposo normal en algunos casos77,79. La prueba de esfuerzo puede poner de manifiesto un BAV infranodular avanzado en presencia de enfermedad del sistema de conducción de ubicación incierta.
En casos raros, las anomalías de la conducción inducidas por el ejercicio se deben a isquemia miocárdica o vasoespasmo coronario, y las pruebas de esfuerzo pueden reproducir los síntomas80,81.
No hay datos para respaldar la indicación de prueba de esfuerzo para pacientes sin síntomas relacionados con el ejercicio. La prueba de esfuerzo puede ser útil para pacientes seleccionados, para diferenciar el NAV de las alteraciones de la conducción en el sistema His-Purkinje por debajo del NAV en el contexto de anomalías de la conducción de localización incierta.
4.3.3Técnicas de imagenPara pacientes con bradicardia sintomática sospechada o documentada, se recomienda esplorara con imagen cardiaca para evaluar la presencia de cardiopatía estructural, determinar la función sistólica del VI y diagnosticar posibles causas reversibles de las anomalías de la conducción (tabla 7).
La ecocardiografía es la técnica de imagen más disponible para la evaluación de los factores ya mencionados. También se puede utilizar en el contexto de inestabilidad hemodinámica. Cuando haya sospecha de enfermedad coronaria, se recomienda la tomografía computarizada (TC) coronaria, la angiografía o la imagen de estrés82. La resonancia magnética cardiovascular (RMC) y las técnicas de imagen nuclear ayudan a la caracterización tisular (inflamación, fibrosis/cicatriz) y deben considerarse antes de implantar un marcapasos cuando se sospechen etiologías específicas asociadas con anomalías de la conducción (especialmente en pacientes jóvenes). Las técnicas de realce tardío de gadolinio (RTG) y la RMC en T2 permiten el diagnóstico de causas específicas de alteraciones en la conducción (como sarcoidosis y miocarditis). La RMC con RTG ayuda en la toma de decisiones de individuos con eventos arrítmicos; la presencia de grandes áreas de RTG (cicatriz/fibrosis) se ha relacionado con un riesgo aumentado de arritmias ventriculares independientemente de la FEVI y puede indicar la necesidad de un desfibrilador automático implantable (DAI)83–85. Las secuencias en T2 de RMC son adecuadas para detectar inflamación miocárdica (es decir, edema e hiperemia) como posible causa de anomalía transitoria de la conducción que puede no necesitar el implante de un marcapasos permanente86. De manera similar, la tomografía por emisión de positrones (PET) combinada con RMC o TC es útil para diagnosticar el estado inflamatorio de las miocadiopatías infiltrativas (sarcoidosis)87,88.
Recomendaciones sobre técnicas de imagen antes del implante
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda una prueba de imagen cardiaca para los pacientes con bradicardia sintomática sospechada o documentada para evaluar la presencia de cardiopatía estructural, determinar la función sistólica del VI y diagnosticar las posibles causas de anomalías de la conducción | I | C |
| Se debe considerar la obtención de imágenes multimodales (RMC, TC o PET) para la caracterización del tejido miocárdico en el diagnóstico de afecciones específicas asociadas con anomalías de la conducción que requieran implante de marcapasos, particularmente en pacientes menores de 60 años83–86,88 | IIa | C |
PET: tomografía por emisión de positrones; RMC: resonancia magnética cardiovascular; TC: tomografía omputarizada; VI: ventrículo/ventricular izquierdo.
Recomendaciones sobre pruebas de laboratorio
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Además de las pruebas de laboratorio previas al implantc, para los pacientes con sospecha clínica de causas de bradicardia subyacentes y reversibles se recomienda realizar pruebas de laboratorio específicas (como pruebas de función tiroidea, título de Lyme, concentración de digitálicos, potasio, calcio y pH) para diagnosticar y tratar estas afecciones90–94 | I | C |
Las pruebas de laboratorio, que incluyen hemogramas completos, tiempo de protrombina, tiempo parcial de tromboplastina, función renal y cuantificación de electrolitos, están justificadas como parte de la planificación previa al implante de marcapasos.
La bradicardia o el BAV pueden ser secundarios a otras afecciones (tabla 7). Los resultados de laboratorio pueden ayudar a identificar estas afecciones cuando haya sospecha y tratarlas (p. ej., función tiroidea, título de Lyme, diagnóstico de miocarditis en una persona joven con BAV, endocarditis, hiperpotasemia, concentración de digitálicos e hipercalcemia)89–94.
4.3.5Pruebas genéticasLa mayoría de los trastornos de la conducción cardiaca se deben a envejecimiento o anomalías estructurales del sistema de conducción causadas por una cardiopatía estructural subyacente. Se han identificado diversos genes que causan enfermedades cardiacas hereditarias asociadas con trastornos de la conducción cardiaca65,95,96.
Las mutaciones genéticas se han relacionado con una variedad de anomalías que pueden presentarse en formas aisladas de trastorno de la conducción o junto con miocardiopatía, anomalías cardiacas congénitas o trastornos extracardiacos. La mayoría de los trastornos de la conducción cardiaca mediados genéticamente tienen un patrón de herencia autosómico dominante65,95 (tabla 5 del material adicional).
La enfermedad progresiva de la conducción cardiaca (EPCC) puede diagnosticarse en presencia de anomalías de conducción progresivas de causa inexplicable en individuos jóvenes (menores de 50 años) con corazones estructuralmente normales en ausencia de miopatías esqueléticas, especialmente si hay antecedentes familiares de EPCC97. Los genes más se asocian con EPCC son SCN5A y TRPM4 para las formas aisladas y LMNA para la EPCC asociada con IC.
El diagnóstico de EPCC en un paciente índice se basa en datos clínicos que incluyan historia clínica, antecedentes familiares y ECG de 12 derivaciones. La posible presencia de cardiopatía congénita (CC) o miocardiopatía debe investigarse con pruebas de imagen cardiaca.
La EPCC de inicio precoz, ya sea aislada o con cardiopatía estructural concomitante, debe impulsar la realización de pruebas genéticas de EPCC, especialmente de pacientes con antecedentes familiares de anomalías de la conducción, implante de marcapasos o muerte súbita97.
Un panel de consenso de expertos ha respaldado la realización de pruebas genéticas específicas dirigidas a buscar mutaciones en familiares y parientes próximos tras la identificación de una mutación causante de EPCC en un caso índice. Estas pruebas pueden diferirse en niños asintomáticos debido a la naturaleza más tardía de las enfermedades de conducción cardiaca y su penetrancia incompleta65. Sin embargo, cada caso debe evaluarse individualmente en función del riesgo de la mutación detectada.
Los familiares asintomáticos que sean positivos para la mutación familiar asociada con EPCC deben ser controlados regularmente para detectar el desarrollo de síntomas relacionados con enfermedad de conducción, deterioro de la conducción cardiaca y comienzo de IC.
Recomendaciones sobre pruebas genéticas
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se debe considerar hacer pruebas genéticas a pacientes con inicio precoz (antes de los 50 años) de enfermedad de la conducción cardiaca progresivac,65,97 | IIa | C |
| Tras la identificación de una variante genética patogénica que explique el fenotipo clínico de la enfermedad de conducción cardiaca en un caso índice, se debe considerar hacer pruebas genéticas a los miembros de la familia65 | IIa | C |
Enfermedad de la conducción cardiaca progresiva: onda P e intervalo PR prolongados y ensanchamiento del QRS con desviación del eje96.
Recomendaciones sobre la evaluación del sueño
Recomendaciones sobre pruebas de basculación
Recomendaciones sobre grabador en bucle implantable
| Recomendación | Clasea | Nivelb |
|---|---|---|
| Para los pacientes con síncope inexplicable poco frecuente (menos de 1 vez al mes) u otros síntomas que se sospeche causados por bradicardia y cuya evaluación integral no haya podido demostrar una causa, se recomienda la monitorización ambulatoria a largo plazo con GBI108–112 | I | A |
GBI: grabador en bucle implantable.
Las bradiarritmias nocturnas son frecuentes en la población general. En la mayoría de los casos, son episodios fisiológicos y asintomáticos mediados por vía vagal que no requieren intervención98–100.
Los pacientes con síndrome de apnea del sueño (SAS) tienen una mayor prevalencia de bradicardia durante el sueño (tanto sinusal como relacionada con el sistema de conducción) durante los episodios de apnea101,102. La hipoxemia inducida por SAS es un mecanismo clave que conduce a un aumento del tono vagal y trastornos bradicárdicos del ritmo101,102. Otro mecanismo poco frecuente de bradicardia relacionada con el sueño (generalmente en forma de parada sinusal prolongada) es la bradicardia asociada con la fase de movimientos oculares rápidos (REM) que no está relacionada con la apnea. Este mecanismo también se puede diagnosticar mediante polisomnografía103. Aunque la mayoría de los casos citados en la bibliografía han sido tratados con marcapasos, hay poca evidencia que respalde esta estrategia y no existe consenso sobre el tratamiento de estos pacientes103.
El tratamiento con presión positiva continua de las vías respiratorias (CPAP) alivia los síntomas relacionados con la apnea obstructiva del sueño y tiene beneficios cardiovasculares. Un tratamiento adecuado es capaz de reducir los episodios de bradicardia en un 72-89%104, y es poco probable que los pacientes desarrollen bradicardia sintomática en el seguimiento a largo plazo104–106. Por lo tanto, se debe evaluar la existencia de SAS en pacientes con bradiarritmias nocturnas asintomáticas o enfermedades de la conducción cardiaca. Si se confirma el diagnóstico, el tratamiento de la apnea del sueño con CPAP y la pérdida de peso pueden ser estrategias eficaces para mejorar las bradiarritmias nocturnas; se debe evitar la estimulación cardiaca permanente. Para los pacientes con SAS sospechado o diagnosticado y bradiarritmias sintomáticas no asociadas con el sueño, se recomienda una evaluación más compleja que permita sopesar los riesgos asociados con las bradiarritmias frente al beneficio de la estimulación cardiaca.
4.3.7Prueba de la mesa basculanteSe debe considerar la prueba de la mesa basculante para confirmar el diagnóstico de síncope reflejo en pacientes con sospecha diagnóstica no confirmada en la evaluación inicial62,107. El criterio de valoración de la prueba de la mesa basculante es la reproducción de los síntomas y del patrón circulatorio característico del síncope reflejo. La metodología y la clasificación de las respuestas se describen en el apartado 4.2 del material adicional y la figura 1 del material adicional.
Una respuesta cardioinhibitoria positiva en la prueba de mesa basculante predice, con alta probabilidad, síncope espontáneo asistólico; este hallazgo es relevante para el tratamiento cuando se considera la estimulación cardiaca (véase el apartado 5.4). Por el contrario, una respuesta vasodepresora positiva, una respuesta mixta o incluso una respuesta negativa no excluyen la asistolia durante el síncope espontáneo62.
4.3.8Monitores implantablesLos pacientes con síntomas de bradicardia poco frecuentes (menos de 1 vez al mes) precisan una mayor duración de la monitorización con ECG. Para estos pacientes, el grabador en bucle implantable (GBI) es la herramienta diagnóstica ideal, por su capacidad para grabar largo tiempo (hasta 3 años) sin necesidad de que el paciente participe (tabla 8).
En personas con síncope inexplicable después de la evaluación inicial y síntomas poco frecuentes (menos de 1 vez al mes), el implante inicial de GBI es más eficaz que la estrategia convencional, según los resultados de varios estudios independientes. Muchas afecciones diagnosticadas mediante GBI están mediadas por bradicardia108–112. Para obtener más información sobre las indicaciones y las funciones diagnósticas del GBI y el ECG ambulatorio, véase la guía de la ESC sobre diagnóstico y tratamiento del síncope62.
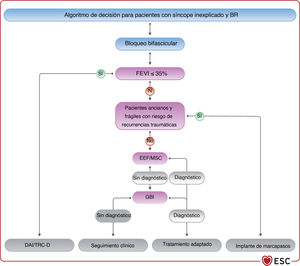
4.3.9Estudio electrofisiológicoEl desarrollo de técnicas de ECG ambulatorio no invasivas ha reducido la necesidad del estudio electrofisiológico (EEF) como prueba diagnóstica. El EEF suele ser una herramienta complementaria en la evaluación de pacientes con síncope y sospecha de bradicardia que no se ha documentado con una evaluación no invasiva (figura 4). El objetivo del EEF en el contexto de la evaluación de la bradicardia es identificar la función anormal del nódulo sinusal o la ubicación anatómica de las anomalías de la conducción cardiaca (NAV o sistema His-Purkinje distal al NAV).
En pacientes con síncope y bradicardia sinusal, la probabilidad previa a la prueba de que se produzca un síncope relacionado con la bradicardia aumenta cuando hay bradicardia sinusal (< 50 lpm) o bloqueo senoauricular. Los estudios observacionales han demostrado una relación entre el tiempo de recuperación del nódulo sinusal prolongado durante el síncope y el efecto de la estimulación en los síntomas113,114.
En pacientes con síncope y bloqueo bifascicular, el intervalo His-ventricular (I-HV) prolongado ≥ 70 ms o un I-HV ≥ 100 ms después de estrés farmacológico (ajmalina, procainamida, flecainida o disopiramida) o la inducción de BAV de segundo o tercer grado por estimulación auricular o estrés farmacológico identifican el subgrupo de pacientes con mayor riesgo de BAV115–122.
La eficacia del EEF en el diagnóstico de síncope es máxima en pacientes con bradicardia sinusal, bloqueo bifascicular y sospecha de taquicardia62, y más baja en pacientes con síncope, ECG normal y ausencia de cardiopatía estructural y palpitaciones. Por lo tanto, se prefiere el EEF al GBI para los pacientes con síncope y alta probabilidad pretest de tener enfermedad de conducción (p. ej., ECG anormal, bloqueo de rama [BR], cardiopatía isquémica o miocardiopatía relacionada con cicatriz). Se prefiere el GBI al EEF para los pacientes con baja probabilidad pretest (sin cardiopatía estructural, ECG normal). También se prefiere el EEF cuando la probabilidad de sufrir otro episodio sincopal que ponga en peligro la vida sea alta, ya que este abordaje facilita el diagnóstico inmediato.
Un EEF negativo no excluye la presencia de síncope arrítmico, por lo que se justificaría una evaluación adicional. Aproximadamente un tercio de los pacientes con EEF negativo a los que se implanta GBI desarrollan BAV durante el seguimiento123.
Recomendaciones sobre el estudio electrofisiológico
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se debe considerar el EEF de los pacientes con síncope y bloqueo bifascicular cuando el síncope siga siendo inexplicable tras una evaluación no invasiva o cuando se precise una decisión inmediata sobre la estimulación debido a la gravedad, a menos que se prefiera el implante empírico de marcapasos (especialmente en ancianos y personas frágiles)115–121 | IIa | B |
| Para los pacientes con síncope y bradicardia sinusal, se puede considerar el EEF cuando las pruebas no invasivas no hayan podido demostrar una correlación entre el síncope y la bradicardia113,114 | IIb | B |
EEF: estudio electrofisiológico.
La DNS, también conocida como síndrome del seno enfermo, comprende un amplio espectro de disfunciones senoauriculares que van desde la bradicardia sinusal, el bloqueo senoauricular y la parada sinusal hasta el síndrome de bradicardia-taquicardia124,125.
Otra manifestación de la DNS es la respuesta cronotrópica inadecuada al ejercicio o incompetencia cronotrópica.
5.1.1Indicaciones de estimulación cardiaca5.1.1.1Disfunción del nódulo sinusalNo se ha demostrado que la estimulación en la DNS asintomática mejore el pronóstico, a diferencia de la estimulación en el BAV. Por lo tanto, la DNS puede considerarse una indicación de estimulación cardiaca permanente adecuada solo cuando se asocie con bradicardia sintomática126. Los pacientes con DNS pueden manifestar síntomas atribuibles a bradiarritmia o síntomas de taquiarritmias auriculares acompañantes en forma de bradicardia-taquicardia. Los síntomas pueden aparecer durante el reposo o al final del episodio taquiarrítmico (pausa de conversión, también llamada pausa de preautomatismo) o durante el ejercicio y pueden variar desde fatiga leve hasta aturdimiento, mareos, casi síncope o síncope. La disnea de esfuerzo puede estar relacionada con la incompetencia cronotrópica. El síncope es una manifestación común de la DNS y se ha detectado en el 50% de los pacientes portadores de marcapasos por DSN127.
Es fundamental establecer una correlación entre los síntomas y la bradiarritmia para la toma de decisiones. Sin embargo, la relación causa-efecto entre la DNS y los síntomas puede verse dificultada por la edad, una cardiopatía concomitante u otras comorbilidades.
El efecto de la estimulación cardiaca en la historia natural de las bradiarritmias se evaluó al comienzo de la era de los marcapasos en estudios no aleatorizados que indicaron una mejoría sintomática128–131. Los resultados se han confirmado en un ECA14 que aleatorizó a 107 pacientes (edad, 73±11 años) con SND sintomática a tratamiento con teofilina oral, marcapasos bicameral con respuesta en frecuencia o ningún tratamiento. En ese estudio, la aparición de síncope e IC fue menor en el grupo de marcapasos durante un seguimiento de 19±14 meses.
Para los pacientes con intolerancia al ejercicio en los que se ha identificado incompetencia cronotrópica, la utilidad de la estimulación cardiaca es incierta, y la decisión de implantarles un marcapasos debe tomarse de manera individualizada.
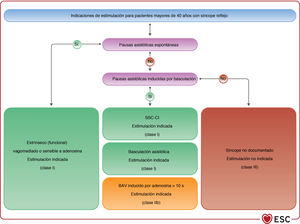
En algunos casos, las bradiarritmias sintomáticas pueden estar relacionadas con afecciones transitorias, potencialmente reversibles o tratables (véase el apartado 4, tabla 7). En tales casos, se requiere la corrección de estos factores, y no está indicada la estimulación cardiaca permanente. En la práctica clínica, es fundamental distinguir la bradicardia fisiológica (debida a influencias autónomas o efectos del entrenamiento) de la bradicardia inapropiada que requiere estimulación cardiaca permanente. Por ejemplo, se puede admitir como fisiológica una bradicardia sinusal de 40-50 lpm en reposo, que llegue a 30 lpm durante el sueño, particularmente en deportistas, que no requiere estimulación cardiaca. La bradicardia asintomática (debida a pausas sinusales o episodios de BAV) no es infrecuente y merece ser interpretada en el contexto clínico del paciente: en personas sanas, las pausas > 2,5 s son infrecuentes, pero esto no constituye necesariamente un trastorno clínico. Las bradiarritmias asintomáticas son frecuentes en los deportistas132. En ausencia de ensayos clínicos publicados, no se puede hacer recomendaciones sobre la bradicardia en pacientes asintomáticos. Por otro lado, para los pacientes evaluados por síncope en los que finalmente se documentan pausas asintomáticas > 6 s debidas a parada sinusal, puede estar indicada la estimulación; estos pacientes constituían un grupo minoritario en un estudio observacional y un ECA sobre marcapasos en el síncope reflejo133,134. En pacientes que presentan bradicardia intermitente asintomática relacionada con el sueño (bradicardia sinusal o BAV), la apnea del sueño y bradicardia relacionada con la fase REM deben considerarse como causas posibles.
5.1.1.2Disfunción del nódulo sinusal en forma de bradicardia-taquicardiaLa variante de bradicardia-taquicardia es la forma más común de DNS y se caracteriza por una fibrosis degenerativa del tejido del nódulo sinusal y del miocardio auricular progresiva y relacionada con la edad. Las bradiarritmias pueden asociarse con diversas formas de taquiarritmias auriculares, incluida la FA125. En esta presentación de DNS, las bradiarritmias pueden corresponder a pausas auriculares por bloqueos senoauriculares o pueden deberse a supresión por sobreestimulación tras una taquiarritmia auricular135.
Las taquiarritmias auriculares pueden estar presentes en el momento del diagnóstico, típicamente con parada sinusal y asistolias al final del periodo taquiarrítmico, o presentarse después del implante del dispositivo. El control de las taquiarritmias auriculares en pacientes que presentan frecuencias ventriculares altas puede resultar difícil antes del implante, ya que los medicamentos recetados para el control de la frecuencia pueden empeorar las bradiarritmias. Se ha propuesto la ablación de la taquiarritmia auricular, principalmente FA, en lugar de estimulación cardiaca, y la continuación del tratamiento farmacológico para grupos de pacientes seleccionados136–138, pero no hay datos de ECA que demuestren que esta estrategia sea tan eficaz como la estimulación cardiaca en cuanto a los síntomas relacionados con la bradicardia en pacientes con síndrome de bradicardia-taquicardia139. Si se elige el tratamiento farmacológico, las bradiarritmias que aparecen con la medicación pueden tratarse mediante la reducción de la dosis o la interrupción del tratamiento como alternativa a la estimulación cardiaca, aunque en muchos casos persisten las bradiarritmias.
5.1.2Modo de estimulación cardiaca y selección del algoritmoEn pacientes con DNS, los estudios controlados han demostrado que la estimulación auriculoventricular bicameral (EAVB) es superior a la estimulación ventricular unicameral para reducir la incidencia de FA. Estos estudios también han mostrado algún efecto de la EAVB en la ocurrencia de accidentes cerebrovasculares140,141. La EAVB reduce el riesgo de síndrome de marcapasos, que puede ocurrir en más de una cuarta parte de los pacientes con DNS21,142. El síndrome de marcapasos se asocia con peor calidad de vida y generalmente justifica la preferencia por la EAVB en la DNS frente a la estimulación con respuesta en frecuencia, siempre que sea razonable143. Las posibles excepciones son los pacientes muy ancianos o frágiles con pausas poco frecuentes y capacidad funcional limitada o esperanza de vida corta. En estos pacientes, el beneficio clínico esperado de la estimulación bicameral (derecha) frente a la unicameral (VVIR) sería pequeño o nulo, y el riesgo incremental de complicaciones relacionadas con el segundo cable auricular requerido en los implantes bicamerales también debe tenerse en cuenta al elegir el modo de estimulación. En pacientes con DNS tratados con un marcapasos de EAVB, la programación del intervalo AV y los algoritmos específicos para minimizar la estimulación del VD pueden reducir aún más el riesgo de FA y, en particular, FA persistente144. La estimulación bicameral es más segura y sostenible que la estimulación auricular utilizada en el pasado127, aunque la estimulación auricular de un solo cable se ha demostrado superior que la estimulación ventricular de un solo cable145,146. Los resultados de los estudios que han evaluado diferentes modos de estimulación en bradiarritmias, incluidos algunos casos de DNS y BAV, se muestran en la tabla 6 del material adicional.
Con respecto a la elección entre EAVB y estimulación auricular con respuesta en frecuencia (EARF), un ECA con solo 177 pacientes muestra una reducción del riesgo de FA en el grupo de EARF147. No obstante, el ensayo clínico DANPACE, más reciente, que ha incluido a 1.415 pacientes con un seguimiento medio de 5,4 años, no ha encontrado diferencias entre las 2 modalidades de estimulación en la mortalidad por cualquier causa. El estudio DANPACE ha descrito una mayor incidencia de FA paroxística (hazard ratio [HR] = 1,27), un riesgo 2 veces mayor de reimplante de marcapasos asociado con EARF y una tasa de aparición de BAV de un 0,6-1,9% por año127. Estos hallazgos respaldan el empleo sistemático de la estimulación bicameral en lugar de la auricular en pacientes con DSN.
A la vista de estos datos, se recomienda la EAVB como estimulación de primera elección en la DNS (figura 5). Se debe evitar sistemáticamente la estimulación del VD innecesaria en pacientes con DNS, ya que puede causar FA y deterioro de la IC, especialmente si la función sistólica está alterada o en el límite de la normalidad144,148. Esto puede lograrse mediante la programación del intervalo AV o utilizando algoritmos específicos para minimizar la estimulación del VD. Programar un intervalo AV excesivamente largo para evitar la estimulación del VD en pacientes con conducción AV prolongada puede ser desventajoso desde el punto de vista hemodinámico, pues causa insuficiencia mitral diastólica, que puede producir síntomas o FA144,149,150.
Los algoritmos de estimulación para minimizar la estimulación ventricular se usan a menudo en la DSN144,151. Un metanálisis de algoritmos para minimizar la estimulación del VD no ha logrado demostrar un efecto significativo en comparación con la EAVB convencional en pacientes con función ventricular normal en cuanto a la incidencia de FA persistente/permanente, hospitalización por cualquier causa y mortalidad por cualquier causa152. Sin embargo, la justificación para reducir la estimulación del VD innecesaria sigue siendo sólida y se suma a los beneficios de prolongar la longevidad del dispositivo151,152. Algunos algoritmos específicos del fabricante son más efectivos para minimizar la estimulación ventricular, pero puede conferir desventajas al favorecer un desacoplamiento entre las aurículas y los ventrículos153,154. En raras ocasiones, los algoritmos diseñados para minimizar la estimulación ventricular pueden causar arritmias ventriculares potencialmente mortales dependientes de la pausa o desencadenadas por ella155–158. Hasta ahora no se ha realizado una comparación directa de estos algoritmos, pero los datos agrupados de los ensayos clínicos aleatorizados no muestran superioridad de ningún algoritmo específico en los resultados clínicos152,159.
En pacientes con FEVI muy reducida y DNS con indicación de estimulación, en los que cabe esperar un alto porcentaje de estimulación ventricular, se debe evaluar la indicación de TRC o EHH (véase el apartado 6 sobre TRC y el apartado 7 sobre EHH).
El papel de los algoritmos de marcapasos en la prevención de la FA ha sido objeto de controversia. Se ha probado una serie de algoritmos para prevenir o suprimir la FA, como la sobreestimulación auricular dinámica, la estimulación auricular en respuesta a latidos auriculares prematuros, la estimulación en respuesta al ejercicio y la estimulación posterior al cambio de modo. La evaluación clínica de estos algoritmos, también aplicados en diferentes sitios de estimulación auricular, no es convincente y no se ha demostrado ningún beneficio en las principales variables clínicas160,161.
La estimulación auricular antitaquicárdica (EAT), es decir, la administración de estímulos auriculares a altas frecuencias para convertir una taquiarritmia auricular en ritmo sinusal (RS), también se ha probado para reducir la carga de taquiarritmia auricular y contrarrestar la tendencia a la progresión a FA permanente162. La EAT convencional aplicada de modo que refleje la EAT ventricular (ráfagas al inicio de la arritmia) tiene una tasa de éxito relativamente baja, y los estudios clínicos basados en EAT auricular convencional no han demostrado beneficio sobre la carga de FA o los episodios clínicos163. Se ha propuesto una nueva forma de administración de EAT, específicamente dirigida a reducir las taquiarritmias auriculares, y su eficacia para reducir la progresión a FA permanente se ha validado en un ECA162,164.
En ese ensayo164, la variable principal compuesta (muerte, hospitalizaciones cardiovasculares o FA permanente) a los 2 años se redujo significativamente en pacientes con un dispositivo que combinaba EAT y algoritmos para minimizar la estimulación del VD (un 36% de reducción del riesgo relativo en comparación con la EAVB convencional). El efecto positivo en la variable principal se debió a una menor tasa de progresión a FA permanente. Un análisis post hoc indicó que esta forma de EAT auricular era un predictor independiente de la reducción permanente o la persistente de la FA162,164,165. En las cardiopatías congénitas (CC), en las que son muy comunes las arritmias auriculares reentrantes, se puede considerar los marcapasos bicamerales con EAT auricular (véase el apartado 8 sobre estimulación cardiaca en CC).
Recomendaciones sobre estimulación para la disfunción del nódulo sinusal
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para los pacientes con DNS y un marcapasos de EAVB, se recomienda minimizar la estimulación ventricular innecesaria mediante la programación144,151,159,164,166–169 | I | A |
| La estimulación está indicada en la DNS cuando los síntomas puedan atribuirse claramente a las bradiarritmias14,128–131 | I | B |
| La estimulación está indicada para los pacientes sintomáticos con DNS en forma de bradicardia-taquicardia para corregir las bradiarritmias y facilitar el tratamiento farmacológico, a menos que se prefiera la ablación de la taquiarritmia17,20,21,136–138,170,171 | I | B |
| Para los pacientes con incompetencia cronotrópica y síntomas claros durante el ejercicio, se debe considerar la EAVB con respuesta en frecuencia172,173 | IIa | B |
| Debe considerarse la ablación de FA para evitar el implante de marcapasos en pacientes con bradicardia relacionada con FA o pausas de preautomatismo sintomáticas tras la conversión de la FA, teniendo en cuenta la situación clínica136–139,174 | IIa | C |
| Para los pacientes con DNS en forma de bradicardia-taquicardia, se puede considerar la programación de EAT auricular164,165 | IIb | B |
| Para los pacientes con síncope, se puede considerar la estimulación cardiaca para reducir el síncope recurrente cuando se documenten pausas asintomáticas > 6 s debidas a parada sinusal133,134 | IIb | C |
| Se puede considerar la estimulación para la DNS cuando sea probable que los síntomas se deban a bradiarritmias y la evidencia no sea concluyente | IIb | C |
| No se recomienda la estimulación para los pacientes con bradiarritmias relacionadas con la DNS que no causen síntomas o se deban a causas transitorias reversibles33 | III | C |
DNS: disfunción del nódulo sinusal; EAT: estimulación antitaquicárdica; EAVB: estimulación auriculoventricular bicameral.
El tratamiento del BAV tiene como objetivo mejorar los síntomas y prevenir el síncope y la muerte súbita cardiaca (MS). El BAV de primer grado suele ser asintomático. El síncope y el mareo se observan principalmente en BAV completos y de alto grado, especialmente en las formas paroxísticas. Los síntomas de IC son más frecuentes en el BAV crónico con bradicardia permanente, pero también se pueden observar en el BAV de primer grado con un intervalo PR muy prolongado. Dado que la edad al inicio de BAV suele ser avanzada, a veces se subestiman las manifestaciones de fatiga, intolerancia al esfuerzo e IC. A menudo, el deterioro de las funciones cognitivas solo es especulativo, por lo que las posibilidades de mejora después del implante de un marcapasos son impredecibles e improbables. La muerte en pacientes con BAV no tratados se debe no solo a IC secundaria a un gasto cardiaco bajo, sino también a MS por asistolia prolongada o taquiarritmia ventricular desencadenada por bradicardia. Aunque no se han realizado ECA de estimulación en el contexto del BAV, los resultados de varios estudios observacionales coinciden en demostrar que la estimulación cardiaca previene la recurrencia del síncope y mejora la supervivencia10–12.
5.2.1.1Bloqueo auriculoventricular de primer gradoPor lo general, el pronóstico es bueno en ausencia de cardiopatía estructural y la progresión a un bloqueo de alto grado es poco frecuente175. La indicación de estimulación cardiaca se basa en una correlación establecida entre los síntomas y el BAV. Hay poca evidencia que demuestre que la prolongación marcada del intervalo PR (es decir, ≥ 300 ms), sobre todo cuando persiste o se prolonga durante el ejercicio, pueda conducir a síntomas similares al síndrome de marcapasos o que puedan mejorar con el marcapasos176. La correlación de síntomas es fundamental, aunque puede resultar difícil si son inespecíficos y sutiles. En ausencia de una correlación clara, el marcapasos no está indicado.
5.2.1.2Bloqueo auriculoventricular de segundo grado tipo I (Mobitz tipo I o Wenckebach)Además de la presencia o ausencia de síntomas, se debe considerar el riesgo de progresión a mayores grados de BAV. El bloqueo supranodular tiene un curso benigno y el riesgo de progresión a tipo II o un mayor grado de BAV es bajo. Algunos estudios retrospectivos de pequeño tamaño indican que, a largo plazo, este tipo de BAV conlleva un mayor riesgo de muerte en pacientes de 45 o más años no portadores de marcapasos177,178. El bloqueo infranodular (poco frecuente en esta forma de bloqueo) conlleva un riesgo elevado de progresión a bloqueo cardiaco completo y muerte súbita, por lo que la estimulación cardiaca es recomendable incluso en ausencia de síntomas179,180.
5.2.1.3Mobitz tipo II, 2:1, BAV avanzado (también llamado BAV de alto grado, en el que el cociente P:QRS es 3:1 o superior) y BAV de tercer gradoEn ausencia de una causa reversible, debido al riesgo de aparición de síntomas graves o posible progresión hacia un BAV más grave o completo, se debe implantar un marcapasos incluso en ausencia de síntomas. En pacientes asintomáticos en los que se encuentra un BAV 2:1 de forma incidental, la decisión de implantar un marcapasos debe ser individualizada, teniendo en cuenta si hay BAV nodular o infranodular. Esta distinción puede basarse en observaciones tales como la prolongación del intervalo PR o PP antes del BAV, el efecto del ejercicio en la conducción AV y el EEF.
5.2.1.4Bloqueo auriculoventricular paroxísticoDebido al riesgo de síncope y MS y la posible progresión a BAV permanente, las indicaciones de estimulación son las mismas para el BAV paroxístico que para el permanente. Es fundamental descartar una causa reversible y reconocer las formas reflejas de BAV, que pueden no necesitar estimulación cardiaca. El bloqueo infranodular documentado en el EEF o el inicio del bloqueo documentado por latidos prematuros auriculares o ventriculares, aumento de la frecuencia cardiaca (BAV dependiente de taquicardia) o disminución de la frecuencia cardiaca (BAV dependiente de bradicardia) respaldan el diagnóstico de BAV infranodulñar intrínseco27.
5.2.2Modo de estimulación y selección del algoritmo5.2.2.1Estimulación bicameral frente a estimulación ventricularLos grandes estudios clínicos aleatorizados que se han llevado a cabo en paralelo con pacientes con BAV solo181 o BAV o DNS140 no han podido demostrar la superioridad de la EAVB sobre la estimulación ventricular en cuanto a mortalidad, y no han demostrado de manera consistente su superioridad en términos de calidad de vida o morbilidad (accidente cerebrovascular o accidente isquémico transitorio y FA)20,140,181. El beneficio de la estimulación bicameral es mayor que el de la estimulación ventricular debido a que evita el síndrome de marcapasos, que se ha descrito en hasta una cuarta parte de los pacientes con BAV incluidos en estos ensayos. En un metanálisis de 20 ensayos cruzados, la EAVB se asoció con mejor capacidad de ejercicio en comparación con la estimulación ventricular. Sin embargo, el efecto se debió a los marcapasos ventriculares no modulados por frecuencia y no se observó ningún beneficio en la comparación de EAVB con VVIR182. El síndrome de marcapasos se asocia con una reducción de la calidad de vida y puede requerir una reintervención para actualizar el dispositivo, lo que justifica la preferencia por la EAVB cuando sea razonable (en pacientes que no presentan fragilidad significativa, edad muy avanzada, comorbilidades importantes que limiten su esperanza de vida o movilidad muy reducida). Otra consideración es el diagnóstico de FA, que es más fiable a partir de los datos del dispositivo en pacientes con marcapasos bicamerales. Tras una evaluación individualizada, se puede considerar la estimulación VVIR para pacientes ancianos frágiles o cuando el BAV sea paroxístico y se prevea una estimulación infrecuente, ya que conlleva una tasa de complicaciones más baja140.
Hay evidencia sólida de que la estimulación convencional del VD crónica puede ser perjudicial para algunos pacientes y llevar a disfunción del VI e IC148, incluso cuando se mantiene la sincronía AV183. Este efecto se explica solo en parte por la secuencia de activación anormal y puede involucrar perfusión miocárdica y cambios humorales, celulares y moleculares184,185. Los pacientes con marcapasos y un cable VD tienen mayor riesgo de IC que la cohorte de control emparejada; la IC también se asocia con edad avanzada, IM previo, enfermedad renal y sexo masculino186. La miocardiopatía inducida por estimulación ocurre en un 10-20% de los pacientes después de 2-4 años de estimulación VD186–188 y se asocia con una carga de estimulación del VD > 20%187–190. No obstante, no se dispone de datos que apoyen un valor umbral de estimulación del VD por debajo del cual sea segura y por encima del cual sea perjudicial. Para conocer las posibles indicaciones de la TRC o la EHH en la prevención de la miocardiopatía inducida por marcapasos, véanse los apartados 6 y 7.
5.2.2.25.2.2.2Bloqueo auriculoventricular en la fibrilación auricular permanenteEn presencia de FA, debe haber sospecha de BAV cuando la frecuencia ventricular sea lenta y el ritmo ventricular, regular. Durante la monitorización prolongada, se pueden detectar pausas ventriculares largas191. Para pacientes con FA y sin BAV permanente o síntomas, no hay una duración mínima de la pausa que deba considerarse indicación de estimulación cardiaca. En ausencia de una causa potencialmente reversible, la bradicardia o la respuesta cronotrópica inapropiada (debido a BAV intermitente o completo) que se asocia (o tiene un grado razonable de correlación) con los síntomas es una indicación para estimulación cardiaca. Cualquier bloqueo de alto grado o bloqueo infranodular también son una indicación de estimulación, incluso en ausencia de síntomas. En ausencia de síntomas debidos a bradicardia y bloqueo de alto grado o infranodular, es poco probable que la estimulación sea beneficiosa, de modo que no está indicada.
En pacientes con FA que se someten a ablación de la unión auriculoventricular (UAV) para controlar las frecuencias ventriculares rápidas, la evidencia demuestra que la ablación de la UAV junto con estimulación del VD mejora los síntomas y la calidad de vida. Por el contrario, los resultados respecto a la progresión de IC, hospitalización y mortalidad193 han sido neutros, excepto en un estudio194. En comparación con el control farmacológico de la frecuencia cardiaca, se ha demostrado que la ablación de la UAV y la TRC reducen el riesgo de muerte por IC, hospitalización por IC o empeoramiento de la IC en un 62% y mejoran los síntomas específicos de FA en un 36% de los pacientes ancianos con FA permanente y QRS estrecho195. En otros estudios, este efecto beneficioso se limitó a pacientes con IC o FEVI reducida166,196. Para más información sobre la función de la TRC después de la ablación de la UAV, véase el apartado 6. La evidencia que respalda el beneficio de la estimulación parahisiana e hisiana tras ablación de la UAV en el tratamiento de la FA refractaria es débil197–200. Para más información, véase el apartado 7.
En pacientes con FA, la estimulación con respuesta en frecuencia se asocia con mejor rendimiento en el ejercicio y las actividades diarias, disminución de los síntomas relacionados con la dificultad para respirar, menos dolor en el pecho y palpitaciones y mejor calidad de vida en comparación con la estimulación de frecuencia fija201–203. También se ha demostrado que esta estrategia mejora la respuesta de la frecuencia cardiaca y la presión arterial al estrés mental con respecto a la estimulación de frecuencia fija204. Por todo ello, la estimulación de frecuencia adaptativa debe ser el modo de estimulación de primera elección. La estimulación VVI de frecuencia fija debe reservarse para pacientes sedentarios de edad avanzada que tengan una actividad muy limitada. Por lo general, para compensar la pérdida de llenado auricular activo, la frecuencia mínima se programa más alta (p. ej., 70 lpm) que para los pacientes que se encuentran en RS.
Recomendaciones sobre estimulación para el bloqueo auriculoventricular
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| La estimulación está indicada para pacientes en RS con BAV permanente o paroxístico de segundo o tercer grado (avanzado o alto grado), infranodular 2:1, independientemente de los síntomasc,9–12 | I | C |
| La estimulación está indicada para pacientes con arritmia auricular (principalmente FA) y BAV permanente o paroxístico de tercer grado (avanzado o alto grado), independientemente de los síntomas | I | C |
| Para los pacientes con FA permanente que necesiten un marcapasos, se recomienda la estimulación ventricular con respuesta en frecuencia201–204 | I | C |
| Se debe considerar la estimulación para los pacientes con BAV de segundo grado tipo 1 que causa síntomas o se localiza a nivel intrahisiano o infrahisiano en el EEF177–180 | IIa | C |
| Para los pacientes con BAV, se debe preferir la EAVB a la estimulación ventricular unicameral para evitar el síndrome de marcapasos y mejorar la calidad de vida20,140,181,182 | IIa | A |
| Se debe considerar el implante de marcapasos permanente para los pacientes con síntomas persistentes similares a los del síndrome de marcapasos y atribuibles claramente a BAV de primer grado (PR > 0,3 s)205–207 | IIa | C |
| No se recomienda la estimulación para pacientes con BAV debido a causas transitorias que puedan corregirse y prevenirse | III | C |
BAV: bloqueo auriculoventricular; EAVB: estimulación auriculoventricular bicameral; EEF: estudio electrofisiológico; FA: fibrilación auricular; RS: ritmo sinusal.
Este apartado se centra en pacientes con conducción AV 1:1 y anomalías del complejo QRS causadas por retraso o bloqueo de la conducción del sistema His-Purkinje: BR, bloqueo fascicular solo o en combinación con BR y retraso intraventricular inespecífico. El bloqueo bifascicular se define como BR izquierda (BRI) o la combinación de BR derecha (BRD) con bloqueo fascicular anterior o posterior izquierdo.
El bloqueo fascicular aislado y el BR raramente producen síntomas; sin embargo, su presencia puede ser un marcador de cardiopatía estructural subyacente. La evaluación de estos pacientes debe estar guiada por la presencia o ausencia de síntomas atribuibles a la bradicardia intermitente.
5.3.1Indicaciones de estimulación cardiaca5.3.1.1Bloqueo de rama y síncope de causa desconocidaAunque el síncope no se asocia con mayor incidencia de MS en pacientes con función cardiaca conservada, se ha observado una alta incidencia de muertes totales (de las cuales aproximadamente un tercio son súbitas) en pacientes con BR e IC, IM previo o fracción de eyección (FE) baja208–210. De hecho, para aquellos con FE baja el síncope es un factor de riesgo de muerte211. Por desgracia, la estimulación ventricular programada no parece identificar correctamente a estos pacientes; por lo tanto, están indicados el DAI o la TRC con desfibrilador (TRC-D) para los pacientes con BR y FEVI < 35% para la prevención de la MS (figura 6)63.
5.3.1.2Bloqueo de rama, síncope de causa desconocida y estudio electrofisiológico anormalLa evaluación electrofisiológica incluye la medición del I-HV al inicio del estudio, con estrés mediante estimulación auricular incremental o por provocación farmacológica (ajmalina, procainamida o flecainida). Scheinman et al.121 estudiaron el valor pronóstico del I-HV: la tasa de progresión a BAV a los 4 años fue del 4% en los pacientes con I-HV < 70 ms, el 2% en aquellos con I-HV de 70-100 ms y el 24% con HV > 100 ms121. El desarrollo de bloqueo intrahisiano o infrahisiano en respuesta a la estimulación auricular incremental o mediante prueba de sobrecarga farmacológica aumenta la sensibilidad y el valor predictivo positivo del EEF para identificar a los pacientes que desarrollarán BAV116–118,120,122,212. Se ha demostrado que un EEF positivo tiene un valor predictivo positivo de hasta el 80% para identificar a pacientes que desarrollarán BAV. Este hallazgo se ha confirmado indirectamente en otro estudio, que ha descrito una reducción significativa de las recurrencias sincopales en pacientes con EEF positivo tratados con marcapasos, en comparación con el grupo de control de pacientes no tratados con EEF negativo119. En pacientes con síncope de causa desconocida y bloqueo bifascicular, el EEF muestra una gran sensibilidad para identificar a los pacientes con BAV de alto grado intermitente o inminente. Sin embargo, un EEF negativo no puede descartar un BAV intermitente/paroxístico como la causa del síncope. De hecho, en pacientes con un EEF negativo, el BAV intermitente o estable se ha documentado mediante GBI en aproximadamente un 50% de los casos. Por lo tanto, los pacientes de edad avanzada con bloqueo bifascicular y síncope de causa desconocida podrían beneficiarse de un marcapasos empírico, especialmente en los casos de síncope impredecible y recurrente que exponen al paciente a un riesgo alto de accidentes traumáticos. La decisión de implantar un marcapasos en estos pacientes debe basarse en la valoración individual del cociente riesgo-beneficio213.
5.3.1.3Bloqueo de rama alternanteEsta rara condición se refiere a situaciones en las que hay clara evidencia de bloqueo de los 3 fascículos en ECG sucesivos. Algunos ejemplos de ello son las morfologías de BRI y BRD en ECG sucesivos o BRD con bloqueo fascicular anterior izquierdo en un ECG y bloqueo fascicular posterior izquierdo en otro214. Hay consenso generalizado en que este fenómeno está asociado con una enfermedad infranodular significativa y que los pacientes progresarán rápidamente hacia BAV. Por lo tanto, se debe implantar un marcapasos en cuanto se detecte BR alternante, incluso en ausencia de síntomas.
5.3.1.4Bloqueo de rama sin síntomasNo está indicado el implante de un marcapasos permanente para el BR asintomático, con la excepción del BR alternante, porque solo una minoría de estos pacientes desarrollarán BAV (un 1-2% anual)115,121,215. Los riesgos derivados del implante de un marcapasos y las complicaciones a largo plazo de los cables transvenosos son mayores que los beneficios de la estimulación cardiaca216,217.
5.3.1.5Pacientes con enfermedades neuromuscularesPara los pacientes con enfermedades neuromusculares, se debe considerar la estimulación cardiaca, ya que cualquier grado de bloqueo fascicular puede progresar de manera impredecible, incluso en ausencia de síntomas (véase el apartado 8.5).
Recomendaciones sobre estimulación para pacientes con bloqueo de rama
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para pacientes con síncope inexplicable y bloqueo bifascular, el marcapasos está indicado cuando el I-HV basal sea ≥ 70 ms y haya bloqueo intrahisiano o infrahisiano de segundo o tercer grado durante la estimulación auricular incremental o respuesta anormal al estrés farmacológico119,120 | I | B |
| La estimulación está indicada en pacientes con BR alternante con o sin síntomas | I | C |
| Para pacientes con síncope inexplicable y bloqueo bifascicular sin EEF seleccionados (ancianos, pacientes frágiles, síncope de alto riesgo y/o recurrente), se puede considerar la estimulación213 | IIb | B |
| No se recomienda la estimulación para los pacientes con BR asintomático o bloqueo bifascicular115,121,215 | III | B |
BR: bloqueo de rama; EEF: estudio electrofisiológico; I-HV: intervalo His-ventricular.
En la bradicardia intermitente, es posible que se requiera estimulación solo durante periodos cortos. En esta situación, los beneficios de la prevención de la bradicardia y las pausas deben sopesarse frente a los efectos perjudiciales de la estimulación permanente, en particular la IC inducida por estimulación. Una programación con respuesta en frecuencia baja para lograr una estimulación de reserva, la adaptación manual del intervalo AV, la programación de la histéresis AV y otros algoritmos específicos que eviten la estimulación innecesaria del VD ofrecen un margen de seguridad y desempeñana un papel fundamental en este grupo de pacientes144,148.
Para los pacientes en RS, el modo óptimo de estimulación es el bicameral. La fuerte evidencia de superioridad de la estimulación bicameral frente a la unicameral se limita a su efecto en la mejoría de los síntomas y la calidad de vida. Sin embargo, hay evidencia sólida de no superioridad en cuanto a la supervivencia y la morbilidad20. Por lo tanto, en pacientes ancianos o frágiles con bradicardia intermitente, la decisión sobre el modo de estimulación debe ser individualizada, teniendo en cuenta el mayor riesgo de complicaciones y los costes de la estimulación bicameral (figura 5).
La estimulación VDD puede ser una alternativa para pacientes con anomalías de la conducción AV avanzadas y función del nódulo sinusal conservada. En comparación con la estimulación bicameral, el implante de VDD se asocia con menor tasa de complicaciones, menos procedimientos, tiempos de fluoroscopia más cortos y una incidencia alta de infradetección auricular218. La infradetección auricular está contribuyendo a la escasa utilización de este sistema, debido a que la mayoría de los operadores procuran la sincronía AV.
5.4Estimulación cardiaca en el síncope reflejoEl tratamiento con marcapasos permanente puede ser eficaz si la asistolia es una característica dominante del síncope reflejo. El objetivo de la evaluación clínica de los pacientes con síncope y ECG basal normal debe ser establecer una relación entre los síntomas y la bradicardia. La eficacia de la estimulación depende del contexto clínico. El hecho de que el marcapasos sea eficaz no significa que sea necesario. En pacientes con síncope reflejo, la estimulación cardiaca debe ser el último recurso y solo debe considerarse en casos muy seleccionados (p. ej., mayores de 40 años, en su mayoría mayores de 60, afectados por formas graves de síncope reflejo con recurrencias frecuentes asociadas con un alto riesgo de lesión, a menudo sin pródromos). La guía de la ESC de 2018 sobre síncope62 ofrece una descripción detallada del algoritmo diagnóstico y las indicaciones de estimulación y proporciona la evidencia de los ensayos clínicos que repaldan dichas recomendaciones. La figura 7 resume el algoritmo de decisión propuesto.
El algoritmo que se muestra en la figura 7 se ha validado prospectivamente en un estudio pragmático multicéntrico que ha demostrado una tasa de recurrencia del síncope asociada con la estimulación del 15% a los 2 años, un valor que es significativamente menor que el 37% observado en los pacientes de control que no recibieron estimulación cardiaca219. La tasa de recurrencia fue similar en pacientes con síndrome del seno carotídeo (SSC) cardioinhibitorio (16%), respuesta asistólica en la prueba de basculación (23%) y asistolia espontánea documentada por GBI (24%), lo que apunta a unas indicaciones y unos resultados similares para las 3 formas de síncope reflejo220.
Si bien prevalece cierto escepticismo sobre la precisión diagnóstica de la prueba de mesa basculante para el diagnóstico de síncope, la evidencia emergente la respalda para la evaluación de la susceptibilidad a la hipotensión refleja107,221. Por lo tanto, se puede considerar la prueba de basculación para identificar a los pacientes con antecedentes de respuesta de hipotensión que tendrían menor probabilidad de responder a la estimulación cardiaca permanente. Los pacientes con susceptibilidad a sufrir hipotensión necesitan medidas dirigidas a contrarrestar esta respuesta refleja (como maniobras físicas de contrapresión, interrupción/reducción de fármacos hipotensores y administración de fludrocortisona o midodrina), además de la estimulación cardiaca.
5.4.1Indicaciones de estimulación cardiacaEste grupo de trabajo ha encontrado suficiente evidencia publicada para recomendar el marcapasos para pacientes con síncope reflejo muy seleccionados (es decir, mayores de 40 años que sufren episodios sincopales graves, recurrentes e impredecibles con asistolia, ya sea inducida por MSC o prueba de basculación o registrada a través de un sistema de monitorización)133,222–228 (véase la tabla 7 del material adicional). Hay evidencia suficiente de que la EAVB debe considerarse para reducir la recurrencia del síncope en pacientes con SSC dominante (pausa asistólica > 3 s y síncope espontáneo durante el MSC) y en los mayores de 40 años con síncope grave, impredecible y recurrente que muestren correlación entre los síntomas espontáneos y el ECG62. El tratamiento con marcapasos permanente puede ser eficaz si la asistolia es una característica dominante del síncope reflejo. El objetivo de la evaluación clínica debe ser establecer una correlación entre los síntomas y la bradicardia en los pacientes con síncope y ECG basal normal. La eficacia de la estimulación depende del contexto clínico. En la tabla 8 del material adicional se presenta una comparación de los resultados en diferentes contextos. Desde la publicación de la guía de la ESC 2018 sobre síncope62, algunos ensayos clínicos han aportado información relevante sobre el subgrupo de pacientes con síncope vasovagal asistólico inducido por basculación. El ensayo SPAIN es un estudio multicéntrico aleatorizado, controlado y transversal en 46 pacientes mayores de 40 años afectados de síncope muy recurrente (más de 5 episodios durante la vida) y respuesta cardioinhibitoria durante la prueba de basculación (definida como bradicardia < 40 lpm de duración > 10 s o asistolia > 3 s)226. Durante un seguimiento de 24 meses, el síncope recurrió en 4 pacientes (9%) tratados con un marcapasos bicameral con estimulación de circuito cerrado frente a 21 (46%) que habían recibido un marcapasos simulado desactivado (p = 0,0001). En un estudio con EPP229, la tasa libre de síncope a los 5 años fue del 81% en el grupo de estimulación cardiaca y el 53% de los pacientes emparejados por puntuación de propensión (HR = 0,25; p = 0,005). Por último, el ensayo multicéntrico BioSync CLS ha investigado la utilidad de la prueba de basculación para seleccionar a los candidatos a estimulación cardiaca228. En ese estudio se aleatorizó a pacientes de edad ≥ 40 años que habían tenido al menos 2 episodios de síncope reflejo grave impredecible durante el último año y un síncope inducido por basculación con una pausa asistólica > 3 s a marcapasos bicameral activo (63 pacientes) o inactivo (64 pacientes) con estimulación de circuito cerrado. Los resultados demostraron que, tras un seguimiento medio de 11,2 meses, el síncope se produjo en un número significativamente menor de pacientes del grupo de marcapasos que en el grupo de control: 10 (16%) frente a 34 (53%) respectivamente (HR=0,23; p = 0,00005). La evidencia aportada por este estudio apoya la inclusión de la prueba de basculación como un método útil para seleccionar a los pacientes con síncope reflejo candidatos a estimulación cardiaca.
Sobre la base de los resultados de los estudios anteriores, existe evidencia suficiente para actualizar de IIb a I la indicación de estimulación para pacientes mayores de 40 años que desarrollan respuesta asistólica > 3 s durante la prueba de basculación. La figura 8 resume la indicación de estimulación cardiaca recomendada. Aunque también existe justificación para estimulación cardiaca en pacientes menores de 40 años que cumplan los mismos criterios de gravedad que los mayores de 40, este grupo de trabajo no puede emitir ninguna recomendación debido a la falta de evidencia procedente de estudios clínicos que aborden esta población específica.
Hay una evidencia débil que indica que la EAVB puede ser útil para reducir la recurrencia del síncope en pacientes con características clínicas de síncope sensible a la adenosina62. En un pequeño ensayo multicéntrico en 80 pacientes ancianos con síncope impredecible de causa desconocida e inducción de BAV de tercer grado ≥ 10 s en respuesta a un bolo intravenoso de 20 mg de trifosfato de adenosina, muy seleccionados, la EAVB redujo significativamente la tasa de recurrencia del síncope a los 2 años desde el 69% del grupo de control al 23% del grupo tratado230. Por último, la estimulación cardiaca no está indicada en ausencia de un reflejo cardioinhibitorio documentado231,232.0
5.4.2Modo de estimulación cardiaca y selección del algoritmoIncluso cuando la evidencia es débil, en la práctica clínica se prefiere ampliamente la estimulación bicameral a la estimulación del VD monocameral para contrarrestar la caída de la presión arterial y prevenir la recurrencia de los síntomas. En pacientes con síncope vasovagal inducido por basculación, la EAVB se ha utilizado principalmente con una función de respuesta modulada por la caída de frecuencia que proporciona una estimulación bicameral rápida si el dispositivo detecta una disminución rápida de la frecuencia cardiaca. Dos estudios pequeños han comparado la EAVB con estimulación de circuito cerrado y la EAVB convencional mediante un diseño transversal. Ambos estudios han demostrado menor recurrencia de síncope en el grupo de estimulación de circuito cerrado, tanto en el contexto agudo durante las pruebas de basculación233 como durante el seguimiento clínico de 18 meses227. No obstante, no se puede hacer ninguna recomendación con respecto a la selección y el modo de estimulación (es decir, EAVB con respuesta en caída de frecuencia o EAVB con estimulación de bucle cerrado) y su programación hasta que se realice un ensayo clínico paralelo adecuado.
Recomendaciones sobre estimulación para el síncope reflejo
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| La estimulación cardiaca bicameral está indicada para reducir el síncope recurrente en pacientes mayores de 40 años con síncope recurrente, impredecible y grave que tengan:• Pausas asistólicas sintomáticas documentadas espontáneas > 3 s o pausas asintomáticas > 6 s por parada sinusal o BAV o• Síndrome del seno carotídeo cardioinhibitorio o• Síncope asistólico durante la basculación62,219,220,226,228,229 | I | A |
| Se puede considerar la estimulación cardiaca bicameral para reducir las recurrencias del síncope en pacientes con características clínicas de síncope sensible a la adenosina230 | IIb | B |
| La estimulación cardiaca no está indicada en ausencia de un reflejo cardioinhibitorio documentado231,232 | III | B |
BAV: bloqueo auriculoventricular.
Para los pacientes con síncope recurrente de causa desconocida o caídas al final de la evaluación convencional, se debe considerar la monitorización con GBI con intención de documentar una recaída espontánea en vez de iniciar una estimulación cardiaca empírica62.
5.5.1Síndrome recurrente no diagnosticadoPara los pacientes con síncope de causa desconocida al final de una evaluación completa y sin anomalías de la conducción, la falta de una justificación clara y los resultados negativos de los estudios pequeños234,235 proporcionan suficiente evidencia sobre la ineficacia de la estimulación cardiaca. Por lo tanto, no se recomienda la estimulación cardiaca hasta que obtener un diagnóstico (figura 8).
5.5.2Caídas recurrentesEntre el 15 y el 20% de las caídas inexplicadas pueden ser de naturaleza sincopal, posiblemente bradiarrítmica. La amnesia retrógrada, que es frecuente en los ancianos que se caen, puede ser causa una mala interpretación del episodio62. El tratamiento de las caídas inexplicables debe ser el mismo que el del síncope de causa desconocida (véase el apartado 5.4.1). En un ensayo aleatorizado a doble ciego236, la estimulación cardiaca fue ineficaz para prevenir las recurrencias en pacientes con una caída inexplicable en los que la hipersensibilidad del seno carotídeo no pudo inducir el síncope.
Recomendaciones sobre estimulación para pacientes con síncope sospechado (no documentado) y caídas de causa desconocida
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para los pacientes con caídas recurrentes inexplicadas, se debe considerar la misma evaluación que para el síncope de causa desconocida62 | IIa | C |
| No se recomienda la estimulación cardiaca para los pacientes con caídas inexplicadas en ausencia de cualquier otra indicación documentada236 | III | B |
| No se recomienda la estimulación cardiaca para los pacientes con síncope de causa desconocida sin evidencia de DNS o anomalía de la conducción234,235 | III | C |
DNS: disfunción del nódulo sinusal.
La prevalencia de IC en los países desarrollados se aproxima a un 1-2% de la población adulta y aumenta hasta ser ≥ 10% de los mayores de 70 años237. La prevalencia de la IC está aumentando (un 23% en la última década, según uno de los cálculos) principalmente debido al envejecimiento de la población, aunque la incidencia específica por edad está disminuyendo238–241.
Hay 3 fenotipos distintos de IC basados en la medición de la FEVI (< 40%, IC con FE reducida [IC-FEr]; 40-49%, IC con FE ligeramente reducida [IC-FElr], y ≥ 50%, IC con FE conservada [IC-FEc])242. La TRC es clínicamente útil para pacientes con IC-FEr y FEVI ≤ 35%. Los pacientes con IC-FEr constituyen aproximadamente el 50% de toda la población con IC, aunque su prevalencia disminuye entre las personas de 70 años o más. El pronóstico de la IC varía según la población definida. En los ensayos clínicos de IC-FEr contemporáneos, se observan tasas de mortalidad a 1 año de aproximadamente un 6%, mientras que, según datos derivados de los grandes registros, las tasas de mortalidad a 1 año superan el 20% de los pacientes hospitalizados por IC recientemente y están más cerca de un 6% de los pacientes ambulatorios con IC estable incluidos243. El concepto de TRC se basa en que los pacientes con IC y disfunción sistólica del VI suelen presentar retrasos de conducción intraventricular de alto grado, con prevalencias de duración QRS > 120 ms de un 25-50% y de BRI de un 15-27% de los casos. Además, en estos pacientes, la disincronía AV también suele estar presente con PR prolongado en el ECG de superficie hasta en un 52% de los casos244–246. Estas anomalías eléctricas pueden dar lugar a una disincronía mecánica AV, interventricular y en el VI247,248.
Las recomendaciones para la TRC se basan en los resultados de los principales ECA sobre TRC, la mayoría de los cuales se ha restringido a aproximadamente un 60% de los pacientes con IC-FEr que están en RS. Además del tratamiento médico indicado en las guías, la TRC se recomienda para sugrupos definidos de la población de pacientes con IC, principalmente con IC sintomática en RS, FEVI reducida y QRS ≥ 130 ms. Otros grupos más pequeños que pueden considerarse para TRC son los pacientes con IC en clase funcional de la New York Heart Association (NYHA) III o IV con FA, FEVI reducida y QRS ≥ 130 ms, siempre que se disponga de una estrategia para garantizar que la captura biventricular esté en su lugar o que el paciente vuelva a RS. Ocasionalmente se puede considerar la TRC como una progresión desde un marcapasos convencional o un DAI en pacientes con IC-FEr que sufran un empeoramiento de la IC y tengan una frecuencia alta de descargas de estimulación ventricular. Según una encuesta reciente en Estados Unidos, que ha derivado en un cálculo representativo nacional de toda la población estadounidense de pacientes hospitalizados, se han implantado en un periodo de 10 años (2003-2012) 378.247 dispositivos de TRC-D, lo que representa aproximadamente 40.000 por año, o 135 por millón de habitantes y año249. En Europa, los cálculos previos indicaban que unos 400 pacientes/millón de hab./año podrían ser candidatos a TRC. Estas estimaciones se basaron en una prevalencia calculada del 35% para la FEVI ≤ 35% en una población con IC representativa, de la cual se estimó que el 41% de los pacientes tenían una QRS ≥ 120 ms. La modificación del umbral de duración del QRS a un valor más alto (≥ 130 ms) apenas reduciría estos números250,251. Según una encuesta reciente realizada en Suecia a partir de 12.807 pacientes con IC-FEr, el 7% había recibido TRC, el 69% no tenía indicación para TRC y el 24% de los pacientes con indicación de TRC no la había recibido. Estos datos ponen de manifiesto la infrautilización de la TRC252,253. El grupo de trabajo quiere subrayar que la decisión de implantar TRC requiere una toma de decisiones compartida con el paciente.
6.2Indicación de terapia de resincronización cardiaca: pacientes en ritmo sinusalLa TRC mejora la función cardiaca, los síntomas y el bienestar y reduce la morbimortalidad en subgrupos de pacientes con IC seleccionados. La TRC también mejora los años de vida ajustados por calidad de los pacientes con IC de moderada a grave. Los efectos beneficiosos de la TRC se han probado ampliamente en pacientes en NYHA II, III y IV37,39,40,254–266. Por el contrario, la evidencia del beneficio de la TRC en pacientes en NYHA I con miocardiopatía isquémica es escasa40,265. En el estudio MADIT-CRT265, 265 de los 1.820 pacientes (7,8%) estaban en NYHA I y tenían miocardiopatía isquémica. A los 7 años de seguimiento, el subgrupo de pacientes con BRI, NYHA I y miocardiopatía isquémica mostró una tendencia no significativa hacia un menor riesgo de muerte por cualquier causa (riesgo relativo, 0,66; intervalo de confianza del 95% [IC95%], 0,30-1,42; p = 0,29). Por lo tanto, las recomendaciones actuales sobre TRC son aplicables a todos los pacientes en clase funcional II-IV de cualquier etiología.
Los estudios MUSTIC256,257, MIRACLE, PATH-CHF I y II58,254,255,259, COMPANION260 y CARE-HF39,261 han comparado el efecto de la TRC frente al tratamiento médico indicado en las guías para pacientes en NYHA III o IV. Por el contrario, los estudios clínicos más recientes comparan la TRC-D con el DAI añadidos al tratamiento médico óptimo (TMO) de pacientes en NYHA II37,40,262–266. Pocos estudios han comparado la TRC con marcapasos (TRC-M) y la estimulación convencional190,267,268. La mayoría de los ensayos clínicos sobre TRC han especificado que la FEVI debe ser ≤ 35%, pero los estudios MADIT-CRT40 y RAFT37 consideraron una FEVI ≤ 30% y el REVERSE262 consideró una FEVI ≤ 40%. En general, se ha aleatorizado a pocos pacientes con FEVI de 35-40%, aunque los resultados de un metanálisis realizado a partir de datos de un participante individual no indican una disminución del efecto de la TRC en este grupo33.
No todos los pacientes responden favorablemente a la TRC. Varias características predicen la reducción del volumen ventricular (remodelado inverso) y la mejora de la morbilidad y la mortalidad. La duración del QRS predice la respuesta a la TRC y ha sido el criterio de inclusión en todos los ensayos aleatorizados (para conocer los criterios electrocardiográficos de BRI y BRD, véase la tabla 1 del material adicional). La morfología del QRS se ha relacionado con una respuesta beneficiosa a la TRC. Varios estudios han demostrado que los pacientes con morfología de BRI tienen más probabilidades de respuesta favorable, mientras que la certeza es menor con pacientes que no presentan morfología de BRI. Sipahi al.269,270 realizaron un metanálisis en el que examinaron 33 ensayos clínicos que investigaban el efecto de la morfología del QRS en la TRC, aunque solo 4 de ellos (los estudios COMPANION, CARE-HF, MADIT-CRT y RAFT) incluyeron resultados según la morfología del QRS. La evaluación del efecto de la TRC en la variable compuesta de eventos clínicos adversos en 3.349 pacientes con BRI al inicio del estudio indicó una reducción de 36% del riesgo (riesgo relativo=0,64; IC95%, 0,52-0,77; p < 0,00001). Sin embargo, dicho beneficio no se observó en pacientes con anomalías de la conducción no relacionadas con BRI (riesgo relativo=0,97; IC95%, 0,82-1,15; p < 0,75). Limitando el análisis a los ensayos que no utilizaron DAI (CARE-HF y COMPANION), el beneficio de la TRC seguía observándose solo en los pacientes con BRI (p < 0,000001). En un metanálisis que excluyó los estudios COMPANION y MADIT-CRT, el BRI no resultó ser un predictor de mortalidad, a diferencia de la duración del QRS266. En un gran metanálisis reciente de 5 ECA (COMPANION, CARE-HF, MADIT-CRT, RAFT y REVERSE) que incluyeron a 6.523 participantes (1.766 con morfología de QRS sin BRI), la TRC no se ha asociado con una reducción de muerte u hospitalización por IC en pacientes con morfología de QRS sin BRI (HR = 0,99; IC95%, 0,82-1,2)271. Debido a que los pacientes se han agregado a la categoría sin BRI en casi todos los estudios y análisis post hoc que han investigado el efecto beneficioso de la morfología del QRS en la TRC, no es posible emitir una recomendación separada sobra TRC para pacientes con alteración difusa de la conducción intraventricular y BRD272–277. Los pacientes con BRD no se benefician de la TRC278 a menos que muestren un BRI enmascarado en el ECG277, caracterizado por una onda R ancha, arrastrada, a veces con muescas en las derivaciones I y aVL, junto con una desviación del eje. En estos pacientes es fundamental colocar la derivación del VI de manera individualizada.
Un concepto reciente que puede ser importante es el posible papel del intervalo PR prolongado en los pacientes con IC sin BRI. Algunos estudios de un solo centro y 2 análisis post hoc de ECA grandes (COMPANION y MADIT-CRT) indican un beneficio potencial de la TRC en este subgrupo de pacientes244,279,280. En el estudio MADIT-CRT, el subgrupo de pacientes sin BRI que tenía un intervalo RP prolongado se benefició de la TRC-D, con una reducción del 73% en el riesgo de IC o muerte y del 81% en el riesgo de mortalidad por cualquier causa respecto al grupo tratado con DAI279. En pacientes sin BRI con PR normal, la TRC-D se asoció con una tendencia hacia mayor riesgo de IC o muerte y una mortalidad 2 veces superior a la observada en el grupo de DAI, lo que indica una interacción bidireccional significativa. Sin embargo, se dispone de muy pocos datos para poder emitir una recomendación279.
Los resultados de los ensayos MADIT-CRT, REVERSE y RAFT indican que la TRC puede ser beneficiosa para todos los pacientes con BRI independientemente de la duración del QRS y que no se puede establecer un punto de corte del QRS que permita excluir a los pacientes que no responderán272,273,275. Por el contrario, el beneficio de la TRC en pacientes sin BRI se produce principalmente cuando el QRS es ≥ 150 ms. Es importante destacar que, como se muestra en el seguimiento a largo plazo de los estudios MADIT-CRT y RAFT, el beneficio para los pacientes con QRS < 150 ms aparece más tardíamente265,273.
El estudio Echo-CRT indica un posible daño de la TRC cuando se utiliza el criterio de la disincronía mecánica en el ECG basal de pacientes con QRS < 130 ms264,281. Por lo tanto, se desaconseja la selección de candidatos a TRC basada en datos de imagen cardiaca cuando haya intervalos QRS «estrechos» (< 130 ms).
Los datos agrupados de pacientes individuales de 3 ensayos de TRC-D frente a DAI que incluyeron sobre todo a pacientes con IC en NYHA II han mostrado que las mujeres tienen mayor probabilidad de respuesta que los varones282. En el metanálisis de datos de pacientes de la Food and Drug Administration de Estados Unidos, Zusterzeel et al.283 identificaron que la principal diferencia ocurría en pacientes con BRI y QRS de 130-149 ms. En este grupo, las mujeres tuvieron una reducción del 76% en la variable combinada de IC o muerte (diferencia absoluta entre la TRC-D y el DAI, 23%; HR = 0,24; IC95%, 0,11-0,53; p < 0,001) y del 76% en la variable muerte (diferencia absoluta, 9%; HR = 0,24; IC95%, 0,06-0,89; p = 0,03), mientras que no hubo un beneficio significativo en los varones en la variable combinada IC o muerte (diferencia absoluta, 4%; HR = 0,85; IC95%, 0,60-1,21; p = 0,38) y la mortalidad (diferencia absoluta, 2%; HR = 0,86; IC95%, 0,49-1,52; p = 0,60). Una posible explicación del mayor beneficio de la TRC en las mujeres se ha atribuido a la diferencia en el tamaño del VI, ya que las diferencias relacionadas con el sexo desaparecen cuando el QRS se normaliza con respecto al volumen telediastólico del VI284. Recientemente, los modelos informáticos han confirmado que las diferencias en el tamaño del VI son en buena medida el origen de la diferencias en la duración del QRS específicas del sexo y ofrecen una explicación mecanicista sobre las diferencias por sexo en la TRC285,286. Las simulaciones que tienen en cuenta el menor tamaño del VI de las mujeres predicen umbrales de QRS 9-13 ms más bajos para las mujeres. Al igual que otros parámetros del ECG (p. ej., duración del QT y el QT corregido), es razonable que el QRS también refleje la diferencia de sexo.
Los criterios electrocardiográficos de anomalía de la conducción intraventricular, BRI y sin BRI no se han definido ni descrito de manera coincidente en ninguno de los estudios anteriores de TRC287,288. Sin embargo, la selección de estos criterios parece influir en las variables clínicas principales287–290. Asimismo, la modalidad de medición del QRS (automática o manual y la máquina de registro electrocardiográfico) no se ha descrito en los estudios de TRC. No obstante, se ha demostrado que la modalidad de registro y el fabricante del equipo pueden afectar a la duración del QRS medida automáticamente.
Por último, la TRC se considera para pacientes en TMO que incluye bloqueadores beta, inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de la angiotensina II y antagonistas de los receptores de mineralocorticoides. Un estudio ha planteado la pregunta de cuál es el momento oportuno para la TRC, ya que la eficacia del tratamiento médico puede ser baja en pacientes con BRI, lo que indica que la TRC podría considerarse antes en estos casos291. Además, hay que tener en cuenta que, si bien en la práctica clínica diaria se apoya el uso de sacubitrilo-valsartán, ivabradina e inhibidores del cotransportador-2 de sodio-glucosa, en los ensayos clínicos de referencia que han documentado la eficacia de estos fármacos muy pocos pacientes tenían una indicación para TRC. Por lo tanto, no existen datos sólidos que respalden el uso obligatorio de estos medicamentos antes de considerar la TRC292–295.
Recomendaciones sobre terapia de resincronización cardiaca para pacientes en ritmo sinusal
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| QRS con morfología de BRI | ||
| Se recomienda la TRC para los pacientes en RS con IC sintomática, FEVI ≤ 35%, QRS ≥ 150 ms y QRS con morfología de BRI a pesar del TMO, con el fin de mejorar los síntomas y reducir la morbimortalidad37,39,40,254–266,283,284 | I | A |
| La TRC se debe considerar para pacientes en RS con IC sintomática, FEVI ≤ 35%, QRS 130-149 ms y QRS con morfología de BRI a pesar del TMO, con el fin de mejorar los síntomas y reducir la morbimortalidad37,39,40,254–266,283,284 | IIa | B |
| QRS con morfología diferente del BRI | ||
| La TRC se debe considerar para los pacientes en RS con IC sintomática, FEVI ≤ 35%, QRS ≥ 150 ms y QRS de morfología diferente del BRI a pesar del TMO, con el fin de mejorar los síntomas y reducir la morbimortalidad37,39,40,254266,283,284 | IIa | B |
| Se puede considerar la TRC para los pacientes en RS con IC sintomática, FEVI ≤ 35%, QRS 130-149 ms y QRS de morfología diferente del BRI a pesar del TMO, con el fin de mejorar los síntomas y reducir la morbimortalidad273–278,281 | IIb | B |
| Duración del QRS | ||
| La TRC no está indicada para los pacientes con IC y QRS < 130 ms que no tengan indicación de estimulación del VD264,282 | III | A |
BRI: bloqueo de rama izquierda; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; RS: ritmo sinusal; TMO: tratamiento médico óptimo; TRC: terapia de resincronización cardiaca; VD: ventrículo derecho.
En este apartado se consideran las indicaciones de TRC para pacientes con FA permanente o persistente que no son aptos para la ablación de FA o han tenido una ablación fallida. Se ha descrito que la ablación de FA mejora la FEVI y reduce la tasa de hospitalización por IC en pacientes seleccionados. Se recomienda la ablación de FA para revertir la disfunción del VI en pacientes con FA cuando la miocardiopatía inducida por taquicardia sea muy probable, independientemente de los síntomas296. Por lo tanto, se debe considerar la TRC para los pacientes que tengan FA persistente e IC-FEr cuando no se pueda llevar a cabo la ablación de FA o el paciente la rechace. Con respecto a las indicaciones sobre el tratamiento de control de la frecuencia y, en particular, la ablación de la UAV, consulte la guía de la ESC para el tratamiento de la FA296.
6.2.2Pacientes con fibrilación auricular e insuficiencia cardiaca candidatos a terapia de resincronización cardiacaUno de los mayores determinantes del éxito de la TRC es la aplicación eficaz de estimulación biventricular. Es importante tener presente que el ritmo de FA con frecuencia ventricular rápida e irregular puede interferir con la adecuada estimulación biventricular. La FA puede reducir la tasa de captura biventricular efectiva al crear latidos espontáneos, de fusión o seudofusión. En dos tercios de los pacientes con FA persistente o permanente no se alcanza una tasa de estimulación biventricular alta297.
Los datos de los grandes registros muestran que los pacientes con FA sometidos a TRC tienen más riesgo de mortalidad incluso tras ajustar por varias variables clínicas297–299. En la mayoría de los pacientes con FA con conducción AV intacta, solo se puede conseguir una estimulación biventricular adecuada mediante ablación de la UAV300–302. Un subestudio del ensayo RAFT300 no ha podido demostrar el beneficio de la TRC sin ablación de la UAV en la variable combinada de muerte u hospitalización por IC; solo el 47% de los pacientes tenían una captura biventricular > 90%. La decisión de realizar ablación de la UAV sigue en debate, pero la mayoría de los estudios han demostrado mejoras en la función del VI, la capacidad funcional, la capacidad de ejercicio y la supervivencia (de una magnitud similar a la de los pacientes en RS)301. Gasparini et al.302 han comparado la mortalidad total de 443 pacientes con FA sometidos a ablación de la UAV (n = 443) y 895 con FA que recibieron tratamiento farmacológico reductor de la frecuencia con la mortalidad de 6.046 pacientes que estaban en RS. La supervivencia a largo plazo tras la TRC de los pacientes con FA y ablación de la UAV fue similar a la observada en los pacientes en RS (HR = 0,93); fue mayor la mortalidad de los pacientes con FA tratados con fármacos reductores de la frecuencia (HR = 1,52). Los fármacos para el control de la frecuencia más utilizados en la FA son los bloqueadores beta; aunque son seguros incluso en el contexto de FA e IC-FEr, no tienen necesariamente el mismo beneficio que el obtenido en pacientes en RS303 y el cociente riesgo-beneficio está modulado por la presencia de otras comorbilidades cardiovasculares304,305. En una revisión sistemática y metanálisis306, la ablación de la UAV, comparada con la estrategia sin ablación, redujo la mortalidad en un 37% y disminuyó la tasa de falta de respuesta en el 59% de los pacientes con estimulación biventricular < 90%, pero no se demostró beneficio en los que tenían estimulación biventricular ≥ 90%. De forma parecida, Tolosana et al. observaron la misma tasa de respondedores (definida como una disminución ≥ 10% del volumen telesistólico) entre los pacientes con FA sometidos a ablación de la UAV o que tomaban reductores de la frecuencia y pacientes en RS que tenían estimulación biventricular adecuada (el 97, el 94 y el 97% respectivamente)307. Es importante destacar que la ablación no mejoró la supervivencia de los pacientes con FA tratados con TRC comparados con los tratados farmacológicamente cuando se lograba una estimulación biventricular adecuada con ablación (97%) o fármacos (94%)308.
En conclusión, a pesar de la poca evidencia disponible por falta de grandes ECA, la opinión mayoritaria de los expertos es que la TRC es útil para pacientes con FA permanente en NYHA III y IV con las mismas indicaciones que para los pacientes en RS, siempre que se añada ablación de la UAV en casos de captura biventricular incompleta (< 90-95%) por FA (figura 9). No obstante, existen otras causas de estimulación biventricular incompleta, como los latidos ventriculares prematuros frecuentes, que pueden requerir tratamiento (con fármacos o ablación) antes de la ablación de la UAV. Es importante destacar que la evaluación del porcentaje de estimulación biventricular viene dada principalmente por el valor que se obtiene de la memoria del dispositivo, que no refleja exactamente la tasa de captura biventricular efectiva. En este sentido, la monitorización Holter puede ayudar a evaluar el porcentaje de captura biventricular real309,310. Se ha desarrollado un nuevo algoritmo que puede hacer una evaluación continua de la estimulación biventricular eficaz311.
Para los pacientes con FA permanente, no hay datos que apoyen la magnitud de respuesta a la TRC según la morfología del QRS o un valor de corte del QRS en 150 ms.
Es importante recordar que hay pocos datos disponibles para pacientes en NYHA II.
6.2.3Pacientes con frecuencia cardiaca no controlada candidatos a ablación del nódulo auriculoventricular (independientemente de la duración del QRS)Se debe considerar la ablación de la UAV para el control de la frecuencia cardiaca en pacientes que no respondan o no toleren el tratamiento farmacológico intensivo de control de frecuencia y ritmo o no sean candidatos para ablación de FA, aceptando que estos pacientes se volverán dependientes de marcapasos296. En pacientes muy sintomáticos con FA permanente y al menos una hospitalización por IC, la ablación de la UAV combinada con TRC puede ser preferible a la ablación de FA296.
La ablación de la UAV y la estimulación permanente desde el ápex del VD (AVD) proporcionan un control de la frecuencia y una regularización de la respuesta ventricular altamente eficaces en la FA y mejoran los síntomas en pacientes seleccionados192. Un estudio clínico de gran tamaño con grupo de control emparejado por puntuación de propensión194 ha mostrado una reducción de 53% en la mortalidad total de los pacientes sometidos a ablación de la UAV respecto a los tratados farmacológicamente para el control de la frecuencia. En la guía de la ESC sobre FA de 2020, tiene indicación de clase IIa.
El inconveniente de la estimulación del VD es que induce disincronía del VI en aproximadamente un 50% de los pacientes312, lo que puede provocar un empeoramiento de los síntomas de IC en algún caso. En la mayoría de los pacientes, la ablación de la UAV mejora la FEVI incluso con estimulación del AVD debido a la mejora de la disfunción del VI inducida por taquicardia, que suele darse. La TRC puede prevenir la disincronía del VI inducida por estimulación del VD. El ensayo prospectivo, multicéntrico y aleatorizado APAF313 incluyó a 186 pacientes sometidos a implante de un dispositivo de TRC o estimulación del VD, seguido de ablación de la UAV. La TRC redujo un 63% la variable principal compuesta de muerte por IC, hospitalización por IC o empeoramiento de la IC durante un seguimiento medio de 20 meses. Los efectos beneficiosos de la TRC en pacientes con FEVI ≤ 35%, NYHA ≥ III y QRS ≥ 120 ms fueron similares que los de quienes tenían FEVI > 35% o estaban en NYHA < III o mostraban QRS estrecho. En comparación con el grupo de estimulación del VD, los respondedores aumentaron del 63 al 83% (p = 0,003)314. Un metanálisis realizado a partir de 696 pacientes de 5 ensayos mostró una reducción del 62% en las hospitalizaciones por IC y una discreta mejora en la FEVI en comparación con la estimulación del VD, pero no en la distancia recorrida en 6 min y la calidad de vida evaluada mediante el cuestionario Minnesota Living with Heart Failure315. El estudio APAF-CRT, aleatorizó a 102 pacientes ancianos (media de edad, 72 años) con FA permanente, QRS estrecho (≤ 110 ms) y al menos una hospitalización por IC en el año anterior, a la ablación de la UAV y TRC o tratamiento farmacológico para el control de la frecuencia195. Después de un seguimiento medio de 16 meses, la variable principal de muerte por IC, hospitalización por IC o empeoramiento de la IC ocurrió en 10 pacientes (20%) del grupo de ablación/TRC y 20 pacientes (38%) del grupo de tratamiento farmacológico (HR = 0,38; p = 0,013). Las diferencias se debieron principalmente a la reducción de hospitalizaciones por IC. Para los pacientes con FEVI ≤ 35%, HR=0,18 (p = 0,01) y para aquellos con FEVI > 35%, HR = 0,62 (p = 0,36). Además, los pacientes sometidos a ablación de la UAV/TRC tuvieron una reducción del 36% en los síntomas y las limitaciones físicas derivadas de la FA al año de seguimiento (p = 0,004). A diferencia de la variable principal compuesta, la mayor mejoría sintomática se observó en los pacientes con FEVI > 35% (p = 0,0003).
En conclusión, existe evidencia procedente de ECA que demuestra que la estimulación con TRC en pacientes con FE reducida candidatos a ablación de la UAV para el control de la frecuencia ofrece un beneficio adicional en cuanto a la tasa de hospitalizaciones y la calidad de vida. La evidencia también indica que la TRC es superior a la estimulación del VD para aliviar los síntomas, pero no la mortalidad y las hospitalizaciones, de los pacientes con función sistólica reducida de grado medio (figura 9).
6.2.4Modalidades emergentes de la terapia de resincronización cardiaca: papel de la estimulación del sistema de conducciónLa EHH, sola o con estimulación del seno coronario, es una técnica de TRC novedosa y prometedora, útil para pacientes con FA sometidos a ablación de la UAV198,199,316–318. La TRC no convencional con estimulación del seno coronario y EHH (conocida como «TRC optimizada para His») o la estimulación de la región de la rama izquierda pueden lograr un QRS más estrecho con una morfología del eje casi normal, una mejora ecocardiográfica de los índices de resincronización mecánica y un resultado clínico a corto plazo superior a la TRC convencional319–321. En general, el beneficio de la EHH depende de la capacidad para lograr un complejo QRS estrecho que sea similar al complejo QRS nativo, no tanto como su efecto en la FEVI. La adopción generalizada de esta técnica se basa en una mayor validación de su eficacia en grandes ECA y mejoras en el diseño de los cables y los dispositivos (véase el apartado 7).
Recomendaciones sobre la terapia de resincronización cardiaca para pacientes con fibrilación auricular persistente o permanente
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| 1. Para los pacientes con IC y FA permanente candidatos a TRC: | ||
| 1A. Se debe considerar la TRC para pacientes con IC y FEVI ≤ 35% en NYHA III o IV a pesar del TMO si están en FA y tienen un QRS intrínseco ≥ 130 ms siempre que se disponga de una estrategia para asegurar la captura biventricular, con el fin de mejorar los síntomas y reducir la morbimortalidad302,306,307,322 | IIa | C |
| 1B. Debe añadirse ablación de la UAV en caso de estimulación biventricular incompleta (< 90-95%) debido a FA conducida por vía aberrante297–302 | IIa | B |
| 2. Para los pacientes con IC sintomática y frecuencia cardiaca incontrolada candidatos a ablación de la UAV (independientemente de la duración del QRS): | ||
| 2A. Se recomienda la TRC para los pacientes con IC-FEr196,197,306,308 | I | B |
| 2B. Se debe considerar la TRC en lugar de la estimulación del VD estándar para los pacientes con IC-FElr | IIa | C |
| 2C. Se debe considerar la estimulación del VD para los pacientes con IC-FEc188,196,323 | IIa | B |
| 2D. Se puede considerar la TRC para los pacientes con IC-FEc | IIb | C |
FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada (≥ 50%) según la guía ESC de IC de 2021242; IC-FElr: insuficiencia cardiaca con fracción de eyección ligeramente reducida (40-49%); IC-FEr: insuficiencia cardiaca con fracción de eyección reducida (< 40%); NYHA: clase funcional de la New York Heart Association; TRC: terapia de resincronización cardiaca; UAV: unión auriculoventricular; VD: ventrículo derecho.
Varios estudios han demostrado el efecto deletéreo de la estimulación crónica del VD en el riesgo de síntomas de IC u hospitalizaciones, que puede reducirse mediante una programación dirigida a maximizar la conducción intrínseca o prevenirse mediante TRC148,183,190,324. Anteriormente, el beneficio de progresar a TRC solo se había investigado en estudios observacionales y registros325–339 que comparaban la progresión a TRC con la TRC de novo, estudios observacionales pequeños anteriores y posteriores a la TRC340–346 y estudios transversales347–350, que en su conjunto aportaron poca evidencia clínica.
Según un metanálisis reciente de estudios observacionales, en su mayoría de un solo centro351, la respuesta ecocardiográfica y funcional, así como el riesgo de mortalidad o de episodios de IC, fue similar en los pacientes con TRC de novo y los que progresaron a TRC. En los análisis de subgrupos de los grandes ensayos prospectivos aleatorizados, como el estudio RAFT 37, no se ha confirmado un beneficio en morbilidad o mortalidad.
Los resultados clínicos también dependen de las características clínicas de los pacientes que se someten a progresión a TRC. Según los datos de la European CRT Survey II352, un registro de gran tamaño, y teniendo en cuenta las características clínicas de los pacientes incluidos en los estudios previos351, los pacientes remitidos a progresión a TRC difieren de los remitidos a TRC de novo: son mayores (incluso comparados con los de los ECA), predominantemente varones y con más comorbilidades, como FA, cardiopatía isquémica, anemia e insuficiencia renal.
En promedio, el número de procedimientos de progresión en los países europeos alcanza el 23% del total de implantes de TRC; de ellos, el 60% procede de un dispositivo convencional y el 40% de un DAI352, con diferencias regionales importantes en cuanto al tipo de dispositivo implantado, TRC-M o TRC-D352,353.
Con respecto a las complicaciones relacionadas con el procedimiento, varios estudios han descrito una tasa mayor (de un 6,8 a un 20,9%) de procedimientos de progresión comparada con los implantes de novo339,354. Esto no se ha confirmado en un análisis reciente realizado con los datos de un registro, que muestra unas tasas de complicaciones similares en el grupo de progresión y el de implantes de novo352. Cabe destacar que un 82% de estos procedimientos se han realizado en centros de gran volumen. Sin embargo, hay muy pocos datos sobre las tasas de infección a largo plazo o las revisiones de los cables después de la progresión a TRC354,355.
El estudio BUDAPEST CRT Upgrade, actualmente en curso, es el primer ensayo prospectivo aleatorizado356 que puede dar respuesta a estas cuestiones.
Recomendaciones sobre el paso de estimulación del ventrículo derecho a terapia de resincronización cardiaca
| Recomendación | Clasea | Nivelb |
|---|---|---|
| Para los pacientes portadores de marcapasos convencional o DAI que después desarrollan IC sintomática con FEVI ≤ 35% a pesar del TMO y tienen una estimulación del VD significativac, se debe considerar el paso a TRC37,148,185,190,324–352 | IIa | B |
DAI: desfibrilador automático implantable; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; TMO: tratamiento médico óptimo; TRC: terapia de resincronización cardiaca; VD: ventrículo derecho.
Los datos observacionales respaldan un valor límite de estimulación del VD del 20% para aplicar intervenciones dirigidas a la IC inducida por estimulación. Sin embargo, no hay datos que demuestren que el porcentaje de estimulación del VD defina un valor umbral de seguridad (por debajo del cual la estimulación sea segura y por encima del cual sea perjudicial).
Tres ensayos aleatorizados han demostrado la superioridad de la estimulación biventricular sobre la estimulación del VD para mejorar la calidad de vida, la clase funcional y la respuesta ecocardiográfica de los pacientes con disfunción sistólica de moderada a grave que requieren estimulación antibradicárdica190,357,358. En el estudio BLOCK HF, se aleatorizó a 691 pacientes con enfermedad del NAV y una indicación de marcapasos con FE levemente reducida (< 50% según los criterios de inclusión; promedio del 42,9% en el grupo de marcapasos) a marcapasos biventricular o estimulación del VD con o sin DAI; la media de seguimiento fue 37 meses190. La variable principal (una variable combinada de aumento ≥ 15% del volumen telesistólico del VI, episodios de IC o mortalidad) mejoró significativamente en el grupo asignado a TRC. La respuesta a la TRC es alta entre los pacientes con disfunción sistólica y estimulación del VD frecuente. Según el ensayo MOST183, al menos el 40% de la estimulación del VD se asocia con mayor riesgo de hospitalización por IC o FA.
Para los pacientes con FE normal o conservada, el efecto de la TRC en la reducción de la tasa de hospitalización es controvertido y no se ha demostrado beneficio alguno en la mortalidad166,268,323,359. Sin embargo, la estimulación biventricular previene el remodelado adverso con la estimulación del VD, especialmente tras un seguimiento a largo plazo323,359,360. Un estudio de un único centro ha descrito que la estimulación del VD > 20% se asocia con remodelado adverso del VI en pacientes con BAV y FEVI conservada188. La fragilidad también debe tenerse en cuenta al decidir la conveniencia de un implante de TRC, debido a los mayores costes y las elevadas tasas de complicaciones de este procedimiento.
Recomendaciones para los pacientes con insuficiencia cardiaca y bloqueo auriculoventricular
| Recomendación | Clasea | Nivelb |
|---|---|---|
| Se recomienda la TRC en lugar de la estimulación del VD para los pacientes con IC-FEr (< 40%) en cualquier clase funcional y que tengan indicación de estimulación ventricular y BAV de alto grado, con el fin de reducir la morbilidad. Esto incluye a los pacientes con FA183,190,196,268,313,323,357359,361,362 | I | A |
BAV: bloqueo auriculoventricular; FA: fibrilación auricular; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida (< 40%) según la guía ESC de IC de 2021242; TRC: terapia de resincronización cardiaca; VD: ventrículo derecho.
Sigue sin establecerse claramente el beneficio de la TRC-D sobre la TRC-M en la mortalidad, principalmente porque no se han diseñado ECA para comparar estos dos tratamientos. Si bien la TRC-D puede mejorar la supervivencia aún más que la TRC-P al reducir las muertes por arritmia, también conlleva riesgos específicos propios del DAI, como un fallo del cable o las descargas inapropiadas, además de los costes.
COMPANION es el único ensayo que ha aleatorizado a pacientes a TRC-M o TRC-D, aunque no era ese el propósito de su diseño, que estaba dirigido a comparar los efectos de la TRC con el TMO260. La TRC-M se asoció con una reducción marginal no significativa del riesgo de mortalidad por cualquier causa (HR = 0,76; IC95%, 0,58-1,01; p = 0,06), mientras que la TRC-D se asoció con una significativa reducción del riesgo, del 36% (HR = 0,64; IC95%, 0,48-0,86; p = 0,004). El análisis de las causas específicas de mortalidad mostró una reducción significativa de la MS asociada con TRC-D (HR=0,44, IC95%, 0,23-0,86; p = 0,02), pero no con la TRC-M (HR=1,21, IC95%, 0,7-2,07; p = 0,50)363.
Sin embargo, la extensión del estudio CARE-HF demostró que la TRC-M sola reducía el riesgo de MS el 5,6%261. En consonancia con estos hallazgos, los análisis de subgrupos de los ECA de pacientes con IC leve han concordado el encontrar una reducción de las arritmias ventriculares con la TRC364–368. Estos efectos se observaron especialmente entre los respondedores a TRC, lo que indica que la reducción del riesgo de MS está relacionada con el grado de remodelado inverso del VI asociado con la TRC.
Los metanálisis han extraído diferentes conclusiones al respecto. En el estudio de Al-Majed et al.369, el beneficio de la TRC en supervivencia se debió en gran medida a una reducción de la mortalidad relacionada con IC, pero la MS no se redujo. Lam et al.370 demostraron que la TRC-D reduce significativamente la mortalidad comparada con el tratamiento médico (odds ratio [OR]=0,57; IC95%, 0,40-0,80), pero no comparada con el DAI sin TRC (OR=0,82; IC95%, 0,57-1,18) o la TRC-M (OR=0,85; IC95%, 0,60-1,22). Sin embargo, más recientemente, un metanálisis en red de 13 ensayos aleatorizados que incluían a más de 12.000 pacientes ha encontrado que la TRC-D redujo la mortalidad total un 19% (IC95%, 1-33%, sin ajustar) comparada con la TRC-M275.
Algunos grandes estudios observacionales recientes han destacado la importancia de la etiología de la IC en la evaluación de los posibles beneficios de la TRC-D sobre la TRC-M371–373. La TRC-D se ha asociado en pacientes con miocardiopatía isquémica con una reducción significativa del riesgo de mortalidad por cualquier causa respecto a la TRC-M. Sin embargo, esta diferencia no se ha encontrado en pacientes con miocardiopatía no isquémica.
Estos hallazgos concuerdan con los del estudio DANISH, que asignó a 1.116 pacientes con IC y miocardiopatía no isquémica a un DAI primario profiláctico o atención médica374. En ambos grupos, un 58% de los pacientes también tenían TRC. El análisis de subgrupos mostró que la TRC-D no fue superior a la TRC-M en la reducción de la variable principal de mortalidad por cualquier causa (HR=0,91; IC95%, 0,64-1,29; p = 0,59) tras un seguimiento medio de 67,6 meses. Sin embargo, en un gran registro multicéntrico con más de 50.000 pacientes, la TRC-D se asoció con una mortalidad significativamente menor375. Se han encontrado unos resultados similares a partir de una cohorte reciente emparejada por puntuación de propensión: la TRC-D se asoció con una mortalidad por cualquier causa significativamente menor que con la TRC-M en pacientes con etiología isquémica y pacientes con IC no isquémica menores de 75 años376. Además, el estudio CeRtiTuDe Cohort377 mostró una mejor supervivencia en el grupo de TRC-D frente al de TRC-M, principalmente debido a una reducción de la muerte súbita no cardiaca. En un registro multicéntrico de TRC italiano, el único predictor independiente de la mortalidad fue la ausencia de DAI378. Si bien estos estudios están limitados por su diseño observacional, se espera obtener información novedosa e importante de la comparación entre TRC-D y TRC-M a partir de los resultados del ensayo clínico aleatorizado RESET-CRT (ClinicalTrials.gov identificador NCT03494933), actualmente en curso.
En conclusión, faltan resultados procedentes de ensayos prospectivos aleatorizados y los datos disponibles son insuficientes para demostrar con solidez la superioridad de la TRC-D sobre la TRC-M. Sin embargo, es importante considerar que los ensayos de TRC en IC leve incluyeron casi exclusivamente a pacientes con DAI37,40,262 y que el beneficio de supervivencia de la TRC sin DAI es incierto en este grupo de pacientes concreto. Además, los datos observacionales apuntan a beneficios en supervivencia significativos con la TRC-D sobre la TRC-M en pacientes con miocardiopatía isquémica, mientras que no se ha demostrado un beneficio claro en aquellos con miocardiopatía no isquémica.
La caracterización de la cicatriz por RMC con realce tardío puede aumentar el valor predictivo del riesgo de arritmia ventricular379,380. Cuando se discute sobre la elección entre TRC-D y TRC-M, es fundamental tener en cuenta predictores generales de efectividad del DAI, tales como la edad y las comorbilidades asociadas con riesgo de mortalidad, que compiten en importancia con la MS arrítmica. Por lo tanto, debe considerarse la adición de DAI a la TRC, especialmente para pacientes más jóvenes y con buen pronóstico de supervivencia, etiología isquémica y un perfil de comorbilidad favorable o presencia de fibrosis miocárdica (figura 10). Además, el beneficio del DAI se rige por el equilibrio entre el riesgo de MS y el riesgo de muerte por otras causas, así como por las comorbilidades. En general, la tasa de MS arrítmica en prevención primaria parece estar disminuyendo (1%/año).
Debido a la complejidad del tema y la falta de evidencia clara, es muy importante que la elección entre TRC-M y TRC-D esté guiada por un proceso de toma de decisiones compartida entre pacientes y médicos que tenga en cuenta tanto los aspectos clínicos como las preferencias del paciente.
Recomendaciones sobre añadir un desfibrilador a pacientes con terapia de resincronización cardiaca
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda el implante de TRC-D para los pacientes candidatos a DAI que tengan indicación de TRC260,369,370,381 | I | A |
| Tras una evaluación del riesgo individualizada mediante una estrategia de toma de decisiones compartida, se debe considerar el implante de TRC-D para los pacientes candidatos a TRC382,383 | IIa | B |
DAI: desfibrilador automático implantable; TRC: terapia de resincronización cardiaca; TRC-D: terapia de resincronización cardiaca con desfibrilador.
El papel de la imagen cardiaca en la selección de pacientes con IC candidatos a TRC se ha evaluado principalmente en análisis observacionales. La disincronía cardiaca384–386, la cicatriz miocárdica387,388 y el sitio de la última activación del VI en relación con la posición del cable389,390 se han asociado con la respuesta a la TRC. La FEVI es el único parámetro incluido en la guía para la selección de pacientes candidatos a TRC, y es clave para definir el tipo de IC (< 40%, IC-FEr; 40-49%, IC-FElr, y ≥ 50%, IC-FEc)242. La ecocardiografía es la técnica de imagen de primera elección para la evaluación de la FEVI. No obstante, cuando no se dispone de contraste intravenoso y la ventana acústica no permite una evaluación precisa de la FEVI, se debe considerar la RMC o la imagen nuclear242. Las imágenes de deformación (basadas en ecocardiografía o RMC) para cuantificar la función sistólica del VI han mostrado un valor pronóstico incremental en la IC y permiten evaluar la asincronía mecánica del VI384,391–393. La RMC con RTG (que muestra la presencia de tejido cicatricial miocárdico) es la que tiene mejor resolución para diferenciar la miocardiopatía isquémica de la no isquémica394. La localización (posterolateral) y la extensión (transmural frente a no transmural y porcentaje de masa del VI) de RTG en RMC o con imagen nuclear se ha correlacionado con el beneficio de la TRC380,387,395,396. La insuficiencia mitral grave397, la falta de sincronía electromecánica del VI significativa384,385,392 y la disfunción sistólica del VD398 se han asociado con una reducción en la mejoría de los síntomas clínicos y la supervivencia tras la TRC. Se han probado varias técnicas de imagen para evaluar la disincronía mecánica del VI, pero la mayoría de las medidas no se han comparado en ensayos clínicos aleatorizados que incluyan a pacientes con IC-FEr y QRS ancho399. La identificación de movimiento anormal del septo (flash septal) y bamboleo apical400, las diferencias de tiempo basadas en la deformación radial y patrones de deformación regional longitudinal384,392,401–403, el mapeo por ECG no invasivo e invasivo385,404 y las imágenes vectoriales405 son técnicas novedosas que pueden predecir la respuesta a la TRC. Además, el trabajo miocárdico del VI evaluado con ecocardiografía de rastreo de marcas (speckle-tracking) se ha correlacionado con la supervivencia de pacientes con TRC406. La venografía del seno coronario se realiza habitualmente para detectar una vena coronaria adecuada en la que desplegar un cable de VI. Los ensayos aleatorizados no han demostrado de manera sistemática que la orientación del implante de cables de VI basado en imágenes (evaluación de la cicatriz del miocardio o sitio de la última activación) sea superior a la práctica estándar389,390,407,408. La experiencia inicial en el uso de inteligencia artificial para combinar parámetros clínicos, eléctricos y de imagen que permitan definir fenotipos de pacientes que vayan a beneficiarse de la TRC es una estrategia prometedora, pero se necesitan más datos409.
La insuficiencia mitral secundaria significativa (moderada a grave y grave) es frecuente entre los candidatos a TRC y se ha demostrado que reduce la supervivencia a largo plazo y la respuesta al tratamiento406,410. La TRC puede mejorar la insuficiencia mitral hasta en un 40% de los pacientes406. Sin embargo, en el restante 60% de los casos, la insuficiencia mitral no se corrige, y en el seguimiento a largo plazo, la progresión de la enfermedad subyacente puede llevar a un mayor deterioro de la función de la válvula mitral y mal pronóstico. Los datos de los registros han demostrado que la reparación percutánea de la válvula mitral de borde a borde mejora la respuesta a la TRC411–414. Sin embargo, los resultados de los ECA recientes que han incluido a pacientes con insuficiencia mitral secundaria grave sintomática a pesar del tratamiento médico indicado en las guías (incluida TRC) no han mostrado de manera consistente un beneficio derivado de este abordaje percutáneo415,416.
En resumen, la selección de pacientes candidatos a TRC basada en imágenes se limita a la medición de la FEVI, pero la evaluación de otros factores como la extensión de la cicatriz miocárdica, la presencia de insuficiencia mitral o la función sistólica del VD es importante para identificar a los posibles no respondedores que pueden necesitan tratamiento adicional (intervención de la válvula mitral, por ejemplo).
Las alternativas a la estimulación del seno coronario convencional para TRC (epicárdica, endocárdica) se describen en el apartado 6.1 del material adicional.
7ESTRATEGIAS Y SITIOS DE ESTIMULACIÓN CARDIACA ALTERNATIVOSLos sitios alternativos de estimulación VD (a diferencia de la estimulación del AVD) incluyen la estimulación desde el tracto de salida del VD (TSVD), el septo del VD (SVD) medio y alto, la EHH, la estimulación parahisiana y la estimulación de la región de la rama izquierda, que incluye estimulación del tabique del VI y estimulación de la rama izquierda.
7.1Estimulación cardiaca septalDesde la publicación de la guía de la ESC 201333, no se han encontrado diferencias en los resultados clínicos entre la estimulación del SVD y la del AVD en el contexto del BAV417 y la TRC418, respectivamente, según los resultados de 2 ensayos aleatorizados. Se ha descrito un beneficio ecocardiográfico relacionado con la estimulación del SVD en pacientes con FEVI reducida preexistente a partir de los datos de un metanálisis419. En un estudio observacional, la estimulación del SVD se ha asociado con una disminución del riesgo de perforación420. Sin embargo, no es fácil conseguir una estimulación del SVD verdadera421 ni determinar su efectividad y, hasta la fecha, no se ha podido demostrar que tenga más efectos beneficiosos o perjudiciales que la AVD en las variables clínicas relevantes (tabla 9 del material adicional). La evidencia actual no respalda la recomendación sistemática de estimulación del SVD o el AVD para todos los pacientes.
7.2Estimulación cardiaca del haz de HisLa EHH se realizó por primera vez en humanos en el año 2000199 y está ganando interés por proporcionar una alternativa más fisiológica a la estimulación del VD. También puede corregir el retraso de la conducción intraventricular en determinados pacientes, y ofrece una alternativa a la estimulación biventricular para el tratamiento de la IC. La llegada de nuevas herramientas ha facilitado enormemente su uso en un número creciente de centros. La EHH se utiliza en lugar de la estimulación del VD y la estimulación biventricular como TRC optimizada para el haz de His (TRC-OH) 319, que aprovecha el efecto sinérgico entre la EHH y la estimulación del VD, la estimulación del VI o la estimulación biventricular para mejorar la sincronía. Cada vez hay más evidencia, principalmente de estudios observacionales, que indica que la EHH es segura y efectiva en estos contextos (tabla 10 del material adicional), aunque se requieren más ECA de gran tamaño con seguimiento a largo plazo que permitan confirmar esta evidencia422. Cuando se disponga de un mayor volumen de datos sobre su seguridad y su eficacia, es probable que la EHH tenga un papel importante en los tratamientos de estimulación del futuro.
7.2.1Implante y seguimientoLos catéteres guía para colocar los cables han facilitado los implantes, que alcanzan tasas de éxito > 80%422. En un registro internacional, el éxito ha llegado a ser del 87% después de una curva de aprendizaje de 40 casos423. La EHH selectiva se reconoce fácilmente por la presencia de un intervalo isoeléctrico (correspondiente al I-HV) entre el pico de estimulación y el inicio del QRS, mientras que con la EHH no selectiva se observa una onda «seudo-delta» debida a la captura del miocardio local424. Además, se puede constatar la corrección del BR (figura 11). Es importante distinguir la EHH no selectiva de la estimulación parahisiana (donde no hay captura de tejido de conducción) evaluando las transiciones en la morfología QRS en respuesta a maniobras de reducción o activación de la estimulación425.
En comparación con la estimulación del VD, los umbrales de captura de la EHH son, en promedio, más altos y las amplitudes de detección, más bajas. Un estudio observacional reciente plantea preocupación por el aumento de los umbrales de estimulación en la EHH tras un seguimiento intermedio426. Los umbrales de captura altos reducen la longevidad de la batería (a los 5 años se tuvo que cambiar el 9% de los generadores para la EHH, frente al 1% de la estimulación del VD)427. En el momento de implantarse, los umbrales de captura de la EHH deben ser < 2,0 V/1 ms (o < 2,5 V/0,4 ms) y la amplitud de detección de la onda R bipolar debe ser > 2,0 mV. Los umbrales disminuyen a medida que el operador adquiere más experiencia y gana confianza para reposicionar los cables. Los problemas de detección incluyen no solo la infradetección ventricular, sino también la sobredetección de potenciales auriculares o potenciales del haz de His (que pueden llegar a ser letales en un paciente que depende de un marcapasos).
Se debe considerar un cable de VD de respaldo si el operador no tiene experiencia o si hay umbrales altos de captura o problemas de detección en pacientes dependientes de marcapasos, pacientes programados para ablación del NAV (donde hay riesgo de comprometer la EHH) o pacientes con bloqueo de alto grado o infranodular. Las ventajas e inconvenientes de esta estrategia se enumeran en la tabla 9.
Ventajas y desventajas del cable ventricular «de seguridad» en la estimulación del haz de His.
| Ventajas |
|---|
| Mayor seguridad (en caso de pérdida de captura del electrodo para EHH)• Se puede usar como sensor (menor riesgo de subdetección ventricular, sin riesgo de sobredetección auricular o hisiana)• Permite una programación de estimulación con márgenes de seguridad más bajos• Puede usarse para estrechar el QRS con estimulación de fusión en caso de EHH selectiva con BRD no corregido |
| Desventajas |
| Mayor coste• Más hardware transvenoso• Riesgo asociado con el cable adicional (p. ej., perforación ventricular)• Programación más compleja• Uso fuera de las indicaciones (la aprobación por la normativa actual y la condicionalidad para la RM en la EHH solo se otorgan para cables de His conectados al puerto del VD) |
BRD: bloqueo de rama derecha; EHH: estimulación de la rama de His; RM: resonancia magnética.
Varias series han demostrado que la tasa de revisión de los cables a medio plazo es relativamente alta, aproximadamente un 7%318,423,427,428 (hasta el 11% en algunas series426) y superior a la de la estimulación del VD, que es de un 2-3%427,429. Por lo tanto, es aconsejable hacer un seguimiento de estos pacientes al menos una vez cada 6 meses o asignarles un programa de monitorización a distancia (asegurándose de que las medidas de umbral automáticas se correspondan con las medidas manuales, ya que, dependiendo de la configuración del dispositivo, puede no ser así430). La programación del dispositivo debería tener en cuenta los requisitos específicos de la EHH, que se tratan en detalle en otros documentos431,432.
7.2.2Indicaciones7.2.2.1Estimulación cardiaca en la bradicardiaUn estudio ha descrito una tasa de incidencia de miocardiopatía inducida por estimulación del VD del 12,3% en pacientes con BAV y FEVI basal normal y un aumento del riesgo si la estimulación ventricular se incrementa a ≥ 20% (HR=6,76; p=0,002)188. No obstante, no hay datos que respalden un porcentaje de estimulación del VD por debajo del cual el procedimiento sea seguro y por encima del cual sea perjudicial. Los datos observacionales indican que los pacientes que reciben EHH tienen menores tasas de hospitalización por IC que los que reciben estimulación del VD cuando el porcentaje de estimulación es > 20% (HR=0,54; p=0,01)42. Es importante señalar que la FEVI basal media de los pacientes con EHH de esa serie era del 55% y la media del QRS, 105 ms. Por lo tanto, la EHH puede evitar el deterioro clínico de esos pacientes, sobre todo cuando el QRS intrínseco es estrecho o la EHH corrige el BR.
En una serie de 100 pacientes con BAV sometidos a EHH por operadores experimentados, el implante tuvo éxito en 41/54 (76%) pacientes con BAV infranodular y superior en el caso de bloqueo ganglionar (93%; p < 0,05)433. Durante un seguimiento medio de 19±12 meses, fue necesaria la revisión del electrodo en 2/41 (5%) pacientes con bloqueo infranodular y en 3/43 (7%) con bloqueo ganglionar. Cabe destacar que la FEVI media en esa serie fue del 54%; no hay datos que se refieran específicamente a pacientes con BAV y FEVI reducida. La EHH es una opción en pacientes con QRS estrecho o si la EHH corrige el BR, pero por lo demás está indicada la estimulación biventricular.
Se requieren ECA que comparen la seguridad y la eficacia de la EHH y la estimulación del VD. Es importante sopesar los beneficios de la EHH frente a los problemas mencionados en cuanto a umbrales de captura más altos, menor duración de la batería, mayor tasa de revisión de los cables y mayor número de problemas de detección que en la estimulación del VD. También hay que tener en cuenta la experiencia y los conocimientos del operador que lleva a cabo la EHH y si está indicado un electrodo de estimulación ventricular de apoyo. La seguridad del paciente debe ser el principal factor que considerar en la toma de decisiones.
7.2.2.2Estimulación cardiaca y ablaciónSiete series observacionales, que incluyeron en total a más de 240 pacientes tratados con una estrategia de «estimulación cardiaca y ablación» para la FA de conducción rápida, han descrito una mejoría de la clase funcional de la NYHA y la FEVI respecto al valor inicial obtenido con ERH197–199,434. Los resultados clínicos a largo plazo tras un seguimiento medio de 3 años han sido buenos434. Un ensayo clínico aleatorizado, a simple ciego y transversal que comparó la EHH con la estimulación AVD en 16 pacientes durante 6 meses ha encontrado una mejoría en la clase funcional de la NYHA y la distancia caminada en la prueba de los 6 min de marcha en el grupo de EHH, sin diferencias en los parámetros ecocardiográficos200. No obstante, solo 4 pacientes habían confirmado EHH (con estimulación parahisiana en el resto de pacientes). Estos estudios han incluido a pacientes con FEVI reducida y conservada197,198 y una duración media del QRS < 120 ms. La EHH es de particular interés en pacientes con morfología QRS basal normal, ya que esta estrategia mantiene la sincronía ventricular intrínseca. Sin embargo, hay que tener en cuenta que la ablación de la UAV puede aumentar los umbrales de captura en la EHH o desplazar el electrodo en algunos casos97,199,318,426. Debido a estos problemas y al riesgo de fallo del electrodo de EHH, se debe considerar un cable de VD de apoyo.
7.2.2.3Papel en la terapia de resincronización cardiacaEn 1977, Narula demostró que la estimulación del haz de His puede corregir el BRI en un subgrupo de pacientes, lo que implica que la anomalía de la conducción está localizada en un sitio proximal y tiene disociación longitudinal dentro del haz de His435. Un reciente estudio de mapeo ha descrito la existencia de bloqueo intrahisiano en un 46% de los pacientes con BRI, que se corrigió con EHH temporal en un 94% de los casos436. Por lo tanto, la EHH puede utilizarse en lugar de la estimulación biventricular para la TRC basada en EHH, ya que algunos datos han demostrado un beneficio comparable (véase la tabla 10 del material adicional)437–439. No obstante, la evidencia de eficacia y seguridad de la estimulación biventricular es más sólida, especialmente en candidatos a TRC con BRI, por lo que sigue siendo la estrategia de primera línea. La EHH debe considerarse como una solución de rescate en caso de un implante fallido del cable del VI junto con otras opciones, como los cables epicárdicos quirúrgicos424,440 (véase el apartado 6.7). Una población interesante para este abordaje son los pacientes con BRD; estos pacientes responden peor a la estimulación biventricular y la EHH ha mostrado resultados preliminares prometedores en una serie de 37 casos441. En ocasiones, la EHH puede corregir de manera incompleta el BR y puede usarse junto con estimulación del VD, del VI o biventricular, como en el estudio HOT-CRT319. Esta estrategia es particularmente interesante en los pacientes con FA permanente, pues el electrodo hisiano se puede conectar al puerto auricular vacante, lo que ofrece otras opciones terapéuticas.
7.3Estimulación cardiaca en la región de la rama izquierdaCon la estimulación de la región de la rama izquierda, el cable se implanta ligeramente distal al haz de His y se atornilla profundamente en el tabique del VI, idealmente para capturar la rama izquierda442. Las ventajas de esta técnica son que los parámetros eléctricos suelen ser excelentes y que puede tener éxito en casos de bloqueo demasiado distal para EHH. Además, facilita la ablación de la UAV, que puede ser muy difícil con la EHH. Sin embargo, aunque la técnica es muy prometedora, los datos sobre esta modalidad son escasos (tabla 11 del material adicional) y no se sabe cuál es el rendimiento del electrodo a largo plazo y la viabilidad de la maniobra de extracción. Por lo tanto, no se pueden formular recomendaciones para la estimulación de la región de la rama izquierda en este momento. Sin embargo, es muy probable que la estimulación del sistema de conducción (que incluye la EHH y la estimulación de la región de la rama izquierda) desempeñe un papel cada vez más importante en el futuro y deban revisarse las recomendaciones actuales cuando se publique evidencia más firme sobre su seguridad y su eficacia. En la tabla 12 del material adicional se muestra una comparación entre estimulación del VD, EHH y estimulación de la región de la rama izquierda.
Recomendaciones sobre la estimulación del haz de His
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para los pacientes tratados con EHH, se recomienda una programación del dispositivo adaptada a los requisitos específicos de la EHH430,431 | I | C |
| Para los pacientes candidatos a TRC con un implante insatisfactorio del cable del seno coronario, se debe considerar la EHH como una opción terapéutica junto con otras técnicas, como el cable epicárdico quirúrgico318,424,440,443 | IIa | B |
| Para los pacientes tratados con EHH, se debe considerar el implante de un cable de estimulación del VD «de seguridad» en situaciones específicas (p. ej., dependencia de marcapasos, BAV de alto grado, bloqueo infranodular, umbral de estimulación alto, ablación de la UAV programada) o como sensor en caso de problemas de detección (p. ej., riesgo de subdetección ventricular o sobredetección de potenciales auriculares/hisianos)423,426,444 | IIa | C |
| Se puede considerar la EHH con cable ventricular de seguridad para los pacientes que tienen indicada una estrategia de «estimulación y ablación» para la arritmia supraventricular de conducción rápida, particularmente cuando el QRS intrínseco sea estrecho197,199,200,318 | IIb | C |
| Para los pacientes con BAV, FEVI > 40% y una estimulación ventricular prevista > 20%, se puede considerar la EHH como alternativa a la estimulación del VD42,433 | IIb | C |
BAV: bloqueo auriculoventricular; EHH: estimulación de la rama de His; FEVI: fracción de eyección del ventrículo izquierdo; TRC: terapia de resincronización cardiaca; UAV: unión auriculoventricular; VD: ventrículo derecho.
Los marcapasos sin cables se han desarrollado para abordar las limitaciones típicamente relacionadas con el bolsillo generador de impulsos y los cables transvenosos de los sistemas de convencionales. Hasta ahora se han estudiado en ensayos clínicos 2 sistemas de marcapasos sin cables, uno de ellos ya disponible. Ambos se insertan en la cavidad del VD mediante un abordaje venoso femoral utilizando un sistema de colocación con un catéter diseñado especialmente para este fin.
Varios registros prospectivos han descrito unas tasas de éxito de implante elevadas, con buenos resultados eléctricos tanto en el momento de su colocación como durante el seguimiento (tabla 13 del material adicional). Los resultados en la práctica clínica de 1.817 pacientes portadores de marcapasos sin cables indican una tasa de eventos adversos graves del 2,7%50. La prevalencia de infecciones del dispositivo sin cables es baja, pues carece de la principal fuente de infecciones (es decir, el bolsillo quirúrgico subdérmico). Sin embargo, en el periodo inicial de experiencia del operador, hubo una mayor incidencia de complicaciones mayores perioperatorias (6,5%), como perforación y taponamiento, complicaciones vasculares, arritmias ventriculares y muerte445. Estos datos ponen de manifiesto la importancia que tiene la adecuada supervisión en las fases iniciales del aprendizaje. Además, los operadores deben tener la misma acreditación que la requerida para la estimulación transvenosa estándar a fin de ofrecer el sistema más adecuado en cada caso particular. El implante de un marcapasos sin cables debe realizarse en un entorno adecuado (es decir, con fluoroscopia multiplano de alta resolución) y con disponibilidad de cirugía cardiaca por el riesgo de taponamiento, que puede ser más difícil de manejar que con el marcapasos estándar446,447.
Los marcapasos sin cables solo funcionan en el modo VVI (R), lo que restringe sus indicaciones a pacientes con FA o estimulaciones muy poco frecuentes (p. ej., BAV paroxístico). Recientemente, se ha introducido la estimulación VDD (mediante la detección de la contracción auricular por acelerómetro), que amplía las indicaciones a pacientes con BAV y función del nódulo sinusal conservada. La sincronía AV se mantiene entre el 70 y el 90% del tiempo, según la posición y la actividad del paciente, según los datos de 2 estudios que han incluido a 73 pacientes en RS con BAV de alto grado448. En el futuro puede ser una alternativa a los marcapasos bicamerales estándar para pacientes seleccionados cuando los beneficios potenciales de la estimulación sin cables superen a los beneficios de la sincronía AV 100%, la estimulación auricular y la monitorización de la arritmia auricular.
Las indicaciones para marcapasos sin cables son, entre otras, la obstrucción de la vía venosa utilizada para implantar un marcapasos estándar (p. ej., síndrome de salida torácica venosa bilateral u obstrucción crónica de la vena cava superior), problemas de bolsillo (en el caso de caquexia o demencia) o riesgo aumentado de infección (como en caso de diálisis o infección previa de un dispositivo cardiovascular implantable). Los datos observacionales han demostrado que el marcapasos sin cables puede ser una alternativa de estimulación segura para pacientes con infección previa del dispositivo y explante y pacientes en hemodiálisis crónica. Si bien los datos observacionales indican una alta eficacia y tasas bajas de complicaciones con los marcapasos sin cables50, no se dispone de datos procedentes de ECA que documenten su seguridad y su eficacia a largo plazo, por lo que su indicación debe ser individualizada y cuidadosa. Asimismo, la ausencia de datos a largo plazo sobre su rendimiento y las maniobras de extracción449 exigen prudencia a la hora de indicar un marcapasos sin cables, especialmente para los pacientes más jóvenes (con esperanza de vida > 20 años).
Recomendaciones sobre la estimulación sin cables (marcapasos sin cables)
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se debe considerar el marcapasos sin cables como alternativa a los marcapasos transvenosos cuando no exista acceso venoso en la extremidad superior o cuando el riesgo de infección del bolsillo del dispositivo sea particularmente alto, como en pacientes con infección previa y pacientes en hemodiálisis45,47–50,450 | IIa | B |
| Los marcapasos sin cables pueden ser una alternativa a la estimulación ventricular estándar de un solo cable, teniendo en cuenta la esperanza de vida y una estrategia de toma de decisiones compartida45,47–50 | IIb | C |
En pacientes con infarto agudo de miocardio, puede haber bradiarritmia significativa debido a influencias autonómicas o daño del sistema de conducción producido por la isquemia o la reperfusión. La coronaria derecha irriga el nódulo sinusal del 60% de los pacientes y el NAV y el haz de His del 90%451,452. El BAV se localiza por encima del haz de His en la mayoría de los pacientes con infarto inferior, pero suele ser infrahisiano y está precedido por alteraciones de la conducción intraventricular en el infarto anterior451,453–457.
La incidencia de BAV de alto grado en pacientes con IM con elevación del segmento ST ha disminuido a un 3-4% en la era de la intervención coronaria percutánea (ICP) primaria458–460. El BAV de alto grado es más frecuente en los infartos inferiores o inferolaterales455,458–461.
Los pacientes con BAV de alto grado tienen mayor riesgo clínico e infartos más grandes, especialmente cuando el BAV aparece en el infarto anterior458–460,462,463. La alteración de la conducción intraventricular de nueva aparición también se asocia con infartos más grandes464–467.
La bradicardia sinusal y el BAV pueden estar mediados por vía vagal y responder a la atropina455,468. Se recomienda la revascularización de los pacientes con BAV que aún no han recibido tratamiento de reperfusión469. El BAV puede requerir estimulación temporal cuando haya síntomas refractarios o deterioro hemodinámico, aunque suele resolverse espontáneamente en pocos días y solo una minoría de pacientes requieren estimulación permanente451,454,456,458,462. No hay evidencia de que la estimulación cardiaca permanente mejore el resultado clínico de los pacientes con anomalías persistentes de la conducción intraventricular y BAV transitorio a los que se recomendó estimulación permanente en el pasado454,470. Estos pacientes suelen tener IC y mala función del VI, y deben ser evaluados para DAI, TRC-P o TRC-D en lugar de marcapasos convencional si se considera un implante precoz del dispositivo471.
Si el BAV no se resuelve en 10 días, se debe implantar un marcapasos permanente. En ausencia de datos científicos sólidos, el periodo de espera antes del implante debe decidirse caso por caso. Puede durar hasta 10 días o acortarse a 5 días según el vaso ocluido, la demora y el éxito de la revascularización. Las condiciones que permiten considerar un implante precoz del marcapasos son la revascularización tardía o fallida, el IM anterior, la presencia de bloqueo bifascicular o BAV antes del IM y la progresión del BAV en los primeros días después del IM. El síndrome del seno enfermo después de la oclusión de la coronaria derecha suele resolverse en la mayoría de los casos. Si la revascularización es incompleta, se puede posponer el implante del marcapasos, excepto cuando haya síntomas pesistentes debidos a la bradicardia sinusal.
Recomendaciones sobre la estimulación cardiaca tras el infarto agudo de miocardio
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Las recomendaciones para implante de marcapasos permanente son las mismas que para la población general (apartado 5.2) cuando el BAV no se haya resuelto tras una espera de al menos 5 días tras el IM | I | C |
| Se puede considerar el implante precoz del dispositivo (TRC-D/TRC-M) para subgrupos de pacientes con BAV en el contexto de un IM de la pared anterior e IC aguda seleccionados471 | IIb | C |
| No se recomienda la estimulación cardiaca si el BAV se resuelve después de la revascularización o espontáneamente454–456,458 | III | B |
BAV: bloqueo auriculoventricular; IM: infarto de miocardio; TRC-D: terapia de resincronización cardiaca con desfibrilador; TRC-M: terapia de resincronización cardiaca con marcapasos.
Puede producirse BAV en un 1-4% de los casos tras cirugía cardiaca y aproximadamente un 8% tras repetir una cirugía valvular472–476. La DNS puede aparecer después de una auriculotomía lateral derecha o un abordaje transeptal superior de la válvula mitral473,474.
El implante de un marcapasos es más frecuente tras cirugía valvular que tras cirugía de revascularización coronaria (CABG)477. En la práctica clínica, se suele dejar un periodo de observación de 3-7 días antes de colocar un marcapasos permanente473 para permitir la regresión de las bradicardias transitorias. El momento ideal para implantar un marcapasos tras la cirugía cardiaca sigue siendo un tema controvertido, ya que un 60-70% de los pacientes con implante por DNS y hasta un 25% de los implantes por BAV no son dependientes de marcapasos en el seguimiento473,478. Se puede considerar un implante precoz de marcapasos en el BAV completo que ocurre en las primeras 24 h tras la cirugía valvular y persiste 48 h, ya que es poco probable que se resuelva en las siguientes 1-2 semanas479,480. Esta misma estrategia parece razonable para el BAV completo con un ritmo de escape bajo473. La situación puede ser diferente en el contexto de la cirugía por CC y en los niños (váse el apartado 8.4).
En la endocarditis valvular, los factores predictores de BAV después de la cirugía son las anomalías de la conducción preoperatorias, la infección por Staphylococcus aureus, el absceso intracardiaco, la afección de la válvula tricúspide y la cirugía valvular previa481. Es razonable el implante precoz de marcapasos en los pacientes con endocarditis y BAV perioperatorios, sobre todo cuando haya uno o más factores predictores de BAV. Según el estado de infección del paciente, se puede considerar implantar un sistema de marcapasos epicárdico durante la cirugía valvular, aunque no se dispone de datos que comparen las tasas de infección de los marcapasos epicárdicos con los transvenosos.
8.2.2Estimulación cardiaca después de trasplante de corazónLa DNS es habitual después del trasplante de corazón y para un 8% de los pacientes conduce a implante de marcapasos permanente473. Las causas de DNS incluyen traumatismo quirúrgico, daño de la arteria del nódulo sinusal y largo tiempo de isquemia cardiaca482,483. El BAV es menos frecuente y posiblemente está relacionado con la inadecuada conservación del corazón del donante473,483,484. Siempre hay incompetencia cronotrópica después de un trasplante de corazón ortotópico estándar, debido a la pérdida del control autonómico. Como la función del nódulo sinusal y el NAV mejoran durante las primeras semanas después del trasplante, es aconsejable dejar un periodo de observación antes del implante del marcapasos para permitir una mejoría espontánea de la bradicardia485. Hay consenso generalizado en que los pacientes cuya bradicardia sintomática persiste tra la tercera semana posoperatoria pueden requerir el implante de un marcapasos permanente. Se recomienda el modo de EAVB (R) con estimulación ventricular minimizada si la conducción del NAV está intacta483.
8.2.3Estimulación cardiaca después de cirugía de válvula tricúspideUn aspecto que suele subestimarse en la cirugía de la válvula tricúspide es el manejo del marcapasos transtricúspideo o los cables del DAI. Dichos cables pueden interferir con la función de una válvula tricúspide reparada o una prótesis valvular.
La colocación de un electrodo de VD epicárdico en el momento de la cirugía de la válvula tricúspide es la alternativa más sencilla en los casos de BAV de segundo o tercer grado tipo II. A pesar de las dudas que ha suscitado, los datos recientes indican que los cables epicárdicos de VI tienen un rendimiento comparable al de los cables transvenosos486.
La estimulación ventricular después de la sustitución mecánica de la válvula tricúspide mediante un cable del seno coronario es un procedimiento seguro y factible, aunque solo se han publicado los resultados de pequeñas cohortes de pacientes. Se ha descrito un 100% de éxito del procedimiento en una serie de 23 pacientes; tras 5,3±2,8 años de seguimiento, el 96% de los cables seguían siendo funcionales y mostraban parámetros de estimulación y detección estables487.
La EHH está emergiendo como un método más fisiológico de estimulación ventricular y puede llegar a ser una solución en pacientes con enfermedad de conducción AV después de la cirugía de la válvula tricúspide. Un estudio de 30 pacientes con EHH tras la cirugía valvular ha descrito que la EHH pemanente tuvo éxito en el 93% de los casos488. Este estudio incluyó a 10 pacientes con anuloplastia de la válvula tricúspide.
Está contraindicado colocar un cable transvalvular después de la cirugía de reemplazo; en estos casos, se recomienda implantar un cable de seno coronario para estimulación ventricular o cables epicárdicos, que pueden colocarse de forma mínimamente invasiva. No se deben implantar cables transvalvulares en pacientes que necesitan estimulación ventricular después de la cirugía valvular porque podrían dañar la válvula tricúspide reparada o la bioprótesis. La mejor opción es implantar un cable sinusal coronario o cables epicárdicos colocados de forma mínimamente invasiva. No obstante, se puede considerar el implante de cables transvalvulares en pacientes seleccionados que han sido sometidos a anuloplastia tricuspídea, otros tipos de reparación y cirugía de sustitución por bioprótesis, tal como se desprende de algunos estudios observacionales que han mostrado resultados aceptables489.
Para llevar a cabo la sustitución de la válvula tricúspide en un paciente con un cable de VD, es preferible extraer el cable de VD antiguo e implantar un cable de VD epicárdico a coser el cable existente entre la bioprótesis y el anillo, ya que esta maniobra se asocia con mayor riesgo de fallo del cable y, si en el futuro se necesita extraerlo, puede requerir cirugía a corazón abierto, que sería una reintervención con riesgo quirúrgico aumentado. En los casos de reparación de la válvula tricúspide con un anillo de anuloplastia contemporáneo con un segmento abierto, se puede dejar el cable de VD existente en su lugar sin coserlo. Sin embargo, incluso en procedimientos de anuloplastia aislada, lo ideal es retirar el cable de VD existente para evitar futuras complicaciones e implantar un cable de VD epicárdico. El uso de un marcapasos sin cables para la estimulación ventricular puede ser una alternativa factible después de un procedimiento quirúrgico de reparación/sustitución valvular, sobre todo en pacientes que no necesiten estimulación bicameral. Sin embargo, hay muy poca experiencia sobre ello y no se dispone de datos a largo plazo. Está contraindicado atravesar una válvula tricúspide mecánica con la guía y el marcapasos.
Recomendaciones sobre estimulación cardiaca tras cirugía cardiaca y trasplante de corazón
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| 1. BAV de alto grado o completo tras cirugía cardiaca. Está indicado un periodo de observación clínica de al menos 5 días para evaluar si la alteración del ritmo es transitoria y se resuelve espontáneamente. No obstante, en caso de BAV completo con ritmo de escape bajo o nulo, el periodo de observación puede acortarse si la resolución espontánea es poco probable473,478 | I | C |
| 2. Cirugía por endocarditis valvular y BAV completo intraoperatorio. Se debe considerar el implante inmediato de un marcapasos epicárdico para los pacientes sometidos a cirugía por endocarditis valvular y BAV completo si está presente uno de los siguientes predictores de persistencia: anomalía de la conducción preoperatoria, infección por Staphylococcus aureus, absceso intracardiaco, afección de la válvula tricúspide o cirugía valvular previa481 | IIa | C |
| 3. DNS tras cirugía cardiaca o trasplante de corazón. Antes de implantar un marcapasos permanente, se debe considerar un periodo de observación de hasta 6 semanas473 | IIa | C |
| 4. Incompetencia cronotrópica después de trasplante de corazón. Se debe considerar la estimulación cardiaca en caso de incompetencia cronotrópica que persista más de 6 semanas tras un trasplante cardiaco para mejorar la calidad de vida485 | IIa | C |
| 5. Pacientes que requieren estimulación en el momento de la cirugía de la válvula tricúspide. Se debe evitar los cables transvalvulares y utilizar cables ventriculares epicárdicos. Durante la cirugía de la válvula tricúspide, se debe considerar la extracción de los cables transvalvulares preexistentes en lugar de coser el cable entre el anillo y la bioprótesis. En caso de anuloplastia tricuspídea aislada y tras valorar el riesgo-beneficio del caso, se puede dejar en su sitio el cable del VD preexistente sin encerrarlo entre el anillo y el annulus. | IIa | C |
| 6. Pacientes que requieren estimulación después de sustitución de la válvula tricúspide biológica/reparación del anillo. Se debe considerar el implante transvenoso de un cable del seno coronario o la colocación mínimamente invasiva de un cable ventricular epicárdico cuando esté indicada la estimulación ventricular, con preferencia al abordaje transvenoso transvalvular 487 | IIa | C |
| 7. Pacientes que requieren estimulación tras la sustitución mecánica de la válvula tricúspide. Debe evitarse el implante de un cable de VD transvalvular. | III | C |
BAV: bloqueo auriculoventricular; DNS: disfunción del nódulo sinusal; VD: ventrículo derecho.
Para información más detallada sobre pacientes con BRD antes del procedimiento y BRI después, véanse los apartados 8.3.1 y 8.3.2 del material adicional.
Las tasas de implante de marcapasos permanente tras el TAVI oscilan entre del 3,4 al 25,9% en ensayos aleatorizados y grandes registros490–502. El efecto de la estimulación después del TAVI en el resultado clínico no está claro503–509; además, es conocido que la estimulación del VD puede llevar a un deterioro de la función del VI183,510,511. Por lo tanto, está justificado minimizar la estimulación permanente innecesaria.
Los predictores de estimulación permanente (tabla 10, tabla 14 del material adicional), especialmente el BRD, que se ha identificado como el predictor más firme e importante de implante de un marcapasos permanente, deben incorporarse a la planificación del TAVI, incluida la selección del tipo de válvula, la altura del implante y el inflado del balón.
Los pacientes con enfermedad del sistema de conducción preexistente y avanzada que puedan tener una indicación de marcapasos permanente, aparte del procedimiento TAVI, deben consultar con un electrofisiólogo antes de la intervención. Actualmente no hay pruebas que respalden el implante de marcapasos permanente como medida «profiláctica» previa al TAVI en pacientes asintomáticos o que no cumplan las indicaciones estándar para implante de marcapasos.
En la figura 12 se muestra el abordaje recomendado para el tratamiento de las anomalías de la conducción después del TAVI. Los pacientes sin nuevas alteraciones de la conducción después del TAVI tienen un riesgo muy bajo de sufrir BAV de alto grado533–535. Por el contrario, el tratamiento de pacientes con BAV de altro grado o completo debe seguir las pautas estándar. El implante de marcapasos permanente está justificado en pacientes con BAV que aparece durante el procedimiento y persiste 24-48 h después del TAVI o que aparece más tarde. Hay pocos datos disponibles sobre el tratamiento de pacientes con otras anomalías de la conducción al inicio o después del procedimiento.
Dada la estrecha proximidad anatómica de la válvula aórtica y la rama izquierda, la anomalía de conducción más frecuente después del TAVI es el BRI de nueva aparición504,536–538. Solo una minoría de estos pacientes van a requerir marcapasos536,537. Por lo tanto, se puede considerar el EEF539–541 o la monitorización a largo plazo536 en lugar del implante de marcapasos542,543 (véase el apartado 8 del material adicional). Se han identificado varios subgrupos de pacientes en alto riesgo con BRI de nueva aparición (figura 12 y apartado 8 del material adicional). En estos pacientes con progresión dinámica de las anomalías de la conducción después del TAVI (BRI nuevo con prolongación dinámica del QRS o el PR), se debe considerar un periodo de seguimiento en el hospital prolongado hasta 5 días. En cambio, es posible que los pacientes con BRI de nueva aparición pero con QRS < 150 ms no requieran una evaluación adicional durante la hospitalización. Cuando se considera un posible EEF, debe llevarse a cabo al menos 3 días después del procedimiento y tras la estabilización de las anomalías de la conducción.
El tipo de marcapasos permanente implantado debe seguir las pautas estándar (véase los apartados 5, 6 y 7). Debido a las bajas tasas de dependencia de marcapasos a largo plazo544,545, deben usarse algoritmos que promuevan la conducción AV espontánea.
Recomendaciones sobre la estimulación cardiaca tras el implantación percutáneo de válvula aórtica
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda la estimulación permanente para los pacientes con BAV completo o de alto grado que persista 24-48 h después del TAVI546 | I | B |
| Se recomienda la estimulación permanente para los pacientes con BR alternante de nueva aparición después del TAVI533,547 | I | C |
| Se debe considerar la estimulación permanente precozc para los pacientes con BRD preexistente que desarrollen cualquier otra anomalía de la conducción durante o después del TAVId | IIa | B |
| Se debe considerar la monitorización con ECG ambulatorioe o EEFf para los pacientes con BRI nuevo y QRS > 150 ms o PR > 240 ms sin mayor prolongación más de 48 h después del TAVI536,537,548 | IIa | C |
| Se puede considerar la monitorización con ECG ambulatorioe o EEFf para los pacientes con anomalías de la conducción preexistentes que después muestren prolongación del QRS o PR > 20 msg | IIb | C |
| Para los pacientes con BRD que no tengan indicación de marcapasos permanente, no está indicado el implante profiláctico de marcapasos permanente antes del TAVI | III | C |
BAV: bloqueo auriculoventricular; BR: bloqueo de rama; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; ECG: electrocardiograma; EEF: estudio electrofisiológico; FA: fibrilación auricular; TRC: terapia de resincronización cardiaca; I-HV: intervalo His-ventrículo; RS: ritmo sinusal; TAVI: implante percutáneo de válvula aórtica.
dBAV transitorio de alto grado, prolongación del intervalo PR, cambio del eje en el QRS.
eMonitorización continua con ECG ambulatorio (implantable o externo) durante 7-30 días536,549.
fEl EEF debe realizarse a partir del tercer día después del TAVI. Un retraso de la conducción con I-HV ≥ 70 ms puede considerarse positivo para estimulación permanente540,541,550.gSin mayor prolongación del QRS o el PR durante 48 h de observación.
Las indicaciones de TRC para pacientes que requieren estimulación después del TAVI son las mismas que para los pacientes en general (véase el apartado 6).
Para la definición de BR alternante, véase el apartado 5.3.1.
8.4Estimulación cardiaca y terapia de resincronización cardiaca en la cardiopatía congénitaLa estimulación permanente en pacientes con CC moderada o compleja debe hacerse en centros que cuenten con un equipo multidisciplinario y experiencia en el tratamiento de CC con dispositivos. Generalmente, la toma de decisiones para el tratamiento con marcapasos de pacientes con CC se basa en el consenso de expertos y la evaluación individual, ya que no hay suficiente evidencia de ECA. En presencia de una comunicación intracardiaca entre la circulación sistémica y la pulmonar, la colocación de cables endovasculares está relativamente contraindicada por el riesgo de embolia arterial551.
La presentación clínica puede variar considerablemente; incluso la bradicardia grave en el BAV congénito puede permanecer oligosintomática o asintomática. Los registros Holter periódicos pueden ser útiles para pacientes con riesgo específico de bradiarritmia.
8.4.1Disfunción del nódulo sinusal y síndrome de bradicardia-taquicardiaNo hay evidencia de que la DNS produzca un aumento de la mortalidad en las CC. Sin embargo, puede asociarse con una mayor tasa de flutter auricular posoperatorio, conducción AV 1:1 en las CC y, por lo tanto, aumento de la morbilidad e incluso de la mortalidad552,553.
8.4.1.1Indicaciones de implante de marcapasosEstá justificado implantar un marcapasos en pacientes con incompetencia cronotrópica sintomática cuando se hayan descartado otras causas (véase el apartado 4)554,555. Puede considerarse el aumento de la frecuencia cardiaca mediante estimulación permanente para prevenir arritmias auriculares556. La evidencia existente es pobre, debido a que el beneficio de la estimulación auricular observada en los pacientes sin cardiopatía estructural no se ha podido validar en la CC21,557,558. El consenso generalizado es que, si la estimulación permanente es necesaria, se prefiere un abordaje auricular de un solo cable para disminuir el número de cables, sobre todo en pacientes jóvenes con conducción AV adecuada559. En los casos de transposición de las grandes arterias corregida congénitamente que requieran estimulación ventricular por BAV de alto grado, se debe considerar la TRC. No es posible hacer recomendaciones generales sobre los dispositivos con estimulación auricular antitaquicárdica para el tratamiento de las taquicardias de reentrada intraauricular en pacientes con CC560,561 debido a la escasa evidencia disponible.
8.4.2Bloqueo auriculoventricular congénitoDiversos factores maternos o fetales pueden causar bloqueo cardiaco congénito, en particular algunas enfermedades autoinmunitarias como el lupus eritematoso sistémico y el síndrome de Sjögren (tabla 16 del material adicional).
Los pacientes con BAV congénito pueden estar asintomáticos o presentar una reducción de la capacidad de esfuerzo, eventos sincopales, IC congestiva, disfunción ventricular y dilatación. En raras ocasiones, el BAV congénito se diagnostica como causa de MS562,563. La MS puede ocurrir por la mayor propensión a las arritmias ventriculares relacionadas con la bradicardia, como torsades-de-pointes.
8.4.2.1Indicaciones de implante de marcapasosHay consenso generalizado en que la estimulación profiláctica está indicada para los pacientes asintomáticos con cualquiera de los siguientes factores de riesgo: frecuencia cardiaca media diurna < 50 lpm, pausas > 3 veces la duración del ciclo del ritmo de escape ventricular, ritmo de escape con QRS ancho, intervalo QT prolongado o ectopia ventricular compleja564–566. Los síntomas clínicos como síncope, presíncope, IC o incompetencia cronotrópica son indicaciones de implante de marcapasos564,567,568. Si la disfunción ventricular se atribuye al deterioro hemodinámico causado por la bradicardia, puede estar indicada la estimulación permanente518,567. A pesar de la discreta calidad de la evidencia, hay consenso firme en que los pacientes con BAV de segundo o tercer grado (Mobitz II) deben recibir tratamiento de estimulación permanente si presentan síntomas o factores de riesgo. Para los pacientes asintomáticos sin factores de riesgo, se puede considerar la estimulación permanente, pero las opiniones sobre el beneficio de la estimulación cardiaca son más divergentes567,569.
8.4.3Bloqueo auriculoventricular posoperatorioSe calcula que un 1-3% de los pacientes sometidos a cirugía por CC contrae un BAV posoperatorio de alto grado518,569,570. En niños, el BAV posoperatorio temprano y transitorio se resuelve por lo general en 7-10 días571. El periodo de espera antes de tomar la decisión de implantar estimulación permanente en el posoperatorio de adultos con CC es el mismo que para otra cirugía cardiaca, a falta de datos que respalden otro plazo. En algunas ocasiones, puede persistir bloqueo bifascicular después de la recuperación de un BAV completo, lo que se asocia con mayor riesgo de BAV tardío recurrente y MS572. El pronóstico es malo para los pacientes con BAV completo posoperatorio no tratado573.
8.4.3.1Indicaciones de implante de marcapasosSe recomienda encarecidamente la estimulación cardiaca permanente para los pacientes con BAV persistente de segundo o tercer grado. Hay menos consenso en implantar un marcapasos en los casos de bloqueo bifascicular persistente asociado con BAV transitorio o intervalo PR prolongado permanentemente. La determinación del I-HV posoperatorio puede ayudar a calcular el riesgo de los pacientes con intervalo PR prolongado o bloqueo bifascicular573. El riesgo de daño extenso del sistema de conducción en pacientes con bloqueo bifascicular y PR prolongado tras la cirugía por CC está aumentado572, por lo que el implante de un marcapasos puede estar indicado incluso sin la determinación del I-HV. Para reducir la tasa de reoperaciones, se debe considerar el implante de cables epicárdicos durante la cirugía en pacientes con CC compleja y riesgo alto de marcapasos permanente.
Recomendaciones sobre la estimulación cardiaca para pacientes con cardiopatía congénita
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para los pacientes con BAV congénito completo o de alto grado, se recomienda la estimulación cardiaca si presentan uno de los siguientes factores de riesgo:a. Síntomasb. Pausas>3 veces la duración del ciclo del ritmo de escape ventricularc. Ritmo de escape con QRS anchod. Intervalo QT prolongadoe. Ectopia ventricular complejaf. Frecuencia cardiaca media diurna<50 lpm | I | C |
| Para los pacientes con BAV congénito completo o de alto grado, se puede considerar la estimulación permanente incluso cuando no haya factores de riesgo566 | IIb | C |
| Para lso pacientes con bloqueo bifascicular posoperatorio persistente asociado con BAV completo transitorio, se puede considerar la estimulación permanente572 | IIb | C |
| Para los pacientes con CC compleja y bradicardia asintomática (frecuencia cardiaca en reposo vigil < 40 lpm o pausas > 3 s), se puede considerar la estimulación permanente de forma individualizada | IIb | C |
BAV: bloqueo auriculoventricular; BR: bloqueo de rama; CC: cardiopatía congénita; ECG: electrocardiograma.
Se pueden considerar las indicaciones estándar de TRC en las CC, teniendo en cuenta que la anatomía, la morfología del ventrículo sistémico, la causa de la disincronía y la morfología del QRS pueden ser atípicas574. La toma de decisiones debe estar a cargo de equipos multidisciplinarios en centros experimentados.
8.5Estimulación cardiaca en la miocardiopatía hipertrófica8.5.1BradiarritmiaEn general, el BAV en la miocardiopatía hipertrófica (MCH) debe tratarse de acuerdo con las recomendaciones de esta guía (véase el apartado 5.2). Ciertos subtipos de MCH heredados genéticamente son más propensos al BAV, como la amiloidosis por transtirretina, las enfermedades de Anderson-Fabry y Danon, el síndrome PRKAG2 y las citopatías mitocondriales575,576. Se puede considerar DAI/TRC-D en lugar de un marcapasos para los pacientes con bradicardia sintomática y FEVI ≤ 35% o que cumplan los criterios de prevención primaria de la MS según la guía vigente576 (para más información sobre los trastornos de la conducción en la MCH, véase el apartado 8.5 del material adicional).
8.5.2Estimulación cardiaca en la obstrucción del tracto de salida del ventrículo izquierdoLas opciones de tratamiento para los pacientes con síntomas causados por obstrucción del tracto de salida del VI incluyen fármacos, cirugía, ablación septal con alcohol y estimulación AV secuencial con retraso AV corto. Tres pequeños ECA con placebo y varios estudios observacionales a largo plazo han descrito reducciones en los gradientes del tracto de salida del VI y una mejoría variable de los síntomas y la calidad de vida asociados con la estimulación AV secuencial577–582. La miectomía ha logrado resultados hemodinámicos superiores en comparación con la EAVB583, pero es una intervención más invasiva y de mayor riesgo. En un ensayo, el análisis de subgrupos indica que los pacientes mayores (más de 65 años) tienen más probabilidades de beneficiarse de la EAVB secuencial579. Un metanálisis reciente, que comprende 34 estudios y 1.135 pacientes, ha encontrado que la estimulación disminuye un 35% el gradiente del flujo de salida del VI, con una tendencia no significativa a empeoramiento de la clase funcional de la NYHA584.
La elección del tratamiento para pacientes con MCH obstructiva debe ser compartida.
Recomendaciones sobre estimulación cardiaca en la miocardiopatía hipertrófica obstructiva
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se puede considerar la estimulación AV secuencial con retraso AV corto para pacientes en RS que tengan otras indicaciones de estimulación o DAI cuando haya síntomas refractarios al tratamiento farmacológico o gradiente del TSVI basal o provocado ≥ 50 mmHg576–581,584 | IIb | B |
| Se puede considerar la estimulación AV secuencial con retraso AV corto para adultos seleccionados con síntomas refractarios al tratamiento farmacológico y gradiente del TSVI basal o provocado ≥ 50 mmHg, en RS, que no sean aptos o no deseen someterse a otros tratamientos invasivos de reducción del septo576–581,584 | IIb | B |
| Se puede considerar la estimulación AV secuencial con retraso AV corto para pacientes seleccionados con síntomas refractarios al tratamiento farmacológico y gradiente del TSVI basal o provocado ≥ 50 mmHg, en RS, que tengan riesgo alto de desarrollar BAV durante la ablación septal585,586 | IIb | C |
AV: auriculoventricular; BAV: bloqueo auriculoventricular; DAI: desfibrilador automático implantable; RS: ritmo sinusal; TSVI: tracto de salida del ventrículo izquierdo; VI: ventrículo izquierdo.
Los parámetros de estimulación deben optimizarse para lograr la máxima preexcitación del vértice del VD con mínimo deterioro del llenado del VI (generalmente se logra con un intervalo AV en reposo de 100±30 ms)587.
8.5.3Implante de marcapasos tras miectomía septal y ablación con alcoholEn un estudio en el que participaron 2.482 pacientes con MCH obstructiva, el 2,3% desarrolló BAV después de la miectomía septal588 (solo el 0,6% de aquellos con conducción basal normal frente al 34,8% de los con BRD preexistente). La ablación septal con alcohol causa BAV en un 7-20% de los pacientes576; el riesgo es mayor para los pacientes con anomalías de la conducción preexistentes, principalmente BRI585.
8.5.4Terapia de resincronización cardiaca en la miocardiopatía hipertrófica terminalA partir de los hallazgos de un pequeño estudio de cohorte589, en las guías anteriores la TRC tenía recomendaciones de clase IIa y clase IIb para pacientes con MCH, IC, BRI y FEVI < 50%576,590. Los estudios más recientes no han demostrado que la eficacia de este tratamiento persista591–593.
Hasta que se disponga de evidencia nueva, se recomiendan los criterios estándar de TRC para los pacientes con MCH (véase el apartado 6).
8.6Estimulación cardiaca en enfermedades raras8.6.1Síndrome del QT largoExisten múltiples interrelaciones entre las diferentes formas del síndrome del QT largo (SQTL) y la bradicardia: el SQTL puede asociarse con bradicardia sinusal, los periodos refractarios del miocardio ventricular muy largos pueden causar BAV 2:1, los cambios bruscos de frecuencia pueden desencadenar taquicardia de tipo torsades-de-pointes y el tratamiento con bloqueadores beta para suprimir los desencadenantes simpáticos de las torsades-de-pointes puede causar bradicardia.
Como los DAI actuales proporcionan todas las funciones de un marcapasos, no se suele indicarlo para el tratamiento del SQTL. Sin embargo, para los pacientes individuales con SQTL y torsades-de-pointes inducidas por catecolaminas, el tratamiento de choque puede ser perjudicial o incluso fatal; en estos casos, se puede utilizar el tratamiento con marcapasos y bloqueadores beta sin DAI. El implante de marcapasos en lugar de DAI es una opción de tratamiento para recién nacidos y lactantes con SQTL594 y una alternativa para pacientes con SQTL y bradicardia sintomática (espontánea o debida a bloqueadores beta) si las taquiarritmias ventriculares son poco probables o si no se desea el implante de DAI (preferencia del paciente).
Hay una indicación de marcapasos en el SQTL para recién nacidos y lactantes con BAV 2:1 debido a una corrección excesiva del QT largo con largos periodos refractarios miocárdicos595.
La estimulación temporal a frecuencia aumentada (generalmente 90-120 lpm) es un tratamiento importante para pacientes con SQTL y tormenta eléctrica, porque el aumento de la frecuencia cardiaca básica acorta la ventana de vulnerabilidad para la reinducción de la taquicardia ventricular en las torsades-de-pointes.
8.6.2Enfermedades neuromuscularesLas enfermedades neuromusculares son un grupo de trastornos hereditarios heterogéneos que afectan al músculo esquelético y, con frecuencia, también al corazón (para obtener más información sobre los trastornos de la conducción en las enfermedades neuromusculares, véase la bibliografía adicional sobre estimulación en enfermedades raras y la tabla 17 del material adicional). El fenotipo cardiaco incluye de manera variable todos los tipos de miocardiopatías, defectos de conducción con o sin miocardiopatía y taquiarritmias supraventriculares y ventriculares596–598. Las enfermedades de Duchenne y Becker y la enfermedad muscular de cintura-cadera tipo 2C, 2F y 2I son distrofias musculares en las que es habitual que aparezca miocardiopatía dilatada, que suele ser la característica predominante. Las arritmias y las enfermedades de la conducción pueden estar asociadas con el desarrollo de miocardiopatía596–598. Se considera a estos pacientes para marcapasos o DAI sobre la base de las recomendaciones sobre otras miocardiopatías no isquémicas242. La distrofia miotónica tipo 1 y 2, Emery-Dreifuss y la distrofia muscular cintura-cadera tipo 1B suelen presentarse con anomalías de la conducción y arritmias asociadas, y de manera variable con miocardiopatía596,597. Las recomendaciones ofrecen una orientación en los casos en que las indicaciones para estimulación cardiaca difieran de las utilizadas para otros pacientes con bradicardia.
Recomendaciones sobre la estimulación cardiaca en enfermedades raras
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Está indicada la estimulación permanente para los pacientes con enfermedades neuromusculares como distrofia miotónica tipo 1 y cualquier tipo de BAV de segundo o tercer grado o I-HV ≥ 70 ms con o sin síntomasc,599-602 | I | C |
| Se puede considerar el implante de marcapasos permanente para los pacientes con enfermedades neuromusculares como distrofia miotónica tipo 1 con PR ≥ 240 ms o QRS ≥ 120 msc600,603,604 | IIb | C |
BAV: bloqueo auriculoventricular; DAI: desfibrilador automático implantable; I-HV: intervalo His-ventrículo; TRC: terapia de resincronización cardiaca.
Las mutaciones en el gen LMNA, que codifica los filamentos intermedios de la lamina A y C de la envoltura nuclear, causan una variedad de enfermedades hereditarias definidas como «laminopatías»605–607. Según el tipo de mutación, pueden producir trastornos cardiacos aislados o enfermedades sistémicas u osteomusculares como la variante autosómica dominante de Emery-Dreifuss o la distrofia de cintura-cadera. Alrededor de un 5-10% de las miocardiopatías dilatadas son inducidas por mutaciones del gen LMNA y se manifiestan como enfermedad de la conducción cardiaca, taquiarritmias o alteración de la contractilidad miocárdica596,606–620. La DNS y las anomalías de la conducción suelen ser la primera manifestación, en muchos casos con tamaño y función del VI conservados613,614. La miocardiopatía relacionada con LMNA es más maligna que la mayoría de las otras miocardiopatías y conlleva más riesgo de MS para los portadores asintomáticos con contractilidad del VI conservada o levemente disminuida610–615.
El implante de marcapasos no reduce el riesgo de MS en estos pacientes. Un metanálisis sobre el modo de muerte de los portadores de mutaciones de LMNA ha demostrado que el 46% de los pacientes que murieron repentinamente tenían un marcapasos implantado. Las tasas de MS fueron similares en aquellos solo con miocardiopatía y los que tenían además un fenotipo neuromuscular611. Las arritmias ventriculares complejas son comunes en los pacientes con alteraciones de la conducción612,613,615. En 2 estudios, los pacientes con mutaciones de LMNA y una indicación de estimulación permanente se sometieron a implante de DAI, que fue apropiado en un 42 y un 52% de los casos en un periodo de 3 y 5 años respectivamente612,613. Estos hallazgos hicieron que, en la práctica clínica, se considerara el DAI en lugar del marcapasos para la enfermedad de conducción relacionada con LMNA614,620. Para conocer otros factores clínicos de riesgo de taquiarritmias ventriculares y MS en pacientes con miocardiopatía dilatada debido a mutaciones de LMNA, véase la tabla 18 del material adicional. Se debe considerar la TRC-D si el paciente tiene BAV y FEVI < 50% y se espera una frecuencia alta de estimulación ventricular (apartado 6, tabla 18 del material adicional). La puntuación de riesgo de arritmia ventricular potencialmente mortal en las laminopatías puede predecirse mediante un módulo recientemente desarrollado y validado (https://lmna-risk-vta.fr/)616.
Recomendaciones para pacientes con mutaciones del gen LMNA (referencias en la tabla 18 del material adicional)
| Recomendación | Clasea | Nivelb |
|---|---|---|
| Para los pacientes con mutaciones del gen LMNA, como distrofias musculares de Emery-Dreifuss y de cintura-cadera, que cumplan los criterios convencionales para el implante de marcapasos o tengan intervalo PR prolongado con BRI, se debe considerar el DAI con capacidad de estimulación si la esperanza de vida es ≥ 1 año616 | IIa | C |
BRI: bloqueo de rama izquierda; DAI: desfibrilador automático implantable.
Recomendaciones sobre estimulación cardiaca en el síndrome de Kearns-Sayre
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se debe considerar la estimulación permanente para los pacientes con síndrome de Kearns-Sayre que tengan prolongación PR, cualquier grado de BAV, BR o bloqueo fascicularc,621–625 | IIa | C |
| Se puede considerar la profilaxis con estimulación permanente para los pacientes con síndrome de Kearns-Sayre que no tengan anomalías de la conducción cardiacac,621–625 | IIb | C |
BAV: bloqueo auriculoventricular; BR: bloqueo de rama; DAI: desfibrilador automático implantable; TRC: terapia de resincronización cardiaca.
Las citopatías mitocondriales son un grupo heterogéneo de trastornos hereditarios en los que las miocardiopatías, los defectos de conducción y las arritmias ventriculares son las presentaciones cardiacas más frecuentes621,622. En el síndrome de Kearns-Sayre, la manifestación cardiaca más habitual es la enfermedad de conducción, que puede progresar a BAV completo y causar MS623–625.
8.6.5Enfermedades infiltrativas y metabólicasLa miocardiopatía infiltrativa es secundaria al depósito y la acumulación de productos patológicos en el intersticio miocárdico, a diferencia de las enfermedades por almacenamiento, que producen una acumulación intracelular de estos productos. La principal causa de miocardiopatía infiltrativa es la amiloidosis, mientras que las enfermedades por almacenamiento incluyen la hemocromatosis, la enfermedad de Fabry y las enfermedades por almacenamiento de glucógeno. En pacientes con amiloide cardiaco, es frecuente que haya anomalías de la conducción, taquiarritmias y MS. Según el conocimiento actual, deben seguirse las indicaciones convencionales de estimulación cardiaca para este grupo de pacientes.
8.6.6Enfermedades inflamatoriasLas infecciones (virales, bacterianas como borreliosis, protozoonosis, por hongos o parásitos), las enfermedades autoinmunitarias (como miocarditis de células gigantes, sarcoidosis, cardiopatía reumática, enfermedad del tejido conectivo, miocarditis eosinofílica), los tóxicos (alcohol, cocaína, tratamientos anticancerígenos, especialmente anticuerpos monoclonales) y las reacciones físicas (radioterapia) pueden causar cardiopatía inflamatoria. La afección del NAV y el sistema de conducción es más frecuente que la del nódulo sinusal. El BAV puede indicar la participación del septo en el proceso inflamatorio y es un predictor de un resultado clínico adverso. Las arritmias ventriculares también pueden ocurrir debido a miocardiopatías.
Cuando la cardiopatía inflamatoria se complica con bradicardia, especialmente BAV, se debe aplicar un tratamiento específico si está disponible, que podría complementarse con un marcapasos temporal o administración intravenosa de isoprenalina. Como alternativa, puede bastar un tratamiento inmunosupresor o esperar a la resolución espontánea. Si la bradicardia no se resuelve en un plazo clínicamente razonable o no se puede esperar a que se resuelva (p. ej., después de la radioterapia), está indicado un marcapasos permanente. Antes de elegir un tipo de dispositivo, se debe considerar la indicación de DAI o TRC en lugar de un marcapasos monocameral o bicameral porque la mayoría de las causas de enfermedad inflamatoria que producen bradicardia también pueden producir reducción de la contractilidad miocárdica y fibrosis ventricular.
8.6.6.1SarcoidosisEn la sarcoidosis puede haber BAV persistente o intermitente, que muestra una propensión a afectar al tabique intraventricular basal. En un registro finlandés, 143 de 325 pacientes (44%) diagnosticados con sarcoidosis cardiaca tenían BAV de segundo o tercer grado Mobitz II en ausencia de otra enfermedad cardiaca causal626. Una historia clínica de síncope, presíncope o palpitaciones apunta a bradicardia, pero también a taquiarritmia ventricular. El BAV es la presentación clínica más común en pacientes con sarcoidosis cardiaca clínicamente evidente627,628. El trabajo diagnóstico incluye monitorización por ECG, ecocardiografía, RMC y biopsia de miocardio u otro tejido afectado. La PET con fluorodesoxiglucosa puede ser útil629. Las posibilidades y la evolución temporal de la resolución del BAV con tratamiento inmunosupresor no están claras630, pero pueden ser malas88. Hay datos a largo plazo de un estudio prospectivo canadiense (32 pacientes)627, un estudio retrospectivo japonés (22 pacientes)628 y un registro finlandés (325 pacientes)626. La reversibilidad del trastorno de conducción es impredecible e, incluso para pacientes con BAV transitorio, se debe considerar la estimulación permanente631. El tratamiento inmunosupresor puede aumentar el riesgo de infección del dispositivo. No obstante, no hay datos firmes que respalden el implante del dispositivo antes del inicio de la medicación inmunosupresora. Los pacientes con sarcoidosis cardiaca y BAV tienen un riesgo alto de MS durante el seguimiento a largo plazo, incluso si la FEVI es > 35%626. Los pacientes con disminución de la FEVI leve o moderada (35-49%) también están en mayor riesgo de MS632,633. Por consiguiente, se debe considerar la TRC-D en lugar de marcapasos para el tratamiento de los pacientes con sarcoidosis cardiaca que tengan indicación de estimulación cardiaca y FEVI < 50%634 (véase el apartado 6).
Recomendaciones sobre estimulación en la sarcoidosis cardiaca
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para los pacientes con sarcoidosis cardiaca que tengan BAV permanente o transitorio, se debe considerar el implante de un dispositivo de estimulación cardiacac,88,629,630 | IIa | C |
| Para los pacientes con sarcoidosis e indicación de marcapasos permanente que tengan FEVI < 50%, se debe considerar el implante de TRC-D631,634 | IIa | C |
BAV: bloqueo auriculoventricular; DAI: desfibrilador automático implantable; FEVI: fracción de eyección del ventrículo izquierdo; TRC-D: terapia de resincronización cardiaca con desfibrilador.
El parto vaginal no conlleva riesgos adicionales para una madre con bloqueo cardiaco congénito completo, a menos que esté contraindicado por razones obstétricas635. Para las mujeres que tienen un ritmo de escape de la unión del complejo estrecho y estable, puede no ser necesario implantar un marcapasos o este puede posponerse hasta después del parto si no hay factores de riesgo (síncope, pausas > 3 veces la duración del ciclo del ritmo de escape ventricular, ritmo de escape con QRS ancho, intervalo QT largo, ectopia ventricular compleja, frecuencia cardiaca media diurna < 50 lpm). Sin embargo, las mujeres con bloqueo cardiaco completo que presenten un ritmo de escape del complejo QRS ancho y lento deben someterse a implante de marcapasos durante el embarazo. Los riesgos de esta intervención son generalmente bajos y se puede realizar con seguridad si el feto tiene más de 8 semanas. Se puede implantar un marcapasos para el alivio de la bradicardia sintomática en cualquier etapa del embarazo utilizando guía ecográfica o navegación electroanatómica para minimizar la fluoroscopia636,637.
9CONSIDERACIONES ESPECIALES SOBRE EL IMPLANTE DE DISPOSITIVOS Y TRATAMIENTO PERIOPERATORIO9.1Consideraciones generalesLos pacientes con signos clínicos de infección activa o fiebre no deben someterse a implante de marcapasos permanente (incluido el marcapasos sin cables) hasta que estén afebriles durante al menos 24 h. Los pacientes febriles que han comenzado una pauta antibiótica deberían acabar el tratamiento completo y estar sin fiebre durante 24 h tras finalizarlo antes de implantar el marcapasos definitivo, siempre que no se requiera estimulación cardiaca aguda. Debe evitarse la estimulación transvenosa temporal siempre que sea posible. Se debe establecer estimulación transvenosa temporal en pacientes que necesiten estimulación aguda, preferiblemente con acceso por la vena yugular o axilar/subclavia lateral638. En un estudio prospectivo multicéntrico con 6.319 pacientes, la presencia de fiebre en las primeras 24 h tras el implante (OR = 5,83; IC95%, 2,00-16,98) y la estimulación temporal antes del implante (OR = 2,46; IC95%, 1,09-5,13) se han correlacionado positivamente con la aparición de infección del dispositivo639. Se puede considerar el implante mínimamente invasivo de un marcapasos epicárdico en pacientes con infección crónica recurrente.
9.2Profilaxis antibióticaSe recomienda la profilaxis antibiótica sistémica preoperatoria como medida estándar en los procedimientos de implante de marcapasos. El riesgo de infección se reduce significativamente con una sola dosis de antibiótico profiláctico (cefazolina 1-2 g i.v. o flucloxacilina 1-2 g i.v.) administrada en los 30-60 min previos a la intervención (90-120 min para vancomicina 15 mg/kg)640–643. La profilaxis antibiótica debe proteger contra especies de S. aureus, pero no se recomienda la cobertura sistemática de S. aureus resistente a meticilina. La prescripción de vancomicina debe basarse en las características de riesgo del paciente de sufrir infección por S. aureus resistente a meticilina y la prevalencia de la bacteria en la institución correspondiente638.
La profilaxis antibiótica posoperatoria no reduce la incidencia de infección644,645.
9.3Entorno operatorio y medidas de asepsia cutáneaEl procedimiento de implante de marcapasos se debe hacer en un entorno quirúrgico que cumpla con los estándares de esterilidad requeridos para otros procedimientos quirúrgicos similares638,646.
Según los datos de los procedimientos quirúrgicos y las intervenciones percutáneas con catéter intravascular, la piel se debe desinfectar con clorhexidina-alcohol en lugar de povidona-yodo-alcohol647,648. En un ECA de gran tamaño con 2.546 pacientes incluidos, la clorhexidina-alcohol se asoció con menor incidencia de enfermedades intravasculares relacionadas con el catéter a corto plazo (HR=0,15; IC95%, 0,05-0,41; p = 0,0002)647.
9.4Tratamiento de la anticoagulaciónEs bien sabido que el desarrollo de hematoma de bolsillo después del implante de un sistema de estimulación aumenta significativamente el riesgo de infección del bolsillo641,643,649. El ensayo BRUISE CONTROL ha demostrado que un hematoma del bolsillo clínicamente significativo es un factor independiente del riesgo de posterior infección del dispositivo (HR = 7,7; IC95%, 2,9-20,5; p < 0,0001)649. Por lo tanto, es de suma importancia tomar todas las medidas necesarias para evitar el hematoma del bolsillo en el posoperatorio.
El tratamiento puente con heparina para los pacientes anticoagulados con un antagonista de la vitamina K aumenta significativamente en 4,6 veces el riesgo de hematoma del bolsillo en el posoperatorio en comparación con el tratamiento continuo con warfarina. La reducción gradual de la razón internacional normalizada (INR) y el cambio temporal de antiagregación plaquetaria doble a monoterapia pueden reducir la tasa de hematoma e infección en un 75 y un 74% respectivamente en comparación con el tratamiento puente con heparina651.
Con respecto a los anticoagulantes orales no antagonistas de la vitamina K (NACO), el ensayo BRUISE CONTROL-2 se tuvo que detener prematuramente por futilidad debido a que la tasa de eventos fue mucho menor de lo anticipado; sin embargo, los datos indican que, según la situación clínica y el tratamiento antiplaquetario concomitante, podría ser razonable suspender o continuar los NACO en el momento del implante del dispositivo 652.
Los pacientes que en tratamiento antiagregante plaquetario doble tienen un riesgo significativamente mayor de hematoma del bolsillo en el posoperatorio que los pacientes tratados solo con ácido acetilsalicílico o sin tratamiento antiagregante plaquetario. En tales casos, los inhibidores del receptor P2Y12 deberían suspenderse durante 3-7 días (según el tipo de fármaco) antes del procedimiento, cuando sea posible, con base en una evaluación del riesgo individualizada638,653,654. Para más información sobre el tratamiento anticoagulante en el implante de marcapasos, véase la tabla 11.
Predictores de estimulación permanente tras el implante percutáneo de válvula aórtica.
| Características | Referencias |
|---|---|
| ECG | |
| BRD | 512–528 |
| Prolongación del intervalo PR | 517,521,525,527 |
| Hemibloqueo anterior izquierdo | 517,525 |
| Paciente | |
| Edad avanzada (por cada año de aumento) | 529 |
| Sexo masculino | 518,519,525,529 |
| IMC más alto (por cada unidad de aumento) | 529 |
| Anatómicos | |
| Calcificación grave del anillo mitral | 512,515 |
| Calcificaciones del TSVI | 522 |
| Longitud del tabique membranoso | 528,530 |
| Aorta en porcelana | 531 |
| Gradiente valvular aórtico medio más alto | 519 |
| Relacionados con el procedimiento | |
| Válvula autoexpandible | 512,513,525,529,531 |
| Implantación valvular más profunda | 517,518,520,522,528,532 |
| Mayor cociente diámetro de la prótesis/diámetro del anillo o del TSVI | 524,529,532 |
| Tras dilatación con balón | 519,521,529 |
| TAVI de tipo valve-in-valve frente al procedimiento de válvula nativa | 531 |
BAV: bloqueo auriculoventricular; BRD: bloqueo de rama derecha; ECG: electrocardiograma; TAVI: implante percutáneo de válvula aórtica; TSVI: tracto de salida del ventrículo izquierdo; VI: ventrículo izquierdo.
Para obtener información más detallada, véase las tablas 14 y 15 del material adicional.
Tratamiento anticoagulante en los procedimientos de marcapasos.
| Tratamiento antiagregante plaquetario doble655,656 | NACO652 | VKA650 | ACO+antiagregantes plaquetarios657 | ||
|---|---|---|---|---|---|
| Riesgo trombótico tras ICP | |||||
| Intermedio o bajo> 1 mes tras ICP> 6 meses tras SCA en la ICP índice | Alto< 1 mes tras ICP< 6 meses tras SCA en la ICP índice | ||||
| Bajo riesgo hemorrágico en primoimplantes | Continuar AAS y suspender los iP2Y12 antes de la cirugía: ticagrelor al menos 3 días antes, clopidogrel al menos 5 días y prasugrel al menos 7 días | Cirugía electiva: considere posponer, si no:• Continuar el AAS• Continuar el iP2Y12 | Continuar o suspender según preferencia del médico. La interrupción debe basarse en AclCr y NACO específico | Continuara | Continuar el ACO (AVKa o NACO). Suspender el tratamiento antiagregante plaquetario según el análisis de riesgo/beneficio específico del paciente |
| Alto riesgo hemorrágico en recambios y actualizaciones/revisiones del dispositivo | Continuar el AAS y suspender el iP2Y12 antes de la cirugía: ticagrelor al menos 3 días antes, clopidogrel al menos 5 días antes y prasugrel al menos 7 días antes Tratamiento puente con inhibidores de la GPIIb/IIIa | ||||
AAS: ácido acetilsalicílico; AclCr: aclaramiento de creatinina; ACO: anticoagulantes orales; AVK: antagonistas de la vitamina K; GPIIb/IIIa: glucoproteína IIb/IIIa; ICP: intervención coronaria percutánea; INR: razón internacional normalizada; iP2Y12: inhibidores de P2Y12; NACO: nuevos anticoagulantes orales (no antagonistas de la vitamina K); SCA: síndrome coronario agudo.
aObjetivo de INR dentro del rango terapéutico.
El implante de cables transvenosos para colocar un marcapasos suele hacerse por acceso a través de las venas cefálica, subclavia o axilar. En caso de signos clínicos de oclusión venosa de la vena subclavia o la vena innominada, las imágenes preoperatorias (venografía o TC de tórax) pueden ser útiles para planificar el acceso venoso antes del procedimiento. Cuando el acceso venoso superior sea imposible, puede ser adecuado implantar cables transfemorales o dispositivo sin cables o con cables epicárdicos.
Cuando se utiliza la técnica de Seldinger, existe riesgo de neumotórax, hemotórax, punción arterial inadvertida y lesión del plexo braquial durante la punción de las venas subclavia y axilar (esta última en menor grado). Estos riesgos se pueden evitar con el abordaje por la vena cefálica, que permite la inserción venosa de cables con inspección directa. El acceso a través de la vena subclavia se asocia con un riesgo de neumotórax 7,8 veces mayor658. Los datos prospectivos indican que el acceso por la vena axilar conlleva menor riesgo de complicaciones que el acceso por la vena subclavia659. Se ha descrito que la punción axilar guiada por ecocardiografía reduce el riesgo de complicaciones660.
Hay evidencia de que el acceso por la vena axilar reduce la tasa de fallo de los cables durante el seguimiento a largo plazo. En un estudio retrospectivo a partir de 409 pacientes con un seguimiento medio de 73,6±33,1 meses, se produjo fallo del cable en el 1,2% de los pacientes con punción de la vena axilar guiada por contraste, el 2,3% de los pacientes con punción de la vena cefálica y el 5,6% de los pacientes con punción de la vena subclavia. En el análisis de regresión multivariante, el único predictor de fallo del cable fue la punción de la vena subclavia (HR=0,26; IC95%, 0,071-0,954; p = 0,042). Cuando se comparan los diferentes accesos venosos, el abordaje por la vena cefálica es el que muestra la tasa de éxito más baja (el 78,2 frente al 97,6% en vena axilar y el 96,8% en vena subclavia; p < 0,001)661.
9.6Consideraciones sobre los cablesEl criterio de elección de fijación activa o pasiva de los cables en AD o VD debe considerar la posibilidad de perforación y pericarditis, así como la facilidad de una extracción ulterior. Los cables de fijación activa tienen mayor tendencia a crear derrames pericárdicos y perforaciones francas. Los cables de fijación pasiva tienen tasas de éxito más bajas y presentan mayor riesgo de complicaciones durante la extracción, posiblemente por el diseño no isodiamétrico de la punta del cable, aunque este aspecto no está claro y se está evaluando662. Será necesario investigarlo en un ECA.
Con respecto a las perforaciones, un estudio sin controles y no aleatorizado que incluyó a 3.815 pacientes con implante de un cable de VD no mostró diferencias significativas en cuanto a la tasa de perforaciones miocárdicas entre la fijación activa y la pasiva (el 0,5 frente al 0,3%; p = 0,3)663. Los cables de fijación activa permiten la estimulación selectiva de regiones del VD que tienen paredes lisas (como el tabique medio). Sin embargo, como la AD tiene paredes delgadas, los cables de fijación activa pueden causar la perforación de la pared libre. Algunos médicos prefieren implantar cables de fijación pasiva en pacientes con riesgo alto de perforación (como los de edad avanzada). No obstante, según la opinión de los expertos y los resultados de un estudio retrospectivo unicéntrico de cables de DAI (637 pacientes), se recomiendan cables de fijación activa en AD y VD para los pacientes jóvenes para facilitar la extracción futura664.
La estabilidad del cable y la estimulación del nervio frénico son aspectos importantes del implante del cable del seno coronario. Los cables cuadripolares tienen ventajas importantes sobre estos parámetros. La tasa de estimulación del nervio frénico que precisa revisión del cable es significativamente menor que con los cables bipolares del seno coronario665,666. Además, la estabilidad es mayor porque los cables cuadripolares se pueden implantar en posición impactada. Si se implantan en posición apical debido a la impactación, el uso de los polos proximales evita la estimulación apical. Por lo tanto, se recomiendan los cables cuadripolares para el implante de cables del seno coronario. Se han desarrollado cables de VI de fijación activa mediante una hélice lateral con resultados que demuestran una buena estabilidad, un acceso fácil al lugar de estimulación y un umbral estable de estimulación del VI a largo plazo. Los cables bipolares y cuadripolares de fijación activa ofrecen resultados similares que los cables cuadripolares de fijación pasiva. El diseño del cable con un mecanismo de fijación activa mediante una hélice lateral se ha desarrollado para permitir su extracción a largo plazo, aunque todavía no se ha puesto a prueba en los estudios de seguimiento667–669.
9.7Posición de los cablesLa estimulación ventricular se ha realizado tradicionalmente desde el ápex del VD. Con la introducción de los cables de fijación activa, se han evaluado sitios alternativos de estimulación, como el tabique del TSVD o el tabique medio, que proporcionan una estimulación más fisiológica. Sin embargo, a pesar de dos décadas de investigación, el beneficio clínico de la estimulación no apical del VD sigue siendo incierto670. Esto puede explicarse, en parte, por la variabilidad en la posición del cable, que a menudo se coloca involuntariamente en la pared libre anterior, lo que puede favorecer que haya un resultado adverso671–673. La principal ventaja del marcapasos septal radica en evitar la perforación de la pared libre. En un estudio de 2.200 pacientes a los que se implantó un marcapasos o un cable DAI, la posición apical se asoció de manera independiente con la perforación cardiaca (OR=3,37; p = 0,024)420. Por consiguiente, la posición septal puede ser preferible en pacientes con riesgo aumentado de perforación, como los de edad avanzada, especialmente si tienen un índice de masa corporal < 20, y las mujeres670,674.
La colocación del cable en el tabique medio es técnicamente difícil (sobre todo en el tabique del TSVD, al tratarse de un área pequeña). Puede ser útil disponer de múltiples perspectivas fluoroscópicas y estiletes con distintas formas, tal y como se describe en un reciente documento de consenso de la EHRA34. Es importante tener en cuenta que la precisión y la reproducibilidad de la evaluación fluoroscópica de las posiciones de los cables del VD suelen ser inexactas421.
También es recomendable disponer de múltiples proyecciones fluoroscópicas para la colocación de los cables AVD, y para garantizar que no se coloque por accidente en una vena tributaria del seno coronario o en el VI a través de una comunicación intracardiaca o el acceso arterial.
El seno coronario se puede utilizar para la estimulación del VI sin necesidad de atravesar la válvula tricúspide. También se puede utilizar en presencia de factores que dificulten desplegar un cable de VD (como cuando hay una válvula tricúspide protésica). En grupos de pacientes seleccionados, el resultado es similar al de la estimulación del VD675,676.
La orejuela de la AD suele ser el sitio preferido para la estimulación auricular. La aurícula lateral puede conllevar un riesgo de captura del nervio frénico677,678. Los sitios de estimulación alternativos para evitar la FA, como el haz de Bachman y la región del ostium del seno coronario, no han mostrado beneficio y no están recomendados en la práctica habitual679,680.
9.8Bolsillo del dispositivoEn los últimos años, ha aumentado la conciencia sobre el papel del bolsillo del dispositivo como fuente de complicaciones. Las precauciones para evitar las infecciones de bolsillo se han convertido en un aspecto fundamental del tratamiento con dispositivos de estimulación. La relación entre los hematomas del bolsillo y el desarrollo de infecciones ya se ha comentado. Además del abordaje anticoagulante adecuado, la técnica quirúrgica y una hemostasia meticulosa son aspectos críticos.
La mayoría de los marcapasos se implantan tras crear un bolsillo subcutáneo681. En determinados contextos, como pacientes con bajo índice de masa corporal y poco tejido subcutáneo o síndrome de Twiddler o cuando hay razones estéticas, puede ser preferible crear un bolsillo submuscular. Sin embargo, esta estrategia implica una sedación más profunda y mayores tasas de reemplazo del generador debido al dolor. Hasta la fecha, no hay datos de ECA que comparen los 2 tipos de bolsillo de dispositivo. Los datos históricos de 1.000 pacientes con DAI han mostrado tiempos de procedimiento significativamente más cortos para los pacientes con bolsillos subcutáneos. No se encontraron diferencias significativas en los hematomas del bolsillo. Tampoco hubo diferencias significativas en los porcentajes acumulados de pacientes sin complicaciones durante el seguimiento682.
La irrigación del bolsillo con solución salina al final del procedimiento ayuda a diluir los posibles contaminantes y elimina los residuos de la herida antes del cierre683,684. La adición de antibióticos a la solución de lavado no reduce el riesgo de infecciones del dispositivo683.
El ensayo WRAP-IT ha estudiado el efecto de un recubrimiento absorbible liberador de antibióticos en el desarrollo de infecciones del DAI posoperatorias. Se aleatorizó 1:1 a 6.983 pacientes que se sometían a revisión del bolsillo del DAI, sustitución del generador, actualización del sistema o implante de TRC-D a recibir recubrimiento antibiótico o no. La tasa de infección del DAI en pacientes que tenían el recubrimiento antibacteriano fue del 0,7% frente al 1,2% en el grupo de control (HR=0,6; IC95%, 0,36-0,98; p = 0,04)685. No se observó efecto en la tasa de infección del subgrupo de pacientes portadores de marcapasos685. Teniendo en cuenta la relación coste-eficacia, se puede considerar el recubrimiento antibiótico para los pacientes con alto riesgo de infecciones. Los factores de riesgo que se debe considerar en este contexto son la enfermedad renal terminal, la enfermedad pulmonar obstructiva crónica, la diabetes mellitus y los procedimientos de sustitución, revisión o actualización del dispositivo638.
Recomendaciones sobre el implante de dispositivos y tratamiento perioperatorio
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda la administración de profilaxis antibiótica preoperatoria dentro de la primera hora de la incisión cutánea para reducir el riesgo de infección por DAI641,643,686 | I | A |
| Para la desinfección cutánea, se debe considerar el alcohol de clorhexidina en lugar del alcohol de povidona yodada647,648 | IIa | B |
| Para el acceso venoso, debe considerarse la vena cefálica o axilar como primera opción658,659 | IIa | B |
| Se debe considerar el uso de múltiples proyecciones fluoroscópicas para confirmar la posición del electrodo ventricular | IIa | C |
| Se debe considerar los electrodos cuadripolares como primera opción para el implante de cables del seno coronario665,666,687 | IIa | C |
| Se debe considerar el lavado del bolsillo del dispositivo con solución salina para cerrar la herida683,684 | IIa | C |
| Para los pacientes que se someten a reintervención por el DAI, se puede considerar un recubrimiento liberador de antibiótico685,688 | IIb | B |
| Se puede considerar la estimulación del tabique medio ventricular en pacientes con alto riesgo de perforación (ancianos, perforación previa, bajo IMC, mujeres)420,674 | IIb | C |
| Se puede considerar un bolsillo submuscular para el implante de marcapasos en pacientes con posibles dificultades con el bolsillo, como mayor riesgo de erosión debido a IMC bajo o síndrome de Twiddler o por razones estéticas | IIb | C |
| Para los pacientes anticoagulados, no se recomienda el tratamiento puente con heparina650,689 | III | A |
| No se recomienda implantar marcapasos permanente en pacientes febriles. El implante debe retrasarse hasta que el paciente haya estado afebril al menos 24 h638,639 | III | B |
DAI: desfibrilador automático implantable; IMC: índice de masa corporal.
La estimulación cardiaca y la TRC se asocian con un riesgo de complicaciones notable (tabla 12), mayormente en la fase perioperatoria429,690, aunque persiste un riesgo considerable durante el seguimiento a largo plazo691. Las tasas de complicaciones después del implante de marcapasos bicameral en el ensayo MOST fueron del 4,8% a los 30 días, el 5,5% a los 90 dáis y el 7,5% a los 3 años692. Sin embargo, los datos de la práctica clínica real indican más riesgo690,693. En un estudio reciente con más de 81.000 pacientes sometidos a implante de DAI de novo, tuvieron complicaciones mayores el 8,2% de los pacientes durante los 90 días posteriores al alta hospitalaria694. La mortalidad hospitalaria y la mortalidad en los primeros 30 días fue baja (el 0,5 y el 0,8% respectivamente).
Complicaciones del implante de marcapasos y la terapia de resincronización cardiaca.
| Incidencia de complicaciones después de tratamiento con DAI | % |
|---|---|
| Reintervenciones relacionadas con el cable354,639,690,692,695,700,701 (como desplazamiento, mala posición, síndrome de aplastamiento subclavio, etc.) | 1,0-5,9 |
| Infecciones relacionadas con el DAI antes de 12 meses354,639,641,645,685,695,702 | 0,7-1,7 |
| Infección superficial354 | 1,2 |
| Infecciones del bolsillo354 | 0,4 |
| Infecciones sistémicas354 | 0,5 |
| Infecciones relacionadas con el DAI antes de 12 meses702–709 | 1,1-4,6 |
| Infecciones del bolsillo702 | 1,3 |
| Infecciones sistémicas702,705 | 0,5-1,2 |
| Neumotórax354,658,690,692,700,701,707 | 0,5-2,2 |
| Hemotórax695 | 0,1 |
| Lesión del plexo braquial695 | <0,1 |
| Perforación cardiaca354,663,690,692,695 | 0,3-0,7 |
| Disección/perforación del seno coronario710,288 | 0,7-2,1 |
| Revisión por dolor/malestar354,690 | 0,1-0,4 |
| Estimulación diafragmática que precisa reintervención711,712,665,713 | 0,5-5 |
| Hematoma354,639,650,652,654,690,700,714,715 | 2,1-5,3 |
| Insuficiencia tricuspídea716–718 | 5-15 |
| Síndrome del marcapasos146,701,719 | 1-20 |
| Problema del generador/cable354,639,690 | 0,1-1,5 |
| Trombosis venosa profunda (aguda o crónica)354,720,721 | 0,1-2,6 |
| Cualquier tipo de complicación354,639,690,692,695,707,722,723 | 5-15 |
| Mortalidad (antes de 30 días)354,694 | 0,8-1,4 |
DAI: desfibrilador automático implantable.
Los riesgos de complicaciones generalmente aumentan con la complejidad del dispositivo y son más comunes en el contexto de una actualización del dispositivo o la revisión de los cables en comparación con el implante de novo. En un estudio de cohorte poblacional danés, se observaron complicaciones en el 9,9% de los pacientes sometidos a un primer implante de dispositivo y el 14,8% tras la actualización o revisión del cable354. Los procedimientos que se limitaban a la sustitución del generador tenían menos riesgo de complicaciones (5,9%). En el registro prospectivo REPLACE, se ha descrito una proporción similar de riesgo de complicaciones en el contexto del reemplazo del generador (4%), pero los riesgos fueron mucho mayores cuando había una o más inserciones de cables adicionales (hasta 15,3%) 695. En consecuencia, las complicaciones mayores fueron más comunes en los procedimientos de actualización de TRC, un hallazgo que se ha corroborado en una gran cohorte de pacientes hospitalizados en Estados Unidos339 y un estudio observacional prospectivo italiano696. La tasa de complicaciones de los procedimientos también aumenta con la carga de comorbilidad697.
Por todo ello, se recomienda una toma de decisiones compartida y cuidadosa cuando se considere un procedimiento de progresión a sistemas más complejos. Esto también se aplica al reemplazo profiláctico de generadores y cables de DAI descatalogados, situación en la que deben sopesarse cuidadosamente los riesgos del procedimiento frente a los riesgos que implica el fallo del dispositivo o del cable698.
En general, las tasas de complicaciones están estrechamente relacionadas con la experiencia y el volumen de implantes del operador y el centro429,658,693. Un estudio ha descrito un aumento del 60% de las complicaciones con operadores sin experiencia que habían realizado menos de 25 implantes429. Los datos de un gran programa nacional de garantía de calidad para marcapasos y TRC-M mostraron que el volumen anual de implantes hospitalarios estaba en relación inversa con la tasa de complicaciones, y la mayor diferencia se observó entre el quintil más bajo (1-50 implantes/año) y el segundo quintil más bajo (51-90 implantes/año)699. Además, los procedimientos de urgencia y fuera del horario de atención se asocian con un aumento de las tasas de complicaciones354. Estos datos indican con claridad que los procedimientos de DAI deben llevarlos a cabo operadores experimentados en centros con suficiente volumen de procedimientos.
10.2Complicaciones específicas10.2.1Complicaciones derivadas de los cablesLos cables de los marcapasos son causa frecuente de complicaciones por desprendimiento, insuficiente aislamiento, fracturas y problemas de detección o de umbral. En una cohorte danesa, las intervenciones relacionadas con los cables (2,4%) fueron la complicación mayor más frecuente354. Los cables del VI tienen una especial propensión a determinadas complicaciones, como el desplazamiento y la disección o perforación de las venas coronarias700. En un registro nacional, los cables del VI (4,3%) se asociaron con complicaciones más frecuentemente que los cables de la AD (2,3%) y el VD (2,2%)429. Los principales predictores de riesgo fueron la presencia de un dispositivo de TRC (OR=3,3) y un cable de AD de fijación pasiva (OR=2,2).
Un metanálisis de 25 ECA ha detectado complicaciones mecánicas (como disección o perforación del seno coronario, derrame o taponamiento pericárdico, neumotórax y hemotórax) en el 3,2% de los casos, otros problemas relacionados con los cables en el 6,2% e infecciones en el 1,4%. La frecuencia de muertes periimplantacionales fue del 0,3%369.
10.2.2HematomaEl hematoma del bolsillo es una complicación frecuente (2,1-9,5%) que suele tratarse de manera conservadora. La evacuación, necesaria en el 0,3-2% de los casos, se asocia con un riesgo de infección aproximadamente 15 veces mayor639. Además, los pacientes que desarrollan hematoma del bolsillo permanecen hospitalizados más tiempo y tienen una tasa de mortalidad hospitalaria más alta (el 2,0 frente al 0,7%)724. Por lo tanto, es crítico tomar todas las precauciones necesarias y restringir las reintervenciones a los pacientes con dolor intenso, sangrado persistente, distensión de la línea de sutura y necrosis cutánea inminente. Muchos hematomas pueden evitarse mediante una hemostasia cuidadosa y la optimización de los fármacos antiagregantes plaquetarios y anticoagulantes.
10.2.3InfecciónLa infección es una de las complicaciones más preocupantes del implante de DAI, pues causa morbilidad, mortalidad y costes de atención médica elevados725,726. Las tasas de infección son más altas con los procedimientos de sustitución o actualización del dispositivo695, así como con los implantes de TRC o DAI en comparación con los marcapasos simples727. Olsen et al.702 han descrito un riesgo de por vida de infección del sistema del 1,19% con marcapasos, el 1,91% con DAI, el 2,18% con TRC-M y el 3,35% con TRC-D. En particular, los pacientes sometidos a reoperaciones, aquellos con una infección previa relacionada con el dispositivo, los varones y los pacientes más jóvenes tenían un riesgo de infección significativamente mayor.
Estos datos son similares a los descritos en una gran cohorte de pacientes que recibieron DAI, con tasas de infección del 1,4% con DAI simple, el 1,5% con DAI dual y el 2,0% con DAI biventricular728. Además, la reintervención precoz (OR=2,70), la cirugía valvular previa (OR=1,53), el reimplante (OR=1,35), la insuficiencia renal en diálisis (OR=1,34), la enfermedad pulmonar obstructiva crónica (OR=1,22), la enfermedad cerebrovascular (OR=1,17) y la toma de warfarina (OR=1,16) fueron los factores que se asociaron con mayor riesgo de infección702. La tasa de infecciones también aumenta con el uso de marcapasos temporales u otros procedimientos antes del implante definitivo (OR=2,5 y OR=5,8 respectivamente), las reintervenciones tempranas (OR=15) y la falta de profilaxis antibiótica (OR=2,5)639,729.
En un reciente documento de consenso de la EHRA se proporciona información más detallada sobre cómo prevenir, diagnosticar y tratar las infecciones en el DAI642.
10.2.4Interferencia con la válvula tricúspideLos cables del DAI pueden interferir con la función de la válvula tricúspide durante la intervención al causar daño a las valvas o el aparato subvalvular, o crónicamente después de la operación o extracción del cable. Este daño se ha relacionado con la aparición de deterioro hemodinámico y un mal resultado clínico730. De hecho, la insuficiencia tricuspídea de moderada a grave se asocia con un exceso de mortalidad731,732 y ocurre más frecuentemente en pacientes con DAI733. La prevalencia de insuficiencia tricuspídea significativa (definida como de grado 2 o superior) después del implante de un DAI varía entre el 10 y el 39%. La mayoría de los estudios atribuyen mayor daño en presencia de cables de DAI, sobre todo si son múltiples cables de VD45,46,49,445,642,685,697,709,728,730–732. Sigue siendo objeto de debate el tema de la interferencia del cable con las válvulas tricúspides bioprotésicas o tras anuloplastia o reparación. Además, no hay evidencia definitiva que indique que la disincronía del VD inducida por estimulación contribuya de manera significativa a la insuficiencia tricuspídea. En un estudio reciente con 63 pacientes aleatorizados a posiciones distintas de los cables de estimulación (vértice del VD, SVD o VI a través del seno coronario), no se detectaron diferencias en el desarrollo de insuficiencia tricuspídea734. El diagnóstico de insuficiencia tricuspídea relacionada con los cables de DAI basado en la evaluación hemodinámica y ecocardiográfica (2D, 3D y Doppler) suele ser un desafío735. No hay recomendaciones claras para el tratamiento de la insuficiencia tricuspídea en presencia de cables de DAI, pero debe haber un alto grado de sospecha clínica, y se debe tener en cuenta la posibilidad de que el empeoramiento de la IC sea una consecuencia del efecto mecánico del cable en la movilidad o coaptación de los velos tricuspídeos730. Las opciones terapéuticas incluyen el tratamiento médico para aliviar la congestión, la extracción/sustitución cuidadosa del cable y la aplicación de estrategias de estimulación alternativas, como estimulación del VI a través del seno coronario o cables epicárdicos. Sin embargo, la extracción del cable por vía transvenosa conlleva en sí misma un riesgo de dañar la válvula tricúspide y, por lo tanto, de empeoramiento de la insuficiencia tricúspidea. En este contexto, la estimulación sin cables eliminaría la necesidad de cables transvalvulares, pero puede afectar negativamente a la función de la válvula tricúspide, posiblemente por interferencias mecánicas y activación ventricular eléctrica y mecánica anormal736. Las recomendaciones para la sustitución o reparación valvular quirúrgica en la insuficiencia tricúspidea inducida por DAI deben basarse en la presencia de síntomas, la gravedad de la insuficiencia tricuspídea y la función del VD. Cuando se considere la valvuloplastia quirúrgica, el manejo del cable del VD debe seguir las recomendaciones descritas en el apartado 8.2.3737. Los métodos para la reparación percutánea de la tricúspide han despertado cada vez mayor intererés, pero la evidencia disponible en el contexto de la insuficiencia tricuspídea relacionada con el cable es escasa738.
10.2.5OtrasSe ha observado un mayor riesgo de complicaciones en mujeres (principalmente neumotórax y perforación cardiaca) y personas con bajo índice de masa corporal354,739. Los pacientes de más de 80 años tienen menos riesgo de reintervenciones relacionadas con el cable que los de 60-79 años (el 1,0 frente al 3,1%)354.
La presencia de sincronía auriculoventricular subóptima puede llevar a un síndrome de marcapasos y dar lugar a ondas en forma de cañón causadas por contracciones auriculares y ventriculares simultáneas y síntomas de fatiga, mareo e hipotensión (véase el apartado 5). La estimulación del VD a largo plazo induce un patrón de activación ventricular asincrónico que puede progresar a disfunción del VI e IC clínica. Las estrategias para evitar y resolver el efecto adverso de la estimulación del VD se comentan en el apartado 6.
11CONSIDERACIONES SOBRE EL TRATAMIENTOSe debe adoptar un enfoque integral durante el proceso de atención médica y el tratamiento de los pacientes con marcapasos y TRC, con un equipo interdisciplinario que tome las decisiones en conjunto con el paciente y la familia (véase el apartado 12). La atención médica integral debe garantizar el enfoque centrado en el paciente y la participación de este en la toma de decisiones. El enfoque de atención integral tiene su origen en el modelo de atención crónica desarrollado por Wagner et al.740 y puede mejorar los resultados clínicos y la percepción del paciente durante el tratamiento de las arritmias741–743 (véase el apartado 12). Se elegirá a los especialistas que deben formar parte del equipo interdisciplinario según las necesidades del paciente y la disponibilidad del centro (figura 13).
A menudo los pacientes portadores de marcapasos requieren una RM. Puede causar efectos adversos como un mal funcionamiento del dispositivo debido a reinicio o problemas de detección, interacción con el interruptor magnético, inducción de corrientes que provoquen captura, calentamiento de la punta del cable con cambios en los umbrales de detección o captura o perforación del cable. Los factores de riesgo de eventos adversos en la RM se enumeran en la tabla 19 del material adicional.
Actualmente, la mayoría de los fabricantes ofrecen dispositivos compatibles con la RM (sistemas de uso condicional). Todo el sistema de DAI en su conjunto (es decir, la combinación de generador y cables, que deben ser del mismo fabricante) determina la compatibilidad condicional con la RM, no los elementos individuales. Las adquisiciones por RM pueden limitarse a 1,5 T y una tasa de absorción específica corporal (TAE) < 2 W/kg (TAE de cabeza, < 3,2 W/kg), pero algunos modelos permiten 3 T y hasta 4 W/kg de TAE de cuerpo entero. El fabricante puede especificar un periodo de exención (generalmente 6 semanas) después del implante, aunque podría realizarse una RM antes de ese plazo si hay justificación clínica.
Hay amplia evidencia de que la RM se puede hacer con seguridad en presencia de marcapasos no condicionales siempre que se tome una serie de precauciones744–746. En 2017, la Heart Rhythm Society publicó un documento de consenso de expertos sobre RM de pacientes con DAI, desarrollado y respaldado por varias asociaciones, incluida la EHRA y diversas asociaciones radiológicas745. En las tablas 20, 21 y 22 y la figura 2 del material adicional, se muestran las recomendaciones detalladas sobre el flujo de trabajo y la programación.
Cuando los cables están conectados a un generador, este absorbe parte de la energía y disipa el calor a través de una gran superficie. Los cables transvenosos abandonados son propensos a calentar la punta hasta aproximadamente 10°C, como se muestra en un estudio in vitro747, aunque es difícil extrapolar los resultados de los modelos experimentales al entorno in vivo. No se han descrito eventos adversos en 4 series que incluían a un total de 125 pacientes con cables transvenosos abandonados748–751. El estudio más grande incluyó a 80 pacientes749 que se sometieron a 97 exploraciones (incluida la región torácica), con una TAE < 1,5 W/kg. Se midió la concentración de troponina antes y después de la exploración a la mitad de los pacientes, y no se detectaron cambios significativos. Por lo tanto, se pueden hacer exploraciones de RM de 1,5 T (con TAE < 1,5 W/kg) de pacientes seleccionados, teniendo en cuenta la relación riesgo-beneficio, especialmente si las exploraciones son extratorácicas y los pacientes no dependen de marcapasos.
Los cables epicárdicos conectados a un generador dan como resultado un aumento de 10°C en la temperatura durante las pruebas in vitro y hasta 77°C en el caso de cables epicárdicos abandonados747. Se han publicado datos de 23 pacientes con cables epicárdicos749–752, incluidos 14 con cables epicárdicos abandonados749–751, sin ningún efecto adverso relacionado con la RM. Debido a la escasez de datos de seguridad en pacientes con cables epicárdicos, adaptadores-extensores de cables o cables dañados, no se puede hacer recomendaciones sobre RM en estos pacientes. La evaluación debe ser individualizada y la toma de decisiones, compartida sopesando las ventajas de la RM con los riesgos posibles y la disponibilidad de métodos de imagen alternativos.
En general, la RM debe realizarse siempre en el contexto de un diagrama de trabajo institucional estandarizado y rigurosamente aplicado, siguiendo las condiciones de uso adecuadas (incluida la programación)744,746,753–755. En la figura 14 se muestra un diagrama de flujo que resume el tratamiento de los pacientes con marcapasos sometidos a RM.
Hay evidencia de que se puede tomar RM de 1,5 T de pacientes con cables epicárdicos temporales756 o con cables transvenosos de fijación activa implantados en marcapasos externalizados para estimulación temporal751.
Recomendaciones sobre resonancia magnética para pacientes portadores de marcapasos
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para los pacientes con sistemas de marcapasos compatibles con la RM (sistemas condicionales)c, esta se puede realizar con seguridad siguiendo las instrucciones del fabricante745,753–755 | I | A |
| Para los pacientes con marcapasos sin sistema condicional para la RM, se debe considerar la RM si no se dispone de otra técnica de imagen y no hay cables epicárdicos, cables abandonados o dañados o cables adaptadores/extensores744,746 | IIa | B |
| Se puede considerar la RM para los pacientes con marcapasos con cables transvenosos abandonados si no se dispone de otra técnica de imagen748–751 | IIb | C |
RM: resonancia magnética.
Los pacientes con DAI derivados a radioterapia van en aumento757; la tasa anual notificada es de 4,33 tratamientos cada 100.000 personas-año. La radioterapia utiliza radiación ionizante de alta energía, como rayos X, rayos gamma y partículas cargadas, que pueden causar errores de software y hardware en los DAI, especialmente cuando la energía del haz de radiación de fotones supera los 6-10 MV y la dosis de radiación recibida por el dispositivo es alta (> 2-10 Gy)758,759. Los errores de hardware son raros y suelen deberse a la irradiación directa del dispositivo, que puede causar daños irreversibles y obligar a su reemplazo. Los errores de software son más frecuentes y se deben a la producción secundaria de neutrones por la irradiación760. Estos errores incluyen típicamente reinicios del dispositivo que no causan daño estructural y pueden resolverse sin reemplazo757,759.
La interferencia electromagnética durante la radioterapia puede causar sobredetección, aunque esto ocurre muy poco en la práctica clínica760. No se recomienda la reubicación del dispositivo antes de la radioterapia, excepto si la ubicación actual interfiere con el tratamiento del tumor o en casos muy seleccionados de riesgo alto757,761.
Según las recomendaciones publicadas para pacientes con DAI745,759,762, el riesgo de mal funcionamiento (o eventos adversos) para los pacientes portadores de marcapasos es mayor en las siguientes situaciones:
- •
Con radiación de fotones aplicando energía > 6-10 MV: el riesgo de mal funcionamiento (generalmente errores de software) se debe a la producción secundaria de neutrones, no está asociado con la zona objetivo y no puede protegerse.
- •
Con una dosis acumulada que llega al dispositivo > 2 Gy (riesgo moderado) o > 10 Gy (riesgo alto): la dosis que llega al dispositivo se puede calcular antes de iniciar el tratamiento y medirla durante este, se correlaciona con la zona objetivo y puede protegerse.
- •
Si el paciente es dependiente de marcapasos.
- •
En la figura 15 se ilustra el proceso de toma de decisiones.
Hay poca experiencia con radioterapia de protones en pacientes con DAI. En comparación con la irradiación de fotones, esta modalidad produce más neutrones secundarios, lo que puede aumentar el riesgo de errores o fallos del dispositivo763. Actualmente no se puede emitir recomendaciones específicas sobre radioterapia de protones para pacientes con DAI.
En la tabla 23 del material adicional se enumeran las recomendaciones específicas de los fabricantes de DAI.
11.3Estimulación cardiaca temporalLa estimulación temporal permite estimular eléctricamente el corazón de los pacientes con bradicardia aguda potencialmente mortal o como profilaxis cuando se prevea la necesidad de estimulación (p. ej., después de cirugía cardiaca)764,765. Las modalidades de estimulación temporal de urgencia incluyen los abordajes transvenosos, epicárdicos y transcutáneos. El abordaje transvenoso suele requerir guía fluoroscópica, aunque también se puede hacer con inspección ecocardiográfica766. Los catéteres flotantes con punta en balón son más fáciles de insertar, más estables y seguros que los catéteres semirrígidos767,768. Los pacientes que se someten a estimulación transvenosa temporal tienen alto riesgo de complicaciones relacionadas con el procedimiento (perforación cardiaca, hemorragias, mal funcionamiento, arritmias y desplazamiento accidental de los cables) y complicaciones relacionadas con la inmovilización (infección, delirio y eventos trombóticos).764,765,769–775 Además, la estimulación temporal previa se asocia con mayor riesgo de infección por marcapasos permanente639,641. Para los pacientes que requieren estimulación temporal prolongada, la estrategia del cable transvenoso percutáneo de fijación activa conectado a un dispositivo externo es más segura y cómoda776–779. No hay suficientes datos que respalden el acceso yugular o axilar/subclavio; no obstante, debe evitarse la punción subclavia intraatorácica para reducir el riesgo de neumotórax. Se prefiere el acceso yugular si se planea el implante de un dispositivo homolateral permanente. En casos seleccionados que requieran una estimulación rápida y eficaz, se puede utilizar el acceso femoral. Debido a la inestabilidad de los cables pasivos colocados a través de la vena femoral y la inmovilización del paciente, la duración de este abordaje debe ser lo más breve posible hasta que la bradicardia se haya resuelto o se haya establecido una solución más permanente. El abordaje epicárdico se utiliza principalmente después de la cirugía cardiaca. La extracción de estos cables se asocia con sangrado y taponamiento780–782. La estimulación transcutánea temporal es un método no invasivo rápido y eficaz, pero no es tan estable como el abordaje transvenoso y está limitado por la necesidad de sedación continua783. Esta modalidad solo debe utilizarse en situaciones de urgencia o cuando no se disponga de otra opción y bajo estrecha vigilancia hemodinámica784. Antes de iniciar la estimulación temporal, se debe considerar la administración de cronotrópicos, teniendo en cuenta los efectos secundarios, las contraindicaciones y las interacciones con otros medicamentos.
Este grupo de trabajo concluye que, si es posible, debe evitarse la estimulación transvenosa temporal. En caso necesario, el cable debe permanecer in situ durante el menor tiempo posible. La estimulación temporal debería limitarse a tratamientos de urgencia de pacientes con bradiarritmia grave que provoque síncope o deterioro hemodinámico y cuando se prevean esas bradiarritmias. Se recomienda la estimulación transvenosa temporal cuando las indicaciones de estimulación sean reversibles, como en el contexto de los fármacos antiarrítmicos, isquemia miocárdica, miocarditis, alteraciones electrolíticas, exposición tóxica, después de cirugía cardiaca o como tratamiento puente para el implante de un marcapasos permanente cuando este procedimiento no esté disponible de inmediato o no sea posible por infección concomitante. Por último, si un paciente cumple los criterios de implante de marcapasos permanente, el procedimiento debe realizarse con prontitud.
Recomendaciones sobre estimulación cardiaca temporal
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda la estimulación transvenosa temporal en casos de bradiarritmia con deterioro hemodinámico refractaria a fármacos cronotrópicos intravenosos764,765 | I | C |
| La estimulación transcutánea debe considerarse en casos de bradiarritmia con deterioro hemodinámico cuando la estimulación transvenosa temporal no sea posible o no esté disponible783–785 | IIa | C |
| Se debe considerar la estimulación transvenosa temporal cuando esté indicada la estimulación inmediata y se espera que las indicaciones de estimulación sean reversibles, como en el contexto de isquemia miocárdica, miocarditis, alteraciones electrolíticas, exposición tóxica o después de cirugía cardiaca771–773 | IIa | C |
| Debe considerarse una estimulación transvenosa temporal como tratamiento puente al implante de un marcapasos permanente, cuando este no esté disponible de inmediato o no sea posible debido a una infección concomitante771–773 | IIa | C |
| Para la estimulación transvenosa temporal a largo plazo, se debe considerar un cable de fijación activo insertado a través de la piel y conectado a un marcapasos externo641,776,777,779 | IIa | C |
Varias sociedades profesionales han publicado documentos para asosorar sobre el tratamiento perioperatorio de los pacientes con DAI786–789. La tabla 24 del material adicional resume las recomendaciones generales sobre el tratamiento de estos pacientes.
- •
La interferencia electromagnética (IEM) puede inducir sobredetección (más probable con los cables unipolares), activación de sensores sensibles a frecuencia, reinicio del dispositivo u otros daños. La fuente de IEM más habitual es el electrocauterio, aunque es poco frecuente en el electrocauterio bipolar a más de 5 cm del DAI y el electrocauterio monopolar por debajo del nivel umbilical790. Para reducir el riesgo de IEM, se debe aplicar electrocauterio monopolar en pulsos cortos (< 5 s), con los parches cutáneos alejados del área del dispositivo. Otras fuentes de IEM son los procedimientos de radiofrecuencia, estimuladores nerviosos y otros dispositivos electrónicos.
- •
La estrategia perioperatoria debe adaptarse en función de las necesidades y los valores individuales de los pacientes, el procedimiento y el dispositivo786–789. La mayoría de los procedimientos no requerirán intervención alguna791. Para los pacientes dependientes de marcapasos, se debe aplicar un imán durante la aplicación de pulsos de ondas cortas de diatermia o, si es probable que haya IEM o no se puede garantizar la estabilidad del imán, el dispositivo debe reprogramarse a un modo asincrónico (VOO/DOO). La respuesta a la aplicación de imanes puede diferir entre los fabricantes de dispositivos. Los DAI con función de respuesta en frecuencia que utilizan un sensor activo también pueden requerir la aplicación de un imán o la desactivación de esta función para evitar una estimulación rápida inapropiada. Se recomienda interrogar el DAI tras la intervención cuando se sospeche mal funcionamiento o el dispositivo haya estado expuesto a fuertes IEM.
El ejercicio regular está muy recomendado para la prevención de las enfermedades cardiovasculares792–795. Las restricciones impuestas a los pacientes con marcapasos, cuando corresponda, estarán motivadas por la enfermedad cardiovascular subyacente. Por lo tanto, es importante abordar los problemas derivados de la práctica deportiva de los pacientes portadores de marcapasos como parte del proceso de toma de decisiones compartida. Se han publicado recomendaciones integrales para la actividad física de los pacientes con enfermedad cardiovascular792,796.
Existe consenso en que los deportes de contacto (como el rugby o las artes marciales) deben evitarse para no correr el riesgo de dañar los componentes del dispositivo o causar hematoma en el sitio del implante. Para la participación en deportes como fútbol, baloncesto o béisbol, se recomienda utilizar escudos protectores especiales que reduzcan el riesgo de golpes en el dispositivo. Se debe tener en cuenta los intereses deportivos del paciente y el dominio del brazo derecho o izquierdo al seleccionar el sitio de implante, y se puede considerar la colocación submuscular para reducir el riesgo de impacto. Es preferible el acceso vascular lateral para prevenir el riesgo de aplastamiento subclavio del cable asociado con el movimiento de los brazos por encima del nivel de los hombros. Se recomienda abstención de la práctica de ejercicio vigoroso y el ejercicio de brazos homolateral las 4-6 semanas posteriores al implante del dispositivo.
Es importante tener presente que las recomendaciones sobre la actividad deportiva de los pacientes con DAI difieren de las de los pacientes con marcapasos797,798.
11.6Cuando la estimulación cardiaca ya no está indicadaExisten varias opciones para el tratamiento de los pacientes portadores de sistemas de marcapasos que ya no tienen indicada la estimulación:
- 1.
Dejar el generador de marcapasos y los cables in situ.
- 2.
Explantar el generador de marcapasos y abandonar los cables.
- 3.
Explantar el generador de marcapasos y los cables.
La viabilidad de la opción 1 depende del comportamiento del generador al final de su vida útil, que a su vez depende del fabricante, y puede ser errático y provocar complicaciones en casos excepcionales799. La opción 1 es la preferida para subgrupos de pacientes frágiles y ancianos seleccionados.
La opción 2 conlleva bajo riesgo del procedimiento, pero puede conllevar las desventajas del abandono del cable, como futuras RM. Es necesario tener en cuenta, sobre todo en pacientes más jóvenes, la posibilidad de una futura extracción de los cables abandonados debido a infección, así como el riesgo asociado con la mayor duración del procedimiento. Varios estudios han demostrado que los procedimientos de extracción de cables abandonados conllevan mayor complejidad, menor éxito del procedimiento y mayores tasas de complicaciones.800–803
La opción 3 es la que tiene el riesgo inicial más alto, pero elimina todas las posibilidades de complicaciones ulteriores relacionadas con el dispositivo. Cuando se lleva a cabo en centros especializados con alto volumen de intervenciones y los actuales instrumentos de extracción, las tasas de éxito son elevadas y hay pocas complicaciones802. Este enfoque puede ser apropiado para pacientes jóvenes con bajo riesgo de extracción intervenidos por un operador experimentado.
Como parte del enfoque centrado en el paciente, la decisión debe basarse en un análisis del cociente riesgo-beneficio individual mediante un proceso de toma de decisiones compartida con el paciente y sus cuidadores. Se debe proporcionar información suficiente para que la toma de decisiones sea informada. Los factores importantes que tener en cuenta son la edad del paciente, su estado general, sus comorbilidades, el sistema de marcapasos, la duración del implante del cable y la esperanza de vida del paciente.
Recomendaciones para cuando la estimulación cardiaca ya no está indicada
11.7Seguimiento del dispositivoEn este apartado se tratan los principios generales del seguimiento, ya que las recomendaciones detalladas están fuera del alcance de este documento. El paciente y el dispositivo deben tratarse como una sola entidad, y la programación del dispositivo debe estar adaptada a las necesidades del paciente. Los objetivos son a) garantizar la seguridad del paciente; b) proporcionar estimulación fisiológica; c) mejorar la calidad de vida del paciente; d) mejorar el tratamiento clínico del paciente, y e) maximizar la longevidad del dispositivo. No debe pasarse por alto la necesidad de hacer un seguimiento de la enfermedad cardiaca subyacente. Además del control técnico y la optimización de la programación, es necesario asesorar adecuadamente al paciente y su familia para que estos objetivos se cumplan. La frecuencia de seguimiento depende del tipo de dispositivo (la TRC y la EHH se asocian con más problemas clínicos o técnicos y necesitan una vigilancia más estrecha) y si se gestiona a distancia (tabla 13).
- •
La gestión del dispositivo a distancia incluye el seguimiento a distancia con interrogación completa del dispositivo a intervalos programados (para sustituir las visitas al consultorio), monitorización a distancia con transmisión no programada de eventos de alerta predefinidos y seguimiento iniciado por el paciente con interrogaciones no programadas tras sufrir un evento clínico real o percibido. La mayoría de los estudios se han centrado en pacientes con DAI y TRC-D, y han mostrado una reducción significativa del retraso entre la detección del evento arrítmico y la decisión clínica, así como menos descargas inapropiadas804. Dos ensayos aleatorizados de no inferioridad con marcapasos unicameral805 o bicameral805 (no TRC-M) han demostrado que las visitas al consultorio se pueden espaciar de manera segura a intervalos de 18 a 24 meses si los pacientes están en monitorización a distancia con dispositivos que tienen algoritmos de umbral automático. El espaciamiento de las visitas programadas es especialmente útil para pacientes ancianos con movilidad limitada, aunque también lo es para pacientes jóvenes o de mediana edad con trabajos a tiempo completo, compromisos familiares, etc., y en situaciones específicas (p. ej., para evitar la exposición durante una pandemia).
- •
Es importante controlar la gestión de los dispositivos a distancia mediante una configuración adecuada que ofrezca un enfoque estructurado para el seguimiento a distancia y una respuesta oportuna a las alertas. Los proveedores externos pueden ser útiles para clasificar las alertas y ayudar en esta tarea807. Es importante destacar que se debe cumplir la regulación general sobre protección de datos, tal y como se describe en un reciente documento de la ESC/EHRA sobre asuntos regulatorios808.
Frecuencia de seguimiento de marcapasos y terapia de resincronización cardiaca, presencial o en combinación con gestión del dispositivo a distancia.
| Solo en consulta | En consulta+remoto | |
|---|---|---|
| Todos los dispositivos | En las primeras 72h y 2-12 semanas después del implante | En consulta en las primeras 72 h y 2-12 semanas después del implante |
| TRC-M o EHH | Cada 6 meses | A distancia cada 6 meses y presencial cada 12 meses* |
| Monocameral/bicameral | Cada 12 meses y cada 3-6 meses cuando haya signos de agotamiento de la batería | A distancia cada 6 meses y presencial cada 18-24 meses* |
EHH: estimulación del haz de His; TRC-M: terapia de resincronización cardiaca con marcapasos.
*El seguimiento a distancia solo puede sustituir a las visitas en consulta si los algoritmos de umbral de captura automática funcionan con precisión (y se han verificado previamente en la consulta).
Es posible que se requiera un seguimiento adicional en la consulta (p. ej., para verificar el efecto clínico de la modificación de la programación o para el seguimiento de un problema técnico). La monitorización a distancia (es decir, de alertas predefinidas) debe implementarse siempre con los seguimientos a distancia.
Recomendaciones sobre el seguimiento de marcapasos y terapia de resincronización cardiaca con marcapasos
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda la gestión del dispositivo a distancia para reducir el número de visitas presenciales de seguimiento de los pacientes portadores de marcapasos que tengan dificultades para acudir a la consulta médica (problemas de movilidad reducida o preferencias del paciente)805,806,809 | I | A |
| Se recomienda la monitorización a distancia en caso de que un componente del dispositivo se haya retirado del mercado o vaya a retirarse próximamente, para permitir la detección precoz de episodios, especialmente en pacientes con mayor riesgo (como los dependientes de marcapasos) | I | C |
| El seguimiento sistemático en consulta de los marcapasos monocamerales y bicamerales de los pacientes con gestión del dispositivo a distancia puede espaciarse hasta 24 meses805,806 | IIa | A |
| Se debe considerar la gestión a distancia del marcapasos para tener una detección más precoz de los problemas clínicos (como arritmias) o técnicos (como fallo del cable o agotamiento de la batería)806,810 | IIa | B |
La atención centrada en el paciente es un proceso holístico que pone de relieve la interrelación entre el paciente y el médico en los temas de salud y tiene en cuenta las necesidades, las creencias, las expectativas, las preferencias, los objetivos y los valores del paciente811–813. En la atención centrada en el paciente, el foco está puesto en la toma de decisiones compartida, aceptando que los pacientes suelen preferir un papel activo en las decisiones sobre su salud814,815. Se ha demostrasdo que este enfoque mejora los resultados clínicos y la experiencia médica814,816. Los clínicos tienen el deber de definir y explicar el problema de salud y hacer recomendaciones sobre la mejor evidencia entre todas las opciones disponibles en ese momento, incluso no tratar, al tiempo que se garantizan los valores y las preferencias del paciente (figura 16)817–820.
Ejemplo de decisión compartida con pacientes considerados para implante de marcapasos/terapia de resincronización cardiaca.821
Los medios que ayudan al proceso de toma de decisiones, como la información escrita, los sitios web interactivos o las aplicaciones, pueden complementar el asesoramiento de los médicos y, por lo tanto, facilitar la toma de decisiones compartida822. Cuando se utilizan ayudas para la toma de decisiones, los pacientes se sienten más informados, tienen una percepción del riesgo más precisa y participan más activamente en la decisión823. Para los pacientes con deficiencias en el lenguaje hablado o poco nivel de alfabetización y aquellos con deterioro cognitivo, se recomiendan estrategias de comunicación, como la intermediación de un intérprete cualificado, para ayudar al paciente a tomar una decisión equilibrada824–826. El uso de material educativo contribuye a promover el aprendizaje de los pacientes827–830. Dependiendo de las necesidades y las preferencias del paciente, la instrucción debe darse antes del implante, al alta y durante el seguimiento utilizando un enfoque centrado en la persona (tabla 14). Antes del alta todos los pacientes deben recibir un folleto proporcionado por el fabricante y una tarjeta de identificación del dispositivo.
Temas y contenido que la formación del paciente podría incluir.
| Temas | Contenido que la formación del paciente puede incluir |
|---|---|
| Biofísicos | Enfermedad/afección, indicación de marcapasos, proceso de implante, posibles complicaciones y mal funcionamiento perioperatorio o tardío, función y aspectos técnicos del marcapasos/TRC, notificador del paciente (si corresponde), sustitución de la bateríaDemostración con marcapasos de prueba |
| Funcionales | Actividades diarias: movilidad, actividades físicas y deportivas, posibles restricciones físicas (movimientos de brazos), actividad sexual, restricciones a la conducción, viajes, cuidado de heridas, toma de medicamentosSignos y síntomas posoperatorios normales y autocuidado; dolor, rigidez en el hombro, hinchazón o sensibilidad alrededor del bolsillo del marcapasos |
| Económicos | Costes del tratamiento y derechos en el sistema de seguridad social, temas relacionados con los seguros médicos, bajas por enfermedad |
| Emocionales | Posibles emociones y reacciones al tratamiento con marcapasos: ansiedad, preocupaciones, imagen corporal |
| Sociales | Apoyo disponible: apoyo telefónico, sesiones grupales presenciales, foros de pacientes y grupos de apoyo entre paresPosibles restricciones laborales e interferencias electromagnéticas |
| Éticos | Derechos y deberes de los pacientes y del personal médico y sanitario: consentimiento/rechazo del tratamiento con marcapasos o TRC o interrupción del tratamientoInformación sobre la inscripción en el registro nacional de marcapasos |
| Prácticos | Información de contacto de la tarjeta identificativa del marcapasos al hospital/clínicaRutinas de seguimiento: a distancia y/o presencialDónde obtener más información: fuentes fiables disponibles en internet, organizaciones que brindan información fiable sobre temas de salud |
TRC: terapia de resincronización cardiaca.
Este Grupo de Trabajo quiere subrayar la importancia de la atención centrada en el paciente y la toma de decisiones compartida entre pacientes y médicos. La decisión de implantar un marcapasos/TRC debe basarse en la mejor evidencia disponible teniendo en cuenta los riesgos-beneficios individuales de cada opción, las preferencias del paciente y los objetivos de la atención médica. La consulta debe incluir si el paciente es un buen candidato para el tratamiento con marcapasos/TRC, y las posibles opciones de tratamiento alternativas deben discutirse de manera que todos las partes involucradas puedan entender. A partir de los principios de toma de decisiones compartida y consentimiento/rechazo informado, los pacientes tienen derecho a rechazar la terapia con marcapasos, incluso si dependen de un marcapasos.
Recomendaciones sobre la atención centrada en el paciente en estimulación cardiaca y terapia de resincronización cardiaca
| Recomendación | Clasea | Nivelb |
|---|---|---|
| Cuando se considera el marcapasos o la TRC, la decisión debe basarse en la mejor evidencia disponible teniendo en cuenta los riesgos-beneficios individuales de cada opción, las preferencias del paciente y los objetivos clínicos, y se recomienda seguir un abordaje integral utilizando los principios de la atención centrada en el paciente y la toma de decisiones compartida en la consulta831–836 | I | C |
TRC: tratamiento de resincronización cardiaca.
Los indicadores de calidad son instrumentos que sirven para evaluar la calidad de la atención, incluidos los procesos de atención y los resultados clínicos837. También pueden servir para mejorar la adherencia a las recomendaciones de las guías a través de evaluaciones comparativas de cumplimiento y calidad de la asistencia838. El papel de los indicadores de calidad para impulsar la mejora de la calidad cada vez está más reconocido y está atrayendo el interés de las autoridades sanitarias, las organizaciones profesionales, las agencias financiadoras y la población general839.
La ESC reconoce la necesidad de medir e informar sobre la calidad y los resultados de la atención cardiovascular. Para ello, es necesario desarrollar e implementar indicadores de calidad específicos para las enfermedades cardiovasculares. Se ha publicado la metodología que la ESC emplea para el desarrollo de los indicadores de calidad839. Hasta la fecha, se ha elaborado un conjunto de indicadores de calidad para un grupo inicial de afecciones cardiovasculares839,840. Para facilitar las iniciativas de mejora de la calidad, se han incluido los indicadores de calidad de la ESC de enfermedades específicas en las correspondientes GPC de la ESC 296,841. Además, estos indicadores se han integrado en en los registros de la ESC como el EurObservational Research Programme (EORP) y el proyecto European Unified Registries On Heart Care Evaluation and Randomized Trials (EuroHeart)842.
Existen varios registros de pacientes sometidos a implante de DAI843 que permiten extrapolar los datos de la práctica clínica diaria a la calidad y los resultados de atención en el contexto del DAI702. No obstante, faltan indicadores de calidad ampliamente aceptados que abarquen la naturaleza multifacética de la atención de los pacientes con DAI y puedan servir como puente entre los registros clínicos y las recomendaciones de las guías. Por ello, en paralelo a la redacción de la presente guía, se ha desarrollado un conjunto de indicadores de calidad para pacientes sometidos a implante de DAI. En la tabla 15 se presenta una selección de estos indicadores de calidad (la lista completa, así como sus especificaciones y la metodología de desarrollo, se encuentra disponible en otra publicación844).
Selección de indicadores de calidad desarrollados para pacientes que se someten a implante de dispositivos electrónicos cardiovasculares.
| Indicador de calidad | Dominio |
|---|---|
| Los centros que prestan servicios DAI deben participar en al menos un registro DAI | Indicador de calidad estructurala |
| Numerador: número de centros que participan en al menos un registro de DAI | |
| Los centros que prestan servicios DAI deben monitorizar e informar sobre el volumen de procedimientos realizados anualmente por cada operador | Indicador de calidad estructural |
| Numerador: número de centros que monitorizan e informan sobre el volumen de procedimientos realizados por cada operador | |
| Los centros que prestan servicios con DAI deben disponer de recursos (monitorización ambulatoria con ECG, ecocardiografía) para estratificar a los pacientes según su riesgo de arritmias ventriculares | Indicador de calidad estructural |
| Numerador: número de centros con servicio de ECG ambulatorio y ecocardiografía | |
| Los centros que prestan servicios con DAI deben tener una lista de verificación previa al procedimiento para asegurar que se informa adecuadamente al paciente y se tiene en cuenta su opinión sobre los riesgos, los beneficios y otras opciones de tratamiento | Indicador de calidad estructural |
| Numerador: número de centros que tienen una lista de verificación para asegurar que se informa adecuadamente al paciente sobre los riesgos, los beneficios y otras opciones de tratamiento antes del implante de DAI | |
| Los centros que prestan servicios con DAI deben haber establecido protocolos para el seguimiento de los pacientes en las 2-12 semanas porteriores al implante | Indicador de calidad estructural |
| Numerador: número de centros que tienen un protocolo establecido para realizar un seguimiento de los pacientes en las 2-12 semanas posteriores al implante de DAI | |
| Proporción de pacientes para los que se considera el implante de DAI que reciben tratamiento antibiótico profiláctico 1 h antes del procedimiento | Evaluación del paciente |
| Numerador: número de pacientes que reciben antibióticos 1 h antes del implante de DAIDenominador: número de pacientes sometidos a implante de DAI | |
| Tasa anual de complicaciones del procedimientob a los 30 días del implante de DAI | Resultados |
| Numerador: número de pacientes que sufren una o más complicaciones del procedimientob en los 30 días posteriores al implante de DAIDenominador: número de pacientes sometidos a implante de DAI | |
DAI: desfibrilador automático implantable; ECG: electrocardiograma.
aLos indicadores de calidad estructural son medidas binarias (sí/no), por lo que solo se define el numerador.
bSangrado relacionado con DAI, neumotórax, perforación cardiaca, taponamiento, hematoma del bolsillo, desplazamiento del cable (todos requieren intervención) o infección.
- •
Para los candidatos a implante de marcapasos permanente, se recomienda una evaluación preoperatoria minuciosa y detallada. Esta evaluación debe incluir: anamnesis y exploración física cuidadosas, pruebas de laboratorio, documentación del tipo de bradiarritmia que requiere tratamiento e imágenes cardiacas. En casos seleccionados, están indicadas pruebas adicionales, EEF o pruebas genéticas.
- •
La monitorización con ECG ambulatoria es útil en la evaluación de pacientes con sospecha de bradicardia o anomalía de la conducción cardiaca para correlacionar las alteraciones del ritmo con los síntomas. La elección del tipo de monitorización debe basarse en la frecuencia y la naturaleza de los síntomas y las preferencias del paciente.
- •
Para los pacientes con DNS, incluidos aquellos con DNS de tipo bradicardia-taquicardia, está indicada la estimulación cardiaca cuando los síntomas puedan atribuirse claramente a la bradiarritmia.
- •
Para los pacientes en RS con BAV permanente o paroxística de segundo o tercer grado de tipo 2 o BAV de alto grado, está indicada la estimulación cardiaca independientemente de los síntomas.
- •
Para los pacientes con FA permanente y BAV permanente o paroxístico, está indicada la estimulación ventricular de un solo cable.
- •
Para los pacientes con síncope y caídas inexplicables, el diagnóstico debe establecerse utilizando los métodos de diagnóstico disponibles antes de considerar un tratamiento con marcapasos.
- •
Para los pacientes con IC sintomática y FEVI ≤ 35% pese al TMO que están en RS y tienen QRS con morfología de BRI, se recomienda la TRC cuando la duración del QRS sea ≥ 150 ms, y debe considerarse cuando el QRS sea de 130-149 ms. Para los pacientes con QRS sin morfología de BRI, la evidencia del beneficio de la TRC es más dudosa, especialmente si el intervalo PR es normal y el QRS, < 150 ms. No se debe aplicar TRC a pacientes con IC y QRS < 130 ms, a menos que sea necesaria la estimulación ventricular.
- •
La selección de pacientes para TRC basada en imágenes se limita a la medición de la FEVI, mientras que la evaluación de otros factores, como la extensión de la cicatriz miocárdica, la presencia de insuficiencia mitral o la función sistólica del VD, es importante para prever posibles faltas de respuesta que puedan necesitar tratamiento adicional (p. ej., valvuloplastia mitral).
- •
Para pacientes con FA permanente, IC sintomática, FEVI ≤ 35% y QRS ≥ 130 ms que permanecen en NYHA III-IV ambulatoria pese al TMO, se debe considerar la TRC.
- •
Para los pacientes con FA y TRC, se debe considerar la ablación de la UAV cuando no se pueda lograr una estimulación biventricular efectiva ≥ 90-95%.
- •
Para los pacientes con BAV de alto grado y una indicación de estimulación cardiaca que tengan IC-FEr (FEVI < 40%), se recomienda la TRC en lugar de la estimulación del VD.
- •
La EHH puede provocar una activación ventricular normal o casi normal y es una alternativa atractiva a la estimulación del VD. Por el momento, no hay datos de ECA que indiquen la no inferioridad de la EHH respecto a la estimulación del VD en cuanto a seguridad y eficacia. Por lo tanto, se puede considerar la EHH para pacientes seleccionados con BAV, FEVI > 40% y una estimulación ventricular prevista > 20%.
- •
Para los pacientes a los que se ofrece la EHH, se debe considerar caso por caso el implante de un cable de VD de seguridad para la estimulación.
- •
La EHH puede corregir la conducción ventricular en un subgrupo de pacientes con BRI, de modo que puede usarse en lugar de la estimulación biventricular para la TRC-OH en grupos de pacientes seleccionados.
- •
En pacientes tratados con EHH, es necesario asegurarse de que la programación del dispositivo se adapte a los requisitos específicos de la EHH.
- •
Se debe considerar el implante de un marcapasos sin cables cuando no haya un acceso venoso en los brazos o el riesgo de infección de la bolsa del dispositivo sea particularmente alto y para pacientes en hemodiálisis.
- •
Los pacientes sometidos a TAVI tienen mayor riesgo de BAV. Las decisiones sobre la estimulación cardiaca después del TAVI deben tomarse en función de las anomalías de la conducción nuevas y preexistentes. Se puede considerar la monitorización con ECG ambulatoria durante 7-30 días o EEF para los pacientes que tras el TAVI tienen BRI nuevo o progresión de una anomalía de la conducción preexistente, pero no hay indicación de marpasos en esta fase.
- •
Para los pacientes sometidos a cirugía por endocarditis o cirugía de la válvula tricúspide que tengan o contraigan un BAV durante la cirugía, se debe considerar la colocación de cables de estimulación epicárdica durante la cirugía.
- •
Para reducir el riesgo de complicaciones, antes de los procedimientos de DAI se debe administrar antibióticos. Es preferible utilizar clorhexidina-alcohol para la desinfección cutánea y se debe intentar el acceso por la vena cefálica o axilar como primera opción.
- •
Se debe evitar el tratamiento puente con heparina en los procedimientos de DAI para minimizar el riesgo de hematoma e infección del bolsillo.
- •
En pacientes sometidos a reintervención por el DAI, se puede considerar un recubrimiento liberador de antibióticos para reducir el riesgo de infección.
- •
La mayoría de los pacientes con marcapasos o TRC pueden someterse a una RM cuando esté indicada si no hay cables epicárdicos, cables abandonados o dañados o adaptadores/extensores de cables, y se deben tomar ciertas precauciones.
- •
Se puede ofrecer radioterapia a pacientes con marcapasos o TRC si la planificación del tratamiento es individualizada, antes se ha estratificado el riesgo y se interroga el dispositivo durante el periodo de radioterapia según las recomendaciones.
- •
La gestión de los dispositivos a distancia es un medio útil para la detección precoz de problemas clínicos y técnicos, y permite espaciar las visitas de seguimiento.
- •
Los principios de la atención centrada en el paciente y la toma de decisiones compartida deben utilizarse en la consulta tanto antes de la operación como durante el seguimiento de los pacientes candidatos o portadores de marcapasos o TRC.
Es frecuente que los médicos responsables de tratar a los candidatos a marcapasos y TRC y los pacientes deban tomar decisiones de tratamiento sin disponer de la evidencia adecuada o sin que exista un consenso de opinión de expertos. A continuación se enumera una lista de problemas comunes que merecen un futuro abordaje mediante investigación clínica.
- •
El mejor programa de evaluación previa al implante, que incluya cuándo aplicar técnicas de imagen avanzadas que garanticen la elección óptima del DAI para cada paciente.
- •
El beneficio de las pruebas genéticas para pacientes con DAI y sus familiares cuando se diagnostique enfermedad de conducción.
- •
Si la estimulación con respuesta en frecuencia es beneficiosa para lso pacientes con DNS.
- •
Si la ablación con catéter de FA sin marcapasos no es inferior al implante de marcapasos en cuanto a la ausencia de síntomas relacionados con la bradicardia en pacientes con pausas de conversión sintomática después de FA.
- •
Para los pacientes con síncope reflejo, se necesitan estudios sobre el modo de estimulación óptimo.
- •
Para los pacientes con indicación de estimulación VVI, es necesario documentar en ECA la eficacia y la seguridad a largo plazo de la estimulación sin cables.
- •
Para los pacientes con IC, aún no se ha demostrado que la TRC mejore el resultado en pacientes sin BRI.
- •
Para los pacientes con FA permanente/persistente, IC y BR, los efectos beneficiosos de la TRC no se han demostrado en ECA.
- •
Se necesitan ECA que documenten el efecto de la TRC en pacientes con IC tratados con los nuevos fármacos para la IC, como sacubitrilo-valsartán, ivabradina y los inhibidores del cotransportador-2 de glucosa sódica.
- •
Es necesario documentar los efectos beneficiosos de la progresión a TRC desde un marcapasos estándar o DAI en pacientes con IC y alta frecuencia de estimulación del VD.
- •
Cuando se implanta el electrodo de VI, se desconoce si el tratamiento manual o eléctrico dirigido a la última activación local mejora el efecto de la TRC y los resultados clínicos.
- •
Se desconoce si el empleo de alguna técnica de imagen antes del implante para decidir la colocación de los cables de VI y VD en la TRC mejora el resultado clínico.
- •
De los pacientes con indicación de marcapasos permanente y necesidad de alta frecuencia de estimulación del VD debido a BAV, se desconoce qué características del paciente y del tratamiento predicen el desarrollo de miocardiopatía inducida por marcapasos o IC.
- •
Para los pacientes con BAV y una indicación de estimulación cardiaca, es necesario demostrar en ECA la eficacia y la seguridad a largo plazo de la EHH como alternativa a la estimulación del VD. Además, aún no se han definido los criterios de selección de los pacientes con más probabilidad de beneficiarse de la EHH.
- •
Para los pacientes con IC e indicación de TRC, es necesario demostrar en ECA la eficacia y la seguridad a largo plazo de la EHH como alternativa a la TRC o como parte de la TRC con estimulación biventricular. Tampoco se han definido los criterios de selección de los candidatos a TRC con más probabilidad de beneficiarse de la EHH.
- •
Se necesitan más estudios para determinar si la EHH podría mejorar la respuesta de los pacientes que no responden a la TRC.
- •
Queda por documentarse la eficacia y la seguridad de la estimulación de la región de la rama izquierda.
- •
No se ha documentado la superioridad de una ubicación específica para el cable de VD (es decir, septal, tracto de salida o apical) para la estimulación estándar para bradicardia o la TRC.
- •
Se necesita mejorar la predicción de quién desarrollará BAV después del TAVI.
- •
Para los pacientes sintomáticos con MCH terminal y BRI, es necesario definir mejor los criterios para implante de TRC y documentar las características clínicas asociadas con el beneficio del procedimiento.
- •
Debe investigarse el tratamiento óptimo, incluida la estimulación cardiaca, para los pacientes con BAV congénito.
- •
Para los candidatos a marcapasos que tengan miocardiopatías y supervivencia esperada > 1 año y no cumplan los criterios estándar para implante de DAI, se deben definir mejor los criterios para implantar un DAI en lugar de un marcapasos.
- •
Queda por determinar el tratamiento preoperatorio óptimo en el implante de DAI y la utilización de desinfección cutánea preoperatoria o la descolonización prehospitalaria de los portadores de S. aureus.
- •
Sigue sin establecerse el abordaje óptimo de los diferentes componentes del procedimiento de implante de DAI, especialmente en cuanto a elección del acceso venoso, los cables de fijación activos o pasivos en las cámaras del lado derecho, los sitios de estimulación específicos, la plicación de agentes hemostáticos en el bolsillo, los tipos de sutura y la aplicación de vendaje compresivo al final del procedimiento.
- •
Los pacientes con necesidad de estimulación cardiaca inmediata a veces presentan fiebre e infección; por lo general, el tratamiento incluye marcapasos transvenosos temporales y antibióticos, seguidos de implante de un marcapasos permanente una vez que se ha resuelto la infección. Se desconoce si el implante de un marcapasos permanente inmediatamente después de iniciar el tratamiento antibiótico sería lo adecuado.
- •
Se debe estudiar el papel de la educación del paciente, la atención centrada en el paciente y la toma de decisiones compartida en la población de pacientes con DAI.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Evaluación de pacientes con bradicardia o enfermedad del sistema de conducción sospechadas o documentadas | ||
| Monitorización | ||
| Se recomienda monitorización con ECG ambulatoria para la evaluación de pacientes con sospecha de bradicardia a fin de correlacionar las anomalías del ritmo con los síntomas | I | C |
| Masaje carotídeo | ||
| Se recomienda el MSC después de excluir estenosis carotídeac para pacientes con síncope de causa desconocida compatible con un mecanismo reflejo o síntomas relacionados con la presión/manipulación de la región del seno carotídeo | I | B |
| Prueba de esfuerzo | ||
| Se recomienda una prueba de esfuerzo para pacientes con síntomas sospechosos de bradicardia durante o inmediatamente después del esfuerzo | I | C |
| Imagen | ||
| Se recomiendan pruebas de imagen cardiaca para los pacientes con bradicardia sintomática sospechada o documentada para evaluar la presencia de cardiopatía estructural, determinar la función sistólica del VI y diagnosticar las posibles causas de las anomalías de la conducción | I | C |
| Pruebas de laboratorio | ||
| Además de las pruebas de laboratorio previas al implanted, se recomienda realizar pruebas específicas si hay sospecha clínica de posibles causas de bradicardia subyacentes (p. ej., pruebas de función tiroidea, título de Lyme, concentración de digitálicos, potasio, calcio y pH) para diagnosticar y tratar estas afecciones. | I | C |
| Evaluación del sueño | ||
| Se recomienda el cribado de SAS en pacientes con síntomas de SAS y cuando haya bradicardia grave o BAV avanzado durante el sueño | I | C |
| Recomendaciones sobre grabador en bucle implantable | ||
| Para los pacientes con síncope inexplicado poco frecuente (menos de una vez al mes) u otros síntomas que se sospecha causados por bradicardia cuya evaluación integral no ha podido demostrar una causa, se recomienda monitorización ambulatoria a largo plazo con GBI | I | A |
| Estimulación cardiaca para bradicardia y enfermedad del sistema de conducción | ||
| Para los pacientes con DNS y EAVB, se recomienda minimizar la estimulación ventricular innecesaria mediante la programación | I | A |
| La estimulación está indicada en la DNS cuando los síntomas puedan atribuirse claramente a bradiarritmias | I | B |
| Para los pacientes sintomáticos con DNS en forma de bradicardia-taquicardia, la estimulación está indicada para corregir las bradiarritmias y facilitar el tratamiento farmacológico, a menos que se prefiera la ablación de la taquiarritmia | I | B |
| No se recomienda la estimulación para los pacientes con bradiarritmias relacionadas con la DNS asintomáticas o que se deban a causas transitorias reversibles | III | C |
| Para los pacientes en RS con BAV permanente o paroxístico de segundo o tercer grado (avanzado o alto grado), infranodular 2:1, está indicada la estimulación independientemente de los síntomase | I | C |
| Para los pacientes con arritmia auricular (principalmente FA) y BAV permanente o paroxístico de tercer grado (avanzado o alto grado), está indicada la estimulación independientemente de los síntomas | I | C |
| Para lospacientes con FA permanente que necesiten un marcapasos, se recomienda la estimulación ventricular con respuesta en frecuencia | I | C |
| No se recomienda la estimulación para pacientes con BAV debido a causas transitorias que puedan corregirse y prevenirse | III | C |
| Para pacientes con síncope inexplicable y bloqueo bifascular, el marcapasos está indicado cuando el I-HV basal sea ≥ 70 ms o haya bloqueo intrahisiano o infrahisiano de segundo o tercer grado durante la estimulación auricular incremental o respuesta anormal al estrés farmacológico | I | B |
| La estimulación está indicada para los pacientes con BR alternante con o sin síntomas | I | C |
| No se recomienda la estimulación para los pacientes con BR asintomático o bloqueo bifascicular | III | B |
| Recomendaciones sobre la estimulación para el síncope reflejo | ||
| La estimulación cardiaca bicameral está indicada para reducir el síncope recurrente en pacientes mayores de 40 años con síncope recurrente, impredecible y grave que tengan:• Pausas asistólicas sintomáticas documentadas espontáneas > 3 s o pausas asintomáticas > 6 s por parada sinusal o BAV o• Síndrome del seno carotídeo cardioinhibitorio o• Síncope asistólico durante la basculación | I | A |
| La estimulación cardiaca no está indicada en ausencia de un reflejo cardioinhibitorio documentado | III | B |
| No se recomienda la estimulación cardiaca para pacientes con caídas inexplicadas en ausencia de cualquier otra indicación documentada | III | B |
| No se recomienda la estimulación cardiaca para pacientes con síncope inexplicado sin evidencia de DNS o anomalía de la conducción | III | C |
| TRC | ||
| Se recomienda la TRC para los pacientes sintomáticos con IC en RS que tengan FEVI ≤ 35%, QRS ≥ 150 ms y QRS con morfología de BRI a pesar del TMO con el fin de mejorar los síntomas y reducir la morbimortalidad | I | A |
| La TRC no está indicada para pacientes con IC y QRS < 130 ms que no tengan indicación de estimulación del VD | III | A |
| Para los pacientes con FA sintomática y frecuencia cardiaca incontrolada candidatos a ablación de la UAV (independientemente de la duración del QRS), se debe considerar TRC en caso de IC-FEr | I | B |
| Se recomienda la TRC en lugar de la estimulación del VD para los pacientes con IC-FEr (< 40%) independientemente de la clase funcional NYHA que tengan indicación de estimulación ventricular y BAV de alto grado, con el fin de reducir la morbilidad. Esto incluye a los pacientes con FA | I | A |
| Para los pacientes candidatos a DAI que tengan indicación de TRC, se recomienda el implante de TRC-D | I | A |
| Recomendaciones sobre la estimulación del haz de His | ||
| Para los pacientes tratados con EHH, se recomienda una programación del dispositivo adaptada a los requisitos específicos de la EHH | I | C |
| Estimulación en el infarto agudo de miocardio | ||
| Las recomendaciones para el implante de un marcapasos permanente son las mismas que para la población general (apartado 5.2) cuando el BAV no se resuelva tras una espera de al menos 5 días después del IM | I | C |
| No se recomienda estimulación cardiaca si el BAV se resuelve después de la revascularización o espontáneamente | III | B |
| Recomedaciones sobre la estimulación tras cirugía cardiaca y trasplante de corazón | ||
| En el BAV de alto grado o completo tras cirugía cardiaca, está indicado un periodo de observación clínica de al menos 5 días para evaluar si la alteración del ritmo es transitoria y se resuelve espontáneamente. No obstante, en caso de BAV completo con ritmo de escape bajo o nulo, el periodo de observación puede acortarse si la resolución espontánea es poco probable | I | C |
| Para los pacientes que requieren estimulación después de la sustitución mecánica de la válvula tricúspide, debe evitarse el implante de un cable de VD transvalvular | III | C |
| Recomendaciones sobre la estimulación cardiaca después del TAVI | ||
| Se recomienda la estimulación permanente para lospacientes con BAV completo o de alto grado que persista 24-48 h tras el TAVI | I | B |
| Se recomienda la estimulación permanente para los pacientes con BR alternante de nueva aparición después del TAVI | I | C |
| El implante profiláctico de marcapasos permanente antes del TAVI no está indicado para pacientes con BRD que no tengan indicación de marcapasos permanente | III | C |
| Recomendaciones sobre la estimulación cardiaca para pacientes con cardiopatía congénita | ||
| Para los pacientes con BAV congénito completo o de alto grado, se recomienda la estimulación cardiaca si se presenta uno de los siguientes factores de riesgo:a. Síntomasb. Pausas>3 veces la duración del ciclo del ritmo de escape ventricularc. Ritmo de escape con QRS anchod. Intervalo QT prolongadoe. Ectopia ventricular complejaf. Frecuencia cardiaca media diurna<50 lpm | I | C |
| Recomendaciones sobre estimulación cardiaca en enfermedades raras | ||
| Está indicada la estimulación permanente para pacientes con enfermedades neuromusculares como distrofia miotónica tipo 1 y cualquier tipo de BAV de segundo o tercer grado o I-HV ≥ 70 ms, con o sin síntomasf | I | C |
| Recomendaciones sobre el implante de dispositivos y el tratamiento perioperatorio | ||
| Se recomienda la administración preoperatoria de profilaxis antibiótica dentro de la primera hora de la incisión cutánea para reducir el riesgo de infección por DAI | I | A |
| No se recomienda el tratamiento puente con heparina para lospacientes anticoagulados | III | A |
| No se recomienda el implante de marcapasos permanente en pacientes febriles. Debe retrasarse el implante hasta que el paciente haya estado afebril al menos 24 h | III | B |
| Recomendaciones sobre resonancia magnética para pacientes portadores de marcapasos | ||
| Para los pacientes con sistemas de marcapasos compatibles con RM (sistemas condicionales)g, la RM es segura siguiendo las instrucciones del fabricante | I | A |
| Recomendaciones sobre la estimulación cardiaca temporal | ||
| Se recomienda la estimulación transvenosa temporal en casos de bradiarritmia con deterioro hemodinámico refractario a fármacos cronotrópicos intravenosos | I | C |
| Recomedaciones para cuando la estimulación cardiaca ya no está indicada | ||
| Cuando el marcapasos ya no esté indicado, la estrategia de tratamiento debe basarse en un análisis del riesgo-beneficio individual siguiendo un proceso de toma de decisiones compartida con el paciente | I | C |
| Recomendaciones sobre el segumiento del marcapasos y la terapia de resincronización cardiaca con marcapasos | ||
| Se recomienda la gestión del dispositivo a distancia para reducir el número de visitas de seguimiento presenciales a los pacientes portadores de marcapasos que tengan dificultades para acudir a la consulta médica (problemas de movilidad reducida o preferencias del paciente) | I | A |
| Se recomienda la monitorización a distancia en caso de que un componente del dispositivo se haya retirado del mercado o vaya a retirarse próximamente, para permitir la detección precoz de episodios, especialmente en los pacientes con mayor riesgo (como los dependientes de marcapasos) | I | C |
| Recomendaciones sobre la atención centrada en el paciente en estimulación cardiaca y terapia de resincronización cardiaca | ||
| Para los pacientes considerados para marcapasos o TRC, la decisión debe basarse en la mejor evidencia disponible teniendo en cuenta los riesgos-beneficios individuales de cada opción, las preferencias del paciente y los objetivos clínicos, y se recomienda seguir un abordaje integral utilizando los principios de la atención centrada en el paciente y la toma de decisiones compartida en la consulta | I | C |
FA: fibrilación auricular; BAV: bloqueo auriculoventricular; BR: bloqueo de rama; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; DAI: desfibrilador automático implantable; DNS: disfunción del nódulo sinusal; EAVB: estimulación auriculoventricular bicameral; ECG: electrocardiograma; EEF: estudio electrofisológico; FEVI: fracción de eyección del ventrículo izquierdo; GBI: grabador en bucle implantable; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; I-HV: intervalo His-ventrículo; IM: infarto de miocardio; MSC: masaje del seno carotídeo; NYHA: New York Heart Association; RM: resonancia magnética; RS: ritmo sinusal; SAS: síndrome de apnea del sueño; TAVI: implante percutáneo de válvula aórtica; TMO: tratamiento médico óptimo; TRC: terapia de resincronización cardiaca; TRC-D: terapia de resincronización cardiaca con desfibrilador; UAV: unión auriculoventricular; VD: ventrículo derecho; VI: ventrículo izquierdo.
No se debe realizar MSC a pacientes con accidente isquémico transitorio previo, accidente cerebrovascular o estenosis carotídea conocida. La auscultación carotídea debe realizarse antes del MSC. Si hay soplo carotídeo, se debe realizar una ecografía carotídea para excluir enfermedad de la carótida.
Hemograma completo, tiempo de protrombina, tiempo de tromboplastina parcial, creatinina sérica y electrolitos.
En QRS estrecho asintomático y BAV 2:1, se puede evitar la estimulación si hay sospecha clínica de bloqueo suprahisiano (se observa Wenckebach concomitante y el bloqueo desaparece con el esfuerzo) o si este se ha demostrado en el EEF.
El material adicional con figuras, tablas y texto adicionales está disponible, solo online y en inglés, en las páginas web de European Heart Journal y la ESC: https://www.escardio.org/Guidelines.
18INFORMACIÓN SOBRE LOS AUTORESFiliaciones de los autores del grupo de trabajo: Mads Brix Kronborg, Department of Cardiology, Aarhus University Hospital, Aarhus N, Dinamarca; Yoav Michowitz, Jesselson Integrated Heart Center, Faculty of Medicine, Hebrew University, Shaare Zedek Medical Center, Jerusalén, Israel; Angelo Auricchio, Department of Cardiology, Istituto Cardiocentro Ticino, Lugano, Suiza; Israel Moshe Barbash, Leviev Heart Center, Sheba Medical Center, Sackler Faculty of Medicine, Tel Aviv University, Ramat Gan, Israel; José A. Barrabés, Departmento de Cardiología, Hospital Universitari Vall d’Hebron, Universitat Autonoma de Barcelona, CIBERCV, Barcelona, España; Giuseppe Boriani, Cardiology Division, Department of Biomedical, Metabolic and Neural Sciences, University of Modena and Reggio Emilia, Módena, Italia; Frieder Braunschweig, Department of Cardiology, Karolinska University Hospital, Estocolmo, Suecia; Michele Brignole, Cardiology, IRCCS Istituto Auxologico Italiano, Milán, Italia; Haran Burri, Cardiology, University Hospital of Geneva, Ginebra, Suiza; Andrew J.S. Coats, Faculty of Medicine, University of Warwick, Coventry, Reino Unido; Jean-Claude Deharo, Cardiology La Timone, Aix Marseille Université, Marsella, Francia; Victoria Delgado, Cardiology, Leiden University Medical Center, Leiden, Países Bajos; Gerhard-Paul Diller, Department of Cardiology III, Adult Congenital and Valvular Heart Disease, University Hospital Muenster, Muenster, Alemania; Carsten W. Israel, Department of Medicine-Cardiology, Diabetology and Nephrology, Bethel-Clinic, Bielefeld, Alemania; Andre Keren, Cardiology, Hadassah-Hebrew University Hospital, Jerusalén, Israel; Reinoud E. Knops, Cardiology and Electrophysiology, Amsterdam University Medical Center, Ámsterdam, Países Bajos; Dipak Kotecha, Institute of Cardiovascular Sciences, University of Birmingham, Birmingham, Reino Unido; Christophe Leclercq, Department of Cadiology, Rennes University Hospital, Rennes, Francia; Béla Merkely, Heart and Vascular Center, Semmelweis University, Budapest, Hungría; Christoph Starck, Department of Cardiothoracic & Vascular Surgery, German Heart Center Berlin, Berlín, Alemania; Ingela Thylén, Department of Health, Medicine and Caring Sciences, Linköping University, Linköping, Suecia; José Maria Tolosana, Sección de Arritmias, Instituto Cardiovascular, Hospital Clínic, Universidad de Barcelona, Barcelona, España.
Grupo de Documentos Científicos de la ESC. Incluye los Revisores del documento y las Sociedades Cardiacas Nacionales de la ESC
Revisores del documento: Francisco Leyva (coordinador de revisión de CPG) (Reino Unido), Cecilia Linde (coordinadora de revisión de GPC) (Suecia), Magdy Abdelhamid (Egipto), Victor Aboyans (Francia), Elena Arbelo (España), Riccardo Asteggiano (Italia), Gonzalo Baron-Esquivias (España), Johann Bauersachs (Alemania), Mauro Biffi (Italia), Ulrika Birgersdotter-Green (Estados Unidos), Maria Grazia Bongiorni (Italia), Michael A. Borger (Alemania), Jelena Celutkiene (Lituania), Maja Cikes (Croacia), Jean-Claude Daubert (Francia), Inga Drossart (Bélgica), Kenneth Ellenbogen (Estados Unidos), Perry M. Elliott (Reino Unido), Larissa Fabritz (Reino Unido), Volkmar Falk (Alemania), Laurent Fauchier (Francia), Francisco Fernández-Avilés (España), Dan Foldager (Dinamarca), Fredrik Gadler (Suecia), Pastora Gallego Garcia De Vinuesa (España), Bulent Gorenek (Turquía), Jose M. Guerra (España), Kristina Hermann Haugaa (Noruega), Jeroen Hendriks (Países Bajos), Thomas Kahan (Suecia), Hugo A. Katus (Alemania), Aleksandra Konradi (Rusia), Konstantinos C. Koskinas (Suiza), Hannah Law (Reino Unido), Basil S. Lewis (Israel), Nicholas John Linker (Reino Unido), Maja-Lisa Løchen (Noruega), Joost Lumens (Países Bajos), Julia Mascherbauer (Austria), Wilfried Mullens (Bélgica), Klaudia Vivien Nagy (Hungría), Eva Prescott (Dinamarca), Pekka Raatikainen (Finlandia), Amina Rakisheva (Kazajistán), Tobias Reichlin (Suiza), Renato Pietro Ricci (Italia), Evgeny Shlyakhto (Rusia), Marta Sitges (España), Miguel Sousa-Uva (Portugal), Richard Sutton (Mónaco), Piotr Suwalski (Polonia), Jesper Hastrup Svendsen (Dinamarca), Rhian M. Touyz (Reino Unido), Isabelle C. Van Gelder (Países Bajos), Kevin Vernooy (Países Bajos), Johannes Waltenberger (Alemania), Zachary Whinnett (Reino Unido) y Klaus K. Witte (Reino Unido).
Sociedades nacionales de la ESC que han participado activamente en el proceso de revisón de la GPC ESC 2021 sobre estimulación cardiaca y terapia de resincronización cardiaca: Argelia: Algerian Society of Cardiology, Brahim Kichou; Armenia: Armenian Cardiologists Association, Armen Khachatryan; Austria: Austrian Society of Cardiology, Daniel Scherr; Bielorrusia: Belorussian Scientific Society of Cardiologists, Alexandr Chasnoits; Bélgica: Belgian Society of Cardiology, Georges H. Mairesse; Bosnia-Herzegovina: Association of Cardiologists of Bosnia and Herzegovina, Mugdim Bajric; Bulgaria: Bulgarian Society of Cardiology, Vasil Velchev; Croacia: Croatian Cardiac Society, Vedran Velagic; Chipre: Cyprus Society of Cardiology, Elias Papasavvas; República Checa: Czech Society of Cardiology, Milos Taborsky; Dinamarca: Danish Society of Cardiology, Michael Vinther; Egipto: Egyptian Society of Cardiology, John Kamel Zarif Tawadros; Estonia: Estonian Society of Cardiology, Jüri Voitk; Finlandia: Finnish Cardiac Society, Jarkko Karvonen; Francia: French Society of Cardiology, Paul Milliez; Georgia: Georgian Society of Cardiology, Kakhaber Etsadashvili; Alemania: German Cardiac Society, Christian Veltmann; Grecia: Hellenic Society of Cardiology, Nikolaos Fragakis; Hungría: Hungarian Society of Cardiology, Laszlo Alajos Gellér; Irlanda: Irish Cardiac Society, Richard Sheahan; Israel: Israel Heart Society, Avishag Laish-Farkash; Italia: Italian Federation of Cardiology, Massimo Zecchin; Kazajistán: Association of Cardiologists of Kazakhstan, Ayan Abdrakhmanov; República de Kosovo: Kosovo Society of Cardiology, Ibadete Bytyci; Kirguistán: Kyrgyz Society of Cardiology, Kurbanbek Kalysov; Letonia: Latvian Society of Cardiology, Oskars Kalejs; Líbano: Lebanese Society of Cardiology, Bernard Abi-Saleh; Lituania: Lithuanian Society of Cardiology, Germanas Marinskis; Luxemburgo: Luxembourg Society of Cardiology, Laurent Groben; Malta: Maltese Cardiac Society, Mark Adrian Sammut; República de Moldavia: Moldavian Society of Cardiology, Mihail Rizov; Montenegro: Montenegro Society of Cardiology, Mihailo Vukmirovic; Marruecos: Moroccan Society of Cardiology, Rachida Bouhouch; Países Bajos: Netherlands Society of Cardiology, Mathias Meine; Macedonia del Norte: North Macedonian Society of Cardiology, Lidija Poposka; Noruega: Norwegian Society of Cardiology, Ole Christian Mjølstad; Polonia: Polish Cardiac Society, Maciej Sterlinski; Portugal: Portuguese Society of Cardiology, Natalia Antonio; Rumanía: Romanian Society of Cardiology, Calin Siliste; Federación Rusa: Russian Society of Cardiology, Sergey Valentinovich Popov; San Marino: San Marino Society of Cardiology, Roberto Bini; Serbia: Cardiology Society of Serbia, Goran Milasinovic; Eslovaquia: Slovak Society of Cardiology, Peter Margitfalvi; Eslovenia: Slovenian Society of Cardiology, Igor Zupan; España: Sociedad Española de Cardiología, Óscar Cano; Suecia: Swedish Society of Cardiology, Rasmus Borgquist; Suiza: Swiss Society of Cardiology, Tobias Reichlin; República de Siria: Syrian Cardiovascular Association, Ahmad Rasheed Al Saadi; Túnez: Tunisian Society of Cardiology and Cardio-Vascular Surgery, Abdeddayem Haggui; Turquía: Turkish Society of Cardiology, Ilyas Atar; Reino Unido e Irlanda del Norte: British Cardiovascular Society, Anthony W.C. Chow.
Comité de la ESC para las Guías de Práctica Clínica: Colin Baigent (moderador) (Reino Unido), Magdy Abdelhamid (Egipto), Victor Aboyans (Francia), Sotiris Antoniou (Reino Unido), Elena Arbelo (España), Riccardo Asteggiano (Italia), Andreas Baumbach (Reino Unido), Michael A. Borger (Alemania), Jelena Celutkiene (Lituania), Maja Cikes (Croacia), Jean-Philippe Collet (Francia), Volkmar Falk (Alemania), Laurent Fauchier (Francia), Chris P. Gale (Reino Unido), Sigrun Halvorsen (Noruega), Bernard Iung (Francia), Tiny Jaarsma (Suecia), Aleksandra Konradi (Rusia), Konstantinos C. Koskinas (Suiza), Dipak Kotecha (Reino Unido), Ulf Landmesser (Alemania), Basil S. Lewis (Israel), Ales Linhart (República Checa), Maja-Lisa Løchen (Noruega), Lis Neubeck (Reino Unido), Jens Cosedis Nielsen (Dinamarca); Steffen E. Petersen (Reino Unido), Eva Prescott (Dinamarca), Amina Rakisheva (Kazajstán), Marta Sitges (España) y Rhian M. Touyz (Reino Unido).
Filiaciones de los autores/miembros del Grupo de Trabajo: véase la información sobre los autores.Comité de la ESC para las Guías de Práctica Clínica (GPC): la lista de los miembros se recoge en el apéndice.Entidades de la ESC que han participado en la elaboración de este documento:Asociaciones: Association for Acute CardioVascular Care (ACVC), Association of Cardiovascular Nursing & Allied Professions (ACNAP), European Association of Cardiovascular Imaging (EACVI), European Association of Percutaneous Cardiovascular Interventions (EAPCI), European Heart Rhythm Association (EHRA), Heart Failure Association (HFA).Consejos: Council for Cardiology Practice, Council on Basic Cardiovascular Science, Council on Cardiovascular Genomics, Council on Hypertension, Council on Stroke.Grupos de Trabajo: Adult Congenital Heart Disease, Cardiac Cellular Electrophysiology, Cardiovascular Regenerative and Reparative Medicine, Cardiovascular Surgery, e- Cardiology, Myocardial and Pericardial Diseases.Foro de PacientesEl contenido de esta GPC de la ESC se publica para uso personal y educativo solamente. No se autoriza su uso comercial. No se autoriza la traducción o reproducción de ningún fragmento de esta guía sin la autorización escrita de la ESC. La autorización se solicitará por escrito a Oxford University Press, editorial de European Heart Journal, o a los representantes autorizados de la ESC (journals.permissions@oup.com).Descargo de responsabilidad. Esta guía recoge la opinión de la ESC y se ha elaborado tras el estudio minucioso de los datos y la evidencia disponibles hasta la fecha. La ESC no es responsable en caso de que exista alguna contradicción, discrepancia o ambigüedad entre la GPC de la ESC y cualquier otra recomendación oficial o GPC publicada por autoridades relevantes de la sanidad pública, particularmente en lo que se refiere al buen uso de la atención sanitaria y las estrategias terapéuticas. Se espera que los profesionales de la salud tengan en consideración esta GPC a la hora de tomar decisiones clínicas, así como al implementar estrategias médicas preventivas, diagnósticas o terapéuticas. No obstante, esta guía no anula la responsabilidad individual de cada profesional al tomar las decisiones oportunas relativas a cada paciente, de acuerdo con dicho paciente y, cuando fuera necesario, con su tutor o representante legal. Además, las GPC de la ESC no eximen al profesional médico de su obligación ética y profesional de consultar y considerar atentamente las recomendaciones y GPC actualizadas emitidas por autoridades sanitarias competentes. Es también responsabilidad del profesional verificar la normativa y la legislación sobre fármacos y dispositivos médicos a la hora de prescribirlos.Este artículo se publica simultáneamente en European Heart Journal y EP Europace.©The European Society of Cardiology 2020. Reservados todos los derechos. Los artículos de ambas revistas son idénticos excepto en diferencias estilísticas menores de cada revista; se pueden citar indistintamente. Para la solicitud de autorizaciones, contacte con: journals.permissions@oup.com.Todos los expertos involucrados en la redacción de esta guía han presentado declaraciones de conflicto de intereses. Las declaraciones de conflicto de intereses se han recopilado en un documento adicional publicado simultáneamente a esta guía. Este documento está disponible en la página web de la ESC: www.escardio.org/guidelines.El material adicional incluye más información sobre los antecedentes y una discusión detallada de los datos que han servido de base para la elaboración de la guía; solo está disponible online y en inglés en la página web de European Heart Journal.Palabras clave: Estimulación cardiaca; Terapia de resincronización cardiaca; Marcapasos; Insuficiencia cardiaca; Síncope; Fibrilación auricular; Estimulación del sistema de conducción; Indicaciones para la estimulación cardiaca; Estimulación cardiaca en sitios alternativos; Complicaciones; Estimulación cardiaca en TAVI; Bradicardia; Estimulación cardiaca temporal.