Las guías de práctica clínica (GPC) tienen como objetivo reunir y evaluar toda la evidencia relevante disponible para ayudar a los profesionales de la salud a seleccionar la mejor estrategia posible de tratamiento para un paciente en particular, que sufre una enfermedad determinada. Las GPC y sus recomendaciones deben ayudar a los profesionales de la salud en la toma de decisiones clínicas en su ejercicio diario. No obstante, la decisión final sobre un paciente concreto la debe tomar el profesional responsable de la salud, en consulta con el propio paciente y, si fuera necesario, con su representante legal.
En los últimos años, la Sociedad Europea de Cardiología (ESC), además de otras sociedades y organizaciones científicas, han publicado un gran número de GPC. Debido al impacto de las GPC, se han establecido criterios de calidad para su elaboración de modo que todas las decisiones se presenten de manera clara y transparente al usuario. Las recomendaciones de la ESC para la elaboración y publicación de las GPC están disponibles en la sección de guías de la página web de la ESC (https://www.escardio.org/Guidelines/Clinical-Practice-Guidelines/Guidelines-development/Writing-ESC-Guidelines). Las GPC representan la postura oficial de la ESC sobre un tema particular y se actualizan con regularidad.
Además de publicar las GPC, la ESC lleva a cabo el EurObservational Research Programme de registros internacionales de enfermedades cardiovasculares e intervenciones que resultan imprescindibles para la evaluación, los diagnósticos/tratamientos, el uso de fuentes y seguimiento de las GPC. El objetivo de estos registros es una mejor comprensión de la práctica clínica en Europa y el mundo basada solo en información de alta calidad recogida durante la práctica clínica habitual.
Más aún, la ESC ha desarrollado e incluido en sus GPC un conjunto de indicadores de calidad como medio para evaluar el grado de implementación de las GPC que pueden servir a la ESC, los hospitales, los profesionales clínicos y los sanitarios para evaluar la práctica clínica y también serían útiles en programas educativos, junto con mensajes clave de las GPC, para mejorar los cuidados y los desenlaces clínicos.
Los miembros de este Grupo de Trabajo, entre los que se incluyen representantes de los grupos de subespecialidades, fueron seleccionados por la ESC en representación de los profesionales de la salud dedicados a los cuidados médicos de la patología tratada en el presente documento. Los expertos seleccionados realizaron una revisión exhaustiva de la evidencia publicada sobre el diagnóstico, el tratamiento y la prevención de esta entidad concreta según las normas establecidas por el Comité de la ESC para la Elaboración de GPC. Se realizó una evaluación crítica de los procedimientos diagnósticos y terapéuticos, además de la relación entre el riesgo y el beneficio. Se valoraron el nivel de evidencia y la fuerza de la recomendación de una opción terapéutica particular de acuerdo con escalas predefinidas, tal como se indica más adelante.
Los expertos responsables de la redacción y la revisión del presente documento han declarado por escrito cualquier relación que se pueda considerar conflicto de intereses real o potencial. Estas declaraciones escritas están archivadas y disponibles en la página web de la ESC (http://www.escardio.org/guidelines) y además se han recopilado en un informe y se han publicado en un documento suplementario paralelo a estas GPC.
Este proceso asegura la transparencia y previene sesgos potenciales en los procesos de redacción y revisión. Durante el periodo de redacción, las modificaciones en las relaciones que se pudiera considerar conflicto de intereses se notificaron a la ESC y se actualizaron. El informe del Grupo de Trabajo fue financiado en su totalidad por la ESC y se desarrolló sin ninguna participación de la industria.
El Comité para la elaboración de GPC de la ESC supervisó y coordinó la preparación de esta nueva edición. El Comité también es responsable del proceso de aprobación de las GPC. Expertos externos realizaron una revisión exhaustiva del documento, tras lo cual fue aprobado por todos los miembros del Grupo de Trabajo. Por último, el documento final fue aprobado por el Comité de GPC de la ESC para su publicación en European Heart Journal. La guía se desarrolló tras la evaluación exhaustiva de los datos científicos, el conocimiento médico y la evidencia disponible en el momento de su elaboración.
La tarea de desarrollar las GPC de la ESC también incluye la creación de instrumentos educativos y la implementación de las recomendaciones a través de programas, entre los que se incluye la versión de bolsillo de las GPC, resúmenes en diapositivas, folletos con mensajes clave para un público no especialista y versiones electrónicas para aplicaciones digitales (smartphones, etc.). Estas versiones están resumidas y, para obtener información más detallada, el usuario siempre debe acceder al texto completo de las GPC, que está disponible gratuitamente en las páginas web de la ESC y European Heart Journal. Los programas de implementación son necesarios porque se ha comprobado que la aplicación de recomendaciones clínicas puede favorecer el resultado de las enfermedades.
Se anima a los profesionales de la salud a considerar de forma plena las GPC durante el ejercicio profesional según su criterio clínico, así como en la determinación e implantación de estrategias preventivas, diagnósticas o terapéuticas. Sin embargo, las GPC no invalidan de ninguna manera la responsabilidad individual de los profesionales de la salud a la hora de tomar las decisiones apropiadas y precisas teniendo en consideración el estado de salud de cada paciente, en consulta con este o con su tutor o representante legal cuando se apropiado o necesario. También es responsabilidad del profesional de la salud comprobar la normativa aplicable a fármacos y dispositivos médicos antes de su prescripción.
2INTRODUCCIÓNLa incidencia y la tasa de mortalidad de la enfermedad ateroesclerótica (EA) se encuentran en declive en muchos países europeos, pero todavía son una causa importante de morbilidad y mortalidad. Los principales factores de riesgo de EA se han identificado en las últimas décadas. La manera más importante de prevenir la EA es la promoción de un estilo de vida saludable de por vida, en especial evitando el tabaquismo. Se han desarrollado tratamientos efectivos y seguros de los factores de riesgo y la mayoría de los fármacos son actualmente genéricos y están disponibles a un bajo precio. Sin embargo, la prevalencia de estilos de vida poco saludables es todavía alta y los factores de riesgo de EA están generalmente mal tratados, incluso en pacientes considerados en alto riesgo (residual) de enfermedades cardiovasculares (ECV).1 Esta guía versa sobre la prevención de eventos cardiovasculares reduciendo las ECV.
2.1Definición y justificaciónLa presente GPC se ha desarrollado para apoyar los esfuerzos de los profesionales de la salud para reducir la carga de EA tanto de los pacientes individuales como poblacional. La anterior guía europea sobre prevención de ECV en la práctica clínica se publicó en 20162. Los últimos avances en la predicción de los factores de riesgo y los beneficios del tratamiento de las ECV y los nuevos tratamientos y objetivos terapéuticos precisaban de una guía nueva y actualizada. La presente guía sobre la prevención de la enfermedad cardiovascular en la práctica clínica se centra, aunque no exclusivamente, en los factores de riesgo, la clasificación del riesgo y la prevención de la EA.
La presente guía facilita recomendaciones sobre la prevención de la EA que apoyan la toma de decisiones conjunta entre paciente y profesional de la salud según las características individuales de cada paciente. Se ha prestado especial atención a las diferencias de edad, sexo y género, expectativa de vida, perfiles de factores de riesgo, etnia y localización geográfica. La estimación del riesgo cardiovascular no solo de personas aparentemente sanas, sino también de edad avanzada o con EA establecida o diabetes mellitus (DM), aporta información para la adaptación de intervenciones individuales. Los objetivos terapéuticos pueden personalizarse a cada caso con un enfoque gradual. El riesgo cardiovascular «residual» se define como la estimación del riesgo tras los cambios iniciales en el estilo de vida y el tratamiento de los factores de riesgo, y se aplica principalmente a pacientes con EA establecida. Para pacientes jóvenes y aparentemente sanos, la estimación del riesgo cardiovascular de por vida está disponible para respaldar decisiones terapéuticas y reemplaza a los algoritmos de estimación a 10 años, que sistemáticamente estiman un riesgo bajo a 10 años aun en presencia de factores de alto riesgo. Para una población envejecida, las decisiones terapéuticas requieren una escala de riesgo cardiovascular específica, que tenga en consideración el riesgo competitivo no cardiovascular, así como consideraciones terapéuticas sobre el colesterol unido a lipoproteínas de baja densidad (cLDL) y la presión arterial (PA). La estimación en pacientes individuales de los beneficios de por vida con la deshabituación tabáquica y la disminución del cLDL y la PA es una oportunidad para comunicar los beneficios del tratamiento de forma que sea fácil de entender. Las decisiones terapéuticas personalizadas que utilizan las estimaciones de riesgo de ECV y un enfoque gradual del tratamiento son más complejas que una estrategia única y uniforme, pero reflejan la diversidad de pacientes y características individuales de la práctica clínica.
Sobre el control del cLDL, la PA y la glucemia en pacientes con DM, los objetivos se mantienen como los recomendados en las recientes guías de práctica clínica de la ESC3–5. Estas GPC sobre prevención proponen un nuevo enfoque gradual para la intensificación del tratamiento como medio para que pacientes y profesionales de la salud puedan trabajar para la consecución de los objetivos con una estrategia que se adapte a cada paciente y sus preferencias. Sin embargo, cabe destacar que nuevas evidencias y consensos pueden haber dado lugar a diferencias con las recientes guías específicas de la ESC. También se incluyen las nuevas evidencias sobre las pautas de tratamiento antitrombótico para la prevención de la EA, así como aspectos específicos del sexo.
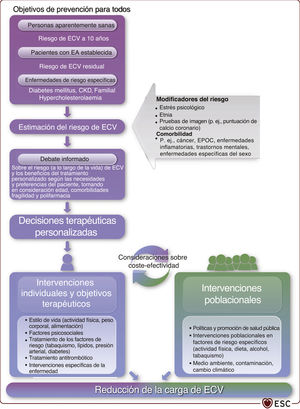
La prevención de la EA requiere un enfoque integrado e interdisciplinario que incluya aportaciones de distintas disciplinas y áreas de especialización. Se debe trabajar conjuntamente centrándose en los pacientes y sus familias para tratar cada uno de los componentes básicos para la prevención y la rehabilitación, como la modificación del estilo de vida, los factores psicosociales, el tratamiento de los factores de riesgo y los determinantes sociales (ilustración central).
2.2DesarrolloEl Comité de la ESC para la elaboración de GPC designó a los coordinadores y los miembros del Grupo de Trabajo. A cada miembro del Grupo de Trabajo se le asignó una tarea de redacción específica, que revisaron otros escritores de (sub)secciones, los coordinadores de la sección y los coordinadores de las GPC. El texto se desarrolló a lo largo de 11 meses, durante los cuales los miembros del Grupo de Trabajo se reunieron en 3 ocasiones y mantuvieron una correspondencia constante entre reuniones. El panel de revisores estuvo compuesto por expertos seleccionados de todas las sociedades científicas que participaron en el desarrollo de estas GPC, no solo de la ESC.
2.3RentabilidadEl Grupo de Trabajo reconoce que los presupuestos para sanidad muchas veces están limitados y, por lo tanto, ciertas recomendaciones y objetivos no siempre son factibles. Sin embargo, la presente GPC no aporta análisis de rentabilidad. Las enormes diferencias nacionales y regionales en los presupuestos y gastos asociados tanto con intervenciones como con enfermedades/eventos imposibilitan análisis de rentabilidad universales. Pero algunas recomendaciones claramente tienen un impacto económico, ya sea en coste individual para los pacientes o en el presupuesto. Algunas de estas recomendaciones están relacionadas con diagnósticos (p. ej., uso a gran escala de pruebas de imagen caras, como la tomografía computarizada [TC]) y otras, a intervenciones (p. ej., fármacos caros, como los nuevos hipolipemiantes o antidiabéticos). No es apropiado implementar «incondicionalmente» susodichas recomendaciones sin considerar primero su rentabilidad a escala nacional o regional o, mejor aún, llevar a cabo análisis reales sobre rentabilidad con datos específicos por país y límites de rentabilidad.
2.4Qué hay de nuevo en la edición de 2021?Las nuevas recomendaciones y los conceptos revisados se presentan en la tabla 3.
3FACTORES DE RIESGO Y CUADROS CLÍNICOS3.1Población de interés para la evaluación del riesgo cardiovascularLa evaluación o el cribado del riesgo cardiovascular pueden ser oportunistas o sistemáticos. El cribado oportunista, es decir, el cribado sin una estrategia predefinida, se lleva a cabo cuando la persona acude a consulta por otro motivo. El cribado sistemático puede ser de la población general como parte de un programa de cribado, citando y volviendo a citar a los pacientes, o de subpoblaciones diana, como pacientes con DM2 o antecedentes familiares de ECV prematura. El cribado sistemático tiene como resultado mejoras en los factores de riesgo, pero no en los desenlaces de la ECV6–9. El cribado oportunista de factores de riesgo de EA, como la PA o los lípidos, es efectivo para aumentar las tasas de detección y se recomienda, aunque su beneficio en los desenlaces clínicos no está claro10.
Los programas estructurados de cribado a escala nacional para identificar y tratar los factores de riesgo de EA no documentada en adultos de más de 40 años sin DM o EA han demostrado un mejor control de los factores de riesgo, pero los resultados en desenlaces clínicos son contradictorios11,12. Una estrategia de alto riesgo basada en invitar a la población con pronóstico de mayor riesgo según una escala del riesgo integrada podría ser igualmente efectiva en la prevención de nuevos casos de ECV y reduciría los costes13. Un gran ensayo con ecografía móvil para el cribado de aneurismas aórticos, enfermedad arterial periférica (EAP) e hipertensión en varones de 65-74 años mostró una reducción de la mortalidad del 7% a los 5 años14.
Una crítica generalizada a los cribados es el potencial efecto dañino de los falsos positivos y los falsos negativos. Sin embargo, la evidencia sobre los cribados de ECV muestran que los pacientes no informan de malestar psíquico15–18.
La evaluación sistemática del riesgo de ECV entre la población general (varones mayores de 40 años y mujeres mayores de 50) sin factores de riesgo cardiovascular conocidos no parece ser rentable para reducir los futuros eventos vasculares y las muertes prematuras, al menos en el seguimiento a corto plazo, pero aumenta la detección de factores de riesgo cardiovascular. La evaluación del riesgo no se lleva a cabo una única vez y debería repetirse, por ejemplo, cada 5 años, aunque no existen datos empíricos para determinar los intervalos.
3.2Factores de riesgo y clasificación del riesgo3.2.1Factores de riesgoLos principales factores de riesgo de EA modificables, descubiertos por casualidad, son la apolipoproteína B que contiene lipoproteínas (de las cuales las lipoproteínas de baja densidad [LDL] son las más abundantes), la PA elevada, el tabaquismo (fumar cigarrillos) y la DM.
| Nuevas secciones |
|---|
| Sección 3 |
| 3.2.2. Sexo, género y sus efectos en la salud |
| 3.2.3. Clasificación del riesgo de enfermedad ateroesclerótica |
| 3.2.3.1. Enfoque gradual para el tratamiento de los factores de riesgo y la intensificación del tratamiento |
| 3.2.3.2. Estimación del riesgo en personas aparentemente sanas |
| 3.2.3.3. Traslado del riesgo cardiovascular a los umbrales de tratamiento |
| 3.2.3.4. Estimación del riesgo y tratamiento de los factores de riesgo para personas aparentemente sanas de 50-69 años |
| 3.2.3.5. Estimación del riesgo y tratamiento de los factores de riesgo para personas aparentemente sanas de 70 o más años |
| 3.2.3.6. Estimación del riesgo y tratamiento de los factores de riesgo para personas aparentemente sanas menores de 50 años |
| 3.2.3.7. Estimación del riesgo y tratamiento de los factores de riesgo para personas con enfermedad ateroesclerótica establecida |
| 3.2.4. Comunicación del riesgo cardiovascular |
| 3.3.1. Factores psicosociales |
| 3.3.4. Fragilidad |
| 3.3.8. Exposición medioambiental |
| 3.4. Cuadros clínicos |
| 3.4.2. Fibrilación auricular |
| 3.4.3. Insuficiencia cardiaca |
| 3.4.5. Enfermedad pulmonar obstructiva crónica |
| 3.4.6. Enfermedades inflamatorias |
| 3.4.7. Infecciones (virus de la inmunodeficiencia humana, gripe, periodontitis) |
| 3.4.8. Migrañas |
| 3.4.9. Trastornos del sueño y apnea obstructiva del sueño |
| 3.4.10. Trastornos mentales |
| 3.4.11. Esteatosis hepática no alcohólica |
| 3.4.12. Enfermedades específicas del sexo |
| Sección 4 |
| 4.10. Tratamiento antiinflamatorio |
| Conceptos nuevos/revisados |
| Sección 3 |
| Tablas de riesgo SCORE-2 y SCORE2-OP para la EA mortal y no mortal (infarto de miocardio, ictus) |
| Estimación total del riesgo de ECV a 10 años en personas aparentemente sanas de 50-69 años |
| Estimación del riesgo de por vida en personas aparentemente sanas menores de 50 años |
| Estimación del riesgo de ECV a 10 años en personas aparentemente sanas de 70 o más años |
| Umbrales de riesgo de ECV a 10 años, según SCORE-2 y SCORE2-OP, para definir el riesgo de bajo a moderado, alto y muy alto en personas aparentemente sanas de distintos grupos etarios (< 50, 50-69 y ≥ 70 años) |
| Estimación del riesgo de ECV a 10 años en pacientes con ECV establecida o DM |
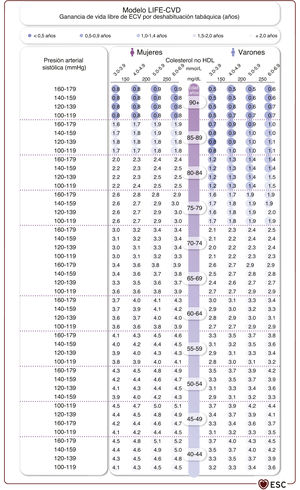
| Beneficios de por vida de la deshabituación tabáquica y la reducción del cLDL y la PAS (secciones 3 y 4) |
| Enfoque gradual para la consecución de los objetivos terapéuticos fundamentales (secciones 3 y 4) |
| Comunicar al paciente los riesgos de ECV y los beneficios del tratamiento de manera comprensible |
| Enfoque gradual para el tratamiento de los factores de riesgo y la intensificación del tratamiento |
| Sección 4 |
| Abordaje explícito de la rentabilidad (a escala local, regional o nacional) antes de la implementación de ciertas recomendaciones |
| Determinación del perfil lipídico no en ayunas (sección 4.6.11) |
| Enfoque gradual para la consecución de los objetivos terapéuticos (secciones 3 y 4) |
| Tratamientos antiinflamatorios para pacientes en muy alto riesgo |
| Sección 5 |
| Consideración de las intervenciones poblacionales para mitigar los efectos de la contaminación en la salud cardiovascular |
| Sección 6 |
| Tratamiento del riesgo de ECV específicas. Esta sección trata la prevención cardiovascular en presencia de ciertas enfermedades y busca prevenir la aparición o empeoramiento de comorbilidades preexistentes que podrían aumentar el riesgo de ECV general |
| Las subsecciones son: 6.1. Enfermedad coronaria; 6.2. Insuficiencia cardiaca; 6.3. Enfermedades cerebrovasculares; 6.4. Enfermedad arterial de las extremidades inferiores; 6.5. Insuficiencia renal crónica; 6.6. Fibrilación auricular, y 6.7. Multimorbilidad |
cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; EA: enfermedad aterosclerótica; PAS: presión arterial sistólica; SCORE2-OP: Systematic Coronary Risk Estimation 2-Older Persons; SCORE2: Systemic Coronary Risk Estimation 2.
Recomendaciones sobre la evaluación de la ECV
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda la evaluación CV sistemática completa para personas con cualquier factor de riesgo vascular mayor (p. ej., antecedentes familiares de ECV prematura, HF, factores de riesgo de ECV como tabaquismo, hipertensión arterial, DM, hiperlipemia, obesidad o comorbilidades que aumenten el riesgo de ECV) | I | C |
| Se puede considerar la evaluación sistémica u oportunista del riesgo CV en varones mayores de 40 años y mujeres mayores de 50 o posmenopáusicas de la población general sin factores de riesgo de EA conocidos9 | IIb | C |
| Se puede considerar una revaluación tras 5 años (o antes si el riesgo se acerca a los umbrales de tratamiento) para todas persona que haya pasado un cribado de riesgo de ECV durante un cribado oportunista | IIb | C |
| Se debe considerar el cribado oportunista de la PA en adultos con riesgo de hipertensión, como aquellos con sobrepeso o antecedentes familiares de hipertensión conocidos19 | IIa | B |
| No se recomienda la evaluación sistemática del riesgo CV en varones mayores de 40 años y mujeres mayores de 50 años sin factores de riesgo CV conocidos9 | III | C |
CV: cardiovascular; DM: diabetes mellitus; EA: enfermedad ateroesclerótica; ECV: enfermedad cardiovascular; HF: hipercolesterolemia familiar; PA: presión arterial.
a Clase.
b Nivel de evidencia.
Otro importante factor de riesgo es la obesidad, que aumenta el riesgo de ECV a través de los factores de riesgo significativos convencionales y otros mecanismos. Además, existen otros factores de riesgo relevantes, factores modificadores y cuadros clínicos que se abordan junto con los factores modificadores del riesgo cardiovascular y los cuadros clínicos (secciones 3.3 y 3.4).
3.2.1.1ColesterolEl papel causal del cLDL y otras lipoproteínas que contienen apolipoproteína B en el desarrollo de la EA se ha demostrado indudablemente con estudios genéticos, observacionales y clínicos de intervención20. Los principales atributos del cLDL como factor de riesgo de EA son:
- •
Los valores de cLDL más bajo durante más tiempo se asocian con menos riesgo de EA en toda la franja estudiada y los resultados de los ensayos controlados aleatorizados (ECA) indican que reducir el cLDL reduce de forma segura el riesgo de ECV incluso con valores de cLDL bajos (p. ej., cLDL < 1,4mmol/l [55mg/dl])20.
- •
La reducción relativa del riesgo de ECV es proporcional al valor absoluto del cambio en el cLDL, independientemente del tratamiento farmacológico para conseguir tal cambio21.
- •
El beneficio absoluto de reducir el cLDL depende del riesgo absoluto de EA y la reducción absoluta de cLDL, por lo que incluso una pequeña reducción absoluta en el cLDL puede ser beneficiosa para un paciente con riesgo alto o muy alto22.
- •
El colesterol no unido a lipoproteínas de alta densidad (HDL) incluye todas las lipoproteínas aterogénicas (que contienen apolipoproteína B) y se calcula de la siguiente forma: colesterol total–cHDL=colesterol no HDL. La relación entre el colesterol no HDL y el riesgo de ECV es al menos tan fuerte como la relación con el cLDL. La concentración de colesterol no HDL es, en esencia, la misma información que una determinación de la concentración plasmática de apolipoproteína B23,24. Los datos de colesterol no HDL se usan en las tablas de riesgo Systemic Coronary Risk Estimation 2 (SCORE2) y SCORE2-Older Persons (SCORE2-OP).
El cHDL está en relación inversa con el riesgo de ECV. Valores de cHDL extremadamente altos indicarían un aumento del riesgo de ECV. Sin embargo, no hay evidencia de ensayos de aleatorización mendeliana o ensayos aleatorizados de inhibidores de la proteína de transferencia de ésteres de colesterol de que concentraciones de cHDL elevadas reduzcan el riesgo de ECV25–28. Aun así, el cHDL es un biomarcador útil para ajustar la estimación del riesgo con las tablas SCORE2. Las tablas SCORE2 no pueden aplicarse a pacientes con dislipemias genéticas, como la hipercolesterolemia familiar (HF). Se recomiendan umbrales y objetivos de cLDL específicos, cualquiera sea el riesgo cardiovascular estimado, para pacientes con HF u otras dislipemias raras/genéticas.
3.2.1.2Presión arterialEstudios longitudinales, estudios genéticos epidemiológicos y ECA han demostrado que la PA elevada es una causa importante tanto de EA como de ECV ateroesclerótica (especialmente insuficiencia cardiaca [IC]), que en el mundo causa 9,4 millones de muertes y el 7% del total de años de vida ajustados por discapacidad29. La PA elevada es un factor de riesgo de enfermedad coronaria (EC), IC, enfermedad cerebrovascular, enfermedad arterial de las extremidades inferiores (EAEI), insuficiencia renal crónica (IRC) y fibrilación auricular (FA). El riesgo de muerte por EC o ictus aumenta de modo lineal con el aumento por encima de los 90 mmHg de PA sistólica (PAS) y a partir de 75mmHg de PA diastólica (PAD)30,31. El beneficio absoluto de reducir la PAS depende del riesgo absoluto y la reducción absoluta de la PAS, con la salvedad de que los parámetros más bajos de PAS están condicionados por la tolerabilidad y la seguridad. El tratamiento está determinado por la categoría de hipertensión (óptima, normal, normal-alta, etapas 1 a 3 e hipertensión sistólica aislada), definida según los valores medios de PA determinada sentado en consulta, con monitorización ambulatoria de la PA (MAPA) con dispositivo o la automedición domiciliaria de la presión arterial (AMPA) (véase la sección 4.7). La evidencia indica que la evolución de la PA durante toda la vida es distinta en mujeres que en varones, lo que puede tener como resultado potencial un aumento del riesgo de ECV con parámetros de PA menores32–34. Las tablas SCORE2 no pueden aplicarse a pacientes con causas secundarias o formas raras de hipertensión tales como el hiperaldosteronismo primario.
3.2.1.3TabaquismoEl tabaquismo causa el 50% de todas las muertes evitables en fumadores, la mitad de ellas por EA. Un fumador de por vida tiene un 50% de probabilidades de morir por el tabaquismo y, de media, perderá unos 10 años de vida35. El riesgo cardiovascular de los fumadores mayores de 50 años es 5 veces mayor que el de los no fumadores36. El tabaquismo de larga duración es más nocivo para las mujeres que para los varones37. En el mundo, justo tras la PAS alta, el tabaquismo es el principal factor de años de vida ajustados por discapacidad38. El tabaquismo pasivo se asocia con un aumento del riesgo de ECV39. Ciertos tabacos sin combustión también se asocian con un aumento del riesgo de ECV40.
3.2.1.4Diabetes mellitusLa DM1, la DM2 y la prediabetes son factores independientes de riesgo de EA y casi lo duplican, dependiendo de la población y el control terapéutico41. Parece que las mujeres con DM2 tienen más riesgo de ictus42. Es muy probable que los pacientes con DM2 tengan múltiples factores de riesgo de EA (como dislipemia e hipertensión), cada uno de los cuales media en el aumento del riesgo tanto ateroesclerótico como no ateroesclerótico.
3.2.1.5ObesidadEn las últimas décadas, el índice de masa corporal (IMC), medido como el peso (enkg) dividido por el cuadrado de la estatura (en metros), de niños, adolescentes y adultos ha aumentado sustancialmente en todo el mundo43. Los análisis mendelianos aleatorizados muestran una relación lineal entre el IMC y la mortalidad en no fumadores y una relación en forma de J en personas que han fumado44. La mortalidad por todas las causas es menor con un IMC de 20-25 en personas aparentemente sanas, con una relación en forma de J o en forma de U45,46. Hay evidencias de una paradoja de la obesidad en pacientes con IC, con un menor riesgo de mortalidad en pacientes con mayor IMC. Un metanálisis concluyó que tanto el IMC como la circunferencia de la cintura tienen similar asociación, firme y continua, con la EA y la DM247.
3.2.2Sexo, género y sus efectos en la saludLa presente guía sobre prevención reconoce la importancia de incorporar el sexo, el género y la identidad de género a la evaluación del riesgo y el tratamiento clínico y terapéutico de los pacientes y grupos poblacionales. Estas GPC también reconocen la complejidad de la interrelación entre estos conceptos y la salud, tanto cardiovascular como psicológica. En este momento, no existe en la ESC una posición específica sobre qué terminología utilizar. Según la Organización Mundial de la Salud (OMS), el sexo hace referencia a «las características biológicas que definen a los seres humanos como hombre o mujer. Estos conjuntos de características biológicas tienden a diferenciar a los humanos como hombres o mujeres, pero no son mutuamente excluyentes, ya que hay individuos que poseen ambos»48.
Este concepto debe distinguirse del género, que hace referencia a «los roles, las características y oportunidades definidos por la sociedad que se consideran apropiados»48. La definición de Global Health 50/50 especifica que el género «es también producto de las relaciones entre las personas y puede reflejar la distribución de poder entre ellas. No es un concepto estático, sino que cambia con el tiempo y el lugar»49.
En esta GPC se han incluido los casos en que haya evidencia del impacto del sexo en los modificadores del riesgo o cuando existan estrategias clínicas para enfermedades específicas del sexo50. La influencia del género en la experiencia individual y el acceso a los servicios de salud es primordial50. Por lo tanto, las preocupaciones específicas sobre la salud relacionadas con el género también se reconocen en esta GPC.
Al parecer, los efectos epigenéticos de los constructos sociales condicionan el traslado del sexo biológico a la fisiopatología de la enfermedad. Más aún, los constructos sociales también pueden ser determinantes en el acceso a los servicios de salud, su utilización, la percepción de la enfermedad, la toma de decisiones y puede que hasta la respuesta terapéutica50, lo que incluye el campo de la prevención de las ECV y la EA. Hay investigaciones en curso, pero también lagunas en la evidencia, y así se reconoce en estas GPC.
Algunos ejemplos de temas específicos en los que se han estudiado las diferencias fisiológicas, patológicas y clínicas en relación con el sexo y el género son la fracción de eyección del ventrículo izquierdo (FEVI), las reacciones farmacológicas adversas y las tendencias y la concienciación sobre los factores de riesgo de EA51–58 o las diferencias entre los sexos en el tratamiento y los desenlaces tras el síndrome coronario agudo (SCA)59.
3.2.3Clasificación del riesgo de enfermedad ateroescleróticaLa presente guía sobre prevención cardiovascular en la práctica clínica se centra principalmente, aunque no en exclusiva, en la prevención del riesgo de EA. Esto incluye factores de riesgo, predicción del riesgo, factores modificadores del riesgo y enfermedades que generalmente aumentan la posibilidad de EA.
Identificar a los pacientes que más puedan beneficiarse del tratamiento de los factores de riesgo de EA es esencial para las estrategias para prevenirla. Por norma general, cuanto más alto sea el riesgo absoluto de ECV, más alto será también el beneficio de tratar los factores de riesgo y, por lo tanto, menor será el número de pacientes que es necesario tratar para prevenir un evento cardiovascular durante cierto periodo de tiempo60,61. Con estos datos, la estimación del riesgo de ECV sigue siendo la piedra angular de esta guía, y por ello aparece al frente de todas las estrategias terapéuticas, que se resumen en los diagramas de flujo.
La edad es el principal factor de riesgo de ECV. Las mujeres menores de 50 años y los varones menores de 40 presentan, casi siempre, bajo riesgo de ECV a 10 años, pero pueden presentar factores de riesgo modificables que aumenten considerablemente el riesgo de ECV a largo plazo. Por el contrario, los varones de más de 65 años y las mujeres de más de 75 presentan casi siempre un alto riesgo de ECV a 10 años. Solo en las mujeres de 55-75 años y los varones de 40-65 varían los umbrales de riesgo de ECV utilizados en general para la intervención. La división entre grupos etarios < 50, 50-69 y ≥ 70 años se debería utilizar con sentido común y flexibilidad. Se puede considerar distintas franjas de edad para varones y mujeres, que pueden ser distintos según la región geográfica. También se debería considerar la incertidumbre en la estimación del riesgo.
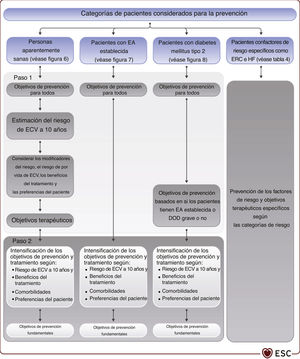
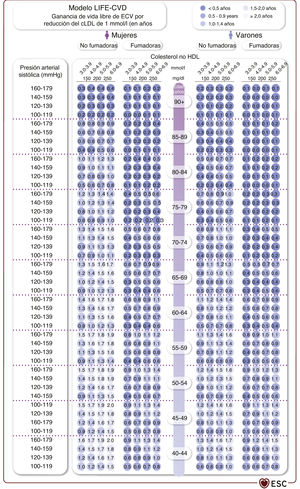
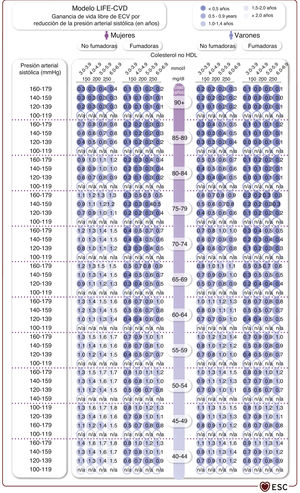
El riesgo de ECV también se puede evaluar en pacientes con DM2 o con EA establecida. Las poblaciones o grupos de pacientes cuyo riesgo cardiovascular se debe considerar se resumen en la tabla 4. La estimación de riesgo de ECV de por vida está disponible para distintos grupos de pacientes y permite la estimación de los beneficios de por vida de intervenciones preventivas como la deshabituación tabáquica (véase la sección 4.5.1), la hipolipemia (véase la sección 4.6.2.1) y el tratamiento de la PA (véase la sección 4.7.5.2). La estimación del riesgo y los beneficios de por vida se puede utilizar en la comunicación para la toma de decisiones conjunta, además de con la consideración de las comorbilidades, la fragilidad y las preferencias del paciente para iniciar (paso 1) e intensificar (paso 2) el tratamiento de los factores de riesgo (figura 2).
Clases de recomendación.
| Clases de recomendación | Definición | Expresión propuesta |
|---|---|---|
| Clase I | Evidencia y/o acuerdo general en que un determinado tratamiento o procedimiento es beneficioso, útil y efectivo | Se recomienda o está indicado |
| Clase II | Evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia de un tratamiento o procedimiento | |
| Clase IIa | El peso de la evidencia/opinión esta a favor de la utilidad/eficacia | Se debe considerar |
| Clase IIb | La utilidad/eficacia esta menos establecida por la evidencia/opinión | Se puede considerar |
| Clase III | Evidencia o acuerdo general en que un tratamiento o procedimiento no es útil/efectivo y en algunos casos puede ser perjudicial | No se recomienda |
Niveles de evidencia.
| Nivel de evidencia A | Datos procedentes de múltiples ensayos clínicos aleatorizados o metanálisis |
|---|---|
| Nivel de evidencia B | Datos procedentes de un único ensayo clínico aleatorizado o de grandes estudios no aleatorizados |
| Nivel de evidencia C | Consenso de opinión de expertos y/o pequeños estudios, estudios retrospectivos, registros |
Qué hay de nuevo en la edición de 2021.
| Nuevo o revisado | Recomendaciones de la versión de 2013 | Clase | Recomendaciones en la versión de 2021 | Clase |
|---|---|---|---|---|
| Factores de riesgo y cuadros clínicos–sección 3 | ||||
| Nuevo | Para toda persona aparentemente sana menor de 70 años sin EA establecida, DM, ERC o trastornos raros/genéticos de la PA, se recomienda la estimación del riesgo de ECV mortal y no mortal a 10 años con las tablas SCORE2 | I | ||
| Nuevo | Se recomienda la estimación del riesgo de ECV mortal y no mortal a 10 años con las tablas SCORE2-OP para toda persona aparentemente sana de 70 o más años sin EA establecida, DM, ERC o trastornos raros/genéticos de la PA | I | ||
| Nuevo | Se debe considerar en alto o muy alto riesgo a los pacientes con EA establecida, DM, nefropatía de moderada a grave, trastornos raros/genéticos de la PA | I | ||
| Nuevo | Para las personas aparentemente sanas con riesgo alto o muy alto de EA o con EA establecida o DM, se recomienda la intensificación del tratamiento con un enfoque por pasos que busque el tratamiento intensivo de los factores de riesgo tomando en consideración el riesgo de ECV, el beneficio del tratamiento de los factores de riesgo, los modificadores del riesgo, las comorbilidades y las preferencias del paciente | I | ||
| Nuevo | Para las personas aparentemente sanas sin DM, ERC, trastornos genéticos/raros de la PA o los lípidos que tengan una puntuación de riesgo de ECV muy alta (SCORE2 ≥ 7,5% para menores de 50 años, SCORE2 ≥ 10% para los de 50-69 años y SCORE2-OP ≥ 15% para los de 70 o más), se recomienda el tratamiento de los factores de riesgo de EA | I | ||
| Nuevo | Se recomienda un debate informado y ajustado a las necesidades del paciente sobre el riesgo de ECV y los beneficios del tratamiento | I | ||
| Nuevo | Se recomienda considerar la influencia de los trastornos mentales tanto con deterioro funcional significativo como disminución del uso de los servicios de salud | I | ||
| Nuevo | Para las personas aparentemente sanas sin DM, ERC, trastornos genéticos/raros de la PA o los lípidos que tengan un riesgo de ECV alto (SCORE2 2,5-< 7,5% para los menores de 50 años; SCORE2 5-< 10% para los de 50-69; SCORE2-OP 7,5-<15% para los 70 o más), se debe considerar el tratamiento de los factores de riesgo de EA tomando en consideración los factores de riesgo de EA modificables, el beneficio del tratamiento y las preferencias del paciente | IIa | ||
| Nuevo | Para personas aparentemente sanas, se debe considerar el riesgo de por vida y el beneficio terapéutico, los factores de riesgo modificables, la fragilidad, la polifarmacia y las preferencias del paciente tras una estimación del riesgo de ECV mortal y no mortal a 10 años | IIa | ||
| Nuevo | Se debe considerar la migraña con aura en la evaluación del riesgo de ECV | IIa | ||
| Nuevo | Se debe considerar la evaluación del riesgo de ECV de los varones con DE | IIa | ||
| Nuevo | Para las mujeres con antecedentes de parto prematuro o muerte fetal, se puede considerar el cribado periódico de hipertensión y DM | IIb | ||
| Nuevo | Para los adultos con enfermedades inflamatorias, se puede considerar la evaluación completa de riesgo de ECV | IIb | ||
| Nuevo | Para las mujeres con migraña con aura, se puede considerar la evitación de anticonceptivos hormonales combinados | IIb | ||
| Factores de riego e intervenciones individuales–sección 4 | ||||
| Nuevo | Se recomienda reducir el sedentarismo y practicar una actividad física al menos ligera durante el día para reducir la mortalidad general y la mortalidad y la morbilidad cardiovasculares | I | ||
| Nuevo | Se recomienda adoptar una dieta mediterránea o similar para reducir el riesgo de ECV | I | ||
| Nuevo | Se recomienda restringir el consumo de alcohol a un máximo de 100g a la semana | I | ||
| Nuevo | Se recomienda el consumo de pescado, especialmente graso, al menos 1 vez a la semana y restringir el consumo de carne (procesada) | I | ||
| Nuevo | Los pacientes con trastornos mentales necesitan una intensificación de la atención y del apoyo para mejorar la adherencia a los cambios en el estilo de vida y al tratamiento farmacológico | I | ||
| Nuevo | Se recomienda la deshabituación tabáquica independientemente de la ganancia de peso, ya que esta no disminuye los beneficios en la EA con la deshabituación tabáquica | I | ||
| Nuevo | Para los pacientes con EA establecida, se recomienda un tratamiento hipolipemiante con un objetivo fundamental <1,4mmol/l (55mg/dl) y una reducción del cLDL ≥ 50% en comparación con los valores basales | I | ||
| Nuevo | Se recomienda tratamiento combinado con un inhibidor de PCSK9 en prevención secundaria para los pacientes que no alcanzan los objetivos terapéuticos con estatinas y ezetimiba | I | ||
| Nuevo | Para los pacientes con DM2 y muy alto riesgo (p. ej., EA establecida, DOD), se recomienda el tratamiento hipolipemiante intensivo, con un objetivo fundamental de reducción del cLDL ≥ 50% y cLDL <1,4mmol/l (<55mg/dl) | I | ||
| Nuevo | Para los pacientes con DM2 mayores de 40 años en alto riesgo, se recomienda un tratamiento hipolipemiante con un objetivo fundamental de reducción del cLDL ≥ 50% y cLDL <1,8mmol/(<70mg/dl) | I | ||
| Nuevo | Para todos los pacientes, se recomienda que el primer objetivo terapéutico sea reducir la PA a <140/90mmHg y luego adaptar los objetivos a la edad y las comorbilidades específicas | I | ||
| Nuevo | Para los pacientes de 18-69 años en tratamiento, se recomienda un objetivo fundamental de PAS de 120-130mmHg | I | ||
| Nuevo | Para todo paciente de 70 o más años en general, se recomienda reducir la PAS a <140 e incluso 130mmHg si se tolera | I | ||
| Nuevo | Para todo paciente en tratamiento, se recomienda reducir la PAD a <80mmHg | I | ||
| Nuevo | Para las personas con DM2 y EA, se recomienda el tratamiento con un aGLP-1 o un iSGLT2 con beneficios probados para reducir los eventos cardiovasculares y cardiorrenales | I | ||
| Nuevo | Para las personas con DM2 y EA, se recomienda el tratamiento con un iSGLT2 para reducir los eventos cardiovasculares y cardiorrenales | I | ||
| Nuevo | Para las personas con DM2 e IC-FEr, se recomienda el tratamiento con un iSGLT2 con beneficios probados para disminuir las hospitalizaciones por IC y la muerte cardiovascular | I | ||
| Nuevo | Para los pacientes que han sufrido eventos de EA o revascularización y los pacientes con IC (principalmente IC-FEr), se recomienda la inclusión en programas de rehabilitación cardiaca y pevención basada en ejercicio estructurados, completos y con supervisión médica para mejorar los resultados | I | ||
| Nuevo | Se debe considerar las intervenciones en el estilo de vida, con educación grupal o individual, estrategias de cambio de la conducta, asesoramiento telefónico y uso de dispositivos de registro de actividad para mejorar la práctica de AF | IIa | ||
| Nuevo | Para los pacientes obesos con alto riesgo, se debe considerar la cirugía bariátrica cuando los cambios en el estilo de vida no resulten en pérdida de peso | IIa | ||
| Nuevo | Se debe derivar a los pacientes con EA y estrés a psicoterapia para el tratamiento del estrés para mejorar los desenlaces de la ECV y reducir los síntomas del estrés | IIa | ||
| Nuevo | Para los pacientes con SCC y depresión mayor de moderada a grave, se debe considerar el tratamiento antidepresivo con ISRS | IIa | ||
| Nuevo | Para las personas aparentemente sanas menores de 70 años con muy alto riesgo, se debe considerar un objetivo fundamental de cLDL <1,4mmol/l (55mg/dl) y una reducción ≥ 50% de los valores basales de cLDL | IIa | ||
| Nuevo | Para personas aparentemente sanas menores de 70 años con muy alto riesgo, se debe considerar un objetivo fundamental de cLDL <1,8mmol/l (70mg/dl) y una reducción ≥ 50% de los valores basales de cLDL | IIa | ||
| Nuevo | Para las personas motivadas a intentarlo, se debe considerar una gran pérdida de peso con dietas hipocalóricas seguidas de reincorporación de alimentos y fases de mantenimiento del peso, ya que puede llevar a la remisión de la DM | IIa | ||
| Nuevo | Para los pacientes con DM2 y DOD, se puede considerar el tratamiento con un iSGLT2 o un aGLP-1 con beneficios probados en los desenlaces para la reducción de la mortalidad total por ECV | IIb | ||
| Nuevo | Para los pacientes con muy alto riesgo sin HF, se puede considerar un tratamiento combinado que incluya un inhibidor de PCSK9 en prevención primaria si el objetivo de cLDL no se alcanza con la dosis máxima tolerada de estatinas y ezetimiba | IIb | ||
| Nuevo | Para los pacientes con riesgo alto (o superior) y triglicéridos > 1,5mmol/l (135mg/dl) independientemente del tratamiento con estatinas y las medidas tomadas en el estilo de vida, se pueden considerar los AGP omega 3 (2 icosapento de etilo 2 g/día) | IIb | ||
| Nuevo | Para los pacientes de 70 más años, se puede considerar el inicio de tratamiento con estatinas en prevención primaria si están en riesgo alto (o superior) | IIb | ||
| Nuevo | Para los menores de 40 años con DM1 o DM2 y evidencia de DOD o cLDL > 2,6mmol/l (100 mg/dl), se puede considerar el tratamiento con estatinas, a menos que se prevea una gestación | IIb | ||
| Nuevo | Para pacientes con DM y riesgo alto o muy alto, se puede considerar una dosis baja de ácido acetilsalicílico en prevención primaria en ausencia de contraindicaciones claras | IIb | ||
| Nuevo | Se puede considerar la rehabilitación cardiaca en el hogar, la telemedicina y las intervenciones con dispositivos móviles para la salud para aumentar la participación de los pacientes y la adherencia a conductas saludables a largo plazo | IIb | ||
| Nuevo | Para los pacientes con IC y depresión mayor, no se recomiendan los ISRS, IRSN ni los antidepresivos tricíclicos | III | ||
| Nuevo | Para los pacientes con ERC dependiente de diálisis sin EA, no se recomienda iniciar el tratamiento con estatinas | III | ||
| Políticas de intervención poblacional–sección 5 | ||||
| Nuevo | Se recomienda implementar medidas para reducir la contaminación atmosférica, como la emisión de partículas y el uso de combustibles fósiles, y limitar las emisiones de dióxido de carbono para reducir la mortalidad y la morbilidad cardiovasculares | I | ||
| Gestión del riesgo cardiovascular específico por enfermedad–sección 6 | ||||
| Nuevo | Para los pacientes con IC, se recomienda la inclusión en un programa de RC integral para reducir el riesgo de hospitalización y muerte por IC | I | ||
| Nuevo | Para los pacientes con IC, se recomienda el cribado de comorbilidades cardiovasculares como no cardiovasculares; de hallarse, se debe tratarlas siempre que existan intervenciones seguras y efectivas, no solo para paliar los síntomas, sino también para mejorar el pronóstico | I | ||
| Nuevo | Para los pacientes con eventos cerebrovasculares, se recomiendan mejoras en el estilo de vida junto con el tratamiento farmacológico apropiado | I | ||
| Nuevo | Se recomienda identificar y tratar los factores de riesgo y las enfermedades concomitantes como parte integral del tratamiento de los pacientes con FA | I | ||
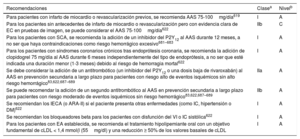
| Nuevo | Para los pacientes con un riesgo isquémico alto y sin riesgo hemorrágico, se debe considerar la adición de un segundo antitrombótico (un inhibidor de P2Y12 o una dosis baja de rivaroxabán) al ácido acetilsalicílico en prevención secundaria a largo plazo | IIa | ||
| Nuevo | Para los pacientes con DM y EAEI sintomática crónica sin riesgo hemorrágico, se puede considerar la combinación de una dosis baja de rivaroxabán (2,5mg 2 veces al día) y ácido acetilsalicílico (100 mg 1 vez al día) | IIb | ||
| Nuevo | Para los pacientes con riesgo moderado de eventos isquémicos y sin riesgo hemorrágico, se puede considerar la adición de un segundo antitrombótico al ácido acetilsalicílico en prevención secundaria a largo plazo | IIb | ||
| Factores de riesgo y cuadros clínicos–sección 3 | ||||
| Revisado | En la evaluación del riesgo cardiovascular, se puede considerar el ITB como un factor modificador del riesgo | IIb | No se recomienda determinar sistemáticamente modificadores del riesgo como puntuaciones de riesgo, biomarcadores en sangre u orina, pruebas vasculares o pruebas de imagen (más allá de la puntuación de CAC o la ecografía carotídea para la detección de placas) | III |
| Factores de riesgo e intervenciones individuales–sección 4 | ||||
| Revisado | Para todo paciente con hipertensión de grado 1 o 2 y riesgo cardiovascular, se debe considerar el tratamiento farmacológico | IIa | Se recomienda iniciar el tratamiento basado en el riesgo de ECV absoluto, la estimación de los beneficios de por vida y la presencia de daño orgánico mediado por hipertensión para la hipertensión de grado 1 | I |
| Revisado | Para los pacientes con DM2 y ECV, se debe considerar el tratamiento con un iSGLT2 al inicio de la enfermedad para reducir el riesgo de ECV y la mortalidad total | IIba | Para los pacientes con DM2 y EA, se recomienda el tratamiento con un aGLP-1 o un iSGLT2 con beneficios probados en los desenlaces para reducir el riesgo cardiovascular o los eventos cardiorrenales | I |
AF: actividad física; aGLP-1: agonistas del péptido similar al glucagón tipo 1 (GLP-1); CAC: calcio coronario; cLDL: colesterol unido a lipoproteínas de baja densidad; DE: disfunción eréctil; DM: diabetes melltius; EA: enfermedad ateroesclerótica; EAEI: enfermedad arterial de las extremidades inferiores; ERC: enfermedad renal crónica; FA: fibrilación auricular; HF: hipercolesterolemia familiar; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; IRSN: inhibidores selectivos de la recaptación de serotonina y norepinefrina; iSGLT2: inhibidores del cotransportador 2 de sodio y glucosa; ISRS: inhibidores selectivos de la recaptación de serotonina; ITB: índice tobillo-brazo; PA: presión arterial; PAS: presión arterial sistólica; PCSK9: proproteína convertasa subtilisina/kexina 9; RC: rehabilitación cardiaca; SCC: síndrome coronario crónico; SCORE2: Systematic Coronary Risk Estimation 2; SCORE2-OP: Systematic Coronary Risk Estimation 2-Older Persons.
Categorías de pacientes y riesgo cardiovascular asociado.
| Categorías de pacientes | Subgrupos | Categorías de riesgo | Estimación del riesgo de ECV y el beneficio terapéutico |
|---|---|---|---|
| Personas aparentemente sanas | |||
| Personas sin EA establecida, diabetes mellitus, enfermedad renal crónica o hipercolesterolemia familiar | <50 años | Riesgo de bajo a alto | Estimación del riesgo de ECV a 10 años (SCORE 2). Estimación del riesgo a lo largo de la vida y el beneficio del tratamiento (p. ej., con el modelo LIFE-CVD) para facilitar la comunicación del riesgo de ECV y los beneficios del tratamiento |
| 50-69 años | Riesgo de alto a muy alto | Estimación del riesgo de ECV a 10 años (SCORE 2). Estimación del riesgo a lo largo de la vida y el beneficio del tratamiento (p. ej., con el modelo LIFE-CVD) para facilitar la comunicación del riesgo de ECV y los beneficios del tratamiento | |
| ≥70 años | Riesgo de alto a muy alto | Estimación del riesgo de ECV a 10 años (SCORE 2). Estimación del riesgo a lo largo de la vida y el beneficio del tratamiento (p. ej., con el modelo LIFE-CVD) para facilitar la comunicación del riesgo de ECV y los beneficios del tratamiento | |
| Pacientes con ERC | |||
| ERC sin diabetes o EA | ERC moderada (TFGe 30-40ml/min/1,73 m2 y cociente albúmina/creatinina <30 o TFGe 45-59ml/min/1,73 m2 y cociente albúmina/creatinina 30-300 o TFGe ≥ 60ml/min/1,73 m2 y cociente albúmina/creatinina > 300) | Riesgo alto | No se aplica |
| ERC grave (TFGe<30ml/min/1,73 m2 o TFGe 30-44ml/min/1,73 m2 y cociente albúmina/creatinina>30) | Riesgo muy alto | No se aplica | |
| Hipercolesterolemia familiar | |||
| Asociada con cifras de colesterol extremadamente altas | No se aplica | Riesgo alto | No se aplica |
| Pacientes con DM2 | |||
| Los pacientes con DM1 mayores de 40 años también se pueden clasificar según estos criterios | Pacientes con DM bien controlada de corta duración (p. ej., <10 años) sin evidencia de DOD ni otros factores de riesgo de EA | Riesgo moderado | No se aplica |
| Pacientes con DM sin EA o DOD grave que no cumplan los criterios de factores de riesgo moderado | Riesgo alto | Estimación del riesgo residual a 10 años tras objetivos de prevención generales (p. ej., con la puntuación de riesgo ADVANCE o el modelo DIAL). Se debe considerar la estimación del riesgo cardiovascular y los beneficios de por vida (p. ej., modelo DIAL). | |
| Pacientes diabéticos con EA establecida o DOD grave87,93-95:• TFGe<45ml/min/1,73 m2 independientemente de la albuminuria• TFGe 45-59ml/min/1,73 m2 y microalbuminuria (cociente albúmina/creatinina 30-300mg/g)• Proteinuria (cociente albúmina/creatinina>300mg/g)• Presencia de enfermedad microvascular en al menos 3 localizaciones (p. ej., microalbuminuria y retinopatía más neuropatía) | Riesgo muy alto | Estimación del riesgo de ECV residual a 10 años tras objetivos de prevención generales (p. ej., con la puntuación de riesgo ADVANCE o el modelo DIAL). Se debe considerar la estimación del riesgo cardiovascular y los beneficios de por vida del tratamiento de los factores de riesgo (p. ej., modelo DIAL) | |
| Pacientes con EA establecida | |||
| EA documentada por clínica o técnicas de imagen inequívocas. La EA documentada por clínica incluye anteriores IAM, SCA, revascularización coronaria y otros procedimientos de revascularización arterial, ictus y AIT, aneurisma aórtico y EAP. La EA documentada inequívocamente en pruebas de imagen incluye placas en la angiografía o la ecografía carotídea o en la angio-TC. No incluye algunos aumentos en técnicas de imagen continua tales como el grosor intimomedial carotídeo | No se aplica | Riesgo muy alto | Estimación del riesgo de ECV residual tras objetivos de prevención (p. ej., riesgo a 10 años con la puntuación de riesgo SMART para pacientes con EC establecida o con riesgo a 1 o 2 años en la puntuación EUROASPIRE para pacientes con EC). Se debe considerar la estimación del riesgo de ECV de por vida y los beneficios del tratamiento de los factores de riesgo (p. ej., modelo SMART-REACH; o modelo DIAL en presencia de DM) |
ADVANCE: Action in Diabetes and Vascular disease: preterAx and diamicroN-MR Controlled Evaluation; AIT: accidente isquémico transitorio; angio-TC: angiografía por tomografía computarizada; DIAL: Diabetes lifetime-perspective prediction; DM: diabetes mellitus¸EA: enfermedad ateroesclerótica; ECV: enfermedad cardiovascular; ERC: enfermedad renal crónica; HF: hipercolesterolemia familiar; IAM: infarto agudo de miocardio; LIFE-CVD: LIFEtime-perspective CardioVascular Disease; PAS: presión arterial sistólica; REACH: Reduction of Atherothrombosis for Continued Healt; SCA: síndrome coronario agudo; SCORE: Systematic Coronary Risk Estimation; SMART: Secondary Manifestations of Arterial Disease; TC: tomografía computarizada; TFGe: tasa de filtrado glomerular estimada.
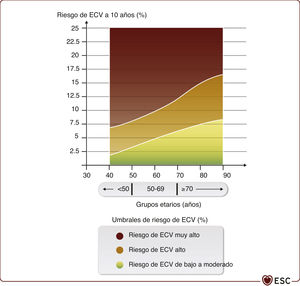
Categorías de riesgo cardiovascular de las personas aparentemente sanas para su edad según SCORE2 y SCORE-OP.
| <50 años | 50-69 años | ≥70 añosa | |
|---|---|---|---|
| Riesgo de ECV de bajo a moderado: por norma general no se recomienda el tratamiento de los factores de riesgo | <2,5% | <5% | <7,5% |
| Riesgo de ECV alto: se debe considerar el tratamiento de los factores de riesgo | 2,5-<7,5% | 5-<10% | 7,5-<15% |
| Riesgo de ECV muy alto: por norma general, se recomienda el tratamiento de los factores de riesgoa | ≥7,5% | ≥10% | ≥15% |
ECV: enfermedad cardiovascular.
aPara las personas aparentemente sanas de edad ≥ 70 años, las recomendaciones de tratamiento hipolipemiante son de clase IIb («se puede considerar»).
La división de la población en 3 grupos etarios (<50, 50-69 y ≥ 70 años) tiene como resultado un aumento discontinuo de los umbrales de riesgo en los riesgos de bajo a moderado, alto y muy alto. En realidad, la edad es obviamente un continuo, y una aplicación sensata de los umbrales en la práctica clínica requiere cierta flexibilidad para tratar los umbrales según los pacientes envejezcan o se acerquen al umbral del siguiente grupo etario. La figura 5 muestra cómo el aumento continuo de la edad se relaciona con un aumento de los umbrales de riesgo y puede servir de guía para la práctica diaria.
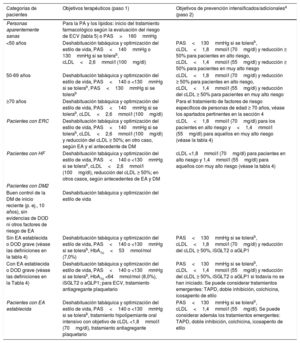
Objetivos terapéuticos para distintas categorías de pacientes.
| Categorías de pacientes | Objetivos terapéuticos (paso 1) | Objetivos de prevención intensificados/adicionalesa (paso 2) |
|---|---|---|
| Personas aparentemente sanas | Para la PA y los lípidos: inicio del tratamiento farmacológico según la evaluación del riesgo de ECV (tabla 5) o PAS>160mmHg | |
| <50 años | Deshabituación tabáquica y optimización del estilo de vida, PAS<140mmHg o 130mmHg si se tolerab, cLDL<2,6mmol/l (100mg/dl) | PAS<130mmHg si se tolerab, cLDL<1,8mmol/l (70mg/dl) y reducción ≥ 50% para pacientes en alto riesgo, cLDL<1,4mmol/l (55mg/dl) y reducción ≥ 50% para pacientes en muy alto riesgo |
| 50-69 años | Deshabituación tabáquica y optimización del estilo de vida, PAS<140 o <130mmHg si se tolerab, PAS<130mmHg si se tolerab | cLDL<1,8mmol/l (70mg/dl) y reducción ≥ 50% para pacientes en alto riesgo, cLDL<1,4mmol/l (55mg/dl) y reducción del cLDL ≥ 50% para pacientes en muy alto riesgo |
| ≥70 años | Deshabituación tabáquica y optimización del estilo de vida, PAS<140mmHg si se tolerab, cLDL<2,6mmol/l (100mg/dl) | Para el tratamiento de factores de riesgo específicos de personas de edad ≥ 70 años, véase los apartados pertinentes en la sección 4 |
| Pacientes con ERC | Deshabituación tabáquica y optimización del estilo de vida, PAS<140mmHg si se tolerab, cLDL<2,6mmol/l (100mg/dl) y reducción del cLDL ≥ 50%; en otro caso, según EA y el antecedente de DM | cLDL<1,8mmol/l (70mg/dl) para los pacientes en alto riesgo y<1,4mmol/l (55mg/dl) para aquellos en muy alto riesgo (véase la tabla 4) |
| Pacientes con HF | Deshabituación tabáquica y optimización del estilo de vida, PAS<140 o <130mmHg si se tolerab, cLDL<2,6mmol/l (100mg/dl), reducción del cLDL ≥ 50%; en otros casos, según antecedentes de EA y DM | cLDL <1,8mmol/l (70mg/dl) para pacientes en alto riesgo y 1,4mmol/l (55mg/dl) para aquellos con muy alto riesgo (véase la tabla 4) |
| Pacientes con DM2 | ||
| Buen control de la DM de inicio reciente (p. ej., 10 años), sin evidencias de DOD ni otros factores de riesgo de EA | Deshabituación tabáquica y optimización del estilo de vida | |
| Sin EA establecida o DOD grave (véase las definiciones en la tabla 4) | Deshabituación tabáquica y optimización del estilo de vida, PAS<140 o <130mmHg si se tolerab, HbA1c<53mmol/mol (7,0%) | PAS<130mmHg si se tolerab, cLDL<1,8mmol/l (70mg/dl) y reducción del cLDL ≥ 50%, iSGLT2 o aGLP1 |
| Con EA establecida o DOD grave (véase las definiciones en la Tabla 4) | Deshabituación tabáquica y optimización del estilo de vida, PAS<140 o <130mmHg si se tolerab, HbA1c <64mmol/mol (8,0%), iSGLT2 o aGLP1; para ECV, tratamiento antiagregante plaquetario | PAS<130mmHg si se tolerab, cLDL<1,4mmol/l (55mg/dl) y reducción del cLDL ≥ 50%, iSGLT2 o aGLP1 si todavía no se han iniciado. Se puede considerar tratamientos emergentes: TAPD, doble inhibición, colchicina, icosapento de etilo |
| Pacientes con EA establecida | Deshabituación tabáquica y optimización del estilo de vida, PAS<140 o <130mmHg si se tolerab, tratamiento hipolipemiante oral intensivo con objetivo de cLDL <1,8mmol/l (70mg/dl), tratamiento antiagregante plaquetario | PAS<130mmHg si se tolerab, cLDL<1,4mmol/l (55mg/dl). Se puede considerar además los tratamientos emergentes: TAPD, doble inhibición, colchicina, icosapento de etilo |
aGLP1: agonistas del péptido similar al glucagón tipo 1 (GLP-1); cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes melitus; DOD: daño de órgano diana; EA: enfermedad ateroesclerótica; EAS: European Atherosclerosis Society; ECV: enfermedad cardiovascular; ERC: enfermedad renal crónica; ESC: European Society of Cardiology; HbA1c: glucohemoglobina; HF: hipercolesterolemia familiar; iSGLT2: inhibidores del cotransportador 2 de sodio y glucosa; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TAPD: tratamiento antiagregante plaquetario doble.
aDependiendo del riesgo (residual) a 10 años o el beneficio estimado de por vida (véase detalles en la tabla 4), las comorbilidades y las preferencias del paciente. Los niveles de evidencia de los objetivos intensificados varían, véase las tablas con recomendaciones en las secciones 4.6 y 4.7. En la ERC y la HF, los objetivos de cLDL se han tomado de la Guía de la ESC/EAS de 2019 sobre el tratamiento de las dislipemias3.
bObjetivo de PAD en consulta <80mmHg.
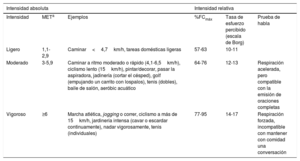
Clasificación de la intensidad de la actividad física y ejemplos de niveles de intensidad absolutos y relativos.
| Intensidad absoluta | Intensidad relativa | ||||
|---|---|---|---|---|---|
| Intensidad | METa | Ejemplos | %FCmáx | Tasa de esfuerzo percibido (escala de Borg) | Prueba de habla |
| Ligero | 1,1-2,9 | Caminar<4,7km/h, tareas domésticas ligeras | 57-63 | 10-11 | |
| Moderado | 3-5,9 | Caminar a ritmo moderado o rápido (4,1-6,5km/h), ciclismo lento (15km/h), pintar/decorar, pasar la aspiradora, jadinería (cortar el césped), golf (empujando un carrito con lospalos), tenis (dobles), baile de salón, aeróbic acuático | 64-76 | 12-13 | Respiración acelerada, pero compatible con la emisión de oraciones completas |
| Vigoroso | ≥6 | Marcha atlética, jogging o correr, ciclismo a más de 15km/h, jardinería intensa (cavar o escardar continuamente), nadar vigorosamente, tenis (individuales) | 77-95 | 14-17 | Respiración forzada, incompatible con mantener con comidad una conversación |
%FCmáx: porcentaje de la frecuencia cardiaca máxima; MET: equivalente metabólico; VO2: consumo de oxígeno.
aMET es la estimación del coste energético de una actividad en concreto divida por el gasto energético en reposo. 1 MET=VO2 3,5ml/kg/min.
Modificado de392.
Características de una dieta saludable.
| Adoptar un patrón alimentario basado en productos vegetales en lugar de animales |
|---|
| Los ácidos grasos saturados deben representar menos del 10% de la ingesta energética total sustituyéndolos por AGP, AGM y carbohidratos de cereales integrales |
| Se debe minimizar los ácidos grasos insaturados trans, y ninguno debe provenir de alimentos procesados |
| Consumo total de sal < 5 g/día |
| 30-45g de fibra al día, preferiblemente de granos integrales |
| ≥200g de fruta al día (≥2-3 raciones) |
| ≥200g de verduras al día (≥ 2-3 raciones) |
| Se debe reducir el consumo de carne roja a un máximo de 350-500g a la semana, especialmente de carne roja procesada |
| Se recomienda el consumo de pescado 1-2 veces por semana, en especial pescado graso |
| 30g diarios de frutos secos sin sal |
| El consumo de alcohol debe estar limitado a 100g a la semana |
| Se debe desaconsejar las bebidas azucaradas, como los refrescos y los zumos |
AGM: ácidos grasos monoinsaturados; AGP: ácidos grasos poliinsaturados.
«Asesoramiento muy breve» para la deshabituación tabáquica.
| El «asesoramiento muy breve» para la deshabituación tabáquica es una probada intervención clínica de 30 s, desarrollada en Reino Unido, que identifica a fumadores, les recomienda el mejor método para la deshabituación y apoya los intentos de deshabituación. Se compone de 3 elementos muy breves: |
|---|
| • Preguntar: identificar y anotar el tabaquismo |
| •Asesoramiento: asesorar sobre las mejores formas para la deshabituación |
| •Acción: brindar ayuda |
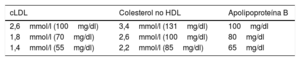
Valores respectivos de colesterol no HDL y apolipoproteína B habituales para los objetivos de colesterol unido a lipoproteínas de baja densidad.
| cLDL | Colesterol no HDL | Apolipoproteína B |
|---|---|---|
| 2,6mmol/l (100mg/dl) | 3,4mmol/l (131mg/dl) | 100mg/dl |
| 1,8mmol/l (70mg/dl) | 2,6mmol/l (100mg/dl) | 80mg/dl |
| 1,4mmol/l (55mg/dl) | 2,2mmol/l (85mg/dl) | 65mg/dl |
cLDL: colesterol unido a lipoproteínas de baja densidad; HDL: lipoproteínas de alta densidad.
Criterios diagnósticos de hipercolesterolemia familiar de la DutchLipid Clinic Network.
| Criterio (escoja solo una puntuación por grupo, la más alta aplicable; el diagnóstico se basa en el total de puntos obtenidos) | Puntos |
|---|---|
| 1. Antecedentes familiares | |
| Familiares de primer grado con enfermedad coronaria o vascular prematura (varones de edad<55 años y mujeres<60) o familiar de primer grado con cLDL por encima del percentil 95 | 1 |
| Familiar de primer grado con xantoma tendinoso o arco corneal o menores de 18 años con cLDL por encima del percentil 95 | 2 |
| 2. Anamnesis | |
| Paciente con EC prematura (varón menor de 55 años y mujer menor de 60) | 2 |
| Pacientes con enfermedad cerebrovascular o enfermedad vascular periférica (varones menores de 55 años y mujeres menores de 60) | 1 |
| 3. Examen físico | |
| Xantoma tendinoso | 6 |
| Arco corneal antes de los 45 años | 4 |
| 4. Concentración de cLDL (sin tratamiento) | |
| cLDL ≥ 8,5mmol/l (326mg/dl) | 8 |
| cLDL 6,5-8,4mmol/l (251-325mg/dl) | 5 |
| cLDL 5,0-6,4mmol/l (191-250mg/dl) | 3 |
| cLDL 4,0-4,9mmol/l (155-190mg/dl) | 1 |
| 5. Análisis de ADN | |
| Mutación funcional de los genes LDLR, apolipoproteína B o PCSK9 | 8 |
| El diagnóstico «final» de HF requiere más de 8 puntos | |
| El diagnóstico de HF «probable» requiere 6-8 puntos | |
| El diagnóstico de HF «posible» requiere 3-5 puntos |
ADN: ácido desoxirribonucleico; cLDL: colesterol unido a lipoproteínas de baja densidad; EC: enfermedad coronaria; HF: hipercolesterolemia familiar; PCSK9: proproteína convertasa subtilisina/kexina 9.
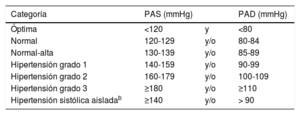
Categorías de presión arterial en sedestación determinada en consultaa.
| Categoría | PAS (mmHg) | PAD (mmHg) | |
|---|---|---|---|
| Óptima | <120 | y | <80 |
| Normal | 120-129 | y/o | 80-84 |
| Normal-alta | 130-139 | y/o | 85-89 |
| Hipertensión grado 1 | 140-159 | y/o | 90-99 |
| Hipertensión grado 2 | 160-179 | y/o | 100-109 |
| Hipertensión grado 3 | ≥180 | y/o | ≥110 |
| Hipertensión sistólica aisladab | ≥140 | y/o | > 90 |
PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
aLa categoría de PA se define según la PA en sedestación tomada en consulta y por el valor más alto de PA, bien sistólica o diastólica.
bSolo sistólica.
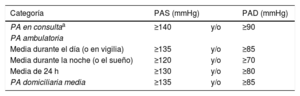
Definiciones de hipertensión según la presión arterial en consulta, ambulatoria y domiciliaria.
| Categoría | PAS (mmHg) | PAD (mmHg) | |
|---|---|---|---|
| PA en consultaa | ≥140 | y/o | ≥90 |
| PA ambulatoria | |||
| Media durante el día (o en vigilia) | ≥135 | y/o | ≥85 |
| Media durante la noche (o el sueño) | ≥120 | y/o | ≥70 |
| Media de 24 h | ≥130 | y/o | ≥80 |
| PA domiciliaria media | ≥135 | y/o | ≥85 |
PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Consideraciones sobre la determinación de la presión arterial.
| Los pacientes deben estar sentados y cómodos en un ambiente tranquilo con al menos 5 min de reposo antes de la determinación de la PA |
|---|
| Se deben registrar 3 determinaciones, con 1-2min de diferencia si las determinaciones adicionales a la primera difieren en más de 10 mmHg. La PA se registra como la media de las últimas 2 determinaciones |
| Se puede llevar a cabo determinaciones adicionales en pacientes con PA inestable debido a arritmias como los pacientes con FA, en quienes se debe emplear técnicas auscultatorias, ya que los dispositivos automáticos no están validados para la determinación de la PA en la FA |
| Se debe usar un manguito estándar (12-13cm de ancho y 35cm de largo) para la mayoría de los pacientes, pero se pueden utilizar manguitos más grandes (circunferencia del brazo > 32cm) y más pequeños (circunferencia del brazo < 26cm) |
| El manguito se debe colocar al nivel del corazón, con la espalda y el brazo sujetos para evitar la contracción muscular y los aumentos isométricos de la PA dependientes del ejercicio |
| Cuando las técnicas auscultatorias, se debe usar las fases I y V (reducción repentina/desaparición) de los ruidos de Korotkoff para identificar la PAS y la PAD respectivamente |
| Se debe determinar la PA en ambos brazos en la primera visita para identificar diferencias entre ellos. Se debe usar como referencia el brazo con valores superiores |
| Se debe determinar la PA en pie tras 1 y 3min de sedestación en la primera determinación de todos los pacientes para descartar hipotensión ortostática |
| En las citas posteriores de personas de edad avanzada, diabéticos o con otras enfermedades en las que la hipotensión ortostática pueda ser frecuente, se debe considerar también la PA en decúbito y ortostática. La hipotensión ortostática puede ocurrir menos de 1 min tras la incorporación y puede ser difícil de detectar con técnicas de determinación convencionales |
| Se debe registrar la frecuencia cardiaca y la palpación del pulso para descartar arritmias |
FA: fibrilación auricular; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
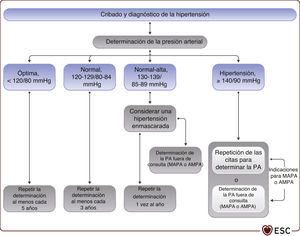
Indicaciones para la monitorización de la presión arterial domicliaria o en consulta ambulatoria.
| Enfermedades en las que es más habitual la hipertensión de bata blanca, por ejemplo: |
|---|
| •Hipertensión de grado 1 durante la determinación de la PA en consulta |
| •PA muy elevada en consulta sin daño orgánico mediado por hipertensión |
| Enfermedades/trastornos en que la hipertensión enmascarada es más común, por ejemplo: |
| •PA normal-alta en consulta |
| •Normotensión en consulta en pacientes con daño orgánico mediado por hipertensión o riesgo CV total alto |
| Hipotensión ortostática y posprandrial en pacientes sin tratamiento |
| Evaluación de la hipertensión resistente |
| Evaluación del control de la PA, especialmente en los pacientes con más riesgo |
| Respuesta exagerada de la PA al ejercicio |
| Cuando haya una variación considerable de la PA en consulta |
| Evaluación de los síntomas compatibles con hipotensión durante el tratamiento |
| Indicaciones específicas para AMPA en lugar de MAPA: |
| •Evaluación de los valores nocturnos de PA y si hay caídas de PA (p. ej., sospecha de hipertensión nocturna, como apnea del sueño, ERC, DM, hipertensión endocrina o disfunción autonómica) |
AMPA: automedición domiciliaria de la presión arterial; CV: cardiovascular; DM: diabetes mellitus; ERC: enfermedad renal crónica; MAPA: monitorización ambulatoria de la presión arterial; PA: presión arterial.
Pruebas sistemáticas para pacientes con hipertensión.
| Pruebas sistemáticas |
|---|
| Hemoglobina y/o hematocrito |
| Glucosa en ayunas y HbA1c |
| Lípidos en sangre: colesterol total, cLDL, cHDL y triglicéridos |
| Potasio y sodio en sangre |
| Ácido úrico en sangre |
| Creatinina en sangre y TFGe |
| Pruebas de función hepática |
| Análisis de orina: microscópico, proteína urinaria por tira reactiva o, preferentemente, cociente albúmina/creatinina |
| ECG de 12 derivaciones |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; ECG: electrocardiograma; HbA1c: glucohemoglobina; TFGe: tasa de filtrado glomerular estimada.
Características de los pacientes que deberían suscitar la sospecha de hipertensión secundaria.
| Características |
|---|
| Pacientes jóvenes (edad<40 años) con hipertensión de grado 2 o inicio de hipertensión de cualquier grado en la infancia |
| Empeoramiento agudo de la hipertensión en pacientes con informes de normontensión siempre estable |
| Hipertensión resistente (PA descontrolada a pesar del tratamiento con dosis óptimas o las máximas toleradas de 3 o más medicamentos que incluyan un diurético, confirmadas por AMPA o MAPA) |
| Hipertensión grave (grado 3) o emergencia hipertensiva |
| Extenso daño orgánico mediado por hipertensión |
| Características clínicas o bioquímicas que indican hipertensión de causa endocrina o ERC |
| Características clínicas que indican AOS |
| Síntomas que indican feocromocitoma o antecedentes familiares de feocromocitoma |
AMPA: automedición domiciliaria de la presión arterial; AOS: apnea obstructiva del sueño; MAPA: monitorización ambulatoria de la presión arterial.
Adaptado de4.
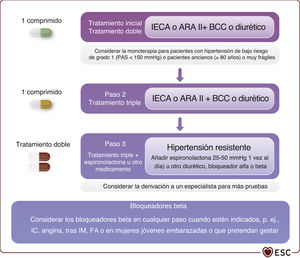
Intervalos de presión arterial en consulta objetivo recomendados. El primer paso para todos los grupos es reducir la presión arterial sistólica a < 140mmHg. Los siguientes objetivos óptimos se listan a continuación.
| Grupo etario | Intervalos objetivo del tratamiento de la PAS en consulta | ||||
|---|---|---|---|---|---|
| Hipertensión | +DM | +ERC | +EC | +Ictus/AIT | |
| 18-69 años | 120-130 | 120-130 | <140-130 | 120-130 | 120-130 |
| Una PAS inferior es aceptable si se tolera | |||||
| ≥70 años | <140 y hasta 130mmHg si se tolera | ||||
| Una PAS inferior es aceptable si se tolera | |||||
| Objetivo del tratamiento de la PAD en consulta | <80mmHg para todos los pacientes tratados | ||||
AIT: accidente isquémico transitorio; EC: enfermedad coronaria; ERC: enfermedad renal crónica; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
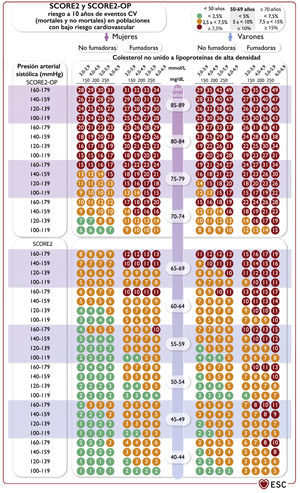
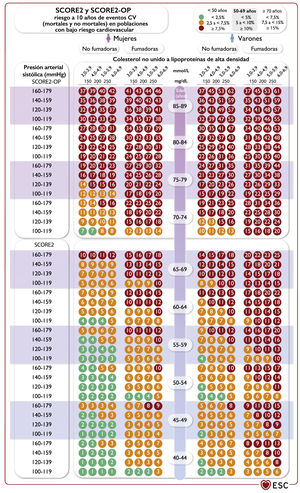
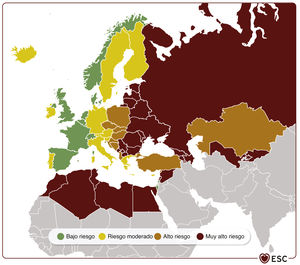
Systematic Coronary Risk Estimation 2 y Systematic Coronary Risk Estimation 2-Older Persons para eventos mortales y no mortales (infarto de miocardio, ictus).68,72 cHDL: colesterol unido a lipoproteínas de alta densidad; CV: cardiovascular; EA: enfermedad ateroesclerótica; ECV: enfermedad cardiovascular; PAS: presión arterial sistólica; SCORE2: Systematic Coronary Risk Estimation 2; SCORE2-OP: Systematic Coronary Risk Estimation 2-Older Persons. Para personas aparentemente sanas de 40-69 años, la tabla SCORE268 sirve para estimar el riesgo a 10 años de ECV mortal y no mortal (infarto de miocardio, ictus). Para personas aparentemente sanas de 70 o más años, se utiliza la SCORE2-OP. Países de bajo riesgo: Bélgica, Dinamarca, España, Francia, Israel, Luxemburgo, Noruega, Suiza, Países Bajos y Reino Unido. Países de riesgo moderado: Alemania, Austria, Chipre, Eslovenia, Finlandia, Grecia, Irlanda, Islandia, Italia, Malta, Portugal, San Marino y Suecia. Países de alto riesgo: Albania, Bosnia y Herzegovina, Croacia, Eslovaquia, Estonia, Hungría, Kazajistán, Polonia, República Checa y Turquía. Países de muy alto riesgo: Argelia, Armenia, Azerbaiyán, Bielorrusia, Bulgaria, Egipto, Federación de Rusia, Georgia, Kirguistán, Letonia, Líbano, Libia, Lituania, Marruecos, Montenegro, República de Moldavia, Rumanía, Serbia, Siria, Macedonia del Norte, Túnez, Ucrania y Uzbekistán.
Regiones de riesgo según las tasas de mortalidad cardiovascular de la Organización Mundial de la Salud.68,72,73
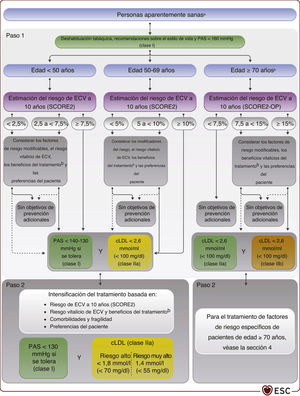
Diagrama de flujo del riesgo de enfermedad cardiovascular y tratamiento de los factores de riesgo de personas aparentemente sanas. cLDL: colesterol unido a lipoproteínas de baja densidad; CV: cardiovascular; DM: diabetes mellitus; EA: enfermedad ateroesclerótica; ERC: insuficiencia renal crónica; ESC: European Society of Cardiology; HF: hipercolesterolemia familiar; LIFE-CVD: LIFEtime-perspective CardioVascular Disease; PAS: presión arterial sistólica; SCORE2: Systematic Coronary Risk Estimation 2; SCORE2-OP: Systematic Coronary Risk Estimation 2-Older Persons. aNo incluye a los pacientes con ECV, DM, ERC o HF. bEl modelo LIFE-CVD para la estimación del riesgo cardiovascular y el beneficio del tratamiento está calibrado para regiones de riesgo de bajo a moderado (véase el cuadro 1). Las líneas continuas representan las opciones por defecto para la mayoría de las personas. Las líneas punteadas representan alternativas para algunas personas, dependiendo de las características específicas del paciente y de las enfermedades que aparecen en cada casilla. Se han indicado los objetivos terapéuticos fundamentales de PAS (< 130 mmHg) y cLDL (según el nivel de riesgo) acordes con las Guías de la ESC correspondientes. El enfoque por pasos se ha aplicado al completo: tras el paso 1, es obligatorio avanzar al paso 2 con intensificación de los objetivos. Las puntuaciones de riesgo están disponibles en la aplicación móvil CVD Risk Calculator de la ESC (https://www.escardio.org/Education/ESC-Prevention-of-CVD-Programme/Risk-assessment/esc-cvd-risk-calculation-app) y en páginas web como https://www.u-prevent.com.
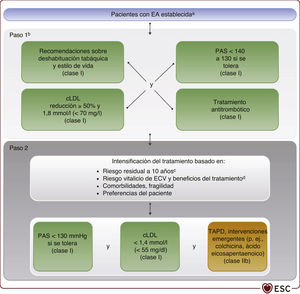
Diagrama de flujo del riesgo de enfermedad cardiovascular y tratamiento de los factores de riesgo de personas con enfermedad ateroesclerótica establecida. Los objetivos terapéuticos fundamentales de PAS (< 130 mmHg) y cLDL (según el nivel de riesgo) según la Guía de la ESC3,4 se deben trabajar como se indica. El enfoque por pasos se ha aplicado al completo: tras el paso 1, es obligatorio avanzar al paso 2 con la intensificación del tratamiento. cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; EA: enfermedad ateroesclerótica; ECV: enfermedad cardiovascular; ESC: European Society of Cardiology; EUROASPIRE: European Action on Secondary and Primary Prevention by Intervention to Reduce Events; PAS: presión arterial sistólica; RC: rehabilitación cardiaca; SCA: síndrome coronario agudo; SMART: Secondary Manifestations of Arterial Disease; TAPD: tratamiento antiagregante plaquetario doble. aPara pacientes con DM, véase el diagrama de flujo de la DM (figura 8). bPara pacientes con SCA reciente, estos objetivos son parte de la RC (clase I A). cPara pacientes de edad ≥ 70 años, un riesgo alto a 10 años se puede asociar con un mayor beneficio vitalicio absoluto del tratamiento debido a la esperanza de vida. dEl beneficio en esperanza de vida se expresa como vida libre de ECV ganada derivada de una intervención específica o de la intensificación del tratamiento. Las puntuaciones de riesgo están disponibles en la aplicación móvil CVD Risk Calculator (https://www.escardio.org/Education/ESC-Prevention-of-CVD-Programme/Risk-assessment/esc-cvd-risk-calculation-app) y en páginas web como https://www.u-prevent.com.
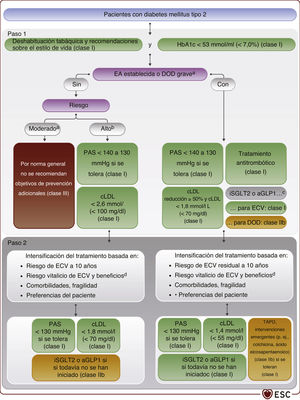
Diagrama de flujo del riesgo cardiovascular y tratamiento de los factores de riesgo de personas con diabetes mellitus tipo 2. Los objetivos terapéuticos fundamentales de PAS (< 130 mmHg) y cLDL (según el nivel de riesgo) acordes con las guías de la ESC3,4 se deben trabajar como se indica. El enfoque por pasos se ha aplicado al completo: tras el paso 1, es obligatorio avanzar al paso 2 con la intensificación del tratamiento. Las puntuaciones de riesgo están disponibles en la aplicación móvil CVD Risk Calculator (https://www.escardio.org/Education/ESC-Prevention-of-CVD-Programme/Risk-assessment/esc-cvd-risk-calculation-app) y en páginas web como https://www.u-prevent.com. cLDL: colesterol unido a lipoproteínas de baja densidad; CV: cardiovascular; DM: diabetes mellitus; DOD: daño de órgano diana (retinopatía, nefropatía, neuropatía); EA: enfermedad ateroesclerótica; ECV: enfermedad cardiovascular; ERC: enfermedad renal crónica; ESC: European Society of Cardiology; HbA1c: glucohemoglobina; IC: insuficiencia cardiaca; iSGLT2: inhibidores del cotransportador 2 de sodio y glucosa; PAS: presión arterial sistólica; TAPD: tratamiento antiagregante plaquetario doble; TFGe: tasa de filtrado glomerular estimada. aEl DOD se define como al menos una de las siguientes: TGFe < 45 ml/min/1,73 m2 independientemente de que haya albuminuria, TFGe 46-59 ml/min/1,73 m2 con microalbuminuria (cociente albúmina/creatinina 30-300 mg/g o > 30 mg/mmol), enfermedad microvascular en al menos 3 localizaciones distintas (p. ej., microalbuminuria y retinopatía y neuropatía). bVéase en la tabla 4 los grupos de riesgo cardiovascular.cSe recomienda un iSGLT2 para los pacientes con IC prevalente o ERC y un aGLP1 para los pacientes que han sufrido ictus. dLos beneficios vitalicios del tratamiento se expresan como años ganados libres de ECV. Véase el cuadro 1.
Papel de los factores de riesgo y las comorbilidades en la fibrilación auricular.215 AOS: apnea obstructiva del sueño; DM: diabetes mellitus; EC: enfermedad coronaria; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; IC: insuficiencia cardiaca; TAPD: tratamiento antiagregante plaquetario doble.
Porcentaje de cambio estimado del riesgo de enfermedad coronaria asociado con sustituciones isocalóricas de grasas saturadas por otros tipos de grasas o carbohidratos. Reproducido de Sacks et al.409 AGM: ácidos grasos monoinsaturados; AGP: ácidos grasos poliinsaturados.
Beneficios de por vida de la deshabituación tabáquica en la enfermedad ateroesclerótica para personas aparentemente sanas según los siguientes factores de riesgo: edad, sexo, presión arterial y colesterol no unido a lipoproteínas de alta densidad. El modelo actualmente está validado en países de riesgo bajo y moderado. El beneficio de por vida se expresa en «media de expectativa de vida en años sin infarto o ictus» ganados por deshabituación tabáquica. El beneficio de por vida se calcula estimando el riesgo de ECV con el modelo LIFE-CVD76 multiplicado por las HR en comparación con la continuación del tabaquismo (0,60) de un metanálisis de estudios del riesgo de ECV y tabaquismo496 y multiplicado por las HR (0,73) para la mortalidad no cardiovascular en competencia.497 Para estimaciones individuales del beneficio de por vida, se puede utilizar esta tabla o la versión electrónica del LIFE-CVD, evaluado en la aplicación móvil ESC CVD o en https://u-prevent.com/. ESC: European Society of Cardiology; HR: hazard ratio; LIFE-CVD: LIFEtime-perspective CardioVascular Disease; PAS: presión arterial sistólica.
Media de años sin enfermedad cardiovascular ganados por cada reducción de 1mmol/l (40mg/dl) del colesterol unido a lipoproteínas de baja densidad en personas aparentemente sanas. El modelo actualmente está validado para países de riesgo bajo y moderado. El beneficio de por vida se basa en los siguientes factores: edad, sexo, tabaquismo, PAS y colesterol no HDL. El beneficio de por vida se expresa en «media de expectativa de vida en años libres de infarto o ictus» ganados por disminución del cLDL de 1 mmol/l. Para reducciones del cLDL de 2 mmol/l, el efecto medio es casi el doble, y así progresivamente. El beneficio de por vida se calcula estimando el riesgo de ECV con el modelo LIFE-CVD76 multiplicado por las HR (0,78) de un metanálisis sobre el efecto hipolipemiante.22 Para estimaciones individuales del beneficio de por vida, se puede utilizar esta tabla o la versión electrónica del LIFE-CVD, evaluado en la aplicación móvil ESC CVD o en https://u-prevent.com/. cLDL: colesterol unido a lipoproteínas de baja densidad; colesterol no HDL: colesterol no unido a lipoproteínas de alta densidad; ESC: European Society of Cardiology; LIFE-CVD: LIFEtime-perspective CardioVascular Disease; PAS: presión arterial sistólica.
Reducciones de colesterol unido a lipoproteínas de baja densidad esperadas con la politerapia. cLDL: colesterol unido a lipoproteínas de baja densidad; PCSK9: proproteína convertasa subtilisina/kexina tipo 9. Adaptado de Mach et al.3
Beneficios de por vida de reducir la presión arterial 10mmHg para personas aparentemente sanas según los siguientes factores de riesgo: edad, sexo, tabaquismo, presión arterial sistólica y colesterol no unido a lipoproteínas de alta densidad. El modelo actualmente está validado para países de riesgo bajo y moderado. El beneficio de por vida expresado en «media de años de expectativa de vida sin infarto de miocardio o ictus» ganados por la reducción de 10 mmHg de la PAS. El beneficio de por vida se calcula estimando el riesgo de ECV con el modelo LIFE-CVD multiplicado por las HR (0,80) de un metanálisis sobre el efecto hipotensor. Para disminuciones de la PAS de 20 mmHg, el efecto medio es casi el doble, etc. Para estimaciones individuales del beneficio de por vida, se puede utilizar esta tabla o la versión electrónica del LIFE-CVD, evaluado en la aplicación móvil ESC CVD o en https://u-prevent.com/. cLDL: colesterol unido a lipoproteínas de baja densidad; colesterol no HDL: colesterol no unido a lipoproteínas de alta densidad; CV: cardiovascular; ESC: European Society of Cardiology; LIFE-CVD: LIFEtime-perspective CardioVascular Disease; NP: no procede; PAS: presión arterial sistólica.
Estrategia farmacológica básica para la hipertensión. Este algoritmo está recomendado para la mayoría de los pacientes con daño orgánico mediado por hipertensión, DM, enfermedad cerebrovascular y EAP. ARA II: antagonistas del receptor de la angiotensina II; BCC: bloqueadores de los canales del calcio; FA: fibrilación auricular; IECA: inhibidores de la enzima de conversión de la angiotensina; IC: insuficiencia cardiaca; IM: infarto de miocardio; PA: presión arterial; PAS: presión arterial sistólica.
Como ya se ha explicado, los objetivos para el control del cLDL, la PA y la glucemia de los pacientes diabéticos son los mismos que los publicados en las recientes guías de la ESC3–5. La presente guía propone un enfoque gradual para la intensificación del tratamiento como medio para ayudar a médicos y pacientes a lograr estos objetivos de modo que se adapte a los perfiles de los pacientes y sus preferencias. Este principio (explicado en la figura 2, con el ejemplo del enfoque gradual) no es un concepto nuevo, sino que refleja la práctica clínica habitual en la que las estrategias terapéuticas se inician y después se intensifican como parte del proceso de toma de decisiones conjunta entre los profesionales de la salud y los pacientes.
Un enfoque por pasos comienza con objetivos de prevención para todas las personas, independientemente del riesgo cardiovascular. Le sigue una estratificación del riesgo cardiovascular y se trata de los beneficios potenciales con el paciente. Si se inicia el tratamiento, se debe evaluar su efecto y se debe considerar la posterior intensificación del tratamiento para la consecución de los objetivos terapéuticos fundamentales en todos los pacientes, tomando en consideración los beneficios adicionales, las comorbilidades y la fragilidad, y que todas ellas convergen en las preferencias del paciente y la toma de decisiones conjunta.
En el campo de la DM, los estudios han demostrado los beneficios de un enfoque gradual para la intensificación del tratamiento y no respaldan la posición del «nihilismo terapéutico» de médicos o pacientes. De hecho, la consecución de objetivos terapéuticos es similar, hay menos efectos secundarios y la satisfacción de los pacientes es significativamente mayor con este enfoque66,67. Sin embargo, es importante señalar que no es apropiado detener sistemáticamente la evaluación de objetivos terapéuticos o el tratamiento tras el paso 1. Los objetivos fundamentales de la intensificación del tratamiento basados en la evidencia son óptimos desde el punto de vista de la reducción del riesgo de ECV y deben tenerse en cuenta con todos los pacientes.
3.2.3.2Estimación del riesgo en personas aparentemente sanasLas personas aparentemente sanas son aquellas sin EA establecida, DM2 o comorbilidades graves. En las GPC de prevención de la ESC publicadas en 20162, se utlizaron las tablas Systemic Coronary Risk Estimation (SCORE) para estimar el riesgo de muerte por ECV a 10 años. Sin embargo, la morbilidad por ECV (infarto de miocardio no mortal, ictus no mortal) combinado con la mortalidad cardiovascular refleja mucho mejor la carga total de EA. La versión final y actualizada de las tablas (SCORE2) que se utiliza en esta GPC (figura 3) estima el riesgo a 10 años de eventos cardiovasculares mortales y no mortales (infarto de miocardio, ictus) de personas de 40-69 años con factores de riesgo sin tratar o que han estado estables durante varios años68.
Se aplican diversas consideraciones específicas a la estimación del riesgo de ECV de personas ancianas. En primer lugar, el gradiente en la relación entre los factores de riesgo clásicos, como los lípidos y la PA, y el riesgo de ECV se atenúa con la edad69. En segundo lugar, la supervivencia libre de ECV se disocia de otras supervivencias progresivamente con el aumento de la edad, porque el riesgo de muerte de causa no cardiovascular aumenta (riesgo competitivo)70. Por ello los modelos de riesgo tradicionales que no toman en consideración el riesgo competitivo de la mortalidad no CV tienden a sobrestimar el verdadero riesgo cardiovascular a 10 años, y sobrestiman los potenciales beneficios terapétucios71. La tabla SCORE2-OP estima los eventos a 5 y 10 años de eventos cardiovasculares mortales y no mortales (infarto de miocardio, ictus) ajustados por riesgos competitivos en personas aparentemente sanas de ≥ 70 años.72
SCORE2 y SCORE2-OP están calibradas para 4 grupos de países (riesgo cardiovascular bajo, moderado, alto y muy alto) siguiendo las tasas de mortalidad cardiovascular publicadas por la Organización Mundial de la Salud (OMS) (tabla 3 del material adicional y figura 4)73.
Países de bajo riesgo: Bélgica, Dinamarca, España, Francia, Israel, Luxemburgo, Noruega, Suiza, Países Bajos y Reino Unido.
Países de riesgo moderado: Alemania, Austria, Chipre, Eslovenia, Finlandia, Grecia, Irlanda, Islandia, Italia, Malta, Portugal, San Marino y Suecia.
Países de alto riesgo: Albania, Bosnia y Herzegovina, Croacia, Eslovaquia, Estonia, Hungría, Kazajistán, Polonia, República Checa y Turquía.
Países de muy alto riesgo: Argelia, Armenia, Azerbaiyán, Bielorrusia, Bulgaria, Egipto, Federación de Rusia, Georgia, Kirguistán, Letonia, Líbano, Libia, Lituania, Marruecos, Montenegro, República de Moldavia, Rumanía, Serbia, Siria, Macedonia del Norte, Túnez, Ucrania y Uzbekistán.
Se ha utilizado un enfoque multiplicador para convertir las tasas de mortalidad cardiovascular en eventos cardiovasculares mortales y no mortales74. La tabla SCORE2 está disponible en la aplicación móvil ESC ECV Risk (gratuita en las tiendas de aplicaciones móviles) y las tablas de riesgo de los 4 grupos de países (figura 4). La tabla SCORE2 no se aplica a personas con ECV documentada u otras enfermedades de alto riesgo, como DM, HF u otras dislipemias genéticas o raras e IRC, ni a mujeres embarazadas.
Para estimar el riesgo cardiovascular total a 10 años de una persona, primero se debe identificar el grupo correcto de países y la tabla correspondiente a su sexo, tabaquismo (o no) y edad aproximada. Una vez en esa tabla, hay que localizar los valores aproximados de PA y cHDL de la persona. Las estimaciones del riesgo deben ajustarse al alza según la persona se acerque a la siguiente categoría de edad.
3.2.3.3Traslado del riesgo cardiovascular a los umbrales de tratamientoAunque no existen umbrales de riesgo de aplicación universal, la intensidad del tratamiento debe aumentar según aumenta el riesgo de ECV. Sin embargo, en ciertos casos ningún umbral de riesgo de ECV total, por bajo que sea, excluye el tratamiento de los factores de riesgo. Por el contrario, ningún umbral de riesgo de ECV total, por alto que sea, implica el tratamiento «obligatorio». En todo el espectro del riesgo de ECV, la decisión de iniciar las intervenciones es una consideración individual y del proceso de toma de decisiones conjunta (véase también la sección 4.1). En general, el tratamiento de los factores de riesgo se basa en categorías de riesgo de ECV («de bajo a moderado», «alto» y «muy alto»). Los valores umbral para estas categorías son numéricamente distintos en los diferentes grupos etarios para evitar el infatratamiento de los jóvenes y el sobretratamiento de los ancianos. Ya que la edad es un factor de riesgo de ECV principal, pero el tratamiento de los factores de riesgo es más beneficioso para los jóvenes, los umbrales de riesgo para considerar el tratamiento de personas jóvenes son más bajos (tabla 5).
Las categorías de riesgo no se traducen «automáticamente» en recomendación de iniciar el tratamiento farmacológico. Para todos los grupos etarios, las consideraciones sobre los factores modificadores del riesgo, el riesgo de ECV de por vida, el beneficio terapéutico, las comorbilidades, la fragilidad y las preferencias del paciente deben guiar también las decisiones terapéuticas.
Además, debe subrayarse que muchos pacientes pueden trasladarse a categorías de menos riesgo sin tratamiento farmacológico solo con la deshabituación tabáquica. Por último, las personas de 70 o más años pueden tener un riesgo muy alto incluso alcanzando los objetivos de PAS, y para las personas mayores la prevención primaria con hipolipemiantes es una recomendación de clase IIb («puede considerarse») (véase la sección 4.6).
En el grupo de 50-69 años, un umbral de riesgo de ECV del 5% estimado con la anterior tabla SCORE se corresponde, de media, con un umbral del riesgo a 10 años de ECV mortal y no mortal del 10% estimado con SCORE2, ya que aproximadamente el mismo número de personas se sitúan por encima del umbral y cumplirían los requisitos para ser tratadas68.
Puesto que los umbrales de riesgo de ECV a 10 años que guían las decisiones terapéuticas tienen un impacto en los costes y los recursos de sanidad, los países o las regiones pueden decidir umbrales más altos o más bajos.
3.2.3.4Estimación del riesgo y tratamiento de los factores de riesgo en personas aparentemente sanas de 50-69 añosLa deshabituación tabáquica, las recomendaciones sobre el estilo de vida y la PAS < 160mmHg están recomendadas para todas las personas (figura 6). Un riesgo de ECV a 10 años (eventos de EA mortales y no mortales) ≥ 10% se considera generalmente «muy alto riesgo» y se recomienda el tratamiento de los factores de riesgo de ECV. Un riesgo de ECV de un 5-< 10% se considera «alto riesgo» y se debe considerar el tratamiento de los factores, tomando en consideración los modificadores del riesgo de ECV, el riesgo de por vida, los beneficios del tratamiento (para regiones de riesgo bajo y moderado, véase el cuadro 1) y las preferencias del paciente. Un riesgo de ECV a 10 años < 5% se considera «bajo a moderado» y generalmente no cumple los requisitos para el tratamiento de los factores de riesgo, a no ser que alguno de los factores de riesgo modificables (véase la sección 3.3) aumente el riesgo o que se considere sustanciales el riesgo de por vida estimado y el beneficio del tratamiento.
3.2.3.5Estimación del riesgo y tratamiento de los factores de riesgo en personas aparentemente sanas de 70 o más añosLa deshabituación tabáquica, las recomendaciones sobre el estilo de vida y la PAS < 160mmHg se recomiendan para todas las personas (figura 6). La edad es un factor dominante del riesgo de ECV y una estimación del riesgo de ECV a 10 años en casi todas las personas de edad ≥ 70 años excede los umbrales de riesgo convencionales. Además, el beneficio de por vida del tratamiento de los factores de riesgo en cuanto a tiempo libre de ECV es menor para los ancianos. Por lo tanto, los umbrales de riesgo de ECV para el tratamiento de los factores de riesgo son más altos para las personas de edad ≥ 70 años aparentemente sanas. Un riesgo de ECV a 10 años > 15% se considera generalmente «muy alto riesgo» y se recomienda el tratamiento de los factores de riesgo de EA (nótese que la recomendación de tratamiento hipolipemiante para personas de edad ≥ 70 años aparentemente sanas es de clase IIb, «se puede considerar»; véase la sección 4.6). Un riesgo de ECV de un 4,5-< 15% se considera «alto riesgo», y se debe considerar el tratamiento de los factores de riesgo tomando en consideración los factores de riesgo de ECV modificables, la fragilidad, los beneficios del tratamiento de por vida (en regiones de riesgo bajo y moderado, cuadro 1), las comorbilidades, la polifarmacia y las preferencias del paciente. Dada la naturaleza subjetiva de muchos de estos factores, no es posible definir criterios estrictos para las consideraciones. Un riesgo de ECV a 10 años < 7,5% se considera «de bajo a moderado» y generalmente no cumpliría los requisitos para el tratamiento de los factores de riesgo, a no ser que uno o varios factores de riesgo modificables (sección 3.3) aumenten el riesgo o que se considere sustanciales el riesgo estimado de por vida y el beneficio del tratamiento75–79.
3.2.3.6Estimación del riesgo y tratamiento de los factores de riesgo en personas aparentemente sanas mayores de 50 añosLa deshabituación tabáquica, las recomendaciones sobre el estilo de vida y la PAS < 160mmHg se recomiendan para todas las personas (figura 6). El riesgo de ECV de las personas relativamente jóvenes y aparentemente sanas es, de media, bajo incluso con factores de alto riesgo, pero el riesgo de ECV de por vida en estas circunstancias es muy alto. Para los mayores de 50 años aparentemente sanos, un riesgo de ECV a 10 años ≥ 7,5% se considera generalmente «muy alto riesgo», ya que este riesgo está relacionado con un riesgo alto de por vida y se recomienda el tratamiento de los factores de riesgo de EA. Un riesgo de ECV a 10 años de un 2,5-< 7,5% se considera «alto riesgo» y se debe considerar el tratamiento de los factores de riesgo teniendo en consideración los factores de riesgo de ECV modificables, los riesgos y beneficios del tratamiento de por vida (en regiones de riesgo bajo a moderado) y las preferencias de los pacientes. Un riesgo de ECV a 10 años < 2,5% se considera «riesgo de bajo a moderado» y generalmente no cumple las condiciones para el tratamiento de los factores de riesgo, a no ser que uno o más factores de riesgo modificables (véase sección 3,3) aumenten el riesgo o que se considere sustanciales el riesgo estimado de por vida y los beneficios del tratamiento (cuadro 1, figura 6)75–78.
La perspectiva de los beneficios de por vida puede ser útil al comunicar el riesgo a los pacientes jóvenes, además de tratar la posibilidad de evitar un evento de ECV devastador a medio y largo plazo, aunque el riesgo de ECV a 10 años sea muy bajo.
Es muy probable que los factores que predicen el riesgo de ECV, así como las predicciones de los beneficios de por vida de tratar los factores de riesgo, sean imprecisos a edades muy tempranas (< 40 años). Por lo general no se recomienda el tratamiento farmacológico hipolipemiante o hipotensor a esas edades, excepto para pacientes con HF o trastornos específicos de la PA. Un estilo de vida saludable a lo largo de la vida es más importante para los jóvenes. Los estudios de aleatorización mendeliana muestran muy bien que las diferencias relativamente pequeñas en el cLDL o la PAS mantenidas de por vida tienen grandes implicaciones en el riesgo cardiovascular de por vida80.
3.2.3.7Estimación del riesgo y tratamiento de los factores de riesgo en personas con enfermedad ateroesclerótica establecidaLos pacientes con EA establecida tienen, de media, un riesgo muy alto de eventos de ECV si no se tratan los factores de riesgo. Por lo tanto, se recomiendan la deshabituación tabáquica, la implementación de un estilo de vida saludable y el tratamiento de los factores de riesgo para todos los pacientes (paso 1). La posterior intensificación del tratamiento de los factores de riesgo con la consecución de objetivos terapéuticos más bajos (paso 2) es beneficiosa para la mayoría de los pacientes y se debe considerar en la toma de decisiones conjunta teniendo en cuenta el riesgo de ECV a 10 años, las comorbilidades, el riesgo de por vida y los beneficios del tratamiento (cuadro 1), la fragilidad y las preferencias del paciente (figura 7).
Tras el tratamiento inicial de los factores de riesgo y la consecución de los objetivos terapéuticos, el riesgo de ECV recurrente residual de cada paciente varía mucho y se debe tener en cuenta81. Está claro que los pacientes con SCA reciente o enfermedad vascular progresiva y aquellos con DM y enfermedad vascular tienen un riesgo de eventos de ECV recurrentes extremadamente alto. Para otros pacientes con EA establecida, el riesgo residual puede ser mucho menos evidente y podría estimarse basándose en criterios clínicos como la edad, los cambios en los niveles de los factores de riesgo y los modificadores del riesgo, o se puede calcular el riesgo de ECV residual con una calculadora.
| Cuadro 1. Estimación y tratamiento del riesgo de ECV de por vida |
|---|
| La prevención cardiovascular a través del tratamiento de los factores de riesgo se lleva a cabo con una perspectiva vitalicia. Se puede conseguir una aproximación del riesgo de ECV de por vida con la experiencia clínica y criterios clínicos como la edad, los cambios en los niveles de los factores de riesgo, los modificadores del riesgo, etc., o una estimación en personas aparentemente sanas, pacientes con EA establecida y pacientes con DM2 y puntuaciones de riesgo de ECV de por vida específicas75–77. Los beneficios de por vida del tratamiento de los factores de riesgo puede estimarse combinando modelos de riesgo de por vida con modelos de HR derivados de ECA, metanálisis de ECA o aleatorizaciones mendelianas, que pueden aportar estimaciones sobre los efectos de por vida del tratamiento de los factores de riesgo. Las calculadoras en línea (como la aplicación móvil ESC ECV Risk) pueden utilizarse para estimar los beneficios para toda la vida del individuo con la deshabituación tabáquica (véase también la figura 11), la hipolipemia (véase también la figura 12) y la disminución de la PA (véase también la figura 15), expresada como años extra libres de ECV78. El beneficio medio de por vida es fácil de interpretar y puede mejorar la comunicación de potenciales tratamientos que beneficien al paciente durante la toma de decisiones conjunta. A su vez, esto puede aumentar la participación del paciente, la autoeficacia y la motivación para adherirse a cambios en el estilo de vida y al tratamiento farmacológico.El riesgo de por vida es una estimación de a qué edad hay una probabilidad del 50% de que una persona haya sufrido un evento cardiovascular o haya fallecido. El beneficio de por vida es la diferencia numérica entre la predicción de la edad a la que una persona tiene una probabilidad del 50% de haber sufrido un evento cardiovascular o haber fallecido con o sin el tratamiento propuesto. Actualmente no existen umbrales de tratamiento oficiales para el beneficio de por vida medio. Además, la estimación individual del beneficio de por vida se debe considerar en relación con la duración estimada del tratamiento. La duración del tratamiento de por vida será generalmente más larga para personas jóvenes que para las mayores. Tanto los efectos del tratamiento como la duración determinan el «retorno de la inversión individual» del tratamiento de los factores de riesgo. En la toma de decisiones conjunta entre el profesional de la salud y el paciente, se necesita establecer el beneficio mínimo deseado de un tratamiento específico, un proceso en el que hay que tener en cuenta las preferencias del paciente, los efectos secundarios del tratamiento y los costes. |
DM: diabetes mellitus; ECA: ensayo controlado aleatorizado; ESC: European Society of Cardiology; ECV: enfermedad cardiovascular; HR: hazard ratio; PA: presión arterial.
El riesgo de ECV recurrente está influido sobre todo por factores de riesgo clásicos, la localización de la enfermedad vascular y la función renal. Los instrumentos para estratificar el riesgo en prevención secundaria son la escala SMART (Secondary Manifestations of Arterial Disease), disponible en la aplicación móvil ESC ECV Risk para la estimación del riesgo de ECV residual a 10 años en pacientes con EA estable, definida como EC, EAP o enfermedad cerebrovascular81, y el modelo de riesgo European Action on Secondary and Primary Prevention by Intervention to Reduce Events (EUROASPIRE), que estima el riesgo de ECV a 2 años en pacientes con EC estable82.
A veces el riesgo cardiovascular recurrente es muy alto a pesar de un tratamiento máximo (tolerado) convencional. En estos casos pueden considerarse los nuevos tratamientos preventivos, aunque menos establecidos, como la doble inhibición antitrombótica83, el icosapento de etilo84 o el tratamiento antiinflamatorio con colchicina (véase la sección 4.10)85,86.
3.2.3.8Estimación del riesgo y tratamiento de los factores de riesgo en personas con diabetes mellitus tipo 2La mayoría de los adultos con DM2 tienen un riesgo alto o muy alto de futura ECV, especialmente a partir de la mediana edad. De media, la DM2 duplica el riesgo de ECV y reduce la expectativa de vida en unos 4-6 años, con los mayores riesgos absolutos en los pacientes con cualquier daño de órgano diana (DOD). La DM2 también aumenta el riesgo de eventos cardiorrenales, especialmente IC e IRC. Los riesgos relativos (RR) de ECV en la DM2 son mayores a edades más jóvenes al inicio de la enfermedad y en mujeres son moderadamente mayores que en varones87. Se recomiendan la deshabituación tabáquica y la implementación de un estilo de vida saludable para todas las personas con DM2, y se debe considerar el tratamiento de los factores de riesgo para todas las personas con DM, al menos las mayores de 40 años (véase las secciones 4.6 y 4.7). Aun así, existe un abanico muy amplio de riesgo individual de eventos CV, especialmente tras el tratamiento inicial de los factores de riesgo88.
Se debe considerar a los pacientes con DM y DOD grave (para la definición, véase la tabla 4) con muy alto riesgo de ECV, similar al de los pacientes con EA establecida (tabla 4). A la mayoría de los demás diabéticos se los considera en alto riesgo de EA64. Sin embargo, se puede hacer una excepción para los pacientes con DM bien controlada de corta duración (p. ej., < 10 años), sin evidencia de DOD y sin otros factores de riesgo de EA, a los que se haya considerado en riesgo de ECV moderado.
Además de la división semicuantitativa en las 3 categorías de riesgo descritas, los modelos de riesgo específicos de la DM pueden refinar las estimaciones de riesgo e ilustrar el impacto de los tratamientos. Estos modelos generalmente incluyen la duración de la DM, los valores de glucohemoglobina (HbA1c) y la presencia de DOD. Algunos ejemplos son la escala ADVANCE (Action in Diabetes and Vascular disease: preterAx and diamicroN-MR Controlled Evaluation), que predice el riesgo de ECV a 10 años, y la ecuación de riesgo del UKPDS (UK Prospective Diabetes Study), que predice los riesgos de ECV mortal y no mortal y está disponible en Reino Unido. Sin embargo, se recomienda un uso prudente de estas calculadoras, ya que ambas se basan en cohortes de edad avanzada89,90 (figura 8).
Recomendaciones sobre la estimación del riesgo de ECV
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda la estimación del riesgo de ECV mortal y no mortal a 10 años con SCORE2 para personas aparentemente sanas de edad<70 años sin EA establecida, DM, IRC o trastornos genéticos raros de la PA o los lípidos68 | I | B |
| Se recomienda la estimación del riesgo de ECV mortal y no mortal a 10 años con SCORE2-OP para personas aparentemente sanas de edad ≥ 70 años sin EA establecida, DM, IRC o trastornos genéticos raros de la PA o los lípidos72 | I | B |
| Tras la estimación del riesgo de ECV mortal y no mortal a 10 años de personas apartemente sanas, deben considerarse los riesgos de por vida y el beneficio terapéutico, los factores de riesgo modificables, la fragilidad, la polifarmacia y las preferencias del paciente | IIa | C |
| Se debe considerar de alto o muy alto riesgo de ECV a los pacientes con EA establecida, DM, nefropatía de moderada a grave, trastornos raros/genéticos de los lípidos o la PA | I | A |
| Para personas aparentemente sanas o con muy alto riesgo, así como para pacientes con EA establecida o DM, se recomienda una intensificación del tratamiento por pasos y enfocada al tratamiento intensivo de los factores de riesgo considerando el riesgo de ECV, los beneficios del tratamiento de los factores de riesgo, los factores de riesgo modificables y las preferencias del paciente66,67 | I | B |
| Para personas aparentemente sanas con alto riesgo (SCORE2 ≥ 7,5% para menores de 50 años; SCORE2 ≥ 10% a los 50-69 años; SCORE2-OP ≥ 15% a edades ≥ 70 años) sin DM, IRC, trastornos genéticos/raros de los lípidos o de la PAS, se recomienda el tratamiento de los factores de riesgo de EA68,72 | I | C |
| Para personas aparentemente sanas con alto riesgo de ECV (SCORE2 2,5-< 7,5% los menores de 50 años; SCORE2 5-< 10% los de 50-69 años; SCORE2-OP 7,5-< 15% los de edad ≥ 70 años) sin DM, IRC o trastornos genéticos/raros de los lípidos o de la PA, se debe considerar el tratamiento de los factores de riesgo de EA tomando en consideración los factores de riesgo de ECV modificables, el riesgo de por vida y los beneficios del tratamiento y las preferencias del paciente | IIa | C |
DM: diabetes mellitus; EA: enfermedad ateroesclerótica; ECV: enfermedad cardiovascular; PA: presión arterial; SCORE2-OP: Systemic Coronary Risk Estimation 2-Older Persons; SCORE2: Systemic Coronary Risk Estimation 2.
a Clase de recomendación.
b Nivel de evidencia.
La intensificación del tratamiento de los factores de riesgo en el paso 2 se debe considerar para todos los pacientes teniendo en cuenta el riesgo de ECV a 10 años, las comorbilidades, el riesgo y el beneficio del tratamiento de por vida (cuadro 1), la fragilidad y las preferencias del paciente en el proceso de toma de decisiones conjunta75.
3.2.3.9Estimación del riesgo y tratamiento de los factores de riesgo en pacientes con diabetes mellitus tipo 1Los pacientes con DM1 están en más riesgo de ECV y la manifestación temprana de la DM1 se relaciona con más años perdidos en mujeres que en varones, principalmente por ECV91. Los riesgos relativos (RR) de la ECV son, de media, más altos en la DM1 que en la DM2 debido a una media de 3-4 décadas de hiperglucemia, y los factores de riesgo clásicos contribuyen mucho a los eventos cardiovasculares en la DM192. Los riesgos cardiovasculares han disminuido con el tiempo en proporción con una mayor expectativa de vida93. Hay mayores riesgos cardiovasculares en la DM1 con mal control glucémico, clase social baja y edad temprana de inicio. El riesgo absoluto de eventos cardiovasculares o mortalidad cardiovascular es mayor en pacientes con cualquier evidencia de enfermedad microvascular, especialmente complicaciones renales, y está muy influido por la edad. La estratificación del riesgo de ECV en pacientes con DM1 se puede basar en la misma clasificación del riesgo para pacientes con DM2 (tabla 4), aunque el nivel de evidencia para la DM1 es menor.
3.2.4Comunicación del riesgo cardiovascularLa reducción del riesgo de ECV de un individuo comienza con una evaluación apropiada del riesgo individual y la comunicación efectiva del riesgo y la reducción del riesgo esperada con el tratamiento de los factores de riesgo. Las interacciones médico-paciente son complejas y comunicar el riesgo es difícil94,95. No hay un único enfoque «correcto», sino que depende de las preferencias y la percepción de cada paciente, que son distintas según el nivel educativo y la alfabetización. La percepción del riesgo también se ve afectada por factores emocionales como el miedo, el optimismo, etc. («los pacientes no piensan el riesgo, lo sienten»)96.
Es importante analizar si los pacientes entienden el riesgo, la reducción del riesgo esperada y los pros y contras de la intervención, así como identificar qué es importante para el propio paciente. Por ejemplo, un paciente puede considerar importante vivir sin fármacos, mientras que otro puede no ser capaz de modificar su estilo de vida. En cuanto a los desenlaces, la reducción del riesgo de muerte es esencial para algunos pacientes, mientras que otros prefieren reducir el riesgo de enfermedad. El riesgo a corto plazo puede motivar a algunos pacientes, mientras que los beneficios de por vida (cuadro 1) pueden impactar más a otros. En general, las ayudas visuales (gráficas, etc.) mejoran la comprensión del riesgo; el riesgo absoluto (reducción) se entiende mejor que los RR (reducción) y el «número de pacientes que es necesario tratar» se entiende peor.
Para personas aparentemente sanas, el enfoque estándar es informar sobre el riesgo de eventos cardiovasculares a 10 años con SCORE2 o SCORE2-OP, disponibles en la aplicación móvil CVD Risk Calculator de la ESC (https://www.escardio.org/Education/ESC-Prevention-of-CVD-Programme/Risk-assessment/esc-cvd-risk-calculation-app) o en http://www.heartscore.org o en https://www.u-prevent.com. En situaciones específicas, se puede optar por expresar los riesgos en otros términos que no sean el riesgo absoluto a 10 años. Algunos ejemplos son los riesgos de personas jóvenes o de edad muy avanzada. En las personas jóvenes, el riesgo de por vida puede ser más informativo, ya que el riesgo de ECV a 10 años es generalmente bajo incluso en presencia de factores de riesgo. En personas de edad avanzada, se precisa la estimación específica del riesgo tomando en consideración el riesgo competitivo de muerte por ECV78. No se recomienda la traslación directa de los RR para las decisiones de tratamiento, ya que el riesgo absoluto sigue siendo el criterio principal para iniciarlo.
Recomendaciones sobre la comunicación del riesgo de ECV
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda una conversación informada sobre el riesgo de ECV y los beneficios del tratamiento, personalizada según las necesidades de cada paciente96 | I | A |
ECV: enfermedad cardiovascular.
a Clase de recomendación.
b Nivel de evidencia.
Recomendaciones sobre modificadores del riesgo de ECV
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Los síntomas de estrés y los estresores psicológicos modifican el riesgo de ECV. Se debe considerar una evaluación de estos estos estresores100–102 | IIa | B |
| La puntuación de CAC se puede considerar para mejorar la clasificación del riesgo en los umbrales de tratamiento. La detección de placas por ecografía carotídea es una alternativa cuando la puntuación de CAC no es posible103,104 | IIb | B |
| Se debe considerar la multiplicación del RR calculado por RR para subgrupos étnicos específicos105 | IIa | B |
| No se recomienda la recopilación sistemática de otros modificadores tales como puntuaciones de riesgo genéticas, biomarcadores en sangre u orina, pruebas vasculares o de imagen (más allá de la puntuación de CAC o la detección de placas por ecografía carotídea) | III | B |
CAC: calcio coronario; ECV: enfermedad cardiovascular; RR: riesgo relativo.
a Clase de recomendación.
b Nivel de evidencia.
Otra forma de expresar el riesgo individual es calcular la «edad del riesgo» de la persona96. La edad del riesgo de una persona con múltiples factores de riesgo de EA es la edad de alguien del mismo sexo con el mismo nivel de riesgo pero con niveles bajos de factores de riesgo. La edad del riesgo es una forma intuitiva y fácilmente entendible de ilustrar la posible reducción en la expectativa de vida de una persona con un RR absoluto bajo pero un riesgo de ECV alto a la que quedará expuesta si no se adoptan medidas preventivas. La edad del riesgo se puede calcular automáticamente como parte del HeartScore (http://www.hearts-score.org/)97–99.
El riesgo de ECV también se puede expresar con perspectiva de vida en lugar de a 10 años, por ejemplo, con el LIFE-CVD (LIFEtime-perspective CardioVascular Disease) en la aplicación móvil ESC CVD Risk Calculation o en https://www.u-prevent.com) (véase también el cuadro 2)78. Los modelos de predicción del riesgo de ECV de por vida identifican a personas con alto riesgo a corto y largo plazo. Estos modelos evalúan el riesgo pronosticado en el contexto de riesgos de otras enfermedades que compiten por el resto de la esperanza de vida de la persona. Otro enfoque que también utiliza la perspectiva de vida es calcular los beneficios de por vida de las intervenciones preventivas78. El beneficio de por vida de las intervenciones preventivas se puede expresar como ganancia libre de ECV (años), que es más fácil de comunicar a un paciente y puede contribuir al proceso de toma de decisiones conjunta.
3.3Potenciales modificadores del riesgoAdemás de los factores de riesgo de ECV clásicos incluidos en las escalas de riesgo, otros factores de riesgo o información de carácter individual también pueden afectar al cálculo del riesgo. Se puede considerar una evaluación de potenciales modificadores si:
- •
Mejora las medidas de predicción del riesgo, como la discriminación o la reclasificación (p. ej., cálculo del índice de reclasificación neto).
- •
El impacto en la salud pública es claro (p. ej., número de pacientes que es necesario cribar o beneficio neto).
- •
Es factible en la práctica diaria.
- •
No solo es que hay información sobre cómo el riego aumenta con resultados desfavorables, sino que hay información sobre cómo el riesgo disminuye cuando el modificador muestra resultados favorables.
- •
La literatura sobre este potencial modificador no está distorsionada por el sesgo de publicación.
Muy pocos modificadores potenciales cumplen todos estos criterios. Los metanálisis en este campo son, por ejemplo, susceptibles a un importante sesgo de publicación106. Además, se desconoce la manera exacta de integrar información adicional junto con los parámetros que informan los cálculos de riesgo habituales. Por último, son escasos los ECA para determinar si la información sobre el riesgo añadida finalmente conlleva mejoras en los desenlaces.
La evaluación de los potenciales modificadores del riesgo parece ser especialmente relevante si la puntuación de la persona se acerca a un umbral que requiera una toma de decisiones. En situaciones de bajo riesgo o muy alto riesgo, es menos probable que la información adicional altere las decisiones sobre el tratamiento. La cifra de personas en esta «área gris» es grande. Por lo tanto, la viabilidad se convierte en una limitación a medida que los modificadores sean más complejos o caros, como las pruebas de imagen.
Se debe tener cuidado de no utilizar los modificadores del riesgo únicamente para incrementar las estimaciones de riesgo cuando el perfil del factor modificable no sea favorable, pero también a la inversa. Aunque un factor de riesgo modificable que es desfavorable puede aumentar el riesgo estimado de una persona, un perfil más favorable que el pronosticado con base en otras características del paciente debe tener el efecto contrario. Por último, es importante reconocer que el grado en que se afecta el cálculo del riesgo absoluto por los factores modificables es generalmente mucho menor que los RR (independientes) que se documentan con estos factores de riesgo modificables en la literatura107.
Tomando todo esto en consideración, en esta sección se resume lo publicado sobre diversos factores poblacionales de riesgo modificables.
3.3.1Factores psicosocialesEl estrés psicosocial se asocia, con un patrón dosis-respuesta, con el desarrollo y la progresión de la EA independientemente de los factores de riesgo convencionales y el sexo. El estrés psicosocial incluye síntomas de estrés (p. ej., síntomas de trastornos mentales) y estresores como la soledad y los acontecimientos vitales importantes. Los RR del estrés psicosocial son generalmente de 1,2 y 2,0108,109 (tabla 4 del material adicional). Por el contrario, los indicadores de salud mental, como el optimismo y un fuerte sentido del propósito, se asocian con menos riesgo109. El estrés psicosocial tiene efectos biológicos directos, pero también se correlaciona con los factores de riesgo socioeconómicos y conductuales (como tabaquismo y baja adherencia)100,109–113. Aunque las asociaciones del estrés psicosocial con la salud cardiovascular son robustas, solo se ha demostrado que el «agotamiento vital» mejora la reclasificación del riesgo101. Debido a la importancia de los síntomas de estrés entre los pacientes con EA, diversas guías y declaraciones científicas recomiendan el cribado de EA para pacientes con estrés psicológico113–115 (cuadro 2 y tabla 5 del material adicional). Un reciente estudio de cohortes con una media de seguimiento de 8,4 años informó de los efectos favorables del cribado de depresión ante eventos ateroescleróticos importantes102.
3.3.2EtniaEn Europa hay muchos ciudadanos con orígenes étnicos en lugares como India, China, el norte de África y Pakistán. Ninguna escala de riesgo funciona adecuadamente en todos estos grupos, dada la considerable variación en los factores de riesgo de EA entre grupos inmigrantes. En su lugar, sería útil utilizar un factor multiplicador para incorporar a la escala de riesgo todos los factores de riesgo cardiovascular derivados de la etnia independientemente de otros factores de riesgo. Los datos contemporáneos más relevantes provienen de los resultados del QRISK3 en Reino Unido105, aunque el estudio se centra en un espectro de desenlaces cardiovasculares más amplio y no solo en la mortalidad por ECV.
Los inmigrantes del sur de Asia (especialmente India y Pakistán) presentan tasas de riesgo cardiovascular más altas independientemente de otros factores de riesgo, mientras que los factores de riesgo de ECV ajustados parecen más bajos en la mayoría de otros grupos étnicos. Los motivos de estas diferencias siguen careciendo de estudios, así como los riesgos asociados con otros orígenes étnicos. Basándose en tales datos, podrían aplicarse los siguientes factores de corrección basados en datos de Reino Unido para la evaluación del riesgo de ECV con calculadoras105. Lo mejor sería usar calculadoras de riesgo y RR específicos de cada país, ya que el impacto de la etnia puede variar entre regiones y calculadoras.
- •
Sur de Asia: multiplicar el riesgo por 1,3 para India y Bangladés y por 1,7 para Pakistán.
- •
Otros grupos asiáticos: multiplicar el riesgo por 1,1.
- •
Negros del Caribe: multiplicar el riesgo por 0,85.
- •
Africanos negros y chinos: multiplicar el riesgo por 0,7.
| Cuadro 2. Temas básicos/esenciales para la evaluación psicosocial | |
|---|---|
| Evaluación diagnóstica simultánea | Al menos 1 de cada 5 pacientes tiene diagnosticado un trastorno mental, que generalmente se presenta con síntomas físicos (p. ej., opresión torácica, disnea). Por lo tanto, los médicos deben prestar a las causas somáticas de los síntomas la misma atención que a las emocionales |
| Cribado | Se recomiendan instrumentos para el cribado de la depresión, la ansiedad y el insomnio (p. ej., Cuestionario de Salud del Paciente [PHQ]116) (véase la tabla 5 del material adicional)117,118 |
| Estresores | Se puede iniciar una conversación sobre estresores importantes con unas preguntas simples112: ¿está usted estresado por el trabajo, problemas de dinero, problemas familiares, soledad o cualquier otro evento importante? |
| Necesidad de apoyo para la salud mental | ¿Estaría usted interesado en que le derivemos a un psicoterapeuta o a una consulta de salud mental? |
La puntuación de calcio coronario (CAC) puede reclasificar el riesgo de ECV por aumento o disminución, junto con los factores de riesgo clásicos, y por ello debe considerarse en varones y mujeres con cálculos de riesgo cercanos al umbral de decisión103,104. Sin embargo, debe considerarse la disponibilidad y la rentabilidad del cribado de CAC locales y regionales (véase la sección 2.3 sobre rentabilidad). Si se determina que hay calcificación coronaria, se debe comparar su extensión con la esperada para un paciente de iguales sexo y edad. Una CAC más alta de lo esperado aumenta el riesgo calculado, mientras que un CAC nulo menor de lo esperado se asocia con una disminución del riesgo calculado. La determinación de la CAC no ofrece información directa sobre la carga de placas o la gravedad de la estenosis y puede ser baja e incluso nula en pacientes de mediana edad con placas blandas sin calcificar. Se recomienda a los profesionales de la salud consultar los protocolos disponibles para los detalles sobre cómo evaluar e interpretar las puntuaciones de CAC.
3.3.3.2Angiografía por tomografía computarizada con contrasteLa angiografía por tomografía computarizada (angio-TC) con contraste permite la identificación de estenosis coronarias y predice eventos cardiacos119. En el estudio SCOT-HEART (Scottish Computed Tomography of the Heart), las tasas de muerte coronaria o infarto de miocardio a 5 años se redujeron mediante la angio-TC con contrate en pacientes con dolor torácico crónico120. La reducción relativa de infartos de miocardio fue similar en pacientes con dolor torácico no cardiaco. Se desconoce si la angio-TC mejora la clasificación del riesgo o añade valor pronóstico a la puntuación de CAC.
3.3.3.3Ecografía carotídeaNo se recomienda utilizar sistemáticamente del grosor intimomedial (GIM) para mejorar la evaluación del riesgo debido a la falta de estabilización metodológica y la ausencia de valor añadido de la GIM en la predicción de futuros eventos cardiovasculares, incluso para el grupo de riesgo intermedio121.
Las placas se definen como un engrosamiento parietal focalizado al menos un 50% mayor que la pared vascular que la rodea o como una región focalizada con un GIM carotídeo ≥ 1,5 mm que obstruye la luz122. Aunque la evidencia es menos considerable que en el CAC, la determinación de placas carotídeas con ecografía probablemente también reclasifique el riesgo de ECV104,122 y se la puede considerar un modificador del riesgo en pacientes con riesgo intermedio cuando no sea posible determinar el CAC.
3.3.3.4Rigidez arterialLa rigidez arterial suele determinarse con la velocidad de onda del pulso o el índice de aumento arterial. Los estudios indican que la rigidez arterial predice el futuro riesgo de ECV y mejora la reclasificación del riesgo123. Sin embargo, las dificultades para determinarla y los importantes sesgos de publicación106 son argumentos contra su empleo generalizado.
3.3.3.5Índice tobillo-brazoSe estima que un 12-17% de las personas de mediana edad tienen un índice tobillo-brazo (ITB) < 0,9, y aproximadamente un 50-89% de ellos no tienen claudicación típica124. Un metanálisis de datos de pacientes individuales concluyó que el potencial de reclasificación del ITB era escaso, quizá con la excepción de las mujeres con riesgo intermedio.
3.3.3.6EcocardiografíaNo se recomienda la ecocardiografía para mejorar la predicción del riesgo de ECV debido a la falta de pruebas fehacientes de que esta técnica de imagen mejore la reclasificación del riesgo de ECV.
3.3.4FragilidadLa fragilidad es un estado multidimensional, independiente de la edad y la multimorbilidad, que hace a las personas más vulnerables a los estresores. Constituye un factor funcional de riesgo de desenlaces adversos como gran morbilidad y mortalidad tanto cardiovascular como no cardiovascular126,127.
La fragilidad no es lo mismo que el envejecimiento y no se debería confundirlos. La incidencia de fragilidad aumenta con la edad, pero personas de la misma edad cronológica pueden tener distintos estados de salud y vitalidad. La «edad biológica» es mucho más importante para el estado de salud (que incluye las características de fragilidad) y los eventos clínicos (que incluye eventos CV)126,127. Asimismo, aunque la presencia de comorbilidades puede exacerbar la fragilidad de una persona, la fragilidad no es lo mismo que la multimorbilidad (véase la sección 6.7).
El cribado de fragilidad está indicado para todo paciente anciano, pero se debería cribar a todo paciente, cualquiera sea su edad, que presente riesgo de envejecimiento acelerado126,127. La mayoría de los instrumentos se relacionan con características de la fragilidad como lentitud, debilidad y escasa actividad física (AF), agotamiento y encogimiento (p. ej., escala de Fried, escala de fragilidad de la Clínica Rockwood, fuerza de la mano y velocidad de la marcha)126–129 y la evaluación de la fragilidad es importante en cada estadio de la EA. Sin embargo, la evaluación de la fragilidad es más difícil durante un evento cardiovascular agudo y se basa en los antecedentes o debería posponerse hasta la recuperación del paciente.
La fragilidad es un potencial factor modificador del riesgo de ECV total. Se ha demostrado el impacto de la fragilidad en el riesgo de ECV en todo el espectro de EA: personas con factores de riesgo de EA o con EA subclínica, EA estable o síndromes cerebrales y coronarios e IC126–130; la fragilidad, más que los factores de riesgo de ECV clásicos, es lo que predice tanto la mortalidad por todas las causas como la mortalidad cardiovascular de los pacientes de edad muy avanzada130,131. Cabe destacar que la capacidad de las determinaciones de la fragilidad para mejorar la predicción del riesgo de ECV no se ha evaluado formalmente. Por lo tanto, no se recomienda integrar las medidas de fragilidad en la evaluación formal del riesgo de ECV.
Es importante subrayar que la fragilidad puede influir en el tratamiento. Las intervenciones no farmacológicas (como nutrición equilibrada, suplementación con micronutrientes, ejercicio de entrenamiento, activación social) que buscan prevenir, atenuar o revertir la fragilidad son extremadamente importantes126,127,132. En cuanto a la farmacoterapia y el implante de dispositivos, la evaluación de la fragilidad no es un método para determinar la elegibilidad para un tratamiento dado, sino que ayuda a construir un plan de cuidados generalizado con prioridades predefinidas. Las personas frágiles generalmente tienen comorbilidades y polifarmacia y pueden ser más susceptibles a efectos secundarios de los fármacos y las complicaciones graves de procedimientos invasivos y quirúrgicos126,127.
3.3.5Antecedentes familiaresLos antecedentes familiares de ECV prematura son un indicador simple de riesgo cardiovascular que reflejan la interacción entre la genética y el medio ambiente133. En los pocos estudios que han evaluado simultáneamente los efectos de los antecedentes familiares y la genética, los antecedentes familiares siguieron asociados de manera significativa con la ECV tras ajustar las puntuaciones por genética134,135. Sin embargo, los antecedentes familiares solo mejoran marginalmente la predicción de riesgo de ECV con los factores de riesgo de EA136–141. Entre las posibles explicaciones, la variedad de definiciones de los antecedentes familiares que se aplican y que los factores de riesgo de EA convencionales explican de largo el impacto de los antecedentes familiares.
Los antecedentes familiares de ECV prematura son una información simple y barata que puede desencadenar la evaluación del riesgo de personas con estos antecedentes136.
3.3.6GenéticaLa etiología de la EA tiene un componente genético, pero este dato no se utiliza actualmente en los enfoques preventivos142. Los avances en las puntuaciones de riesgo poligénicas para la estratificación del riesgo podrían aumentar las aplicaciones de la genética a la prevención143–145. Sin embargo, no hay un consenso sobre qué genes y sus correspondientes polimorfismos de un solo nucleótido se deben incluir para la EA ni sobre la aplicación de las puntuaciones de riesgo específicas a los factores de riesgo o los denselances146. La puntuación de riesgo poligénico ha mostrado cierto potencial para mejorar la predicción del riesgo de EA en prevención primaria147–149, pero la precisión de la mejora en la predicción es relativamente baja y se necesitan más estudios tanto en varones como en mujeres150,151. También se necesita más evidencia para evaluar la utilidad clínica de las puntuaciones de riesgo poligénicas en otros contextos clínicos, como los pacientes con EA preexistente152.
3.3.7Determinantes socioeconómicosEl bajo nivel socioeconómico y el estrés laboral se relacionan de manera independiente con el pronóstico y la aparición de EA en ambos sexos153,154. La asociación más fuerte se ha encontrado entre los ingresos bajos y la mortalidad por ECV, con RR=1,76 (intervalo de confianza del 95% [IC95%], 1,45-2,12)155. El estrés laboral está determinado por el desgaste laboral (como la combinación de gran exigencia y escasa decisión sobre el trabajo) y el desequilibrio entre esfuerzos y recompensas. Hay evidencia preliminar de que el impacto nocivo del estrés laboral en la EA es independiente de los factores de riesgo convencionales y su tratamiento156.
3.3.8Exposición medioambientalLa exposición medioambiental con potencial de modificar el riesgo de ECV incluye la contaminación atmosférica y del suelo y una cantidad de ruido por encima de los umbrales. Evaluar la exposición acumulada por el individuo a los contaminantes y el ruido sigue siendo un reto pero, cuando sea posible, podría influir en la evaluación del riesgo individual.
Entre los componentes de la contaminación del aire exterior, están las partículas áreas (con tamaños que van desde las gruesas de 2,5-1,0μm de diámetro hasta las partículas finas < 2,5 μm y ultrafinas < 0,1 μm) y los contaminantes gaseosos (como ozono, dióxido de nitrógeno, componentes orgánicos volátiles, monóxido de carbono o dióxido de sulfuro) producidos principalmente por la quema de combustibles fósiles. La contaminación del agua y el suelo también es factor de riesgo modificable. Una mayor exposición al plomo, el arsénico y el cadmio se asocia con múltiples desenlaces cardiovasculares como hipertensión, EC, ictus y mortalidad cardiovascular157. La contaminación atmosférica por partículas se ha clasificado recientemente como uno de los principales factores de riesgo de mortalidad modificables en todo el mundo158. En un modelo reciente se estimó que la pérdida de expectativa de vida debido a la contaminación atmosférica es similar, si no superior, a la del tabaquismo y representa un exceso de mortalidad mundial estimado de 8,8 millones/año159.
Los efectos atribuibles a corto plazo en la mortalidad se relacionan principalmente con la exposición a partículas, dióxido de nitrógeno y ozono, con un aumento medio del 1,0% en la mortalidad por todas las causas y un aumento de 10μm/m3 en la exposición a partículas de 2,5μm, mientras que los efectos a largo plazo se relacionan principalmente con partículas de 2,5μm. La evidencia que relaciona la exposición a partículas y los eventos cardiovascular se basa en grandes estudios epidemiológicos y estudios experimentales. La relación con la EA varía, pero la mayoría de los estudios de cohortes vinculan la contaminación atmosférica a largo plazo con un aumento del riesgo de EC mortal y no mortal y con ateroesclerosis subclínica. La evidencia indica que la reducción de partículas de 2,5μm está relacionada con mejorías en la inflamación, la trombosis y el estrés oxidativo y con una disminución de las muertes por cardiopatía isquémica38,160,161. Ya que las estimaciones precisas de exposición individual son difíciles de obtener, actualmente resulta complicado cuantificar una reclasificación formal del riesgo.
Recomendaciones sobre el riesgo cardiovascular relacionado con la contaminación atmosférica
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se debe instar a los pacientes con (muy) alto riesgo de ECV para que eviten la exposición a largo plazo en regiones con alta contaminación atmosférica | IIb | C |
| En regiones donde las personas están expuestas a altos niveles de contaminación atmosférica, se puede considerar programas de cribado (oportunista) del riesgo | IIb | C |
ECV: enfermedad cardiovascular.
a Clase de recomendación.
b Nivel de evidencia.
Se ha señalado que muchos biomarcadores mejoran la estratificación del riesgo. Algunos pueden ser causales —p. ej., la lipoproteína(a) refleja una fracción lipídica patogénica—, mientras que otros pueden reflejar mecanismos subyacentes —la proteína C reactiva refleja inflamación— o indicar daño cardiaco inicial —como los péptidos natriuréticos o la troponina cardiaca de alta sensibilidad—.
En la guía de 20162 no se recomendaba el empleo sistemático de biomarcadores porque la mayoría no mejoran la predicción del riesgo y los sesgos de publicación tergiversan mucho la evidencia106,162. Estudios recientes confirman que la proteína C reactiva tiene poco valor adicional103. La lipoproteína(a) ha despertado interés nuevamente, pero su potencial para la reclasificación tiene poco valor adicional163,164. Los biomarcadores cardiacos son prometedores165,166, pero se necesita más investigación sobre el tema.
3.3.10Composición corporalEn las últimas décadas, en todo el mundo el IMC de niños, adolescentes y adultos ha aumentado considerablemente43. En estudios observacionales, la mortalidad por todas las causas es mínima con un IMC de 20-25, con una relación en forma de J o de U para fumadores actuales45,46. Los análisis de aleatorizaciones mendelianas indican una relación lineal entre el IMC y la mortalidad en quienes nunca han fumado y una relación en J en quienes alguna vez hayan fumado44. En un metanálisis se concluyó que tanto el IMC como la circunferencia de la cintura tienen fuerte asociación continua, y de modo similar, con la EA en ancianos y jóvenes, tanto varones como mujeres.
Hay evidencia contradictoria sobre los pacientes con EA establecida. Las revisiones sistemáticas de pacientes con SCA o IC muestran la «paradoja de la obesidad», en la que esta parece tener un efecto protector167,168,169. Sin embargo, estas evidencias deberían interpretarse con cautela, ya que podrían estar influidas por la causalidad inversa y otros sesgos45.
3.3.10.1¿Qué índice de obesidad es el mejor predictor de riesgo cardiovascular?El IMC se puede determinar fácilmente y se utiliza mucho para definir categorías de peso corporal (tabla 6 del material adicional). Las grasas corporales ectópicas conllevan un mayor riesgo que la grasa subcutánea. Existen muchas medidas de grasa abdominal en el mundo; de ellas, la circunferencia de la cintura es la más fácil de medir. Los umbrales de la OMS para circunferencias de la cintura están ampliamente aceptados en Europa. Hay 2 niveles de acción recomendados:
- •
Circunferencia de la cintura ≥ 94cm en varones y ≥ 80cm en mujeres: evite la ganancia ponderal.
- •
Circunferencia de la cintura ≥ 102 en varones y ≥ 88 en mujeres: se recomienda la pérdida ponderal.
Puede que se precisen distintos umbrales de medidas antropométricas para etnias diferentes.
El fenotipo de «obesidad metabólica sana», definido como obesidad en ausencia de factores de riesgo metabólicos, ha suscitado interés. Los resultados a largo plazo respaldan la noción de que la obesidad metabólica sana es una fase transitoria hacia anomalías glucometabólicas, más que un «estado» en sí170.
3.3.10.2Reclasificación del riesgoLas relaciones del IMC, la circunferencia de la cintura y el índice cintura-cadera con la ECV se mantienen tras ajustar por los factores de riesgo convencionales. Sin embargo, estas medidas no mejoran la predicción del riesgo cardiovascular evaluado por reclasificación47.
Recomendaciones sobre la evaluación cardiovascular en cuadros clínicos específicos
| Cuadros clínicos | Recomendaciones | Clasea | Nivelb |
|---|---|---|---|
| IRC | Para todo paciente con IRC en evolución, con o sin DM, se recomienda el oportuno cribado de EA y determinar la albuminuria172 | I | C |
| Cáncer | Se recomienza monitorizar la disfunción cardiaca con técnicas de imagen y biomarcadores en sangre antes, periódicamente durante el tratamiento oncológico y despué173 | I | B |
| Para pacientes con alto riesgo (con dosis acumuladas o radioterapia combinada) tratados con quimioterapia que contiene una antraciclina, se puede considerar la cardioprotección para prevenir la disfunción del VI174,175 | IIb | B | |
| Se recomienda el cribado de los factores de riesgo de EA y la optimización del perfil de riesgo de ECV de los pacientes en tratamiento oncológico | I | C | |
| EPOC | Se recomienda cribar de EA y factores de riesgo de EA a todo paciente con EPOC | I | C |
| Enfermedades inflamatorias | Se puede considerar la evaluación del riesgo total de ECV de los adultos con enfermedades inflamatorias crónicas176 | IIb | B |
| Para todo paciente con artritis reumatoide, se debe considerar multiplicar el riesgo total de ECV por 1,5177,178 | IIa | B | |
| Migrañas | Se debe considerar la presencia de migrañas con aura en la evaluación del riesgo de ECV179–181 | IIa | B |
| Se puede considerar que las mujeres con migraña con aura eviten los anticonceptivos hormonales combinados182,183 | IIb | B | |
| Trastorno del sueño y AOS | Se recomienda el cribado de sueño no reparador (p. ej., con la pregunta: «¿cada cuánto tiene problemas para quedarse o mantenerse dormido o duerme demasiado?») para pacientes con EA, obesidad e hipertensión | I | C |
| Se recomienda la derivación a un especialista cuando haya importantes problemas de sueño que en 4 semanas no han respondido a las medidas de higiene del sueño | I | C | |
| Trastornos mentales | Se recomienda considerar que los trastornos mentales, ya sea con deterioro funcional significativo o disminución del recurso a los servicios de salud, influyen en el riesgo de ECV | I | C |
| Enfermedades específicas del sexo | Se debe considerar el cribado de hipertensión y DM para las mujeres con antecedentes de preeclampsia o hipertensión inducida por el embarazo184–187 | IIa | B |
| Se debe considerar el cribado periódico de DM para las mujeres con antecedentes de síndrome del ovario poliquístico o DM gestacional188–191 | IIa | B | |
| Se debe considerar el cribado periódico de hipertensión y DM para las mujeres con antecedentes de muerte fetal o parto prematuro192,193 | IIb | B | |
| Se debe considerar la evaluación del riesgo de los varones con DE | IIa | C |
DE: disfunción eréctil; DM: diabetes mellitus; EA: enfermedad ateroesclerótica; ECV: enfermedad cardiovascular; EPOC: enfermedad pulmonar obstructiva crónica; IRC: insuficiencia renal crónica.
a Clase de recomendación.
b Nivel de la evidencia.
Se recomienda una evaluación exhaustiva del riesgo de ECV de los pacientes con una composición corporal no saludable. Las principales secuelas de la obesidad relacionadas con el riesgo son hipertensión, dislipemia, insulinorresistencia, inflamación sistémica, estado pretrombótico, albuminuria, disminución de la tasa de filtrado glomerular estimada (TFGe)171 y aparición de DM2, eventos cardiovasculares, IC y FA.
3.4Cuadros clínicosLos riesgos de ECV individuales calculados según los factores de riesgo clásicos con puntuaciones de riesgo pueden ajustarse con potenciales factores modificadores del riesgo, como se señala en la sección 3.3. Más allá de estos potenciales factores modificadores del riesgo, ciertos cuadros clínicos pueden influir en el riesgo de ECV. Estos generalmente aumentan la posibilidad de ECV o se asocian con un peor pronóstico clínico. Esta sección revisa alguno de estos cuadros clínicos, que por lo general no se incluyen en las puntuaciones de riesgo tradicionales pero pueden integrarse en algunas puntuaciones de riesgo nacionales, y se analizará cómo pueden aumentar el riesgo.
Muchos factores de riesgo de ECV y EA se solapan en el mismo cuadro clínico, por lo que el tratamiento de los factores de riesgo permite una reducción sinérgica de la carga total de enfermedad.
3.4.1Enfermedad renal crónicaLas personas con enfermedad renal crónica (ERC) que no han recibido tratamiento de sustitución renal fueron aproximadamente 850 millones en 2017 en todo el mundo194. Esta cifra incluye una prevalencia del 10-12% entre varones y mujeres. La IRC es la tercera causa de mortalidad total con mayor crecimiento195.
La IRC se define como anormalidades en la estructura o la función renal con complicaciones de salud durante más de 3 meses. Los criterios y los marcadores de daño renal, especialmente nefropatía diabética, son la albuminuria (cociente albúmina/creatinina > 30 mg/g en muestras de orina puntuales) y TFG < 60ml/min/1,73 m2. La TFG se puede estimar (TFGe) con las ecuaciones calibradas para estimar la creatinina sérica con la fórmula CKD-EPI. Se distinguen 2 estadios (categorías) de gravedad de la nefropatía según la TFG y la albuminuria. Un paciente con una TFGe < 60ml/min/1,73 m2 se clasifica como IRC en estadio 3a, que representa deterioro grave de la función renal172.
La ECV es la principal causa de morbilidad y muerte de los pacientes con ERC196. Incluso ajustar por los factores de riesgo de EC, como DM e hipertensión, el riesgo de muerte aumenta progresivamente con el deterioro de la ERC197. A medida que la TFG disminuye por debajo de unos 60-75ml/min/1,73 m2, la probabilidad de sufrir EC aumenta de manera lineal198, con hasta el triple de riesgo de mortalidad cardiovascular al llegar a una TFGe de 15ml/min/1,73 m2. La nefropatía se asocia con un riesgo de ECV muy alto. Hay una alta prevalencia de factores de riesgo de EC, como DM e hipertensión, entre las personas con ERC. Las puntuaciones de CAC para la estratificación del riesgo de pacientes con ERC son un instrumento prometedor199–203. Más aún, los pacientes con ERC también están expuestos a factores de riesgo de EA no tradicionales, como los relacionados con la uremia: inflamación, estrés oxidativo y promotores de la calcificación vascular. La ERC y la insuficiencia renal no solo aumentan el riesgo de EC, también modifican su presentación clínica y los síntomas principales204.
3.4.2Fibrilación auricularParece que la FA se asocia con un aumento del riesgo de muerte, ECV y nefropatía205. Además, parece que la FA es un factor de riesgo de ECV más potente en mujeres que en varones206.
La prevalencia de la FA varía del 2 al 4% y se espera que se multiplique por 2,3, debido en parte al envejecimiento poblacional y a la intensificación del cribado de FA sin diagnosticar, así como menos muertes cardiovasculares207. La incidencia ajustada por edad, la prevalencia y el riesgo de por vida de FA son menores en mujeres que en varones y también es menor en cohortes no blancas frente a las blancas208,209. La estimación del riesgo vitalicio de FA actualmente es de 1 de cada 3 personas de ascendencia europea a la edad índice de 55 años210. La carga de factores de riesgo de EA y comorbilidades, lo cual incluye los factores de estilo de vida, y la edad afectan significativamenet al riesgo vitalicio de FA211–213. El efecto clínico observado de la carga de factores de riesgo de EA y múltiples comorbilidades en el riesgo vitalicio de FA (que está aumentando significativamente del 23,4% en personas con un buen perfil de factores de riesgo al 33,4 y el 38,4% en aquellos con factores de riesgo clínico limítrofes y elevados respectivamente)214 indica que la intervención temprana y el control de los factores de riesgo de EA modificables podrían reducir la incidencia de la FA. La progresión de un estilo de vida poco saludable a factores de riesgo y ECV puede contribuir al remodelado auricular/miocardiopatía y la aparición de FA, que generalmente resulta de la interacción de diversos factores (figura 9)215. El tratamiento de los factores de riesgo y la ECV reduce la carga de FA. El tratamiento dirigido a los cuadros clínicos subyacentes puede mejorar significativamente el mantenimiento del ritmo sinusal de los pacientes con FA persistente e IC216. Sin embargo, en los estudios centrados en el tratamiento aislado de cuadros clínicos específicos (p. ej., hipertensión), se obtuvieron resultados contradictorios217.
El riesgo anual general de ictus isquémico para los pacientes con FA es del 5%, pero varía considerablemente dependiendo de las comorbilidades215. Los ictus cardioembólicos asociados con FA suelen ser más graves y muchas veces recurrentes218. Además, la FA parece ser un predictor de ictus más potente en mujeres que en varones215. La FA también se asocia con un deterioro de la función cognitiva que varía de leve a demencia219. La FA se asocia de manera independiente con un aumento del riesgo de muerte por cualquier causa por 2 en mujeres y por 1,5 en varones220. En una población, las causas más comunes de muerte fueron IC (14,5%), malignidad (23,1%) e infección/sepsis (17,3%), mientras que la mortalidad relacionada con el ictus fue solo del 6,5%221. Estos datos indican que, además del tratamiento anticoagulante y para la IC, se debe tratar activamente las comorbilidades para reducir la mortalidad y la morbilidad asociadas con la FA.
En cuanto a la PA, tanto los estilos de vida sedentarios como la PA alta se asocian con la aparición de FA (curva en U), aunque a través de diferentes mecanismos. Más aún, cuando la FA aparece en deportistas, esta no se asocia con el mismo aumento del riesgo de ictus.
3.4.3Insuficiencia cardiacaLa IC de origen isquémico es una grave manifestación clínica de la EA. Por el contrario, la propia IC (predominantemente de etiología isquémica) aumenta el riesgo de eventos cardiovasculares (infarto de miocardio, arritmias, ictus isquémico y muerte cardiovascular).
La disfunción del VI asintomática (disfunción sistólica o diastólica) y sintomática (en todo el espectro de FEVI: IC con fracción de eyección reducida [IC-FEr], IC con fracción de eyección en rango medio222 e IC con fracción de eyección conservada [IC-FEc]) aumenta el riesgo de hospitalización urgente (lo que incluye las hospitalizaciones por empeoramiento de la IC) y muerte cardiovascular y por cualquier causa.
Los efectos adversos en los desenlaces clínicos se han demostrado en pacientes asintomáticos libres de ECV sintomática, pacientes con infarto agudo de miocardio previo y pacientes con ictus agudo previo y con otras manifestaciones clínicas de ECV223.
El diagnóstico de IC isquémica otorga a los pacientes un riesgo cardiovascular muy alto y justifica las recomendaciones sobre estrategias terapéuticas para prevención secundaria. Además, se recomiendan múltiples fármacos para la reducción del riesgo de morbilidad y mortalidad cardiovascular de los pacientes con IC-FEr sintomática (véase la sección 6.2).
3.4.4CáncerEl cáncer y los factores de riesgo de EA se solapan en los pacientes con cáncer, ya que comparten mecanismos biológicos y predisposiciones genéticas. Su prevención y tratamiento, por lo tanto, son beneficiosos en la reducción del riesgo tanto de ECV como de cáncer. Más aún, las tasas de extensión del riesgo de ECV dependen de la toxicidad cardiovascular de los tratamientos y de factores relacionados con los pacientes. Debido a las recientes mejoras en los desenlaces clínicos para muchos pacientes con cáncer, la mortalidad por ECV a la larga puede exceder la de la mayoría de las formas recurrentes del cáncer224,225.
La creciente variedad de nuevos fármacos oncológicos y tratamientos adyuvantes ha mostrado una amplia gama de efectos secundarios cardiovasculares precoces y tardíos, como miocardiopatía, disfunción del VI, IC, hipertensión, EC, arritmias y otras lesiones. Por lo tanto, las estrategias efectivas para la predicción y prevención de las toxicidades cardiovasculares son extremadamente importantes. La latencia y la gravedad de la cardiotoxicidad de la radioterapia, así como la aceleración de la ateroesclerosis y la enfermedad cerebrovascular, se relacionan con múltiples factores como la dosis (total por fracción), el volumen de corazón irradiado, la administración concomitante de otros fármacos cardiotóxicos y factores individuales del paciente (como una edad más joven, los factores de riesgo clásicos y los antecedentes de cardiopatías)226,227. Más aún, la radioterapia y la quimioterapia pueden tener efectos vasculares directos y aumentar el riesgo de desenlaces CV cardiovasculares relacionados con la ateroesclerosis227,228.
3.4.4.1Diagnóstico y cribadoLos signos y los síntomas de la disfunción cardiaca deben monitorizarse antes y periódicamente durante el tratamiento oncológico para la detección precoz de anormalidades en pacientes que reciban quimioterapia potencialmente cardiotóxica. En la actualidad se recomiendan la detección de alteraciones subclínicas con técnicas de imagen y la determinación de biomarcadores en sangre (como las troponinas cardiacas y los péptidos natriuréticos)173,229. La determinación del esfuerzo miocárdico, especialmente el strain longitudinal sistólico, puede preceder a un deterioro significativo de la FEVI230–233.
3.4.4.2Prevención de la cardiotoxicidad y factores de riesgo cardiovascularLos resultados de los ECA sobre tratamientos preventivos con inhibidores del sistema renina-angiotensina-aldosterona (SRAA) o bloqueadores beta tras trastuzumab o antraciclinas son contradictorios230,234,235. Los principales beneficios son un remodelado del VI menos marcado o una reducción de la FEVI durante la resonancia magnética cardiaca, pero que esto se traduzca en mejores desenlaces sigue sin estar claro.
Se debe recomendar encarecidamente el ejercicio. El ejercicio aeróbico en particular se considera una estrategia no farmacológica prometedora para prevenir o tratar la toxicidad de la quimioterapia236. Un estudio mostró un riesgo de ECV significativamente más alto en supervivientes a cáncer infantil que en otros controles adultos sin cáncer y, especialmente, en supervivientes a cáncer de inicio en la edad adulta con factores de riesgo de EA subyacentes237. Por lo tanto, para esta población se recomienda el tratamiento agresivo de los factores de riesgo de EA.
3.4.5Enfermedad pulmonar obstructiva crónicaLa enfermedad pulmonar obstructiva crónica (EPOC) es una enfermedad respiratoria compleja y progresiva que actualmente es la cuarta causa de muerte en el mundo. Se caracteriza por la limitación crónica del flujo de aire con síntomas respiratorios y se asocia con un aumento de la respuesta inflamatoria y alteraciones de las vías respiratorias causadas por una exposición significativa a partículas o gases nocivos (principalmente por tabaquismo). Aunque la EPOC se reconoce y se ha estudiado ampliamente como una comorbilidad cardiovascular, su papel como factor de riesgo de EA no está bien determinado. Aun así, los pacientes con EPOC tienen un aumento del riesgo de ECV de 2-3 veces mayor que los controles emparejados por edad con ajuste por consumo de cigarrillos. Para los pacientes con EPOC de leve a moderada, la probablidad de morir por EA es 8-10 veces mayor que por insuficiencia respiratoria, con tasas más altas de hospitalización y muerte por ECV, ictus e IC238,239. La ECV tampoco se diagnostica: se diagnostica ECV a menos de un tercio de los pacientes con EPOC y evidencia electrocardiográfica de infarto de miocardio240. Por cada disminución del 10% del volumen espiratorio forzado en el primer segundo (VEF1), la mortalidad cardiovascular aumenta un 28% y la frecuencia de eventos coronarios no mortales, un 20%241. Las exacerbaciones agudas de la EPOC, causadas principalmente por infecciones, son recurrentes y aumentan 4 veces los eventos cardiovasculares242. El riesgo tanto de infarto de miocardio como de ictus isquémico aumenta en los 3 meses tras una exacerbación aguda243.
La alta prevalencia de ECV en los pacientes con EPOC puede explicarse porque ambas enfermedades comparten factores de riesgo, como tabaquismo, envejecimiento, hipertensión y dislipemia244. El 34% de los pacientes con EPOC presentan síndrome metabólico y escasa AF, y los componentes más prevalentes son la hipertensión (56%), la obesidad abdominal (39%) y la hiperglucemia (44%)245. La ECV puede estar causada por hipoxia durante el ejercicio debido a la hiperinflación pulmonar, la frecuencia cardiaca elevada en reposo, la capacidad de vasodilatación disminuida y el estrés neurohumoral simpático periférico y cardiaco. La ateroesclerosis y la calcificación coronaria pueden ser resultado del estrés oxidativo y las reducciones de las moléculas antienvejecimiento que causan envejecimiento pulmonar y vascular246. La inflamación sistémica es importante en la EPOC, con altas concentraciones sanguíneas de biomarcadores asociados con aumento de la mortalidad247. La troponina se eleva durante la exacerbación aguda de la EPOC y el 10% de los pacientes hospitalizados cumplen la definición de infarto agudo de miocardio (IAM)248. Si la concentración de péptido natriurético cerebral está aumentada, aumenta el riesgo de muerte249.
La inflamación sistémica y el estrés oxidativo causados por la EPOC promueven el remodelado vascular, la rigidez y la ateroesclerosis e inducen un estado «procoagulante» que afecta a todo el sistema vascular250. El deterioro cognitivo se relaciona con la gravedad de la EPOC. Estos pacientes tienen un aumento del 20% del riesgo de ictus isquémico y hemorrágico, que puede llegar a multiplicarse por 7 tras una exacerbación aguda251. Tienen EAP apropiadamente el 9% de los pacientes con EPOC252, que tienen casi el doble de riesgo de sufrir EAP253 y un aumento de la prevalencia de placas carotídeas relacionadas con la gravedad de la enfermedad254. Por último, la EPOC tiene relación directa con los aneurismas aórticos abdominales independientemente del tabaquismo255.
Las arritmias cardiacas son frecuentes y pueden deberse a los efectos hemodinámicos (hipertensión pulmonar, disfunción diastólica, remodelado auricular estructural y eléctrico) causados por la enfermedad junto con el desequilibrio autonómico y las alteraciones de la repolarización ventricular256. La FA es frecuente, tiene relación directa con el VEF1, generalmente se desencadena por exacerbaciones agudas de la EPOC y también es un predictor independiente de mortalidad hospitalaria por EPOC257,258. La EPOC también es un factor de riesgo de taquicardia ventricular con cualquier FEVI259 y de muerte súbita cardiaca independientemente de los factores de riesgo de ECV260.
La disfunción ventricular subclínica es común en la EPOC261, aunque la IC es 3,8 veces más común en pacientes con EPOC que en los controles262. Los pacientes con exacerbaciones agudas frecuentes presentan alta frecuencia de disfunción diastólica. El riesgo de IC-FEc es mayor debido a la alta prevalencia de hipertensión y DM263.
Tomando en consideración esta evidencia, es de gran importancia someter a los pacientes con EPOC a criba de la EA y los factores de riesgo de EA teniendo en cuenta que la EPOC afecta a la precisión de las pruebas de diagnóstico cardiovascular. Conseguir un nivel de ejercicio adecuado es difícil, los vasodilatadores para la perfusión miocárdica pueden estar contraindicados debido al riesgo de broncoespasmo y la ecocardiografía transtorácica o de esfuerzo están alteradas por ventanas ecográficas pobres. La angio-TC o la resonancia magnética pueden ser una opción, pero siguen siendo caras, llevan mucho tiempo y no siempre están disponibles.
Los fármacos para la EPOC (como los antagonistas muscarínicos de acción prolongada y los agonistas beta de acción prolongada) en general no se asocian con eventos cardiovasculares adversos en pacientes con EPOC estable. El olodaterol puede reducir el riesgo general de eventos cardiovasculares y el formoterol puede disminuir el riesgo de isquemia cardiaca. Los agonistas beta de acción prolongada pueden reducir la incidencia de hipertensión, pero también pueden aumentar el riesgo de IC, por lo que deberían emplearse con precaución en pacientes con IC264.
3.4.6Enfermedades inflamatoriasLas enfermedades inflamatorias aumentan el riesgo de ECV tanto agudo como a largo plazo. El mejor consejo sobre la inflamación crónica que aumenta el riesgo de ECV está disponible para la artritis reumatoide, que aumenta el riesgo de ECV en aproximadamente un 50% por encima de los factores de riesgo establecidos176. Por lo tanto, un umbral bajo para la evaluación del riesgo de ECV total es apropiado para los adultos con artritis reumatoide y se debe considerar un aumento del riesgo estimado según la actividad de la enfermedad176. También hay evidencia de un aumento del riesgo de ECV de aproximadamente el 20% en pacientes con enfermedad inflamatoria intestinal265.
El riesgo de ECV también puede aumentar con otras enfermedades inflamatorias crónicas, como la psoriasis177 y la espondilitis anquilosante178. Sin embargo, la evidencia es menos firme y la independencia de tales aumentos del riesgo respecto a los factores de riesgo de EA clásicos. Sin embargo, sería prudente al menos considerar la evaluación del riesgo de ECV en pacientes con cualquier enfermedad inflamatoria crónica y tener en consideración el curso de estas enfermedades cuando haya dudas sobre el inicio de intervenciones preventivas. La carga de enfermedad acumulada y el grado de inflamación reciente determinan de manera importante el aumento del riesgo.
Además del tratamiento antinflamatorio oportuno, el riesgo de ECV en las enfermedades inflamatorias debería tratarse con intervenciones similares a las de la población general en alto riesgo, ya que hay evidencia de que los métodos tradicionales para disminuir el riesgo (como el tratamiento hipolipemiante) son igualmente beneficiosos para la prevención de la EA.
3.4.7Infecciones (virus de inmunodeficiencia la humana, gripe, periodontitis)La infección por el virus de la inmunodeficiencia humana (VIH) se asocia con aumento del riesgo de EAEI y EC un 19% por encima del explicado por los factores de riesgo de ateroesclerosis clásicos266,267. Sin embargo, para aquellos con recuento de células CD4 < 200/μl, el riesgo de incidencia de eventos de EAEI es casi el doble, mientras que para aquellos con un recuento ≥ 500 células/μl no hay un exceso de riesgo de incidentes de EAEI en comparación con los no afectos268.
La ECV y la gripe se han relacionado desde hace tiempo debido a un solapamiento en el pico de incidencia de cada enfermedad durante los meses de invierno. Los estudios epidemiológicos han subrayado un aumento de muertes cardiovasculares durante las epidemias de gripe, lo que indica que las complicaciones cardiovasculares de la gripe, como la cardiopatía isquémica aguda y, menos frecuente, el ictus, contribuyen de modo importante a la morbilidad y la mortalidad durante la infección por gripe.
El riesgo de IAM o ictus es más de 4 veces mayor tras una infección de las vías respiratorias, con el riesgo más alto en los primeros 3 días tras el diagnóstico269. La prevención de la gripe, especialmente a través de la vacunación, podría prevenir los IAM desencadenados por gripe270.
Los estudios han vinculado la enfermedad periodontal con la ateroesclerosis y la ECV271–273, y los estudios serológicos han vinculado la alta titulación de anticuerpos contra las bacterias periodontales con la EA274. Sin embargo, si el tratamiento activo o la prevención de la periodontitis mejora, los pronósticos clínicos requieren más estudios a pesar de la evidencia preliminar275–277.
3.4.8MigrañasLa migraña es una enfermedad con alta prevalencia que afecta al 15% de la población general278. Existen 2 tipos principales de migraña: la migraña sin aura, que es el subtipo más común, y la migraña con aura, que representa aproximadamente un tercio de todas las migrañas. Ambas formas coexisten en muchos pacientes.
Los datos disponibles indican que la migraña se asocia generalmente con un aumento al doble del riesgo de ictus isquémico y un aumento de 1,5 veces en el riesgo de cardiopatía isquémica179–181,279,280. Estas asociaciones son más evidentes para la migraña con aura179,180,280. Dada la baja media de edad de la población afectada por migrañas, el aumento absoluto del riesgo individual es pequeño, pero el poblacional es alto debido a la alta prevalencia de migrañas281.
Diversas líneas de evidencia también indican que el riesgo vascular de los pacientes con migrañas puede aumentar con el consumo de cigarillos182 y anticonceptivos hormonales combiados183,281,283. Por lo tanto, las mujeres con migraña deben evitar los anticonceptivos hormonales combinados282,283. Sin embargo, se necesitan más datos de buena calidad que evalúen el riesgo de ictus asociado con dosis bajas de estrógenos en mujeres con migraña.
3.4.9Trastornos del sueño y apnea obstructiva del sueñoLos trastornos o las alteraciones de la duración del sueño se asocian con un aumento del riesgo de ECV284–286. En cuanto a la duración del sueño, 7 h parecen ser lo mejor para la salud cardiovascular287.
En la población general, la prevalencia de los trastornos generales del sueño es del 32,1%: el 8,2% por insomnio, el 6,1% por parasomnia, el 5,9% por somnolencia excesiva, el 12,5% por síndrome de piernas inquietas y movimientos repetitivos de las extremidades y el 7,1% por trastornos respiratorios del sueño (como la apnea obstructiva del sueño [AOS])288. Todos los trastornos del sueño se asocian contundentemente con trastornos mentales y comparten la hiperactivación como mecanismo subyacente289,290.
El trastorno de sueño más relevante es la AOS, que se caracteriza por episodios repetidos de apena, cada uno de ellos de más de 10 s de duración. A pesar de las fuertes relaciones de la AOS con la ECV, como hipertensión, ictus, IC, EC y FA, el tratamiento de la AOS con presión positiva en la vía aérea (PAP) no ha conseguido mejorar los desenlaces objetivos en pacientes con ECV establecida291–293. Por lo tanto, se necesitan intervenciones en conducta (reducción de la obesidad, abstinencia alcohólica), higiene del sueño y reducción del estrés además de la PAP290,294. En cuanto a la hipertensión y la AOS, la PAP tiene efectos pequeños en la PA, pero solo en pacientes con hipertensión resistente confirmada con MAPA que utilizan la PAP más de 5,8 h/noche295.
3.4.10Trastornos mentalesLa prevalencia a 12 meses de los trastornos mentales o de la salud mental en la población general de Europa es de un 27 a un 38% dependiendo de las fuentes y las definiciones296. Todos los trastornos mentales (p. ej., trastornos de ansiedad, trastorno somatomorfos, trastornos relacionados con el consumo de sustancias, trastornos de la personalidad, trastornos del estado de ánimo y trastornos psicóticos) se asocian con la aparición de ECV y reducen la expectativa de vida en ambos sexos297–300. El riesgo aumenta con la gravedad del trastorno mental, y la vigilancia de los síntomas (por lo general, inespecíficos) es crucial301. La aparición de ECV se asocia con aproximadamente un aumento en 2-3 veces de los trastornos mentales en comparación con la población sana115,302. Con estos datos, el cribado se debe llevar a cabo en cada consulta (o 2-4 veces al año). La prevalencia a 12 meses de los trastornos mentales en pacientes con ECV es aproximadamente del 40%, lo que conlleva un peor pronóstico100,108,303,304. El riesgo de ECV aumenta el riesgo de suicidio305. Por lo tanto, se debe incidir en aumentar la concienciación sobre los síntomas de ansiedad y depresión.
Se desconocen los mecanismos exactos por los que los tratarnos mentales aumentan la ECV. Los efectos perjudiciales estarían causados por un estilo de vida poco saludable, un aumento de la exposición a estresores socioeconómicos y los efectos secundarios cardiometabólicos de algunos medicamentos113, pero también por los efectos directos del sistema de defensa y miedo de la amígdala y otras vías fisiopatológicas303. El consumo de psicoestimulantes (como la cocaína) es un desencadenante principal de isquemia miocárdica306. Más aún, la capacidad de estos pacientes para hacer buen uso de los sistemas de salud se ve deteriorada por sus trastornos mentales (p. ej., incapacidad para confiar en otras personas y buscar ayuda, deterioro de la capacidad de adherencia)100. Los profesionales de la salud presentan barreras tales como la estigmatización, la falta de conocimientos sobre enfermedades mentales y la falta de confianza en los servicios de salud mental307–309. Aunque los pacientes con trastornos mentales presentan un aumento del riesgo de ECV, reciben menor tasa de reconocimiento y tratamiento de los factores de riesgo de EA clásicos310. La evidencia preliminar indica que tomar en consideración los trastornos mentales mejora los modelos de riesgo cardiovascular tradicionales311,312.
Algunos grupos de pacientes con dificultades de aprendizaje y trastornos asociados (como el síndrome de Down) presentan un aumento del riesgo de ECV, pero quizá no específicamente de EA. Sin embargo, las desigualdades y la prevalencia de los factores de riesgo de ECV pueden ser mayores en estas poblaciones, aunque no hay demasiadas investigaciones epidemiológicas.
3.4.11Esteatosis hepática no alcohólicaLa esteatosis hepática no alcohólica se ha relacionado con un aumento del riesgo de infarto de miocardio e ictus. La estenosis hepática no alcohólica es una acumulación de grasa ectópica y las personas que la sufren generalmente tienen sobrepeso u obesidad, y no es raro que tengan alteraciones de PA, glucosa y lípidos. Una investigación reciente sobre si la estenosis hepática no alcohólica aumenta el riesgo por encima de los factores de riesgo clásicos313 mostró que la asociación no se mantenía tras ajustar por los factores de riesgo establecidos. Sin embargo, se debería calcular la puntación de riesgo cardiovascular y cribar de DM a los pacientes con estenosis hepática no alcohólica, además de recomendarles un estilo de vida saludable y reducción del consumo de alcohol.
3.4.12Enfermedades específicas del sexo3.4.12.1Enfermedades obstétricasHay preeclampsia (definida como la hipertensión relacionada con el embarazo acompañada de proteinuria) en el 1-2% de todos los embarazos; esta multiplica el riesgo de ECV por 1,5-2,7 en comparación con todas las mujeres181,186,314, mientras que el RR de hipertensión se triplica y el de DM se duplica184,185. Aún no está claro si el aumento del riesgo de ECV tras la preeclampsia es independiente de los factores de riesgo cardiovascular. Los argumentos para el cribado de hipertensión y DM de estas mujeres son, sin embargo, contundentes. No parece que hoy sea necesario un modelo de riesgo independiente para mujeres con antecedentes de trastornos hipertensivos del embarazo a pesar de que tienen un riesgo basal alto315.
La hipertensión relacionada con el embarazo afecta al 10-15% de todos los embarazos. El riesgo asociado de una posterior ECV es menor con la preeclampsia, pero aun así es alto (RR, 1,5-2,5)193,314,316,317. Además, el riesgo de hipertensión persistente o futura es alta (el RR varía de 2,0 a 7,2 o incluso más)197,318. Aun así, no se completó el ajuste por los factores de riesgo clásicos. El riesgo de sufrir DM también es alto en estas mujeres (RR, 1,6-2,0)314,319. Tanto el parto prematuro (RR=1,6) como la muerte fetal (RR=1,5) se han asociado con un aumento moderado del riesgo de ECV316.
Por último, la DM gestacional conlleva un riesgo de DM futura marcadamente alto y hasta un 50% de las mujeres afectadas contraen DM en los 5 años posteriores al embarazo y tienen hasta el doble de riesgo de ECV futura188,320. El cribado con glucemia en ayunas o la HbA1c pueden ser preferibles a una prueba de tolerancia oral a la glucosa191,321.
3.4.12.2Enfermedades no obstétricasEl síndrome del ovario poliquístico afecta al 5% de las mujeres en edad fértil322,323. Se ha asociado con un aumento del riesgo de ECV314. Probablemente también aumente el riesgo de hipertensión, pero los datos son contradictorios324. El síndrome del ovario poliquístico se asocia con mayor riesgo de DM (RR, 2-4)189,190, lo que indica que es oportuno el cribado periódico de DM.
Aproximadamente el 1% de las mujeres de 40 o más años presentan menopausia prematura. Hasta el 10% de las mujeres están en menopausia precoz, definida como la que ocurre antes de los 45 años314,325. La menopausia precoz se asocia con un aumento del riesgo de ECV (RR=1,5)326–328. Se ha encontrado una relación lineal inversa entre la menopausia precoz y el riesgo de EC, y por cada disminución de 1 año en la edad de la menopausia se pronostica un aumento del riesgo de EC del 2%329.
3.4.12.3Disfunción eréctilLa DE, definida como una constante incapacidad para alcanzar y mantener una erección satisfactoria para la actividad sexual, tiene una causa multifactorial. Afecta por lo menos al 40% de los varones mayores de 40 años y a más del 50% de los mayore de 60330,331. Los varones con DE tienen un aumento del riesgo de muerte por cualquier causa (odds ratio [OR]=1,26; IC95%, 1,01-1,57) y muerte por ECV (OR = 1,43; IC95%, 1,00-2,05). La DE y la ECV tienen factores de riesgo en común (hipercolesterolemia, hipertensión, resistencia a la insulina y DM, tabaquismo, obesidad, síndrome metabólico, estilo de vida sedentario y depresión) y una base fisiopatológica común de etiología y progresión332,333.
Los fármacos utilizados para prevenir la ECV, como los antagonistas del receptor de la aldosterona, algunos bloqueadores beta y los diuréticos tiacídicos, pueden servir para la DE330,332–335. La DE se asocia con enfermedad vascular subclínica336 y precede a la EC, el ictus y la EAP en lapso que va desde los 2 hasta los 5 años (media, 3 años). Los varones con DE tienen un riesgo de cualquier evento cardiovascular un 44-59% más alto, de IAM un 62% mayor, de ictus un 39% mayor y de muerte por cualquier causa un 24-33% mayor, con un riesgo más alto para los pacientes con DE grave337–341.
Hay evidencia contundente sobre la evaluación del riesgo de ECV que necesitan los varones con DE336,342. Para los varones con DE y riesgo de ECV bajo-intermedio, se propone detallar un perfil del riesgo, por ejemplo, con la puntuación de CAC, aunque la evidencia no lo respalda338,341. Evaluar la gravedad de la DE y el examen físico deben ser parte de la evaluación de primera línea del riesgo de ECV de los varones333,341. Entre los cambios del estilo de vida efectivos en la mejoría de la función sexual de los varones, se incluyen el ejercicio físico intenso334,343, una mejora de la alimentación, el control del peso y la deshabituación tabáquica343–345.
4FACTORES DE RIESGO E INTERVENCIONES INDIVIDUALES4.1Recomendaciones terapéuticas: clases, grados y libertad de elecciónLa comunicación clara de los riesgos y los beneficios es crucial antes de iniciar cualquier tratamiento. La comunicación de los riesgos se aborda en la sección 3.2.4 y la presente sección trata de los beneficios de los tratamientos individuales. En todos los casos en que las recomendaciones sobre intervenciones individuales para reducir el riesgo sean «fuertes» (clase I o IIa), es importante tener en cuenta que muchos pacientes que han recibido la información apropiada sobre los riesgos (algunos estudios apuntan que hasta el 50%) conscientemente deciden renunciar a la intervención propuesta en muchas ocasiones. Esto se aplica no solo a las medidas para el estilo de vida, sino también a las intervenciones farmacológicas. Aparentemente, lo que los profesionales de la salud consideran una reducción del riesgo suficiente a cambio de un esfuerzo razonable o la iniciación de un tratamiento farmacológico con pocos efectos secundarios no siempre se corresponde con los valores de los pacientes. El caso contrario también se da: no solo algunos pacientes con (muy) alto riesgo rechazan las intervenciones, algunos con riesgo bajo-moderado pueden estar muy motivados para disminuirlo aún más. Por lo tanto, las recomendaciones de tratamiento nunca son «imperativas» para los pacientes con (muy) alto riesgo ni están «prohibidas» las intervenciones para pacientes con riesgo bajo-moderado. Hay evidencia de una mayor proporción de mujeres que de varones que no son plenamente conscientes del riesgo de ECV y de la necesidad de intervenciones terapéuticas. Esto justifica que se mejore la concienciación, la evaluación del riesgo y los tratamientos de las mujeres52,346–351.
4.2Optimización del tratamiento del riesgo cardiovascular4.2.1Objetivos de la comunicación médico-pacienteLos profesionales de la medicina deben adaptar y personalizar las recomendaciones sobre mejorar la comprensión, fomentar cambios en el estilo de vida y apoyar la adherencia al tratamiento farmacológico de los pacientes. La aplicación en la práctica diaria tiene diversos obstáculos352. La capacidad del paciente para adoptar un estilo de vida saludable depende de factores cognitivos y emocionales, el impacto del diagnóstico o los síntomas, los factores socioeconómicos, el nivel educativo y la salud mental. La percepción sobre el riesgo de enfermedad y la predicción de la gravedad de las consecuencias también son factores importantes en la motivación de los pacientes353.
4.2.2¿Cómo mejorar la motivación?Las estrategias comunicativas como la entrevista motivacional son útiles354. Las consultas pueden incluir a un miembro de la familia o un amigo, especialmente en el caso de pacientes ancianos. Establecer una conexión es esencial: concentrarse antes de la bienvenida, escuchar atentamente, estar de acuerdo con las prioridades, conectar con la historia del paciente y explorar las emociones355. Los principios del modelo OARS (preguntas abiertas, afirmación, escucha reflexiva y resumen) ayudan a los pacientes a exponer sus percepciones y a los profesionales de la medicina a resumir. Los objetivos SMART (específico, medible, alcanzable, realista y con plazos) puede ayudar a establecer objetivos para el cambio conductual355,356. Los profesionales de la salud deben considerar la capacidad, la oportunidad (física, social o medioambiental) y la motivación para el cambio conductual357. Se recomienda un enfoque multidisciplinario de la conducta que combine los conocimientos y las habilidades de distintos profesionales358.
4.2.3Optimización de la adherencia al tratamiento farmacológicoLa adherencia al tratamiento farmacológico varía del 50% en prevención primaria de EA al 66% en prevención secundaria359. Los médicos deben considerar la falta de adherencia ante todo paciente y preguntar sobre ella sin juzgar360. Aproximadamente el 9% de los casos de EA en Europa pueden atribuirse a baja adherencia farmacológica361. Entre los factores que contribuyen a la baja adherencia están la polifarmacia, la complejidad de las pautas posológicas, la mala comunicación entre el médico y el paciente, la falta de aceptación de la enfermedad, las creencias sobre las consecuencias y los efectos secundarios, las habilidades intelectuales/cognitivas, los trastornos mentales, las limitaciones físicas, los aspectos económicos y vivir solo360,362–364. Más importante aún, solo una reducción importante del riesgo motiva a los pacientes a iniciar el tratamiento preventivo, lo que evita la necesidad de una comunicación apropiada del riesgo365,366. La depresión es otro factor importante, y un tratamiento adecuado mejora la adherencia367,368.
Las aplicaciones móviles pueden mejorar la adherencia tanto a la medicación como a los cambios conductuales369. Son fáciles de utilizar y probablemente sean rentables370.
4.2.4Objetivos terapéuticosEn las siguientes secciones se tratan distintos campos del tratamiento individualizado. La tabla 6 resume los objetivos terapéuticos y algunas intervenciones clave para diferentes categorías de pacientes. Para más información sobre las categorías de riesgo y los principios del enfoque por pasos para los objetivos terapéuticos, acuda a la sección 3.2.3.1. Para más detalles sobre objetivos terapéuticos, la consecución de objetivos, la fuerza de las recomendaciones y los niveles de evidencia que los respaldan, vea las secciones pertinentes.
4.3Optimización del estilo de vida4.3.1Actividad física y ejercicioRecomendaciones sobre actividad física
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda que los adultos de todas las edades se esfuercen en realizar al menos 150-300min/semana de AF de intensidad moderada o 75-150min/semana de AF aeróbica vigorosa o una combinación equivalente para reducir la mortalidad por cualquier causa, la mortalidad cardiovascular y la morbilidad371,372 | I | A |
| Se recomienda a los adultos que no puedan realizar 150min/semana de AF de intensidad moderada que se mantengan tan activos como su capacidad y su estado de salud le permitan373,374 | I | B |
| Se recomienda reducir el tiempo de sedentarismo a favor de una actividad al menos ligera durante el día para reducir la mortalidad por cualquier cusa y la mortalidad y la morbilidad cardiovasculares375–377 | I | B |
| Se recomienda la práctica de ejercicio de fuerza, además del aeróbico, 2 o más días por semana para reducir la mortalidad por cualquier causa378,379 | I | B |
| Se debe considerar las intervenciones en el estilo de vida, como instrucción individualizada o en grupo, técnicas de cambio conductual, asesoramiento telefónico y rastreadores de actividad móviles, para aumentar la práctica de AF380–382 | IIa | B |
FA: actividad física.
a Clase de recomendación.
b Nivel de la evidencia.
La AF reduce el riesgo de muchos desenlaces adversos y factores de riesgo a cualquier edad y en ambos sexos. Existe una relación inversa entre la AF de moderada a vigorosa y la mortalidad por cualquier causa, la morbilidad y la mortalidad cardiovascular, así como la incidencia de DM2371–373,383–387. La reducción del riesgo se mantiene por todo el espectro de volúmenes de AF y la disminución del riesgo es más pronunciada para las personas menos activas371–374,386–387. Se puede encontrar más información sobre la prescripción de AF en la reciente GPC de la ESC388.
4.3.1.1Prescripción de actividad físicaLa frecuencia, la intensidad, la duración, el tipo y la progresión de la AF deberían evaluarse y prescribirse de manera individualizda389. Las recomendaciones sobre el cribado previo a la participación pueden encontrarse en las GPC de la ESC previas388. Las intervenciones con demostrado aumento del nivel de AF o reducción del sedentarismo son las basadas en teorías conductistas, como establecer objetivos, la revaluación de objetivos, el autocontrol y la retroalimentación372,380,381. El uso de un dispositivo de control de la actividad puede ayudar a aumentar el nivel de AF382. Lo más importante es animar a la práctica de actividades que el paciente disfrute o pueda incluir en su rutina diaria, ya que es más probable que este tipo de actividades se mantengan en el tiempo.
4.3.1.2Actividad física aeróbicaAlgunos ejemplos de AF aeróbica son caminar, jogging, ciclismo, etc.389. Se recomienda que los adultos practiquen al menos 150-300min a la semana de AF de intensidad moderada, 75-150 minutos de AF de intensidad vigorosa o una combinación equivalente de ambas distribuida a lo largo de la semana371,372. Los beneficios aumentan con más AF. También se debería fomentar la práctica de AF de personas que no sean capaces de llegar al mínimo. Se recomienda un aumento gradual del nivel de actividad para las personas sedentarias. Cuando los adultos mayores o las personas con dolencias crónicas no puedan llegar a los 150min semanales de AF de intensidad moderada, deberían ser tan activos como su capacidad y sus dolencias les permitan371–375,384,384. La acumulación de AF incluso en intervalos < 10 min se asocia con desenlaces favorables, incluida la mortalidad371,390.
La AF se expresa en términos absolutos o relativos389. La intensidad absoluta es la cantidad de energía gastada por minuto de actividad evaluada por la captación de oxígeno por unidad de tiempo (ml/min o l/min) o por los MET (equivalentes metabólicos) de la actividad. Está disponible una recopilación del coste energético en MET de diversas actividades391. Una medida absoluta no toma en consideración los factores individuales como el peso corporal, el sexo y el estado de forma física389.
La intensidad relativa se determina según el esfuerzo máximo (pico) de la persona; por ejemplo, el porcentaje del estado cardiorrespiratorio (VO2máx), la frecuencia cardiaca máxima (FCmáx) o la tasa de esfuerzo percibido según la escala de Borg. Las personas con peor forma física generalmente necesitan mayor esfuerzo que las que están en forma para llevar a cabo la misma actividad. Se necesita una medida de intensidad relativa para ofrecer una prescripción de AF individualizada389.
La clasificación de la intensidad absoluta y relativa y algunos ejemplos se presentan en la tabla 7.
4.3.1.3Ejercicios de fuerzaLa incorporación de ejercicios de fuerza a la AF aeróbica se asocia con menos riesgo de eventos cardiovasculares totales y mortalidad por cualquier causa378,379,393–395. La prescripción recomendada es 1-3 series de 8-12 repeticiones a una intensidad del 60-80% de la frecuencia de 1 repetición máxima de la persona durante al menos 2 días a la semana, con una variedad de 8-10 ejercicios diferentes en los que se ejercite cada uno de los grandes grupos musculares. Se recomienda que los adultos mayores o en baja forma empiecen con una serie de 10-15 repeticiones al 40-50% de 1 repetición máxima389. Además, se recomienda que los adultos mauyores realicen AF multicompetente que combine ejercicio aeróbico, de fuerza y de equilibrio para prevenir las caídas372.
4.3.1.4SedentarismoEl sedentarismo se asocia con más riesgo de muchas enfermedades crónicas importantes y mortalidad371,372,375–377,396–399. Incluso solo 15 min diarios de AF de intensidad baja pueden beneficiar a los adultos que no son físicamente activos. Hay evidencias contradictorias de que las tandas de actividad que interrumpen el sedentarismo se asocian con beneficios para la salud375,389,400.
4.3.2Nutrición y alcoholRecomendaciones sobre nutrición y consumo de alcohol
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda una dieta sana para todas las personas como piedra angular de la prevención cardiovascular401,402 | I | A |
| Se recomienda adoptar una dieta mediterránea o similar para reducir el riesgo de ECV403,404 | I | A |
| Se recomienda sustituir las grasas saturadas por grasas insaturadas para reducir el riesgo de ECV405–409 | I | A |
| Se recomienda disminuir el consumo de sal para reducir la PA y el riesgo de ECV410 | I | A |
| Se recomienda adoptar un patrón alimentario de origen vegetal, rico en fibra, que incluya cereales integrales, frutas, verduras, legumbres y frutos secos411,412 | I | B |
| Se recomienda restringir el consumo de alcohol a un máximo de 100g a la semana413–415 | I | B |
| Se recomienda consumir pescado, preferiblemente graso, al menos una vez a la semana y restringir el consumo de carne (procesada)406–418 | I | B |
| Se recomienda restringir la ingesta de azúcares libres, especialmente bebidas azucaradas, a un máximo del 10% de la ingesta energética419,420 | I | B |
ECV: enfermedad cardiovascular.
a Clase de la recomendación.
b Nivel de la evidencia.
Los hábitos alimentarios influyen en el riesgo de ECV, principalmente a través de los factores de riesgo como los lípidos, el peso corporal y la DM401,402. La tabla 8 resume las características de una dieta sana. Aunque las recomendaciones sobre nutrientes y alimentos siguen siendo importantes para la salud cardiovascular, la sostenibilidad ambiental preocupa cada vez más, y esto respalda un cambio de un patrón alimentario de productos animales a productos vegetales.
4.3.2.1Ácidos grasosEl riesgo de EC se reduce cuando se sustituyen las grasas saturadas apropiadamente (figura 10), al igual que con la sustitución de carnes y lácteos406,407. La sustitución isocalórica de grasas poliinsaturadas (–25%), grasas monoinsaturadas (–15%) y, en menor medida, los carbohidratos provenientes de cereales integrales (–9%) por grasas saturadas se asocia con una reducción del riesgo de EC408,409.
Reducir el consumo de ácidos grasos saturados a menos del 10% de la energía puede tener beneficios adicionales405. Sin embargo, el efecto hipolipemiante en el cLDL de la sustitución de los ácidos grasos poliinsaturados (AGP) por ácidos grasos saturados puede ser menor en personas obesas (5,3%) que en personas con normopeso (9,7%)421.
Los ácidos grasos trans, que se forman durante el procesamiento industrial de grasas, tienen efectos desfavorables en el colesterol total (aumento) y el cHDL (disminución). De media, un aumento del 2% en la ingesta energética de ácidos grasos trans se asocia con un aumento del riesgo de EC del 23%422. Una directiva de la Comisión de la Unión Europea ha puesto el límite en 2 g por cada 100 g de grasa (abril de 2019) (https://ec.europa.eu/food/safety/label- ling_nutrition/trans-fat-food_en).
Cuando se siguen las recomendaciones sobre la disminución de grasas saturadas, se consiguen reducciones del colesterol de la dieta.
4.3.2.2Vitaminas y mineralesLa reducción del consumo de sodio puede reducir la PAS una media de 5,5mmHg en pacientes hipertensos y 1,9mmHg en normotensos410.
El ensayo DASH mostró una relación dosis-respuesta entre la reducción del sodio y la reducción de la PA423. En un metanálisis, la reducción de la sal en 2,5g/día tuvo como resultado una reducción del 20% de los eventos de EA (RR=0,80)410. La relación en U o en J entre un consumo bajo de sal y la EA es contradictoria424. Las enfermedades subyacentes y la desnutrición pueden explicar tanto el bajo consumo de alimentos y sal como el aumento de la EA410,425,426. El cuerpo de evidencia justifica una reducción de la sal para prevenir EC e ictus.
El consumo de sal es alto en la mayoría de los países occidentales (≈ 9-10g/día), mientras que el consumo máximo recomendado es de 5g/día. El consumo óptimo puede llegar incluso a los ≈ 3g. La reducción de la sal se puede conseguir con decisiones sobre la dieta (menos alimentos procesados) y la reformulación de la comida al disminuir su contenido en sal (véase la sección 5.2.2).
El potasio (en frutas y alimentos vegetales) tiene efectos favorables para la PA y el riesgo de ictus (RR=0,76)427.
En cuanto a las vitaminas, los estudios observacionales han demostrado una asociación inversa entre las vitaminas A y E y el riesgo de EA. Sin embargo, estos resultados no han podido confirmarse en ensayos de intervención. Además, los ensayos de suplementación con las vitamina B (B6, ácido fólico y B12), C y D no han demostrado efectos beneficiosos428,429.
4.3.2.3FibraCada 7g/día de consumo de fibra se asocia con una reducción del 9% en el riesgo de EA (RR=0,91)430. Un consumo de 10g/día de fibra se asocia con una disminución del 16% del riesgo de ictus (RR=0,84) y una reducción del 6% del riesgo de DM2 (RR=0,94)431,432. Un gran consumo de fibra reduce la glucemia tras comidas ricas en carbohidratos y también reduce los triglicéridos433.
4.3.2.4Alimentos específicos y grupos alimentarios4.3.2.4.1Frutas, verduras y legumbresUn metanálisis demostró una disminución del 4% en el riesgo de mortalidad cardiovascular por cada ración adicional de fruta (equivalente a 77g) y verduras (equivalente a 80g) por día, mientras que la mortalidad por cualquier causa no se redujo con un aumento del consumo > 5 raciones434. Un metanálisis informó de una reducción del 11% del riesgo de ictus asociada con 3-5 raciones de fruta y verdura y una reducción del 26% con 5 raciones en comparación con menos de 3 raciones435,436. Una única ración diaria de legumbres disminuye el cLDL 0,2mmol/l y se asocia con menos riesgo de EC.437, 438
4.3.2.4.2Frutos secosEn los resultados de un metanálisis de cohortes prospectivo, se asoció el consumo diario de 30g de una combinación de frutos secos con una disminución del ≈ 30% del riesgo de EA437. Tanto las legumbres como los frutos secos contienen fibra y otros compuestos bioactivos.
4.3.2.4.3CarneSe recomienda una reducción del consumo cárnico, especialmente de carnes procesadas, tanto desde el punto de vista de la salud como del medioambiente411. La restricción del consumo de carne roja puede tener un efecto pequeño o nulo en los desenlaces metabólicos406. Sin embargo, la sustitución de carne roja por alimentos de origen vegetal de alta calidad (como frutos secos, soja y legumbres) mejora las concentraciones de cLDL406. Un análisis reciente ha demostrado que un mayor consumo de carne procesada y carne roja sin procesar se asocia con aumentos del riesgo de EA del 7 y el 3% respectivamente417.
Al reducir el consumo de carne, también se reduce el consumo de sal. La World Cancer Research Fund recomienda limitar el consumo de carne roja a 350-500g por semana439.
4.3.2.4.4Pescado y complementos alimenticios de aceite de pescadoLos estudios indican que el consumo de pescado, especialmente el rico en AGP omega 3, al menos 1 vez a la semana se asocia con una disminución del riesgo de EC del 16%418 y que el consumo de pescado 2-4 veces a la semana se asocia con una disminución del riesgo de ictus del 6%440. El riesgo más alto se observó en la ausencia de consumo y los consumos muy bajos. Diversos metanálisis y una reciente revisión Cochrane no han demostrado que los aceites de pescado tengan beneficios en los desenlaces y la mortalidad cardiovascular441–443, aunque se observó una reducción del riesgo de eventos de EC del 7%. Un metanálisis de 13 ECA incluyó los resultados de los ensayos VITAL (Vitamin D and Omega-3 Trial), ASCEND (A Study of Cardiovascular Events in Diabetes) y REDUCE-IT (Reduction of Cardiovascular Events with Icosapent Ethyl-Intervention Trial)444. En el análisis en el que se excluyó el REDUCE-IT, los aceites de pescado redujeron el riesgo de EA (RR=0,97) y muerte por EC (RR=0,92)444. Incluyendo el REDUCE-IT (un ensayo con pacientes con valores de triglicéridos altos, en el que se compararon dosis muy altas de icosapento de etilo frente a un aceite mineral como placebo) se reforzaron los resultados444. Sin embargo, este es el único estudio con dosis altas de icosapento de etilo y han surgido dudas sobre la elección del placebo. Muy recientemente, el ensayo STRENGTH no pudo demostrar los beneficios de una preparación combinada de ácido eicosapentaenoico y ácido docosahexaenoico445.
4.3.2.4.5Bebidas alcohólicasLa cantidad máxima segura para el consumo de bebidas alcohólicas es apropiadamente 100 g de alcohol puro por semana. La equivalencia en número de bebidas depende del tamaño de la bebida, ya que la porción estándar difiere entre países, por lo general entre 8 y 14 g por bebida. La cantidad máxima es similar para varones y mujeres413. El consumo por encima de esta cantidad máxima disminuye la esperanza de vida. Los resultados de estudios epidemiológicos indican que, mientras que el alto consumo de alcohol tiene relación más o menos lineal con mayor riesgo de todos los tipos de ictus, EC, IC y diversas ECV menos frecuentes, parece que tiene asociación log-lineal con menos riesgo de infarto de miocardio413. Más aún, las aleatorizaciones mendelianas no apoyan los efectos supuestamente protectores contra la EA del consumo moderado frente a no consumir alcohol, lo que indica que los abstemios tienen menos riesgo de eventos de ECV y que el consumo de cualquier cantidad de alcohol aumenta uniformemente la PA y el IMC414,415. Estos datos cuestionan la idea de que el consumo moderado de alcohol se asocia universalmente con un menor riesgo de ECV.
4.3.2.4.6Refrescos y bebidas azucaradasEl consumo habitual de bebidas azucaradas (p. ej., 2 raciones al día frente a 1 ración al mes) se asocia con un aumento del riesgo de EC del 35% en las mujeres del estudio Nurses’ Health Study, mientras que las bebidas con edulcorantes artificiales no se asocian con EC. En la cohorte EPIC (European Prospective Investigation into Cancer and Nutrition), tanto las bebidas con edulcorantes como las azucaradas se asociaron con mortalidad por cualquier causa, mientras que solo las primeras se asociaron con enfermedades circulatorias419. La guía de la OMS recomienda un consumo máximo del 10% de la energía total en azúcares libres (monosacáridos y disacáridos), lo que incluye los azúcares añadidos y los azúcares de los zumos de frutas420.
4.3.2.4.7CaféEl café sin filtrar contiene cafestol, que aumenta el cLDL, y kahweol, que se puede asociar con un aumento de hasta el 25% de mortalidad por EA con el consumo ≥ 9 tazas al día446. El café sin filtrar incluye los cafés griegos y algunos expresos. El consumo moderado de café (3-4 tazas al día) probablemente no sea dañino, sino moderadamente beneficioso447.
4.3.2.4.8Alimentos funcionalesLos alimentos funcionales que contienen fitosteroles (esteroles y estanoles vegetales) son efectivos en la reducción del cLDL, con una media del 10% cuando se consumen 2g/día448. El efecto se añade al obtenido con una dieta baja en grasas o la toma de estatinas. Todavía no se ha llevado a cabo ningún estudio con objetivos clínicos.
No se recomiendan los suplementos de levadura de arroz rojo, que incluso puede causar efectos secundarios449.
4.3.2.4.9Patrones dietéticosEl estudio del impacto de los patrones dietéticos muestra el potencial preventivo de la dieta. La dieta mediterránea incluye un gran consumo de frutas, verduras, legumbres, productos integrales, pescado y aceite de oliva, un consumo moderado de alcohol y un bajo consumo de carne (roja), productos lácteos y ácidos grasos saturados. Una mayor adherencia a la dieta mediterránea se asocia con una reducción de la incidencia o la mortalidad cardiovascular del 10%, con una reducción del 8% de la mortalidad por cualquier causa403. Adoptar una dieta mediterránea enriquecida con frutos secos durante 5 años, en comparación con una dieta de control, disminuyó el riesgo de EA en un 28%; al enriquecerla con aceite de oliva extra virgen disminuyó un 31%404.
Además, el cambio de un patrón de consumo de animales a un de vegetales puede reducir la EA411.
4.3.3Peso y composición corporalesRecomendaciones sobre el peso corporal
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para personas con sobrepeso y obesidad, se recomienda un objetivo de pérdida ponderal para reducir la PA, la dislipemia y el riesgo de DM2 y así mejorar el perfil de riesgo de ECV450,451 | I | A |
| Aunque hay una amplia gama de dietas efectivas para la pérdida de peso, se recomienda una dieta sana para mantener la salud cardiovascular a largo plazo452–454 | I | A |
| Se debe considerar la cirugía bariátrica para las personas obesas con alto riesgo cuando los cambios en el estilo de vida no den como resultado una pérdida de peso persistente455 | IIa | B |
DM: diabetes mellitus; PA: presión arterial.
a Clase de recomendación.
b Nivel de evidencia.
Aunque la dieta, el ejercicio y la modificación de la conducta son las principales formas de tratamiento para el sobrepeso y la obesidad, muchas veces fracasan a largo plazo. Aun así, mantener una pérdida ponderal del 5-10% del peso basal tiene efectos saludables en los factores de riesgo, incluidos la PA, los lípidos y el control glucémico450,451, así como en la mortalidad prematura por cualquier causa456. La pérdida ponderal se asocia con menos morbilidad pero más mortalidad entre los adultos (biológicamente) mayores (la «paradoja de la obesidad»). En este grupo, la atención debería centrarse en mantener la masa muscular y una buena nutrición, más que en la pérdida ponderal.
4.3.3.2Dietas para la pérdida de pesoLa restricción de la ingesta calórica es la piedra angular del tratamiento. La AF es esencial para mantener la pérdida ponderal y prevenir el efecto rebote, aunque no se revise aquí. Las dietas hipocalóricas se pueden categorizar en:
- 1.
Dietas que buscan reducir la EA, como las dietas basadas en alimentos vegetales457,458 y las dietas mediterráneas hipocalóricas458,459 con modificaciones para adaptarse a los alimentos locales y las preferencias.
- 2.
Cambios en la composición de macronutrientes de las grasas y los carbohidratos de la dieta, como dietas bajas o muy bajas en carbohidratos (50-130 y 20-49 g de carbohidratos/día respectivamente), dietas moderadas en carbohidratos (> 130-225 g de carbohidratos/día) y dietas bajas en grasa (< 30% de la energía aportada por grasas).
- 3.
Dietas altas en proteínas para conservar la masa de los músculos largos y aumentar la saciedad.
- 4.
Dietas centradas en grupos alimentarios específicos (p. ej., aumentar el consumo de frutas y verduras o evitar los azúcares refinados).
- 5.
Dietas que restringen la ingesta energética durante periodos concretos, por ejemplo, 2 días a la semana o días alternos (ayuno intermitente) o a ciertas horas del día (consumo restringido por tiempo).
Estas dietas dan como resultado similares pérdidas ponderales a corto plazo452–454. A los 12 meses, los efectos tienden a disminuir453. Sin embargo, los beneficios de la dieta mediterránea tienden a mantenerse. La calidad de los nutrientes en una dieta, como la sustitución de grasas insaturadas o saturadas (véase la sección 4.3.2.1) incluyendo carbohidratos ricos en fibras460, determina si la dieta es saludable a largo plazo.
Las dietas bajas o muy bajas en carbohidratos pueden tener ventajas para el control del apetito, la reducción de los triglicéridos y la reducción de medicación para la DM2461. Estas dietas pueden ser cetogénicas y requieren supervisión médica o al menos dietética. No hay demasiados estudios de más de 2 años. Se debe evitar el consumo excesivo de carbohidratos a largo plazo y la sustitución de grasas, y proteínas animales por carbohidratos vegetales en lugar de animales es beneficiosa462.
Las dietas de ayuno intermitente dan la misma pérdida ponderal que las de restricción energética cuando tienen la misma ingesta energética463.
Los medicamentos aprobados en Europa para coadyuvar en la pérdida de peso (orlistat, naltrexona/bupropión, altas dosis de liraglutida) pueden complementar los cambios en el estilo de vida para conseguir y mantener la pérdida ponderal, aunque algunos tienen efectos secundarios. En los metanálisis sobre pérdida ponderal asistida con medicamentos, se encontraron efectos favorables en la PA, el control glucémico y la mortalidad por EA464.
Una opción de tratamiento muy efectiva para la obesidad extrema o la obesidad con comorbilidades es la cirugía bariátrica. En un metanálisis se descubrió que los pacientes sometidos a cirugía bariátrica tenían un 50% menos riesgo de mortalidad total, por EA y por cáncer que las personas de peso similar que no se habían sometido a la cirugía455.
4.4Salud mental e intervenciones psicosocialesRecomendaciones sobre salud mental e intervenciones psicosociales individuales
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Los pacientes con trastornos mentales necesitan más atención y apoyo para mejorar la adherencia a los cambios en el estilo de vida y el tratamiento farmacológico3,465 | I | C |
| Para pacientes con EA y trastornos mentales, se recomienda una atención a la salud mental basada en la evidencia y la cooperación interdisciplinaria100,113,466 | I | B |
| Para los pacientes con EA y estrés, se debe considerar la derivación a psicoterapia para el control del estrés con el objetivo de mejorar los desenlaces cardiovasculares y los síntomas de estrés467–469 | IIa | B |
| Se debe considerar el tratamiento antidepresivo con ISRS para los pacientes con EC y depresión de moderada a grave470,471 | IIa | B |
| No se recomiendan los ISRS, los ISRN y los antidepresivos tricíclicos para los pacientes con IC y depresión mayor472,473,c | III | B |
EA: enfermedad ateroesclerótica; EC: enfermedad coronaria; IC: insuficiencia cardiaca; IRSN: inhibidores selectivos de la recaptación de serotonina y norepinefrina; ISRS: inhibidores selectivos de la recaptación de serotonina.
a Clase de evidencia.
b Nivel de evidencia.
c Los datos sobre esta recomendación se muestran en la sección 2.1 del material adicional.
El tratamiento de un estilo de vida poco saludable reducirá el riesgo de ECV y mejorará la salud mental. La deshabituación tabáquica, por ejemplo, tiene un efecto positivo en los desenlaces de la depresión474,475, al igual que el ejercicio terapéutico476 y la buena alimentación477. Las intervenciones basadas en la evidencia para la deshabituación tabáquica y la mejora de la PA y la dieta se consideran útiles y aplicables para personas con trastornos mentales465,478–480.
Los trastornos mentales se asocian con un aumento del riesgo de ECV y un peor pronóstico en pacientes con EA debido a eventos cardiovasculares o muerte por otras causas como el suicidio100,133,305. Los tratamientos de salud mental son efectivos para reducir los síntomas de estrés y mejorar la calidad de vida. Diversos estudios observacionales indican que el tratamiento o la remisión de la depresión reducen el riesgo de ECV113,481–484. Las intervenciones psicológicas en pacientes con EC pueden reducir la mortalidad cardiaca (RR=0,79) y aliviar los síntomas psicológicos466. La psicoterapia centrada en el manejo del estrés para pacientes con EA mejora los desenlaces cardiovasculares. En el ensayo SUPRIM, los pacientes del grupo intervenido tuvieron una tasa un 41% menor de eventos de EA mortales y no mortales de primera aparición y recurrentes (hazard ratio [HR]=0,59) y menos IAM recurrentes (HR = 0,55)467. En el ensayo SWITCHD, la intervención reportó una reducción sustancial en la mortalidad por cualquier causa (OR = 0,33)468. En un ECA reciente se han informado reducciones significativas de los eventos de EA con la combinación de rehabilitación cardiaca (RC) con manejo del estrés en comparación con la RC sola (HR = 0,49)469. En cuanto a la psicofarmacoterapia de pacientes con EC y depresión, el tratamiento con ISRS disminuye las tasas de reingreso por EC (RR = 0,63) y la mortalidad por cualquier causa (RR = 0,56)470. Un ECA reciente muestra que, en pacientes con SCA y depresión, el tratamiento con el ISRS escitalopram tuvo como resultado una tasa menor del objetivo compuesto por mortalidad por cualquier causa, infarto de miocardio o intervención coronaria percutánea (ICP) (HR = 0,69)471. La colaboración interdisciplinaria para el tratamiento de pacientes con EC y depresión tiene poco efecto beneficio en la depresión, pero reduce significativamente los eventos cardiacos mayores a corto plazo485.
Sobre los efectos secundarios de los tratamientos psicofarmacológicos, muchos medicamentos psiquiátricos se asocian con un aumento del riesgo de muerte súbita cardiaca486. En pacientes con IC, los antidepresivos se asocian con un aumento del riesgo de mortalidad cardiaca y por cualquier causa (HR = 1,27) (véase la sección 4.4 del material adicional)472. Por lo tanto, los pacientes con EA y trastornos mentales complejos, especialmente los que necesiten tratamiento psicofarmacológico, requieren la cooperación de un equipo multidisciplinario.
4.5Intervención en el tabaquismoRecomendaciones sobre estrategias para la intervención en el tabaquismo
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se debe cesar todo consumo de tabaco, ya que este es una causa importante e independiente de EA487,488 | I | A |
| Se debe considerar dar apoyo a los fumadores en el seguimiento y ofrecerles terapia de sustitución de la nicotina, vareniclina y bupropión, solos o en combinación489–494 | IIa | A |
| Se recomienda la deshabituación tabáquica independientemente de la ganancia ponderal, ya que esta no disminuye los beneficios de la deshabituación en la EA495 | I | B |
EA: enfermedad ateroesclerótica.
a Clase de recomendación.
b Nivel de recomendación.
La deshabituación tabáquica sería la medida preventiva más eficaz, con reducciones sustanciales de reinfartos de miocardio y muertes487,488. Las ganancias de por vida de años libres de ECV son sustanciales a todas las edades y los beneficios son obviamente mayores si se tienen en cuenta otras complicaciones derivadas del tabaquismo. Desde los 45 años, mantienen ganancias de 3-5 años los varones hasta los 65 años y las mujeres hasta los 75 años (figura 11). Incluso para los grandes fumadores (≥ 20 cigarrillos/día) la deshabituación disminuye el riesgo de ECV a los 5 años, aunque se mantienen elevado más allá de ese plazo. Los beneficios totales para la salud serán incluso mayores debido a la ganancia en salud no cardiocascular.
Se debe promover la deshabituación de todos los fumadores y se debe evitar el tabaquismo pasivo todo lo posible. Los consejos muy breves pueden ser útiles cuando el tiempo es escaso (tabla 9). Un momento clave para la deshabituación es durante el diagnóstico y el tratamiento de la ECV. Son intervenciones basadas en la evidencia animar a la deshabituación, dar un breve recuerdo de los beneficios cardiocasculares y generales de la deshabituación y acordar un plan específico con seguimiento.
Los fumadores que quieran abandonar el tabaquismo pueden esperar una ganancia ponderal de 5 kg, pero los beneficios de la deshabituación tabáquica sobrepasan los riesgos de la ganancia ponderal495. El tabaquismo persistente o las recaías son comunes en pacientes con EC, en especial entre aquellos con depresión grave y exposición ambiental498. Las terapias para el control del estado de ánimo pueden mejorar los resultados en pacientes con depresión pasada o actual499.
4.5.2Intervenciones farmacológicas basadas en la evidenciaSe debe considerar el apoyo farmacológico para la deshabituación tabáquica para todos los fumadores que estén listos para abandonar el tabaquismo. Las intervenciones farmacológicas basadas en la evidencia incluyen la terapia de sustitución de la nicotina, el bupropión, la vareniclina y la cistina (aunque no está fácilmente disponible)489–491. Todas las formas de terapia de sustitución de la nicotina (chicles, parches transdérmicos de nicotina, aerosoles nasales, inhaladores, comprimidos sublinguales) son efectivas. La combinación frente a solo terapia de sustitución de la nicotina y 4mg frente a 2mg de chicle pueden aumentar el éxito492. La terapia de sustitución de la nicotina no tiene efectos adversos en pacientes con EA493, pero la evidencia sobre la eficacia en este grupo de pacientes no es concluyente494. En pacientes con EA, la vareniclina (RR=2,6), el bupropión (RR=1,4), el apoyo telefónico (RR=1,5) y el asesoramiento individual (RR=1,6) aumentan las tasas de éxito494. Los antidepresivos y el bupropión contribuyen a la deshabituación tabáquica a largo plazo con una eficacia similar a la terapia de sustitución de la nicotina.
La vareniclina (1 mg 2 veces al día) aumenta las tasas de deshabituación más del doble en comparación con el placebo491. La RR para la abstinencia frente a la terapia de sustitución de la nicotina fue de 1,25 y frente al bupropión, RR=1,4. Las dosis más bajas o variables también son efectivas y reducen los efectos secundarios. La vareniclina se tolera bien más allá de las 12 semanas de tratamiento estándar. El inicio de la vareniclina en el hospital tras un SCA es efectivo y seguro500.
El principal efecto secundario de la vareniclina son las náuseas, pero generalmente remiten. La relación causal entre la vareniclina y los eventos adversos psiquiátricos es poco probable501. La vareniclina, el bupropión y la terapia de sustitución de la nicotina no aumentan el riesgo de eventos adversos cardiovasculares mayores durante o tras el tratamiento502.
La cistina es eficaz para la deshabituación tabáquica, pero la evidencia aún es escasa491.
4.5.2.1Cigarrillos electrónicosLos cigarrillos electrónicos (e-cigarrillos) imitan a los cigarrillos combustibles al calentar y convertir nicotina y otras sustancias químicas en vapor. Los e-cigarrillos liberan nicotina sin la mayoría de las sustancias químicas del tabaco y probablemente sean menos dañinos que el tabaco.
La evidencia reciente indica que los e-cigarrillos probablemente sean más efectivos que la terapia de sustitución de nicotina para la deshabituación tabáquica503–505. Sin embargo, los efectos a largo plazo de los e-cigarrillos en la salud cardiovascular y pulmonar necesitan más estudio506. Su uso junto con cigarrillos tradicionales debería evitarse. Más aún, ya que los e-cigarrillos son adictivos, su consumo debería someterse a controles de márketing similares a los cigarrillos tradicionales, especialmente las variedades con sabores, que llaman la atención de los niños507. Pese a tener menos sustancias tóxicas que los cigarrillos tradicionales, los cigarrillos de «calentar, no quemar» contienen tabaco y se deberían desaconsejar.
4.6LípidosEsta sección trata las recomendaciones sobre el diagnóstico y el tratamiento de las concentraciones lipídicas en sangre perjudiciales. Para más información y directrices sobre casos complejos/atención terciaria, como trastornos genéticos de los lípidos, están disponibles las Guía 2019 de la ESC/Sociedad Europea de Ateroesclerosis (EAS) sobre el tratamiento de las dislipemias3.
La evidencia reciente ha confirmado que el evento iniciador clave en la aterogénesis es la retención de LDL y otras lipoproteínas ricas en colesterol en la pared arterial. El papel causal del cLDL y otras lipoproteínas que contienen apolipoproteína B en el desarrollo de la EA se ha demostrado más allá de cualquier duda razonable en estudios genéticos, observacionales e intervencionistas20. En un metanálisis de ensayos clínicos se observó que la reducción relativa del riesgo de ECV es proporcional a la reducción absoluta de cLDL independientemente de los medicamentos utilizados para conseguir ese cambio, sin evidencia de que haya un límite inferior de valores de cLDL o un efecto en «curva en J»21. El beneficio absoluto de la disminución del cLDL se puede traducir en una significativa reducción absoluta en un paciente con alto o muy alto riesgo22. Un reciente ECA con objetivos de cLDL en pacientes tras ictus isquémico o accidente isquémico transitorio (AIT) demostró que un objetivo de cLDL < 1,8mmol/mol (70 mg/dl) con tratamiento con estatinas y, si se requiriese, ezetimiba se asoció con menos riesgo de ECV que el de los pacientes con un objetivo de 2,3-2,8mmol/l (90-110mg/dl)508. Los estudios sobre la seguridad clínica de la consecución de objetivos de cLDL (muy) bajos no han suscitado preocupaciones, aunque se necesita monitorización más larga.
4.6.1Determinación de lípidos y lipoproteínas4.6.1.1Determinaciones en ayunas frente a sin ayunoSe recomienda la determinación de los parámetros lipídicos sin ayuno para el cribado general, ya que tiene el mismo valor pronóstico que las muestras tomadas en ayunas509,510. En pacientes con síndrome metabólico, DM o hipertrigliceridemia, la determinación del cLDL en muestras sin ayuno se debe interpretar con cuidado.
4.6.1.2Determinación del colesterol unido a lipoproteínas de baja densidadEl cLDL se puede determinar directamente, pero en la mayoría de los estudios y laboratorios el cLDL se calcula utilizando el método de Friedewald:
- •
En mmol/l: cLDL=colesterol total–cHDL–(0,45×triglicéridos)
- •
En mg/dl: cLDL=colesterol total–cHDL–(0,2×triglicéridos)
El cálculo solo es válido cuando la concentración de triglicéridos es ≤ 4,5mmol/l (∼400mg/dl) y es impreciso cuando el cLDL es muy bajo (< 1,3mmol/l [50mg/dl]). Para los pacientes con cifras de cLDL bajas e hipertrigliceridemia (≤ 800mg/dl), se pueden utilizar fórmulas alternativas511,512 o determinar el cLDL directamente.
4.6.1.3Determinación del colesterol no unido a lipoproteínas de alta densidadEl colesterol no HDL se determina restando el cHDL del colesterol total. Para el colesterol no HDL, a diferencia del cLDL, no se necesita que la concentración de triglicéridos sea<4,5mmol/l (400mg/dl). También tiene la ventaja de que es preciso sin ayuno y puede ser más preciso en pacientes diabéticos. Hay evidencia del papel del colesterol no HDL como objetivo terapéutico, ya que tiene toda la información sobre las apolipoproteínas que contienen apolipoproteína B513. Se propone este objetivo como una alternativa de tratamiento para todos los pacientes, especialmente para aquellos con hipertrigliceridemia o DM. El grado de correspondencia del colesterol no HDL con los objetivos de cLDL más habituales se muestran en la tabla 10.
4.6.1.4Apolipoproteína BLa apolipoproteína B ofrece una estimación directa de la concentración total de lípidos aterogénicos, especialmente en pacientes con triglicéridos elevados. Sin embargo, de media, la información que aporta la apolipoproteína B es similar a la de la determinación de cLDL514. El grado de correspondencia de la apolipoproteína B con los objetivos de cLDL más habituales se muestran en la tabla 10.
4.6.2Definición de objetivos lipídicos4.6.2.1Objetivos de colesterol unido a lipoproteínas de baja densidadRecomendaciones sobre los objetivos de colesterol unido a lipoproteínas de baja densidada
| Recomendación | Claseb | Nivelc |
|---|---|---|
| Para las personas aparentemente sanas con riesgo de ECV alto o muy algo, así como aquellos con EA establecida o DM, se recomienda una intensificación gradual del tratamiento teniendo en cuenta el riesgo de ECV, el beneficio del tratamiento, los modificadores del riesgo y las preferencias del paciente | I | C |
DM: diabetes mellitus; EA: enfermedad ateroesclerótica;
a Recomedación de la sección 3.2.
b Clase de recomendación.
c Nivel de evidencia.
Los objetivos de cLDL se resumen en la tabla de recomendaciones. Ya que no todos los medicamentos se toleran bien, están disponibles o son asequibles, el tratamiento se debería centrar en la consecución de cifras de cLDL tan próximas a los objetivos como sea posible. El tratamiento debe ser una decisión conjunta entre médico y paciente.
Como ya se ha explicado, en esta guía (sección 3.2.3.1) se propone un enfoque gradual para los objetivos terapéuticos, también el cLDL (figuras 6 y 8). Este enfoque puede parecer nuevo, pero en realidad refleja la práctica clínica, en la que la intensificación del tratamiento se basa en los beneficios previstos, los efectos secundarios y, muy importante, las preferencias del paciente. Los objetivos lipídicos fundamentales son los mismos que en la Guía ESC/EAS de 2019 sobre el tratamiento de las dislipemias3. La evidencia de estudios con tratamientos hipoglucemiantes indica que un enfoque gradual no compromete la consecución de objetivos y se asocia con menos efectos secundarios y mayor satisfacción del paciente66,67. En casos específicos (pacientes en muy alto riesgo), el médico puede optar por fusionar ambos pasos y avanzar directamente al paso 2. Para las personas aparentemente sanas, el beneficio de por vida del tratamiento reductor del cLDL puede servir en la toma de decisiones conjunta, junto con los factores modificadores del riesgo, las comorbilidades, las preferencias del paciente y la fragilidad. La figura 12 puede ayudar en la toma de decisiones, ya que muestra los beneficios estimados de por vida en años libres de ECV en relación con el perfil de riesgo de ECV total, calibrado para países de riesgo bajo a moderado.
Tras el paso 1, se debe considerar la intensificación del tratamiento con el paso 2 en todos los pacientes. Dado que menos es más, se anima a intensificar el tratamiento con liberalidad, especialmente si se utilizan dosis submáximas de estatinas genéricas (de bajo coste) y los efectos secundarios no son evidentes.
El objetivo terapéutico de cLDL<1,4mmol/l (55mg/dl) en el paso 2 para pacientes con EA establecida o sin EA pero en muy alto riesgo es menor que el objetivo < 1,8mmol/l (70mg/dl) de la Guía ESC de prevención de 20162. Este objetivo se ha definido con datos de aleatorizaciones mendelianas recientes80, metanálisis del Cholesterol Treatment Trialists’ Collaboration21, ECA como IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial)515 y, más recientemente, los resultados de ensayos sobre la proproteína convertasa de la subtilisina/kexina tipo 9 (PCSK9)516–518. La clase de recomendación y el nivel de la evidencia que respalda el objetivo de cLDL < 1,4mmol/l (55mg/dl) para pacientes con EA es idéntico al de la Guía ESC/EAS de 2019 sobre el tratamiento de las dislipemias3. Sin embargo, para la prevención primaria para pacientes en muy alto riesgo, la clase de recomendación es menor (clase I en la GPC de dislipemias, clase IIa en esta) porque la decisión del Grupo de Trabajo sobre el objetivo de cLDL en prevención primaria fue menos unánime.
Para pacientes con EA que sufran un segundo evento vascular a los 2 años (no necesariamente del mismo tipo que el primero) durante el tratamiento con la dosis máxima tolerada de estatinas, se puede considerar un objetivo de cLDL incluso más bajo, < 1,0mmol/l (40mg/dl). Cabe destacar que no hay diferencias en la reducción de RR entre varones y mujeres y pacientes jóvenes y mayores (al menos hasta los 75 años) o entre pacientes con y sin DM3.
4.6.2.2Lipoproteínas ricas en triglicéridos y restosNo hay objetivos terapéuticos para los triglicéridos, pero valores < 1,7mmol/l (150mg/dl) se consideran indicativos de riesgo bajo, mientras que valores más altos indican la necesidad de buscar otros factores de riesgo.
4.6.2.3Colesterol unido a lipoproteínas de alta densidadHasta el momento, no se han determinado objetivos específicos de cHDL en ensayos clínicos, aunque el cHDL se asocia con riesgo (residual) en pacientes con EA. La PA y otros factores del estilo de vida, más que el tratamiento, siguen siendo una manera importante de aumentar la concentración de cHDL.
4.6.3Estrategias para el control de las dislipemiasSe deben excluir dislipemias secundarias u otras enfermedades antes de iniciar el tratamiento, ya que el tratamiento de la enfermedad subyacente puede mejorar la hiperlipemia sin necesidad de hipolipemiantes. Este es el caso del hipotiroidismo. Las dislipemias secundarias también pueden ser resultado de alcoholismo, DM, síndrome de Cushing, hepatopatías y nefropatías, así como de fármacos (p. ej., corticoides). Además, la optimización del estilo de vida es crucial para todos los pacientes con valores lipídicos por encima de los recomendados.
4.6.3.1Estrategias para el control del colesterol unido a lipoproteínas de baja densidad4.6.3.1.1Modificaciones de la dieta y del estilo de vidaLos factores dietéticos influyen en el desarrollo de EA, bien directamente o a través de su impacto en factores de riesgo clásicos, como los lípidos plasmáticos, la PA o la glucemia. La evidencia de estudios epidemiológicos indica que un mayor consumo de fruta, verduras sin almidón, frutos secos, legumbres, pescado, aceites vegetales, yogur y granos integrales, junto con menor consumo de carnes rojas y procesadas, alimentos ricos en carbohidratos y sal, se asocia con una menor incidencia de eventos cardiovasculares519. Más aún, la sustitución de grasas animales, incluidas las grasas lácteas, por fuentes vegetales de grasas y AGP puede disminuir el riesgo de EA407. En esta misma sección se puede encontrar recomendaciones sobre el estilo de vida más detalladas.
4.6.3.1.2Fármacos para el tratamiento de las dislipemiasLos hipolipemiantes disponibles en la actualidad son los inhibidores específicos de la 3-hidroxi-3-metilglutaril-coenzima A reductasa (estatinas), fibratos, secuestradores de ácidos biliares, inhibidores selectivos de la absorción del colesterol (como ezetimiba) y los más recientes inhibidores de la PCSK9. El ácido bempedoico, un inhibidor oral de la síntesis del colesterol, se ha aprobado recientemente en diversos países. Se prescribe principalmente para el tratamiento doble junto con ezetimiba para pacientes con intolerancia a las estatinas. No se esperan los resultados de los ensayos en la EA hasta 2022. Además, se ha demostrado que el inclisirán, un nuevo pequeño ácido ribonucleico de interferencia, reduce el cLDL un 50-55% con aplicación subcutánea 2 veces al año. Estos resultados se obtuvieron en combinación con estatinas o sin otros tratamientos hipolipemiantes y con apenas efectos secundarios. El inclisirán se ha aprobado en varios países europeos. Los resultados del ensayo en EA se esperan para 2023.
Las reducciones de cLDL esperadas del tratamiento pueden variar ampliamente entre personas, y se muestran en la figura 13. Por lo tanto, se recomienda la determinación de la concentración de cLDL 4-6 semanas tras el inicio o el cambio de cualquier estrategia terapéutica.
Recomendaciones sobre la reducción farmacológica del colesterol unido a lipoproteínas de baja densidad en pacientes menores de 70 años (para personas de edad ≥ 70 años, consulte las respectivas tablas de recomendaciones)
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda prescribir estatinas de alta intensidad hasta la dosis máxima tolerada para alcanzar los objetivos de cLDL establecidos para cada grupo de riesgo específico 21,520,521 | I | A |
| Para personas menores de 70 años aparentemente sanas y con riesgo muy alto, se debe considerar un objetivo fundamental de cLDL<1,4mmol/l (55mg/dl) y una reducción ≥ 50% de los valores basales21,22,522 | IIa | C |
| Para personas menores de 70 años aparentemente sanas y con riesgo alto, se debe considerar un objetivo fundamental de cLDL < 1,8mmol/l (70mg/dl) y una reducción ≥ 50% de los valores basales21,22,522 | IIa | C |
| Para pacientes con EA establecida, se recomienda un tratamiento hipolipemiante con un objetivo fundamental de cLDL de 1,4mmol/l (55mg/dl) y una reducción ≥ 50% de los valores basales21,508,515–517,522 | I | A |
| Se recomienda el tratamiento doble con ezetimiba si los objetivos no se alcanzan con la dosis máxima tolerada de estatinas515 | I | B |
| En prevención primaria para pacientes en riesgo muy alto pero sin HF, se puede considerar la politerapia con inhibidores de la PCSK9 si el objetivo de cLDL no se alcanza con la dosis máxima tolerada de estatinas y ezetimiba | IIb | C |
| Se recomienda la politerapia con inhibidores de la PCSK9 como prevención secundaria para pacientes que no alcancen los objetivos con la dosis máxima tolerada de estatinas y ezetimiba516,517 | I | A |
| Se recomienda la politerapia con inhibidores de la PCSK9 para pacientes con muy alto riesgo y HF (con EA u otro factor de riesgo importante) que no alcancen los objetivos con la dosis máxima tolerada de estatinas y ezetimiba | I | C |
| Se debe considerar el ezetimiba si el tratamiento con estatinas no se tolera a cualquier dosis (incluso tras reexposición)515,523–525 | IIa | B |
| Se puede considerar un inhibidor de la PCSK9 si el tratamiento con estatinas no se tolera a cualquier dosis (incluso tras reexposición)523,524, 526 | IIb | C |
| Se puede considerar el tratamiento doble con estatinas y un secuestrador de ácidos biliares si no se alcanzan los objetivos | IIb | C |
| No se recomienda el tratamiento con estatinas para pacientes premenopáusicas que planeen gestar o no empleen métodos anticonceptivos adecuados | III | C |
cLDL: colesterol unido a lipoproteínas de baja densidad; EA: enfermedad ateroesclerótica; HF: hipercolesterolemia familiar; PCSK9: proproteína convertasa de la subtilisina/kexina tipo 9.
a Clase de recomendación.
b Nivel de evidencia.
c Se recomienda un enfoque gradual para los objetivos de cLDL; véase la sección 3.2.3.1 y las figuras 6 y 7.
Adaptado3.
Las estatinas disminuyen el cLDL, por lo que reducen la morbilidad y la mortalidad de la EA, así como la necesidad de intervenciones coronarias. Las estatinas también disminuyen los triglicéridos y pueden reducir el riesgo de pancreatitis. Por lo tanto, son el medicamento de primera elección para pacientes con aumento del riesgo de EA3.
4.6.3.1.3.1Reacciones adversas, interacciones y adherencia al tratamiento con estatinas. El efecto adverso más frecuente del tratamiento con estatinas es la miopatía, pero sucede poco. En un metanálisis se descartó la contribución de las estatinas al aumento en la mortalidad no cardiovascular522. El aumento de la glucemia y la HbA1c (es decir, aumento del riesgo de DM2) puede ocurrir tras el inicio del tratamiento y dependen de la dosis, en parte relacionada con una ligera ganancia ponderal, pero los beneficios de las estatinas superan los riesgos para la mayoría de los pacientes527. La adherencia a los cambios en el estilo de vida tras la prescripción de estatinas debería disminuir el riesgo de DM. Puede producirse un aumento de enzimas hepáticas durante el tratamiento con estatinas, pero suele ser reversible. La monitorización sistemática de las enzimas hepáticas no está indicada.Aunque un 5-10% de los pacientes tratados con estatinas informan de mialgia, en la mayoría de los casos no se puede atribuir a las estatinas3. El riesgo de miopatía (síntomas musculares graves) puede minimizarse identificando a los pacientes vulnerables o evitando las interacciones de las estatinas con grupos farmacológicos específicos. La rabdomiolisis es extremadamente rara. Teniendo en cuenta que las estatinas se prescriben a largo plazo, las posibles interacciones con otros medicamentos obligan a una vigilancia extrema y continua, ya que muchos pacientes recibirán tratamiento farmacológico para enfermedades concomitantes. En la práctica, el tratamiento de un paciente con mialgia sin un gran aumento de los valores de creatincinasa se basa en ensayo y error, y suele conllevar el cambio a estatinas diferentes o el tratamiento con dosis muy bajas durante varios días a la semana, con un aumento gradual de la frecuencia y la dosis. Un algoritmo terapéutico puede ayudar en el tratamiento de estos pacientes3.
4.6.3.1.4Inhibidores de la absorción de colesterol (ezetimiba)La combinación de estatinas con ezetimiba reporta un beneficio parecido al de los metanálisis en que se observa que la reducción del cLDL tiene beneficios independientemente del enfoque utilizado3,21. Los estudios genéticos también respaldan los efectos beneficios de la ezetimiba528. Todos estos datos apoyan la consideración del tratamiento con ezetimiba como tratamiento de segunda línea, bien en combinación con estatinas cuando no se alcance el objetivo terapéutico, bien cuando las estatinas no se puedan prescribir.
4.6.3.1.5Inhibidores de la proproteína convertasa subtilisina/kexina tipo 9Los inhibidores de la PCSK9 (anticuerpos monoclonales para la PCSK9) disminuyen el cLDL hasta en un 60% en monoterapia o en combinación con la dosis máxima tolerada de estatinas u otros tratamientos hipolipemiantes como la ezetimiba. Su eficacia parece ser en gran medida independiente del tratamiento de fondo. En combinación con la dosis máxima tolerada de estatinas, alirocumab y evolocumab redujeron el cLDL un 46-73% más que con placebo y un 30% más que con ezetimiba516,517. En pacientes a los que no se puede prescribir estatinas, los inhibidores de la PCSK9 combinados con ezetimiba reducen el cLD529. Tanto el alirocumab como el evolocumab reducen efectivamente el cLDL en pacientes diabéticos, con una gran reducción de futuros eventos de EA516,517. Los inhibidores de la PCSK9 también reducen los triglicéridos, aumentan el cHDL y la apolipoproteína A-I y disminuyen la lipoproteína(a), aunque se desconoce la contribución relativa de estas modificaciones lipídicas. Los inhibidores de la PCSK9 son caros y se desconocen su rentabilidad, su seguridad a largo plazo y su efecto en la prevención primaria. Se recomienda considerar su rentabilidad local y regional antes de implementar recomendaciones sobre su empleo. Las recomendaciones sobre el tratamiento con inhibidores de la PCSK9 se describen en las recomendaciones sobre la reducción farmacológica del cLDL. El inclisirán es un inhibidor de la síntesis hepática de PCSK9 de acción prolongada que también disminuye el cLDL considerablemente530. Queda por definir su efecto en desenlaces clínicos.
4.6.3.2Estrategias para el control de los triglicéridos plasmáticosAunque el riesgo de ECV aumenta con cifras de triglicéridos en ayunas > 1,7mmol/l (50mg/dl)531, el tratamiento farmacológico para reducirlas solo se debe considerar para pacientes con alto riesgo y triglicéridos > 2,3mmol/l (200mg/dl) y si no se pueden reducir con modificaciones del estilo de vida. Las intervenciones farmacológicas disponibles son las estatinas, los fibratos, los inhibidores de la PCSK9 y los AGP omega 3 (especialmente el icosapento de etilo en dosis de 2-4g/día) (véase la sección 4.3.2.4.4).
Las recomendaciones sobre el tratamiento de la hipertrigliceridemia se encuentran más adelante.
4.6.3.2.1FibratosLos fibratos sirven principalmente para reducir los triglicéridos y, a veces, aumentar la concentración de cHDL. La evidencia que respalda el tratamiento con estos medicamentos para la reducción de eventos cardiovasculares es escasa y, dada la evidencia a favor de las estatinas, no se recomienda el tratamiento sistemático con estos medicamentos para la prevención de la ECV3. Para prevenir la pancreatitis, con triglicéridos > 10mmol/l (900mg/dl) la reducción no solo debe ser farmacológica, también debe incluir la restricción del consumo de alcohol, el tratamiento de la DM y la retirada del tratamiento estrogénico, etc. Se debe considerar la derivación a un especialista para los pacientes con hipertrigliceridemia primaria grave.
Un enfoque sobre la prescripción de nutracéuticos hipolipemiantes basada en la evidencia podría mejorar la calidad del tratamiento, lo cual incluye la adherencia al tratamiento y la consecución de objetivos de cLDL en la práctica clínica. Sin embargo, debe quedar claro que todavía no hay estudios sobre los resultados que demuestren que los nutracéuticos hipolipemiantes pueden prevenir la mortalidad o la morbilidad cardiovascular532.
Recomendaciones sobre el tratamiento farmacológico de pacientes con hipertrigliceridemia
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda el tratamiento con estatinas como medicamento de primera elección para la reducción del riesgo de ECV en personas con alto riesgo e hipertrigliceridemia (triglicéridos > 2,3mmol/l [200mg/dl])533 | I | A |
| Para los pacientes que toman estatinas y están en el objetivo de cLDL con triglicéridos>2,3mmol (200mg/dl), se puede considerar el fenofibrato o el bezafibrato534–536 | IIb | B |
| Para los pacientes con riesgo alto (o superior) y triglicéridos>1,5mmol/l (135mg/dl) pese al tratamiento con estatinas y los cambios en el estilo de vida, se puede considerar los AGP omega 3 (icosapento de etilo 2×2g/día) en combinación con estatinas84 | IIb | B |
AGP: ácidos grasos poliinsaturados; cLDL: colesterol unido a lipoproteínas de baja densidad; ECV: enfermedad cardiovascular.
a Clase de recomendación.
b Nivel de evidencia.
Adaptado3.
Las reducciones proporcionales por mmol/l de reducción del cLDL en los eventos vasculares mayores, eventos coronarios mayores, revascularización coronaria e ictus son similares en varones y en mujeres. Además, los efectos relativos de los hipolipemiantes distintos de las estatinas (ezetimiba e inhibidores de la PCSK9 en combinación con estatinas de alta intensidad) también son similares3.
4.6.4.2Pacientes ancianos (≥ 70 años)En comparación con la Guía ESC/EAS 2019 sobre el tratamiento de las dislipemias3, en el presente documento se aporta un único límite para identificar a las «personas ancianas» como las de edad ≥ 70 años, en lugar de 75, por coherencia con otras partes de este documento. Como resultado, la clase de recomendación y el nivel de evidencia se han modificado en algunos grupos etarios, específicamente en la categoría de pacientes de 70 a 75 años. Aunque actualmente se utiliza un único límite, es importante subrayar que todos los límites de edad son relativamente arbitrarios y que en la práctica clínica la edad biológica influye en el umbral. Por ejemplo, una persona de 75 años en muy buena forma física puede cumplir los criterios del tratamiento reservado a los menores de 70 años y viceversa, a una persona de 65 años muy frágil se la puede considerar «anciana». Las recomendaciones generales sobre tratamientos hipolipemiantes para pacientes ancianos se resumen más adelante.
La evidencia reciente ha reforzado el papel del cLDL como un factor de riesgo de EA en pacientes ancianos537. La evidencia de ensayos clínicos indica que las estatinas y otros medicamentos hipolipemiantes consiguen reducciones significativas de los eventos vasculares mayores independientemente de la edad538,539. Sin embargo, no hay evidencia tan directa sobre los beneficios de las estatinas en pacientes sin EA documentada. Por debajo de los 70 años, las estatinas se recomiendan para la prevención primaria dependiendo del nivel de riesgo. Por encima de esa edad, el inicio del tratamiento con estatinas para la prevención primaria se puede considerar cuando haya un riesgo (muy) alto, pero se recomienda explícitamente tomar en consideración otros factores, como los modificadores del riesgo, la fragilidad, la estimación del beneficio de por vida, las comorbilidades y las preferencias del paciente (véase la sección 3.2.3.3 y la figura 12). En el caso de deterioro de la función renal o riesgo de interacción medicamentosa, se debe ajustar la dosis de estatinas con cuidado. En cuanto a los objetivos de cLDL, no hay evidencia suficiente que respalde los objetivos en prevención primaria para pacientes ancianos. Aunque el objetivo convencional de cLDL de<2,6mmol (100mg/dl) puede parecer razonable, se debe esperar por los resultados de los ensayos con pacientes ancianos en prevención primaria actualmente en curso (STAREE [STAtin Therapy for Reducing Events in the Elderly]; clinicatrials. gov registration: NCT02099123). La fragilidad, la polifarmacia y los síntomas musculares son factores relevantes que tener en consideración en pacientes ancianos.
Recomendaciones sobre el tratamiento de las dislipemias de personas ancianas (≥ 70 años)
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda el tratamiento con estatinas para personas ancianas con EA de la misma forma que para los pacientes más jóvenes538,539 | I | A |
| Se puede considerar el inicio del tratamiento con estatinas en prevención primaria para pacientes de edad ≥ 70 años que tengan riesgo alto o superior538,539 | IIb | B |
| Se recomienda iniciar el tratamiento con estatinas con una dosis baja si hay deterioro renal significativo o posibles interacciones medicamentosas | I | C |
La reducción del cLDL de los pacientes diabéticos se ha asociado de manera constante con menos riesgo de ECV. Al igual que la prevención en personas aparentemente sanas, se propone un enfoque gradual para el control lipídico que dependa del riesgo, la estimación del beneficio de por vida, las comorbilidades y las preferencias del paciente (figura 8). Los inhibidores de la PCSK9 también se pueden prescribir a pacientes diabéticos que no alcancen los objetivos de cLDL con estatinas o ezetimiba.
Recomendaciones sobre el tratamiento de las dislipemias en la diabetes mellitus
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para los pacientes con diabetes mellitus tipo 2 y muy alto riesgo (p. ej., con EA establecida o DOD grave, se recomienda una intensificación del tratamiento hipolipemiante con el objetivo fundamentald de reducir el cLDL al menos un 50% y a un valor < 1,4mmol/l (55mg/dl)21,22,522,540,541 | I | A |
| Para los pacientes con DM2 mayores de 40 años con alto riesgo, se recomienda el tratamiento hipolipemiante con un objetivo fundamentald de reducir el cLDL al menos un 50% y a un valor < 1,8mmol/l (70mg/dl)540,541 | I | A |
| Para los pacientes de edad ≤ 40 años con DM1 o DM2 sin evidencia de DOD o cLDL > 2,6mmol/l (100mg/dl), se puede considerar el tratamiento con estatinas, a menos que no se planee una gestación | IIb | C |
| Se debe considerar la politerapia de estatinas y ezetimiba si los objetivos de cLDL no se alcazan515,542 | IIa | B |
cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; DOD: daño de órgano diana; EA: enfermedad ateroesclerótica.
a Clase de recomendación.
b Nivel de recomendación.
c El DOD grave en este contexto específico implica una TFGe<45ml/min/1,73 m2; TFGe 46-79ml/min/1,73 m2 y microalbuminuria, enfermedad microvascular en al menos 3 localizaciones distintas (p. ej., albuminuria con retinopatía y neuropatía). Para más información, véase la tabla4.
dSe recomienda un enfoque gradual para los objetivos de cLDL (véase la sección 3.2.3.1 y la figura8).
Adaptado3.
Los pacientes con ERC tienen un riesgo de EA alto o muy alto y una dislipemia característica (triglicéridos altos, cLDL normal y cHDL bajo). El tratamiento doble con estatinas en combinación con ezetimiba (que permite mayores reducciones de cLDL sin aumentar la dosis de estatinas) tiene un efecto beneficioso en los eventos de EA en la ERC543. Sin embargo, para los pacientes con nefropatía en fase terminal, se recomienda no iniciar el tratamiento hipolipemiante (véase las recomendaciones más adelante). Si los pacientes con ERC en tratamiento hipolipemiante entran en fase terminal, se debe mantener el tratamiento.
Recomendaciones sobre el tratamiento lipídico para pacientes con enfermedad renal crónica de moderada a grave (Kidney Disease Outcomes Quality Initiative, estadios 3-5)
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda el tratamiento con estatinas o el tratamiento doble con estatinas y ezetimiba para pacientes sin diálisis diaria en estadios 3-5 de ERC525,544,545 | I | A |
| Se debe considerar la continuación del tratamiento de los pacientes tratados con estatinas, ezetimiba o el tratamiento doble con estatinas y ezetimiba al inicio de la diálisis, especialmente si tienen EA | IIa | C |
| Para los pacientes con ERC y diálisis sin EA, no se recomienda iniciar el tratamiento con estatinas546,547 | III | A |
EA: enfermedad ateroesclerótica; ERC: enfermedad renal crónica.
a Clase de recomendación.
b Nivel de evidencia.
Adaptado3.
Se puede identificar a los pacientes que pueden padecer dislipemias genéticas, como la HF heterocigota, por las alteraciones lipídicas importantes o los antecedentes familiares (tabla 1). Un cLDL > 4,9mmol (190mg/dl) en pacientes sin tratamiento previo requiere la evaluación minuciosa de HF. Sin embargo, en presencia de EA prematura o antecedentes familiares, se debe considerar la posibilidad de HF con cifras de cLDL menores. Además de las pruebas genéticas (no siempre asequibles) se recomienda utilizar los criterios del Dutch Clinical Lipid Network (tabla 11) para identificar posibles HF. La HF heterocigota es infrecuente y siempre se debe derivar a expertos en lípidos.
Las recomendaciones sobre el tratamiento de los pacientes con HF se pueden encontrar en la Guía de la ESC/EAS de 2019 sobre el tratamiento de las dislipemias3.
4.7Presión arterialLa hipertensión es una de las principales causas evitables de morbilidad y mortalidad prematuras. Afecta a más de 150 millones de personas en Europa y a más de mil millones en el mundo, con una prevalencia de un ∼30-45% de los adultos, que aumenta con la edad hasta más del 60% de los mayores de 60 años y representa ∼10 millones de muertes al año en el mundo577. A pesar de la gran cantidad de evidencia sobre la efectividad de los tratamientos hipotensores en la reducción del riesgo de ECV y muerte, la detección, el tratamiento y el control de la PA en Europa y en el mundo siguen siendo deficientes578.
Esta sección engloba las recomendaciones sobre el diagnóstico y el tratamiento de la hipertensión aplicables a la práctica habitual de la atención primaria y secundaria. Para más información y recomendaciones sobre casos complejos y atención terciaria, está disponible las Guía de la ESC/ESH de 2018 sobre el diagnóstico y el tratamiento de la hipertensión arterial4.
Resumen de recomendaciones sobre el tratamiento clínico de la hipertensión
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Clasificación de la PA | ||
| Se recomienda la clasificación de la PA en óptima, normal y normal-alta o grados 1-3 de hipertensión, según la PA en consulta | I | C |
| Diagnóstico de hipertensión | ||
| Se recomienda basar el diagnóstico de hipertensión en: | ||
| Mediciones de PA repetidas en consulta, en más de una cita, excepto cuando la hipertensión sea grave (p. ej., grado 3 y sobre todo en pacientes con alto riesgo) | I | C |
| o | ||
| PA fuera de consulta con MAPA o AMPA cuando sea posible | I | C |
| Evaluación del daño orgánico mediado por hipertensión | ||
| Para todos los pacientes, se recomienda determinar la creatinina sérica, la TFGe, los electrolitos y el cociente albúmina/creatinina para evaluar la presencia de daño orgánico mediado por hipertensión. Se recomienda un ECG de 12 derivaciones y una ecocardiografía para los pacientes con alteraciones electrocardiográficas y signos/síntomas de disfunción del VI. Se recomiendan la oftalmoscopia o las pruebas de imagen retinianas para los pacientes con hipertensión de grado 2-3 y para todos los hipertensos con DM548–551 | I | B |
| Parámetros para el inicio del tratamiento hipotensor | ||
| Se recomienda iniciar el tratamiento según el riesgo de ECV absoluto, los beneficios de por vida estimados y la presencia de daño orgánico mediado por hipertensión para la hipertensión grado 1552,553 | I | C |
| Se recomienda el tratamiento farmacológico para los pacientes con hipertensión de grado 2 o superior4,552 | I | A |
| Objetivos de PA en consulta | ||
| Se recomienda que el primer objetivo terapéutico sea disminuir la PA a<140/90mmHg en todos los pacientes y luego ajustar los objetivos según la edad y las comorbilidades específicas552,554 | I | A |
| Se recomienda un objetivo fundamental en la franja de 120-130mmHg para la mayoría de los pacientes de 18-69 años en tratamiento552,554–556 | I | A |
| Se recomienda que el objetivo de la PAS sea < 140, e incluso < 130 si se tolera, para los pacientes de 70 o más años en tratamiento552,554,557 | I | A |
| Se recomienda reducir la PAD de todos los pacientes en tratamiento a < 80 mmHg555,558,559 | I | A |
| Tratamiento de la hipertensión: intervenciones en el estilo de vida | ||
| Se recomiendan intervenciones en el estilo de vida para toda persona con PA normal-alta o superiorc | I | C |
| Tratamiento farmacológico de la hipertensión | ||
| Para la mayoría de los pacientes, se recomienda iniciar el tratamiento antihipertensivo con una combinación de 2 fármacos, preferiblemente en un único comprimido. Las excepciones son los pacientes frágiles o de edad avanzada y aquellos con hipertensión grado 1 de bajo riesgo (especialmente con PAS < 150mmHg)560–565 | I | B |
| Se recomienda que las combinaciones preferibles incluyan un bloqueador del SRA (p. ej., un IECA o ARA-II) con un BCC o un diurético, pero se puede utilizar otras combinaciones de los 5 grandes grupos (IECA o ARA-II, bloqueadores beta, BCC, tiacidas o diurético tiacídico)566–569 | I | A |
| Si no se logra controlar la PA con tratamiento doble, se recomienda instaurar tratamiento triple, por lo general un bloqueador del SRA con un BCC y un diurético, preferiblemente combinados en un único comprimido563,570,571 | I | A |
| Si no se logra controlar la PA con tratamiento triple, se recomienda agregar al tratamiento espironolactona o, si no se tolera, otros diuréticos como amilorida o dosis más altas de otros diuréticos, un bloqueador alfa o un bloqueador beta o clonidina555,572,574 | I | B |
| No se recomienda la combinación de dos bloqueadores del SRA575,576 | III | A |
| Tratamiento del riesgo de ECV de los pacientes hipertensos | ||
| Se recomienda el tratamiento con estatinas para muchos pacientes hipertensosd | Sección 4.6 | |
| Se recomienda el tratamiento antiagregante plaquetario en prevención secundaria para pacientes hipertensos | Sección 4.9 | |
AMPA: automedición domiciliaria de la presión arterial; ARA-II: antagonistas del receptor de la angiotensina II; BCC: bloqueadores de los canales del calcio; DM: diabetes mellitus; EA: enfermedad ateroesclerótica; ECG: electrocardiograma; IECA: inhibidores de la enzima de conversión de la angiotensina; MAPA: monitorización ambulatoria de la presión arterial; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica; SRA: sistema renina-angiotensina; TFGe: tasa de filtrado glomerular estimada; VI: ventrículo izquierdo.
a Clase de recomendación.
b Nivel de evidencia.
c Más información en la sección 4.3.
d Más información en la sección 4.6.
eMás información en la sección 4.9.
La PA se clasifica según la determinada en consulta en sedestación (tabla 12), cuyos valores se corresponden aproximadamente a las cifras medias de MAPA o AMPA de la tabla 13.
4.7.2Determinación de la presión arterial4.7.2.1Determinación de la presión arterial en consultaLa PA se debe determinar en condiciones estandarizadas utilizando técnicas auscultatorias o dispositivos (semi)automáticos validados, como se describe en la tabla 14.
4.7.2.2Determinación de la presión arterial en consulta sin supervisiónLas determinaciones automatizadas de la PA en consulta repetidas pueden mejorar la reproducibilidad de la determinación de la PA. Si el paciente está sentado solo y sin observación, la PA en consulta sin supervisión puede reducir o eliminar el «efecto bata blanca», y los valores de PA en estas condiciones suelen ser más bajos que los de la PA en consulta convencional y más parecidos a la MAPA durante el día o los valores de AMPA. Hay poca información sobre el valor pronóstico de los valores de PA en consulta sin supervisión4.
4.7.2.3Monitorización ambulatoria de la presión arterialLa MAPA es la media de determinaciones automáticas de la PA durante el día y la noche en 24 h. La MAPA es mejor predictor del daño orgánico mediado por hipertensión y de los desenlaces clínicos que la PA en consulta e identifica la hipertensión clínica aislada (efecto de «bata blanca») y la hipertensión enmascarada (véase más adelante). Los umbrales diagnósticos de la hipertensión son menores con MAPA que con la determinación en consulta (tabla 12)4.
4.7.2.4Automedición domiciliaria de la presión arterialEs la media de todas las determinaciones de PA llevadas a cabo con un monitor semiautomático validado durante al menos 3 días consecutivos (preferiblemente 6-7 días) con determinaciones durante la mañana y la tarde, en sedestación y en una habitación tranquila tras 5 min en reposo. Los umbrales para el diagnóstico de hipertensión con la automedición domiciliaria de la presión arterial (AMPA) son más bajos que los umbrales para la PA en consulta (tabla 12). Que los pacientes se determinen la PA puede tener un efecto beneficioso en la adherencia a la medicación y el control de la PA4.
Las recomendaciones clínicas para la AMPA se presentan en la tabla 15.
4.7.3Cribado y diagnóstico de la hipertensiónPreferiblemente, se debería cribar a todos los adultos para detectar hipertensión578,579, pero la mayoría de los países carecen de los recursos y las infraestructuras necesarios. Esta guía recomienda oficialmente el cribado oportunista, al menos de las personas susceptibles, como aquellas con sobrepeso o antecedentes familiares de hipertensión (véase la sección 3.1).
Cuando se sospeche hipertensión, el diagnóstico se debe confirmar por determinaciones de PA en consulta repetidas durante varias citas o con MAPA o AMPA de 24 h (figura 14).
4.7.3.1Hipertensión clínica aislada e hipertensión enmascaradaLa hipertensión clínica aislada se define como una PA elevada en consulta con cifras normales en la MAPA o la AMPA. Se presenta en un 30-40% de los pacientes. El riesgo asociado con la hipertensión clínica aislada es menor que con la hipertensión sostenida, pero podría ser más alta que la normotensión. Las personas con hipertensión clínica aislada deben recibir asesoramiento sobre el estilo de vida para reducir su riesgo cardiovascular y se les debe ofrecer la determinación de la PA al menos cada 2 años con MAPA o AMPA debido a las altas tasas de transición a hipertensión esencial. No está indicado por sistema el tratamiento farmacológico para la hipertensión clínica aislada.
La hipertensión enmascarada hace referencia a pacientes con normotensión en consulta pero una PA elevada en MAPA o AMPA. Estos pacientes suelen tener daño orgánico mediado por hipertensión y un riesgo cardiovascular equivalente al de la hipertensión esencial. Es más común en pacientes jóvenes o con normotensión en consulta. Se recomiendan cambios en el estilo de vida para la hipertensión enmascarada, y se debe considerar el tratamiento farmacológico para controlar la PA «fuera de la consulta», con monitorización periódica de la PA, habitualmente con AMPA.
4.7.4Evaluación clínica y estratificación del riesgo de los pacientes con hipertensiónLas pruebas diagnósticas habituales para los pacientes con hipertensión se muestran en la tabla 16. Además de la exploración clínica, este proceso está diseñado para:
- •
Evaluar los factores de riesgo de EA (véase la sección 3.2) o la presencia de enfermedades cardiacas, vasculares o renales.
- •
Detectar evidencia de daño orgánico mediado por hipertensión, como hipertrofia del VI, nefropatía o retinopatía.
- •
Considerar las potenciales causas secundarias de hipertensión, como enfermedad cardiorrenal, hiperaldosteronismo o feocromocitoma (tabla 17). Además, evaluar cuidadosamente el consumo de drogas (p. ej., cocaína), fármacos que puedan elevar la PA (como la ciclosporina o los simpaticomiméticos), regaliz, etc. Otras fuentes ofrecen más detalles sobre las pruebas diagnósticas por sospecha de hipertensión secundaria4.
Para los pacientes con alteraciones electrocardiográficas, se recomienda una ecocardiografía, que se debe considerar cuando el resultado pueda afectar a las decisiones clínicas. Se recomienda la oftalmoscopia en hipertensión de grado 2 o 3 y para todo paciente con DM. No se recomiendan la determinación sistemática de otros biomarcadores y las pruebas de imagen vascular548–551.
4.7.5Tratamiento de la hipertensiónEl tratamiento de la hipertensión conlleva intervenciones en el estilo de vida para todos los pacientes y el tratamiento farmacológico para casi todos.
4.7.5.1Intervenciones en el estilo de vida para disminuir la presión arterial y reducir el riesgo cardiovascularLas intervenciones en el estilo de vida están indicadas para todo paciente con PA normal-alta o hipertensión porque pueden retrasar la necesidad del tratamiento farmacológico o complementar el efecto hipotensor del tratamiento farmacológico. Más aún, la mayoría de las intervenciones en el estilo de vida tienen beneficios para la salud más allá de su efecto hipotensor. Se trata en extenso sobre el estilo de vida en la sección 4.3.
4.7.5.2Inicio del tratamiento farmacológicoLas decisiones sobre el tratamiento farmacológico en la prevención de la ECV se basan principalmente en el riesgo de ECV absoluto, los factores modificadores del riesgo, las comorbilidades, el beneficio estimado del tratamiento, la fragilidad y las preferencias del paciente. El tratamiento farmacológico para la hipertensión de grado 1 (PAS 140-159mmHg) tiene un nivel de evidencia A para la reducción del riesgo de ECV. Sin embargo, en pacientes más jóvenes, el riesgo de ECV absoluto a 10 años suele ser bajo y se debe considerar los beneficios del tratamiento de por vida y comunicarlos antes de iniciar el tratamiento (figura 6 y sección 3.2.3.6). En muchos de estos casos, el beneficio absoluto de por vida por cada 10 mmHg de reducción de la PAS es de moderado a alto (figura 15) (el beneficio absoluto se ha calibrado en países con riesgo de ECV de bajo a moderado). Además, la presencia de daño orgánico mediado por hipertensión obliga al tratamiento de la hipertensión de grado 1. Se recomienda el tratamiento para la hipertensión de grado 2 (PAS > 160mmHg) no solo porque el beneficio de por vida de la reducción de la PA es grande para casi todos estos pacientes, sino que también es importante la reducción del riesgo de daño orgánico mediado por hipertensión, que puede dar lugar a otras morbilidades como nefropatía, ictus hemorrágico e IC.
4.7.5.3Objetivos de presión arterial terapéuticosCuando se instaure el tratamiento farmacológico, el objetivo es disminuir la PA al objetivo en 3 meses. La evidencia actual indica que los objetivos de PA en la versión anterior de esta guía2 eran demasiado conservadores, especialmente para pacientes de edad avanzada. Siguiendo el enfoque por pasos (sección 3.2.3.1), ahora se recomienda que el primer paso de tratamiento de todos los pacientes tratados sea una PAS < 140mmHg y una PA diastólica (PAD)<80 mmHg552,554. El intervalo objetivo fundamental de la PAS para pacientes jóvenes (18-69 años) es 120-130mmHg, aunque algunos pacientes tratados pueden conseguir con seguridad cifras de PAS por debajo de estos valores y, si se tolera bien, no hay necesidad de retirar el tratamiento552,554–556. El objetivo fundamental de PAS para los pacientes de 70 o más años es < 140mmHg, y hasta 130mmHg si se tolera552,554–556. Este cambio en el intervalo de cifras objetivo de PA para personas de edad avanzada en comparación con las Guía de la ESC de 20162 está respaldado por la evidencia de que muchos pacientes ancianos pueden conseguir con seguridad estos objetivos terapéuticos, que se asocian con reducciones significativas del riesgo de ictus grave, IC y muerte cardiovascular557,580. También toma en consideración que incluso las PAS más bajas en el grupo de tratamiento intensivo del ensayo SPRINT (media, 124mmHg) probablemente reflejan el intervalo habitual de la PAS en consulta, 130-139 mmHg555. Sin embargo, se reconoce que la evidencia que respalda objetivos más estrictos es menos contundente en caso de personas muy ancianas (> 80 años) y pacientes frágiles. Además, en los muy ancianos y sobre todo los pacientes frágiles, puede ser difícil conseguir los objetivos de PA recomendados debido a la mala tolerancia o la dificultad de obtener mediciones de alta calidad, por lo que vigilar la tolerabilidad y los efectos adversos es de vital importancia en estas poblaciones580.
En comparación con la Guía de la ESC/ESH de 2018 sobre el diagnóstico y el tratamiento de la hipertensión, se ha modificado de 65 a 70 años el umbral para identificar a los pacientes «de edad avanzada» por coherencia con otros apartados de esta guía. Aunque se ofrece un único umbral, es importante señalar que en la práctica clínica la edad biológica influye en él. Por ejemplo, una persona de 75 años en muy buena forma física puede cumplir los requisitos del tratamiento reservado para los menores de 70 años y viceversa, a una persona de 65 años muy frágil se la puede considerar «anciana».
Los objetivos de PA para subgrupos de pacientes con diversas comorbilidades se muestran en la tabla 18.
4.7.5.3.1Objetivos de presión arterial por MAPA y AMPANo hay ensayos clínicos de resultados que hayan utilizado la MAPA o la AMPA para guiar el tratamiento. Por lo tanto, los objetivos de PA con estos sistemas están extrapolados de datos observacionales. Una PAS en consulta de 130mmHg con tratamiento probablemente se corresponda con una PAS de 24 h de 125mmHg o una PAS < 130mmHg por AMPA4.
4.7.5.4Tratamiento farmacológico de la hipertensiónEl factor más importante para el beneficio es la magnitud de la reducción de la PA. Raramente se conseguirá el control óptimo de la PA con monoterapia.
Tratamiento doble. Se debe considerar como el inicial de referencia para la hipertensión560–563,565,581. Las únicas excepciones serían los pacientes con una PA basal cercana al objetivo recomendado, que podrían alcanzar el objetivo con un único medicamento, o personas de edad muy avanzada (> 80 años) o muy frágiles, que podrían tolerar mejor una reducción menos intensa de la PA. La politerapia inicial, incluso en dosis bajas, es más efectiva para la reducción de la PA que la monoterapia560,561,565, reduce antes la PA y, por lo tanto, se obtiene una respuesta más heterogénea560,565. Más aún, la politerapia inicial no aumenta el riesgo de efectos adversos560–563. Iniciar el tratamiento con politerapia también ayuda a combatir la inercia terapéutica por la que solo se trata a los pacientes con un medicamento pese a un control inadecuado de la PA562.
Estrategia de un comprimido para la hipertensión. La mala adherencia a los medicamentos hipotensores es una de las principales causas del mal control de la PA y se relaciona directamente con el número de comprmidos581. La politerapia con un único comprimido (si está disponible) es preferible y mejora el control de la PA de la mayoría de los pacientes560–565.
Tratamiento farmacológico recomendado y algoritmo para el tratamiento. Las 5 principales clases de hipotensores han mostrado beneficios en la reducción de eventos cardiovasculares: los inhibidores de la enzima de conversión de la angiotensina (IECA), los antagonistas del receptor de la angiotensina II (ARA-II), los bloqueadores beta, los bloqueadores de los canales del calcio (BCC) y las tiacidas o los diuréticos tiacídicos582. La figura 16 muestra un reciente algoritmo para la recomendación de tratamientos basado en la mejor evidencia disponible, consideraciones pragmáticas (como la disponibilidad de comprimidos combinados) y razonamientos fisiopatológicos4. El tratamiento preferible para la mayoría de los pacientes con hipertensión es la politerapia con un IECA o un ARA-II con un BCC o tiacidas/diuréticos tiacídicos566–569. Para los pacientes que requieran tratamiento triple, se debe utilizar una combinación de IECA o ARA-II, BCC y tiacidas/tiacídicos563,570,571. Los bloqueadores beta se deben utilizar con indicaciones especiales (p. ej., angina, tras infarto de miocardio, arritmia o IC-FEr, o como alternativa a los IECA o ARA-II para mujeres en edad fértil)582. No se recomienda combinar un IECA y un ARA-II, pues no producen beneficios adicionales en los resultados y aumentan el riesgo de daño575,576. Se recomiendan modificaciones específicas del algoritmo de tratamiento para los pacientes con EC, ERC, IC y FA4.
4.7.6Hipertensión resistenteLa hipertensión resistente se define como una PA descontrolada a pesar del tratamiento con las dosis óptimas o más toleradas de 3 o más fármacos que incluyan un diurético, confirmada con MAPA o AMPA. Es probable que la prevalencia de la hipertensión resistente se aproxime a menos del 10% de los pacientes hipertensos en tratamiento. La espironolactona es el fármaco más efectivo para disminuir la PA en la hipertensión resistente cuando se añade al tratamiento preexistente; sin embargo, el riesgo de hiperpotasemia aumenta en pacientes con ERC y TFGe < 45ml/min/m2 y potasio en sangre > 4,5mmol/l555,572. Los fármacos que absorben potasio reducen el riesgo de hiperpotasemia573. Cuando no se tolere la espironolactona, hay evidencia para el tratamiento con amilorida, bloqueadores alfa, bloqueadores beta o agentes de acción central como la clonidina555,572,574. La denervación renal y los tratamientos con dispositivos se pueden considerar para casos específicos y se analizan en la Guía de la ESC/ESH de 2018 sobre el diagnóstico y el tratamiento de la hipertensión4.
4.7.7Tratamiento de la hipertensión en mujeresEl diagnóstico y el tratamiento de la hipertensión en mujeres es similar que en varones, excepto para las mujeres en edad fértil o embarazadas debido a los potenciales efectos adversos de algunos fármacos para el feto, especialmente en el primer trimestre. Además, se debe considerar el efecto de los anticonceptivos orales en el riesgo de desarrollar o empeorar la hipertensión.4
4.7.8Duración del tratamiento y el seguimientoEl tratamiento de la hipertensión suele mantenerse indefinidamente porque interrumpir el tratamiento suele dar como resultado que la PA vuelva a los valores previos al tratamiento. Para quienes hayan tenido éxito implementando cambios en el estilo de vida, es posible reducir gradualmente la dosis o el número de fármacos. Una vez la PA se ha controlado y es estable, se debería concertar citas anuales e incluir el control de otros factores de riesgo, la función renal y el daño orgánico mediado por hipertensión y reforzar los cambios en el estilo de vida. Cuando a un paciente con PA controlada se le descontrole, se debe considerar la posible falta de adherencia al tratamiento. La AMPA ayuda a los pacientes a participar en el control y puede mejorar el control de la PA. La AMPA es esencial para monitorizar el control de la PA de pacientes con hipertensión clínica aislada o enmascarada. La supervisión del seguimiento del paciente involucra cada vez más a profesionales de enfermería y farmacia, y es probable que se apoye cada vez más en la telemedicina y las aplicaciones móviles.
4.8Diabetes mellitusRecomendaciones sobre el tratamiento de pacientes con diabetes mellitus
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Cribado | ||
| Se debe considerar la determinación de la HbA1c (no necesariamente en ayunas) o la glucosa en ayunas en el cribado de DM en pacientes con o sin EA583 | IIa | A |
| Estilo de vida | ||
| Se recomiendan cambios en el estilo de vida que incluyan la deshabituación tabáquica, una dieta baja en grasas saturadas y alta en fibras, AF aeróbica y entrenamiento de fuerza584 | I | A |
| Se recomienda reducir la ingesta energética para contribuir a la pérdida de peso o prevenir la ganancia de peso lenta584 | I | B |
| Para los pacientes que estén motivados, se debe considerar las dietas hipocalóricas con reintroducción de alimentos para las fases de mantenimiento justo tras el diagnóstico, ya que pueden llevar a la remisión de la DM585,586 | IIa | A |
| Objetivos de glucemia | ||
| Para la mayoría de los pacientes adultos con DM2 o DM2, se recomienda un objetivo de HbA1c < 0,7% (53mmol/mol) para la reducción del riesgo de ECV y complicaciones microvasculares587,588 | I | A |
| Para pacientes con DM de larga duración o adultos frágiles, se debe considerar objetivos de HbA1c más laxos (menos estrictos)588 | IIa | B |
| Para los diabéticos que no estén frágiles y no tengan EA, se debe considerar un objetivo de HbA1c ≤ 6,5% (48mmol/mol) en el momento del diagnóstico o en el curso de la DM2587,588 | IIa | B |
| Tratamiento de la hiperglucemia y la EA o los riesgos cardiorrenales | ||
| Para la mayoría de los pacientes sin antecedentes de EA, ERC o IC, se recomienda la metformina como tratamiento de primera línea tras evaluar la función renal589 | I | B |
| Para los pacientes con DM2 y EA, se debe considerar la metformina, a no ser que haya contraindicaciones5,590–592 | IIa | B |
| Se debe considerar evitar las hipoglucemias y la ganancia de peso excesiva559,588,593 | IIa | B |
| Para los pacientes con DM2 y EA, se recomienda el tratamiento con un aGLP-1 o un iSGLT2 con resultados probados para reducir el riesgo cardiovascular o los eventos cardiorrenales590–592 | I | A |
| Para los pacientes con DM2 y daño de órgano dianac, se puede considerar el tratamiento con un iSGLT2 o un aGLP-1 con beneficios probados para la reducción de la mortalidad cardiovascular y total futuras594–597 | IIb | B |
| Para los pacientes con DM2 y ERC, se recomienda el tratamiento con un iSGLT2 para mejorar la EA y los eventos cardiorrenales598,599 | I | A |
| Para los pacientes con DM2 e IC-FEr, se recomienda el tratamiento con un iSGLT2 con demostrado beneficio en resultados para disminuir las hospitalizaciones por IC y las muertes cardiovasculares600,601 | I | A |
| Para los pacientes con DM2 sin EA, IC o ERC, se debe considerar el tratamiento con un iSGLT2 o un aGLP-1 según los riesgos estimados (p. ej., con la puntuación de riesgo ADVANCE o el modelo DIAL) de eventos cardiovasculares adversos o eventos cardiorrenales por los perfiles de riesgo602 | IIa | B |
ADVANCE: Action in Diabetes and Vascular disease: preterAx and diamicroN-MR Controlled Evaluation; AF: actividad física; aGLP-1: agonistas del péptido similar al glucagón tipo 1; DIAL: DIAbetes Lifetime-perspective prediction; DM: diabetes mellitus; EA: enfermedad ateroesclerótica; ERC: enfermedad renal crónica; HbA1c: glucohemoglobina; IC: insuficiencia cardiaca;IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; iSGLT2: inhibidores del cotransportador 2 de sodio y glucosa; TFGe: tasa de filtrado glomerular estimada.
a Clase de recomendación.
b Nivel de evidencia.
c Véase la tabla 4.
Salvo por el control de la glucosa, la prevención de la EA sigue los mismos principios que para las personas sin DM2. La consecución de objetivos de PA y cLDL es especialmente importante. La evidencia de los ensayos más recientes demuestra que los fármacos de las clases del SGLT2 y los aGLP-1 disminuyen los riesgos de EA, IC y renales independientemente de los valores basales de HbA1c y de que los pacientes estén en tratamiento con metformina. Estos beneficios son más evidentes en pacientes con EA, IC o ERC preexistentes, pero no parece que se extiendan a los grupos con riesgo alto. Estos datos han dado lugar a nuevos algoritmos de tratamiento.
4.8.1.1Intervenciones en el estilo de vidaEl abordaje del estilo de vida es una prioridad para la prevención de la EA y el tratamiento de la DM. La mayoría de las personas con DM son obesas, por lo que el control del peso es crucial. Es posible adoptar diversos patrones dietéticos en los que el predominio de frutas, verduras, cereales integrales y fuentes proteicas poco grasas son más importantes que las proporciones de energía que aporta cada nutriente. Se debe restringir el consumo de sal. Las recomendaciones específicas son limitar las grasas saturadas y trans y el consumo de alcohol, moderar el consumo de carbohidratos y aumentar el consumo de fibra dietética. Una dieta de estilo mediterráneo, en la que las fuentes de grasas se derivan principalmente de aceites monoinsaturados, protege contra la EA. Hay más información en la sección 4.3.2.
La combinación de ejercicio aeróbico y de fuerza es efectiva para prevenir la progresión de la DM2 y para el control glucémico. Los fumadores deben recibir apoyo para la deshabituación tabáquica (véase la sección 4.5). Las intervenciones en el estilo de vida reducen los futuros riesgo microvasculares y macrovasculares y la mortalidad a largo plazo603. Los cambios intensivos en el estilo de vida con dietas hipocalóricas y pérdidas de peso medias de 10kg conllevan la remisión de la DM2 en el 46% de los casos al año y el 36% a los 2 años585. En pacientes con prediabetes hay que evaluar otros factores de riesgo de EA antes (para incentivar mejoras) y después de los cambios en el estilo de vida604.
4.8.1.2Control glucémicoEl UKPDS587 estableció la importancia del tratamiento hipoglucemiante intensivo para reducir el riesgo de ECV de los pacientes con DM de reciente diagnóstico con mejor evidencia en respaldo de la metformina, que sigue siendo el fármaco de primera elección para la mayoría de los pacientes diagnosticados de DM. Se llevaron a cabo 3 ensayos para analizar si se podía reducir los eventos cardiovasculares con un tratamiento de la glucemia más intensivo559,588,596. Sin embargo, se observaron aumentos inesperados de las muertes totales y por EA en el ensayo ACCORD559 y se observó una tendencia similar en el VADT593. Los resultados suscitaron preocupaciones sobre el control intensivo de la glucosa, especialmente en pacientes diabéticos de edad avanzada o con EA preexistente. Los metanálisis posteriores de ensayos relevantes mostraron reducciones de los IAM no mortales y los eventos coronarios, pero sin efectos en los ictus o la mortalidad total605,606. Los metanálisis indican que los beneficios en ECV con una reducción media de la HbA1c del 0,9% a los 5 años fueron menores que con el tratamiento del colesterol y de la PA. Se debe personalizar los objetivos de HbA1c para ajustarlos a las características y las preferencias individuales.
Cuatro ensayos con inhibidores de la dipeptidil peptidasa-4607–610 en pacientes con DM y EA preexistente o en alto de riesgo demostraron no inferioridad (es decir, seguridad), pero no demostraron superioridad en cuanto al riesgo de ECV. Sin embargo, hubo un aumento en la tasa de hospitalizaciones por IC con la saxagliptina en el ensayo AVOR-TIMI 53608.
4.8.1.3Nuevas clases de fármacos para la diabetes mellitus: beneficios cardiovascularesEnsayos recientes con 2 tipos de fármacos (iSGLT2 y aGLP-1) han demostrado beneficios cardiovasculares independientemente del control de la glucemia y, en los estudios que lo analizaron, el tratamiento basal con metformina596,597,611. Hace poco se ha hecho un metanálisis sistemático de los resultados (figuras 1-4 del material adicional)590,591.
Tres ensayos han demostrado los beneficios CV de los iSGLT2 empagliflozina, canagliflozina y dapagliflozina611–613. Los eventos adversos cardiovasculares mayores (MACE) se redujeron ligeramente, un 14%, con efectos dudosos en los ictus y sin efectos en los infartos de miocardio590. Sin embargo, se observaron reducciones del 24% en la incidencia de hospitalización por IC/muerte por ECV y del 44% en los objetivos renales590. Los beneficios en los MACE fueron evidentes solo en los pacientes con EA al inicio del estudio, pero los beneficios renales y en la IC alcanzaban a los pacientes con DM2 con múltiples factores de riesgo. Sin embargo, en un ensayo más reciente con pacientes con DM2 y EA, se observó que la ertugliflozina era no inferior al placebo en cuanto a los desenlaces de los MACE614. Por lo tanto, no está claro si estos resultados representan un efecto de clase. Otros 4 ensayos con iSGLT2 han demostrado los beneficios de la canagliflozina598 y la dapaglifozina599 en pacientes con ERC (y en el ensayo DAPA-CKD se observaron beneficios similares en personas sin DM) y de la dapagliflozina600 y la empagliflozina601 en pacientes con IC-FEr, y ambos ensayos mostraron beneficios similares a los reportados en pacientes sin DM2.
El patrón específico de los resultados de los ensayos (como la separación temprana de las curvas por hospitalización por IC) indica que los beneficios de los iSGLT2 pueden estar más relacionados con los efectos hemodinámicos cardiorrenales que con la ateroesclerosis600. Aparte de infecciones genitourinarias, las tasas de acontecimientos adversos (incluida la cetoacidosis diabética) fueron bajas por lo general. En un ensayo se observó un exceso de amputaciones y fraturas612, pero no hubo desequilibrios en los demás ensayos. Se debe aconsejar a los pacientes sobre la importancia de la higiene genitourinaria antes de prescribirles estos medicamentos.
Los aGLP-1 reducen los MACE, la mortalidad cardiovascular y la mortalidad por cualquier causa aproximadamente un 12%, con una reducción del 9% de los infartos de miocardio y el 16% de los ictus591. Más aún, la IC disminuyó un 9% y el objetivo renal compuesto, un 17%. No es posible explicar los resultados por la reducción de la glucemia, y en diversos ensayos con iSGLT2 y aGLP-1, los análisis de subgrupos han indicado que estos beneficios podrían ser independientes del tratamiento con metformina594–597. La mayoría de los ensayos se llevaron a cabo con pacientes con EA prexistente o, en el ensayo REWIND (Researching Cardiovascular Events With a Weekly Incretin in Diabetes), con una proporción significativa de pacientes con riesgo de ECV alto615. Los efectos secundarios de esta clase de fármacos son principalmente náuseas y vómitos, que se pueden reducir con dosificación progresiva. El riesgo de hipoglucemia se puede reducir disminuyendo las dosis de sulfonilureas o insulina.
Los resultados mayormente positivos de estas 2 clases de fármacos (iSGLT2 y aGLP-1) se han traducido en cambios rápidos en los algoritmos de DM, pero con algunas diferencias en la interpretación602. La mayoría de las guías sobre DM, también el informe de consenso de la American Diabetes Association (ADA)/European Association for the Study of Diabetes (EASD) de 2020592, recomiendan la metformina como tratamiento de primera línea, mientras que las GPC de la ESC5 de 2018 recomiendan el tratamiento con iSGLT2 y aGLP-1 sin metformina para pacientes con DM y ECV o con muy alto riesgo de ECV, como se revisó602. Se convocó a un grupo de los equipos de redacción de la ADA/EASD y de las GPC de la ESC616 como panel de expertos. El panel de expertos subrayó las similitudes generales del enfoque y la necesidad de asegurar que los pacientes con DM2, ECV, IC o ERC reciban el tratamiento apropiado con un iSGLT2 o un aGLP-1. El panel concluyó que este tratamiento se debe iniciar independientemente del tratamiento de fondo, el control de la glucemia o los objetivos terapéuticos individuales616. La opinión de la ESC es que la metformina se debe considerar, pero no es un tratamiento de primera línea obligatorio para los pacientes con EA o evidencia de daño de órgano diana. Es cierto que el inicio del tratamiento con metformina para estos pacientes no debe excluir o retrasar el inicio del tratamiento basado en la evidencia con iSGLT2 o aGLP-1. Un análisis de puntuación de riesgo y rentabilidad sería útil para determinar qué pacientes sin EA o evidencia de DOD son candidatos a estos nuevos tratamientos. En los datos mencionados, no hay evidencia de interacción alguna en los beneficios por sexo. Por último, los pacientes con DM2 deben involucrarse en la toma de decisiones tras habérseles explicardo los potenciales beneficios y efectos secundarios de los medicamentos.
4.8.2Diabetes mellitus tipo 1En el ensayo DCCT (Diabetes Control and Complications Trial) se estableció la importancia del control estricto de la glucemia para disminuir los riesgos de enfermedad microvascular y macrovascular tanto en varones como en mujeres con DM1617. Un seguimiento de 27 años en este ensayo demostró que 6,5 años de tratamiento intensivo de la DM se asocian con una pequeña reducción de la tasas de mortalidad por cualquier causa617. Un objetivo glucémico de HbA1c en un 6,5-7,5% (48-58mmol/mol) parece ser un enfoque equilibrado para el tratamiento a largo plazo.
Más recientemente, no se ha demostrado que la metformina disminuya la progresión del GIM carotídeo de los pacientes con DM1 considerados en alto riesgo de ECV618. Mo se recomienda prescribirla a pacientes con DM1 con esa indicación. Los iSGLT2 mejoran el control metabólico en la DM1 y puede complementar el tratamiento con insulina de ciertos pacientes.
4.9Tratamiento antitrombóticoRecomendaciones sobre tratamiento antitrombótico
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para la prevención secundaria de la ECV, se recomienda AAS 75-100 mg/día619 | I | A |
| Para la prevención secundaria en caso de intolerancia al AAS, se recomienda clopidogrel 75 g/día como alternativa620 | I | B |
| Se puede considerar el clopidogrel 75 g/día con preferencia sobre el AAS para pacientes con EA establecida620,621 | IIb | A |
| Para los pacientes en tratamiento antiagregante plaquetario con alto riesgo de hemorragia gastrointestinal, se recomienda el tratamiento concomitante con un inhibidor de la bomba de protones622,623 | I | A |
| Para los pacientes diabéticos con alto o muy alto riesgo, se puede recomendar una dosis baja de AAS para prevención primaria en ausencia de contraindicaciones5,624,625 | IIb | A |
| Para los pacientes con riesgo cardiovascular bajo-moderado, no se recomienda el tratamiento antiagregante plaquetario debido al aumento del riesgo de hemorragia grave624,626–630 | III | A |
AAS: ácido acetilsalicílico; DM: diabetes mellitus; EA: enfermedad ateroesclerótica.
a Clase de evidencia.
b Nivel de evidencia.
En un metanálisis de 2009 sobre pacientes con bajo riesgo de ECV, se informó de una reducción del 12% en la EA con ácido acetilsalicílico y un aumento de las hemorragias graves619. La reducción del riesgo de ECV y el riesgo hemorrágico eran similares en varones y mujeres631. En ensayos de prevención primaria más recientes se informó de beneficio discreto o nulo en pacientes sin EA y un constante aumento de las hemorragias624,626,627. Un metanálisis actualizado no reveló una reducción de la mortalidad cardiovascular o por cualquier causa con ácido acetilsalicílico, aunque sí se observó una disminución del riesgo de infarto de miocardio no mortal (RR=0,82) y de ictus isquémico (RR=0,87)628, Por el contrario, el ácido acetilsalicílico se asoció con un aumento del riesgo de hemorragia grave (RR=1,50), hemorragia intracraneal (RR=1,32) y hemorragia gastrointestinal grave (RR=1,52), sin diferencias en el riesgo de hemorragia mortal (RR=1,09). El riesgo hemorrágico aumentó especialmente en los ancianos. Se encontraron resultados similares en otros metanálisis recientes629,630, En general, aunque el ácido acetilsalicílico no debe prescribirse sistemáticamente a pacientes sin EA establecida, no se puede negar que los beneficios superan a los riesgos en algunos pacientes con riesgo de ECV alto o muy alto632,633. En pacientes diabéticos sin EA evidente, el ensayo ASCEND informó de una reducción del riesgo del 12% y un aumento considerable del riesgo hemorrágico, pero no de hemorragia intracraneal o mortal624. Un metanálisis sobre el ácido acetilsalicílico para la prevención primaria en la DM mostró que el número de pacientes que es necesario tratar (NNT) para prevenir un evento isquémico adverso grave en 5 años es 95635. Por lo tanto, como para los pacientes sin DM, el ácido acetilsalicílico se puede considerar si el riesgo de ECV es excepcionalmente alto. Solo 1 de cada 4 pacientes del ensayo ASCEND recibía tratamiento con un inhibidor de la bomba de protones. Generalizar la prescripción de estos fármacos podría potenciar los beneficios del ácido acetilsalicílico en prevención primaria para pacientes con riesgo ateroesclerótico alto.
Se necesitan más estudios con menores de 70 años aparentemente sanos con riesgo (muy) alto de ECV. Hasta entonces, las decisiones para estos pacientes con alto riesgo se deben tomar caso por caso y considerando los riesgos isquémico y hemorrágico.
4.9.2Tratamiento antitrombótico para pacientes con enfermedad ateroesclerótica establecidaEn la enfermedad ateroesclerótica establecida, el ácido acetilsalicílico se asocia con reducciones significativas de los eventos vasculares, como ictus y eventos coronarios, y una reducción del 10% de la mortalidad total619. Estos beneficios superan el peligro de hemorragia.
En pacientes con infarto de miocardio previo, ictus o EAEI, el clopidogrel mostró superioridad frente al ácido acetilsalicílico contra los eventos isquémicos, con similar perfil de seguridad620 Los análisis de subgrupos indicaron mayor beneficio del clopidogrel en pacientes con EAEI. Un metanálisis mostró una leve reducción clínica del riesgo con un inhibidor del P2Y12 en monoterapia (NNT=244), sin efectos en la mortalidad por cualquier causa, la mortalidad vascular y las hemorragias graves621. En la sección 6 hay más recomendaciones sobre el tratamiento antitrombótico específicamente para la EC, la enfermedad cerebrovascular y la EAEI, con posibles indicaciones de doble inhibición para los pacientes con EAEI.
4.9.3Inhibidores de la bomba de protonesLos inhibidores de la bomba de protones reducen el riesgo de hemorragia gastrointestinal en pacientes con tratamiento antiagregante plaquetario y pueden ser un tratamiento adyuvante útil para mejorar la seguridad634,635. Los inhibidores de la bomba de protones que específicamente inhiben el CYP2C19 (omeprazol o esomeprazol) pueden reducir la respuesta farmacodinámica del clopidogrel. Aunque no se ha demostrado que esta interacción afecte al riesgo de eventos isquémicos, no se recomienda la prescripción de omeprazol o esomeprazol concomitante con clopidogrel622.
4.10Tratamiento antiinflamatorioRecomendaciones sobre el tratamiento antiinflamatorio
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se puede considerar las dosis de colchicina bajas (0,5mg 1 vez al día) en prevención secundaria cardiovascular, especialmente si otros factores de riesgo no están controlados o si se presentan eventos de ECV a pesar del tratamiento óptimo | IIb | A |
ECV: enfermedad cardiovascular.
a Clase de recomendación.
b Nivel de evidencia.
Haber reconocido los componentes inflamatorios del proceso ateroesclerótico ha llevado a investigar varios tratamientos antiinflamatorios en los últimos años. El primer estudio que analizó los resultados en reducción de la inflamación sin efectos en la concentración lipídica ha sido el CANTOS, cuyos resultados preliminares con el anticuerpo monoclonal canakinumab lo muestran eficaz como tratamiento antiinflamatorio para pacientes con alto riesgo636. Sin embargo, este fármaco no se desarrolló con esta indicación debido al riesgo de infección mortal y su elevado coste. El metotrexato es el segundo fármaco antiinflamatorio estudiado con este propósito, pero no se mostró efectivo en la reducción de desenlaces cardiovasculares637.
En 2019 el ensayo COLCOT (Colchicine Cardiovascular Outcomes Trial) informó de una reducción significativa (HR = 0,77) de los eventos cardiovasculares con dosis bajas de colchicina (0,5mg 1 vez al día) en pacientes con IAM reciente. El más reciente ensayo LoDoCo2 (segunda dosis baja de colchicina) reforzó estos resultados en pacientes con EC crónica (HR = 0,69)85. En este estudio se observó tendencia al aumento de la mortalidad no cardiovascular, lo que requiere más estudio.
El tratamiento con colchicina en la práctica diaria necesita establecerse con más ensayos clínicos y experiencias en la práctica clínica. Sin embargo, los resultados alentadores justifican considerar las dosis bajas de colchicina para ciertos pacientes en alto riesgo.
4.11Rehabilitación cardiaca y programas de prevenciónRecomendaciones sobre rehabilitación cardiaca
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para los pacientes que han sufrido eventos de EA y revascularización o con IC (principalmente IC-FEr), se recomienda la participación en una rehabilitación cardiaca basada en el ejercicio estructurada, integral y multidisciplinaria para mejorar los resultados638–642 | I | A |
| Se debe considerar métodos para aumentar la RC y la derivación preventiva (p. ej., recordatorios electrónicos o derivaciones automáticas, derivaciones e interconsultas, seguimiento estructurado por profesionales de enfermería o sanitarios e inicio temprano del programa tras el alta)643–646 | IIa | B |
| Para aumentar la participación y la adherencia a conductas saludables a largo plazo, se puede considerar la RC, la telemedicina y los dispositivos sanitarios móviles647,648 | IIb | B |
EA: enfermedad ateroesclerótica; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; RC: rehabilitación cardiaca.
a Clase de recomendación.
b Nivel de evidencia.
La RC es una intervención integral y multidisciplinaria que no solo incluye entrenamiento con ejercicio y asesoramiento para la AF, sino también instrucción, modificación de los factores de riesgo, asesoramiento nutricional/dietético y apoyo vocacional y psicosocial358. Los programas de prevención y rehabilitación tras eventos de EA o revascularización disminuyen las hospitalizaciones, los infartos de miocardio, la mortalidad cardiovascular y, en algunos programas, la mortalidad por cuaquier causa638,640–642. También pueden reducir los síntomas de depresión/ansiedad649. En pacientes con IC crónica (principalmente IC-FEr), la RC basada en el ejercicio puede mejorar la mortalidad por cualquier causa, reducir el número de ingresos hospitalarios y mejorar la capacidad para el ejercicio y la calidad de vida639,650. La RC, por norma general, es rentable651.
Los ensayos clínicos y los registros son muy heterogéneos, lo que influye las recomendaciones nacionales, la legislación y el reembolso/compensación652,653. Los resultados de revisiones recientes aportan a los clínicos los requisitos mínimos para una RC exitosa tras SCA o cirugía de revascularización coronaria:
- •
La RC es una intervención integral y multidisciplinaria466,649,654,655.
- •
La RC deben supervisarla y llevarla a cabo profesionales de la salud formados adecuadamente, entre ellos cardiólogos649.
- •
La RC debe iniciarse tan pronto como sea posible tras el evento cardiovascular649.
- •
La RC basada en el ejercicio incluye ejercicios aeróbicos y de fuerza muscular que deben prescribirse caso por caso según el cribado antes del ejercicio y las pruebas de ejercicio656.
- •
La dosis de RC basada en el ejercicio (número de semanas de entrenamiento del ejercicio×número medio de sesiones semanales×duración media de la sesión en minutos) debe ser > 1.000638.
- •
El número de sesiones de RC basada en el ejercicio debe ser > 36641.
- •
Durante la RC deben abordarse y tratarse todos los factores de riesgo cardiovascular conocidos642.
Recientemente, la European Association of Preventive Cardiology (EAPC) propuso unos estándares mínimos y óptimos para la mejora de la prevención secundaria con programas de RC en Europa657.
Aunque la prescripción de ejercicio de entrenamiento debe adoptar el modelo FITT (frecuencia, intensidad, tiempo y tipo), entre los profesionales de la medicina hay desacuerdos y variaciones sobre el modelo. Para optimizar los ejercicios de entrenamiento, la EAPC ha introducido un instrumento digital e interactivo para la toma de decisiones: EXPERT (EXpert Prescription in Everyday practice and Rehabilitation Training) (https://www.escardio.org/Education/Practice-Tools/CVD-prevention-toolbox/expert-tool)659. Ningún componente del ejercicio es por sí solo predictor de mortalidad, solo la adherencia total a la intervención mejora los desenlaces660.
A pesar de los beneficios comprobados, las tasas de derivación, participación e implementación son bajas653,660,661. La utilización suele ser menor en mujeres, pero la participación y la adherencia se ven afectadas por un conjunto de factores intrapersonales, interpersonales, clínicos, logísticos y relacionados con los sistemas de salud y los propios programas de RC662. Hay más inscripción en la RC con la intervención presencial de personal de enfermería o sanitario de confianza, mientras que la adherencia suele ser mayor cuando se implementan intervenciones a distancia (es decir, en el hogar)643. La coordinación de estos programas por personal de enfermería aumenta la efectividad644–646. La RC en el hogar con o sin supervisión telemática puede aumentar la participación y parece ser igualmente efectiva que la RC desarrollada en centros647. Las intervenciones de telemedicina son más efectivas que no llevar a cabo ninguna intervención648, pero también pueden complementar la RC convencional. Además, el uso en sanidad de dispositivos móviles como los smartphones puede ser tan efectivo como la RC en centros y muestra mejoras significativas de la calidad de vida relacionada con la salud663. Estas nuevas intervenciones pueden apoyar al paciente en mantener conductas saludables a largo plazo tras los programas de RC especializados664.
5POLÍTICAS DE INTERVENCIÓN POBLACIONALRecomendaciones sobre políticas de intervención poblacional
| Recomendaciones | Clasea | Nivelb,c |
|---|---|---|
| La política y las estrategias sobre AF, dieta, tabaquismo y consumo de tabaco y alcohol en las restricciones y obligatoriedades del Gobierno, los medios y la educación, el etiquetado y la información, los incentivos económicos y los contextos educativos, laborales y comunitarios tienen diferentes niveles de recomendación (véase las tablas de la sección 5 del material adicional) | ||
| Se recomienda implementar medidas para reducir la contaminación atmosférica, la emisión de partículas y contaminantes gaseosos y el consumo de combustibles fósiles y limitar las emisiones de dióxido de carbono para reducir la mortalidad y la morbilidad por ECV | I | C |
AF: actividad física; ECV: enfermedad cardiovascular.
a Clase de recomendación.
b Nivel de evidencia.
c El nivel de evidencia no se aplica adecuadamente a las políticas de intervención y las evidencias empíricas varían enormemente entre los distintos enfoques propuestos.
Las estrategias dirigidas a la prevención de las ECV se centran en medidas preventivas que requieren grandes intervenciones en salud pública enfocadas en los estilos de vida y promover la vigilancia de las ECV. Estas medidas están diseñadas para dirigir poblaciones con el objeto de modificar el riesgo atribuible a la población. Se basa en la paradoja de la prevención descrita por Geoffrey Rose en 1981665. El riesgo atribuible a la población depende de los RR y de la prevalencia del factor de riesgo entre la población general. Si la prevalencia de un factor de RR significativo es baja, el riesgo atribuible a la población puede ser bajo. Por el contrario, si la prevalencia de un factor de RR de bajo impacto es común, el riesgo atribuible a la población puede ser alto. El enfoque preventivo basado en el paradigma de Geoffrey Rose665,666 afirma que cambios pequeños en el riesgo de enfermedad de toda la población conllevan de manera constante mayores reducciones en la carga de enfermedad que solo un gran cambio en solo una persona con alto riesgo667,668. Es decir, la exposición de muchas personas a un riesgo pequeño puede generar más enfermedad que unas pocas personas expuestas a un riesgo importante. Esta gran estrategia poblacional (en oposición a las estrategias que se centran en las personas en alto riesgo) tiene grandes ventajas poblacionales al mismo tiempo que solo tiene un ligero beneficio individual, ya que se centra en la salud cardiovascular de un gran número de personas a lo largo de toda su vida. Cabe señalar que el riesgo alto y la prevención a escala poblacional no son mutuamente excluyentes, por lo cual deben coexistir.
La prevalencia de enfermedades de alto riesgo y tasas de invidencia de ECV varían en cada país. Se conocen muchas de las causas subyacentes y están estrechamente relacionadas con los hábitos alimentarios, la PA, el tabaquismo, el consumo de alcohol, la empleabilidad, la privación social y el entorno. El objetivo de las estrategias poblacionales para la prevención de ECV es el control de los determinantes subyacentes de la salud cardiovascular para, de esta forma, reducir las tasas de incidencia en la población. La estrategia poblacional puede reportar diversos beneficios, como reducir las desigualdades sanitarias, prevenir otras enfermedades como el cáncer, las enfermedades pulmonares y la DM2 y ahorrar gastos al evitar eventos cardiovasculares y la jubilación anticipada debido a problemas de salud.
El comportamiento individual se sitúa en un entorno con niveles jerárquicos que engloba las decisiones individuales, las influencias familiares, culturales, étnicas, laborales y de salud, además de las políticas regionales, estatales y mundiales (como las políticas de la UE y los acuerdos de comercio internacionales). El objetivo de esta sección de la GPC es aportar recomendaciones basadas en la evidencia sobre las intervenciones más efectivas para reducir el riesgo poblacional de ECV promoviendo decisiones saludables a escala comunitario, regional y mundial. Los sistemas de salud no pueden solventar los problemas de salud por sí solos y requieren apoyos políticos. Para apoyar esta causa, la OMS organiza desde 1990 las Conferencias Mundiales sobre la Promoción de la Salud.
5.2Intervenciones poblacionales en factores de riesgo específicosLas intervenciones poblacionales buscan alterar el entorno social, modificar ciertos determinantes sociales de la salud y proporcionar incentivos para fomentar cambios en el comportamiento individual y la exposición a los factores de riesgo. Los determinantes sociales de la salud incluyen el estatus socioeconómico (educación, ocupación e ingresos), las desigualdades en la distribución de la riqueza, los diseños comunitarios y urbanos y las redes sociales, por nombrar algunos. Los profesionales de la salud tienen un papel muy importante en la promoción de intervenciones poblacionales basadas en la evidencia. Al modificar el contexto general, se pueden inducir decisiones saludables por defecto en toda una población (en todos los grupos etarios y, en especial, los vulnerables). El cometido de las autoridades nacionales y locales es crear entornos sociales en los que se ofrezcan opciones saludables por defecto, teniendo en consideración la alfabetización en salud669,670. La evidencia que se presenta en el presente documento se basa en revisiones exhaustivas y estudios individuales, y hace notar que raramente es posible utilizar un ECA para evaluar intervenciones poblacionales (en contraste con las intervenciones individuales)671,672. La importancia de las cardiopatías en mujeres ya es evidente y las diferencias de sexo en la prevención cardiovascular han llevado a campañas de concienciación dirigidas a reducir las disparidades de sexo en la investigación y la práctica clínica. Al interpretar esta sección, es importante reconocer que muchas veces hay intereses especiales que puede influir las decisiones sobre las políticas de promoción de la salud.
El material adicional de esta sección presenta evidencia sobre estrategias poblacionales centradas en intervenciones sobre factores de riesgo específicos, como la PA (sección 5.2.1), la dieta (sección 5.2.2), el tabaquismo y el consumo de tabaco (sección de 5.2.3) y el consumo de alcohol (sección 5.2.4). Los cambios en el estilo de vida a escala poblacional llevan tiempo, pueden ser caros y deben perdurar. Más aún, los beneficios pueden tardar en manifestarse. Sin embargo, persisten a largo plazo y mejoran la calidad de vida relacionada con la salud y el bienestar.
5.2.1Actividad físicaVéase la sección 3.1 del material adicional.
5.2.2DietaVéase la sección 3.2 del material adicional.
5.2.3Tabaquismo y consumo de tabacoVéase la sección 3.3 del material adicional.
5.2.4AlcoholVéase la sección 3.4 del material adicional.
5.3Medio ambiente, contaminación atmosférica y cambio climáticoLa contaminación atmosférica contribuye a la mortalidad y la morbilidad. En concreto, aumenta el riesgo de enfermedades respiratorias y cardiovasculares, especialmente EC, IC, arritmias y parada cardiaca, enfermedad cerebrovascular y tromboembolia venosa158,673,674. Se ha estimado que la pérdida de expectativa de vida debido a la contaminación medioambiental en 2,9 años, con un exceso total de mortalidad mundial estimada de 8,8 millones/año159. Entre los posibles mecanismos por los que la contaminación medioambiental se relaciona con la ECV, se encuentran que favorece la ateroesclerosis, la inflamación, la trombosis, las alteraciones del sistema vascular, la fibrosis miocárdica, los cambios epigenéticos y las interacciones con factores de riesgo clásicos158.
Los emisores más importantes de partículas finas son el tráfico rodado, las centrales eléctricas y la combustión industrial y residencial de petróleo, carbón y madera. Entre los principales componentes de la contaminación atmosférica exterior, están las partículas aéreas (con tamaños que van desde las partículas gruesas de diámetro de 2,5-1,0 μm hasta las partículas finas < 2,5 μm y las ultrafinas < 0,1μm) y los contaminantes gaseosos como el ozono, el dióxido de nitrógeno, los compuestos volátiles orgánicos, el monóxido de carbono y el dióxido de sulfuro, producidos principalmente por la quema de combustibles fósiles158,675. Hasta un tercio de los europeos que viven en zonas urbanas están expuestos a una calidad del aire que excede los estándares de calidad de la UE. La Comisión de la UE acordó un paquete de políticas que implementar antes de 2030 con medidas para reducir las emisiones nocivas del tráfico, las centrales de energía y la agricultura.
También se debe prestar atención a la contaminación atmosférica y el ruido en interiores. La contaminación en el hogar, como la que se produce al utilizar biomasa, representa más de 3 millones de muertes en el mundo38. La OMS ha estimado que el 30% de la población europea está expuesta a niveles de ruido nocturno que exceden los 55 dB161. Estos niveles se han asociado con hipertensión, arterioesclerosis, EC, mortalidad cardiovascular e ictus. Sin embargo, cabe destacar que hasta el momento los esfuerzos para reducir la exposición al ruido no han demostrado beneficios en salud161.
También se ha establecido la influencia del suelo y el agua en la ECV157. Se requieren más estudios para reducir esta contaminación, así como regulaciones industriales y controles de agua potable157.
Las organizaciones de pacientes y los profesionales de la salud son muy importantes en la educación y las iniciativas políticas. Se necesita información sobre los comportamientos de los pacientes durante los picos de bruma industrial (smog). Los incentivos económicos, como reducir los impuestos sobre los coches eléctricos e híbridos y fomentar el uso del transporte público, pueden ayudar a mejorar la calidad del aire. Se debe dar prioridad a los diseños urbanos que promuevan la construcción de nuevas casas y escuelas en áreas lejanas a autopistas y factorías contaminantes.
También se debe fomentar la legislación sobre «aire limpio» centrada en promover la reducción de la emisión de partículas y el uso del transporte público. La necesidad urgente de aceptar lo que pueden parecer «sacrificios de la comodidad» por beneficios distantes en la salud y los altos costes de transición durante la reorganización de industrias al completo probablemente sean un dilema para la estrategia poblacional. Un ejemplo de esta legislación es Un Pacto Verde Europeo, por el que la UE tiene como objetivo ser climáticamente neutra para 2050.
5.3.1Cambio climáticoEl cambio climático como resultado del aumento del consumo de combustibles fósiles y como fuente importante de contaminación atmosférica y gases «invernadero» se está convirtiendo en un problema grave de salud pública y de preocupaciones medioambientales. Las medidas sociales para reducir el uso de estos combustibles con una transición hacia energías renovables es una de las prioridades más urgentes en la reducción de la contaminación atmosférica y el cambio climático676. Los políticos también tendrán que abordar el impacto de la dieta, especialmente de las cadenas de producción cárnica no sostenibles a largo plazo, así como el impacto de estilos de vida sedentarios en variables que alteran el clima.
5.4Implicaciones para las políticas y la promoción de la salud pública gubernamentales y no gubernamentalesVéase la sección 3.5. del material adicional.
6GESTIÓN DEL RIESGO DE ENFERMEDAD CARDIOVASCULAR ESPECÍFICO POR ENFERMEDADEsta sección trata de la prevención de las ECV en contextos clínicos específicos. Un número significativo de pacientes ya presentan comorbilidades que representan un riesgo adicional. Los principios generales de la modificación del estilo de vida y el tratamiento de los factores de riesgo más importantes se detallan en la sección 4. En esta sección solo se añaden aspectos relacionados con enfermedades concretas.
6.1Enfermedad coronariaEl tratamiento agudo específico de la EC ya se trata en detalle en una GPC reciente677–680.
En cuanto al tratamiento antitrombótico, el tratamiento antiagregante plaquetario doble (TAPD) durante 12 meses, preferiblemente con prasugrel o ticagrelor, es el estándar tras un SCA681–683. Los datos son contradictorios sobre si se prefiere el prasugrel al ticagrelor684,685. Una TAPD de 6 meses suele ser demasiado corto686, pero se puede considerar para ciertos pacientes con alto riesgo de hemorragias.
Para los pacientes con síndromes coronarios crónicos con ICP programada, la duración estándar del TAPD es de 6 meses, pero se puede reducir a 1-3 meses cuando el riesgo hemorrágico sea muy alto622. El clopidogrel es el inhibidor del P2Y12 de elección, pero el prasugrel y el ticagrelor también se pueden considerar tras intervenciones complejas622.
El TAPD prolongado (> 12 meses) tras ICP, SCA o síndromes coronarios crónicos es una opción para pacientes que toleren bien el tratamiento y tengan características de riesgo isquémico alto687,688. En pacientes con EC estable, la doble inhibición con una dosis baja de rivaroxabán (2,5mg 2 veces al día) y el AAS mejoraron los desenlaces cardiovasculares a cambio de más eventos hemorrágicos que con AAS solo83.
Según los datos presentados antes y siguiendo la GPC de síndromes coronarios crónicos622, se debe considerar la adición de un segundo antitrombótico (inhibidor del P2Y12 o una dosis baja de rivaroxabán) al AAS en prevención secundaria a largo plazo para pacientes con alto riesgo isquémico sin alto riesgo hemorrágico. Se pueden considerar para pacientes con riesgo isquémico moderado sin alto riesgo hemorrágico, pero los beneficios son menores622. Para más detalle sobre las opciones de tratamiento antitrombótico, consulte la GPC de la ESC sobre síndromes coronarios crónicos622.
Recomendaciones para pacientes con enfermedad coronaria
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para pacientes con infarto de miocardio o revascularización previos, se recomienda AAS 75-100mg/día619 | I | A |
| Para los pacientes sin antecedentes de infarto de miocardio o revascularización pero con evidencia clara de EC en pruebas de imagen, se puede considerar el AAS 75-100mg/día622 | IIb | C |
| Para los pacientes con SCA, se recomienda la adición de un inhibidor del P2Y12 al AAS durante 12 meses, a no ser que haya contraindicaciones como riesgo hemorrágico excesivo681–683 | I | A |
| Para los pacientes con síndromes coronarios crónicos tras endoprótesis coronaria, se recomienda la adición de clopidogrel 75 mg/día al AAS durante 6 meses independientemente del tipo de endoprótesis, a no ser que esté indicada una duración menor (1-3 meses) debido al riesgo de hemorragia mortal622 | I | A |
| Se debe considerar la adición de un antitrombótico (un inhibidor del P2Y12 o una dosis baja de rivaroxabán) al AAS en prevención secundaria a largo plazo para pacientes con riesgo alto de eventos isquémicos sin alto riesgo hemorrágico83,622,687–689 | IIa | A |
| Se puede recomendar la adición de un segundo antitrombótico al AAS en prevención secundaria a largo plazo para pacientes con riesgo moderado de eventos isquémicos sin riesgo hemorrágico83,622,687–689 | IIb | A |
| Se recomiendan los IECA (o ARA-II) si el paciente presenta otras enfermedades (como IC, hipertensión o DM)622 | I | A |
| Se recomiendan los bloqueadores beta para los pacientes con disfunción del VI o IC sistólica622 | I | A |
| Para los pacientes con EA establecida, se recomienda el tratamiento hipolipemiante oral con un objetivo fundamental de cLDL < 1,4 mmol(l (55mg/dl) y una reducción ≥ 50% de los valores basales de cLDL | I | A |
ARA-II: antagonistas del receptor de la angiotensina II; cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; EA: enfermedad ateroesclerótica; IECA: inhibidores de la enzima de conversión de la angiotensina; SCA: síndrome coronario agudo; TAPD: tratamiento antiagregante plaquetario doble; VI: ventrículo izquierdo.
a Clase de recomendación.
b Nivel de evidencia.
El tratamiento de las dislipemias y de la hipertensión en pacientes con EC se detalla en las secciones 4.6 y 4.7 respectivamente. Para los IECA (o ARA-II) y bloqueadores beta, consulte la Guía de la ESC de 2019 sobre el diagnóstico y el tratamiento de los síndromes coronarios crónicos622.
6.2Insuficiencia cardiacaEl tratamiento de la IC busca mejorar la mortalidad, las tasas de hospitalización y la calidad de vida690. Para conseguirlo, son fundamentales los programas de tratamiento multidisciplinarios y el seguimiento estructurado que incluyan la instrucción del paciente, la optimización del tratamiento médico, el empleo de la telemedicina, los cambios en el estilo de vida, el apoyo psicosocial y la mejora del acceso a los servicios de salud691–694.
En el tratamiento de los factores de riesgo de ECV, se aplican principios similares a pacientes con IC y sin ella. Sin embargo, en pacientes con IC, la baja concentración de colesterol695,696 y el bajo peso corporal se asocian con un aumento de la mortalidad697,698. No se recomienda iniciar el tratamiento hipolipemiante de pacientes con IC sin indicios contundentes para el tratamiento3. Mientras que la pérdida de peso involuntaria se asocia con un peor pronóstico cualquiera sea el IMC basal, los efectos de la pérdida de peso voluntaria no están claros.
Por el contrario, los ejercicios de entrenamiento habituales (especialmente la combinación de ejercicios aeróbicos y de fuerza) mejora el estado clínico de todos los pacientes con IC650,699,700 y mejora la carga de ECV y el pronóstico en la IC-FEr700,701.
Se recomienda cribar a todos los pacientes con IC por comorbilidades cardiovasculares y no cardiovasculares y, una vez identificadas, tratarlas690. Entre estas enfermedades se incluyen la EC, la hipertensión, las dislipemias, la DM, la obesidad, la caquexia y la sarcopenia, los trastornos tiroideos, la ERC, la anemia, la ferropenia y la apnea del sueño690.
Los antagonistas neurohormonales (IECA702–705, ARA-II706, inhibidores de la neprilisina y del receptor de la angiotensina [INRA]707–710, los bloqueadores beta711–717 y los antagonistas del receptor de mineralocorticoides [ARM]718,719) mejoran la supervivencia y reducen el riesgo de hospitalización por IC de los pacientes con IC-FEr sintomática690. Estos fármacos también reducen el riesgo de eventos cardiovasculares en pacientes con IC-FEr sintomática702–719. Además, la dosis de estos fármacos debe incrementarse progresivamente hasta la dosis máxima tolerada, que puede ser distinta para varones que para mujeres, sobre todo en caso de alta reciente tras hospitalización por IC690,720,721.
Los iSGLT2 (actualmente dapagliflozina y empagliflozina) en politerapia con un bloqueador neurohormonal reducen el riesgo de muerte cardiovascular y empeoramiento de la IC en pacientes con IC-FEr sintomática con o sin DM600,601, y se recomiendan para todo paciente con IC-FEr sintomática que ya esté en tratamiento con un IECA (o ARA-II), un bloqueador beta y un ARM.
Más recientemente, un estimulador del receptor de la guanilil ciclasa oral soluble (vericiguat) en politerapia con un bloqueador neurohormonal estándar en pacientes con IC-FEr sintomática y una hospitalización reciente por IC redujo el compuesto de muerte por cualquier causa y hospitalización por IC722.
Otros fármacos aportan moderados beneficios adicionales a ciertos pacientes con IC-FEr sintomática. Se debe considerar los diuréticos723,724, la ivabradina725,726 y la hidralazina727,725, y se puede considerar la digoxina como tratamiento complementario para ciertos pacientes con IC-FEr sintomática. Algunos de estos tratamientos reducen la morbilidad y la mortalidad cardiovascular (p. ej., la ivabradina).
Además, el implante de un desfibrilador automático está indicado para ciertos pacientes con IC-FEr sintomática para reducir el riesgo de muerte súbita y mortalidad por cualquier causa, y el de resincronización cardiaca para reducir la morbilidad y la mortalidad (para más información, consulte la Guía de la ESC de 2021 sobre IC)690.
Recomendaciones sobre las intervenciones farmacológicas y no farmacológicas para pacientes sintomáticos (clase funcional de la New York Heart Association II-IV) con insuficiencia cardiaca y fracción de eyección reducida (< 40%) con beneficios demostrados en desenlaces clínicos como la morbilidad y la mortalidad cardiovasculares
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda se incluir a todo paciente con IC en un programa de RC integral para reducir el riesgo de hospitalización por IC y muertec00,691–694 | I | A |
| Para todo paciente con IC-FEr, se recomienda la RC basada en el ejercicio para reducir el riesgo de hospitalización por IC700,701 | I | A |
| Se recomienda cribar a los pacientes con IC por comorbilidades cardiovasculares y no cardiovasculares que, de hallarse, habría que tratar si existe un tratamiento seguro y efectivo, no solo para aliviar los síntomas, sino también para mejorar el pronósticoc | I | A |
| Para los pacientes con IC-FEr sintómatica, se recomienda añadir un IECA a un bloqueador beta o a un ARM para reducir el riesgo de hospitalización por IC y muerte702–705 | I | A |
| Para los pacientes con IC-FEr sintómatica, se recomienda añadir un bloqueador beta a un IECA (o un INRA) y un ARM para reducir el riesgo de hospitalización por IC y muerte711–717 | I | A |
| Para los pacientes con IC-FEr ya tratados con un IECA (o un INRA) y un bloqueador beta, se recomienda un ARM para reducir el riesgo de hospitalización por IC y muerte718,719 | I | A |
| Para los pacientes con IC-FEr, se recomienda el sacubitrilo-valsartán como sustituto del IECA para reducir el riesgo de hospitalización por IC y muerte707,730 | I | B |
| Para los pacientes con IC-FEr sintomáticos que no toleren un IECA o un INRA, se recomienda un ARA-II para reducir el riesgo de hospitalización por IC o muerte cardiovascular (también se debe prescribir un bloqueador beta y un ARM)706 | I | B |
| Para los pacientes con IC-FEr, se recomiendan dapagliflozina o empagliflozina, además del tratamiento óptimo con un IECA (o un INRA), un bloqueador beta y un ARM para reducir el riesgo de hospitalización por IC y muerte600,601,730 | I | A |
| Para los pacientes con IC-FEr sintomática que hayan sufrido un empeoramiento de la IC pese al tratamiento con un IECA (o un INRA), un bloqueador beta y un ARM, se puede considerar el vericiguat para reducir el riesgo de hospitalización por IC y muerte cardiovascular722 | IIb | B |
| Para los pacientes con IC-FEr y signos/síntomas de congestión, se recomiendan los diuréticos para reducir el riesgo de hospitalización por IC723,724 | I | C |
| Para los pacientes sintomáticos con FEVI ≤ 35% en ritmo sinusal y frecuencia cardiaca ≥ 70 lpm en tratamiento con dosis basadas en la evidencia de bloqueador beta (o dosis máxima tolerada por debajo de la evidencia), un IECA (o un INRA) o un ARM, se debe considerar la ivabradina para reducir el riesgo de hospitalización por IC o muerte cardiovascular725 | IIa | B |
| Para los pacientes asintomáticos con FEVI ≤ 35% en ritmo sinusal y frecuencia cardiaca ≥ 70 lpm que no toleren o tengan contraindicaciones para los bloqueadores beta, se debe considerar la ivabradina para reducir el riesgo de hospitalización por IC o muerte cardiovascular. También se debería tratarlos con un IECA (o ARNI) y un ARM726 | IIa | C |
| Para los pacientes autodefinidos como negros con FEVI ≤ 35% o < 45% con un VI dilatado y en NYHA III-V a pesar del tratamiento con un IECA (o INRA), un bloqueador beta y un ARM, se debe considerar la hidralazina y el dinitrato de isosorbida para reducir el riesgo de hospitalización por IC y muerte731 | IIa | B |
| Para los pacientes con IC-FEr sintomática que no toleren los IECA, ARA-II o INRA (o los tengan contraindicados), se puede considerar la hidralazina y el dinitrato de isosorbida para reducir el riesgo de muerte728 | IIb | B |
| Para los pacientes con IC-FEr sintomática en ritmo sinusal pese al tratamiento con un IECA (o INRA), un bloqueador beta o un ARM, se puede considerar la digoxina para reducir el riesgo de muerte729 | IIb | B |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonista del receptor de mineralocorticoides; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; IECA: enzima de conversión de la angiotensina; INRA: inhibidor de la neprilisina y del receptor de la angiotensina; NYHA: clase funcional de la New York Heart Association; RC: rehabilitación cardiaca.
a Clase de recomendación.
b Nivel de evidencia.
c Se aplica a todos los pacientes con IC independientemente de la FEVI.
Por recomendaciones sobre implante de desfibriladores automáticos, véase600.
Las intervenciones para las enfermedades cerebrovasculares dependen del tipo de evento (isquémico o hemorrágico)723,733. Los eventos isquémicos están causados principalmente por aterotrombosis, embolia cardiaca o microangiopatías734. Otros mecanismos (como disección arterial, foramen oval permeable, trombofilia o enfermedades hereditarias) son relativamente raros. La hemorragia intracerebral generalmente se origina por angiopatía hipertensiva o angiopatía amiloide cerebral735. La hemorragia puede originarse por un aumento de la PA, el tratamiento con anticoagulantes o trastornos de la coagulación733,735.
En pacientes con ictus isquémico o accidente isquémico transitorio (AIT), los antitrombóticos previenen más eventos vasculares. La isquemia cardioembólica, que se presenta principalmente en la FA, requiere anticoagulación (véase las secciones 3.4.3 y 6.6)736–742. Para mecanismos no cardioembólicos, se recomiendan los antiagregantes plaquetarios619,620,743–753.
El AAS es el antitrombótico más estudiado para el ictus isquémico no cardioembólico. Una dosis de AAS de 75-150 mg/día reduce el riesgo de ictus isquémico recurrente y eventos vasculares graves619–743. El clopidogrel muestra ligera superioridad frente al AAS620. En pacientes con ictus isquémico o AIT y estenosis carotídea homolateral, la adición de ticagrelor al AAS en comparación con AAS en monoterapia reduce el riesgo de ictus o muerte a 1 mes sin aumentar el riesgo de hemorragia grave754. La adición de AAS al clopidogrel se asoció con una reducción no significativa de eventos vasculares graves y un aumento del riesgo hemorrágico a largo plazo747,749. Sin embargo, en pacientes con ictus isquémico leve o AIT, el TAPD corto con AAS y clopidogrel es beneficioso750,751. Asimismo, el TAPD con ticagrelor y AAS frente a AAS en monoterapia reduce los ictus y las muertes a los 30 días tras un ictus isquémico de leve a moderado o un AIT no tratado con trombolisis o trombectomía. Sin embargo, el TAPD con ticagrelor y AAS no mejoró la incidencia de discapacidad y contribuyó a hemorragias graves755. El TAPD con dipiridamol y AAS también mostró superioridad sobre el AAS en monoterapia744. Sin embargo, en pacientes con ictus isquémico, el dipiridamol con AAS frente al clopidogrel solo mostró tasas similares de ictus recurrente, incluido el hemorrágico745, pero más eventos hemorrágicos graves. En pacientes con ictus isquémico no cardioembólico, los antagonistas de la vitamina K por vía oral no son superiores al AAS y conllevan más riesgo hemorrágico752,753. En ausencia de una clara causa de isquemia o sospecha de origen cardioembólico (p. ej., ictus embólico de causa indeterminada), ni el dabigatrán ni el rivaroxabán son mejores que el AAS756,757.
Las recomendaciones sobre el tratamiento de la PA y los lípidos son coherentes con las recomendaciones generales especificadas en las secciones 4.6 y 4.7. La reducción de la PA en pacientes con enfermedad cerebrovascular isquémica o hemorrágica y una PA de 140/90 o superior reduce el riesgo de ictus recurrente758,759. Los objetivos óptimos de PA para estos pacientes no están claros, como tampoco el tratamiento760. La mayor parte de la evidencia disponible versa sobre los IECA, los ARA-II y los diuréticos. Las comorbilidades pueden ayudar a orientar la elección del antihipertensivo. Para los pacientes con ictus lacunar reciente, el objetivo de PAS es < 130 mmHg761.
Para los pacientes con ictus (isquémico o hemorrágico) o AIT y cLDL en 100-190mg/dl, la atorvastatina 80 mg/día redujo la incidencia general de ictus y eventos cardiovasculares762. Los últimos ensayos respaldan un objetivo de cLDL < 1,8mmol/l (70mg/dl)508.
La evidencia de lesiones cerebrovasculares (como hiperintensidades de la sustancia blanca, lagunas o infarto no lacunar) en ausencia de antecedentes de ictus es relativamente común en las pruebas de neuroimagen, especialmente de pacientes ancianos. La enfermedad cerebrovascular asintomática es un marcador de aumento del riesgo de ictus763,764. La hipertensión arterial, la DM y el consumo de cigarrillos contribuyen a estas lesiones y hay que tratarlos. No hay estudios sobre las mejores opciones de tratamiento para el infarto cerebral asintomático765.
Recomendaciones para pacientes con enfermedad cerebrovascular
| Recomendaciones | Clasea | Nivelb,c |
|---|---|---|
| Para los pacientes con eventos cerebrovasculares, se recomienda mejorar los factores del estilo de vida, además del tratamiento farmacológico adecuado732,733,741 | I | A |
| Para los pacientes con ictus isquémico o AIT, se recomienda la prevención con antitrombóticos. La elección del antitrombótico dependerá del mecanismo del evento. Para los pacientes con ictus isquémico o AIT no cardioembólico, se recomienda el tratamiento con antiagregantes plaquetarios, y para aquellos con ictus isquémico o AIT cardioembólico, se recomienda el tratamiento con anticoagulantes732,741 | I | A |
| Para los pacientes con ictus isquémico o AIT no cardioembólico, se recomienda la prevención con ácido acetilsalicílico en monoterapia o dipiridamol con ácido acetilsalicílico o con clopidogrel solo620,743–745 | I | A |
| Para los pacientes con ictus isquémico menorc o AIT, se debe considerar el TAPD con ácido acetilsalicílico y clopidogrel o ácido acetilsalicílico y ticagrelor durante las 3 semanas posteriores a un evento agudo750,751,755 | IIa | A |
| Para los pacientes con ictus o AIT y PA en 140/90 o superior, se recomienda reducir la PA757,766 | I | A |
AIT: accidente isquémico transitorio; PA: presión arterial; TAPD: tratamiento antiagregante plaquetario doble.
a Clase de recomendación.
b Nivel de evidencia.
c El ictus menor se define como una puntaución ≤ 3 o ≤ 5, dependiendo del ensayo, en la Escala NIHSS (National Institutes of Health Stroke Scale).
La EAEI sintomática o asintomática (ITB ≤ 0,90) se asocia con un aumento al doble de la tasa de eventos coronarios a 10 años, mortalidad cardiovascular y mortalidad total125. A los 5 años del diagnóstico de EAEI, el 20% de los pacientes sufren un IAM o ictus y la mortalidad es del 10-15%.767
Todos los pacientes con EAEI necesitan mejorar su estilo de vida y tratamiento farmacológico. La deshabituación tabáquica aumenta la distancia de deambulación y disminuye el riesgo de amputación2. En pacientes diabéticos, el control glucémico mejora los desenlaces en las extremidades768. Las estatinas ofrecen ligeras mejoras en la distancia de deambulación y disminuyen el riesgo de eventos adversos en las extremidades769,770. La politerapia con estatinas y ezetimiba771 o un inhibidor de la PCSK9 también tiene efectos beneficiosos772.
Los antiagregantes plaquetarios se utilizan para prevenir eventos en las extremidades y eventos cardiovasculares en general. La estrategia antiagregante plaquetaria óptima no está clara773. Actualmente El TAPD está recomendado solo tras intervención (independientemente del tipo de endoprótesis) durante al menos 1 mes.
En el ensayo COMPASS, las dosis bajas de rivaroxabán en combinación con AAS en pacientes con ECV y un ITV < 0,90 redujeron no solo los eventos de EA, sino también los eventos adversos en las extremidades, incluida la amputación (HR = 0,54), aunque a expensas de mayor riesgo de hemorragia grave774. Estos resultados, junto con los beneficios similares del rivaroxabán frente al AAS en monoterapia, indican que los anticoagulantes son beneficiosos en la EAEI. Sin embargo, se necesitan más estudios. El tratamiento antitrombótico óptimo se describe con más detalle en la Guía de la ESC/EACTS de 2017 sobre el tratamiento de las valvulopatías775. Se debe destacar que no se recomienda el tratamiento antiagregante plaquetario para pacientes con EAEI asintomática sola (p. ej., ITB bajo)775.
Las recomendaciones sobre el tratamiento de la PA y los lípidos son coherentes con las recomendaciones generales especificadas en las secciones 4.6 y 4.7. Los objetivos de hipertensión se basan principalmente en el ensayo INVEST776. Una PAS por debajo de 110-120mmHg puede aumentar los eventos cardiovasculares en pacientes con EAEI776. Los IECA y los ARA-II reducen los eventos cardiovasculares en pacientes con EAEI575,577 y se prefieren (en monoterapia o en combinación como parte del tratamiento)778. Los bloqueadores beta no están contraindicados en la EAEI de leve a moderada, ya que no afectan a la capacidad de deambulación o a los eventos adversos en las extremidades779 y reducen significativamente los eventos coronarios780, Sin embargo, los bloqueadores beta se deben considerar cuidadosamente en la isquemia crítica que amenaza las extremidades.
Recomendaciones para pacientes con enfermedad arterial de las extremidades inferiores: el mejor tratamiento médico
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para todo paciente con EAEI, se recomienda la deshabituación tabáquica29,781 | I | B |
| Para todo paciente con EAEI, se recomienda una dieta sana y cifras de PA óptimas | I | C |
| Para los pacientes con claudicación intermitente: | ||
| Se recomienda ejercicio de entrenamiento supervisado782–784 | I | A |
| Se recomienda el ejercicio de entrenamiento no supervisado cuando la supervisión no sea posible o no esté disponible | I | C |
| Para los pacientes con EAEI sintomáticac, se recomienda tratamiento antiagregante plaquetario | I | C |
| Para todo paciente con EAEI, se recomienda una PA < 140/90 mmHg776,785,786 | I | A |
| Para todo paciente diabético con EAEI, se recomienda el control glucémico estricto768 | I | A |
| Para todos los pacientes con EAP e hipertensiónd, se debe considerar los IECA o los ARA-II como tratamiento de primera línea575,787 | IIa | B |
| Para los pacientes diabéticos con EAEI crónica sintomática sin alto riesgo hemorrágico, se puede considerar la combinación de una dosis baja de rivaroxabán (2,5 mg 2 veces al día) y ácido acetilsalicílico (100 mg 1 vez el día)774 | IIb | B |
ARA-II: antagonistas del receptor de angiotensina II; BCC: bloqueadores de los canales del calcio; DM: diabetes mellitus; EAEI: enfermedad arterial de las extremidades inferiores; EAP: enfermedad arterial periférica; IECA: inhibidores de la enzima de conversión de la angiotensina; PA: presión arterial.
a Clase de recomendación.
b Nivel de evidencia.
c No hay evidencia disponible para todas las localizaciones. Cuando haya evidencia sobre la localización cardiovascular, se presenta en la sección correspondiente.
d Para los pacientes negros, se debe proponer los BCC.
La enfermedad renal crónica grave se asocia con un riesgo muy alto de ECV y se considera un equivalente de riesgo de la EC (véase la sección 3.2). Los factores de riesgo no clásicos emergen según disminuye la TFGe y aumenta el riesgo de los eventos cardiovasculares no ateroescleróticos204. Los ensayos generalmente excluyen a los pacientes con TFGe < 30ml/min/1,73 m2. En los pacientes con diálisis diaria, los síndromes coronarios pueden presentarse de forma atípica, y los equivalentes a una angina, como disnea o fatiga, son frecuentes788. El tratamiento estándar para la ECV es efectivo en los pacientes con diálisis, pero los síndromes asociados con la hemodiálisis (como hipotensión intradialítica y aturdimiento miocárdico) que causan mortalidad complican el tratamiento y los desenlaces.
La clasificación del riesgo de los pacientes con ERC en diversos estadios se resume en la tabla 4. Se recomienda el tratamiento con estatinas o la combinación estatinas-ezetimiba para los pacientes con ERC y riesgo de ECV suficientemente alto, pero no si están en diálisis. Esta recomendación se basa en la evidencia del estudio SHARP (Study of Heart and Renal Protection), que demostró una reducción de los eventos ateroescleróticos graves525. La dosis de estatinas se debe ajustar según un tratamiento de intensidad moderada basado en la poca experiencia y los riesgos asociados con los tratamientos de alta intensidad543. Los análisis de subgrupos de un reciente estudio con un inhibidor de la PCSK9 demostraron que también puede beneficiar a los pacientes en los primeros estadios de la ERC (60-90 y también 30-30ml/min/1,73 m2)789.
Para los pacientes diabéticos con hipertensión y albuminuria, se recomienda el tratamiento con un IECA o un ARA-II. Estos fármacos deben ajustarse progresivamente hasta la dosis máxima tolerada (grado 1B de la Kidney Disease Improving Global Outcomes).
Para los pacientes diabéticos con ERC no dependiente de diálisis, a su vez se recomiendan unos objetivos de HbA1c individualizados desde el 6,5 a < 8,0%. El papel de los iSGLT2 y los aGLP-1 en la ERC con DM se trata en la sección 4.8. La dapagliflozina ha mostrado renoprotección y cardioprotección prometedoras599, y se están llevando a cabo más estudios con iSGLT2 en pacientes con ERC sin DM790.
En general, el tratamiento de la EC en pacientes con ERC debe informarse de la modificación de su presentación clínica en la ERC y las comorbilidades y los riesgos de efectos secundarios del tratamiento. El tratamiento de los factores de riesgo establecidos suele ser deficiente en los pacientes con ERC.
Recomendaciones para pacientes con enfermedad renal crónica: el mejor tratamiento médicoa.
| Recomendaciones | Claseb | Nivelc |
|---|---|---|
| Para los pacientes diabéticos con hipertensión y albuminuria, se recomienda el tratamiento con un IECA o un ARA-II. Estos fármacos deben ajustarse progresivamente hasta la dosis máxima tolerada | I | B |
| Para los pacientes con ERC, se debe considerar un iSGLT2 con beneficios demostrados para la prevención del deterioro renal y la mortalidad599 | IIa | B |
| No se recomienda la politerapia con IECA y ARA-II | III | C |
ARA-II: antagonistas del receptor de la angiotensina II; DM: diabetes mellitus; ERC: enfermedad renal crónica; IECA: inhibidores de la enzima de conversión de la angiotensina; iSGLT2: inhibidores del cotransportador 2 de sodio y glucosa.
a Las recomendaciones sobre el tratamiento de la ERC para pacientes con DM se hallan en la sección 4.8.
b Clase de recomendación.
c Nivel de evidencia.
La estrategia ABC (Atrial fibrilation Better Care) es un enfoque holístico («A», anticoagulation/avoid stroke [anticoagulación/evitar el ictus]; «B», better symptom management [mejor tratamiento de los síntomas], y «C», cardiovascular and comorbidity optimization [optimización cardiovascular y de las comorbilidades]) que simplifica el tratamiento integral de los pacientes con FA215. La estrategia ABC disminuye el riesgo de mortalidad por cualquier causa y el objetivo compuesto ictus, hemorragia grave, muerte cardiovascular o primera hospitalización791 y disminuye la tasa de eventos cardiovasculares792,793 y los costes relacionados con la salud794.
El componente «C» de la estrategia ABC (la optimización cardiovascular y de las comorbilidades) se refiere a identificar y tratar las enfermedades concomitantes, los factores de riesgo cardiometabólico y los factores del estilo de vida poco saludables. El tratamiento de las enfermedades subyacentes mejora el control del ritmo de los pacientes con FA persistente e IC216. En los pacientes obesos, la pérdida de peso previene la recurrencia de FA y los síntomas795–802. Dado que la hipertensión causa FA, es obligatorio tratarla. El consumo excesivo de alcohol es un factor de riesgo de FA de nuevo diagnóstico803,804 y la abstinencia reduce la recurrencia de FA en bebedores habituales798. Muchos estudios han demostrado los efectos beneficiosos del entrenamiento y la AF de intensidad moderada805–807. Sin embargo, la incidencia de la FA parece que aumenta entre los deportistas de élite, principalmente en deportes de resistencia808–811. Se debe animar a los pacientes a practicar ejercicio de intensidad moderada y mantenerse físicamente activos para prevenir la aparición o la recurrencia de FA, pero evitando el ejercicio de resistencia excesivo. La RC es un programa universalmente recomendado para pacientes con SCA o revascularizados y para pacientes con IC639,640,655. Los beneficios de la RC basada en el ejercicio no son tan claros en pacientes con FA, pero la RC se sigue recomendando con las indicaciones ya mencionadas812. La PAP continua puede mejorar el control del ritmo y atenuar la recurrencia de FA en pacientes con AOS813–816. El control glucémico intensivo no afecta a las tasas de FA de nueva aparición817. Sin embargo, un buen control glucémico durante los 12 meses posteriores a una ablación de FA reduce la recurrencia de FA818. Todos los pacientes con IC y FA deben recibir tratamiento para la IC según lo establecido en la guía.
Recomendaciones sobre intervenciones en el estilo de vida y el tratamiento de los factores de riesgo y las comorbilidades para pacientes con fibrilación auricular215
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda identificar y tratar los factores de riesgo y las enfermedades concomitantes como parte integral del tratamiento795 | I | B |
| Para reducir la carga de FA y la gravedad de los síntomas, se recomienda la modificación de estilos de vida poco saludables y el tratamiento dirigido para las enfermedades intercurrentes216,795–802 | I | B |
| Se recomienda prestar atención al buen control de la PA de los pacientes con FA e hipertensión para reducir la recurrencia de FA y el riesgo de ictus y hemorragia800,801 | I | B |
| Para los pacientes obesos con FA, se debe considerar la pérdida de peso y el tratamiento de otros factores de riesgo para reducir la incidencia, la progresión, la recurrencia y los síntomas de FA795–797 | IIa | B |
| Para la prevención de la FA y para los pacientes con FA candidatos a tratamiento anticoagulante oral, se debe considerar el asesoramiento y el tratamiento para evitar el consumo excesivo de alcohol798,803,804 | IIa | B |
| Como ayuda en la prevención de la incidencia y la recurrencia de FA, se debe considerar la AF salvo el ejercicio de resistencia excesivo, que puede causarla805–815 | IIa | C |
| Se debe considerar el tratamiento óptimo de la AOS para reducir la incidencia, la progresión, la recurrencia y los síntomas de FA813 | IIb | C |
AF: actividad física; AOS: apnea obstructiva del sueño; FA: fibrilación auricular.
a Clase de recomendación.
b Nivel de evidencia.
La población está envejeciendo rápidamente y la supervivencia tras ECV aguda ha mejorado820, lo que ha llevado a un aumento del número de pacientes de edad avanzada con ECV y multimorbilidades821,822. Esta evolución se asocia con altos costes para los servicios de salud823,824, peores indicadores de resultado y mayores tasas de reingreso825 y mortalidad826.
Hasta el 70% de los pacientes de edad ≥ 70 años tienen al menos 1 ECV y 2 tercios también sufren comorbilidades no cardiovasculares. La multimorbilidad es importante en los pacientes con ECV823.
Las enfermedades predominantes en los pacientes mayores de 60 años son hipertensión, hiperlipemia, cardiopatía isquémica, arritmias, DM y EC823. Otras comorbilidades frecuentes son la anemia y la artritis. Los defectos de visión, los problemas de cuello y espalda, la osteoartritis, la EPOC, la depresión y el cáncer son algunas de las comorbilidades no cardiovasculares más comunes en los pacientes con ECV. La mayoría de los estudios no han encontrado diferencias de sexo en las comorbilidades. Sin embargo, los varones tienen más comorbilidades con la ECV (sobre todo más depresión)822,826,827.
Hasta ahora, las guías para el tratamiento de la ECV se habían centrado principalmente en ECV individuales. La aplicación de una guía para ECV individuales a los pacientes con multimorbilidad no suele ser posible, ya que la competencia terapéutica es muy frecuente (22,6%)820 y el tratamiento de una enfermedad puede empeorar otra coexistente. Los retos para el tratamiento de la ECV y la multimorbilidad son interacciones enfermedad-enfermedad, enfermedad-fármaco y fármaco-fármaco820. Además, la farmacocinética puede ser distinta en cada paciente con comorbilidades y la expectativa de vida debe tenerse en cuenta cuando se inicie el tratamiento con un nuevo fármaco. Se debe proponer un enfoque basado en los valores siempre que sea posible820. Por lo general, no está claro que aumente el beneficio cuando se añade un nuevo fármaco a un tratamiento ya existente282. Más aún, el tratamiento de pacientes con ECV y multimorbilidades suele dividirse entre varios especialistas, lo que complica la toma de decisiones y la adherencia al tratamiento recomendado820.
Los pacientes con ECV y multimorbilidades han estado infrarrepresentados en la mayoría de los ensayos clínicos que fundamentan estas guías. Ensayos que incluyan a pacientes con multimorbilidades y objetivos importantes para ellos, los ensayos pragmáticos y el empleo de registros y big data podrían ser de ayuda para establecer tratamiento óptimos y estrategias para pacientes con ECV y multimorbilidades820.
Para los pacientes con ECV y multimorbilidades, hay un clamor por el cambio de paradigma de unos tratamientos centrados en la enfermedad a tratamientos centrados en el paciente que pongan en el centro la consecución de objetivos terapéuticos de los pacientes828. «¿Qué es lo más importante para usted?» debería ser la pregunta en la que se centre la atención, y no «¿qué le ocurre?».
La atención centrada en el paciente debe incluir la evaluación de las preferencias deeste, la interpretación de la evidencia y sus aplicaciones a cada paciente concreto, la consideración de un pronóstico general que incluya la expectativa de vida, el estado funcional y la calidad de vida, y la viabilidad clínica. Se debería considerar la adherencia al tratamiento, los efectos farmacológicos adversos, la carga económica y el estrés que experimentan los cuidadores al optimizar los tratamientos y los planes de cuidados en los que se enfatiza la adherencia a la medicación esencial y no se pausa ningún fármaco828. Más aún, los planes de cuidados avanzados deben comenzar lo antes posible. Se necesitan equipos multidisciplinarios y la colaboración estrecha entre profesionales de atención primaria y especialistas. Por último, los sistemas de apoyo automatizados para la multimorbilidad y la ECV podrían ayudar a poner en común las evidencias relevantes y la toma de decisiones adecuadas829.
7MENSAJES CLAVEFactores de riesgo y clasificación del riesgo
- •
Los principales factores de riesgo de EA son el colesterol, la PA, el consumo de cigarrillos, la DM y la obesidad.
- •
En personas aparentemente sanas, pacientes con EA establecida y pacientes diabéticos, los factores de riesgo se tratan con un enfoque por pasos para la consecución de los objetivos terapéuticos fundamentales.
- •
El riesgo de ECV a 10 años de las personas aparentemente sanas de 40-69 años se estima con SCORE2 y el de las de 70 o más años, con SCORE2-OP.
- •
Los umbrales de riesgo de ECV a 10 años específicos para la edad, con consideración de los modificadores del riesgo, la fragilidad, las comorbilidades, el riesgo de ECV de por vida, el beneficio terapéutico, la polifarmacia y las preferencias de los pacientes, deben guiar las decisiones sobre el tratamiento de los lípidos y la PA.
- •
Hay varias formas de comunicar el riesgo (residual) de ECV y deben adaptarse a cada paciente.
Modificadores del riesgo
- •
El estrés psicosocial se asocia con riesgo de EA.
- •
Las puntuaciones de riesgo actuales pueden subestimar o sobrestimar el riesgo de ECV en grupos étnicos minoritarios que difieran.
- •
La puntuación de calcio coronario es la mejor modalidad de imagen establecida para mejorar la estratificación del riesgo de ECV.
- •
La fragilidad es un factor de riesgo funcional de morbilidad y mortalidad tanto cardiovascular como no cardiovascular.
- •
La evaluación de la fragilidad no es un método que determine la elegibilidad para ningún tratamiento, sino que sirve para elaborar un plan de tratamiento individualizado con prioridades predefinidas.
- •
Se debe preguntar sistemáticamente por los antecedentes familiares y, cuando haya antecedentes familiares de EA, se debe llevar a cabo una exhaustiva evaluación del riesgo de ECV.
- •
Los datos actuales no respaldan el empleo de la puntuación de riesgo poligénico para la evaluación del riesgo de ECV en prevención primaria.
- •
La aparición de EA y su pronóstico se vinculan con gradientes sociales.
- •
La contaminación atmosférica tiene firme relación con la EA.
- •
No se debe hacer sistemáticamente determinaciones adicionales de biomarcadores en sangre y orina.
- •
Se debe evaluar el riesgo de ECV de las personas obesas.
Cuadros clínicos
- •
La ERC es un factor independiente de riesgo de EA, y esta es la principal causa de muerte en la ERC.
- •
Una reducción a corto plazo de aproximadamente un 30% de la albuminuria al iniciar el tratamiento con inhibidores del SRAA se asocia con beneficios en los resultados cardiovasculares y renales.
- •
Asimismo los iSGLT2 se asocian con beneficios en el riesgo cardiovascular y renal.
- •
La FA se asocia con un aumento del riesgo de muerte y de ECV.
- •
La IC isquémica es la manifestación clínica más avanzada de la ateroesclerosis miocárdica.
- •
El diagnóstico de IC sintomática, así como la presentación asintomática con disfunción del VI, aumenta el riesgo de eventos cardiovasculares (infarto de miocardio, ictus isquémico, muerte cardiovascular).
- •
Hay un solapamiento entre los factores del riesgo cardiovascular y del cáncer: el riesgo cardiovascular de los pacientes con cáncer depende tanto de la toxicidad cardiovascular de los tratamientos como de los factores propios de cada paciente.
- •
Se debe monitorizar los signos o síntomas de disfunción cardiaca antes, periódicamente durante y tras el tratamiento.
- •
Se debe recomendar encarecidamente el ejercicio, en especial el ejercicio aeróbico, para prevenir la cardiotoxicidad.
- •
La EPOC es un importante factor de riesgo de ECV, sobre todo EA, ictus e IC.
- •
Los pacientes con EPOC son propensos a las arritmias (FA y taquicardia ventricular) y la muerte súbita cardiaca.
- •
Se debe buscar ECV en todos los pacientes con EPOC.
- •
Las enfermedades inflamatorias crónicas aumentan el riesgo de ECV.
- •
La infección por el VIH se asocia con un aumento del riesgo de EAEI y EC.
- •
La gripe y la periodontitis tienen relación con la EA.
- •
La migraña, en especial la migraña con aura, es un importante factor independiente del riesgo de ictus y cardiopatía isquémica.
- •
El riesgo de ictus isquémico de los pacientes con migraña con aura aumenta considerablemente por el consumo de anticonceptivos orales y cigarrillos.
- •
El sueño no reparador y la duración del sueño que se desvían significativamente de las 7 h/día recomendadas se asocia con un aumento del riesgo cardiovascular.
- •
Los trastornos mentales son comunes entre la población general (prevalencia a 12 meses del 27%) y se asocian con un exceso de mortalidad.
- •
La aparición de ECV multiplica por 2,2 el riesgo de trastornos mentales y conlleva peores pronósticos.
- •
Algunos trastornos mentales, incluso los síntomas de ansiedad y depresión, se asocian con la aparición de ECV y con un peor pronóstico para los pacientes con ECV (EC, hipertensión arterial, FA, IC).
- •
La causa principal del exceso de mortalidad está en factores de riesgo derivados de la conducta (como el tabaquismo) y el deterioro de la capacidad para los autocuidados (p. ej., adherencia al tratamiento).
- •
La EHNA se asocia con otros factores de riesgo cardiometabólicos.
- •
Se debe evaluar otros factores de riesgo cardiometabólicos en los pacientes con EHNA.
- •
Enfermedades específicas del sexo:
- –
La preeclampsia y la hipertensión relacionada con el embarazo se asocian con mayor riesgo de ECV.
- –
El síndrome del ovario poliquístico confiere un riesgo significativo de futura DM.
- –
La DE de los varones se asocia con futuros eventos cardiovasculares y mortalidad.
- –
Se debe buscar ECV en los varones con DE.
- –
Preguntar por la DE debería ser un procedimiento estándar en la evaluación habitual del riesgo cardiovascular de los varones.
Factores de riesgo e intervenciones individuales
- •
La AF habitual es la base de la prevención de la EA.
- •
Se recomienda la AF aeróbica combinada con ejercicios de fuerza y la reducción del tiempo de sedentarismo.
- •
Una dieta sana disminuye el riesgo de ECV y otras enfermedades crónicas.
- •
El cambio de una dieta basada en productos de origen animal a otra vegetal puede reducir las ECV.
- •
Conseguir y mantener un peso saludable gracias a cambios en el estilo de vida tiene efectos favorables en los factores de riesgo (PA, lípidos, glucosa, metabolismo) y disminuye el riesgo de ECV.
- •
Para los pacientes con alto riesgo, se debe considerar la cirugía bariátrica cuando los cambios en la dieta y la PA u otras intervenciones no invasivas no tengan éxito.
- •
También se puede considerar los fármacos antiobesidad con efectos protectores contra la EA.
- •
Los pacientes con trastornos mentales tienen un aumento drástico de los riesgos relacionados con el estilo de vida, que se debe reconocer y tratar.
- •
Los tratamientos de salud mental mejoran el estrés y la calidad de vida, reducen el riesgo de suicidio y pueden mejorar los desenlaces cardiovasculares.
- •
El tratamiento de la EA en pacientes con trastornos mentales requiere coordinación y comunicación multidisciplinarias.
- •
La deshabituación tabáquica reduce rápidamente el riesgo de ECV y es la estrategia más rentable para la prevención de la EA.
- •
Hay evidencia contundente sobre las intervenciones asistidas con fármacos: la TSN, el bupropión, la vareniclina y otras politerapias. La combinación más efectiva es de fármacos y apoyo durante el seguimiento.
- •
Menos es más: el efecto del cLDL en los riesgos de ECV parece estar determinado por los valores basales y la duración total de la exposición al cLDL.
- •
La disminución del cLDL con estatinas, ezetimiba y, si fuese necesario y rentable, los inhibidores de la PCSK9 disminuyen el riesgo de EA en proporción a la reducción absoluta de cLDL.
- •
Cuando no se alcancen los objetivos de cLDL según el nivel de riesgo, se debe buscar una reducción del cLDL ≥ 50% y después intentar la reducción de otros factores de riesgo como parte de la toma de decisiones conjunta con el paciente.
- •
Ante la sospecha de hipertensión, el diagnóstico debe confirmarse determinando la PA en consulta en varias citas o con AMPA o MAPA.
- •
Se recomiendan las intervenciones en el estilo de vida para todos los pacientes con hipertensión, ya que pueden retrasar la necesidad de tratamiento farmacológico o complementar los efectos hipotensores del tratamiento farmacológico.
- •
Se recomiendan los fármacos hipotensores para la mayoría de los adultos con PA en consulta ≥ 140/90mmHg y todos los adultos con PA ≥ 160/100mmHg.
- •
Para todos los grupos de pacientes, incluso los de edad avanzada autónomos, los objetivos del tratamiento de la PA son inferiores que en la anterior Guía de la ESC para la prevención de la ECV.
- •
Se recomienda extender los tratamientos con un único comprimido para reducir la mala adherencia al tratamiento hipotensor.
- •
Para tratar a la mayoría de los pacientes, se debe utilizar un único algoritmo de tratamiento simple basado en politerapia con bloqueadores del SRAA y un BCC o tiacidas/diurético tiacídico o los tres. Los bloqueadores beta también se pueden utilizar cuando las guías lo indiquen.
- •
Muchos pacientes con hipertensión tendrán el suficiente nivel de riesgo para beneficiarse del tratamiento con estatinas en prevención primaria. En prevención secundaria se recomiendan los antiagregantes plaquetarios.
- •
Un enfoque multifacotrial, con cambios en el estilo de vida, es imprescindible para personas con DM2.
- •
El tratamiento de la hiperglucemia reduce el riesgo de complicaciones microvasculares y, en menor grado, el riesgo de ECV. Los objetivos glucémicos para los pacientes anciano o frágiles deben relajase.
- •
Los nuevos fármacos antihiperglucemiantes son especialmente importantes para los pacientes con DM2 y EA y (riesgo aumentado de) IC o nefropatía, por normal general e independientemente de los valores glucémicos.
Diabetes mellitus tipo 1
- •
El tratamiento intensivo de la hiperglucemia en la DM reduce el riesgo de complicaciones microvasculares y macrovasculares y la mortalidad prematura. Se recomienda un objetivo de HbA1c de 6,5-7,5 (48-58mmol/mol).
- •
En la DM1 no se recomienda la metformina para disminuir el riesgo de ECV.
- •
Se ha recomendado la dapagliflozina para el tratamiento de la DM1, aunque conlleva un aumento del riesgo de cetoacidosis diabética.
- •
El tratamiento de otros factores de riesgo, en especial el tabaquismo, la PA y el colesterol, sigue siendo una forma importante de disminuir el riesgo de ECV en la DM1.
- •
Todos los pacientes con EA establecida necesitan algún tipo de tratamiento antitrombótico.
- •
El tratamiento antiinflamatorio es una estrategia prometedora en la prevención de la ECV.
- •
Todos los pacientes deben participar en RC basada en el ejercicio tan pronto como sea posible tras un SCA o una cirugía de revascularización coronaria o ICP o en caso de IC-FEr crónica.
- •
La RC basada en el ejercicio y los programas de prevención deben cumplir ciertos estándares de calidad y adecuarse al perfil de cada paciente.
- •
Se debe potenciar y fomentar la participación y la adherencia a largo plazo a estos programas. La telerrehabilitación y el uso de dispositivos móviles para la salud pueden ayudar a conseguir este objetivo.
Estrategias poblacionales para la prevención de la enfermedad cardiovascular
Actividad física
- •
Un porcentaje significativo de la población mundial, y en especial de la europea, presenta altos niveles de sedentarismo e inactividad física.
- •
El porcentaje de personas que practican ejercicio habitualmente es mayor entre los varones que entre las mujeres.
- •
El progreso en aumentar los niveles de AF ha sido lento en todo el mundo, en gran parte debido a la falta de concienciación e inversión.
- •
La dosis óptima de distintos tipos de AF para la ECV y la prevención general aún está en controversia y se actualiza frecuentemente. Sin embargo, aumentar el nivel de AF de moderado a vigoroso y reducir el tiempo sedentario es beneficioso, y cualquier nivel de AF se considera mejor que ninguno.
- •
Los médicos deben implementar la AF para la promoción de la salud como si fuese la prescripción de medicamentos, y también deben fomentarla otros profesionales de la salud.
- •
Las intervenciones poblacionales son efectivas para fomentar la AF en grupos de edad, sexo y raza, poblaciones de ingresos altos, medios y bajos y distintos entornos (guarderías, colegios, gimnasios, empresas y lugares de trabajo en general).
- •
La práctica de AF en el colegio debería ser ≥ 3 h/semana y preferiblemente 60 min/día.
- •
Las estrategias poblaciones son complementarias a las individuales.
Dieta
- •
Las medidas estructurales como los cambios en la cadena de suministros agrícolas y la industria alimentaria, la reformulación de productos, la limitación del márketing (digital) dirigido a menores, los impuestos sobre comidas/nutrientes poco saludables y el etiquetado centrado en los consumidores pueden ayudar a tomar mejores decisiones alimentarias.
- •
Los entornos saludables en la comunidad, el transporte púbico, la escuela y los lugares de trabajo favorecen decisiones alimentarias saludables.
- •
El Plan de Acción Global de la OMS para la Prevención y el Control de Enfermedades No Transmisibles 2013-2020, ampliado hasta 2025, recomienda el desarrollo de objetivos en las agendas mundiales, regionales y nacionales. Entre los 10 objetivos voluntarios que conseguir en 2025 está una reducción relativa del 30% en el consumo medio poblacional de sodio/sal830.
Tabaquismo y consumo de tabaco
- •
La adolescencia es el momento más vulnerable para contraer tabaquismo, con consecuencias de por vida.
- •
Las campañas de prevención hasta ahora han reducido el consumo de tabaco más entre las chicas que entre los chicos.
- •
Se debe informar a los adolescentes de que el tabaquismo no contribuye a la pérdida de peso.
- •
Los impuestos altos para todos los productos del tabaco es la política más efectiva para reducir la adquisición del hábito tabáquico entre los jóvenes.
- •
Deberían aplicarse restricciones al tabaco sin combustión debido a las contundentes evidencias sobre su nocividad.
- •
También deberían aplicarse restricciones a los cigarrillos electrónicos por el mismo motivo.
- •
El empaquetado simple es efectivo para reducir el atractivo de los productos del tabaco.
- •
Deberían imponerse restricciones a la publicidad, la promoción y los patrocinios de la industria tabacalera.
- •
Un objetivo puede ser una decisión común para que Europa esté libre de tabaquismo en 2030.
Alcohol
- •
El consumo de alcohol se asocia con un aumento de la mortalidad cardiovascular y es el principal factor de riesgo de muerte prematura y discapacidad de las personas de 15-49 años.
- •
Las intervenciones para paliar las consecuencias nocivas del alcohol (aumentar el precio único por bebida alcohólica y los impuestos indirectos, restringir el acceso a las bebidas alcohólicas e implementar restricciones y prohibiciones exhaustivas en la publicidad y la promoción de las bebidas alcohólicas) son rentables y devuelven beneficios.
- •
Los profesionales de la salud pueden preguntar sobre el consumo de alcohol en cada examen médico y deben informar a los pacientes de que el alcohol es muy energético: aporta 7kcal/g sin nutrientes.
Medio ambiente, contaminación y cambio climático
- •
La contaminación atmosférica contribuye a la mortalidad y la morbilidad y en particular aumenta el riesgo de enfermedades respiratorias y cardiovasculares.
- •
La exposición ambiental se ha convertido en una nueva prioridad ya que, además de sus efectos en la salud, también se ha descrito que la contaminación atmosférica es uno de los principales contribuyentes al cambio climático, especialmente por el consumo de combustibles fósiles que conllevan el aumento de emisiones de dióxido de carbono.
Tratamiento del riesgo de enfermedad cardiovascular específico por enfermedad
Enfermedad coronaria
- •
La prevención multidimensional es esencial para los desenlaces de la EC a corto y largo plazo.
Insuficiencia cardiaca
- •
Los pacientes con IC se benefician de los programas de tratamiento multidisciplinarios.
- •
Varios antagonistas neurohormonales, así como las nuevas moléculas, mejoran los desenlaces clínicos en pacientes con IC-FEr sintomáticos.
Enfermedades cerebrovasculares
- •
Los eventos isquémicos están causados principalmente por aterotrombosis, cardioembolia o enfermedad de pequeños vasos, mientras que las hemorragias intracerebrales están causadas por angiopatías hipertensivas o angiopatías cerebrales amiloides.
- •
Se recomiendan los antiagregantes plaquetarios para los eventos no cardioembólicos y los anticoagulantes para los cardioembólicos.
- •
Los hipotensores reducen las recurrencias en pacientes con ictus o AIT previo y PA elevada.
- •
Las estatinas previenen los eventos cardiovasculares y cerebrovasculares en pacientes con ictus o AIT.
Enfermedad arterial de las extremidades inferiores
- •
La EAEI se asocia con un aumento del riesgo de ECV.
- •
El tratamiento antiagregante plaquetario (solo o en combinación con una dosis baja de un anticoagulante oral) reduce el riesgo de acontecimientos eventos adversos en las extremidades y el riesgo general de ECV de los pacientes con EAEI.
- •
La deshabituación tabáquica y el control de otros factores de riesgo de ECV mejoraran el pronóstico.
Enfermedad renal crónica
- •
La hipertensión, las dislipemias y la DM son frecuentes en pacientes con ERC y requieren una estrategia terapéutica para los riesgos altos.
- •
El tratamiento del riesgo incluye el estilo de vida, la deshabituación tabáquica, la nutrición, suficiente bloqueo del SRAA, control de la PA por objetivos, control de los lípidos y, en la ECV establecida, ácido acetilsalicílico.
- •
Se da gran valor a los programas de formación en autocuidados y el tratamiento en equipos con atención integral para los pacientes con DM, ERC y ECV.
Fibrilación auricular
- •
El tratamiento holístico de los pacientes con FA mejora el pronóstico y reduce los costes relacionados con la salud.
- •
La modificación exhaustiva de los factores de riesgo y la atención a las enfermedades subyacentes reducen la carga de FA y su recurrencia.
Multimorbilidad
- •
El número de pacientes con múltiples comorbilidades cardiovasculares y no cardiovasculares está aumentado rápidamente.
- •
Ante un paciente con comorbilidades, se debe considerar la competencia terapéutica, ya que el tratamiento de una enfermedad puede empeorar otra concomitante.
- •
Para los pacientes multimórbidos con ECV, se recomienda un cambio en el paradigma del tratamiento centrado en la enfermedad a otro centrado en el paciente.
Clasificación del riesgo de enfermedad cardiovascular
- •
Algoritmos de riesgo para pacientes con ECV establecida y pacientes con DM específicos para cada país.
- •
Comparación formal de la efectividad y la rentabilidad del tratamiento de la ECV guiado por riesgo frente al tratamiento guiado por nivel de factor de riesgo.
- •
Comparación de la precisión de los modelos de riesgo de ECV ajustados por riesgos competitivos frente a modelos estándar del riesgo de ECV.
- •
Incorporación de potenciales marcadores de riesgo a los modelos de riesgo convencionales, como el estatus socioeconómico y la etnia.
- •
Comparación de estrategias de tratamiento guiadas por el beneficio del tratamiento frente a estrategias guiadas por riesgo en la reducción de los niveles de factores de riesgo y del riesgo de ECV.
- •
Tratamiento del riesgo de ECV de los pacientes ancianos (> 85 años) con fragilidad importante, para quienes hoy no hay datos.
- •
Comparación de diferentes métodos para la estimación del riesgo de ECV de por vida y el beneficio de por vida del tratamiento de los factores de riesgo.
Modificadores del riesgo
Factores psicosociales
- •
Más evidencia de que los factores psicosociales añaden valor y mejoran la predicción del riesgo de los modelos de factores de riesgo clásicos.
Etnia
- •
Cuestionar si el reajuste de los factores de riesgo por etnia es homogéneo en los países europeos.
- •
Riesgos asociados con otros orígenes étnicos.
Fragilidad
- •
Consenso sobre un instrumento clínico de cribado de fragilidad aplicado a todo el desarrollo de EA.
- •
Contribución cuantitativa de la fragilidad a la estrategia de predicción del riesgo total de ECV.
- •
Con qué grado de fragilidad debería ser menos agresivo el tratamiento de los factores de riesgo.
Antecedentes familiares
- •
Desentrañar el papel, los mecanismos y el peso (genético, socioeconómico) de los antecedentes familiares en el riesgo de ECV.
Genética
- •
El potencial de las puntuaciones de riesgo poligénico para complementar las puntuaciones de riesgo existentes.
Determinantes socioeconómicos
- •
Más evidencia procedente de distintas regiones de riesgo de que la inclusión de factores socioeconómicos mejora la predicción del riesgo por encima de los factores de riesgo clásicos tanto en varones como en mujeres.
Exposición medioambiental
- •
Determinar si la contaminación atmosférica reclasifica el riesgo individual.
Biomarcadores
- •
El valor añadido de los biomarcadores en la clasificación del riesgo.
Cuadros clínicos
Enfermedad renal crónica
- •
Identificar un número relevante de biomarcadores, además de la albuminuria, y quizá la puntuación de calcio coronario para subclasificar el riesgo cardiovascular en la ERC.
- •
Identificación precoz y precisa de la ERC progresiva con nuevos biomarcadores más sensibles que la TFGe y la albuminuria.
Fibrilación auricular
- •
Evaluar los efectos de las intervenciones en la reducción de desenlaces además de los ictus.
- •
¿La FA es un factor causal del aumento de morbilidad y mortalidad por ECV?
- •
Predicción del riesgo de ictus de los pacientes con FA en bajo riesgo.
- •
La evidencia más reciente indica que el ictus puede aparecer en pacientes con FA incluso tras la restauración del ritmo sinusal.
Insuficiencia cardiaca
- •
Se desconoce si los pacientes con IC-FEr de origen isquémico deben tener un objetivo de cLDL diferente del recomendado para pacientes sin IC en prevención secundaria.
Cáncer
- •
ECA con cirugía preventiva para demostrar el efecto evidente en la prevención de eventos cardiovasculares.
Enfermedad pulmonar obstructiva crónica
- •
Aunque es muy probable que la ECV y la EPOC compartan vías fisiopatológicas, siguen sin estar claras.
Enfermedades inflamatorias
- •
El mejor modo de integrar a la evaluación del riesgo de ECV información sobre las enfermedades inflamatorias.
- •
El efecto de los antiinflamatorios modernos (como los inhibidores del factor de necrosis tumoral [TNF], las interleucinas [IL] 7, 17 y 23) en el riesgo cardiovascular.
Infecciones
- •
Ensayos a gran escala para evaluar la eficacia de la vacunación contra la gripe o el tratamiento de la periodontitis en la prevención de la ECV.
- •
La asociación de infección por el VIH y el riesgo total de ECV.
Migraña
- •
No existen datos que permitan la identificación fiable de subgrupos de pacientes migrañosos con un riesgo particular (p. ej., migraña activa, auras muy frecuentes, pacientes más jóvenes, mujeres).
- •
El papel de los factores de comorbilidad (como foramen oval permeable o factores protrombóticos) no está claro y por ahora no hay indicaciones para el cribado o el tratamiento de estos factores.
Trastornos del sueño
- •
No hay pruebas de que el aumento de las horas de sueño mejore la predicción del riesgo.
- •
Se necesitan ensayos sobre las vías complejas que vinculan las alteraciones del sueño con la ECV.
Trastornos mentales
- •
Se desconoce el mecanismo exacto por el que los trastornos mentales aumentan las ECV.
- •
Cómo la consideración de trastornos mentales mejora los modelos de riesgo cardiovascular.
Esteatosis hepática no alcohólica
- •
Si la EHNA aumenta el riesgo cardiovascular por encima de los factores de riesgo clásicos.
Enfermedades específicas del sexo
- •
En qué grado el aumento del riesgo de ECV asociado con diversas enfermedades en mujeres se presenta independientemente de los factores de riesgo de ECV convencionales, aunque los datos de mujeres todavía carezcan de potencia estadística respecto a los varones.
- •
Información sobre si las enfermedades de las mujeres mejoran la clasificación del riesgo.
- •
No hay suficientes datos para sacar conclusiones sobre un posible aumento del riesgo de hipertensión o DM con menopausia prematura.
- •
No hay suficientes estudios de las especificidades de la ECV en la población transgénero.
Disfunción eréctil
- •
Los beneficios del cribado sistemático de DE y el medio más eficaz para evaluarla no están claras.
- •
No está claro el beneficio de buscar enfermedad vascular subclínica en los varones con DE y riesgo de ECV de bajo a intermedio.
Factores de riesgo e intervenciones individuales
Actividad física y ejercicio
- •
Conocimiento sobre la importancia relativa de varias características de la AF y el ejercicio de fuerza o su combinación en la mortalidad por cualquier causa, la incidencia de ECV y la mortalidad.
- •
Conocimiento sobre cómo el sexo, la edad, el peso, la raza/etnia, la ocupación y el estatus socioeconómico pueden modificar asociaciones entre la AF y la salud.
- •
Implementación de estrategias para la conseguir adherencia a la AF a largo plazo.
- •
Evaluación de los efectos de la eHealth en la promoción de la AF.
Alimentación
- •
Estrategias efectivas para fomentar cambios en la dieta y disfrutar y mantener una dieta saludable.
Peso corporal
- •
Conocimiento e implementación de estrategias efectivas con fármacos y en el estilo de vida centradas en la pérdida de peso y que se mantenga a largo plazo.
Intervenciones psicosociales y en salud mental
- •
La efectividad de los tratamientos de salud mental para la prevención de eventos cardiovasculares graves.
- •
Cómo implementar efectivamente medidas de prevención de ECV en la población de pacientes con trastornos mentales en alto riesgo.
Intervenciones en tabaquismo
- •
Una mejor comprensión sobre la incorporación efectiva de la deshabituación tabáquica a la práctica clínica.
Lípidos
- •
Evidencia empírica derivada de ECA sobre el enfoque por pasos para la intensificación del tratamiento. Se necesita estudiar la viabilidad y los efectos de alcanzar los objetivos de cLDL < 1,4mmol/l (55mg/dl), especialmente en atención primaria.
- •
Se necesita más evidencia sobre los efectos de los tratamientos modificadores de los lípidos en la mortalidad total en forma de seguimientos a largo plazo tras ECA, especialmente de personas jóvenes con riesgo de ECV de bajo a moderado y ancianos y sobre nuevas intervenciones.
- •
Se necesita profundizar en la rentabilidad de utilizar el riesgo vitalicio de ECV y puntuaciones de riesgo de ECV más precisas para ajustar las intervenciones.
- •
El valor de los triglicéridos y los valores de cHDL como objetivo para el tratamiento.
- •
Si la reducción de lipoproteínas con estatinas, ezetimiba o iPCSK9 como tratamiento de fondo puede reducir el riesgo de EA.
- •
Si los alimentos funcionales y los suplementos alimenticios con efectos hipolipemiantes pueden reducir de forma segura el riesgo de ECV.
Presión arterial
- •
¿Cuál es el beneficio incremental sobre las calculadoras de riesgo de ECV de las determinaciones de daño orgánico mediado por hipertensión en la reclasificación del riesgo cardiovascular de los pacientes con hipertensión?
- •
Evidencia empírica directa de ECA sobre el enfoque por pasos para la intensificación del tratamiento.
- •
¿Cuáles son los beneficios de tratar la PA de los pacientes normotensos?
- •
Más datos sobre los beneficios del tratamiento de la PA en personas de edad muy avanzada y la influencia de la fragilidad.
- •
Efectos de las estrategias terapéuticas del tratamiento con un único comprimido frente a varios comprimidos en la adherencia al tratamiento, el control de la PA y los desenlaces clínicos.
- •
Efectividad del tratamiento antihipertensivo en la prevención del deterioro cognitivo o la demencia.
- •
Eficacia y rentabilidad de los procedimientos invasivos y los dispositivos para el tratamiento de la hipertensión.
- •
Umbrales de tratamiento de la PA específicos por sexo para varones y mujeres.
Diabetes mellitus
- •
Se necesita trabajar en el desarrollo de puntaciones de riesgo de eventos cardiacos graves e IC en la DM2.
- •
Se necesita comprobar si la combinación de un iSGLT2 con un aGLP-1 disminuye los MACE u otros desenlaces más que cada fármaco por separado.
- •
La seguridad a largo plazo de las nuevas clases de fármacos.
Tratamiento antitrombótico
- •
Se necesita definir el papel del tratamiento antitrombótico en prevención primaria para pacientes con (muy) alto riesgo.
Rehabilitación cardiaca y programas de prevención
- •
El efecto y la implementación óptima de la RC basada en el ejercicio para mujeres, pacientes ancianos/frágiles, pacientes con dispositivos electrónicos implantables tras trasplante cardiaco o reemplazo de válvula y en pacientes con FA, ictus, IC-FEc, EAEI o múltiples comorbilidades.
- •
Se necesitan otros modelos de RC rentables para asegurar la participación de los pacientes en todo el mundo, también los países de ingresos bajos y medios.
- •
Se necesitan grandes ECA sobre los efectos a largo plazo de la telerrehabilitación y el uso de dispositivos móviles para la salud.
Medio ambiente, contaminación atmosférica y cambio climático
- •
Se necesitan estudios sobre la exposición individual para determinar los efectos de las medidas de mitigación.
Tratamiento del riesgo de enfermedad cardiovascular específico por enfermedad
Enfermedad coronaria
- •
Se necesita evaluar en mayor profundidad la eficacia y la seguridad del AAS u otros tratamientos antitrombóticos en pacientes sin manifestaciones clínicas de EC, pero con EA identificada en pruebas de imagen, como angio-TC con contraste.
- •
No está claro el tratamiento antitrombótico óptimo para los pacientes con alto riesgo de eventos isquémicos.
- •
Se necesitan ensayos clínicos que comparen la eficacia y la seguridad de los inhibidores de P2Y12 frente al rivaroxabán o la politerapia con otros inhibidores del factor Xa en dosis bajas y AAS para determinar qué subgrupos se benefician más con cada estrategia.
Insuficiencia cardiaca
- •
No se ha demostrado con ningún tratamiento farmacológico o el implante de dispositivo que se modifique el riesgo de ningún desenlace cardiovascular en los pacientes con IC-FEc.
- •
Es necesario abordar las dosis más bajas de tratamiento de la IC para las mujeres con IC-FEr, ya que las mujeres suelen estar infrarrepresentadas en muchos ensayos sobre la IC.
Enfermedad cerebrovascular
- •
La selección óptima de pacientes para el TAPD corto.
- •
El régimen antihipertensivo óptimo y los objetivos de PA.
- •
Los valores objetivo de cLDL óptimos.
- •
El tratamiento óptimo para pacientes con enfermedad cerebrovascular asintomática.
Enfermedad arterial de las extremidades inferiores
- •
No están claros el tipo y la potencia óptimos del tratamiento antitrombótico para pacientes con diferentes manifestaciones de EAEI sintomática o asintomática.
Enfermedad renal crónica
- •
Se han dedicado muy pocos ensayos sobre la ECV a pacientes con ERC, especialmente con ERC avanzada.
- •
Se necesitan más estudios prospectivos que se centren en el diagnóstico, la prevención y el tratamiento de la EC y la ECV en la ERC.
Fibrilación auricular
- •
Los efectos de varios factores de riesgo cardiovascular y comorbilidades en la FA.
- •
El tratamiento óptimo de la AOS y su efecto en la progresión de la FA y sus síntomas.
Multimorbilidad
- •
El efecto de distintos conjuntos o combinaciones de morbilidades cardiovasculares y no cardiovasculares en los desenlaces cardiovasculares.
- •
Las estrategias de tratamiento óptimas y pragmáticas para los pacientes con morbilidades cardiovasculares y no cardiovasculares, especialmente adherencia terapéutica y los tratamientos en competencia.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Recomendaciones sobre la evaluación del riesgo de enfermedad cardiovascular | ||
| Se recomienda evaluar sistemáticamente el riesgo de ECV en general de toda persona con cualquier factor de riesgo vascular mayor (como antecedentes familiares de ECV prematura, HF, factores de riesgo de ECV como tabaquismo, hipertensión arterial, DM, hiperlipemia, obesidad o comorbilidades que aumenten el riesgo de ECV) | I | C |
| No se recomienda la evaluación sistemática del riesgo de ECV de los varones menores de 40 años y las mujeres menores de 50 sin factores de riesgo cardiovascular conocidos | III | C |
| Recomendaciones sobre la estimación del riesgo de enfermedad cardiovascular | ||
| Para toda persona aparentemente sana menor de 70 años sin EA establecida, DM, ERC o trastornos raros/genéticos de la PA, se recomienda estimar el riesgo a 10 años de ECV mortal y no mortal con las tablas SCORE2 | I | B |
| Para toda persona de edad ≥ 70 años aparentemente sana sin EA establecida, DM, ERC o trastornos raros/genéticos de la PA, se recomienda estimar el riesgo a 10 años de ECV mortal y no mortal con las tablas SCORE2-OP | I | B |
| Se debe considerar en alto o muy alto riesgo a los pacientes con ECV, DM, nefropatía de moderada a grave o trastornos raros/genéticos de la PA | I | A |
| Para personas aparentemente sanas con riesgo alto o muy alto de EA, así como para pacientes con EA establecida o DM, se recomienda intensificar el tratamiento con un enfoque por pasos que busque el tratamiento intensivo de los factores de riesgo tomando en consideración el riesgo de ECV, el beneficio del tratamiento de los factores de riesgo, los modificadores del riesgo, las comorbilidades y las preferencias del paciente | I | B |
| Para las personas aparentemente sanas sin DM, ERC, trastornos genéticos/raros de la PA o los lípidos que tengan una puntuación de riesgo de ECV muy alta (SCORE2 ≥ 7,5% los menores de 50 años; SCORE2 ≥ 10% los de 50-69 años, y SCORE2-OP ≥ 15% los de 70 o más años), se recomienda el tratamiento de los factores de riesgo de EA | I | C |
| Recomendación para la comunicación del riesgo cardiovascular | ||
| Se recomienda un debate informado sobre el riesgo de ECV y los beneficios del tratamiento ajustado a las necesidades del paciente | I | C |
| Recomendaciones sobre los modificadores del riesgo | ||
| No se recomienda recopilar sistemáticamente otros posibles modificadores como puntuaciones de riesgo genético, biomarcadores en sangre u orina, pruebas vasculares o pruebas de imagen (más allá de la puntuación de CAC o la ecografía carotídea para la detección de placas) | III | B |
| Recomendaciones sobre la evaluación del riesgo de enfermedad cardiovascular en cuadros clínicos específicos | ||
| Para todo paciente con ERC, con o sin DM, se recomienda el oportuno cribado de EA y de progresión de la nefropatía incluyendo monitorización de la albuminuria | I | C |
| Se recomienza monitorizar la disfunción cardiaca con técnicas de imagen y biomarcadores en sangre antes, periódicamente durante y tras el tratamiento oncológico | I | B |
| Se recomienda el cribado de factores de riesgo cardiovascular y la optimización del perfil de riesgo de ECV de los pacientes en tratamiento oncológico | I | C |
| Se recomienda que se considere la EA y los factores de riesgo de EA en todo paciente con EPOC | I | C |
| Para pacientes con ECV, obesidad e hipertensión, se recomienda el cribado de sueño no reparador (p. ej., con la pregunta: «¿Cada cuánto tiene problemas para dormirse o mantenerse dormido o duerme demasiado?») | I | C |
| Se recomienda la derivación a un especialista en caso de problemas de sueño importantes que no responden a las medidas para la higiene del sueño en 4 semanas | I | C |
| Se recomienda considerar la influencia de los trastornos mentales, ya sea con deterioro funcional significativo o disminución del uso de los servicios de salud, como una influencia en el riesgo de ECV | I | C |
| Se recomienda que los adultos de todas las edades se esfuercen en mantener AF de intensidad moderada al menos 150-300min/semana o AF aeróbica vigorosa 75-150min/semana o una combinación equivalente, para reducir la mortalidad por cualquier causa, la mortalidad y la morbilidad cardiovasculares | I | A |
| Se recomienda que los adultos que no puedan realizar AF de intensidad moderada 150min/semana se mantengan tan activos como su capacidad y su estado de salud les permitan | I | B |
| Se recomienda reducir el tiempo sedentario a favor de una actividad al menos ligera durante el día para reducir la mortalidad por cualquier causa y la mortalidad y la morbilidad cardiovasculares | I | B |
| Se recomienda la práctica de ejercicio de fuerza, además de aeróbico, 2 o más días por semana para reducir la mortalidad por cualquier causa | I | B |
| Recomendaciones sobre alimentación y consumo de alcohol | ||
| Se recomienda una dieta saludable para todas las personas como piedra angular de la prevención cardiovascular | I | A |
| Se recomienda adoptar una dieta mediterránea o similar para reducir el riesgo de ECV | I | A |
| Se recomienda sustituir las grasas saturadas por grasas insaturadas para reducir el riesgo de ECV | I | A |
| Se recomienda disminuir el consumo de sal para reducir la PA y el riesgo de ECV | I | A |
| Se recomienda adoptar un patrón alimentario de origen vegetal, rico en fibra, que incluya cereales integrales, frutas, verduras, legumbres y frutos secos | I | B |
| Se recomienda restringir el consumo de alcohol a un máximo de 100g a la semana | I | B |
| Se recomienda consumir pescado, preferiblemente graso, al menos una vez a la semana y restringir el consumo de carne (procesada) | I | B |
| Se recomienda restringir la ingesta de azúcares libres, especialmente bebidas azucaradas, a un máximo del 10% de la ingesta energética | I | B |
| Recomendaciones sobre el peso corporal | ||
| Para las personas con sobrepeso y obesidad, se recomienda un objetivo de pérdida de peso para reducir la PA, la dislipemia y el riesgo de DM2 y así mejorar el perfil de riesgo de ECV | I | A |
| Aunque hay una amplia gama de dietas efectivas para la pérdida de peso, se recomienda una dieta saludable para mantener la salud cardiovascular a lo largo del tiempo | I | A |
| Recomendaciones sobre salud mental e intervenciones psicosociales individuales | ||
| Los pacientes con trastornos mentales necesitan más atención y apoyo para mejorar la adherencia a los cambios en el estilo de vida y el tratamiento farmacológico | I | C |
| Para los pacientes con EA y trastornos mentales, se recomienda una atención a la salud mental basada en la evidencia y la cooperación interdisciplinaria | I | B |
| No se recomiendan los ISRS, los IRSN ni los antidepresivos tricíclicos para los pacientes con IC y depresión mayor | III | B |
| Recomendaciones sobre estrategias para la intervención en el tabaquismo | ||
| Se debe cesar todo consumo de tabaco, ya que este es una importante causa independiente de EA | I | A |
| Se recomienda la deshabituación tabáquica independientemente de la ganancia de peso, ya que esta no disminuye los beneficios de la deshabituación para la EA | I | B |
| Recomendaciones sobre los objetivos de colesterol unido a lipoproteínas de baja densidad | ||
| Para las personas aparentemente sanas con riesgo de ECV alto o muy algo o con EA establecida o DM, se recomienda una intensificación del tratamiento por pasos con consideración del riesgo de ECV, el beneficio del tratamiento, los modificadores del riesgo y las preferencias del paciente | I | C |
| Recomendaciones sobre la reducción farmacológica del colesterol unido a lipoproteínas de baja densidad en pacientes menores de 70 años | ||
| Se recomienda prescribir estatinas de alta intensidad hasta la dosis máxima tolerada para la consecución de los objetivos de cLDL por riesgo específico para cada grupo | I | A |
| Para los pacientes con EA establecida, se recomienda un tratamiento hipolipemiante con un objetivo fundamental de cLDL de 1,4mmol/l (55mg/dl) y una reducción ≥ 50% de los valores basales | I | A |
| Si no se alcanzan los objetivos con la dosis máxima tolerada de estatinas, se recomienda combinarla con ezetimiba | I | B |
| Se recomienda la politerapia con inhibidores de la PCSK9 en prevención secundaria para pacientes que no alcancen los objetivos con la dosis máxima tolerada de estatinas y ezetimiba | I | A |
| Se recomienda la politerapia con inhibidores de la PCSK9 para pacientes con muy alto riesgo y HF (con EA u otro factor de riesgo importante) que no alcancen los objetivos con la dosis máxima tolerada de estatinas y ezetimiba | I | C |
| Para las pacientes premenopáusicas que tengan intención de gestar o no utilicen métodos anticonceptivos adecuados, no se recomienda el tratamiento con estatinas | III | C |
| Recomendación sobre el tratamiento farmacológico de pacientes con hipertrigliceridemia | ||
| Se recomienda el tratamiento con estatinas como medicamento de primera elección para la reducción del riesgo de ECV de las personas con alto riesgo e hipertrigliceridemia (triglicéridos > 2,3mmol/l [200mg/dl]) | I | A |
| Recomendaciones sobre el tratamiento de las dislipemias en ancianos (edad ≥ 70 años) | ||
| Se recomienda el tratamiento con estatinas para los ancianos con EA de la misma forma que para los pacientes más jóvenes | I | A |
| Se recomienda iniciar el tratamiento con estatinas con una dosis baja si hay un deterioro renal significativo o son posibles interacciones medicamentosas | I | C |
| Recomendación sobre el tratamiento de las dislipemias en la diabetes mellitus | ||
| Para los pacientes con DM2 y muy alto riesgo (p. ej., con EA establecida o DOD grave), se recomienda intensificar el tratamiento hipolipemiante con un objetivo fundamentald de reducción del cLDL ≥ 50% y valores de cLDL < 1,4mmol/l (55 mg/dl)21,22,522,540,541 | I | A |
| Para los pacientes menores de 40 años con DM2 y alto riesgo, se recomienda el tratamiento hipolipemiante con un objetivo fundamental de reducción del cLDL ≥ 50% y cifras de cLDL < 1,8mmol/l (70 mg/dl) | I | A |
| Recomendaciones sobre el tratamiento lipídico para pacientes con enfermedad renal crónica moderada-grave (estadios 3-5 de laKidney Disease Outcomes Quality Initiative) | ||
| Para pacientes con ERC en estadios 3-5 sin diálisis diaria, se recomienda el tratamiento con estatinas o combinado de estatinas-ezetimiba | I | A |
| Para los pacientes con ERC en diálisis sin EA, no se recomienda iniciar el tratamiento con estatinas | III | A |
| Recomendaciones sobre el tratamiento clínico de la hipertensión | ||
| Clasificación de la PA | ||
| Se recomienda la clasificación de la PA en óptima, normal y normal-alta, o grados 1-3 de hipertensión, según la PA en consulta | I | C |
| Diagnóstico de hipertensión | ||
| Se recomienda basar el diagnóstico de hipertensión en: | ||
| Determinaciones de PA repetidas en consulta, en más de una cita, excepto cuando la hipertensión sea grave (p. ej., grado 3, sobre todo en pacientes con alto riesgo) o | I | C |
| PA fuera de consulta con MAPA o AMPA cuando sea posible | I | C |
| Evaluación del daño orgánico mediado por hipertensión | ||
| Para todos los pacientes, se recomienda la determinación de la creatinina sérica, la TFGe, los electrolitos y el cociente albúmina/creatinina para evaluar la presencia de daño orgánico mediado por hipertensión. Para los pacientes con alteraciones electrocardiográficas y signos/síntomas de disfunción del VI, se recomienda un ECG de 12 derivaciones y ecocardiografía. Para los pacientes con hipertensión de grados 2 o 3 y todo paciente hipertenso con DM, se recomienda una oftalmoscopia o pruebas de imagen retinianas | I | B |
| Parámetros para el inicio del tratamiento hipotensor | ||
| Se recomienda iniciar el tratamiento según el riesgo de ECV absoluto, la estimación de los beneficios de por vida y la presencia de daño orgánico mediado por hipertensión para la hipertensión grado 1 | I | C |
| Se recomienda el tratamiento farmacológico para los pacientes con hipertensión de grado ≥ 2 | I | A |
| Objetivos de PA en consulta | ||
| Para todos los pacientes, se recomienda que el primer objetivo terapéutico sea disminuir la PA a < 140/90mmHg y luego ajustar los objetivos según la edad y las comorbilidades específicas | I | A |
| Para la mayoría de los pacientes de 18-69 años con tratamiento, se recomienda un objetivo fundamental en el intervalo de 120-130mmHg | I | A |
| Para para los pacientes de edad ≥ 70 años en tratamiento, se recomienda un objetivo de PAS < 140 e incluso < 130 si se tolera | I | A |
| Para todos los pacientes en tratamiento, se recomienda reducir la PAD a < 80mmHg | I | A |
| Tratamiento de la hipertensión: intervenciones en el estilo de vida | ||
| Para toda persona con PA normal-alta o superior, se recomiendan intervenciones en el estilo de vida | I | A |
| Tratamiento de la hipertensión: fármacos | ||
| Para la mayoría de los pacientes, se recomienda iniciar el tratamiento antihipertensivo con una combinación de 2 fármacos, preferiblemente en un único comprimido. Las excepciones son los pacientes frágiles o de edad avanzada y aquellos con hipertensión de grado 1 y bajo riesgo (especialmente con PAS < 150mmHg) | I | A |
| Se recomienda que las combinaciones preferibles incluyan un bloqueador del SRA (p. ej., un IECA o ARA-II) con un BCC o un diurético, pero se pueden utilizar otras combinaciones de los 5 grandes grupos (IECA o ARA-II, bloqueadores beta, BCC, tiacidas o un diurético tiacídico | I | A |
| Si no se logra controlar la PA con tratamiento combinado se recomienda, se recomienda instaurar el tratamiento triple, generalmente un bloqueador del SRA con un BCC y un diurético, preferiblemente combinados en un único comprimido | I | A |
| Si no se logra controlar la PA con tratamiento triple, se recomienda añadir espironolactona al tratamiento o, si no se tolera, otros diuréticos como amilorida o dosis más altas de otros diuréticos, un bloqueador alfa o un bloqueador beta o clonidina | I | B |
| No se recomienda la combinación de 2 bloqueadores del SRA | III | A |
| Recomendaciones sobre el tratamiento de pacientes con diabetes mellitus | ||
| Estilo de vida | ||
| Se recomiendan cambios en el estilo de vida que incluyan la deshabituación tabáquica, una dieta baja en grasas saturadas y alta en fibras, AF aeróbica y entrenamiento de fuerza | I | A |
| Se recomienda reducir la ingesta energética para contribuir a la pérdida de peso o prevenir la ganancia de peso lenta | I | A |
| Objetivos glucémicos | ||
| Para la mayoría de los adultos con DM2 o DM2, se recomienda un objetivo de HbA1c < 0,7% (53mmol/mol) para reducir el riesgo de ECV y complicaciones microvasculares | I | A |
| Tratamiento de la hiperglucemia y la EA/los riesgos cardiorrenales | ||
| Para la mayoría de los pacientes sin antecedentes de EA, ERC o IC, se recomienda la metformina como tratamiento de primera línea tras evaluar la función renal | I | B |
| Se recomienda el tratamiento con un aGLP-2 o un iSGLT2 con resultados probados para reducir el riesgo cardiovascular y los eventos cardiorrenales en pacientes con DM2 y EA | I | A |
| Para los pacientes con DM2 y ERC, se recomienda el tratamiento con un iSGLT2 para mejorar los eventos cardiovascular y cardiorrenales | I | A |
| Para los pacientes con DM2 e IC-FEr, se recomienda el tratamiento con un iSGLT2 con demostrado beneficio en los resultados para disminuir las hospitalizaciones por IC y la muerte cardiovascular | I | A |
| Recomendaciones sobre el tratamiento antitrombótico | ||
| Para la prevención secundaria de la ECV, se recomienda AAS 75-100 mg/día | I | A |
| Se recomienda clopidogrel 75 mg/día en prevención secundaria como alternativa al AAS en caso de intolerancia a este | I | B |
| Para los pacientes en tratamiento antiagregante plaquetario con alto riesgo de hemorragia gastrointestinal, se recomienda el tratamiento concomitante con un inhibidor de la bomba de protones | I | B |
| Para los pacientes con riesgo cardiovascular bajo-moderado, no se recomienda el tratamiento antiagregante plaquetario debido al aumento del riesgo de hemorragia grave | III | A |
| Recomendaciones sobre rehabilitación cardiaca | ||
| Para los pacientes que han sufrido eventos de EA y revascularización y los pacientes con IC (principalmente IC-FEr), se recomienda la participación en una rehabilitación cardiaca basada en el ejercicio, estructurada, integral y multidisciplinaria para mejorar los resultados | I | A |
| Recomendación sobre políticas de intervención poblacionales | ||
| Se recomienda implementar medidas para reducir la contaminación atmosférica, la emisión de partículas y contaminantes gaseosos y el consumo de combustibles fósiles y limitar las emisiones de dióxido de carbono para reducir la mortalidad y la morbilidad por ECV | I | C |
| Recomendaciones para pacientes con enfermedad coronaria | ||
| Para los pacientes con infarto de miocardio o revascularización previos, se recomienda AAS 75-100 mg/día | I | A |
| Para los pacientes con SCA, se recomienda añadir al AAS un inhibidor del P2Y12 durante 12 meses, a no ser que haya contraindicaciones como riesgo hemorrágico excesivo | I | A |
| Para los pacientes con síndromes coronarios crónicos tras endoprótesis coronaria, independientemente del tipo de endoprótesis, se recomienda añadir al AAS clopidogrel 75 mg/día durante 6 meses, a no ser que esté indicada una pauta más corta (1-3 meses) debido al riesgo de hemorragia mortal | I | A |
| Se recomiendan los IECA (o ARA-II) si el paciente presenta otras enfermedades (como IC, hipertensión o DM) | I | A |
| Se recomiendan los bloqueadores beta para los pacientes con disfunción del VI o IC sistólica | I | A |
| Para los pacientes con EA establecida, se recomienda el tratamiento hipolipemiante oral con un objetivo fundamental de cLDL < 1,4mmol/l (55mg/dl) y una reducción ≥ 50% de los valores basales de cLDL | I | A |
| Recomendaciones sobre intervenciones farmacológicas y no farmacológicas para pacientes sintomáticos (NYHA II-IV) con insuficiencia cardiaca y fracción de eyección reducida (< 40%) con demostrado beneficio en desenlaces clínicos como la morbilidad y la mortalidad cardiovasculares | ||
| Para todo paciente con IC se recomienda un programa de RC integral para reducir el riesgo de hospitalización por IC y muerte | I | A |
| Para los pacientes sintomáticos estables con IF-FEr, se recomiendan la RC basada en ejercicio para reducir el riesgo de hospitalización por IC y muerte | I | A |
| Para los pacientes con IC, se recomienda el cribado de comorbilidades cardiovasculares y no cardiovasculares que, de hallarse, habría que tratar si existe un tratamiento seguro y efectivo, no solo para aliviar los síntomas, sino también para mejorar el pronóstico | I | A |
| Para los pacientes con IC-FEr sintomática, se recomienda añadir un IECA a un bloqueador beta o un ARM para reducir el riesgo de hospitalización por IC y muerte | I | A |
| Para los pacientes con IC-FEr sintomática, se recomienda añadir un bloqueador beta a un IECA (o un INRA) y un ARM para reducir el riesgo de hospitalización por IC y muerte | I | A |
| Para los pacientes con IC-FEr tratados con un IECA (o un INRA) y un bloqueador beta, se recomienda un ARM para reducir el riesgo de hospitalización por IC y muerte | I | A |
| Para los pacientes con IC-FEr, se recomienda el sacubitrilo-valsartán como sustituto de un IECA para reducir el riesgo de hospitalización por IC y muerte | I | B |
| Para los pacientes sintomáticos con IC-FEr que no toleren un IECA o un INRA, se recomienda un ARA-II para reducir el riesgo de hospitalización por IC o muerte CV (también se debe prescribir un bloqueador beta y un ARM) | I | B |
| Para los pacientes con IC-FEr, se recomiendan dapagliflozina o empagliflozina, además del tratamiento óptimo con un IECA (o un INRA), un bloqueador beta y un ARM, para reducir el riesgo de hospitalización por IC y muerte | I | A |
| Para los pacientes con IC-FEr y signos/síntomas de congestión, se recomiendan los diuréticos para reducir el riesgo de hospitalización por IC | I | C |
| Recomendaciones para pacientes con enfermedad cerebrovascular | ||
| Para los pacientes con un evento cerebrovascular, se recomienda mejorar los factores del estilo de vida, además del tratamiento farmacológico adecuado | I | A |
| Para los pacientes con ictus isquémico o AIT, se recomienda la prevención con antitrombóticos. La elección del antitrombótico dependerá del mecanismo del evento. Para los pacientes con ictus isquémico o AIT no cardioembólico, se recomienda el tratamiento con antiagregantes plaquetarios; para aquellos con ictus isquémico o AIT cardioembolítico, se recomienda el tratamiento con anticoagulantes | I | A |
| Para los pacientes con ictus isquémico o AIT no cardioembólico, se recomienda la prevención con AAS en monoterapia o dipiridamol+AAS o clopidogrel solo | I | A |
| Para los pacientes con ictus o AIT con PA de 140/90 o superior, se recomienda reducir la PA | I | A |
| Recomendaciones para pacientes con enfermedad arterial de las extremidades inferiores: tratamiento médico óptimo | ||
| Se recomienda la deshabituación tabáquica para todo paciente con EAEI | I | B |
| Se recomienda una dieta saludable y valores óptimos de PA para todo paciente con EAEI | I | C |
| Para los pacientes con claudicación intermitente: | ||
| Se recomienda ejercicio de entrenamiento supervisado | I | A |
| Se recomienda ejercicio de entrenamiento no supervisado cuando la supervisión no sea posible o no esté disponible | I | C |
| Para los pacientes con EAEI sintomática, se recomienda tratamiento antiagregante plaquetario | I | C |
| Para los pacientes con EAEI e hipertensión, se recomienda reducir la PA a < 140/90mmHg | I | A |
| Para todos los pacientes diabéticos con EAEI, se recomienda el control glucémico estricto | I | A |
| Recomendaciones para pacientes con enfermedad renal crónica: tratamiento médico óptimo | ||
| Para los pacientes diabéticos con hipertensión y albuminuria, se recomienda el tratamiento con un IECA o un ARA-II. Estos fármacos deben ajustarse progresivamente hasta la dosis máxima tolerada | I | B |
| No se recomienda la politerapia con IECA y ARA-II | I | C |
| Recomendaciones sobre intervenciones en el estilo de vida y tratamiento de los factores de riesgo y las enfermedades concomitantes en pacientes con fibrilación auricular | ||
| Se recomienda identificar y tratar los factores de riesgo y las enfermedades concomitantes como parte integral del tratamiento | I | B |
| Se recomienda modificar los estilos de vida poco saludables y el tratamiento dirigido de las enfermedades intercurrentes para reducir la carga de FA y la gravedad de los síntomas | I | B |
| Se recomienda prestar atención al buen control de la PA de los pacientes con FA e hipertensión para reducir las recurrencias de FA y los riesgos de ictus y de hemorragias | I | B |
AF: actividad física; aGLP-1: agonistas del péptido similar al glucagón tipo 1 (GLP-1); AIT: accidente isquémico transitorio; AMPA: automedición domiciliaria de la presión arterial; ARA-II: antagonistas del receptor de angiotensina II; ARM: antagonista del receptor de mineralocorticoides; BCC: bloqueador de los canales del calcio; CAC: calcio coronario; cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; DOD: daño de órgano diana; EA: enfermedad ateroesclerótica; EAEI: enfermedad arterial de las extremidades inferiores; ECG: electrocardiograma; ECV: enfermedad cardiovascular; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FA: fibrilación auricular; HbA1c: glucohemoglobina; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; IECA: inhibidores de la enzima de conversión de la angiotensina; INRA: inhibidor de la neprilisina y del receptor de la angiotensina; IRSN: inhibidores selectivos de la recaptación de serotonina y norepinefrina; iSGLT2: inhibidores del cotransportador 2 de sodio y glucosa; ISRS: inhibidores selectivos de la recaptación de serotonina; MAPA: monitorización ambulatoria de la presión arterial; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PCSK9: proproteína convertasa subtilisina/kexina tipo 9; RC: rehabilitación cardiaca; SCA: síndrome coronario agudo; SCORE2: Systematic Coronary Risk Estimation 2; SCORE2-OP: Systematic Coronary Risk Estimation 2-Older Persons; SRA: sistema renina-angiotensina; TAPD: tratamiento antiagregante plaquetario doble; TFGe: tasa de filtrado glomerular estimada; VI: ventrículo izquierdo.a Clase de recomendación.b Nivel de evidencia.
10INDICADORES DE CALIDADLos indicadores de calidad son instrumentos que sirven para evaluar la calidad del tratamiento, incluidos los procesos y los desenlaces clínicos730. También se pueden utilizar para mejorar la adherencia a las recomendaciones propuestas en las GPC a través de los esfuerzos y la evaluación comparativa de los profesionales de la salud831. Por ello, el papel de los indicadores de calidad en la mejora de la calidad está cada vez más reconocido y atrae el interés de las autoridades sanitarias, las organizaciones profesionales, los clientes y la población general832.
La ESC reconoce la necesidad de medir e informar sobre la calidad y los resultados de la atención cardiovascular, lo que ha llevado al desarrollo y la implementación de indicadores de calidad para la ECV. La metodología de desarrollo de los indicadores de calidad de la ESC está publicada832 y, hasta la fecha, se ha producido un grupo de indicadores de calidad para la evaluación inicial de las ECV833,834. Para facilitar mejoras en la calidad de las iniciativas, los indicadores de calidad de la ESC específicos para cada enfermedad se incluyen en las GPC de la ESC correspondientes215,680. Este proceso, además, está respaldado por la integración en el EORP (EURObservational Research Programme) y en el proyecto EuroHeart (European Unified Registries On Heart Care Evaluation and Randomized Trials)835.
Los indicadores de calidad para la prevención de la ECV están disponibles para cada enfermedad específica, como el tratamiento de la PA elevada836 y los lípidos en prevención secundaria837. Sin embargo, no existe un conjunto de indicadores de calidad general que englobe la profundidad de la prevención de la ECV. Este conjunto de indicadores de calidad debe evaluar la adopción de las recomendaciones de esta GPC y la adherencia a ellas, y podría aplicarse retrospectivamente para evaluar la calidad de los cuidados basados en la evidencia. Por lo tanto, y siguiendo otras GPC de la ESC, se inició el desarrollo y la definición de indicadores de calidad para la prevención de la ECV durante la redacción del presente documento y los resultados se publicarán en un documento aparte.
11MATERIAL ADICIONALEl material adicional con tablas, figuras y texto que complementan el texto principal solo están disponibles en inglés en las páginas web de European Heart Journal y la ESC (www.escardio.org/guidelines).
12INFORMACIÓN SOBRE LOS AUTORESFiliaciones de los autores/miembros del grupo de trabajo: Yvo M. Smulders, Internal Medicine, Amsterdam University Medical Center, Ámsterdam, Países Bajos; David Carballo, Cardiology, Geneva University Hospitals, Ginebra, Suiza; Konstantinos C.Koskinas, Cardiology, Bern University Hospital -INSELSPITAL, Berna, Suiza; Maria Bäck, Unit of Physiotherapy, Department of Health, Medicine and Caring Sciences, Linköping University, Linköping, Suecia, y Department of Molecular and Clinical Medicine, Institute of Medicine, Sahlgrenska Academy, University of Gothenburg, y Sahlgrenska University Hospital, Gotemburgo, Suecia; Athanase Benetos, Geriatric Department CHRU de Nancy and ISERM DCAC, Université de Lorraine, Nancy, Francia; Alessandro Biffi, Cardiology, FIMS y EFSMA, Roma, Italia; José Manuel Boavida, APDP-Diabetes Portugal, IDF-E International Diabetes Federation Europe, Lisboa, Portugal; Davide Capodanno, Cardiothoracic, Vascular and Transplants, Policlinico G. Rodolico-San Marco, University of Catania, Catania, Italia; Bernard Cosyns, Cardiology, Centrum voor Hart en vaatziekte (CHVZ) Universitair Ziekenhuis Brussel, Bruselas, Bélgica; Carolyn A. Crawford (Irlanda del Norte), ESC Patient Forum, Sophia Antipolis, Francia; Constantinos H. Davos, Cardiovascular Research Laboratory, Biomedical Research Foundation, Academy oAthens, Atenas, Grecia; Ileana Desormais, INSERM, Univ. Limoges, CHU Limoges, IRD, U1094 Tropical Neuroepidemiology, GEIST, Limoges, Francia; Emanuele Di Angelantonio, Department of Public Health and Primary Care, University of Cambridge, Cambridge, Reino Unido; Oscar H. Franco Duran, ISPM Institute of Social and Preventive Medicine, University of Bern, Berna, Suiza; Sigrun Halvorsen, Department of Cardiology, Oslo University Hospital Ullevaal, Oslo, Noruega; F.D. Richard Hobbs, NDPCHS, University of Oxford, Oxford, Reino Unido; Monika Hollander, Julius Center for Health Sciences and Primary Care, UMC Utrecht, Utrecht University, Utrecht, Países Bajos; Ewa A. Jankowska, Department of Heart Diseases, Wroclaw Medical University, Wroclaw, Polonia; Matthias Michal, Department of Psychosomatic Medicine and Psychotherapy, University Medical Center Mainz, Maguncia, Alemania; Simona Sacco, Department of Applied Clinical and Biotechnological Sciences, University of L’Aquila, L’Aquila, Italia; Naveed Sattar, Institute of Cardiovascular and Medical Sciences, University of Glasgow, Glasgow, Reino Unido; Lale Tokgozoglu, Cardiology, Hacettepe University, Ankara, Turquía; Serena Tonstad, Preventive Cardiology, Oslo University Hospital, Oslo, Noruega; Konstantinos P. Tsioufis, First Cardiology Clinic, Medical School, National and Kapodistrian University, Hippokration Hospital, Atenas, Grecia; Ineke van Dis, European Heart Network, Bruselas, Bélgica; Isabelle C. van Gelder, Cardiology, University of Groningen, University Medical Center Groningen, Gröningen, Países Bajos; Christoph Wanner, Department of Nephrology, University Würzburg, Alemania; Bryan Williams, Institute of Cardiovascular Science, University College London, Londres, Reino Unido.
13ANEXOESC Scientific Document Group
Incluye a los revisores del documento y las Sociedades de Cardiología de la ESC.
Revisores del documento: Guy De Backer (coordinador de la revisión de la GPC) (Bélgica), Vera Regitz-Zagrosek (coordinadora de la revisión de la GPC) (Alemania), Anne Hege Aamodt6 (Noruega), Magdy Abdelhamid (Egipto), Victor Aboyans (Francia), Christian Albus11 (Alemania), Riccardo Asteggiano (Italia), Magnus Bäck (Suecia), Michael A. Borger (Alemania), Carlos Brotons13 (España), Jelena Čelutkienè (Lituania), Renata Cifkova (República Checa), Maja Cikes (Croacia), Francesco Cosentino (Italia), Nikolaos Dagres (Alemania), Tine De Backer (Bélgica), Dirk De Bacquer (Bélgica), Victoria Delgado (Países Bajos), Hester Den Ruijter (Países Bajos), Paul Dendale (Bélgica), Heinz Drexel (Austria), Volkmar Falk (Alemania), Laurent Fauchier (Francia), Brian A. Ference (Reino Unido), Jean Ferrières (Francia), Marc Ferrini (Francia), Miles Fisher1 (Reino Unido), Danilo Fliser4 (Alemania), Zlatko Fras (Eslovenia), Dan Gaita3 (Rumanía), Simona Giampaoli (Italia), Stephan Gielen (Alemania), Ian Graham (Irlanda), Catriona Jennings (Irlanda), Torben Jorgensen (Dinamarca), Alexandra Kautzky-Willer12 (Austria), Maryam Kavousi (Países Bajos), Wolfgang Koenig (Alemania), Aleksandra Konradi (Rusia), Dipak Kotecha (Reino Unido), Ulf Landmesser (Alemania), Madalena Lettino (Italia), Basil S. Lewis (Israel), Aleš Linhart (República Checa), Maja-Lisa Løchen (Noruega), Konstantinos Makrilakis9 (Grecia), Giuseppe Mancia5 (Italia), Pedro Marques-Vidal (Suiza), John William McEvoy (Irlanda), Paul McGreavy (Reino Unido), Bela Merkely (Hungría), Lis Neubeck (Reino Unido), Jens Cosedis Nielsen (Dinamarca), Joep Perk (Suecia), Steffen E. Petersen (Reino Unido), Anna Sonia Petronio (Italia), Massimo Piepoli (Italia), Nana Goar Pogosova (Rusia), Eva Irene Bossano Prescott (Dinamarca), Kausik K. Ray2 (Reino Unido), Zeljko Reiner (Croacia), Dimitrios J. Richter (Grecia), Lars Rydén (Suecia), Evgeny Shlyakhto (Rusia), Marta Sitges (España), Miguel Sousa-Uva (Portugal), Isabella Sudano (Suiza), Monica Tiberi7,10 (Italia), Rhian M. Touyz (Reino Unido), Andrea Ungar8 (Italia), W.M. Monique Verschuren (Países Bajos), Olov Wiklund (Suecia), David Wood (Reino Unido/Irlanda) y José Luis Zamorano (España).
14Sociedades de Cardiología de la ESC que han participado activamente en el proceso de revisión de la GPC de la ESC 2021 sobre prevención de las ECVArgelia:Algerian Society of Cardiology, Naima Hammoudi; Armenia:Armenian Cardiologists Association, Parounak Zelveian; Austria:Austrian Society of Cardiology, Peter Siostrzonek; Azerbaiyán:Azerbaijan Society of Cardiology, Elman Alakbarov; Bielorrusia:Belorussian Scientific Society of Cardiologists, Olga Plavova; Bélgica:Belgian Society of Cardiology, Jonathan De Suttter; Bosnia y Herzegovina:Association of Cardiologists of Bosnia and Herzegovina, Mirza Dilíc; Bulgaria:Bulgarian Society of Cardiology, Nina Gotcheva; Croacia:Croatian Cardiac Society, Cardiology, Bosko Skoric; Chipre:Cyprus Society of Cardiology, Hera Heracleous Moustra; República Checa:Czech Society of Cardiology, Renata Cifkova; Dinamarca:Danish Society of Cardiology, Ann Bovin; Egipto:Egyptian Society of Cardiology, Bassem Zarif; Estonia:Estonian Society of Cardiology, Margus Viigimaa; Finlandia:Finnish Cardiac Society, mma-Mari Hekkala; Francia:French Society of Cardiology, Serge Kownator; Georgia:Georgian Society of Cardiology, Zurab, Pagava; Alemania:German Cardiac Society, Ulf Landmesser; Grecia:Hellenic Society of Cardiology, Harry Grassos; Hungría:Hungarian Society of Cardiology, Eszter Szabados; Islandia:Icelandic Society of Cardiology, Karl Andersen; Irlanda:Irish Cardiac Society, John William McEvoy; Israel:Israel Heart Society, Barak Zafrir; Italia:Italian Federation of Cardiology, Francesco Barillà; Kosovo (República de):Kosovo Society of Cardiology, Pranvera Ibrahimi; Kirguistán:Kyrgyz Society of Cardiology, Erkin Mirrakhimov; Letonia:Latvian Society of Cardiology, Iveta Mintale; Líbano:Lebanese Society of Cardiology, Samir Arnaout; Lituania:Lithuanian Society of Cardiology, Rimvydas Šlapikas; Luxemburgo:Luxembourg Society of Cardiology, Cristiana Banu; Malta:Maltese Cardiac Society, Mark Abela; Moldavia (República de):Moldavian Society of Cardiology, Victor Rudi; Montenegro:Montenegro Society of Cardiology, Aneta Boskovic; Marruecos:Moroccan Society of Cardiology, Mohamed Alami; Países Bajos:Netherlands Society of Cardiology, Hareld M.C. Kemps; Macedonia del Norte:North Macedonian Society of Cardiology, Marijan Bosevski; Noruega:Norwegian Society of Cardiology, Erik Ekker Solberg; Polonia:Polish Cardiac Society, Tomasz Zdrojewski; Portugal:Portuguese Society of Cardiology, Carlos Rabaçal; Rumanía:Romanian Society of Cardiology, Dan Gaita; Federación Rusa:Russian Society of Cardiology, Yury Belenkov; San Marino:San Marino Society of Cardiology, Luca Bertelli; Serbia:Cardiology Society of Serbia, Vojislav Giga; Eslovaquia:Slovak Society of Cardiology, Daniel Pella; Eslovenia:Slovenian Society of Cardiology, Zlatko Fras; España: Sociedad Española de Cardiología, Regina Dalmau; Suecia:Swedish Society of Cardiology, Anna Kiessling; Suiza:Swiss Society of Cardiology, Otmar Pfister; República Árabe Siria:Syrian Cardiovascular Association, Yassin Bani Marjeh; Túnez:Tunisian Society of Cardiology and Cardio-Vascular Surgery, Salem Abdessalem; Turquía:Turkish Society of Cardiology, Oner Ozdoganzun; Ucrania:Ukrainian Association of Cardiology, Elena Nesukay; Reino Unido:British Cardiovascular Society, Riyaz Patel; Uzbequistán:Association of Cardiologists of Uzbekistan, Guzal Mullabayeva.
15Comité de la ESC para las Guías de Práctica ClínicaColin Baignet (coordinador) (Reino Unido), Magdy Abdelhamid (Egipto), Victor Aboyans (Francia), Sotiris Antoniou (Estados Unidos), Elena Arbelo (España), Riccardo Asteggiano (Italia), Andreas Baumbach (Reino Unido), Michael A. Borger (Alemania), Jelena Ćelutkienè (Lituania), Maja Cikes (Croacia), Jean-Philippe Collet (Francia), Volkmar Falk (Alemania), Laurent Fauchier (Francia), Chris P. Gale (Reino Unido), Sigrun Halvorsen (Noruega), Bernard lung (Francia), Tiny Jaarsma (Suecia), Aleksandra Konradi (Rusia), Kontastinos C. Koskinas (Suiza), Dipak Kotecha (Reino Unido), Ulf Landmesser (Alemania), Basil. S. Lewis (Isareal), Aleš Linhart (República Checa), Maja-Lisa Løchen (Noruega), Jens Cosedis Nielsen (Dinamarca), Steffen E. Petersen (Reino Unido), Eva Irene Bossano Prescott (Dinamarca), Amina Rakisheva (Kazajistán), Marta Sitges (España) y Rhian M. Touyz (Reino Unido).
.Ambos representantes del Grupo de Trabajo contribuyeron por igual en el documento.La lista de miembros del Comité de la ESC para la elaboración de Guías de Práctica Clínica y los revisores de las sociedades nacionales se recogen en el anexo.Entidades de la ESC que han participado en la elaboración de este documento:Asociaciones: Association of Cardiovascular Nursing and Allied Professions (ACNAP), European Association of Cardiovascular Imaging (EACVI), European Association of Preventive Cardiology (EAPC), European Heart Rhythm Association (EHRA) y Heart Failure Association (HFA).Consejos: Council on Valvular Heart Disease.Grupos de Trabajo: Aorta and Peripheral Vascular Diseases, Atherosclerosis and Vascular Biology y Cardiovascular Pharmacotherapy.El contenido de esta guía de práctica clínica (GPC) de la ESC se publica exclusivamente para uso personal y educativo. No se autoriza su uso comercial. No se autoriza la traducción o reproducción de ningún fragmento de esta guía sin la autorización escrita de la ESC. La autorización se solicitará por escrito a Oxford University Press, editorial de European Heart Journal, o a los representantes autorizados de la ESC (journals.permissions@oxfordjournals.org).Descargo de responsabilidad. Esta guía recoge la opinión de la ESC y se ha elaborado tras el estudio minucioso del conocimiento científico y médico y la evidencia disponible hasta la fecha. La ESC no es responsable en caso de que exista alguna contradicción, discrepancia o ambigüedad entre la GPC de la ESC y cualquier otra recomendación oficial o GPC publicada por autoridades relevantes de la sanidad pública, particularmente en lo que se refiere al buen uso de la atención sanitaria y las estrategias terapéuticas. Se espera que los profesionales de la salud tengan en consideración esta GPC a la hora de tomar decisiones clínicas, así como al implementar estrategias médicas preventivas, diagnósticas o terapéuticas. No obstante, esta guía no anula la responsabilidad individual de cada profesional al tomar las decisiones oportunas relativas a cada paciente, de acuerdo con dicho paciente y, cuando fuera necesario, su tutor o representante legal. Además, las GPC de la ESC no eximen al profesional médico de su obligación ética y profesional de consultar y considerar atentamente las recomendaciones y las GPC actualizadas emitidas por autoridades sanitarias competentes. Es también responsabilidad del profesional verificar la normativa y la legislación sobre fármacos y dispositivos médicos a la hora de prescribirlos.Todos los expertos que han participado en el desarrollo de esta guía han firmado declaraciones de conflicto de intereses. Estas se han recogido y publicado en un documento adicional a la guía. El documento también está disponible en la página web de la ESC www.escardio.org/guidelines.© The European Society of Cardiology 2021. Reservados todos los derechos. Para la solicitud de autorizaciones, contacte con: journals.permissions@oup.com.Sociedades colaboradoras y que respaldan el documento: 1European Association for the Study of Diabetes (EASD); 2European Atherosclerosis Society (EAS); 3European Heart Network (EHN); 4European Renal Association - European Dialysis and Transplant Association (ERA-EDTA); 5European Society of Hypertension (ESH); 6European Stroke Organization (ESO); 7European Federation of Sports Medicine Association (EFSMA); 8European Geriatric Medicine Society (EuGMS); 9International Diabetes Federation Europe (IDF Europe); 10International Federation of Sport Medicine (FIMS); 11International Society of Behavioural Medicine (ISBM); 12International Society of Gender Medicine (IGM); 13World Organization of National Colleges, Academies and Academic Associations of General Practitioners/Family Physicians (WONCA) - EuropaPalabras clave:Guías de práctica clínica • Prevención • Personalizado • Población • Estimación del riesgo • Riesgo de por vida • Beneficios de por vida • Gestión del riesgo • Toma de decisiones conjunta • Enfoque gradual • Nutrición • Tabaquismo • Estilo de vida saludable • Factores psicosociales • Presión arterial • Lípidos • Diabetes • Tabaquismo • Contaminación atmosférica • Cambio climático.