INTRODUCCIÓN
En los últimos años del siglo XX la cardiología ha redescubierto la fibrilación auricular (FA). Las arritmias ventriculares son tratadas con éxito con el desfibrilador implantable, las taquicardias por vías accesorias e intranodales y el mismo flúter auricular pueden ser eliminados con radiofrecuencia aplicada con catéteres, con lo que la FA se convierte en la última frontera de las arritmias. Además, la FA representa un enorme mercado potencial, lo que atrae muchos recursos hacia su investigación. Nuevos fármacos, marcapasos, desfibriladores y métodos de ablación lineal o focal son desarrollados continuamente, pero el éxito parece esquivo o cuanto menos parcial. Cada paso plantea más preguntas de las que responde y hay una cierta confusión conceptual. Resulta oportuno volver a la base del problema y empezar por preguntarse qué sabemos de la FA.
EL MECANISMO DE ACTIVACIÓN EN LA FIBRILACIÓN AURICULAR
La definición de FA depende hoy por hoy sólo del electrocardiograma (ECG); se denomina FA a un patrón continuo e irregular de ondas auriculares. El mecanismo no ha sido estudiado en humanos y dependemos de modelos animales y matemáticos para su comprensión. Cada vez parece más probable que pronto tendremos que dividir la FA en varios tipos de arritmia con mecanismos y sustratos diferentes.
La reentrada por múltiples ondas
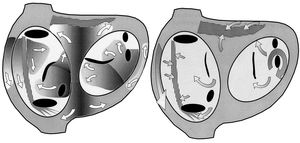
Los estudios experimentales y modelos informáticos diseñados por Moe hace 40 años 1, y confirmados por los estudios de cartografía de Allessie 2, son todavía la base para aceptar la reentrada con múltiples frentes simultáneos (multiple wavelets) como el mecanismo de la FA. Todo el miocardio auricular participa en el mantenimiento de frentes simultáneos de activación que continuamente giran, se dividen, se fusionan o se extinguen (fig. 1A). Un circuito simple de reentrada, como el flúter, se estabiliza por un obstáculo central, sea orgánico o funcional y el mantenimiento de la activación depende de la longitud de onda (período refractario ´ velocidad de conducción) y del tamaño del circuito3,4. En la FA la presencia de múltiples frentes añade una complejidad mucho mayor. No hay estabilidad en torno a ningún obstáculo, sino que cada onda de activación condiciona el curso de las que la suceden, alterando la refractariedad y la velocidad de conducción o creando transitoriamente obstáculos funcionales. La FA se mantiene en función de la probabilidad de que en cada momento se forme un número de nuevos frentes igual o mayor que el que se extingue; es un proceso caótico, en el sentido de estar determinado por múltiples factores en una lógica no lineal 5. La formulación matemática y la construcción de modelos informáticos del proceso fibrilatorio necesitará utilizar programas de análisis de elementos finitos, capaces de computar la interacción de múltiples variables, incluyendo geometría real, a lo largo del proceso.
Fig. 1A. Representación esquemática de la fibrilación auricular por reentrada múltiple. Las aurículas se representan en una visión oblicua anterior izquierda. El endocardio se representa punteado, dentro de los anillos tricúspide (izquierda) y mitral. Se representan los orificios de las venas cavas, seno coronario y venas pulmonares izquierdas como orientación. Las zonas sombreadas representan frentes («ondas») de activación que progresan en la dirección de las flechas, dejando tras de sí una zona de refracteriedad (oscuro). Hay zonas de bloqueo funcional (líneas negras) que obligan a girar a los frentes. El haz de Bachmann y la cresta terminal (rayado) pueden ser obstáculo a la conducción en sentido transversal.
LA ACTIVACIÓN EN ESPIRAL
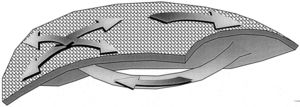
La activación en espiral o rotor (vortex) es un interesante desarrollo teórico del mecanismo de reentrada, al que ha contribuido de modo importante el grupo de Jalife 6. La activación gira como un remolino, sin un obstáculo central, debido a una menor excitabilidad en su centro de giro que hace la conducción más lenta que en la periferia (fig. 2) y puede producirse en medios homogéneos, en contraste con la necesidad de una dispersión de la refractariedad para la reentrada por ondas múltiples de Moe 1. Un patrón irregular en el ECG podría ser producido por múltiples rotores simultáneos o por un rotor único con centro de giro migratorio 7. El modelo espiral puede ayudar a entender algunos efectos de los fármacos antiarrítmicos debidos a la depresión de la excitabilidad y no a cambios del período refractario 8.
Fig. 2. Esquema de un rotor de activación reentrante espiral. Las flechas marcan el progreso del frente de activación. La velocidad de giro es inferior en el centro porque aquí se encuentra una zona de baja excitabilidad provocada por el anterior paso de la activación (zona oscura). No hay ningún obstáculo central, anatómico ni funcional.
Reentrada tridimensional
En la hipótesis clásica de las múltiples ondas se considera que todo el grosor del miocardio auricular se activa simultáneamente, de modo que los frentes de activación se mueven e interaccionan en sólo dos dimensiones 1; sin embargo, la realidad parece más compleja. En las cartografías epicárdicas de FA se han encontrado patrones de activación centrífuga radial, aparentemente focal 2,9, que se explican como la emergencia de frentes de activación profundos, no detectables desde la superficie epicárdica. En la aurícula derecha la estructura endocárdica de los músculos pectíneos puede ser una vía para esta activación reentrante en profundidad 10 (fig. 3). En la aurícula izquierda se ha descrito una estructura miocárdica compuesta por varias capas celulares con distinta orientación espacial 11 que potencialmente pudiera también dar origen a circuitos de reentrada tridimensionales. Esta tercera dimensión de la reentrada auricular es otro factor a tener en cuenta a la hora de diseñar estrategias de ablación en líneas o compartimentación.
Fig. 3. Esquema representativo de reentrada tridimensional utilizando un músculo pectíneo de la aurícula derecha. La emergencia en superficie del frente de activación que llega por el músculo papilar muestra un patrón centrífugo radial, de apariencia focal.
Conducción fibrilatoria
En los trabajos iniciales sobre la inducción de FA con aconitina ya se describieron las diferencias entre conducción fibrilatoria y FA 12. La conducción fibrilatoria consiste en la conducción irregular, con trayectos cambiantes, de una activación regular cuyo ciclo de descarga es tan corto que no permite la recuperación completa del miocardio circundante (fig. 1B). El concepto es similar al de la conducción aberrante dependiente de la frecuencia. En apariencia es una fibrilación, pero cuando el foco desaparece la activación se interrumpe, porque hay un origen localizado de la activación. Por contra, la FA es un proceso autosostenido que, aunque haya sido desencadenado por una descarga focal, persiste al hacer desaparecer el foco iniciador. Recientemente se ha demostrado conducción fibrilatoria en modelos experimentales de reentrada focal (microrreentrada)13, y en estudios de FA experimental el grupo de Jalife 14 ha descrito rotores localizados en la aurícula izquierda como origen de activación irregular del resto del miocardio auricular. Estos hallazgos reflejan la necesidad de no considerar un solo mecanismo para el ECG de FA, abren la puerta a una mejor comprensión de los efectos de los fármacos antiarrítmicos y quizá puedan llevar al diseño de intervenciones de ablación más localizadas y más efectivas.
Clasificación de la fibrilación auricularpor cartografía local
La demostración de reentrada tridimensional y de actividad focal con conducción fibrilatoria subraya la cautela necesaria para la interpretación de estudios basados en la cartografía localizada a una porción determinada de las aurículas, especialmente la derecha 9,15,16. De estos estudios han emanado clasificaciones de la FA basándose en su complejidad local, cuya significación debe cuestionarse, ya que no se descarta conducción fibrilatoria y, en cualquier caso, parece que la aurícula izquierda es más importante para el proceso fibrilatorio 17. Recientemente se han desarrollado sistemas de cartografía sin contacto directo con el endocardio 18, capaces de registrar continuamente la activación de una cámara cardíaca completa cuya aplicación al estudio de la FA podrá arrojar datos de interés.
SUSTRATO Y REMODELADO
Remodelado eléctrico en la fibrilación auricular
En un experimento reciente el grupo de Allesie ha demostrado que en cabras normales la estimulación rápida no produce FA, pero si se mantiene la estimulación rápida durante días o semanas, un 80% de los animales desarrolla FA, que en la mayoría es permanente 19. Este proceso de hacer las aurículas vulnerables a FA se ha llamado remodelado y se ha resumido en la frase «atrial fibrillation begets atrial fibrillation» (la FA lleva a FA). El principal cambio observado es un acortamiento del período refractario con pérdida de su adaptación a la frecuencia, que es reversible al interrumpir la FA. Estudios posteriores demostraron que el remodelado incluye alteraciones estructurales 20, y de los canales iónicos de la membrana 21. A corto plazo se produce una dispersión de períodos refractarios que favorece la reentrada y a largo plazo también se altera la velocidad de conducción 22. Se atribuye una gran importancia a la sobrecarga de calcio en la génesis del remodelado 23. El remodelado ha dado nuevo impulso a la idea de la cardioversión precoz como medio para la prevención de la FA crónica y, de alguna manera, apoyó la creación del desfibrilador implantable auricular.
La dificultad de realizar experimentos de semanas de duración ha hecho que varios grupos estudien los efectos de la estimulación auricular rápida durante minutos 24-26, lo que han denominado también remodelado. Hay que ser muy cuidadoso a la hora de interpretar la bibliografía así generada, ya que se están tratando fenómenos distintos.
Sustratos anatómicos
No obstante, la historia clínica de la FA enseña que en la mayoría de los casos se inicia sin un precipitante reiterado, como el causante del remodelado eléctrico experimental, y estudios ya antiguos demostraron la presencia de sustratos anatómicos 27 y electrofisiológicos 28 estables. Estudios recientes del grupo de Nattel 29 han demostrado una sobrecarga hemodinámica crónica de la FA a través de fibrosis intersticial y alteración de la conducción, sin cambios en el período refractario. Los estudios biópsicos de Aimé-Sempé et al 30 apoyan la presencia de muerte celular y otras alteraciones en la FA humana en presencia de cardiopatía orgánica. La posible relación de los sustratos anatómicos con la susceptibilidad al remodelado eléctrico o con la aparición de iniciadores ( triggers) aún no está establecida.
ORIGEN FOCAL DE LA FIBRILACIÓN AURICULAR
Haïssaguerre et al fueron los primeros en describir casos de FA paroxística debidos a descargas focales repetitivas desde las venas pulmonares, que podían ser curados por medio de la ablación del foco de origen 31. Otros autores han descrito focos fuera de las venas pulmonares, incluyendo la cava superior, el seno coronario o la pared libre auricular 32. El estudio anatómico de las venas pulmonares ha demostrado la presencia de manguitos de miocardio que se extienden en una longitud variable, especialmente en las venas pulmonares superiores, con propiedades electrofisiológicas especiales, incluyendo automatismo espontáneo y capacidad de generar respuestas repetitivas por pospotenciales precoces 33. Esta definición clara de la FA paroxística de origen focal se ha difuminado con el intento de extender esta patogenia a todas las FA paroxísticas, con y sin cardiopatía asociada, e incluso a la FA crónica establecida 34. Se propone la ablación de focos productores de una sola extrasístole y hasta la ablación de áreas con potenciales «rápidos», en ausencia de extrasístoles, por considerarlos característicos del miocardio de las venas pulmonares 35. Se ha considerado focal la FA en la que se identifican 3-4 focos de origen en distintas venas pulmonares y/o pared libre auricular. En este momento el origen focal de la FA abre una posibilidad terapéutica para pacientes bien seleccionados, con episodios muy frecuentes, casi diarios, de FA y extrasistolia auricular frecuente y/o fácilmente inducible, de origen localizado. Es probable que en pacientes con cardiopatía significativa el papel de los focos precipitantes sea de una importancia relativa, predominando el sustrato miocárdico difuso. La selección de pacientes es importante porque la ablación con radiofrecuencia en las venas pulmonares puede producir complicaciones graves, como embolias sistémicas, hemopericardio y obstrucción venosa con hipertensión pulmonar 36.
PAPEL DEL SISTEMA NERVIOSO AUTÓNOMO
La estimulación vagal ha sido un método clásico para producir FA en el laboratorio y Coumel definió una FA «vagal», de incidencia nocturna, relacionada con bradicardia 37, concepto que ha permanecido hasta hoy, aunque sus límites no son tan definidos como se quisiera. Estudios más recientes sugieren, sin embargo, un papel menos claro del vago 38 y una mayor importancia del sistema nervioso simpático de lo que se ha creído hasta ahora 39-42. Aún queda mucho camino por recorrer para comprender las complejas interacciones del vago y el simpático y su efecto arritmogénico sobre el sustrato y los iniciadores de la FA.
SORPRESAS Y LECCIONES DE LOS FÁRMACOS ANTIARRÍTMICOS
En los últimos años se ha consolidado el potencial terapéutico de los fármacos bloqueantes de canales de Na (acción clase IC). En preparaciones experimentales se ha comprobado que el efecto está relacionado con una prolongación de la longitud de onda, que debida a la mayor prolongación del período refractario que a la disminución de la velocidad de conducción hace que el efecto sobre la longitud de onda sea impredecible 43-45. Estudios más recientes sugieren que la depresión de la excitabilidad miocárdica puede desempeñar un papel antiarrítmico al impedir los giros cerrados de los frentes de activación 8. No obstante, no es el único hallazgo que pone en cuestión una relación simple de refractariedad y longitud de onda con el efecto antiarrítmico de un fármaco. Los nuevos fármacos con efecto casi exclusivamente prolongador del potencial de acción y del período refractario (acción clase III) 46 han demostrado ser mucho más eficaces en el flúter que en la FA 47,48. Existe una tendencia en la bibliografía a mezclar los efectos sobre una y otra arritmia 49, lo que puede ocultar los modestos efectos sobre la FA. La actitud opuesta, es decir, buscar las causas de la diferencia de efectividad en el flúter y la FA podría ayudarnos a entender también mejor los mecanismos de ambas arritmias 50.
PREVENCIÓN DE LA FIBRILACIÓN AURICULAR CON MARCAPASOS
Animadas por el efecto preventivo de la estimulación auricular crónica en pacientes con enfermedad del nódulo sinusal 51, se han desarrollado líneas que investigan la prevención de FA por medio de estimulación auricular en ausencia de bradicardia asociada. Es interesante constatar que, tras el fracaso de la hipótesis extrasistólica en las arritmias ventriculares, el papel de las extrasístoles se reanima actualmente con la FA. Con el fin de suprimir las extrasístoles se han desarrollado algoritmos basados en aumentos de frecuencia y en la supresión de pausas postextrasistólicas. Hasta el momento no ha habido resultados positivos en este sentido 52.
En pacientes con FA asociada a bloqueo del haz de Bachmann en el ECG 53 se ha postulado la resincronización auricular por medio de la estimulación simultánea de ambas aurículas, colocando un segundo electrodo en el seno coronario. Tras algunas experiencias iniciales alentadoras, el primer estudio controlado no ha dado resultados positivos 54, que quizá no es de extrañar, ya que no se conoce bien la base anatómica y electrofisiológica del bloqueo de Bachmann y la estimulación biauricular podría, al menos en teoría, aumentar la dispersión de la activación en algunos casos, al añadir un nuevo frente de activación.
Una contribución importante de los ensayos de prevención de FA con marcapasos es que la memoria de estos dispositivos permitirá en el futuro conocer mucho mejor los mecanismos de iniciación y terminación de estas arritmias, y con ello quizá se puedan diseñar estrategias terapéuticas y preventivas más racionales 55.
SOLUCIONAR EL PROBLEMA AUNQUE NO SE COMPRENDA
Algunas técnicas terapéuticas propuestas pasan por alto las causas de la FA y se dirigen a hacerla inviable o a interrumpirla. Son conceptos muy interesantes, aunque no nos ayuden a progresar en la comprensión de las causas y, por tanto, en la prevención de la FA.
La técnica del laberinto (maze)
El éxito de la ablación con radiofrecuencia en el flúter creó la ilusión de poder reproducirlo en la FA. En ésta, como en muchas otras áreas, los electrofisiólogos se basaron en la experiencia previa de los cirujanos e intentaron reproducir la intervención de Cox, que divide el miocardio auricular en «corredores» por medio de cortes lineales 56-58. Cada corredor está abierto en un extremo para recibir la activación del ritmo sinusal, pero cerrado en el otro extremo para impedir el retorno (reentrada) de la activación; por eso se llama la intervención del laberinto (maze). La posibilidad de llevar a cabo este tratamiento por medio de catéteres es atractiva, ya que lo haría aplicable a un gran número de pacientes. Sin embargo, se han encontrado problemas técnicos por el momento insalvables. La manipulación precisa de los catéteres en la aurícula izquierda es difícil y la realización de líneas de ablación transmurales y continuas es casi imposible en una sola intervención. Se ha llegado a eliminar la FA con ablación lineal de aurícula izquierda, pero a costa de múltiples intervenciones para el tratamiento de recurrencias o de taquicardias reentrantes por líneas incompletas, además de una tasa significativa de complicaciones graves (accidentes embólicos y hemopericardio) 59,60. En el aire quedaría la cuestión del efecto de la ablación en líneas sobre la función auricular.
Una lección parece clara después de los ensayos de ablación de FA en líneas: el éxito sólo puede reproducirse si las líneas se hacen en la aurícula izquierda. Algunos grupos han logrado mejora del control de FA paroxística tras ablación lineal de aurícula derecha, pero con unos porcentajes de éxito bajos y la necesidad de utilizar fármacos antiarrítmicos en la mayoría de los pacientes después del procedimiento 61,62. Así pues, parece que la aurícula izquierda sería la base principal de la actividad fibrilatoria en la FA.
El desfibrilador automático auricular
También pareció una buena idea repetir el éxito del desfibrilador automático ventricular en la aurícula 63. La colocación de electrodos en el seno coronario y la aurícula derecha permite incluir la mayor parte del miocardio auricular dentro del campo de la descarga, y la utilización de pulsos bifásicos de descarga permite umbrales por debajo de 5 J en la mayoría de los casos. Además, al no tratarse de una arritmia inmediatamente mortal, se pueden aplicar algoritmos complejos de reconocimiento que impidan las descargas inapropiadas. El problema de la seguridad pareció aclararse con la fijación de un límite mínimo al intervalo RR previo a la descarga, para evitar la inducción de fibrilación ventricular. Pero otros problemas limitan su aplicación. Los choques de hasta 0,5 J pueden ser muy dolorosos 64, y aunque la mayor parte de los choques tienen éxito, las recidivas de FA a los pocos segundos son muy frecuentes 63. De los desfibriladores auriculares implantados, gracias a la grabación en memoria, podemos también aprender a conocer mejor la verdadera incidencia y mecanismos de las arritmias auriculares en pacientes con FA 65.
¿UNA SOLUCIÓN MOLECULAR PARA LA FIBRILACIÓN AURICULAR?
La descripción de una base genética para la FA familiar 66 abre aún un nuevo ángulo a la investigación de alcance incalculable 67. Es posible que cambios de las conexinas, las proteínas de las uniones intercelulares (gap junctions), desempeñen un papel en la alteración de la activación 68, o que se puedan establecer relaciones moleculares entre activación alterada y expresión de canales iónicos de la membrana 69, y se podrían llegar a definir bases genéticas para una predisposición especial a sufrir unos u otros mecanismos de arritmia o un distinto efecto de los fármacos antiarrítmicos.
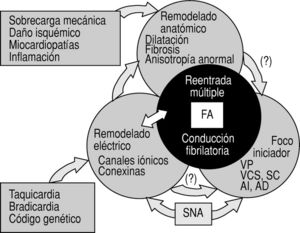
Pero, de todo lo dicho es inevitable concluir que aún quedan muchos pasos que dar antes de que podamos simplificar las causas de la FA a una o varias alteraciones genéticas. Tendremos que entender primero cuáles son los probablemente múltiples mecanismos de la ahora considerada una sola arritmia, cómo interacciona el sustrato con los precipitantes y los moduladores y qué hace a algunos sujetos sensibles al remodelado eléctrico, mientras que otros no lo son (fig. 4). Y una vez delimitados los mecanismos necesitaremos métodos de integración nuevos, no lineales, que nos permitan tener un enfoque más abierto, para entender la auténtica complejidad que subyace a ese tan conocido ECG de la FA. Pero el camino está abierto y se sigue arañando la corteza del problema, de sorpresa en sorpresa, con avances prometedores.
Fig. 4. Resumen de la patogenia de la fibrilación auricular, siguiendo las líneas actuales de investigación. Para una explicación completa, véase el texto. AI: aurícula izquierda; AD: aurícula derecha; FA: fibrilación auricular; SC: seno coronario; SNA: sistema nervioso autónomo; VCS: vena cava superior; VP: venas pulmonares.
Bibliografía
[1]
A computer model of atrial fibrillation. Am Heart J 1964; 67: 200-220.
[2]
Experimental evaluation of Moe's multiple wavelet hypothesis of atrial fibrillation. En: Zipes DP y Jalife J, editores. Cardiac electrophysiology and arrhythmias. Nueva York: Grune & Stratton, 1985; 265-275.
[3]
Flúter auricular. Mapeo y ablación por radiofrecuencia. Rev Esp Cardiol 1993; 46: 520-528.
[4]
Legth of excitation wave and susceptibility to reentrant atrial arrhythmias in normal conscious dogs. Circ Res 1988; 62: 395-410.
[5]
Chaos and the transition to ventricular fibrillation: a new approach to antiarrhythmic drug evaluation. Circulation 1999; 99: 2819-2826.
[6]
A new perspective on the mechanisms of arrhythmias and sudden cardiac death: spiral waves of excitation in heart muscle. J Cardiovasc Electrophys 1991; 2 (Supl): 133-152.
[7]
Mechanisms of cardiac fibrillation. Science 1995; 270: 1222-1223.
[8]
Preferential depression of conduction around a pivot point in rabbit ventricular myocardium by potassium and flecainide. J Cardiovasc Electrophys 2000; 11: 262-273.
[9]
Epicardial right atrial free wall mapping in chronic atrial fibrillation. Documentation of repetitive activation with a focal spread - a hitherto unrecogised phenomenon in man. Eur Heart J 1997; 18: 290-310.
[10]
Incomplete reentry and epicardial breakthrough patterns during atrial fibrillation in the sheep heart. Circulation 1996; 94: 2649-2661.
[11]
Anatomy of the left atrium: implications for radiofrequency ablation of atrial fibrillation. J Cardiovasc Electrophysiol 1999; 10: 1525-1533.
[12]
Atrial fibrillation as a self-sustaining arrhythmia independent of focal discharge. Am Heart J 1959; 58: 59-70.
[13]
Cholinergically mediated tachyarrhythmias induced by a single extrastimulus in the isolated canine right atrium. Circ Res 1992; 71: 1254-1267.
[14]
Stable microreentrant sources as a mechanism of atrial fibrillation in the isolated sheep heart. Circulation 2000; 101: 194-199.
[15]
High-density mapping of electrically induced atrial fibrillation in humans. Circulation 1994; 89: 1665-1680.
[16]
Patrones de activación durante la fibrilación auricular en un modelo experimental. Rev Esp Cardiol 1999; 52: 327-338.
[17]
Electrophysiologic effects of selective right versus left atrial linear lesions in a canine model of chronic atrial fibrillation. J Cardiovasc Electrophys 1999; 10: 1564-1574.
[18]
Mapping of atrial activation with a noncontact, multielectrode catheter in dogs. Circulation 1999; 99: 1906-1913.
[19]
Atrial fibrillation begets atrial fibrillation. A study in awake chronically instrumented goats. Circulation 1995; 92: 1954-1968.
[20]
Structural changes of atrial myocardium due to sustained atrial fibrillation in the goat. Circulation 1997; 96: 3157-3163.
[21]
Molecular mechanisms underlying ionic remodeling in a dog model of atrial fibrillation Circ Res 1999; 84: 776-784.
[22]
Importance of refractoriness heterogeneity in the enhanced vulnerability to atrial fibrillation induction caused by tachycardia-induced atrial electrical remodeling. Circulation 1998; 98: 2202-2209.
[23]
Verapamil reduces tachycardia-induced electrical remodeling of the atria. Circulation 1997; 95: 1945-1953.
[24]
Effect of atrial fibrillation on atrial refractoriness in humans. Circulation 1996; 94: 1600-1606.
[25]
Electrical remodeling in atrial fibrillation: time course and mechanisms. Circulation 1996; 94: 2968-2974.
[26]
Role of the Na
[27]
Pathology of atrial fibrillation in man. Br Heart J 1972; 34: 520-525.
[28]
Electrophysiologic studies in atrial fibrillation. Slow conduction of premature impulses: a possible manifestation of the background for reentry. Am J Cardiol 1983; 51: 122-130.
[29]
Promotion of atrial fibrillation by heart failure in dogs: atrial remodeling of a different sort. Circulation 1999; 100: 87-95.
[30]
Myocardial cell death in fibrillating and dilated human right atria. J Am Coll Cardiol 1999; 34: 1577-1586.
[31]
Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339: 659-666.
[32]
Radiofrequency ablation of atrial fibrillation initiated by spontaneous ectopic beats. Europace 2000; 2: 99-105.
[33]
Initiation of atrial fibrillation by ectopic beats originating from the pulmonary veins: electrophysiological characteristics, pharmacological responses, and effects of radiofrequency ablation. Circulation 1999; 100: 1879-1886.
[34]
Catheter ablation of chronic atrial fibrillation targeting the reinitiating triggers. J Cardiovasc Electrophys 2000; 11: 2-10.
[35]
Catheter ablation in the pulmonary veins in patients without ectopy during exploration [resumen]. PACE 2000; 23: 624.
[36]
Pulmonary vein stenosis complicating catheter ablation of focal atrial fibrillation. J Cardiovasc Electrophys 2000; 11: 677-681.
[37]
Neurogenic and humoral influences of the autonomic nervous system in the determination of paroxysmal atrial fibrillation. En: Attuel P, Coumel P, Janse MJ, editores. The atrium in health and disease. Nueva York: Futura, 1989; 213-232.
[38]
Altered complexity and correlation properties of R-R interval dynamics before the spontaneous onset of paroxysmal atrial fibrillation. Circulation 1999; 100: 2079-2084.
[39]
Atrial fibrillation and flutter after coronary artery bypass surgery: epidemiology, risk factors and preventive trials. Int J Cardiol 1992; 36: 253-261.
[40]
Power spectral analysis of heart period variability of preceding sinus rhythm before initiation of paroxysmal atrial fibrillation. Am J Cardiol 1998; 82: 869-874.
[41]
Low vagal tone and supraventricular ectopic activity predict atrial fibrillation and flutter after coronary artery bypass grafting. Eur Heart J 1995; 16: 825-831.
[42]
Heterogeneous sympathetic innervation of the atria in atrial fibrillation - autonomic remodeling with rapid atrial rates [resumen]. PACE 1998; 21: 831.
[43]
Determination of refractory periods and conduction velocity during atrial fibrillation using atrial capture in dogs: direct assessment of the wavelegth and its modulation by a sodium channel blocker, pilsicainide. J Am Coll Cardiol 2000; 35: 246-253.
[44]
Mechanism of flecainide's antiarrhythmic action in experimental atrial fibrillation. Circ Res 1992; 71: 271-287.
[45]
Idiopathic atrial fibrillation in dogs: electrophysiologic determinants and mechanisms of antiarrhythmic action of flecainide. J Am Coll Cardiol 1995; 26: 277-286.
[46]
Class III antiarrhythmic drug action in experimental atrial fibrillation: differences in reverse use dependence and effectiveness between d-sotalol and the new antiarrhtyhmic drug ambasilide. Circulation 1994; 90: 2032-2040.
[47]
Efficacy and safety of repeated intravenous doses of ibutilide for rapid conversion of atrial aflutter or fibrillation. Circulation 1996; 94: 1613-1621.
[48]
Intravenous dofetilide, a class III antiarrhythmic agent, for the termination of sustained atrial fibrillation or flutter. J Am Coll Cardiol 1997; 29: 385-390.
[49]
Maintenance of sinus rhythm with oral d,l-sotalol therapy in patients with symptomatic atrial fibrillation and/or atrial flutter. Am J Cardiol 1999; 84: 270-277.
[50]
Oral d,l-sotalol in atrial fibrillation and/or flutter. Am J Cardiol 2000; 85: 132.
[51]
Long-term follow-up of patients from a randomised trial of atrial versus ventricular pacing for sick-sinus syndrome. Lancet 1997; 350: 1210-1216.
[52]
Atrial pacing periablation for prevention of paroxysmal atrial fibrillation. Circulation 1999; 99: 2553-2558.
[53]
Interatrial conduction block and retrograde activation of the left atrium and paroxysmal supraventricular tachyarrhythmia. Eur Heart J 1988; 9: 1112-1118.
[54]
Biatrial synchronous pacing for atrial arrhythmia prevention: the SYMBIAPACE study [resumen]. Eur Heart J 1999; 20 (Supl): 4.
[55]
Aftherapy study phase 1: onset mechanisms [resumen]. PACE 1999; 22 (Supl A): 86.
[56]
The surgical treatment of atrial fibrillation. III. Development of a definitive surgical procedure. J Thorac Cardiovasc Surg 1991; 101: 569-583.
[57]
Técnica de maze para el tratamiento de la fibrilación auricular: experiencia inicial. Rev Esp Cardiol 1998; 51: 901-907.
[58]
Results of maze surgery for lone paroxysmal atrial fibrillation. Circulation 2000; 101: 1559-1567.
[59]
Right and left atrial radiofrequency catheter therapy of paroxysmal atrial fibrillation. J Cardiovasc Electrophysiol 1996; 7: 1132-1144.
[60]
Modification of the substrate for maintenance of idiopathic human atrial fibrillation: efficacy of radiofrequency ablation using nonfluoroscopic catheter guidance. Circulation 1999; 100: 2085-2092.
[61]
Atrial mapping and radiofrequency catheter ablation in patients with idiopathic atrial fibrillation: electrophysiological findings and ablation results. Circulation 1998; 97: 2136-2145.
[62]
Catheter ablation approach on the right side only for paroxysmal atrial fibrillation therapy: long-term results. PACE 2000; 23: 224-233.
[63]
Atrioverter: an implantable device for the treatment of atrial fibrillation. Circulation 1998; 98: 1651-1656.
[64]
Testing different biphasic wavenorms and capacitances: effect on atrial defibrillation threshold and pain perception. J Am Coll Cardiol 1996; 28: 695-699.
[65]
Two-year-follow-up of patients with a combined dual chamber atrial and ventricular defibrillator reveals a high incidence of atrial arrhythmias with short episode duration and strongly suggests a benefit of atrial antitachycardia pacing [resumen]. PACE 2000; 23: 571.
[66]
Identification of a genetic locus for familial atrial fibrillation. N Engl J Med 1997; 336: 905-911.
[67]
Fibrilacion auricular: ¿la solucion está en los genes? Rev Esp Cardiol 1997; 50: 367-367.
[68]
Connexins, conduction, and atrial fibrillation. J Cardiovasc Electrophys 1998; 9: 608-611.
[69]
Molecular mechanisms underlying ionic remodeling in a dog model of atrial fibrillation. Circ Res 1999; 84: 776-784.