Palabras clave
INTRODUCCION
Concepto
La enfermedad cerebrovascular (ECV) es uno de los motivos más frecuentes de asistencia neurológica urgente y constituye un grave problema de salud pública. Datos de la Organización Mundial de la Salud indican que es la segunda causa de muerte y la primera causa de discapacidad. En España es la primera causa de mortalidad específica en la mujer. Hasta hace 10 años, los profesionales sanitarios y especialmente los neurólogos han mantenido una actitud conservadora y no agresiva hacia esta enfermedad devastadora. Las unidades de ictus y especialmente la posibilidad de la reperfusión a través del tratamiento trombolítico han posibilitado un cambio de actitud: el ictus puede ser una entidad tratable, lo que mejora de manera significativa el pronóstico de estos pacientes.
Llamamos ECV o ictus al trastorno circulatorio cerebral que ocasiona una alteración transitoria o definitiva de la función de una o varias partes del encéfalo. Hay diferentes tipos de ictus según la naturaleza de la lesión. El ictus isquémico es debido a una falta de aporte de sangre a una determinada zona del parénquima encefálico, mientras que el ictus hemorrágico se debe a la rotura de un vaso sanguíneo encefálico con extravasación de sangre fuera del lecho vascular1. El 85% de los ictus es isquémico, mientras que el resto es hemorrágico.
Debido a los distintos subtipos de ictus, las diferencias en el perfil evolutivo, las características de la topografía, y las diferencias en el mecanismo de producción y en la etiología, se utilizan numerosos términos para describir las ECV2. Es muy importante conocer de manera correcta el mecanismo causante para realizar el tratamiento más adecuado y aplicar una eficaz prevención secundaria3.
Según la evolución en las primeras horas, distinguiremos entre 2 grandes tipos de eventos cerebrovasculares isquémicos: al ataque isquémico transitorio (AIT), clásicamente definido como el déficit neurológico que se recupera antes de las primeras 24 h, y el infarto cerebral con lesión definitiva del parénquima cerebral.
En cuanto al AIT, debe precisarse que, aunque el término «transitorio» indica una naturaleza benigna, estos episodios deben considerarse como un importante signo de alarma para experimentar un infarto cerebral u otras complicaciones cardiovasculares. Aproximadamente un 15-30% de los infartos cerebrales está precedido de un AIT4. El 17% de los pacientes que presentan un infarto cerebral ha experimentado un AIT en el mismo día, el 9% en el día previo y el 43% en la semana previa5. Asimismo, los pacientes que han experimentado un AIT también presentan un pronóstico desfavorable a largo plazo6. Las nuevas técnicas de neuroimagen han permitido detectar una lesión isquémica, un infarto cerebral, en pacientes con resolución de los síntomas en menos de 24 h. Estos datos pronósticos y el mejor conocimiento de la fisiopatología de la isquemia cerebral han motivado una nueva definición temporal de AIT como el evento isquémico que ocasiona un déficit neurológico de menos de una hora de duración y que no se asocia con infarto cerebral en la neuroimagen7. El AIT debe considerarse hoy día una urgencia médica.
Según el territorio vascular afectado, el AIT se clasifica en carotídeo, vertebrobasilar e indeterminado, y en función de las manifestaciones clínicas puede ser retiniano (amaurosis fugaz), hemisférico cortical, lacunar o atípico. Cada uno de estos AIT tiene una fisiopatología, una clínica y un pronóstico, y por estos motivos, un tratamiento diferente.
En resumen, los pacientes con AIT deben considerarse un grupo de alto riesgo vascular y, una vez diagnosticado, debe identificarse el mecanismo causante8.
Respecto al infarto cerebral, su causa final es la falta de irrigación de sangre a cualquier parte del cerebro, lo cual produce isquemia y, en última instancia, infarto (muerte de células cerebrales). Cuando el tejido cerebral está isquémico ya se produce alteración de la función cerebral y, por lo tanto, las manifestaciones clínicas típicas de un ictus. La zona de tejido isquémico pero no infartado se conoce como zona de penumbra isquémica, y con tratamientos recanalizadores y cuidados adecuados es potencialmente salvable. Hoy día es posible visualizar, mediante técnicas de neuroimagen, resonancia magnética (RM) con difusión/perfusión y tomografía computarizada (TC) de perfusión, el tejido de penumbra isquémica o mismatch.
Clasificación etiopatogénica del ictus
La categorización etiopatogénica del ictus es fundamental para su adecuado tratamiento. Aunque no hay unos criterios unívocos, los más extendidos se basan en las clasificaciones TOAST (Trial Org-10172 Acute Stroke Treatment)9 y SSS-TOAST10.
Podemos distinguir 5 subtipos etiopatogénicos que precisarán distintas pautas en cuanto al tratamiento: el ictus aterotrombótico por enfermedad de gran vaso, el cardioembólico, el lacunar por enfermedad de pequeño vaso, el de causa inhabitual (disección arterial, vasculitis, vasoespasmo, etc.) y el de etiología indeterminada o criptogénico después de un estudio adecuado. Asimismo, distinguimos diferentes mecanismos de producción del ictus, el más habitual de los cuales es el embólico e incluye 2 posibles etiologías (la cardioembólica y la aterotrombótica por una embolia arterioarterial procedente de una placa ateromatosa), además de la trombosis por alteración de la pared del vaso, la lipohialinosis en el infarto lacunar, y el mecanismo hemodinámico cuando se produce un infarto en territorios vasculares limítrofes por la hipoperfusión debida a una estenosis grave del territorio vascular afectado.
Los criterios SSS-TOAST se especifican a continuación.
Criterios de infarto aterotrombótico (aterosclerosis de grandes arterias)
Este diagnóstico exige la realización de dúplex/ Doppler y/o estudio angiográfico (angiorresonancia, angio-TC o arteriografía) para detectar lesiones de la pared arterial (estenosis y oclusión) en los grandes vasos, tanto extracraneales, supraaórticos, como intracraneales (arterial cerebral media, anterior, posterior o tronco basilar). La normalidad, las alteraciones mínimas o la falta de realización de estos estudios excluyen el diagnóstico.
Criterios obligatorios
Estenosis significativa (> 50%), oclusión o placa ulcerada (> 2 mm de profundidad) en la arteria intracraneal o extracraneal ipsilateral, demostrada mediante dúplex/Doppler o estudio angiográfico (convencional, angio-RM o angio-TC).
Ausencia de cardiopatía embolígena u otra etiología.
Otros criterios que indican este diagnóstico
1. Clínicos
Presencia de soplo ipsilateral al infarto.
Presencia de AIT previos, ipsilaterales al infarto.
Historia previa de cardiopatía isquémica.
Historia previa de claudicación intermitente de las extremidades inferiores.
2. Imagen
En la TC/RM, presencia de un infarto no hemorrágico, de tamaño > 1,5 cm, cortical o subcortical, en el territorio carotídeo o vertebrobasilar.
En la angiografía, estenosis u oclusión del territorio vascular afectado.
Criterios de ictus isquémico cardioembólico
Criterios obligatorios
Presencia de una cardiopatía embolígena (véase el listado de fuentes cardioembólicas en la tabla 1).
Exclusión de lesiones ateromatosas cerebrovasculares significativas (véanse los criterios de infarto aterotrombótico) y otras etiologías posibles.
En caso de que haya una enfermedad cardiaca de riesgo bajo (véase el listado de fuentes cardioembólicas) y de haber descartado otras causas del ictus, se clasificará como «posible» ictus cardioembólico.
Otros criterios que indican este diagnóstico
1. Clínicos
Déficit neurológico máximo instaurado bruscamente (en segundos o pocos minutos).
Aparición durante la vigilia.
Pérdida de consciencia (transitoria) y/o crisis comiciales al inicio del cuadro.
Múltiples infartos cerebrales simultáneos.
Infartos cerebrales o AIT previos en diferentes territorios vasculares.
Historia o coexistencia de embolismos sistémicos.
2. Imagen
En la TC, infarto de tamaño > 1,5 cm de localización generalmente cortical, en ocasiones hemorrágico, o múltiples infartos en diferentes territorios vasculares.
En la angiografía: oclusiones angiográficas evanescentes, oclusión arterial aislada sin evidencia de lesiones ateroescleróticas o defecto central de relleno en la porción proximal de una arteria sin cambios ateroscleróticos.
Enfermedad de pequeño vaso (lacunar)
Infarto de diámetro máximo de 1,5 cm, localizado en el territorio de las arterias o las arteriolas perforantes cerebrales (cuyo diámetro generalmente es < 200 µm) debido a lipohialinosis o microateromatosis de dichos vasos.
Cursa clínicamente en forma de uno de los síndromes lacunares clásicos (hemiparesia pura, síndrome sensitivo puro, síndrome sensitivomotriz, hemiparesia-ataxia o disartria-mano torpe).
La presencia de hipertensión arterial o diabetes mellitus apoya el diagnóstico.
Por definición, es obligatoria la ausencia de signos o síntomas corticales.
No debe haber fuentes potenciales de embolismo de origen cardiaco ni estenosis > 50% en las arterias extracraneales ipsilaterales.
La presencia de lesiones de estenosis < 50% o placas de ateroma en arterias de mediano o gran calibre no excluye la presencia de un infarto lacunar.
Criterios de infarto de causa indeterminada
Infarto de tamaño medio o generalmente grande, cortical o subcortical, tanto de territorio carotídeo como vertebrobasilar. Dentro de este tipo de infarto pueden distinguirse, a su vez, varias situaciones o subtipos:
Evaluación inadecuada o insuficiente.
Ausencia de una etiología determinada pese a un estudio exhaustivo.
Datos conflictivos por la presencia simultánea de dos etiologías posibles de infarto cerebral.
Criterios de infarto por otras etiologías o causas infrecuentes
En esta categoría se incluye a los pacientes con un infarto cerebral agudo de causas poco frecuentes, como pueden ser vasculopatías no ateroscleróticas, (inflamatorias, no inflamatorias, infecciosas, hereditarias), estados de hipercoagulabilidad, alteraciones hematológicas, migraña-infarto, vasoespasmo, y otras enfermedades hereditarias y metabólicas.
Deben ser excluidas las etiologías mencionadas de infarto cerebral cardioembólico y la presencia de aterosclerosis de las arterias extracraneales.
En la figura 1 se recoge la frecuencia de cada subtipo de ictus en el Banco de Datos de Ictus de la Sociedad Española de Neurología (BADISEN).
Fig. 1. Frecuencia de subtipos de ictus. Fuente BADISEN. Criterios SSS-TOAST. En el subtipo cardioembólico se incluyen tanto las fuentes cardioembólicas mayores como menores.
DIAGNOSTICO
La identificación rápida del ictus, su diagnóstico etiopatogénico y su adecuado tratamiento, con la aplicación de terapias específicas (fibrinolíticos) en la fase aguda, cuidados generales en unidades de ictus y tratamiento preventivo específico para cada subtipo de ictus, es vital para disminuir el daño cerebral irreversible, evitar recurrencias y, así, conseguir una mejor recuperación funcional del paciente.
El proceso diagnóstico incluye los siguientes apartados: historia clínica, exploración general y neurológica, y exploraciones complementarias.
En la historia clínica se debe prestar atención a los antecedentes vasculares personales y familiares, la instauración ictal o súbita de la focalidad neurológica y, especialmente, la hora de inicio para valorar si el paciente puede ser subsidiario de tratamiento fibrinolítico urgente.
La exploración neurológica debe confirmar la sospecha de una focalidad neurológica y permitirá realizar una orientación acerca de la topografía del ictus.
Estos datos, juntamente con la exploración general, los datos de la analítica, el ECG y la radiografía de tórax, nos permitirán realizar una aproximación diagnóstica sobre la posible etiología del ictus (soplo carotídeo, fibrilación auricular en el ECG, cardiomegalia en la radiografía de tórax, etc.).
En las exploraciones más específicas es esencial la realización de una TC craneal (TC-C) urgente para descartar la hemorragia cerebral, otras causas de focalidad neurológica y confirmar la naturaleza isquémica del proceso. En las primeras horas de un infarto cerebral, la TC-C puede ser normal o mostrar signos precoces de infarto que nos serán de gran ayuda para valorar la extensión del infarto e instaurar un tratamiento fibrinolítico.
Se realizará un estudio dúplex/Doppler de troncos supraaórticos (DTSA) y transcraneal (DTC) en todos los pacientes que han experimentado un ictus isquémico. El estudio carotídeo nos permitirá diagnosticar la etiología aterotrombótica del ictus isquémico y valorar tratamientos preventivos específicos como la endarterectomía carotídea. El Doppler/dúplex transcraneal nos permite diagnosticar estenosis intracraneales, valorar la circulación colateral, confirmar la recanalización arterial después de administrar un tratamiento fibrinolítico (fig. 2) e incluso detectar una comunicación derecha-izquierda (shunt) por un foramen oval permeable (FOP) mediante el test de microburbujas. Por otro lado, aporta un información valiosa en la evaluación preoperatoria y pronóstica de la estenosis carotídea (estudio de circulación colateral, estudios de reserva hemodinámica y detección de microembolias) (tabla 2). Un error frecuente es limitar el estudio ultrasonográfico en pacientes con estenosis carotídea al análisis de las arterias cervicales.
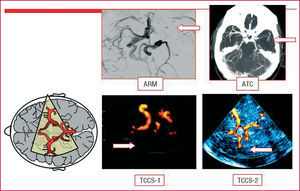
Fig. 2. Oclusión intracraneal de la arteria cerebral media. Imagen obtenida mediante angiorresonancia magnética craneal (ARM), angiotomografía computarizada craneal (ATC) y dúplex transcraneal (TCCS 1-2).
La elevada sensibilidad y especificidad del estudio ultrasonográfico (dúplex color de troncos supraaórticos más Doppler/dúplex transcraneal) permite plantear, asociada a alguna otra técnica de imagen no invasiva como la angio-RM o la angio-TC, la posibilidad de indicar la endarterectomía sin la utilización de la angiografía por sustracción digital.
Se debe valorar la presencia de cardiopatías potencialmente embolígenas sobre la base de la anamnesis, la exploración física, la radiografía de tórax y el ECG, y así poder instaurar un tratamiento preventivo descoagulante. Se recomienda realizar una ecocardiografía transtorácica cuando en las exploraciones previas no se haya detectado una enfermedaa, cuando se sospecha una etiología cardioembólica y en los ictus en pacientes jóvenes. En los casos en que se sospeche ateromatosis aórtica y cuando se detecte un shunt derecha-izquierda, se recomienda completar el estudio con ecocardiografía transesofágica.
La resonancia magnética craneal (RM-C) resulta muy útil en el tratamiento del ictus, no sólo porque ayuda a confirmar y localizar topográficamente los infartos, sino también por su utilidad en su tratamiento agudo. En la actualidad se dispone de secuencias de difusión (DWI) que nos muestran el tejido infartado en la fase aguda, y mediante secuencias de perfusión (PWI) podemos cuantificar la extensión del tejido hipoperfundido; la diferencia entre ambas zonas nos identificará el tejido en penumbra o mismatch y, por lo tanto, potencialmente recuperable con tratamientos recanalizadores (fig. 3). Se recomienda la RM-C para localizar y confirmar infartos lacunares y para valorar el ictus de territorio vertebrobasilar. Se recomienda completar el estudio con angio-RM o, excepcionalmente, con arteriografía por sustracción digital (DIVAS), cuando se detecte por Doppler de los troncos supraaórticos/TC una estenosis en la arteria carótida interna > 50% o cuando se sospeche una estenosis intracraneal.
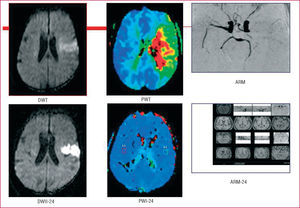
Fig. 3. Penumbra isquémica o mismatch. Ictus isquémico en el territorio de la arteria cerebral media, con oclusión de la arteria en la angiorresonancia magnética. Imagen en difusión (DWI) de la lesión de infarto y área de penumbra detectada mediante imagen de perfusión (PWI) correspondiente al área isquémica. La diferencia entre ambas zonas constituye el área de penumbra o mismatch. Control a las 24 horas con recanalización arterial y recuperación del área de penumbra con lesión residual en DWI.
TRATAMIENTO
El ictus es una emergencia médica que requiere una intervención inmediata. El infarto cerebral se establece de forma progresiva en varias horas, y existe la posibilidad de minimizar el tamaño del infarto si actuamos en esa ventana terapéutica.
En los últimos años se ha producido un cambio sustancial en el enfoque terapéutico del ictus isquémico. El concepto de ictus isquémico como un proceso que progresa en horas ha abierto nuevas perspectivas con fármacos recanalizadores, neuroprotectores y con un tratamiento médico más adecuado para prevenir un mayor daño neuronal. La correcta evaluación de la causa del ictus, su fisiopatología y la topografía vascular determinarán el tratamiento idóneo y, en consecuencia, un mejor pronóstico. La aplicación de estas medidas diagnósticas y terapéuticas protocolizadas en las primeras 6 h del inicio de los síntomas disminuye de manera significativa la incapacidad y acorta la estancia hospitalaria11.
El descubrimiento de la terapia trombolítica, juntamente con la implementación de las unidades de ictus (aumento de la vigilancia y el control en los primeros días), ha sido el avance más importante en los últimos años en el tratamiento de los pacientes que han experimentado un ictus.
El tratamiento del ictus se basa en 2 apartados: el tratamiento agudo y la prevención de recurrencias. El tratamiento agudo del ictus se puede subclasificar en 2 partes: las medidas generales y el tratamiento recanalizador.
Medidas generales: unidades de ictus
Los cuidados generales han demostrado ser eficaces en mejorar el pronóstico de los pacientes con un ictus. La hipoxia, la hipertensión arterial grave o la hipotensión, la hiperglucemia, la hipertermia, la deshidratación y la desnutrición son factores que influyen negativamente en el pronóstico funcional del ictus al provocar mayor daño neuronal12-17. El control de constantes, el tratamiento y la detección precoz de estas complicaciones, así como la movilización precoz, son todas medidas incluidas en todas las guías y recomendaciones de atención al ictus2.
Las unidades de ictus están formadas por equipos multidisciplinares, coordinados por neurólogos con formación especializada en enfermedades cerebrovasculares, con atención inmediata, disponibilidad continua de técnicas diagnósticas como la TC-C, el Doppler/dúplex de troncos supraaórticos y transcraneal, y con frecuencia, la RM con protocolos con secuencias de difusión, perfusión y angio-RM.
Las unidades de ictus deben estar formadas por 4-8 camas, según las necesidades, proporcionar cuidados agudos y no intensivos, donde los pacientes son monitorizados de forma continuada para detectar y corregir precozmente los factores que puedan agravar el proceso isquémico agudo y donde puedan recibir tratamiento específico para el infarto cerebral. En estas unidades se mantendrá observación continua por el personal de enfermería. Se seguirá un protocolo estandarizado de evaluación diagnóstica, tratamiento y rehabilitación. Debe haber una atención protocolizada de los tratamientos trombolíticos, la prevención de complicaciones del ictus (edema cerebral, crisis epilépticas), de prevención de complicaciones médicas (control de la glucemia, presión arterial, temperatura, prevención de la trombosis venosa profunda, detección de arritmias, infecciones respiratorias, nutrición, prevención de úlceras por decúbito) y de rehabilitación precoz.
Esta atención multidisciplinar y especializada es la base del concepto de unidades de ictus. El desarrollo de estas unidades ha mostrado una reducción significativa de la mortalidad, la morbilidad, la estancia hospitalaria y los costes18-22. En nuestro medio encontramos resultados similares, con un mejor pronóstico de los pacientes con un ictus grave respecto al de la hospitalización convencional23. El metaanálisis del Stroke Unit Trialist Collaboration24 demostró una reducción del 18% del riesgo relativo en términos de mortalidad, morbilidad y discapacidad, mientras que el beneficio igual para todos los tipos de ictus y para todas las edades.
Terapias recanalizadoras: trombolisis
Trombolisis intravenosa
El objetivo del tratamiento trombolítico es lograr la restitución precoz de la perfusión arterial y preservar el tejido neuronal dañado de manera reversible en la zona de penumbra, mediante un agente relativamente seguro para mejorar la evolución del paciente. El menor daño neuronal se traduce en menor discapacidad funcional.
En junio de 1998, la Food and Drug Association (FDA) en Estados Unidos y en 1999 en Canadá aprobaba el uso del activador tisular del plasminógeno recombintante (r-TPA) como el primer tratamiento para el ictus isquémico agudo. Desde marzo de 2003, la utilización de r-TPA está aprobada por la Agencia Europea del Medicamento en las primeras 3 h del ictus, aunque condicionada a la realización del estudio en fase IV SITS-MOST, que ha finalizado y ha sido publicado recientemente25.
El beneficio se basa en los resultados del estudio NINDS26, que demostró que el uso de r-TPA en menos de 3 h produjo un aumento absoluto del 11-13% de los pacientes con evolución excelente. En comparación con los que recibieron placebo, los pacientes tratados con r-TPA tenían un 30% más de posibilidades de quedar asintomáticos o tener una mínima discapacidad a los 3 meses de experimentar el ictus. Este beneficio no comportaba un aumento en la mortalidad, pero sí un incremento del 6,4% de presentar una hemorragia cerebral sintomática.
Este resultado destaca el hecho de que el tratamiento deber ser administrado por profesionales que conozcan bien su uso. La Agencia Europea del Medicamento recomienda su administración por personal experto en el tratamiento del ictus agudo. Varios estudios prospectivos en fase IV en los que se utilizan los criterios de tratamiento del NINDS27 y la práctica clínica diaria de los hospitales españoles (registro español) han mostrado resultados favorables similares28 (fig. 4).
Fig. 4. Resultados de los estudios NINDS, ECASS II (< 3 h), registro español y SITS-MOST.
Recientemente se han publicado los resultados del estudio SITS-MOST, de fase IV, realizado por exigencia de la Agencia Europea del Medicamento, en el que se han implicado 14 países, 285 centros y se ha incluido a 6.483 pacientes. En él se ha demostrado de forma definitiva la eficacia del tratamiento trombolítico endovenoso con r-TPA aplicado en las primeras 3 h desde el inicio del ictus, ya que consigue que un 54,8% de los pacientes tratados sea independiente a los 3 meses, con una incidencia de hemorragias sintomáticas del 7,3%, incluso inferior al resultado global detectado en los ensayos clínicos (8,6%)25.
Dos estudios europeos, ECASS I y ECASS II29, no mostraron beneficio al ampliar la ventana a 6 h, aunque hay pruebas científicas de su eficacia hasta las 4 horas y media, actualmente en ensayo clínico ECASS III (presentado en la International Stroke Conference de 2003).
Todos los estudios con estreptocinasa mostraron un riesgo inaceptable de hemorragia30.
Trombolisis intraarterial
El tratamiento intraarterial con prourocinasa en la oclusión de la arteria cerebral media ha demostrado su seguridad y eficacia cuando es administrado en las primeras 6 h desde el inicio de los síntomas (estudio PROACT II)31. La FDA no ha aprobado el uso de prourocinasa porque nunca se ha realizado un estudio confirmatorio, aunque es práctica clínica habitual el tratamiento intraarterial de la oclusión de la arteria basilar con prourocinasa.
La limitación más importante del tratamiento trombolítico intraarterial es la necesidad de realizar una angiografía superselectiva de urgencia, que requiere un neurólogo/neurorradiólogo intervencionista y un equipo especial de cuidados de ictus. Entre los nuevos abordajes se podrían incluir la terapia combinada, con tratamiento inicial con r-TPA intravenoso en el hospital local, seguido de una derivación rápida al centro de tratamiento de ictus para realizar una angiografía y valorar si se podría beneficiar de fibrinolisis intraarterial si no se ha producido la recanalización32.
Antiagregación y anticoagulación en fase aguda
La administración de aspirina tras las primeras 48 h del establecimiento del ictus reduce la mortalidad y la recurrencia, según 2 grandes estudios no ciegos33,34.
No hay pruebas científicas a favor de la anticoagulación precoz en la fase aguda del ictus35, aunque es práctica clínica habitual en distintas situaciones, como los AIT de repetición, la disección arterial, la trombosis basilar y la sospecha de ictus isquémico de causa cardioembólica con alto riesgo de reembolización (válvulas artificiales, fibrilación auricular, infarto agudo de miocardio con trombo mural).
Se recomienda siempre la profilaxis de la trombosis venosa con heparinas de bajo peso molecular.
Nuevas terapias
Inhibidores de la glucoproteína IIb/IIIa
Los inhibidores de la glucoproteína IIb/IIIa bloquean la vía final común de la agregación plaquetaria y también disminuyen la liberación de factor tisular que activa la formación de trombina36. Ya han mostrado ser eficaces en la prevención de la formación de trombos en el síndrome coronario agudo y en intervenciones percutáneas. Un estudio de fase IIB37 señalaba la eficacia de dicho tratamiento en pacientes con ictus isquémico de menos de 6 h de evolución. Hay estudios en marcha para valorar la asociación de antiplaquetarios de acción rápida para evitar la reoclusión tras el tratamiento con r-TPA (www.stroke-center.org/trials).
Prolongación de la ventana terapéutica con nuevos trombolíticos: desmoteplase
La mayoría de pacientes con ictus no puede acceder a tratamiento fibrinolítico con r-TPA por sobrepasar el límite de 3 h. La aplicación de tratamientos con mayor especificidad por la fibrina y una mejor selección de pacientes con tejido de penumbra mediante RM-DWI/PWI pueden alargar la ventana terapéutica sin mayor riesgo de hemorragia cerebral y, así, acceder a un mayor número de pacientes. El desmoteplase es una molécula procedente de saliva de murciélago Desmodus rotundus, activador de plasmina pero con mayor afinidad para la fibrina, y en consecuencia, con menor riesgo de hemorragias lejanas al trombo. Se ha realizado un estudio de fase II con pacientes con ictus isquémico de 3-9 h con una área de mismatch en la RM-C inicial38 y con resultados de recanalización muy favorables, del 71,4% (p = 0,0012), frente al 19,2% del grupo placebo. Asimismo, el pronóstico funcional fue favorable a los 90 días y la tasa de hemorragia cerebral fue baja, del 2,2%, con dosis de 125 µg/kg. Estos excelentes resultados se intentarán confirmar en el estudio DIAS-II, cuyos resultados se publicarán en 2007.
Lisis mecánica
Los tratamientos mecánicos podrían obviar o complementar la necesidad de agentes trombolíticos que aumentan el riesgo de hemorragia y, por lo tanto, resultan muy interesantes. La trombectomía mecánica endovascular ha mostrado ser factible y segura, y los resultados son favorables39. La combinación de la trombectomía mecánica con trombolisis intraarterial puede ser un tratamiento prometedor40, incluso con resultados favorables en el subgrupo de pacientes con oclusión de la arteria carótida interna41, que tienen peor pronóstico y mala respuesta al tratamiento fibrinolítico endovenoso. Los resultados del estudio Mechanical Embolus Removal in Cerebral Ischemia (MERCI) han motivado la aprobación del dispositivo MERCI Retriever System, aunque esta terapia no está aprobada para el tratamiento del ictus.
Ultrasonidos
Estudios experimentales, tanto in vitro como en modelos animales, han mostrado el efecto trombolítico de los ultrasonidos. La aplicación de ultrasonidos sobre la arteria ocluida en pacientes con infarto cerebral es una práctica habitual para el tratamiento diagnóstico mediante Doppler transcraneal. El estudio CLOTBUST42 ha demostrado que la aplicación de ultrasonidos, mediante la técnica de Doppler transcraneal utilizada de manera sistemática para el estudio diagnóstico, sobre la arteria ocluida simultáneamente a la administración de r-TPA mejora la tasa de recanalización y la evolución de los pacientes.
Neuroprotección
El objetivo de la neuroprotección es bloquear las alteraciones bioquímicas, «cascada isquémica» que se producen en el área de penumbra y que conducen a la muerte celular.
En los últimos 10 años se han investigado numerosos fármacos neuroprotectores con resultados prometedores en el ámbito experimental, pero sin resultados convincentes en los ensayos clínicos. Un metaanálisis de citicolina en pacientes con ictus isquémico de 24 h de evolución ha mostrado que los pacientes que recibieron 2.000 mg de citicolina al día tuvieron una recuperación un 38% superior que el grupo placebo43. Actualmente está en marcha un ensayo clínico multicéntrico doble ciego de citicolina oral para confirmar estos resultados.
Hipotermia
La hipotermia constituye el neuroprotector ideal, pues actúa en todos los ámbitos de la cascada isquémica. Varios estudios han demostrado que una leve hipotermia disminuye el daño por isquemia porque se produce una disminución de los requerimientos energéticos y se inhibe la producción de radicales libres y aminoácidos neuroexcitadores44. En algún estudio realizado en pacientes se ha demostrado que la hipotermia moderada en la fase aguda del ictus es factible y que puede ser beneficiosa45,46.
Tratamiento preventivo
Las estrategias para prevenir recurrencias de ictus se pueden subdividir en dos grandes grupos: las particulares según el subtipo de ictus y el mecanismo subyacente, y las generales sobre los factores de riesgo vascular.
Varios factores de riesgo aumentan la posibilidad de recurrencias. En la tabla 3 se presentan los factores más frecuentes y aceptados, su prevalencia y el riesgo relativo.
El tratamiento óptimo de estos factores reducirá notablemente el riesgo de recurrencias ictales y también de otras complicaciones vasculares.
Las principales estrategias para la prevención de recurrencias son:
1. Antiagregantes plaquetarios para el ictus isquémico de causa no cardioembólica (aterotrombótico, lacunar e indeterminado).
2. Anticoagulación en los ictus isquémicos cardioembólicos.
3. Cirugía de la estenosis carotídea sintomática.
4. Control de la hipertensión.
5. Control de la hiperlipemia.
6. Control de la diabetes mellitus.
7. Modificación de los hábitos (tabaquismo, consumo de alcohol, ejercicio físico y control de la obesidad).
8. Tratamiento de enfermedades sistémicas hematológicas, causantes de ictus en los factores de causa inhabitual.
Agentes antiplaquetarios
Los antiagregantes plaquetarios son los fármacos más utilizados para la prevención secundaria del ictus isquémico, excepto el de causa cardioembólica y algunos subtipos poco frecuentes, como la disección arterial y otras enfermedades sistémicas.
El ácido acetilsalicílico (AAS) ha demostrado ser eficaz en la prevención de ictus/AIT, el IAM o la muerte de causa vascular, con una reducción del riesgo relativo del 25% respecto a placebo48. En pacientes con antecedentes de ictus, la reducción es del 23%.
No se han encontrado diferencias en la efectividad a distintas dosis, pero sí mayor riesgo de complicaciones hemorrágicas con dosis más altas49-51.
Actualmente constituye el tratamiento de primera elección en dosis de 100-300 mg/día2,52,53.
Clopidogrel
El clopidogrel está indicado en pacientes con elevado riesgo vascular o intolerancia al AAS. Ha demostrado una reducción del riesgo relativo de ictus, IAM y muerte vascular del 8,7% frente al AAS, con menos hemorragias digestivas, y el beneficio absoluto frente a AAS es mucho mayor al analizar el subgrupo de pacientes con historia previa de enfermedad vascular (ictus o IAM)54,55.
Hay otros antiagregantes, como la ticlopidina, el triflusal o el dipiridamol, mucho menos usados y con indicaciones más restringidas.
Combinación de clopidogrel y ácido acetilsalicílico
Los estudios MATCHL y CHARISMA no han mostrado beneficio en la prevención de recurrencias cerebrovasculares y sí un riesgo excesivo de hemorragias. Actualmente no se recomienda la asociación en pacientes con ictus56.
Anticoagulantes
La anticoagulación con anticoagulantes orales es el tratamiento de elección para la prevención del ictus de causa cardioembólica. El European Atrial Fibrillation Trial y el Stroke Prevention in Atrial Fibrillation han demostrado la superioridad de la warfarina con INR 2-3 frente a AAS, con una reducción del riesgo relativo del 8 y el 48% frente a AAS en la prevención de ictus recurrente en la fibrilación auricular57,58.
Mención aparte merece el tratamiento del ictus por una comunicación derecha-izquierda (shunt DI) secundaria a un FOP. No disponemos de estudios específicos diseñados para evaluar las distintas posibilidades terapéuticas. En la prevención secundaria del ictus asociado con un FOP con aneurisma del septo interauricular asociado o no, se han utilizado la antiagregación, la anticoagulación y el cierre endovascular. Actualmente se desconoce el riesgo de recidiva de estos pacientes. Datos preliminares del estudio cooperativo español CODICIA muestran una tasa de recurrencias baja y con ictus de buen pronóstico (European Stroke Conference 2006). Los resultados del subestudio PICSS del WARSS59 tampoco han mostrado que la anticoagulación sea superior al tratamiento antiagregante, y no se dispone de otros estudios que hayan comparado la eficacia de la antiagregación frente a la anticoagulación o el cierre percutáneo del FOP60. En varios trabajos se indica que el cierre endovascular constituiría la mejor opción terapéutica, aunque la implantación de estos sistemas no está exenta de riesgos, los estudios son retrospectivos y no hay estudios a largo plazo ni ensayos clínicos que demuestren su superioridad frente al tratamiento médico61. Las recomendaciones actuales aceptan el uso de anticoagulantes o el cierre percutáneo en casos recidivantes en los que el tratamiento antiagregante haya fracasado2,52,53. Dados los efectos secundarios del tratamiento anticoagulante, su efecto acumulativo y la falta de pruebas científicas acerca de su superioridad en relación con el tratamiento antiagregante, su utilización debería evitarse y plantear el cierre percutáneo en pacientes jóvenes seleccionados con recurrencia de ictus y coexistencia de FOP y aneurisma del septo interauricular (ASA).
Hipertensión arterial
La HTA es el factor de riesgo de ictus más importante. No debe reducirse la presión arterial de manera brusca en las primeras 48 h del ictus, excepto si hay insuficiencia cardiaca o renal, pues un descenso agudo en las primeras horas puede empeorar el ictus.
El factor más importante asociado con la disminución del riesgo de recurrencias de ictus es el control de la presión arterial. La relación dosis-respuesta entre HTA y riesgo de ictus es continua62,63. El valor deseable es de 130/80 mmHg, aunque con valores inferiores se logrará una mayor prevención.
El tratamiento adecuado de la presión arterial parece ser mucho más determinante que la elección del fármaco, aunque estudios recientes parecen demostrar la eficacia de los inhibidores del enzima de conversión de la angiotensina (IECA) asociados o no con diuréticos, así como de los antagonistas de los receptores de la angiotensina II (ARA-II). Estos fármacos mostrarían efectos beneficiosos más allá del debido al control tensional, posiblemente por sus efectos endoteliales. En el estudio HOPE, con ramipril 10 mg/día64, se demostró un reducción mayor de los eventos cerebrovasculares, tanto en prevención primaria como secundaria, en pacientes de elevado riesgo vascular. El estudio PROGRESS muestra resultados favorables, tanto en pacientes hipertensos como normotensos en prevención secundaria con la asociación perindopril 4 mg e indapamida 2,5 mg/día frente a perindopril solo y placebo65. Los ARA-II también parecen desempeñar un papel importante en la prevención más allá del control tensional, como muestra el estudio LIFE, con losartán frente a atenolol en pacientes hipertensos con hipertrofia del ventrículo izquierdo con resultados favorables en la prevención primaria de eventos cerebrovasculares66, y el estudio MOSES, con resultados favorables de eprosartán 600 mg frente a nitrendipino 10 mg en pacientes hipertensos con antecedentes de episodios cerebrovasculares67.
Hipercolesterolemia
Aunque la hipercolesterolemia es un factor de riesgo demostrado de cardiopatía isquémica, su asociación con el ictus isquémico ha sido controvertida y confusa. Sin embargo, en estudios recientes se indica la asociación entre las concentraciones elevadas de colesterol y el ictus isquémico, por lo que se aconseja seguir las recomendaciones del National Colesterol Education Program III (NCEPIII)68 en las que, según el grado de riesgo vascular de los pacientes (determinado en función de la presencia de los siguientes factores: hábito tabáquico, HTA, colesterol unido a lipoproteínas de alta densidad [cHDL] < 40 mg/dl, historia familiar de cardiopatía isquémica prematura, y edad de los varones >= 45 años y de las mujeres é 55 años), se establece el valor de colesterol unido a lipoproteínas de baja densidad (cLDL) que se debe tratar. El tratamiento se realizará con estatinas. Las pruebas científicas procedentes de ensayos clínicos con estatinas en pacientes con cardiopatía isquémica, así como el metaanálisis de éstos, muestran una reducción significativa del riesgo de ictus69,70. Estos resultados han llevado a la FDA americana a aprobar la utilización de pravastatina y simvastatina en la prevención de ictus en pacientes con cardiopatía isquémica coexistente71. Globalmente, la utilización de estos fármacos no incrementa el riesgo de hemorragia cerebral.
Siguiendo recomendaciones recientes, el objetivo en pacientes con enfermedad coronaria o equivalente será mantener cifras de cLDL ¾ 100 mg/dl; la presencia de una estenosis carotídea ateromatosa sintomática es uno de estos equivalentes.
El estudio SPARCL (Stroke Prevention by Aggressive Reduction in Cholesterol Levels)72 ha sido diseñado para evaluar, en pacientes con ictus previo sin cardiopatía isquémica, la capacidad de atorvastatina en prevención secundaria de recurrencias de ictus, y es el único ensayo clínico realizado de manera específica en prevención secundaria de ictus. Los resultados recientemente publicados del SPARCL muestran una reducción del riesgo de ictus del 16% (odds ratio [OR] = 0,84; intervalo de confianza [IC] del 95%, 0,71-0,99; p = 0,03), del riesgo de ictus isquémico del 23% (OR = 0,78; IC del 95%; 0,66-0,94; p = 0,007) y de la enfermedad coronaria del 43% (OR = 0,57; IC del 95%, 0,35-0,95; p = 0,003) frente a placebo, con atorvastatina en dosis de 80 mg/día.
Tratamiento de la estenosis carotídea aterotrombótica
Los resultados finales de los estudios ECST73 y NASCET74 han demostrado la eficacia de la endarterectomía carotídea, en determinadas condiciones, en la prevención de recurrencias en pacientes con estenosis carotídea sintomática > 70% que han experimentado un AIT o un ictus menor (grado de recomendación A, basado en evidencias de tipo I).
Siguiendo los resultados finales del estudio NASCET, está indicado el tratamiento quirúrgico de la estenosis carotídea sintomática cuando ésta es del 70% o superior y probablemente de la estenosis del 60% o superior si consideramos los resultados del estudio europeo ECST. En la figura 5 se muestra la equivalencia entre ambos estudios.
Fig. 5. Cuantificación del grado de estenosis carotídea. Correlación entre los métodos NASCET y ECST. ACC: arteria carótida común.
Angioplastia o endarterectomía en la estenosis carotídea: situación actual
Los estudios NASCET y ECST, en los que se basa la indicación de endarterectomía carotídea, han sido criticados y cuestionados en cuanto a la capacidad de reproducir sus resultados en la práctica clínica diaria. Los centros y los cirujanos fueron seleccionados de forma escrupulosa, lo que cuestiona la generalización de los resultados a otros centros y cirujanos con una experiencia y estándares de calidad probablemente inferiores. La angioplastia transluminal percutánea surge como alternativa a la endarterectomía carotídea, considerando que la morbimortalidad quirúrgica no es despreciable (5,8%) y el margen riesgo/beneficio respecto al tratamiento médico es muy estrecho. El estudio CAVATAS75 (Carotid and Vertebral Artery Transluminal Angioplasty Study) mostró que la morbimortalidad de la endarterectomía carotídea y la angioplastia transluminal percutánea es similar y que el beneficio obtenido a los 3 años no difiere significativamente del conseguido en los estudios NASCET y ECST. Por tanto, la angioplastia carotídea no ha mostrado un mayor beneficio en sus resultados finales respecto a la endarterectomía y, aunque debería reservarse para casos en los que la endarterectomía esté contraindicada, sería una opción excelente en equipos con experiencia y baja morbimortalidad. Los estudios en marcha muestran una cada vez menor tasa de complicaciones, por lo que es muy posible que en un futuro próximo su espectro de aplicación se amplíe. Este descenso en la morbimortalidad se debe, por un lado, a la curva de aprendizaje, pero especialmente a la introducción de modificaciones de la técnica, como la colocación de una endoprótesis metálica (stent). El stent tiene una configuración de malla que evita la disección de la íntima, lo que disminuye la tasa de reestenosis y los embolismos distales tras dilatación del balón de angioplastia. Otro elemento que ha permitido un descenso de las complicaciones embólicas distales ha sido la colocación de «paraguas de protección» que, situados distalmente durante la dilatación, actúan como filtro de posibles fragmentos desprendidos de la placa.
En la tabla 4 se recogen las indicaciones actuales de la angioplastia carotídea. A día de hoy, la angioplastia debe considerarse una técnica experimental y su utilización debería hacerse en el contexto de estudios o ensayos clínicos. Pese a todo, debemos considerar su utilización en pacientes rechazados para la cirugía por motivos anatómicos, por coexistencia de múltiples factores de riesgo que hagan prever un incremento de morbimortalidad en la endarterectomía (factores de riesgo vascular acumulados, estenosis/oclusión contralateral, estenosis distales) o que no pueden recibir anestesia general.
Por otro lado, la angioplastia puede estar contraindicada igualmente por factores anatómicos (estenosis muy calcificadas o vasos muy tortuosos) o por elementos que incrementen el riesgo de ictus, como es el caso de estenosis preoclusivas/seudooclusiones o las estenosis críticas con trombos no organizados, en donde el catéter que debe pasar por la estenosis puede desprenderlos y provocar embolismos distales.
Indicación quirúrgica en estenosis asintomáticas: prevención primaria
Uno de los capítulos más controvertidos es la realización de endarterectomía carotídea en pacientes con una estenosis carotídea asintomática. El estudio ACAS77, y recientemente los resultados del estudio ACST78, demuestran la superioridad de la endarterectomía frente a tratamiento médico en pacientes con estenosis carotídea asintomática > 70% (criterios NASCET). Sin embargo, pese a la significación estadística obtenida, la diferencia absoluta respecto a los eventos primarios en 5 años fue de un 5,8%, lo que requiere la realización de cerca de 85 endarterectomías para prevenir un ictus en 2 años, siempre que la morbimortalidad del equipo quirúrgico sea < 3%. Estas cifras, con la morbimortalidad exigida, en un ensayo realizado por equipos quirúrgicos seleccionados con criterios muy estrictos en los que se exigía una experiencia y eficiencia elevadas, dificultan enormemente la generalización de estos resultados en la clínica diaria, motivo por el que se debe ser muy estricto en la indicación de endarterectomía en la estenosis carotídea asintomática. Este aspecto es más evidente si consideramos que, en pacientes sintomáticos, el número que es necesario tratar (NNT) es de 7-8 endarterectomías para evitar un ictus (tabla 5).
Uno de los aspectos actualmente en desarrollo es la aplicación técnicas que permitan la identificación de los pacientes de mayor riesgo. Esto posibilitaría en un futuro próximo la identificación y la clasificación de pacientes con estenosis carotídea en 2 grupos: de bajo riesgo (tratamiento médico) y de alto riesgo (endarterectomía/angioplastia).
ICTUS HEMORRAGICO
El ictus hemorrágico constituye el 15-20% del total, con un tasa de mortalidad a los 30 días del 35-52% y con la mitad de las muertes producidas en los 2 primeros días80,81. El diagnóstico temprano, el tratamiento adecuado y la prevención determinarán su pronóstico evolutivo.
El ictus hemorrágico comprende la hemorragia intracerebral (HIC), colección de sangre dentro del parénquima cerebral producida por una rotura vascular espontánea no traumática, y la hemorragia subaracnoidea (HSA), definida como una sangrado en el espacio subaracnoideo.
El ictus hemorrágico es el ictus más frecuente en pacientes menores de 40 años de edad, y es 2-3 veces más habitual en la raza negra y también en la asiática82.
La HTA es la causa más frecuente de HIC no traumática (60%)83. La HIC puede ser secundaria a una coagulopatía, a tratamientos trombolíticos y a anticoagulantes en un 6-10%. La antiagregación plaquetaria se ha asociado con una mayor tendencia no estadísticamente significativa de HIC. La angiopatía cerebral amiloidea es causa de un 5-10% de las HIC, y es más frecuente en pacientes ancianos y con deterioro cognitivo. El diagnóstico es neuropatológico y se sospecha ante hemorragias recidivantes en pacientes ancianos con deterioro cognitivo. Las malformaciones arteriovenosas y los aneurismas también pueden ser causa de HIC. Los tumores cerebrales más vascularizados, como las metástasis de melanoma, el hipernefroma y el coriocarcinoma, pueden ser causa de HIC.
En el 90% de los casos, la HSA es secundaria a la rotura de una aneurisma cerebral.
Otras causas menos frecuentes incluyen vasculitis, infartos venosos secundarios a trombosis de los senos venosos cerebrales, infecciones del sistema nervioso central (SNC) y consumo de cocaína y anfetaminas.
El 50% de las HIC son de localización profunda a los hemisferios cerebrales, en los ganglios de la base (putamen, cápsula interna, caudado y tálamo). La HTA es el factor implicado en la mayoría de ellas.
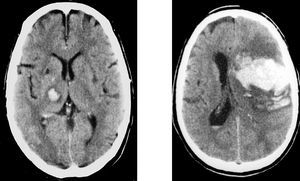
El 40% de las HIC son de localización lobar, la mayoría en los lóbulos parietal y occipital. En la HIC de localización lobar, aparte de la HTA, deben tenerse en cuenta otras etiologías, como malformaciones vasculares en pacientes jóvenes, metástasis, y la angiopatía amiloidea en pacientes ancianos (fig. 6).
Fig. 6. Hemorragia intracerebral. A la izquierda: hemorragia intracerebral profunda (cápsulo-talámica) hipertensiva. A la derecha: hemorragia intracerebral lobar.
El 10% restante es infratentorial, cerebeloso y protuberancial.
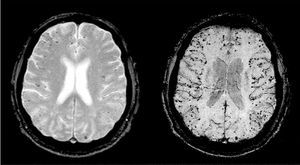
Para el diagnóstico del ictus hemorrágico es esencial la práctica de la neuroimagen. Se sospecha ante la clínica de focalidad neurológica aguda, y la TC-C o la RM detectarán el sangrado. Secuencias específicas de RM de gradiente eco que detectan el efecto paramagnético de la desoxihemoglobina y la metahemoglobina permiten detectar sangrados crónicos parenquimatosos (microbleeds) (fig. 7).
Fig. 7. Microsangrados. Imagen por resonancia magnética con secuencias de eco-gradiente que muestra microsangrados (microbleeds) corticales compatibles con angiopatía amiloide cerebral.
La arteriografía cerebral está indicada en la HSA y ante la sospecha de malformaciones vasculares.
En los últimos años se han realizado avances importantes, con un mejor conocimiento de la fisiopatología y los factores implicados en el crecimiento de la HIC y el deterioro neurológico84-87, tratamientos médicos para limitar el crecimiento del hematoma88 y técnicas quirúrgicas nuevas que aportan expectativas esperanzadoras para el futuro de esta enfermedad.
El ictus hemorrágico debe considerarse una emergencia médica y requiere un traslado urgente a un centro hospitalario con los recursos adecuados para el tratamiento de esta enfermedad89.
El control de las constantes (como en el ictus isquémico), la estabilización de la respiración, la hipoxia, el control de la presión arterial, la glucemia y la temperatura, la prevención y el tratamiento de complicaciones, la prevención secundaria y la rehabilitación precoz son fundamentales para evitar mayor daño neurológico. Se recomienda el seguimiento neurológico en la fase aguda en unidades especializadas89.
El aumento de la HIC puede contribuir a un deterioro neurológico precoz, por lo que debe corregirse rápidamente cualquier trastorno de la coagulación. En los pacientes sin trastorno de la coagulación, un tratamiento hemostático precoz contribuiría a minimizar el aumento de volumen del hematoma y mejorar el pronóstico90. El Factor VII recombinante activado administrado en las primeras 4 h del inicio de la clínica es el único tratamiento que ha demostrado seguridad y eficacia. En un estudio prospectivo, aleatorizado con placebo, con 400 pacientes, se ha demostrado la limitación del crecimiento del hematoma, una disminución de la mortalidad y un mejor pronóstico funcional respecto a placebo88.
El tratamiento quirúrgico aún está por definir y solamente está aceptado en determinados casos8,89. En la hemorragia cerebelosa > 3 cm con compresión del tronco e hidrocefalia se recomienda realizar un drenaje quirúrgico precoz. Se recomienda la colocación de un drenaje ventricular en los casos de HIC con hidrocefalia secundaria. En la HSA, la colocación de coils para reparar el aneurisma roto se recomienda de manera temprana.
En la HIC espontánea, los resultados de la cirugía en hemorragias profundas de los ganglios basales no son concluyentes. En la hemorragia lobar, según la localización, el estado del paciente y el tamaño de la hemorragia, puede ser una opción que cabe considerar, aunque no hay suficientes pruebas científicas. En el estudio STICH91 se comparó una intervención quirúrgica temprana con el tratamiento inicial conservador, sin que se encontraran diferencias considerables. Los pacientes jóvenes con hemorragia lobar que presentan deterioro neurológico por crecimiento de la hemorragia pueden ser considerados para un drenaje quirúrgico8,89.
Las técnicas quirúrgicas están avanzando y nuevos procedimientos, como pequeñas craniectomías guiadas por sistemas de neuronavegación, técnicas microquirúrgicas o evacuaciones endoscópicas, pueden aportar resultados prometedores89.
Full English text available from: www.revespcardiol.org
Sección patrocinada por el Laboratorio Dr. Esteve
Correspondencia: Dr. J. Serena Leal.
Hospital Universitari Dr. Josep Trueta. Servicio de Neurología.
Avda. França, s/n. 17007 Girona. España.
Correo electrónico: nrl.jserena@htrueta.scs.es