La insuficiencia del ventrículo derecho en el postoperatorio de una cirugía cardiaca es una importante causa de morbilidad y mortalidad. La circulación extracorpórea, el recambio valvular mitral, el implante de un sistema de asistencia ventricular izquierda o el trasplante cardiaco son importantes estímulos precipitantes de la insuficiencia del ventrículo derecho, sobre todo en determinadas poblaciones. Identificar estas poblaciones permitirá seleccionar mejor las distintas terapias y aplicar tratamientos que reduzcan el riesgo. En este artículo se definen los subgrupos de riesgo, las herramientas para identificarlos, la fisiopatología implicada y su pronóstico.
Palabras clave
La insuficiencia del ventrículo derecho (VD) en el postoperatorio de una cirugía cardiaca es una importante causa de morbilidad y mortalidad. Se produce en el 0,1% de las cardiotomías, fundamentalmente en la cirugía de recambio valvular mitral (RVM), en la revascularización coronaria y en la reparación de determinadas cardiopatías congénitas, en un 2-3% de los trasplantes cardiacos (TxC) y en un 20-30% de los pacientes a los que se implanta asistencia ventricular izquierda (AVI)1–3. En este artículo se definen los subgrupos de riesgo, las herramientas para identificarlos, la fisiopatología implicada y su pronóstico.
El ventrículo derechoLa función principal del VD es recoger la sangre desoxigenada de la circulación sistémica y enviarla a los pulmones para que se lleve a cabo el intercambio gaseoso. Para que este intercambio se produzca, es necesario un sistema de membranas altamente permeables; por lo tanto, la presión dentro de la circulación pulmonar ha de ser baja, para evitar que, por la ley de presiones de Starling, se produzca edema pulmonar. Luego el VD es una cámara cardiaca adaptada para trabajar a baja presión. Estas condiciones especiales de trabajo, diferentes de las del ventrículo izquierdo, determinan distintas anatomía, mecánica y adaptación a las agresiones.
La sobrecarga de volumen —como, por ejemplo, en pacientes con una comunicación interauricular por hiperflujo o el aumento de la poscarga en los pacientes con hipertensión pulmonar (HP)— produce en el VD una serie de mecanismos adaptativos, como son la hipertrofia de la pared libre o la dilatación progresiva de la cavidad, que consiguen mantener una función y una hemodinámica aceptables hasta que, en fases avanzadas, aparece la disfunción progresiva y grave y, finalmente, el fracaso funcional o colapso hemodinámico.
En ocasiones, existen diversos factores que pueden precipitar esta insuficiencia del VD y, por lo tanto, el deterioro hemodinámico, como la disfunción ventricular izquierda, fundamentalmente la actividad contráctil del septo interventricular, la pérdida de la contracción auricular eficaz, la asincronía auriculoventricular o la isquemia miocárdica1,4.
La cirugía cardiaca con circulación extracorpórea (CEC), los cambios anatómicos y funcionales tras el implante de un sistema de AVI o el TxC son importantes estímulos precipitantes de la insuficiencia del VD.
Insuficiencia del ventrículo derecho tras cardiotomíaTras la cardiotomía, la insuficiencia del VD depende fundamentalmente de su estado previo a la cirugía y del tiempo de CEC.
Que se emplee o no la CEC en una cirugía cardiaca es un factor determinante en el postoperatorio de los pacientes, ya que se asocia a la aparición de múltiples complicaciones, mayores en ventrículos previamente disfuncionantes. Las principales causas de insuficiencia cardiaca son las complicaciones mecánicas como el taponamiento, las alteraciones fisiológicas como precargas inadecuadas por la vasoplejía o el sangrado, el aumento de la poscarga debido a la vasoconstricción inducida por la hipotermia o la menor liberación de óxido nítrico al tratarse de un flujo no pulsátil, y la inadecuada contractilidad por hipoxia o isquemia durante el procedimiento o el daño por reperfusión inducido por la liberación de moléculas con efectos cardiotóxicos cuando los tiempos han sido muy largos o no se realiza una adecuada protección miocárdica.
No hay ninguna duda sobre el importante papel pronóstico de la función sistólica del ventrículo izquierdo en el postoperatorio de una cirugía cardiaca, pero ahora además existen pequeños estudios que reconocen también el papel de la función del VD prequirúrgica como predictor de mortalidad e insuficiencia cardiaca. En el trabajo de Haddad et al5, una fracción de acortamiento del VD < 32% o un índice de comportamiento miocárdico o Tei ≥ 0,50 en pacientes con valvulopatía mitral o aórtica derivados a cirugía se asocia a un incremento de la morbilidad y la mortalidad tras la cirugía.
De igual forma, Maslon et al6 realizaron un análisis retrospectivo de 41 pacientes con disfunción ventricular izquierda grave secundaria a cardiopatía isquémica, en los que se llevó a cabo una revascularización quirúrgica con CEC, y compararon las diferencias de morbilidad y mortalidad entre el subgrupo de pacientes que además presentaban disfunción del VD, 7 pacientes (17%), y los pacientes sin disfunción. La función del VD se midió con la fracción de acortamiento de área por ecocardiograma según fuera < 35% o ≥ 35%. Se observó que los pacientes con disfunción del VD prequirúrgica presentaban un aumento significativo de los días de estancia en la unidad de cuidados intensivos (UCI), necesidad de ventilación mecánica prolongada, necesidad de más de un inotrópico en el postoperatorio y mortalidad precoz.
Los pacientes con cardiopatía izquierda pueden contraer disfunción del VD por varios mecanismos: a) HP; b) miocardiopatía que afecta a ambos ventrículos, idiopática, displasia arritmogénica, miocarditis, etc.; c) isquemia del VD por bajo gasto cardiaco, y d) interdependencia ventricular.
La HP asociada es el mecanismo más frecuente: el 60% de los pacientes con disfunción sistólica, el 70% de los pacientes con disfunción diastólica, un 15-20% de los pacientes con insuficiencia mitral, hasta el 70% de los pacientes con estenosis mitral, el 15% de los pacientes con insuficiencia aórtica grave y el 40% de los pacientes con estenosis aórtica grave7–12.
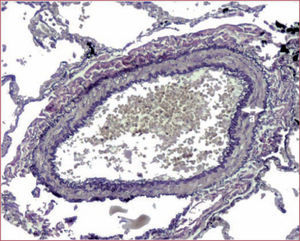
La HP puede ser reversible o irreversible con el tratamiento de la causa. En el paciente con cardiopatía izquierda, se produce un aumento de la presión de llenado del ventrículo izquierdo, la aurícula izquierda o las venas pulmonares que se acompaña de un aumento en paralelo de la presión en la arteria pulmonar (PAP) para mantener el gradiente transpulmonar (GT) y, por lo tanto, un flujo sanguíneo adecuado hacia las cavidades izquierdas, se produce una HP pasiva y, por ello, reversible. Con el paso del tiempo, el aumento persistente de las presiones pulmonares produce daño endotelial, con mayor producción de sustancias vasoconstrictoras y proliferativas como la endotelina- 1 y disminución de la producción de óxido nítrico, lo que da lugar a un remodelado vascular con hipertrofia de la media y fibrosis de la íntima (fig. 1), HP reactiva, al principio con cierto grado de reversibilidad con el tratamiento de la causa, y después fija7.
Marcada hipertrofia de la capa media en un paciente con insuficiencia cardiaca izquierda e hipertensión pulmonar. Imagen reproducida con permiso de Delgado7.
Otros factores asociados al desarrollo de HP que contribuyen al aumento retrógrado del volumen y la presión son el tamaño y la contracción de la aurícula izquierda y la edad del paciente; a edades más avanzadas, hay mayor disfunción diastólica del ventrículo izquierdo y mayor engrosamiento de la capa media de los vasos, por lo que se produce disminución de su elasticidad y su adaptación al aumento de presión8.
En las últimas guías clínicas sobre diagnóstico y manejo de las valvulopatías del American College of Cardiology/American Heart Association de 2006 y de la Sociedad Española de Cardiología de 2007, se recomienda la cirugía, con indicación de clase IIa y nivel de evidencia C (opinión de expertos), para pacientes con insuficiencia mitral e HP asociada, independientemente de los síntomas, la morfología o la fracción de eyección del ventrículo izquierdo. Esta indicación se basa en trabajos como el de Barbieri et al9 en los que el manejo conservador de este grupo de pacientes da lugar a un incremento en la mortalidad total y de causa cardiovascular muy superior al de los pacientes con tratamiento quirúrgico. Sin embargo, la cirugía en estos pacientes no está exenta de riesgos; así, la mortalidad total en el postoperatorio es 2,2 veces superior a la de los pacientes sin HP y el riesgo de disfunción del VD es 2,5 veces superior.
De manera similar, en el trabajo de Ghoreishi et al8, los pacientes con HP presentaban mayor mortalidad operatoria, que aumentaba con la gravedad (sin HP, 2%; PAPs en 40-50mmHg, 3%; PAPs en 50-60mmHg, 8%, y PAPs > 60mmHg, 12%). Además aumentaba la necesidad de ventilación prolongada, la disfunción renal, la necesidad de diálisis y la estancia en la unidad de cuidados postoperatorios.
Podemos encontrar unos resultados parecidos en la cirugía de reemplazo valvular mitral (RVM) por estenosis mitral, teniendo en cuenta que esta probablemente sea la cardiopatía izquierda con mayor incidencia de HP, presente en un 70% de los pacientes, con una HP desproporcionada en torno al 20%10.
El punto de corte establecido es la presencia de una PAP sistólica (PAPs) > 50mmHg medida por ecocardiograma o una PAP media (PAPm) > 25mmHg medida por cateterismo derecho, aunque es probable que lo que mejor determine los resultados tras la cirugía no sea tanto el grado de HP, sino cuán afectado esté el VD.
Insuficiencia del ventrículo derecho tras el implante de asistencia ventricular izquierdaEl empleo de AVI en el tratamiento de la insuficiencia cardiaca es cada vez más frecuente en la práctica clínica, bien como puente a la recuperación o al TxC, bien como terapia definitiva. Sin embargo, su uso no está exento de complicaciones de diversos tipos, infecciosas, hemorrágicas y también hemodinámicas, como insuficiencia precoz del VD en un 20-30% de los pacientes1.
La insuficiencia del VD, en este caso, se debe a varios mecanismos: las complicaciones derivadas de la CEC, como ya hemos visto, el aumento brusco de precarga en el VD que hasta entonces recibía un volumen sanguíneo mucho menor procedente de un ventrículo izquierdo disfuncionante, y la descarga brusca de volumen y de presión del ventrículo izquierdo, que induce un cambio en la disposición del septo interventricular y, con ello, un cambio en la geometría del VD, con empeoramiento de la insuficiencia tricuspídea y disminución de la contribución de la contracción septal durante la sístole, todo ello mal tolerado en ventrículos previamente disfuncionantes13.
Al igual que en los demás subgrupos de riesgo, la insuficiencia del VD se asocia a un aumento de la mortalidad postoperatoria de hasta un 40% y también de la morbilidad, con mayor porcentaje de disfunción hepática, disfunción renal y fallo multiorgánico, estancia en UCI, necesidad de fármacos vasoactivos a dosis altas e implante adicional de asistencia ventricular derecha (AVD), con los inconvenientes que esto supone, sobre todo el aumento de la incidencia de hemorragias y la necesidad de reesternotomía, y una supervivencia significativamente menor13,14.
Por lo tanto, es importante analizar y determinar qué factores predicen la aparición de la insuficiencia del VD para, desde el principio, hacer una adecuada selección del dispositivo de asistencia más apropiado. Podemos distinguir tres grupos de factores de riesgo: demográficos, clínicos y hemodinámicos. Desde el punto de vista demográfico, Ochiai et al15 realizaron un análisis retrospectivo en 245 pacientes a los que se había implantado una AVI, de los que 23 (9%) habían necesitado, la mayoría a los pocos días, implante adicional de una AVD. Al comparar los dos grupos, se definieron como factores de riesgo demográficos una superficie corporal baja (1,85±0,20 frente a 1,96±0,21m2; p=0,01), el sexo femenino (el 39 frente al 13%; p=0,003) y la etiología no isquémica.
En el trabajo de Farrar et al16, de 139 pacientes que recibieron una AVI y posteriormente AVD o asistencia biventricular desde el principio, tan solo el 46% eran cardiopatías isquémicas, y el otro 64% eran cardiopatías no isquémicas. Desde el punto de vista clínico, tanto en el trabajo de Ochiai et al15 como en los de Kromos et al17, Pagani et al18, Fukamachi et al19 y Matthews et al20, se definieron como factores predictores de la insuficiencia del VD la disfunción hepática (bilirrubina > 3mg/dl, hipertransaminasemia con cifras 5 veces superiores a las normales o un INR > 1,5 en ausencia de anticoagulación), la disfunción renal (creatinina > 3mg/dl), la ventilación mecánica o la asistencia circulatoria tipo ECMO previa al implante. Finalmente, desde el punto de vista hemodinámico, tanto los trabajos de Ochiai et al15 como los de Matthews et al20 demostraron que valores bajos de PAPm (33±7 frente a 37±9mmHg; p=0,04), PAP diastólica (25±7 frente a 29±8mmHg; p=0,03), trabajo sistólico del VD bruto (543±392 frente a 780±437; p=0,037) e indexado por superficie corporal (285±196 frente a 400±221; p=0,046) se asocian a un VD disfuncionante y predicen la necesidad de una AVD. Estos parámetros hemodinámicos se traducen en que se trata de un VD que no tiene la suficiente capacidad contráctil para elevar la PAP en presencia de unas resistencias vasculares pulmonares altas.
Otros factores que no debemos olvidar antes de decidir el tipo de asistencia son los parámetros ecocardiográficos como el diámetro del VD, el movimiento longitudinal del anillo lateral tricuspídeo (TAPSE), el índice Tei, la fracción de acortamiento, la gravedad de la insuficiencia tricuspídea y el diámetro y el grado de colapso de la vena cava inferior.
Si tenemos en cuenta estos factores, podremos seleccionar mejor el tipo de dispositivo, asistencia biventricular o izquierda aislada y, por lo tanto, reducir la mortalidad y la morbilidad de estos pacientes.
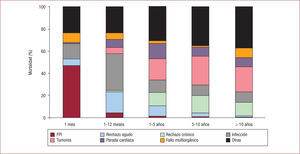
Insuficiencia del ventrículo derecho en el trasplante cardiacoA pesar de los numerosos avances en el manejo de la insuficiencia cardiaca y en el perioperatorio del TxC, la insuficiencia del VD en el postoperatorio inmediato sigue siendo una de las principales causas de mortalidad y morbilidad. En el último informe de la Sociedad Internacional de Trasplante de Corazón y Pulmón de 201121, el periodo de mayor mortalidad tras el trasplante sigue siendo el primer año, y las principales causas de muerte son el fallo primario del injerto (FPI), la infección, el fallo multiorgánico y el rechazo agudo; aún más, el FPI es la primera causa de muerte en los primeros 30 días, con más de un tercio del total (39%). Estos resultados coinciden con los obtenidos en el registro español22 (fig. 2). Además de una causa importante de mortalidad, el FPI supone un aumento en el soporte circulatorio inotrópico y mecánico de hasta el 20% durante el postoperatorio23.
Causas de muerte por periodos de tiempo en el trasplante cardiaco. Reproducida con permiso de Almenar et al22. FPI: fallo primario del injerto.
Teniendo en cuenta estos datos, es importante conocer las causas o factores que se asocian a su aparición. Estos factores de riesgo se pueden clasificar según estén relacionados con el donante, el receptor o el procedimiento (tabla)23, aunque más que cada uno de ellos tomado individualmente, es la combinación de varios lo que incrementa el riesgo de manera considerable24.
Factores de riesgo asociados al desarrollo de fracaso primario del injerto.
| Relacionados con el donante |
| Edad |
| Causa de la muerte |
| Uso de altas dosis de fármacos vasoactivos |
| Disfunción ventricular en el ecocardiograma |
| Disfunción de otros órganos |
| Relacionados con el receptor |
| Edad |
| Ventilación mecánica |
| Tratamiento con fármacos vasoactivos |
| Soporte circulatorio mecánico |
| Hipertensión pulmonar desproporcionada |
| Obesidad |
| Diabetes mellitus |
| Relacionados con el procedimiento |
| Tiempo de isquemia |
| Discordancia > 20% entre la superficie corporal del donante y la del receptor |
| Trasplante combinado |
| Obstrucción en relación con la sutura de la arteria pulmonar |
El VD, con una menor masa muscular, sería más vulnerable a estos factores, y el principal precipitante sería la HP previa al trasplante. Aproximadamente el 66% de los pacientes con insuficiencia cardiaca crónica remitidos para valoración de TxC tienen HP25. Los trabajos de Chen et al26 y Klotz et al27 demostraron que tras el TxC los pacientes con HP, en comparación con aquellos sin HP, presentaban un aumento en el número de complicaciones cardiacas, fundamentalmente insuficiencia del VD (el 64 y el 27%). Sin embargo, los trabajos de Drakos et al28 y Goland et al29 mostraron que los pacientes con HP reversible, es decir, cuando las resistencias vasculares arteriolares pulmonares (RVAP) son < 6 UW y el gradiente transpulmonar (GT) < 15mmHg tras una adecuada optimización del tratamiento para la insuficiencia cardiaca o vasodilatadores pulmonares como el óxido nítrico o el sildenafilo, la mortalidad a corto y a largo plazo es similar a la de los pacientes sin HP.
En conclusión, los pacientes con insuficiencia cardiaca crónica remitidos para valoración de TxC con HP pasiva o reversible con el tratamiento de la insuficiencia cardiaca o vasodilatadores pulmonares podrán ser incluidos en lista de espera teniendo en cuenta el alto riesgo de insuficiencia del VD y evitando otros factores que puedan incrementar este riesgo, como los tiempos de isquemia largos, mientras que los pacientes con HP desproporcionada e irreversible no podrán recibir un TxC.
Conflicto de interesesM.A. Gómez Sánchez declara haber recibido honorarios como ponente de INO Therapeutics-Linde.