Recientemente, el polvo desértico se ha reconocido en Asia como desencadenante de infarto agudo de miocardio. En España, las entradas de polvo sahariano están relacionadas con empeoramientos de la calidad del aire debidos a aumentos en las concentraciones de material particulado en el aire ambiental. Nuestro objetivo es dilucidar si los eventos de polvo sahariano tienen relación con la incidencia de síndrome coronario agudo (SCA) en pacientes que habitan cerca del norte de África, la mayor fuente global de polvo desértico.
MétodosSe analizan prospectivamente los datos de 2.416 pacientes consecutivos hospitalizados por SCA en un hospital terciario (Islas Canarias, España), desde diciembre de 2012 hasta diciembre de 2017. La Red Europea de Calidad del Aire midió las concentraciones de material particulado de diámetro aerodinámico <10 μm (PM10) y gases reactivos. Se aplicó un diseño mediante estratificación en el tiempo de casos cruzados, utilizando modelos de regresión condicional de Poisson, para estimar el impacto de los eventos de polvo sahariano de PM10 en la incidencia de SCA.
ResultadosLos eventos de polvo sahariano observados los días 0 a 5 tras el inicio del SCA no mostraron asociación significativa con la incidencia de SCA. Los cocientes de tasas de incidencia de las concentraciones de PM10 1, 2, 3, 4 y 5 días antes del inicio del SCA (para cambios de 10 μg/m3) fueron 1,27 (IC95%, 0,87-1,85), 0,92 (IC95%, 0,84-1,01), 0,74 (IC95%, 0,45-1,22), 0,98 (IC95%, 0,87-1,11) y 0,95 (IC95%, 0,84-1,06).
ConclusionesEs poco probable que la exposición a polvo sahariano tenga relación con la incidencia de SCA.
Palabras clave
La inhalación de contaminantes atmosféricos relacionados con la combustión ha pasado a ser una amenaza mundial para la salud humana. Según la Organización Mundial de la Salud, las partículas de diámetro aerodinámico <10 μm y <2,5 μm (PM2,5) tienen unas repercusiones en la salud más negativas que las de los contaminantes gaseosos1. En Europa, en cuyo material particulado (PM) predominan los componentes relacionados con la combustión (p. ej., carbón negro, carbón orgánico, sulfato, nitrato)2, un 15-28% de la mortalidad cardiovascular total se atribuye a la contaminación atmosférica3.
Los efectos en la salud que produce la inhalación de partículas de polvo del desierto traídas por el viento en el aire ambiental (como consecuencia de las tormentas de arena) están pasando a ser un tema de creciente interés mundial4,5. Este tipo de polvo mineral es, con mucho, el factor contribuyente más importante por lo que respecta a las concentraciones de PM10 y PM2,5 en grandes regiones subtropicales, como el norte de África, Oriente Medio y partes de Asia4. En estudios de revisión se ha resaltado la existencia de un desequilibrio entre las áreas más expuestas al polvo del desierto (norte de África) y las áreas más estudiadas por lo que respecta a los efectos en la salud, principalmente Europa y Asia5. Por ejemplo, Kojima et al.6 estudiaron la exposición al polvo asiático y señalaron que es probable que esos eventos de presencia de polvo sean un potencial desencadenante de infarto agudo de miocardio (IAM) en pacientes de la prefectura de Kumamoto (Japón). En el mundo faltan estudios realizados cerca de los orígenes del polvo5.
La emisión mundial de polvo del desierto oscila entre 1.500 y 2.000 Tg año−17. El norte de África es el principal origen del total de polvo desértico mundial, y supone un 50-70% de las emisiones mundiales. El polvo del norte de África se transporta regularmente sobre el Atlántico Norte (lo que da lugar a concentraciones habituales de decenas a centenares de μg/m3), y también de forma episódica sobre el Mediterráneo y Europa (con concentraciones habituales de unas decenas de μg/m3)7,8.
Las Islas Canarias están situadas en el Atlántico Norte (figura 1), y están bajo la influencia de los vientos alisios atlánticos, lo que contribuye a producir unos valores basales bajos de PM10 y PM2,5 (∼15 y 8 μg/m3 respectivamente), es decir, unas condiciones de calidad del aire más o menos buenas. Sin embargo, las Islas Canarias están muy cerca del norte de África (∼500km) y reciben impactos frecuentes de aire portador de polvo procedente del desierto del Sahara, y esta situación implica aumentos de las concentraciones de PM10 y PM2,5 que pueden alcanzar valores> 100 μg/m3. Estas concentraciones de PM son muy superiores a las que se dan en Europa y> 50 μg/m3 de PM10, que es el valor límite diario recomendado en la Air Quality Guideline de la Organización Mundial de la Salud1. Estas características brindan una oportunidad ideal para investigar los efectos del polvo desértico en la enfermedad cardiovascular en poblaciones que viven cerca de los principales orígenes de polvo9. Para el presente trabajo, se diseñó un estudio cruzado de casos, con estratificación temporal, para esclarecer la asociación entre la exposición al polvo sahariano y la incidencia del síndrome coronario agudo (SCA) en pacientes que viven cerca del norte de África, el principal origen de polvo desértico en el mundo.
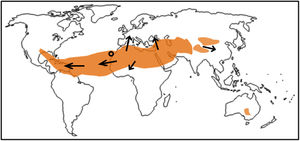
Distribución mundial de las áreas con deterioro de la calidad del aire a causa del polvo del desierto. Las flechas resaltan las rutas principales de transporte. El círculo negro indica la localización de Tenerife. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Las Islas Canarias son un archipiélago de origen volcánico situado en la parte oriental del Atlántico Norte (figura 1). Este estudio se llevó a cabo en Tenerife, que es la isla de mayor tamaño (2.034,38km2). El clima se caracteriza por vientos alisios (marzo a agosto) que contribuyen a producir una rápida dispersión de los contaminantes atmosféricos locales y ayudan a mantener una calidad del aire bastante buena en la mayor parte del archipiélago. Aunque pueden producirse episodios de polvo sahariano a lo largo del año, hay 2 temporadas de polvo10 separadas entre sí por las condiciones climáticas: a) noviembre a marzo, y b) julio a agosto.
Datos de los pacientesEl estudio se llevó a cabo en un hospital de nivel terciario (Tenerife, España) que presta asistencia médica a los residentes en la parte norte de la isla de Tenerife, una población de 343.025 habitantes. La parte norte de Tenerife incluye principalmente zonas residenciales, por lo que sus habitantes se desplazan cada mañana a trabajar a otras partes de las islas (en su mayor parte a la capital, Santa Cruz, y a la parte sur de Tenerife), y están expuestos a las condiciones de calidad del aire de toda la isla. En nuestro estudio se incluyó a todos los pacientes a los que se diagnosticó un SCA con o sin IAM entre diciembre de 2012 y diciembre de 2017 en nuestro centro. El IAM se definió según la guía vigente por la presencia de síntomas de isquemia miocárdica y un aumento de los marcadores de necrosis miocárdica11,12.
Se registraron prospectivamente diversas variables clínicas de todos los pacientes: factores de riesgo coronario, edad, sexo, enfermedad vascular previa, presencia de asma o enfermedad pulmonar obstructiva crónica, enfermedad renal crónica, fibrilación auricular, número de vasos coronarios afectados (registrados a partir de la coronariografía), fracción de eyección del ventrículo izquierdo, clase de Killip, concentración de troponina I, intervención coronaria (angioplastia coronaria transluminal percutánea o cirugía de revascularización coronaria), duración de la hospitalización, mortalidad hospitalaria y mortalidad a 1 año.
Este estudio fue aprobado por el Comité Ético de Investigación Clínica de un hospital de nivel terciario (Hospital Universitario de Canarias).
Calidad del aire, polvo del desierto y variables meteorológicasSe registraron cada día de menera prospectiva los datos climáticos, las concentraciones de PM10, PM2,5-10, PM2,5 y contaminantes gaseosos (NOx, O3 y SO2) entre diciembre de 2012 y diciembre de 2017. Estos datos se obtuvieron de la Red de Calidad del Aire de las Islas Canarias, que forma parte de la Red de Calidad del Aire Europea y realiza un seguimiento de los contaminantes particulados (PM10 y PM2,5) y gaseosos mediante los métodos y procedimientos de referencia obligatorios establecidos por la legislación de la Unión Europea (Directiva 2008/50/EC). La red proporciona con una resolución horaria los datos que se transmiten a la Agencia Europea del Medio Ambiente. Se determinaron y analizaron los valores medios diarios. Con objeto de obtener una imagen completa del impacto de los episodios de polvo sahariano en la calidad del aire, se trabajó inicialmente con los datos de varias estaciones de registro de la calidad del aire situadas en el norte (Balsa Zamora, de tipo residencial), nordeste (Depósito Tristán y Tena Artigas, de tipo residencial) y sur (El Río, de tipo rural) de Tenerife. Dado el contenido basal de PM más bien bajo y puesto que los episodios de polvo sahariano causan concentraciones elevadas de PM en toda la isla, las series temporales de PM en estas diversas zonas mostraron una alta correlación entre ellas. En consecuencia, se eligieron los registros con más datos disponibles (estación de Tena Artigas) para la inclusión en el análisis estadístico en relación con los datos médicos. Durante el periodo del estudio, las series temporales de concentraciones diarias de PM10 de Tena Artigas (disponibilidad, 98,4%) mostraron un coeficiente de correlación situado dentro del intervalo de 0,76 a 0,84 con las de las otras 3 estaciones durante el periodo de estudio (diciembre de 2012 a diciembre de 2017). La aparición de episodios de polvo sahariano se detectó con las predicciones validadas del Sand and Dust Storm – Warning Advisory and Assessment System (WMO SDS-WAS) de la Organización Meteorológica Mundial, cuyo centro de referencia regional para el norte de África, Oriente Medio y Europa gestionan la Agencia Meteorológica Estatal de España y el Centro de Supercomputación de Barcelona. El sistema de predicción de polvo del WMO SDS-WAS está formado por un modelo de predicción meteorológica que incluye también un módulo para la simulación del polvo (ciclo de emisiones, transporte y depósito)13. Esta predicción del polvo para las Islas Canarias fue validada por García-Castrillo y Terradellas14.
Análisis estadísticoLas variables cuantitativas y cualitativas se describen, respectivamente, con la mediana [intervalo intercuartílico] y el número (porcentaje). Se emplearon análisis de regresión de series temporales, que se emplean con frecuencia para el estudio de las asociaciones entre exposiciones agregadas y resultados de salud. El resultado es un recuento (generalmente el número de episodios por día) y la unidad principal de análisis es el día y no la persona individual. Dado que los factores de confusión propios del sujeto (como edad, sexo o diabetes) no cambian significativamente de un día a otro, esos factores carecen de repercusión en las estimaciones del efecto de las variables ambientales. Para introducir un control respecto a la estacionalidad y las tendencias temporales a largo plazo, se utilizó un diseño cruzado de casos con estratificación temporal, tomando como estratos el día de la semana en el mes15,16. La idea era comparar la exposición de un caso inmediatamente antes del episodio con la exposición de esa misma persona en otros momentos «de referencia» que por lo demás fueran similares. Dado que nuestros estratos eran los definidos por el día de la semana dentro de los meses, se compararon las exposiciones asociadas con un evento aparecido un día de la semana, por ejemplo un lunes, con las exposiciones de los demás lunes del mismo mes que se usaron como valores de referencia. Se preveía que estos estratos proporcionarían un control respecto a las covariables individuales y los cambios lentos o regulares del riesgo subyacente, como los de la estación, las tendencias a lo largo del tiempo o el día de la semana15,16.
Generalmente se emplea un modelo de regresión logística condicional para analizar las repercusiones de las variables ambientales en los episodios clínicos. Sin embargo, dada la influencia de las causas no medidas de eventos clínicos que varían con el paso del tiempo, los recuentos de eventos observados tienen generalmente una variación más amplia que la predicha por una distribución de Poisson15,16. Esta sobredispersión al emplear un modelo de regresión logística no se tiene en cuenta, ya que los resultados son binarios y, por consiguiente, la sobredispersión no es apreciable. Sin embargo, el supuesto de independencia entre conjuntos de casos y controles en un modelo logístico condicional parte implícitamente del supuesto de que no hay sobredispersión en los recuentos16. Además, la regresión logística condicional parte del supuesto de que las observaciones son independientes. Sin embargo, las observaciones próximas en el tiempo probablemente sean más similares que las distantes en el tiempo17 y es probable que haya una autocorrelación. En una situación así, el modelo habitual de regresión logística condicional no permite un ajuste respecto a la sobredispersión y la autocorrelación, que son causas frecuentes de subestimación de la incertidumbre o error de tipo 116.
Con objeto de superar todas estas limitaciones metodológicas siguiendo el método publicado por Armstrong et al.16, se empleó un modelo de regresión de Poisson condicional para aplicar un control respecto a la sobredispersión y la autocorrelación. La variable dependiente fue el número diario de SCA diagnosticados en el centro. Para realizar este análisis, fue preciso modificar la matriz de datos (). Se calcularon los cocientes de tasas de incidencia (CTI) con los intervalos de confianza del 95% (IC95%). Para determinar la influencia de las PM10, se aplicó un ajuste respecto a los siguientes contaminantes y variables ambientales: PM2,5-10, PM2,5, NO2, SO2, O3, temperatura y humedad. El modelo máximo se diseñó con las PM10, los contaminantes y las variables ambientales descritos anteriormente y las interacciones bidireccionales entre las PM10 y todas las demás variables. Todas estas interacciones se evaluaron y se eliminaron si no alcanzaban significación estadística. Se tuvo en cuenta también la posibilidad de que el impacto de las partículas se produjera con unos pocos días de retraso. Se estudió el efecto de un intervalo de retraso de solo 1 día, del día 0 al día 5. Se aplicó también un ajuste respecto a los efectos de esos diferentes intervalos de retraso entre ellos, elaborando un modelo de intervalos de retraso distribuido con estratificación según el intervalo16. Sin embargo, en ese último modelo, es probable que los términos de intervalos de retraso tengan una alta correlación. Con objeto de reducir la colinealidad de estos términos de intervalo de retraso, que lleva a estimaciones imprecisas, se impusieron algunas limitaciones en el modelo de intervalos de retraso distribuido, a saber, que las estimaciones del efecto para los días 1 y 2 fueran iguales y que las estimaciones del efecto para los días 3 a 5 fueran también iguales16. Se repitieron todos los análisis, calculando la incidencia del IAM en vez del SCA. Se verificaron los diagnósticos del modelo. Los valores de p <0,05 se consideraron estadísticamente significativos. Todos los análisis se realizaron con el programa STATA v.15 (StataCorp, Estados Unidos).
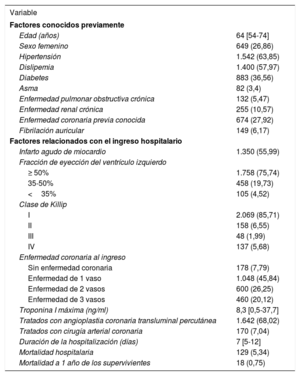
RESULTADOSPoblación del estudio, síndrome coronario agudo, PM10 y episodios de polvoDurante el periodo de estudio, se diagnosticó un SCA en el centro antes mencionado a 2.416 pacientes. La mediana de edad fue de 64 [54-74] años y 649 de los participantes (26,86%) eran mujeres. Un total de 1.350 pacientes (55,88%) sufrieron un IAM, 185 (7,67%) ingresaron en clase de Killip III o IV y 129 (5,34%) fallecieron durante su ingreso en el hospital. Estas y otras variables se describen en la tabla 1.
Características de la población
| Variable | |
|---|---|
| Factores conocidos previamente | |
| Edad (años) | 64 [54-74] |
| Sexo femenino | 649 (26,86) |
| Hipertensión | 1.542 (63,85) |
| Dislipemia | 1.400 (57,97) |
| Diabetes | 883 (36,56) |
| Asma | 82 (3,4) |
| Enfermedad pulmonar obstructiva crónica | 132 (5,47) |
| Enfermedad renal crónica | 255 (10,57) |
| Enfermedad coronaria previa conocida | 674 (27,92) |
| Fibrilación auricular | 149 (6,17) |
| Factores relacionados con el ingreso hospitalario | |
| Infarto agudo de miocardio | 1.350 (55,99) |
| Fracción de eyección del ventrículo izquierdo | |
| ≥ 50% | 1.758 (75,74) |
| 35-50% | 458 (19,73) |
| <35% | 105 (4,52) |
| Clase de Killip | |
| I | 2.069 (85,71) |
| II | 158 (6,55) |
| III | 48 (1,99) |
| IV | 137 (5,68) |
| Enfermedad coronaria al ingreso | |
| Sin enfermedad coronaria | 178 (7,79) |
| Enfermedad de 1 vaso | 1.048 (45,84) |
| Enfermedad de 2 vasos | 600 (26,25) |
| Enfermedad de 3 vasos | 460 (20,12) |
| Troponina I máxima (ng/ml) | 8,3 [0,5-37,7] |
| Tratados con angioplastia coronaria transluminal percutánea | 1.642 (68,02) |
| Tratados con cirugía arterial coronaria | 170 (7,04) |
| Duración de la hospitalización (días) | 7 [5-12] |
| Mortalidad hospitalaria | 129 (5,34) |
| Mortalidad a 1 año de los supervivientes | 18 (0,75) |
Los valores expresan n (%) o mediana [intervalo intercuartílico].
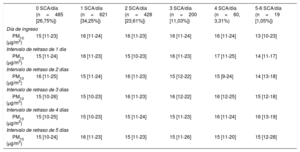
En el periodo de estudio, hubo 485 días (26,75%) en los que no hubo ningún SCA, 621 días (34,25%) en los que hubo 1 SCA, 428 días (23,61%) en los que hubo 2 SCA, 200 días (11,03%) en los que hubo 3 SCA, 60 días (3,31%) en los que hubo 4 SCA, 15 días (0,83%) en los que hubo 5 SCA y 4 días (0,22%) en los que hubo 6 SCA. La mediana de PM10 fue de 15 [11-24] μg/m3. En los días sin SCA, la concentración de PM10 fue de 15 [11-23] μg/m3. En los días con 1, 2, 3, 4, 5 o 6 SCA, las PM10 fueron de 16 [11-24], 16 [11-23], 16 [11-24], 16 [11-24] y 13 [10-23] μg/m3 respectivamente. En la tabla 2 se muestran las concentraciones de PM10 para diferentes cantidades de SCA/día y con diferentes intervalos de días de retraso.
Concentraciones de PM10 según el número diario de SCA. Los datos se presentan para distintos días de intervalo de retraso
| 0 SCA/día (n=485 [26,75%]) | 1 SCA/día (n=621 [34,25%]) | 2 SCA/día (n=428 [23,61%]) | 3 SCA/día (n=200 [11,03%]) | 4 SCA/día (n=60, 3,31%) | 5-6 SCA/día (n=19 [1,05%]) | |
|---|---|---|---|---|---|---|
| Día de ingreso | ||||||
| PM10 (μg/m3) | 15 [11-23] | 16 [11-24] | 16 [11-23] | 16 [11-24] | 16 [11-24] | 13 [10-23] |
| Intervalo de retraso de 1 día | ||||||
| PM10 (μg/m3) | 15 [11-24] | 16 [11-23] | 15 [10-23] | 16 [11-23] | 17 [11-25] | 14 [11-17] |
| Intervalo de retraso de 2 días | ||||||
| PM10 (μg/m3) | 16 [11-25] | 15 [11-24] | 16 [11-23] | 15 [12-22] | 15 [9-24] | 14 [13-18] |
| Intervalo de retraso de 3 días | ||||||
| PM10 (μg/m3) | 15 [10-26] | 15 [10-23] | 16 [11-23] | 16 [12-22] | 16 [12-25] | 15 [12-18] |
| Intervalo de retraso de 4 días | ||||||
| PM10 (μg/m3) | 15 [10-25] | 15 [10-23] | 15 [11-24] | 15 [11-23] | 16 [11-24] | 16 [13-19] |
| Intervalo de retraso de 5 días | ||||||
| PM10 (μg/m3) | 15 [10-24] | 16 [11-23] | 15 [11-23] | 15 [11-26] | 15 [11-20] | 15 [12-28] |
n: número de días; PM10: partículas de diámetro <10μg/m3; SCA: síndrome coronario agudo.
Los vaores expresan mediana [intervalo intercuartílico].
En la se muestran las concentraciones diarias de PM10 en Tenerife durante el periodo del estudio. Estas series temporales de valores de PM10 muestran los valores basales regularmente bajos de esta región (∼15 μg/m3) y episodios de picos bruscos debidos a la llegada de aire con polvo procedente del norte de África, en los que las concentraciones de PM10 alcanzaron valores entre 40 y 350 μg/m3. En la se muestran las series temporales de concentraciones de polvo de Tenerife proporcionadas por los modelos del WMO SDS-WAS, en los que los episodios de picos de polvo (de hasta ∼320μg/m3) motivaron episodios de aumento de PM10, como puede observarse claramente.
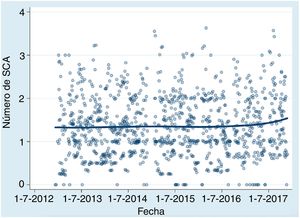
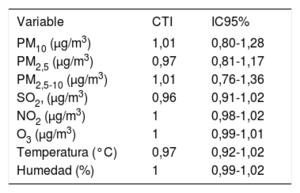
Influencia del polvo sahariano en la incidencia del síndrome coronario agudoEl mismo día del SCA (sin ningún efecto de intervalo de retraso), el CTI por cada 10μg/m3 de PM10 fue 1,01 (IC95%, 0,80-1,28). En la tabla 3 se muestran los resultados de la regresión de Poisson con el CTI de las PM10 y otros factores de confusión. No se observó ninguna tendencia a largo plazo entre el periodo de estudio y el número de SCA predicho (figura 2).
Análisis de regresión de Poisson. Ausencia de efecto del intervalo de días de retraso
| Variable | CTI | IC95% |
|---|---|---|
| PM10 (μg/m3) | 1,01 | 0,80-1,28 |
| PM2,5 (μg/m3) | 0,97 | 0,81-1,17 |
| PM2,5-10 (μg/m3) | 1,01 | 0,76-1,36 |
| SO2, (μg/m3) | 0,96 | 0,91-1,02 |
| NO2 (μg/m3) | 1 | 0,98-1,02 |
| O3 (μg/m3) | 1 | 0,99-1,01 |
| Temperatura (°C) | 0,97 | 0,92-1,02 |
| Humedad (%) | 1 | 0,99-1,02 |
CTI: cocientes de tasas de incidencia; IC95%: intervalo de confianza del 95%; PM10: partículas con diámetro aerodinámico <10μg/m3.
Se calcularon los CTI de las variables de PM para los cambios de 10μg/m3.
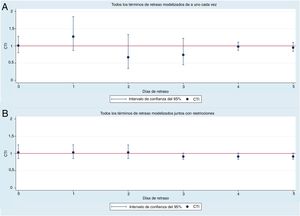
El estudio de los posibles efectos del intervalo de días de retraso mostró que las concentraciones de PM10 no se asociaban con el número de SCA en ninguno de los 5 días previos. Los CTI de las concentraciones de PM10 en los días 1, 2, 3, 4 y 5 (para un cambio de 10μg/m3) fueron 1,27 (IC95%, 0,87-1,85), 0,92 (IC95%, 0,84-1,01), 0,74 (IC95%, 0,45-1,22), 0,98 (IC95%, 0,87-1,11) y 0,95 (IC95%, 0,84-1,06) respectivamente. No se observó asociación alguna entre las PM10 y el número de SCA tras introducir un ajuste de estos efectos de diferentes intervalos de retraso entre sí en un modelo con restricciones (las estimaciones del efecto para el intervalo de 0, 1 y 2 días son iguales, y también son iguales para el intervalo de retraso de 3, 4 y 5 días). En la figura 3 se muestra el CTI derivado de la modelización de las asociaciones con un intervalo de retraso entre las PM10 y el número de SCA. Las interacciones no fueron estadísticamente significativas en ninguno de los modelos y se eliminaron.
CTI calculadas mediante modelización de las asociaciones con intervalo de retraso entre las concentraciones de PM10 y el número de SCA. A: sin un control por otros efectos de intervalo de retraso. B: con un control por los efectos de intervalos de retraso diferentes con restricciones. CTI para los cambios en 10μg/m3 de PM10. CTI: cocientes de tasas de incidencia; PM10: partículas de menos de 10 μm de diámetro aerodinámico; SCA: síndrome coronario agudo.
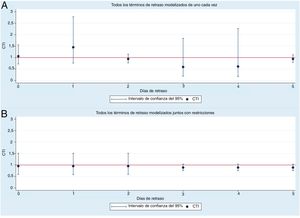
Se diagnosticó IAM a un total de 1.350 pacientes. En función de lo indicado por el modelo de regresión de Poisson ajustado respecto a la autocorrelación y la sobredispersión, lasconcentraciones de PM10 no tuvieron influencia en el número de IAM. Con 10μg/m3 de PM10, el CTI fue 1,1 (IC95%, 0,71-1,55). El número de IAM no mostró asociación con las concentraciones de PM10 en ninguno de los 5 días previos. No se observó asociación alguna entre las PM10 y el número de SCA al aplicar un ajuste respecto a estos efectos de diferentes intervalos de retraso entre sí en un modelo con restricciones (figura 4).
CTI calculadas mediante modelización de las asociaciones con intervalo de retraso entre las concentraciones de PM10 y el número de infartos agudos de miocardio. A: sin un control por otros efectos de intervalo de retraso. B: con un control por los efectos de intervalos de retraso diferentes con restricciones. CTI para los cambios en 10μg/m3 de PM10. CTI: cocientes de tasas de incidencia; PM10: partículas de menos de 10 μm de diámetro aerodinámico.
En este estudio se observó que el polvo del desierto no es un desencadenante potencial de los SCA en pacientes expuestos al polvo sahariano en Tenerife (España). Recientemente se ha prestado especial atención a la contaminación atmosférica no antropogénica, originada por tormentas de arena naturales, que puede constituir un riesgo para la salud5,18. La mayor parte de la investigación medioambiental que analiza los efectos de la contaminación atmosférica en la salud cardiovascular se centra en la contaminación antropogénica (es decir, la ligada a la combustión de combustibles fósiles, como el transporte y la industria). En el presente estudio se analizó la posibilidad de que el polvo sahariano producido por fenómenos naturales sea un desencadenante de los SCA.
En general, se establece una distinción entre las partículas de menos de 10 μm de diámetro (PM10, partículas torácicas que pueden entrar en las vías respiratorias bajas), las de menos de 2,5 μm (PM2,5, denominadas partículas finas o respirables que pueden entrar en la región de intercambio de gases del pulmón) y las partículas ultrafinas de menos de 100nm (0,1 μm) que habitualmente contribuyen escasamente a la masa particulada PM (es decir, PM10 y PM2,5) pero que son las más abundantes y tienen un alto grado de penetración en los pulmones19. La mayor parte de las partículas derivadas de la combustión antropogénica corresponden a las fracciones ultrafina y PM2,5, mientras que una parte significativa del polvo mineral forma parte del material particulado grueso (2,5-10μm) de las PM10. Por ejemplo, durante los episodios de polvo sahariano, la mayor parte de las PM10 están formadas por partículas de polvo gruesas (un 70-80%, es decir, PM2,5/PM10=0,2-0,3). En cambio, en las ciudades de Europa contaminadas por fuentes de combustión, las PM10 son en su mayor parte partículas de combustión (PM2,5/PM10=0,8-0,9)2. Las partículas gruesas tienen una mayor probabilidad de depositarse en las vías bronquiales e inducir, por lo tanto, trastornos respiratorios como asma, enfermedad pulmonar obstructiva crónica y neumonía19.
Los artículos publicados hasta la fecha que aportan información sobre la investigación relativa a las PM en relación con la salud se han centrado en las repercusiones de las PM antropogénicas, en su mayor parte procedentes de la combustión3,20–22. Las conclusiones de estos estudios fueron muy coincidentes y mostraron que las PM derivadas de la combustión constituyen una clara amenaza para la salud humana. Por ejemplo, un estudio reciente de Bañeras et al.23 realizado en un área urbana del norte de España, sin fuentes naturales de polvo desértico, observó que las PM10 y las PM2,5 se asociaban con la incidencia de IAM. Las PM de áreas urbanas proceden de emisiones de combustión2. Es probable que la influencia de las PM10 derivadas de la combustión en la fisiopatología cardiovascular difiera de la que tienen las PM10 procedentes de orígenes naturales5.
Los estudios sobre la influencia de las PM de orígenes no antropogénicos son escasos y sus resultados, discordantes. Un estudio de Estados Unidos indicó la existencia de una asociación entre las PM10 derivadas de tormentas de arena y la mortalidad24, mientras que otro estudio en el que se analizaron 13 países del sur de Europa no observó asociación alguna entre las concentraciones de PM10 derivadas del desierto y los ingresos hospitalarios o la mortalidad25.
Recientemente, 2 estudios han examinado la relación entre las tormentas de arena y los SCA6,25. Vodonos et al.26 señalaron que hubo una influencia de las PM10 (con un intervalo de retraso de 1 día) durante los días de tormenta de arena en la incidencia de SCA (odds ratio [OR]=1,007; IC95%, 1,002-1,012), mientras que no hubo un efecto significativo durante los días sin tormenta de arena (OR=1,011; IC95%, 0,998-1,025). Los autores plantearon la hipótesis de que las partículas relacionadas con el tránsito y con la industria tuvieran efectos más tóxicos para la salud humana26 que las de origen no antropogénico. Kojima et al.6 propusieron una hipótesis similar. Estos autores, que estudiaron el efecto del polvo asiático en la incidencia de IAM en la Prefectura de Kumamoto (suroeste de Japón), llegaron a la conclusión de que los episodios de polvo asiático el día anterior conducían a la aparición de IAM (OR=1,46; IC95%, 1,09-1,95). En su estudio introdujeron un control respecto a las PM2,5 pero no respecto a otros posibles efectos de confusión como las PM10 o las PM2,5-10. Existe un acuerdo «medioambiental» respecto a considerar los episodios de polvo en función de las concentraciones medias de PM10 a lo largo de 24 h5. Además, resulta difícil pensar que el polvo asiático pueda ser un factor de riesgo el día antes del IAM (efecto con un intervalo de retraso de 1 día), pero que sea casi un factor protector el mismo día del IAM (efecto con un intervalo de retraso de 0 días), como se deduce de los intervalos de confianza presentados en su 6. Los resultados estadísticamente significativos pero incongruentes pueden deberse a la realización de múltiples comparaciones, en especial en caso de incertidumbre subestimada, como ocurre cuando no se tiene en cuenta la sobredispersión y la autocorrelación.
Dados el lenguaje ambiguo utilizado en relación con los denominados episodios de polvo, la confusión existente acerca del tipo de partículas que constituyen el episodio y la existencia de posibles factores de confusión no medidos o no controlados, las asociaciones epidemiológicas entre el polvo del desierto y los SCA son muy controvertidas y poco concluyentes. En este contexto, pensamos que el estudio del impacto de los episodios de polvo sahariano del África oriental, en los que los episodios de polvo son más frecuentes e intensos que en cualquier otro lugar del mundo4,5, podría aportar luz respecto a esta cuestión. Se consideraron los episodios de polvo en función de las concentraciones de PM105, se introdujo un control respecto a posibles factores de confusión (principalmente otras PM y contaminantes) y se empleó un proceso estadístico nuevo y adecuado que permitió no subestimar los errores de tipo 115–17. Además, este estudio se basa en un único hospital terciario, que atiende a toda la población de la región, con lo que se elimina el sesgo de selección. Asimismo la exposición analizada en nuestro estudio es de origen no antropogénico y la mayor parte de las tormentas de arena tienen su origen en el desierto del Sahara.
LimitacionesEste estudio tiene ciertas limitaciones. En primer lugar, se emplearon las concentraciones de contaminación atmosférica en el aire exterior, medidas en puntos fijos, mientras que las personas pasan la mayor parte del tiempo en el interior. En segundo lugar, el error de medición de la exposición es un inconveniente intrínseco de los estudios de series temporales, ya que la media de las estaciones de seguimiento fijas elegidas no refleja la exposición media real de la población. En consecuencia, algunos datos indican que el error de medición de la exposición en el análisis de series temporales podría introducir un sesgo de las estimaciones a la baja27. El empleo de un análisis de regresión de Poisson permitió introducir un control respecto a la sobredispersión y la autocorrelación, que son causas frecuentes de subestimación del error de tipo 1. Sin embargo, para ello fue preciso modificar la matriz de datos y no pudo realizarse un análisis estratificado por variables específicas, puesto que estas dejan de tener sentido en la nueva matriz de datos. Por último, no se puede descartar una potencia estadística insuficiente para mostrar asociaciones. Esta falta de potencia estadística no es trivial y plantea dificultades en este tipo de estudio28. Con un periodo de estudio de 5 años y más de 2.000 episodios, se ha estudiado la influencia de los cambios de 10μg/m3 de PM10 en la incidencia de SCA, con una mediana de PM10 en nuestro territorio de 15 [11-24] μg/m3. Es decir, un aumento de 10 unidades de PM10 sería equivalente a pasar de un día con unas PM10 relativamente bajas (supongamos 11 unidades, que está dentro del primer cuartil de PM10) a un día con unas PM10 relativamente altas (supongamos 21, que está dentro del tercer cuartil de las PM10). Aun así, los intervalos de confianza no son excesivamente amplios y ninguna de las asociaciones evaluadas fue estadísticamente significativa. No obstante, las asociaciones entre las PM y los eventos cardiovasculares son en general muy pequeñas, y suelen situarse en el tercer decimal del riesgo relativo, por lo que no se puede descartar una falta de potencia estadística.
CONCLUSIONESEste estudio negativo, que es el primero que evalúa las repercusiones de los episodios de polvo sahariano como posible desencadenante de la aparición de los SCA, muestra que es improbable que el polvo africano se asocie con la incidencia de SCA. Se deberá centrar los esfuerzos en la reducción de las emisiones derivadas de la combustión.
- –
El transporte de polvo sahariano puede aumentar en gran manera la concentración ambiental de material particulado que se registran en las redes de vigilancia de la calidad del aire. Esto tiene especial importancia en el sur de Europa y en algunas islas del Atlántico.
- –
La mayor parte de los estudios se han realizado en regiones distantes de los orígenes del polvo desértico (sur de Europa y este de Asia).
- –
En el mundo, las concentraciones más altas de polvo desértico son las que se producen en el norte de África, y no hay estudios sobre los efectos del polvo en la salud en esa región.
- –
Los estudios sobre el polvo desértico y los efectos en la salud han sido en su mayor parte epidemiológicos y han relacionado la mortalidad cardiovascular con el polvo.
- –
En este estudio prospectivo observacional, la aparición de episodios de polvo sahariano observada de 0 a 5 días antes del inicio del síndrome coronario agudo no mostró una asociación significativa con la incidencia del síndrome coronario agudo.
- –
En los estudios de calidad del aire, el uso de técnicas estadísticas apropiadas es de gran importancia para el control de la estacionalidad y la autocorrelación de las observaciones.
- –
La reproducción y publicación de estudios rigurosos, incluso los que tienen resultados «negativos», permiten esclarecer las relaciones y evita posibles sesgos.
No se declara ninguno.
Damos las gracias al programa Sand and Dust Storm – Warning Advisory and Assessment System de la Organización Meteorológica Mundial, cogestionado por la Agencia Española de Meteorología y el Centro de Supercomputación de Barcelona, por la modelización del polvo y a la Consejería de Medio Ambiente del Gobierno de las Islas Canarias por los datos de calidad del aire.