La Organización Mundial de la Salud calificó la enfermedad por coronavirus (COVID-19) como una pandemia global. No está claro si el tratamiento previo con inhibidores de la enzima de conversión de la angiotensina (IECA) y antagonistas de los receptores de angiotensina (ARA-II) tiene un impacto en el pronóstico de los pacientes infectados con COVID-19. El objetivo fue evaluar la implicación clínica del tratamiento previo con IECA/ARA-II en el pronóstico de la COVID-19.
MétodosEstudio observacional, retrospectivo, unicéntrico, de cohortes basado en todos los habitantes del área de salud. El análisis de los resultados principales (mortalidad, insuficiencia cardiaca, hospitalización, ingreso en la unidad de cuidados intensivos (UCI) y eventos cardiovasculares agudos mayores [un compuesto de mortalidad e insuficiencia cardiaca]), se ajustó mediante modelos de regresión logística multivariada y modelos de coincidencia de puntaje de propensión.
ResultadosDe una población total, 447.979 habitantes, 965 pacientes (0,22%), fueron diagnosticados de infección por COVID-19, 210 (21,8%) estaban bajo tratamiento con IECA o ARA-II en el momento del diagnóstico. El tratamiento con IECA/ARA-II (combinado e individualmente) no tuvo efecto sobre la mortalidad (OR=0,62; IC95%, 0,17-2,26; p=0,486), insuficiencia cardiaca (OR=1,37; IC95%, 0,39-4,77; p=0,622), tasa de hospitalización (OR=0,85; IC95%, 0,45-1,64; p=0,638), ingreso en UCI (OR=0,87; IC95%, 0,30-2,50; p=0,798) y cardiopatía aguda grave eventos (OR=1,06; IC95%, 0,39-2,83; p=0,915). En el análisis del subgrupos de pacientes que requirieron hospitalización, el efecto se mantuvo neutral.
ConclusionesEl tratamiento previo con IECA/ARA-II en pacientes con COVID-19 no tuvo efecto sobre la mortalidad, la aparición de insuficiencia cardíaca, ni en la necesidad de hospitalización ni ingreso en UCI. La supresión de IECA/ARA-II en pacientes con COVID-19 no estaría justificada en ningún caso, de acuerdo a las recomendaciones actuales de las sociedades científicas y las agencias gubernamentales.
Palabras clave
Hasta el 1 de abril de 2020, la enfermedad producida por el coronavirus 2 causante del síndrome respiratorio agudo grave (SARS-CoV-2)1–4, denominada COVID-19 (enfermedad por coronavirus de 2019), se había propagado a más de 200 países en los que ha infectado a más de 1 millón de personas, y la OMS la ha considerado una pandemia mundial5.
Aunque la infección puede causar una enfermedad grave en cualquier persona, uno de los análisis más amplios llevados a cabo hasta la fecha6 ha descrito unos resultados más graves (ingreso en unidad de cuidados intensivos [UCI], ventilación mecánica y muerte) en los pacientes con hipertensión, enfermedad coronaria o diabetes mellitus.
La interacción entre el SARS-CoV-2 y el sistema renina-angiotensina-aldosterona es una piedra angular en la infección de la COVID-19. El virus se une a la enzima de conversión de la angiotensina 2 (ECA2) ligada a la membrana y se interna en las células por la acción de proteasas transmembranarias7,8. La angiotensina I produce un aumento de una metaloproteasa (ADAM-17) que eleva la solubilidad de la ECA2 (una forma no válida para la unión del SARS-CoV-2)9,10 y también libera citocinas proinflamatorias que reducen la expresión de la ECA2 en la superficie celular, con lo que disminuye la capacidad del SARS-CoV-2 de causar daños11.
Dada la posible mayor susceptibilidad de los pacientes tratados con IECA en la pandemia de COVID-19, se ha propuesto que deba suspenderse esta medicación12. En este momento hay controversia respecto al impacto que tienen los inhibidores de la enzima de conversión de la angiotensina (IECA) y los antagonistas del receptor de la angiotensina II (ARA-II) en la evolución clínica de la COVID-193,7,13–17. Cuando se realizaba el presente estudio, las sociedades científicas y los organismos gubernamentales recomendaban continuar con este tratamiento, dada la falta de evidencia que respaldara la hipótesis18,19.
Falta evidencia en este campo, y la mayor parte de los datos existentes se basan en estudios observacionales llevados a cabo en China; ninguno de ellos se ha basado en una población completa y hay poca información sobre cómo el virus afecta a la población occidental.
MÉTODOSDiseño del estudio y participantesSe realizó un estudio de cohortes, observacional, retrospectivo y unicéntrico en un hospital universitario que presta servicio a una ciudad y su área metropolitana, cuya población ha estado confinada durante el periodo de estudio bajo el estado de alarma a partir del 14 de marzo de 2020. Se incluyeron todos los casos de infección por SARS-CoV-2 con confirmación mediante análisis de laboratorio que se identificaron en la zona, según lo establecido en la orientación provisional de la Organización Mundial de la Salud20, con independencia de su evolución clínica. El diagnóstico de COVID-19 se basó en pruebas de reacción en cadena de la polimerasa en tiempo real de muestras nasofaríngeas obtenidas con escobillón, que tienen gran sensibilidad para la detección del virus; sin embargo, la sensibilidad puede disminuir si la carga vírica del paciente es baja o hay alguna deficiencia en la obtención de la muestra. Esto podría afectar al tamaño de la muestra, pero probablemente no a los resultados, puesto que su distribución es homogénea en la población.
Este estudio cumplió lo establecido en la Declaración de Helsinki de 1975 y fue aprobado por el Comité de Ética de Investigación de Medicamentos de Galicia.
Obtención de los datosSe utilizaron formularios estandarizados para crear la base de datos, que incluía información demográfica, datos epidemiológicos, análisis realizados, fármacos administrados durante el ingreso hospitalario y al alta según el criterio de los médicos, así como otras informaciones clínicas pertinentes. La información clínica se obtuvo de los registros médicos electrónicos que permitían acceder a la totalidad de la historia clínica, desde la atención primaria hasta la hospitalaria, así como a las prescripciones electrónicas, para confirmar la adherencia al tratamiento.
Parámetros de valoraciónEste estudio se realizó para tipificar de manera adecuada las consecuencias clínicas del tratamiento crónico previo con IECA/ARA-II en el pronóstico de la COVID-19. El objetivo primario fue el impacto del tratamiento crónico previo con IECA y ARA-II en el pronóstico, y se evaluó mediante la mortalidad, la insuficiencia cardiaca, la necesidad de hospitalización y de ingreso en la unidad de cuidados intensivos (UCI) y los eventos adversos cardiovasculares mayores (un combinado de muerte e insuficiencia cardiaca). La insuficiencia cardiaca se definió según lo indicado en la guía vigente21, con base en los datos clínicos, analíticos y radiológicos. También se estudió si la inhibición del sistema renina-angiotensina-aldosterona mantenida durante más de 1 año podía modificar los resultados.
Análisis estadísticoPara la comparación de los pacientes tratados y no tratados con IECA/ARA-II, las variables continuas (expresadas en forma de media±desviación estándar) se analizaron con la prueba de la t de Student y las variables cualitativas (expresadas en porcentajes) se evaluaron con la prueba de la χ2 o la prueba exacta de Fisher según procediera.
Se utilizaron modelos de regresión logística para explicar la asociación independiente entre el tratamiento con IECA/ARA-II y el ingreso hospitalario, el ingreso en UCI, la mortalidad y la insuficiencia cardiaca. Para el ajuste multivariante, se incluyeron todas las variables que mostraban una asociación significativa (p <0,05) con los eventos en los análisis univariantes (véase la ), sin aplicar ninguna selección. Todos los modelos multivariantes seleccionados tuvieron una buena discriminación (estadístico c > 0,85 para la población total y> 0,80 para los pacientes hospitalizados) y una buena calibración (Hosmer-Lemsehow, p> 0,6 para la población total y p> 0,40 para los pacientes hospitalizados). Los resultados se expresan en forma de odds ratio (OR) con sus intervalos de confianza del 95% (IC95%). En todas las pruebas de hipótesis, la hipótesis nula se rechazó con un error de tipo I o error alfa <0,05.
Dadas las diferencias sustanciales existentes en las características basales de los pacientes tratados y no tratados con IECA/ARA-II, el análisis se complementó con un análisis con emparejamiento por puntuación de propensión. Se emparejó a los pacientes según el tratamiento con IECA/ARA-II según las puntuaciones de propensión. Se aplicó un algoritmo de emparejamiento ambicioso 1:1, sin sustitución, con un margen de 0,1. Las puntuaciones de propensión se calcularon con un modelo de regresión logística sin limitación del número de variables, tomando el tratamiento como variable dependiente y las características que diferían (p <0,05) entre los pacientes tratados y no tratados con IECA/ARA-II (tabla 1) como covariables. Se realizó un emparejamiento por puntuación de propensión para todos los pacientes y se repitió solamente para los pacientes con ingresos hospitalarios. Tras el emparejamiento por puntuación de propensión, se identificó a un total de 164 pacientes emparejados con unas características basales bien equilibradas y no hubo diferencias significativas en función del tratamiento con IECA/ARA-II (desviación estándar <0,1 para todas las variables). En la población emparejada mediante puntuación de propensión, los resultados se compararon mediante un modelo de regresión logística estratificado.
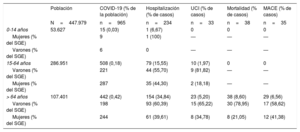
Distribución por edad y sexo de la población afectada por la COVID-19
| Población | COVID-19 (% de la población) | Hospitalización (% de casos) | UCI (% de casos) | Mortalidad (% de casos) | MACE (% de casos) | |
|---|---|---|---|---|---|---|
| N=447.979 | n=965 | n=234 | n=33 | n=38 | n=35 | |
| 0-14 años | 53.627 | 15 (0,03) | 1 (6,67) | 0 | 0 | 0 |
| Mujeres (% del SGE) | 9 | 1 (100) | — | — | — | |
| Varones (% del SGE) | 6 | 0 | — | — | — | |
| 15-64 años | 286.951 | 508 (0,18) | 79 (15,55) | 10 (1,97) | 0 | 0 |
| Varones (% del SGE) | 221 | 44 (55,70) | 9 (81,82) | — | — | |
| Mujeres (% del SGE) | 287 | 35 (44,30) | 2 (18,18) | — | — | |
| > 64 años | 107.401 | 442 (0,42) | 154 (34,84) | 23 (5,20) | 38 (8,60) | 29 (6,56) |
| Varones (% del SGE) | 198 | 93 (60,39) | 15 (65,22) | 30 (78,95) | 17 (58,62) | |
| Mujeres (% del SGE) | 244 | 61 (39,61) | 8 (34,78) | 8 (21,05) | 12 (41,38) |
MACE: eventos adversos cardiovasculares mayores (síndrome coronario agudo, miocarditis, parada cardiaca arrítmica, ictus, embolia pulmonar, insuficiencia cardiaca y mortalidad cardiovascular); SGE: subgrupo de edad; UCI: unidad de cuidados intensivos.
Los valores expresan n (%).
Se repitieron análisis similares con la inclusión solo de los pacientes hospitalizados, utilizando tanto regresión logística como emparejamiento por puntuación de propensión (con 58 pacientes emparejados). El análisis estadístico se realizó con el programa informático SPSS 25.0.
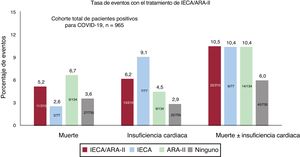
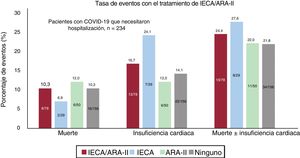
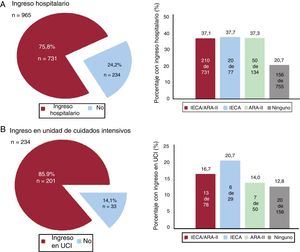
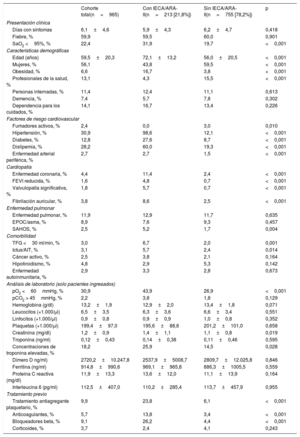
RESULTADOSEntre el 10 marzo y el 6 de abril, se diagnosticó COVID-19 a 965 pacientes (0,22%) de un total de 447.979 habitantes del área atendida por el hospital universitario. De los pacientes con COVID-19, 234 (24,25%) necesitaron hospitalización y 33 de ellos (14,1%) precisaron el ingreso en UCI. Durante el periodo de estudio, fallecieron 38 pacientes (3,94%), de los que 35 (3,6%) sufrieron insuficiencia cardiaca (figura 1, figura 2 y figura 3).
En el conjunto de la población, 72.527 (16,19%) estaban en tratamiento crónico con IECA (26.617 [36,7%]) o ARA-II (48.085 [66,3%]). De los pacientes con COVID-19, 210 (21,8%) estaban en tratamiento con IECA o ARA-II en el momento del diagnóstico y, de ellos, 165 (78,57%) habían recibido esta medicación durante más de 1 año. En la tabla 1 se resume la distribución por edad y sexo de la población afectada por la COVID-19.
En la tabla 2 se presentan de manera resumida las características basales de los pacientes con COVID-19 y se muestra una comparación de la cohorte de pacientes que estaban en tratamiento con IECA/ARA-II con la de los pacientes que no recibían este tratamiento. La cohorte de pacientes en tratamiento con IECA/ARA-II era de más edad (72,1±13,2 frente a 56,0±20,5 años; p <0,01) y presentaba más factores de riesgo cardiovascular (hipertensión, diabetes, tabaquismo y dislipemia) y también más comorbilidades cardiovasculares (enfermedad coronaria y disfunción ventricular) que la cohorte de pacientes no tratados con IECA/ARA-II. Había un número inferior de mujeres en el grupo de IECA/ARA-II (el 43,8 frente al 59,5%; p <0,01). La disfunción renal y la vasculopatía periférica tenían también una mayor prevalencia en los pacientes tratados con IECA/ARA-II. Al ingreso, los pacientes con un tratamiento previo con IECA/ARA-II mostraban una menor oxigenación (saturación de O2 periférica <95% en el 31,9 frente al 19,7%; p <0,01; insuficiencia respiratoria en el 43,9 frente al 26,9%; p <0,01) y tenían concentraciones más altas de creatinina y de troponina. En la figura 1 y la figura 2 se muestran los eventos que se produjeron en el conjunto de los pacientes con COVID-19 y en los que fueron hospitalizados. En la figura 3 se presentan los ingresos hospitalarios en función del tipo de tratamiento.
Características basales
| Cohorte total(n=965) | Con IECA/ARA-II(n=213 [21,8%]) | Sin IECA/ARA-II(n=755 [78,2%]) | p | |
|---|---|---|---|---|
| Presentación clínica | ||||
| Días con síntomas | 6,1±4,6 | 5,9±4,3 | 6,2±4,7 | 0,418 |
| Fiebre, % | 59,9 | 59,5 | 60,0 | 0,901 |
| SaO2 <95%, % | 22,4 | 31,9 | 19,7 | <0,001 |
| Características demográficas | ||||
| Edad (años) | 59,5±20,3 | 72,1±13,2 | 56,0±20,5 | <0,001 |
| Mujeres, % | 56,1 | 43,8 | 59,5 | <0,001 |
| Obesidad, % | 6,6 | 16,7 | 3,8 | <0,001 |
| Profesionales de la salud, % | 13,1 | 4,3 | 15,5 | <0,001 |
| Personas internadas, % | 11,4 | 12,4 | 11,1 | 0,613 |
| Demencia, % | 7,4 | 5,7 | 7,8 | 0,302 |
| Dependencia para los cuidados, % | 14,1 | 16,7 | 13,4 | 0,226 |
| Factores de riesgo cardiovascular | ||||
| Fumadores activos, % | 2,4 | 0,0 | 3,0 | 0,010 |
| Hipertensión, % | 30,9 | 98,6 | 12,1 | <0,001 |
| Diabetes, % | 12,8 | 27,6 | 8,7 | <0,001 |
| Dislipemia, % | 28,2 | 60,0 | 19,3 | <0,001 |
| Enfermedad arterial periférica, % | 2,7 | 2,7 | 1,5 | <0,001 |
| Cardiopatía | ||||
| Enfermedad coronaria, % | 4,4 | 11,4 | 2,4 | <0,001 |
| FEVI reducida, % | 1,6 | 4,8 | 0,7 | <0,001 |
| Valvulopatía significativa, % | 1,8 | 5,7 | 0,7 | <0,001 |
| Fibrilación auricular, % | 3,8 | 8,6 | 2,5 | <0,001 |
| Enfermedad pulmonar | ||||
| Enfermedad pulmonar, % | 11,9 | 12,9 | 11,7 | 0,635 |
| EPOC/asma, % | 8,9 | 7,6 | 9,3 | 0,457 |
| SAHOS, % | 2,5 | 5,2 | 1,7 | 0,004 |
| Comorbilidad | ||||
| TFG <30 ml/min, % | 3,0 | 6,7 | 2,0 | 0,001 |
| Ictus/AIT, % | 3,1 | 5,7 | 2,4 | 0,014 |
| Cáncer activo, % | 2,5 | 3,8 | 2,1 | 0,164 |
| Hipotiroidismo, % | 4,8 | 2,9 | 5,3 | 0,142 |
| Enfermedad autoinmunitaria, % | 2,9 | 3,3 | 2,8 | 0,673 |
| Análisis de laboratorio (solo pacientes ingresados) | ||||
| pO2 <60mmHg, % | 30,9 | 43,9 | 26,9 | <0,001 |
| pCO2 > 45mmHg, % | 2,2 | 3,8 | 1,8 | 0,129 |
| Hemoglobina (g/dl) | 13,2±1,9 | 12,9±2,0 | 13,4±1,8 | 0,071 |
| Leucocitos (×1.000/μl) | 6,5±3,5 | 6,3±3,6 | 6,6±3,4 | 0,551 |
| Linfocitos (×1.000/μl) | 0,9±0,8 | 0,9±0,9 | 1,0±0,8 | 0,352 |
| Plaquetas (×1.000/μl) | 199,4±97,0 | 195,6±88,6 | 201,2±101,0 | 0,658 |
| Creatinina (mg/dl) | 1,2±0,9 | 1,4±1,1 | 1,1±0,8 | 0,019 |
| Troponina (ng/ml) | 0,12±0,43 | 0,14±0,38 | 0,11±0,46 | 0,595 |
| Concentraciones de troponina elevadas, % | 18,2 | 25,9 | 14,5 | 0,028 |
| Dímero D ng/ml) | 2720,2±10.247,8 | 2537,9±5008,7 | 2809,7±12.025,8 | 0,846 |
| Ferritina (ng/ml) | 914,8±990,6 | 969,1±965,8 | 886,3±1005,5 | 0,559 |
| Proteína C reactiva (mg/dl) | 11,9±13,3 | 13,6±12,0 | 11,1±13,9 | 0,164 |
| Interleucina 6 (pg/ml) | 112,5±407,0 | 110,2±285,4 | 113,7±457,9 | 0,955 |
| Tratamiento previo | ||||
| Tratamiento antiagregante plaquetario, % | 9,9 | 23,8 | 6,1 | <0,001 |
| Anticoagulantes, % | 5,7 | 13,8 | 3,4 | <0,001 |
| Bloqueadores beta, % | 9,1 | 26,2 | 4,4 | <0,001 |
| Corticoides, % | 3,7 | 2,4 | 4,1 | 0,243 |
AIT: accidente isquémico transitorio; ARA-II: antagonistas del receptor de la angiotensina II; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima de conversión de la angiotensina; pCO2: presión parcial de dióxido de carbono; pO2: presión parcial de oxígeno; SAHOS: síndrome de apneas-hipopneas obstructivas del sueño; SaO2: saturación de oxígeno en sangre arterial; TFG: tasa de filtrado glomerular.
Los valores expresan n (%) o media±desviación estándar.
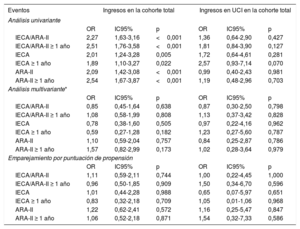
En la tabla 3 se muestra que, en el análisis univariante, el tratamiento con IECA/ARA-II (en combinación o por separado) aumentaba significativamente el riesgo de hospitalización, pero esta asociación desaparecía en el análisis multivariante con regresión logística y también en el análisis realizado en el modelo con emparejamiento por puntuación de propensión para introducir un ajuste respecto a posibles factores de riesgo. En los pacientes hospitalizados que estaban en tratamiento con IECA/ARA-II, fue más frecuente la necesidad de más ingresos en UCI.
Asociación entre los IECA/ARA-II y los ingresos en el hospital y en la UCI
| Eventos | Ingresos en la cohorte total | Ingresos en UCI en la cohorte total | ||||
|---|---|---|---|---|---|---|
| Análisis univariante | ||||||
| OR | IC95% | p | OR | IC95% | p | |
| IECA/ARA-II | 2,27 | 1,63-3,16 | <0,001 | 1,36 | 0,64-2,90 | 0,427 |
| IECA/ARA-II ≥ 1 año | 2,51 | 1,76-3,58 | <0,001 | 1,81 | 0,84-3,90 | 0,127 |
| IECA | 2,01 | 1,24-3,28 | 0,005 | 1,72 | 0,64-4,61 | 0,281 |
| IECA ≥ 1 año | 1,89 | 1,10-3,27 | 0,022 | 2,57 | 0,93-7,14 | 0,070 |
| ARA-II | 2,09 | 1,42-3,08 | <0,001 | 0,99 | 0,40-2,43 | 0,981 |
| ARA-II ≥ 1 año | 2,54 | 1,67-3,87 | <0,001 | 1,19 | 0,48-2,96 | 0,703 |
| Análisis multivariante* | ||||||
| OR | IC95% | p | OR | IC95% | p | |
| IECA/ARA-II | 0,85 | 0,45-1,64 | 0,638 | 0,87 | 0,30-2,50 | 0,798 |
| IECA/ARA-II ≥ 1 año | 1,08 | 0,58-1,99 | 0,808 | 1,13 | 0,37-3,42 | 0,828 |
| IECA | 0,78 | 0,38-1,60 | 0,505 | 0,97 | 0,22-4,16 | 0,962 |
| IECA ≥ 1 año | 0,59 | 0,27-1,28 | 0,182 | 1,23 | 0,27-5,60 | 0,787 |
| ARA-II | 1,10 | 0,59-2,04 | 0,757 | 0,84 | 0,25-2,87 | 0,786 |
| ARA-II ≥ 1 año | 1,57 | 0,82-2,99 | 0,173 | 1,02 | 0,28-3,64 | 0,979 |
| Emparejamiento por puntuación de propensión | ||||||
| OR | IC95% | p | OR | IC95% | p | |
| IECA/ARA-II | 1,11 | 0,59-2,11 | 0,744 | 1,00 | 0,22-4,45 | 1,000 |
| IECA/ARA-II ≥ 1 año | 0,96 | 0,50-1,85 | 0,909 | 1,50 | 0,34-6,70 | 0,596 |
| IECA | 1,01 | 0,44-2,28 | 0,988 | 0,65 | 0,07-5,97 | 0,651 |
| IECA ≥ 1 año | 0,83 | 0,32-2,18 | 0,709 | 1,05 | 0,01-1,06 | 0,968 |
| ARA-II | 1,22 | 0,62-2,41 | 0,572 | 1,16 | 0,25-5,47 | 0,847 |
| ARA-II ≥ 1 año | 1,06 | 0,52-2,18 | 0,871 | 1,54 | 0,32-7,33 | 0,586 |
ARA-II: antagonistas del receptor de la angiotensina II; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; OR: odds ratio; UCI: unidad de cuidados intensivos.
Cohorte total: ajuste para las variables con p <0,05 en el análisis univariante (días con síntomas, fiebre, saturación de oxígeno en sangre arterial <95%, edad, sexo, personal sanitario, personas internadas, estado de dependencia, demencia, hipertensión, dislipemia, disfunción ventricular, enfermedad pulmonar, cáncer previo, hipotiroidismo, tratamiento antiagregante plaquetario). Cohorte ingresada en UCI: ajuste para las variables con p <0,05 en el análisis univariante (saturación de oxígeno en sangre arterial <95%, diabetes mellitus, hipoxemia, hipercapnia, linfocitos, creatinina, elevación de troponina, ferritina, proteína C reactiva e interleucina 6) ().
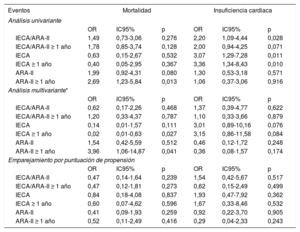
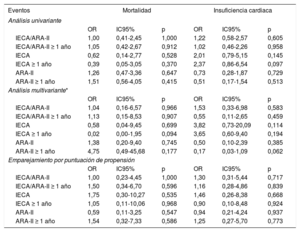
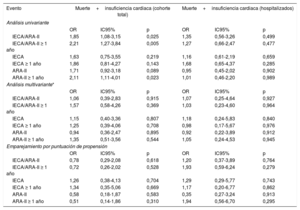
El tratamiento previo con IECA/ARA-II (en combinación o por separado) no tuvo repercusión alguna en la mortalidad o la insuficiencia cardiaca, ni en el análisis multivariante ni en el modelo ajustado mediante la puntuación de propensión. El hecho de recibir el tratamiento durante más de 1 año tampoco tuvo efecto alguno (tabla 4). Al analizar solo el subgrupo de pacientes que requirieron hospitalización, la ausencia de efecto en la mortalidad y la insuficiencia cardiaca se mantuvo tanto en el análisis multivariante como en el modelo de puntuación de propensión, y lo mismo ocurrió al evaluar el efecto del tratamiento tomado durante más de 1 año (tabla 5). La ausencia de efecto persistió al aplicar los mismos modelos al parámetro combinado de mortalidad o insuficiencia cardiaca (tabla 6).
Asociación del tratamiento con IECA/ARA-II con la mortalidad y la insuficiencia cardiaca en la cohorte total de pacientes positivos para la COVID-19
| Eventos | Mortalidad | Insuficiencia cardiaca | ||||
|---|---|---|---|---|---|---|
| Análisis univariante | ||||||
| OR | IC95% | p | OR | IC95% | p | |
| IECA/ARA-II | 1,49 | 0,73-3,06 | 0,276 | 2,20 | 1,09-4,44 | 0,028 |
| IECA/ARA-II ≥ 1 año | 1,78 | 0,85-3,74 | 0,128 | 2,00 | 0,94-4,25 | 0,071 |
| IECA | 0,63 | 0,15-2,67 | 0,532 | 3,07 | 1,29-7,28 | 0,011 |
| IECA ≥ 1 año | 0,40 | 0,05-2,95 | 0,367 | 3,36 | 1,34-8,43 | 0,010 |
| ARA-II | 1,99 | 0,92-4,31 | 0,080 | 1,30 | 0,53-3,18 | 0,571 |
| ARA-II ≥ 1 año | 2,69 | 1,23-5,84 | 0,013 | 1,06 | 0,37-3,06 | 0,916 |
| Análisis multivariante* | ||||||
| OR | IC95% | p | OR | IC95% | p | |
| IECA/ARA-II | 0,62 | 0,17-2,26 | 0,468 | 1,37 | 0,39-4,77 | 0,622 |
| IECA/ARA-II ≥ 1 año | 1,20 | 0,33-4,37 | 0,787 | 1,10 | 0,33-3,66 | 0,879 |
| IECA | 0,14 | 0,01-1,57 | 0,111 | 3,01 | 0,89-10,16 | 0,076 |
| IECA ≥ 1 año | 0,02 | 0,01-0,63 | 0,027 | 3,15 | 0,86-11,58 | 0,084 |
| ARA-II | 1,54 | 0,42-5,59 | 0,512 | 0,46 | 0,12-1,72 | 0,248 |
| ARA-II ≥ 1 año | 3,96 | 1,06-14,87 | 0,041 | 0,36 | 0,08-1,57 | 0,174 |
| Emparejamiento por puntuación de propensión | ||||||
| OR | IC95% | p | OR | IC95% | p | |
| IECA/ARA-II | 0,47 | 0,14-1,64 | 0,239 | 1,54 | 0,42-5,67 | 0,517 |
| IECA/ARA-II ≥ 1 año | 0,47 | 0,12-1,81 | 0,273 | 0,62 | 0,15-2,49 | 0,499 |
| IECA | 0,84 | 0,18-4,08 | 0,837 | 1,93 | 0,47-7,92 | 0,362 |
| IECA ≥ 1 año | 0,60 | 0,07-4,62 | 0,596 | 1,67 | 0,33-8,46 | 0,532 |
| ARA-II | 0,41 | 0,09-1,93 | 0,259 | 0,92 | 0,22-3,70 | 0,905 |
| ARA-II ≥ 1 año | 0,52 | 0,11-2,49 | 0,416 | 0,29 | 0,04-2,33 | 0,243 |
ARA-II: antagonistas del receptor de la angiotensina II; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; OR: odds ratio.
Ajuste para las variables con p <0,05 en el análisis univariante (fiebre, saturación de oxígeno <95%, edad, sexo, obesidad, personal sanitario, estado de dependencia, hipertensión, diabetes mellitus, dislipemia, enfermedad arterial, cardiopatía, fibrilación auricular, neumonía, enfermedad renal crónica, enfermedad cerebrovascular, enfermedad autoinmunitaria, anticoagulación, bloqueadores beta) ().
Asociación del tratamiento con IECA/ARA-II con la mortalidad y la insuficiencia cardiaca en pacientes hospitalizados por una infección de COVID-19
| Eventos | Mortalidad | Insuficiencia cardiaca | ||||
|---|---|---|---|---|---|---|
| Análisis univariante | ||||||
| OR | IC95% | p | OR | IC95% | p | |
| IECA/ARA-II | 1,00 | 0,41-2,45 | 1,000 | 1,22 | 0,58-2,57 | 0,605 |
| IECA/ARA-II ≥ 1 año | 1,05 | 0,42-2,67 | 0,912 | 1,02 | 0,46-2,26 | 0,958 |
| IECA | 0,62 | 0,14-2,77 | 0,528 | 2,01 | 0,79-5,15 | 0,145 |
| IECA ≥ 1 año | 0,39 | 0,05-3,05 | 0,370 | 2,37 | 0,86-6,54 | 0,097 |
| ARA-II | 1,26 | 0,47-3,36 | 0,647 | 0,73 | 0,28-1,87 | 0,729 |
| ARA-II ≥ 1 año | 1,51 | 0,56-4,05 | 0,415 | 0,51 | 0,17-1,54 | 0,513 |
| Análisis multivariante* | ||||||
| OR | IC95% | p | OR | IC95% | p | |
| IECA/ARA-II | 1,04 | 0,16-6,57 | 0,966 | 1,53 | 0,33-6,98 | 0,583 |
| IECA/ARA-II ≥ 1 año | 1,13 | 0,15-8,53 | 0,907 | 0,55 | 0,11-2,65 | 0,459 |
| IECA | 0,58 | 0,04-9,45 | 0,699 | 3,82 | 0,73-20,09 | 0,114 |
| IECA ≥ 1 año | 0,02 | 0,00-1,95 | 0,094 | 3,65 | 0,60-9,40 | 0,194 |
| ARA-II | 1,38 | 0,20-9,40 | 0,745 | 0,50 | 0,10-2,39 | 0,385 |
| ARA-II ≥ 1 año | 4,75 | 0,49-45,68 | 0,177 | 0,17 | 0,03-1,09 | 0,062 |
| Emparejamiento por puntuación de propensión | ||||||
| OR | IC95% | p | OR | IC95% | p | |
| IECA/ARA-II | 1,00 | 0,23-4,45 | 1,000 | 1,30 | 0,31-5,44 | 0,717 |
| IECA/ARA-II ≥ 1 año | 1,50 | 0,34-6,70 | 0,596 | 1,16 | 0,28-4,86 | 0,839 |
| IECA | 1,75 | 0,30-10,27 | 0,535 | 1,46 | 0,26-8,38 | 0,668 |
| IECA ≥ 1 año | 1,05 | 0,11-10,06 | 0,968 | 0,90 | 0,10-8,48 | 0,924 |
| ARA-II | 0,59 | 0,11-3,25 | 0,547 | 0,94 | 0,21-4,24 | 0,937 |
| ARA-II ≥ 1 año | 1,54 | 0,32-7,33 | 0,586 | 1,25 | 0,27-5,70 | 0,773 |
ARA-II: antagonistas de los receptores de angiotensina II; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; OR: odds ratio.
Ajuste para las variables con p <0,05 en el análisis univariante (fiebre, saturación de oxígeno en sangre arterial <95%, edad, sexo, obesidad, profesional de la salud, dependencia, hipertensión, diabetes mellitus, dislipemia, enfermedad arterial periférica, enfermedad coronaria, fibrilación auricular, enfermedad pulmonar, deterioro de la función renal, ictus/accidente isquémico transitorio, hemoglobina, leucocitos, linfocitos, creatinina, aumento de troponina, dímero D, ferritina, proteína C reactiva ultrasensible e interleucina 6 ().
Asociación del tratamiento con IECA/ARA-II con el objetivo combinado de muerte e insuficiencia cardiaca
| Evento | Muerte+insuficiencia cardiaca (cohorte total) | Muerte+insuficiencia cardiaca (hospitalizados) | ||||
|---|---|---|---|---|---|---|
| Análisis univariante | ||||||
| OR | IC95% | p | OR | IC95% | p | |
| IECA/ARA-II | 1,85 | 1,08-3,15 | 0,025 | 1,35 | 0,56-3,26 | 0,499 |
| IECA/ARA-II ≥ 1 año | 2,21 | 1,27-3,84 | 0,005 | 1,27 | 0,66-2,47 | 0,477 |
| IECA | 1,63 | 0,75-3,55 | 0,219 | 1,16 | 0,61-2,19 | 0,659 |
| IECA ≥ 1 año | 1,86 | 0,81-4,27 | 0,143 | 1,68 | 0,65-4,37 | 0,285 |
| ARA-II | 1,71 | 0,92-3,18 | 0,089 | 0,95 | 0,45-2,02 | 0,902 |
| ARA-II ≥ 1 año | 2,11 | 1,11-4,01 | 0,023 | 1,01 | 0,46-2,20 | 0,989 |
| Análisis multivariante* | ||||||
| OR | IC95% | p | OR | IC95% | p | |
| IECA/ARA-II | 1,06 | 0,39-2,83 | 0,915 | 1,07 | 0,25-4,64 | 0,927 |
| IECA/ARA-II ≥ 1 año | 1,57 | 0,58-4,26 | 0,369 | 1,03 | 0,23-4,60 | 0,964 |
| IECA | 1,15 | 0,40-3,36 | 0,807 | 1,18 | 0,24-5,83 | 0,840 |
| IECA ≥ 1 año | 1,25 | 0,39-4,06 | 0,708 | 0,98 | 0,17-5,67 | 0,976 |
| ARA-II | 0,94 | 0,36-2,47 | 0,895 | 0,92 | 0,22-3,89 | 0,912 |
| ARA-II ≥ 1 año | 1,35 | 0,51-3,56 | 0,544 | 1,05 | 0,24-4,53 | 0,945 |
| Emparejamiento por puntuación de propensión | ||||||
| OR | IC95% | p | OR | IC95% | p | |
| IECA/ARA-II | 0,78 | 0,29-2,08 | 0,618 | 1,20 | 0,37-3,89 | 0,764 |
| IECA/ARA-II ≥ 1 año | 0,72 | 0,26-2,02 | 0,528 | 1,93 | 0,59-6,24 | 0,279 |
| IECA | 1,26 | 0,38-4,13 | 0,704 | 1,29 | 0,29-5,77 | 0,743 |
| IECA ≥ 1 año | 1,34 | 0,35-5,06 | 0,669 | 1,17 | 0,20-6,77 | 0,862 |
| ARA-II | 0,58 | 0,18-1,87 | 0,583 | 0,35 | 0,27-3,24 | 0,913 |
| ARA-II ≥ 1 año | 0,51 | 0,14-1,86 | 0,310 | 1,94 | 0,56-6,70 | 0,295 |
ARA-II: antagonistas del receptor de la angiotensina II; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; OR: odds ratio.
Cohorte total: ajuste para las variables con p <0,05 en el análisis univariante (fiebre, saturación de oxígeno en sangre arterial <95%, edad, sexo, obesidad, profesional de la salud, dependencia para los cuidados, hipertensión, diabetes, dislipemia, enfermedad arterial periférica, cardiopatía, fibrilación auricular, enfermedad pulmonar, disfunción renal, ictus/accidente isquémico transitorio). Cohorte ingresada en el hospital: ajuste para las variables con p <0,05 en el análisis multivariante (fiebre, saturación de oxígeno en sangre arterial <95%, edad, sexo, obesidad, profesional de la salud, dependencia para los cuidados, hipertensión, diabetes, dislipemia, enfermedad arterial periférica, cardiopatía, fibrilación auricular, enfermedad pulmonar, disfunción renal, ictus/accidente isquémico transitorio, hemoglobina, leucocitos, linfocitos, creatinina, elevación de las concentraciones de troponina, dímero D, ferritina, proteína C reactiva e interleucina 6) ().
Hasta donde se sabe, este es uno de los pocos estudios en los que se ha analizado la repercusión de los IECA/ARA-II en el pronóstico de la COVID-19 basándose en una población occidental amplia que incluye todos los casos positivos identificados en un área de salud. Se trata también de la cohorte más amplia de pacientes estudiada hasta la fecha.
Los principales resultados son el efecto neutro de los IECA/ARA-II en la mortalidad, la insuficiencia cardiaca y la combinación de mortalidad e insuficiencia cardiaca. El tratamiento previo con IECA/ARA-II en pacientes con COVID-19 no mostró asociación con la necesidad de hospitalización o de ingreso en UCI. El hecho de recibir tratamiento con IECA/ARA-II durante más de 1 año tampoco tuvo efecto alguno. Todos estos resultados se confirmaron tanto en el análisis global de la muestra como en el modelo de puntuación de propensión. Sobre la base de estos datos, no estaría justificado retirar el tratamiento crónico con IECA/ARA-II a los pacientes que dan positivo para la COVID-19. Los datos existentes sobre el efecto de los IECA/ARA-II en la mortalidad de los pacientes con COVID-19 se han centrado principalmente en cohortes de pacientes ingresados y, sobre todo, hipertensos22,23.
El SARS-CoV-2 entra en las células a través de una glucoproteína de su corona, que se une a la ECA2 de los neumocitos alveolares7,13, lo que da lugar a su internalización tras el cebado producido por la proteasa transmembranaria serina 27,8. Una vez que el virus ha entrado en la célula, este libera su ARN y sus proteínas, y ello conduce a la formación de nuevas partículas víricas. La ECA2 se encuentra en un 2% en una forma soluble (que no es válida para la unión del SARS-CoV-2), tras la segmentación producida por la ADAM-17. La angiotensina I aumenta la ADAM-17, con lo que eleva las concentraciones de ECA2 soluble9,10. Además, la ADAM-17 interviene también en la liberación a la circulación de precursores de citocinas proinflamatorias (factor de necrosis tumoral alfa, interferón gamma e interleucina 4) ligados a la membrana. La interacción entre el SARS-CoV-2 y la ECA2 desencadena una producción masiva de citocinas proinflamatorias, que atraen a leucocitos y macrófagos hiperactivos que liberan más citocinas, con lo que se induce la obliteración de los alvéolos y la aparición de las membranas hialinas características del síndrome de dificultad respiratoria aguda3,7,13,17. Así pues, la reducción de la expresión de la ECA2 en la superficie celular hace que disminuya la capacidad del SARS-CoV-2 de causar daños11. Los IECA y los ARA-II son fármacos muy recomendados para los pacientes con enfermedades cardiovasculares como la hipertensión refractaria, la insuficiencia cardiaca y la enfermedad coronaria18,19. El tratamiento crónico con estas medicaciones aumenta la expresión de la ECA24–26. Basándose en este mecanismo, algunos autores han planteado la hipótesis de que una regulación negativa persistente del sistema renina-angiotensina-aldosterona pueda causar un daño al aumentar la expresión de la ECA212,14. Por otra parte, la angiotensina II participa en la respuesta inmunitaria contra el síndrome de dificultad respiratoria aguda, por lo que su depuración a través de la ECA2 puede tener efectos beneficiosos15–17. Cuando se realizaba este estudio, las sociedades científicas y los organismos gubernamentales recomendaban continuar con este tratamiento18,19. Los resultados del presente estudio respaldan esta recomendación y elevan su grado de una recomendación basada en el consenso de expertos a una basada en la evidencia derivada de un registro de todos los casos de infección de COVID-19 de un área de salud occidental. Un ensayo clínico aleatorizado en curso con losartán en estos pacientes ayudará a establecer una recomendación más sólida (NCT04312009 y NCT04311177)27.
Para presentar una perspectiva global de la relevancia de estos resultados, destaca que, en el área en la que se realizó el estudio, un total de 72.527 habitantes (16,19%) están en tratamiento crónico con IECA o ARA-II. De los pacientes con COVID-19, 210 (21,8%) estaban tratados con IECA o ARA-II en el momento del diagnóstico. Según las estimaciones más recientes, es probable que al final del año hasta un 70% de la población española haya sido infectada por este nuevo coronavirus28; de ahí la importancia de identificar los efectos que estos fármacos ampliamente utilizados tienen en el pronóstico de esta nueva enfermedad.
Limitaciones del estudioDado que se trata de un estudio observacional, podría haber factores de confusión no médicos que limiten la inferencia causal en el presente estudio. Los resultados falsos negativos de la prueba de reacción en cadena de la polimerasa podrían haber afectado al tamaño de la muestra y haber dado lugar a una subestimación del número de individuos infectados por el virus.
CONCLUSIONESNo estaría justificado retirar el tratamiento crónico con IECA/ARA-II a los pacientes que dan positivo para la COVID-19. De manera coherente con las recomendaciones de las sociedades científicas y los organismos gubernamentales, este estudio respalda que se mantenga este tratamiento.
No está claro si el tratamiento previo con IECA y ARA-II afecta al pronóstico de los pacientes con COVID-19 o no. El tratamiento crónico con estos medicamentos aumenta la expresión de la ECA. Basándose en este mecanismo, se ha planteado la hipótesis de que una regulación negativa persistente del sistema renina-angiotensina-aldosterona podría ser nociva, ya que aumenta la expresión de la ECA2.
¿QUÉ APORTA DE NUEVO?Nuestros datos indican que la administración crónica de IECA y ARA-II es segura para los pacientes con COVID-19, por lo que no debe recomendarse suspender estos tratamientos.
Los autores declaran no tener ningún conflicto de intereses relacionado con la publicación de este artículo.