El objetivo es estudiar el impacto clínico de la variabilidad intrapaciente (VIP) de la concentración sanguínea de los anticalcineurínicos en el trasplante cardiaco, pues la información actual es escasa.
MétodosSe analizó retrospectivamente a pacientes de edad≥18 años con un trasplante cardiaco realizado entre 2000 y 2014 y con supervivencia≥1 año. La VIP se valoró mediante el coeficiente de variación de concentraciones entre los meses 4 a 12 postrasplante. El compuesto de rechazo, mortalidad o pérdida del injerto y la mortalidad o pérdida del injerto 1-5 años tras el trasplante se analizaron mediante regresión de Cox.
ResultadosSe estudió a 1.581 receptores (edad, 56 años; mujeres, 21%), tratados con ciclosporina (790 pacientes) o tacrolimus (791 pacientes). En el análisis multivariable, un coeficiente de variación> 27,8% tendió a asociarse con el compuesto de rechazo/mortalidad (HR=1,298; IC95%, 0,993-1,695; p=0,056) y con la mortalidad (HR=1,387; IC95%, 0,979-1,963; p=0,065) a los 5 años. La asociación con el rechazo fue significativa al analizar a la población sin rechazos durante el primer año del trasplante (HR=1,609; IC95%, 1,129-2,295; p=0,011). El tacrolimus tuvo menos VIP que la ciclosporina, junto con unos mejores resultados por la menor influencia de la VIP.
ConclusionesLa VIP de los anticalcineurínicos, especialmente con la inmunosupresión basada en el tacrolimus, se asocia solo marginalmente con los resultados a medio plazo del trasplante cardiaco, aunque puede tener influencia en los pacientes más estables durante el primer año tras el trasplante.
Palabras clave
Desde la introducción de la ciclosporina a principios de la década de los ochenta, los anticalcineurínicos han constituido la base de la inmunosupresión en el trasplante cardiaco (TxC). Tanto la ciclosporina como el tacrolimus comparten un índice terapéutico corto, lo que exige un estrecho seguimiento de la concentración sanguínea para garantizar la eficacia y evitar la toxicidad. La variabilidad intrapaciente (VIP) en la concentración sanguínea de los anticalcineurínicos está relacionada con múltiples factores1, aunque la falta de adherencia a la medicación es el más importante y también evitable2. La VIP se ha documentado ampliamente en trasplantes de riñón3–14, hígado15–19 y pulmón20. En general, se ha demostrado que varios parámetros que indican esta variabilidad están relacionados con resultados desfavorables del aloinjerto. Algunos estudios incluso han informado de una relación con la supervivencia del paciente6,8. Más recientemente, las consecuencias de la VIP se han evaluado en algunos estudios pequeños y unicéntricos sobre TxC21,22. Esos estudios han encontrado una relación considerable entre la VIP y el rechazo del aloinjerto, aunque falta evidencia del impacto independiente en la supervivencia del paciente21.
Este estudio retrospectivo y multiinstitucional se planteó como objetivo evaluar el impacto clínico (rechazo del aloinjerto y supervivencia del paciente) de la VIP en la concentración sanguínea de los anticalcineurínicos en una serie importante de pacientes con TxC.
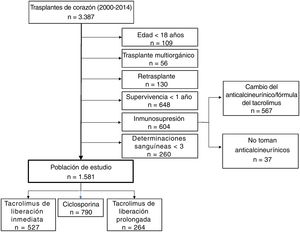
MÉTODOSDatos originalesEl Registro Español de Trasplante Cardiaco es una base de datos prospectiva impulsada por la Sociedad Española de Cardiología que contiene información clínica detallada de todas las intervenciones de TxC realizadas en España desde 1984 hasta la actualidad. El registro se actualiza anualmente con los datos que proporcionan todos los centros de trasplante del país. Esta base de datos se ha descrito en otra publicación23. A efectos de este estudio, los datos sobre las características basales del receptor, el donante, la intervención quirúrgica y la supervivencia se obtuvieron de la base de datos del Registro Español de Trasplante Cardiaco. Se sabía si cada uno de los participantes seguía con vida a 31 de diciembre de 2017. Además, se realizó una revisión específica de las historias clínicas para obtener información detallada sobre las mediciones de la concentración sanguínea de los anticalcineurínicos durante el primer año postrasplante, la inmunosupresión concomitante y la incidencia y la caracterización de los episodios de rechazo entre 2 y 5 años después del trasplante (figura 1).
Diseño del estudio. Los valores sanguíneos valle del anticalcineurínico se recogieron de 4 a 12 meses después del trasplante. Los resultados fueron un compuesto de rechazo o muerte por cualquier causa/pérdida del injerto (primario) y mortalidad por cualquier causa/pérdida del injerto (secundario) entre 1 y 5 años después del trasplante.
Se trata de un análisis retrospectivo en el que participaron receptores de 13 centros que cumplían los criterios de inclusión: a) receptor de un primer TxC de un solo órgano entre 2000 y 2014; b) edad en el momento del trasplante ≥18 años; c) supervivencia del receptor al menos durante 1 año después del trasplante, y d) tratamiento inmunosupresor a base de tacrolimus (tacrolimus de liberación inmediata [TLI] 2 veces al día y de liberación prolongada [TLP] 1 vez al día) o microemulsión de ciclosporina, mantenida durante el primer año postrasplante al menos con 3 muestras disponibles para el cálculo de la VIP. Los motivos de exclusión se resumen en la figura 2.
Evaluación de la exposiciónLos receptores fueron tratados con TLI (Prograf, Astellas Pharma Ltd, Reino Unido), TLP (Advagraf, Astellas Pharma Europe BV, Países Bajos) o ciclosporina (Sandimmun Neoral, Novartis Farmacéutica SA, España). La concentración sanguínea se midió mediante 5 inmunoanálisis diferentes ().
Se utilizaron todos los valores valle de las mediciones sanguíneas realizadas entre los meses 4 y 12 después del TxC para calcular la media y la desviación estándar. La VIP se analizó mediante el coeficiente de variación (CV), que se calculó como (desviación estándar / media) × 100. La concentración sanguínea media se clasificó según los valores medianos.
Evaluación de resultadosPuesto que no existía ningún protocolo común de vigilancia del rechazo después del primer año posterior al TxC en los centros participantes, el rechazo se definió como cualquier evento clínico que provocara un aumento temporal de la inmunosupresión y consistiera en al menos una tanda corta de corticoides intravenosos a dosis altas24.
Evaluación de otras variablesLa función renal se evaluó mediante la tasa de filtrado glomerular (TFG) estimada según la ecuación de la Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI)25. La fracción de eyección del ventrículo izquierdo (FEVI) se calculó mediante ecocardiografía.
El estudio se realizó de acuerdo con las directrices de la Declaración de Helsinki y fue aprobado por los comités de ética de todos los centros participantes.
Análisis estadísticosLos datos se presentan como mediana [intervalo intercuartílico] o frecuencia y porcentaje, según corresponda. Las diferencias entre grupos se analizaron mediante la prueba exacta de Fisher o la prueba de la χ2 para las variables cualitativas, y la prueba de la U de Mann-Whitney y la prueba de Kruskal-Wallis para las variables continuas.
La variable de respuesta principal fue una combinación de rechazo o mortalidad por cualquier causa/pérdida del injerto a los 5 años, analizada como el tiempo hasta el primer evento. El resultado secundario fue la mortalidad por cualquier causa/pérdida del injerto a los 5 años. La población se organizó en subgrupos de acuerdo con la mediana del CV del análisis. Las hazard ratio (HR) con sus intervalos de confianza del 95% (IC95%) se calcularon mediante regresión de Cox, que también se utilizó para ajustar modelos multivariantes. Se comprobó el supuesto de proporcionalidad de riesgos mediante un método gráfico (curvas logaritmo menos logaritmo). El análisis multivariante incluyó todas las variables con un valor de p ≤0,10 en el análisis univariante, además del tipo de anticalcineurínico. También se incluyó la concentración sanguínea media para valorar la posibilidad de sesgo protopático y la época del trasplante debido a la mejora reconocida de los resultados de nuestro registro en función de la época23. Las variables cuantitativas se clasificaron de acuerdo con sus valores medianos en todos los análisis. Para los análisis de sensibilidad, primero se evaluaron los cambios en la fuerza de la asociación entre la VIP y los resultados después de excluir los anticalcineurínicos del modelo multivariante original. Para evaluar más a fondo la influencia del tipo de anticalcineurínico en los resultados, se compararon las curvas de supervivencia generadas por la interacción entre el tipo de anticalcineurínico (ciclosporina o tacrolimus) y el grupo de CV (bajo o alto). En segundo lugar, los mismos análisis univariantes y multivariantes realizados en toda la población del estudio se repitieron con los pacientes sin antecedentes de rechazo durante el primer año.
Los datos perdidos () se trataron mediante imputación múltiple con el método completo de especificación condicional, que generó 10 conjuntos de datos imputados utilizando todas las variables de ajuste aplicables y la variable de resultado como predictores. Para el análisis se utilizó el promedio de los 10 conjuntos de datos imputados. Para la imputación, las variables cuantitativas y continuas se modelaron mediante regresión logística y regresión lineal respectivamente.
Un valor bilateral de p <0,05 se consideró significativo desde el punto de vista estadístico. El análisis estadístico se realizó con el paquete SPSS 25.0 (SPSS Inc, Estados Unidos).
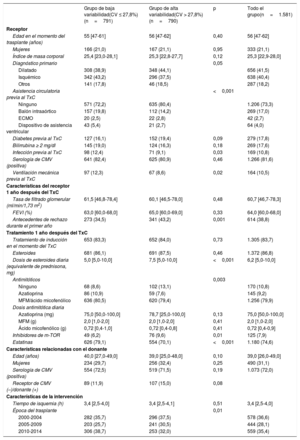
RESULTADOSLas principales características basales se describen en la tabla 1. El grupo de estudio estaba formado por 1.581 pacientes (mediana de edad, 56 años; mujeres, 21,1%). La mayoría de los pacientes (69,5%) seguían1 año después del TxC una triple terapia inmunosupresora con corticoides y micofenolato concomitantes (). Un total de 614 pacientes (38,8%) habían sufrido al menos 1 episodio de rechazo agudo tratado durante el primer año postrasplante (335 pacientes, 1 episodio; 135 pacientes, 2 episodios; 144 pacientes, 3 episodios o más). Se observaron resultados histológicos compatibles con rechazo celular agudo en el 94,7% de estos episodios. La mediana de duración del seguimiento fue 4,0 años, sin diferencias significativas entre los grupos de CV alto y bajo (p=0,06). Los anticalcineurínicos utilizados fueron ciclosporina (50%), TLI (33,3%) y TLP (16,7%) (figura 2). A 31 de diciembre de 2017 se había logrado el seguimiento completo de 5 años del 94,7, el 82,2 y el 47,4% de los receptores de ciclosporina, TLI y TLP respectivamente. Las características de la población según el tipo de inmunoanálisis se describen en la .
Características de la población según la variabilidad intrapaciente en la concentración sanguínea de anticalcineurínicos en el trasplante de corazón
| Grupo de baja variabilidad(CV ≤ 27,8%)(n=791) | Grupo de alta variabilidad(CV > 27,8%)(n=790) | p | Todo el grupo(n=1.581) | |
|---|---|---|---|---|
| Receptor | ||||
| Edad en el momento del trasplante (años) | 55 [47-61] | 56 [47-62] | 0,40 | 56 [47-62] |
| Mujeres | 166 (21,0) | 167 (21,1) | 0,95 | 333 (21,1) |
| Índice de masa corporal | 25,4 [23,0-28,1] | 25,3 [22,8-27,7] | 0,12 | 25,3 [22,9-28,0] |
| Diagnóstico primario | 0,05 | |||
| Dilatado | 308 (38,9) | 348 (44,1) | 656 (41,5) | |
| Isquémico | 342 (43,2) | 296 (37,5) | 638 (40,4) | |
| Otros | 141 (17,8) | 46 (18,5) | 287 (18,2) | |
| Asistencia circulatoria previa al TxC | <0,001 | |||
| Ninguno | 571 (72,2) | 635 (80,4) | 1.206 (73,3) | |
| Balón intraaórtico | 157 (19,8) | 112 (14,2) | 269 (17,0) | |
| ECMO | 20 (2,5) | 22 (2,8) | 42 (2,7) | |
| Dispositivo de asistencia ventricular | 43 (5,4) | 21 (2,7) | 64 (4,0) | |
| Diabetes previa al TxC | 127 (16,1) | 152 (19,4) | 0,09 | 279 (17,8) |
| Bilirrubina ≥ 2 mg/dl | 145 (19,0) | 124 (16,3) | 0,18 | 269 (17,6) |
| Infección previa al TxC | 98 (12,4) | 71 (9,1) | 0,03 | 169 (10,8) |
| Serología de CMV (positiva) | 641 (82,4) | 625 (80,9) | 0,46 | 1.266 (81,6) |
| Ventilación mecánica previa al TxC | 97 (12,3) | 67 (8,6) | 0,02 | 164 (10,5) |
| Características del receptor 1 año después del TxC | ||||
| Tasa de filtrado glomerular (ml/min/1,73 m2) | 61,5 [46,8-78,4] | 60,1 [46,5-78,0] | 0,48 | 60,7 [46,7-78,3] |
| FEVI (%) | 63,0 [60,0-68,0] | 65,0 [60,0-69,0] | 0,33 | 64,0 [60,0-68,0] |
| Antecedentes de rechazo durante el primer año | 273 (34,5) | 341 (43,2) | 0,001 | 614 (38,8) |
| Tratamiento 1 año después del TxC | ||||
| Tratamiento de inducción en el momento del TxC | 653 (83,3) | 652 (84,0) | 0,73 | 1.305 (83,7) |
| Esteroides | 681 (86,1) | 691 (87,5) | 0,46 | 1.372 (86,8) |
| Dosis de esteroides diaria (equivalente de prednisona, mg) | 5,0 [5,0-10,0] | 7,5 [5,0-10,0] | <0,001 | 6,2 [5,0-10,0] |
| Antimitóticos | 0,003 | |||
| Ninguno | 68 (8,6) | 102 (13,1) | 170 (10,8) | |
| Azatioprina | 86 (10,9) | 59 (7,6) | 145 (9,2) | |
| MFM/ácido micofenólico | 636 (80,5) | 620 (79,4) | 1.256 (79,9) | |
| Dosis antimitótica diaria | ||||
| Azatioprina (mg) | 75,0 [50,0-100,0] | 78,7 [25,0-100,0] | 0,13 | 75,0 [50,0-100,0] |
| MFM (g) | 2,0 [1,0-2,0] | 2,0 [1,0-2,0] | 0,41 | 2,0 [1,0-2,0] |
| Ácido micofenólico (g) | 0,72 [0,4-1,0] | 0,72 [0,4-0,8] | 0,41 | 0,72 [0,4-0,9] |
| Inhibidores de m-TOR | 49 (6,2) | 76 (9,6) | 0,01 | 125 (7,9) |
| Estatinas | 626 (79,1) | 554 (70,1) | <0,001 | 1.180 (74,6) |
| Características relacionadas con el donante | ||||
| Edad (años) | 40,0 [27,0-49,0] | 39,0 [25,0-48,0] | 0,10 | 39,0 [26,0-49,0] |
| Mujeres | 234 (29,7) | 256 (32,4) | 0,25 | 490 (31,1) |
| Serología de CMV (positiva) | 554 (72,5) | 519 (71,5) | 0,19 | 1.073 (72,0) |
| Receptor de CMV (–)/donante (+) | 89 (11,9) | 107 (15,0) | 0,08 | |
| Características de la intervención | ||||
| Tiempo de isquemia (h) | 3,4 [2,5-4,0] | 3,4 [2,5-4,1] | 0,51 | 3,4 [2,5-4,0] |
| Época del trasplante | 0,01 | |||
| 2000-2004 | 282 (35,7) | 296 (37,5) | 578 (36,6) | |
| 2005-2009 | 203 (25,7) | 241 (30,5) | 444 (28,1) | |
| 2010-2014 | 306 (38,7) | 253 (32,0) | 559 (35,4) | |
CMV: citomegalovirus; CV: coeficiente de variación; ECMO: oxigenador extracorpóreo de membrana; FEVI: fracción de eyección del ventrículo izquierdo; TxC: trasplante de corazón; MFM: micofenolato mofetilo.
Las variables cuantitativas se presentan como mediana [intervalo intercuartílico] y las cualitativas, como n (%).
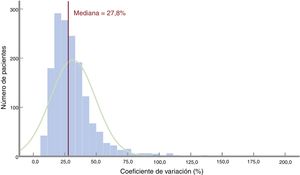
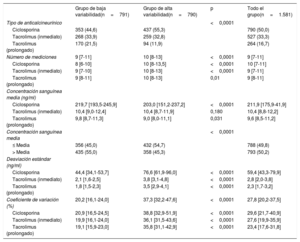
Los datos sobre VIP se resumen en la tabla 2. La distribución del CV se muestra en la figura 3. La mediana del CV fue del 27,8% [20,2%-37,5%]. Hubo diferencias muy importantes entre los grupos según el tipo de anticalcineurínico (p<0,001 en todas las comparaciones por pares) y el TLP mostró la menor variabilidad. Se observó una proporción significativamente mayor de pacientes con una concentración sanguínea media por debajo del valor mediano en el grupo de alta variabilidad. El CV fue mayor en los pacientes con al menos 1 episodio de rechazo durante el primer año postrasplante (30,0% [21,2%-41,2%]) que en los pacientes sin rechazo (26,8% [19,8%-35,8%]; p<0,0001). También se observaron diferencias significativas en el número de determinaciones en sangre. No se encontró ninguna relación entre el CV y la edad y el sexo del receptor (tabla 1).
Parámetros de variabilidad intrapaciente de los anticalcineurínicos
| Grupo de baja variabilidad(n=791) | Grupo de alta variabilidad(n=790) | p | Todo el grupo(n=1.581) | |
|---|---|---|---|---|
| Tipo de anticalcineurínico | <0,0001 | |||
| Ciclosporina | 353 (44,6) | 437 (55,3) | 790 (50,0) | |
| Tacrolimus (inmediato) | 268 (33,9) | 259 (32,8) | 527 (33,3) | |
| Tacrolimus (prolongado) | 170 (21,5) | 94 (11,9) | 264 (16,7) | |
| Número de mediciones | 9 [7-11] | 10 [8-13] | <0,0001 | 9 [7-11] |
| Ciclosporina | 8 [6-10] | 10 [8-13,5] | <0,0001 | 10 [7-11] |
| Tacrolimus (inmediato) | 9 [7-10] | 10 [8-13] | <0,0001 | 9 [7-11] |
| Tacrolimus (prolongado) | 9 [8-11] | 10 [8-13] | 0,01 | 9 [8-11] |
| Concentración sanguínea media (ng/ml) | ||||
| Ciclosporina | 219,7 [193,5-245,9] | 203,0 [151,2-237,2] | <0,0001 | 211,9 [175,9-41,9] |
| Tacrolimus (inmediato) | 10,4 [9,0-12,4] | 10,4 [8,7-11,9] | 0,180 | 10,4 [8,8-12,2] |
| Tacrolimus (prolongado) | 9,8 [8,7-11,3] | 9,0 [8,0-11,1] | 0,031 | 9,6 [8,5-11,2] |
| Concentración sanguínea media | <0,0001 | |||
| ≤ Media | 356 (45,0) | 432 (54,7) | 788 (49,8) | |
| > Media | 435 (55,0) | 358 (45,3) | 793 (50,2) | |
| Desviación estándar (ng/ml) | ||||
| Ciclosporina | 44,4 [34,1-53,7] | 76,6 [61,9-96,0] | <0,0001 | 59,4 [43,3-79,9] |
| Tacrolimus (inmediato) | 2,1 [1,6-2,5] | 3,8 [3,1-4,8] | <0,0001 | 2,8 [2,0-3,8] |
| Tacrolimus (prolongado) | 1,8 [1,5-2,3] | 3,5 [2,9-4,1] | <0,0001 | 2,3 [1,7-3,2] |
| Coeficiente de variación (%) | 20,2 [16,1-24,0] | 37,3 [32,2-47,6] | <0,0001 | 27,8 [20,2-37,5] |
| Ciclosporina | 20,9 [16,5-24,5] | 38,8 [32,9-51,9] | <0,0001 | 29,6 [21,7-40,9] |
| Tacrolimus (inmediato) | 19,9 [16,1-24,0] | 36,1 [31,5-43,6] | <0,0001 | 27,6 [19,9-35,9] |
| Tacrolimus (prolongado) | 19,1 [15,9-23,0] | 35,8 [31,1-42,9] | <0,0001 | 23,4 [17,6-31,8] |
Las variables cuantitativas se presentan como mediana [intervalo intercuartílico] y las cualitativas, como n (%).
Entre los años 1 y 5 postrasplante, hubo 142 (9,0%) muertes/pérdida del injerto (138 muertes y 4 retrasplantes). La muerte/pérdida del injerto fue significativamente más frecuente en el grupo de CV alto (84 pacientes, 10,6%) que en el grupo de CV bajo (58 pacientes, 7,3%; p=0,02). Durante el periodo de seguimiento, hubo 143 episodios de rechazo en 120 pacientes (112 pacientes, 1 episodio; 8 pacientes, 2 episodios o más). Se observaron hallazgos histológicos compatibles con rechazo celular agudo en 132 (92,3%) de estos episodios. El resultado primario ocurrió en 92 pacientes (11,6%) con CV ≤27,8% y en 131 pacientes (16,6%) con CV ≤27,8% (p=0,005).
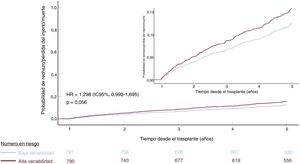
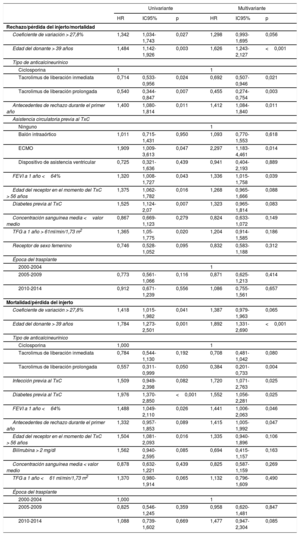
Las relaciones univariantes con el resultado primario se describen en la . Un CV >27,8% se relacionó significativamente con mayor rechazo/mortalidad a los 5 años (HR = 1,342; IC95%, 1,034-1,743; p=0,027). La relación no fue estadísticamente significativa después del ajuste multivariante (HR = 1,298; IC95%, 0,993-1,695; p=0,056) (tabla 3 y figura 4). Los predictores independientes de rechazo o mortalidad/pérdida del injerto a los 5 años fueron la edad del donante > 39 años, el tipo de anticalcineurínico (tanto el TLP como el TLI en comparación con ciclosporina), el tipo de asistencia circulatoria anterior al trasplante, FEVI al año y antecedentes de rechazo durante el primer año (tabla 3). Como variable continua, no hubo ninguna correlación significativa entre el CV y el resultado primario (HR = 1,37; IC95%, 0,71-2,62; p=0,35).
Predictores de resultados a 5 años en 1.581 receptores de trasplante de corazón
| Univariante | Multivariante | |||||
|---|---|---|---|---|---|---|
| HR | IC95% | p | HR | IC95% | p | |
| Rechazo/pérdida del injerto/mortalidad | ||||||
| Coeficiente de variación > 27,8% | 1,342 | 1,034-1,743 | 0,027 | 1,298 | 0,993-1,695 | 0,056 |
| Edad del donante > 39 años | 1,484 | 1,142-1,926 | 0,003 | 1,626 | 1,243-2,127 | <0,001 |
| Tipo de anticalcineurínico | ||||||
| Ciclosporina | 1 | 1 | ||||
| Tacrolimus de liberación inmediata | 0,714 | 0,533-0,956 | 0,024 | 0,692 | 0,507-0,946 | 0,021 |
| Tacrolimus de liberación prolongada | 0,540 | 0,344-0,847 | 0,007 | 0,455 | 0,274-0,754 | 0,003 |
| Antecedentes de rechazo durante el primer año | 1,400 | 1,080-1,814 | 0,011 | 1,412 | 1,084-1,840 | 0,011 |
| Asistencia circulatoria previa al TxC | ||||||
| Ninguno | 1 | |||||
| Balón intraaórtico | 1,011 | 0,715-1,431 | 0,950 | 1,093 | 0,770-1,553 | 0,618 |
| ECMO | 1,909 | 1,009-3,613 | 0,047 | 2,297 | 1,183-4,461 | 0,014 |
| Dispositivo de asistencia ventricular | 0,725 | 0,321-1,636 | 0,439 | 0,941 | 0,404-2,193 | 0,889 |
| FEVI a 1 año <64% | 1,320 | 1,008-1,727 | 0,043 | 1,336 | 1,015-1,758 | 0,039 |
| Edad del receptor en el momento del TxC > 56 años | 1,375 | 1,062-1,782 | 0,016 | 1,268 | 0,965-1,666 | 0,088 |
| Diabetes previa al TxC | 1,525 | 1,124-2,07 | 0,007 | 1,323 | 0,965-1,814 | 0,083 |
| Concentración sanguínea media <valor medio | 0,867 | 0,669-1,123 | 0,279 | 0,824 | 0,633-1,072 | 0,149 |
| TFG a 1 año > 61ml/min/1,73 m2 | 1,365 | 1,05-1,775 | 0,020 | 1,204 | 0,914-1,585 | 0,186 |
| Receptor de sexo femenino | 0,746 | 0,528-1,052 | 0,095 | 0,832 | 0,583-1,188 | 0,312 |
| Época del trasplante | ||||||
| 2000-2004 | 1 | |||||
| 2005-2009 | 0,773 | 0,561-1,066 | 0,116 | 0,871 | 0,625-1,213 | 0,414 |
| 2010-2014 | 0,912 | 0,671-1,239 | 0,556 | 1,086 | 0,755-1,561 | 0,657 |
| Mortalidad/pérdida del injerto | ||||||
| Coeficiente de variación > 27,8% | 1,418 | 1,015-1,982 | 0,041 | 1,387 | 0,979-1,963 | 0,065 |
| Edad del donante > 39 años | 1,784 | 1,273-2,501 | 0,001 | 1,892 | 1,331-2,690 | <0,001 |
| Tipo de anticalcineurínico | ||||||
| Ciclosporina | 1,000 | 1 | ||||
| Tacrolimus de liberación inmediata | 0,784 | 0,544-1,130 | 0,192 | 0,708 | 0,481-1,042 | 0,080 |
| Tacrolimus de liberación prolongada | 0,557 | 0,311-0,999 | 0,050 | 0,384 | 0,201-0,733 | 0,004 |
| Infección previa al TxC | 1,509 | 0,949-2,398 | 0,082 | 1,720 | 1,071-2,763 | 0,025 |
| Diabetes previa al TxC | 1,976 | 1,370-2,850 | <0,001 | 1,552 | 1,056-2,281 | 0,025 |
| FEVI a 1 año <64% | 1,488 | 1,049-2,110 | 0,026 | 1,441 | 1,006-2,063 | 0,046 |
| Antecedentes de rechazo durante el primer año | 1,332 | 0,957-1,853 | 0,089 | 1,415 | 1,005-1,992 | 0,047 |
| Edad del receptor en el momento del TxC > 56 años | 1,504 | 1,081-2,093 | 0,016 | 1,335 | 0,940-1,896 | 0,106 |
| Bilirrubina > 2 mg/dl | 1,562 | 0,940-2,595 | 0,085 | 0,694 | 0,415-1,157 | 0,163 |
| Concentración sanguínea media < valor medio | 0,878 | 0,632-1,221 | 0,439 | 0,825 | 0,587-1,159 | 0,269 |
| TFG a 1 año <61 ml/min/1,73 m2 | 1,370 | 0,980-1,914 | 0,065 | 1,132 | 0,796-1,609 | 0,490 |
| Época del trasplante | ||||||
| 2000-2004 | 1,000 | 1 | ||||
| 2005-2009 | 0,825 | 0,546-1,245 | 0,359 | 0,958 | 0,620-1,481 | 0,847 |
| 2010-2014 | 1,088 | 0,739-1,602 | 0,669 | 1,477 | 0,947-2,304 | 0,085 |
ECMO: oxigenador extracorpóreo de membrana; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%: intervalo de confianza del 95%; TFG: tasa de filtrado glomerular; TxC: trasplante cardiaco.
Rechazo o muerte por cualquier causa/pérdida del injerto a 5 años ajustado por el grupo de variabilidad intrapaciente en la concentración sanguínea de anticalcineurínicos de 1.581 receptores de trasplante de corazón. HR: hazard ratio (regresión de Cox); IC95%, intervalo de confianza del 95%.
Las relaciones univariantes con la mortalidad por cualquier causa/pérdida del injerto a los 5 años se presentan en la . Un CV > 27,8% se asoció significativamente con mayor mortalidad a los 5 años (HR = 1,418; IC95%, 1,015-1,982; p=0,041). Como variable continua, también hubo una correlación significativa entre el CV y la mortalidad a los 5 años (HR = 2,22; IC95%, 1,09-4,57; p=0,03). Después del ajuste multivariante, un CV > 27,8% no mantuvo la significación estadística (HR = 1,387; IC95%, 0,979-1,963; p=0,065) (tabla 3 y figura 5). Los predictores independientes de mortalidad/pérdida del injerto a los 5 años fueron el tipo de anticalcineurínico (TLP y TLI en comparación con ciclosporina), la edad del donante, la diabetes previa al trasplante, la infección previa al trasplante, la FEVI al año y el antecedente de rechazo durante el primer año (tabla 3).
Análisis de sensibilidadDespués de excluir del modelo multivariante el tipo de anticalcineurínico, un CV alto se asoció significativamente con un mayor rechazo o con la pérdida del injerto/mortalidad a los 5 años (HR = 1,358; IC95%, 1,041-1,772; p=0,024) y una mayor mortalidad/pérdida del injerto a los 5 años (HR = 1,489; IC95%, 1,054-2,105; p=0,024) (). Además, se analizó la interacción entre el tipo de anticalcineurínico y el grupo de CV (figura 6). Dentro del mismo grupo de tipo de anticalcineurínico, un CV alto tendió a asociarse con peores resultados, aunque sin significación estadística. Asimismo, dentro del mismo grupo de CV, el tacrolimus mostró resultados significativamente mejores que la ciclosporina.
Interacción entre el tipo de anticalcineurínico y el grupo de coeficiente de variación (CV) (método de Kaplan-Meier). Las líneas azules indican tacrolimus (TAC); las líneas rojas indican ciclosporina; las líneas continuas indican un bajo CV; las líneas discontinuas indican un alto CV.
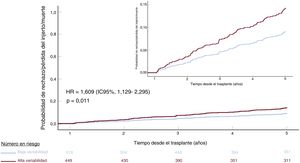
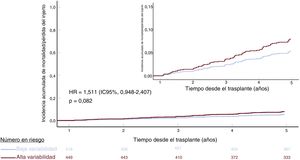
Los resultados observados en pacientes sin antecedentes de rechazo durante el primer año postrasplante se describen en las . En estos pacientes, el grupo de CV alto mostró una asociación independiente y altamente significativa con el compuesto de rechazo/pérdida del injerto/mortalidad a los 5 años (HR = 1,609; IC95%, 1,129-2,295; p=0,011) (figura 7). No se observó ninguna asociación significativa con la mortalidad por cualquier causa/pérdida del injerto a los 5 años (HR = 1,511; IC95%, 0,948-2,407; p=0,082) (figura 8).
Rechazo o muerte por cualquier causa/pérdida del injerto a 5 años ajustado por el grupo de variabilidad intrapaciente en la concentración sanguínea de anticalcineurínicos de 967 receptores de trasplante de corazón sin antecedentes de rechazo durante el primer año postrasplante. HR: hazard ratio (regresión de Cox); IC95%: intervalo de confianza del 95%.
Incidencia de mortalidad/pérdida del injerto ajustada a 5 años según el grupo de variabilidad intrapaciente en la concentración sanguínea de anticalcineurínicos de 967 receptores de trasplante de corazón sin antecedentes de rechazo durante el primer año postrasplante. HR: hazard ratio (regresión de Cox); IC95%, intervalo de confianza del 95%.
Por último, cuando se añadió el tipo de inmunoanálisis al ajuste multivariante, la relación entre la VIP y el resultado primario compuesto se volvió significativa, mientras que la relación con la mortalidad/pérdida del injerto permaneció no significativa ().
DISCUSIÓNLos resultados del presente estudio muestran que una elevada VIP en la concentración sanguínea de los anticalcineurínicos durante el primer año postrasplante no se asoció de manera independiente con menor supervivencia sin rechazo a medio plazo o mayor mortalidad a medio plazo, aunque en ambos casos en general se detectó una tendencia a esta asociación. Estos hallazgos podrían atribuirse a una falta de potencia estadística si se tiene en cuenta el número relativamente pequeño de eventos, como podría esperarse del diseño de nuestro estudio, centrado en eventos que ocurren después del primer año postoperatorio en una población privilegiada de supervivientes después de 1 año. Por otra parte, nuestros resultados también podrían reflejar la interacción entre múltiples factores relacionados con los resultados postrasplante a medio plazo, entre los cuales la VIP podría ser un factor relevante solo en algunos subconjuntos de población.
Un tema importante en el diseño de nuestro estudio es el riesgo de sesgo protopático, que se deriva del hecho de que la VIP también se asocia con cuadros clínicos que igualmente predisponen a la incidencia tardía de rechazo o mortalidad. En este sentido, se observa una asociación importante entre el CV durante el primer año postrasplante y la incidencia de rechazo y la concentración baja de anticalcineurínicos durante el mismo periodo. Ambos factores pueden estar relacionados con la incidencia de rechazo justo después del primer año postoperatorio. Se intentó sortear este inconveniente con un doble enfoque. Primero, se ajustaron todos los análisis multivariantes por la concentración sanguínea media. En segundo lugar, se realizó un análisis de sensibilidad restringido a un subconjunto de pacientes caracterizados por la ausencia de episodios de rechazo durante el primer año postoperatorio. En esta población, es menos probable que la variación de la concentración sanguínea pueda estar relacionada con el ajuste frecuente de la dosis para el tratamiento y la prevención del rechazo. Sorprendentemente, se vio que la asociación entre la VIP y el rechazo tardío fue incluso más fuerte en esta población más estable que en toda la población, aunque la asociación con la mortalidad no fue estadísticamente significativa.
Aunque nuestro estudio no pretendía evaluar las diferencias entre los tipos o fórmulas de anticalcineurínicos, se encontró un efecto independiente del tipo de anticalcineurínico en los resultados a 5 años. El hecho de que la fuerza de las asociaciones con los resultados fuera mayor después de excluir de los modelos el tipo de anticalcineurínico indica que el tamaño del efecto observado en nuestro estudio podría ser, al menos en parte, atribuible al tipo de anticalcineurínico. Una evaluación más detallada reveló que la VIP es menor en las fórmulas a base de tacrolimus que con la ciclosporina. Estos resultados indican que la VIP no es un tema tan importante en la inmunosupresión basada en tacrolimus como en la inmunosupresión basada en ciclosporina, y esta característica podría ser la base de los mejores resultados clínicos obtenidos con tacrolimus. Este es un hallazgo importante, ya que la mayor parte de la inmunosupresión contemporánea se basa en el tacrolimus. Es de destacar que el TLP tuvo una VIP más baja que el TLI y la ciclosporina, como ya se ha observado en el trasplante de riñón27. Se ha señalado que estos hallazgos podrían explicarse por la mejor adherencia al tratamiento28. De hecho, la VIP se ha propuesto como marcador simple, cuantitativo y fiable de la adherencia2,10. El diseño de nuestro estudio impidió realizar una evaluación detallada de la adherencia terapéutica.
Recientemente, Gueta et al.21 han informado de la asociación entre la VIP del TLI de 3 a 12 meses después del TxC y los resultados después del primer año postoperatorio en una cohorte de 72 receptores de TxC de un solo centro. Encontraron un riesgo de rechazo 8 veces mayor en pacientes con un CV superior al 28,8%. Sin embargo, no pudieron observar ninguna asociación con la mortalidad. Las diferencias en la fuerza de las asociaciones en comparación con nuestro estudio pueden explicarse por razones metodológicas. Tuvieron en cuenta cualquier rechazo en el periodo de observación, que abarcó muchos episodios con expresión patológica solamente (p. ej., rechazos de grado 1R), mientras que nuestro estudio consideró solo los episodios que requirieron un aumento de la inmunosupresión. Además, a diferencia de nuestro estudio, no encontraron ninguna relación entre el CV y la concentración sanguínea media o la incidencia de rechazo durante el primer año postrasplante. La inclusión de la ciclosporina en nuestro estudio también podría explicar algunas diferencias entre los estudios. En cuanto a la mortalidad, no es de extrañar la falta de asociación con la VIP, ya que realizaron un ajuste multivariante por complicaciones cardiovasculares graves (ictus, insuficiencia cardiaca o infarto de miocardio) y estas complicaciones con frecuencia son la causa de la muerte. Además, un pequeño número de muertes (8 en total) disminuyó su potencia estadística. En otro trabajo reciente, Shuker et al.22 analizaron a 86 receptores de TxC tratados con TLI. Los autores no pudieron establecer ninguna asociación entre la VIP y la aparición de vasculopatía del aloinjerto cardiaco.
Se ha establecido la relación entre la VIP y el rechazo del aloinjerto comprobado mediante biopsia en trasplantes de riñón3,5,7–9,12,13, hígado15–19 y corazón21, tanto en pacientes tratados con ciclosporina3 como tratados con tacrolimus5,7–9,12,13,15–19,21,22, y tanto en población pediátrica7,15–18 como adulta3,5,8,9,12,13,19,21. Sin embargo, Godal et al.4 no lograron demostrar esta asociación después de un ajuste multivariante; los únicos predictores independientes de rechazo restantes fueron la aparición de anticuerpos específicos del donante, concentración sanguínea de tacrolimus baja y una tasa de inasistencia a la clínica alta. En cambio, como en el estudio de Gueta et al. y el nuestro, la relación entre la VIP y la muerte continúa siendo difícil de demostrar en el trasplante renal14 o hepático a causa de las pequeñas poblaciones de estudio, las bajas tasas de mortalidad y las consecuencias no mortales de la disfunción del aloinjerto en esos contextos. Es de destacar que, en el trasplante de pulmón en adultos, un entorno clínico con una fuerte relación entre la disfunción del aloinjerto y la muerte, Gallagher et al.20 observaron una asociación muy importante entre la VIP del tacrolimus y la mortalidad.
La mayoría de los mecanismos que explican la asociación entre VIP y rechazo continúan siendo desconocidos. Según nuestros hallazgos y los de Gueta et al.21, no parece que la incidencia de rechazo esté relacionada con valores sanguíneos valle más bajos en el grupo de VIP alta. En el trasplante renal, Rodrigo et al.10 han demostrado una estrecha relación entre la VIP y la pérdida del injerto mediada por aparición de anticuerpos específicos del donante sin tener en cuenta las muertes. Asimismo, Shen et al.12 han señalado una asociación entre la VIP y pérdida del aloinjerto mediada por infección por el virus BK.
Utilizamos el CV, que es un parámetro adimensional que permite el análisis conjunto de la ciclosporina y el tacrolimus. De acuerdo con investigaciones previas4,5,10,11,13,14, para los cálculos se emplearon mediciones de los meses 3 a 12 postrasplante, en un intento de evitar la influencia de los ajustes de dosis, las interacciones de la dieta y el fármaco y las alteraciones de la absorción típicas de los trastornos más inestables, que generalmente se observan durante el periodo postrasplante inicial.
Hasta la fecha, este es el estudio de mayor tamaño que se ocupa de las consecuencias clínicas de la exposición errática a los anticalcineurínicos y amplía el conocimiento sobre este tema adquirido con otros trasplantes de órganos sólidos. Sus principales fortalezas son el gran tamaño de la muestra y su naturaleza multiinstitucional. Sin embargo, algunas limitaciones merecen comentarios: a) el diseño retrospectivo, que es muy sensible a los sesgos ocultos; aunque el ajuste de covariables es el enfoque analítico estándar, el efecto de estos sesgos no se puede eludir por completo; en cambio, nuestro estudio podría considerarse de la «vida real»; b) la ausencia de protocolos uniformes de vigilancia de la inmunosupresión y el rechazo, particularmente del rechazo tardío, entre las instituciones participantes; c) la adopción de una definición pragmática de rechazo de aloinjerto basada principalmente en el juicio clínico que condujo a un tratamiento específico; este enfoque se ha utilizado en informes anteriores24 y parece que es muy útil en estudios multiinstitucionales, donde se carece de un protocolo único sobre la vigilancia del rechazo en los centros participantes; además, en el contexto de las etapas más avanzadas del TxC, el impacto clínico de los hallazgos de la biopsia, cuando se toman aisladamente, continúa siendo controvertido26, pero debe reconocerse que esta definición puede incluir episodios que en realidad no son rechazo agudo; d) el empleo de diferentes análisis para determinar la concentración sanguínea de tacrolimus, que pueden haber originado diferencias considerables en las lecturas; e) las determinaciones de la concentración obtenidas durante los ingresos hospitalarios; los cuadros clínicos que requieran hospitalización durante el primer año postrasplante (frecuentemente rechazo o infección) y sus correspondientes tratamientos pueden modificar la biodisponibilidad del tacrolimus y aumentar la variabilidad después. Sin embargo, en el trasplante de pulmón, Gallagher et al.20 no encontraron diferencias en la VIP de la concentración de tacrolimus en pacientes hospitalizados y ambulatorios. Además, el número de mediciones de la concentración de tacrolimus a los 4-12 meses después del TxC en nuestro estudio fue bastante parecido a las comunicadas por Gueta et al.21, que prestaron especial atención a la obtención de una situación de equilibrio (al menos 48 h en régimen de dosis fija) mediante valores valle de 3 a 12 meses después del TxC; f) falta de información sobre la aparición de anticuerpos específicos del donante e incidencia de rechazo mediada por anticuerpos, lo que podría haber explicado algunos hallazgos, como los casos de rechazo con biopsia negativa, y g) las diferencias entre los anticalcineurínicos deben interpretarse con cuidado, ya que las duraciones del seguimiento no fueron iguales para cada uno de ellos.
CONCLUSIONESLos resultados del presente estudio muestran que la VIP en la concentración sanguínea de los anticalcineurínicos tiene poca influencia en los resultados del TxC a medio plazo. Sin embargo, la VIP alta puede predisponer al rechazo en pacientes inicialmente estables.
- –
La variabilidad en la concentración sanguínea de los anticalcineurínicos se ha relacionado con malos resultados (rechazo o mortalidad) en receptores de trasplante de órgano sólido.
- –
Los datos son escasos en el trasplante de corazón. Solo un estudio ha mostrado una relación entre los niveles de variabilidad y el rechazo, pero no con la mortalidad. En otro estudio, la variabilidad no mostró relación con la aparición de vasculopatía del aloinjerto cardiaco.
- –
Se ha obtenido información de un gran registro multicéntrico.
- –
La influencia de los niveles de variabilidad es poca en general y se observa principalmente en la incidencia de rechazo del aloinjerto, pero no en la mortalidad por cualquier causa o la pérdida del injerto.
- –
Nuestros resultados indican que la influencia de los niveles de variabilidad podría ser independiente de la derivada de las variaciones secundarias al tratamiento de los episodios de rechazo inicial.
- –
Al parecer, tanto la variabilidad como su influencia en los resultados son menos relevantes en la época contemporánea del tratamiento con tacrolimus.
Este trabajo contó con el apoyo de becas de Astellas Pharma (España) y la Asociación de Insuficiencia Cardiaca de la Sociedad Española de Cardiología.
CONTRIBUCIÓN DE LOS AUTORESF. González-Vílchez: diseño del estudio, análisis estadístico, redacción del borrador, aprobación del manuscrito final; M.G. Crespo-Leiro, J. Delgado-Jiménez, F. Pérez-Villa, J. Segovia-Cubero, B. Díaz-Molina, S. Mirabet-Pérez, J.M. Arizón del Prado, T. Blasco-Peiró, M. Martínez-Sellés, L. Almenar-Bonet, I. Garrido-Bravo y G. Rábago: discusión de resultados, aprobación final del manuscrito, recopilación de datos; J.A. Vázquez de Prada: diseño del estudio, redacción del borrador, aprobación del manuscrito final.
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto de intereses.