La estabilización del número de trasplantes cardiacos y el aumento de los tiempos de espera han llevado al incremento de implantes de dispositivos de asistencia ventricular izquierda (DAVI) de larga duración en enfermos con insuficiencia cardiaca terminal1. Sin embargo, cuando la causa es la miocardiopatía hipertrófica (MCH) y las miocardiopatías restrictivas, la opción del soporte mecánico no es obvia, ya que por sus características anatómicas se suele considerarlas contraindicación para la terapia con DAVI2,3. La razón es que el ventrículo izquierdo suele ser demasiado pequeño o trabeculado; esto supone riesgo de colapso al asistirlo e ineficacia de la asistencia y bajo gasto, así como succión del tejido circundante, trombosis e ictus2,3. La complejidad es incluso mayor para optimizar el flujo sin crear succión cuando el paciente comienza a moverse y cambiar de posturas, debido a los cambios de orientación de la cánula de entrada. Por ello, los pacientes con MCH reciben DAVI solo ocasionalmente, y se han indicado pequeñas series unicéntricas, incluso mezclando MCH con restrictivas2,3. Se presenta el caso de 1 paciente de nuestro centro con MCH que recibió un DAVI, el primero indicado en España. Los objetivos son confirmar que pacientes seleccionados pueden beneficiarse de esta terapia y aportar información sobre parámetros anatómicos, funcionales y quirúrgicos útiles para el implante de DAVI en MCH.
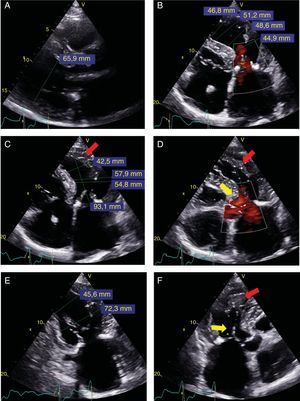
El paciente es un varón de 66 años, con MCH obstructiva, al que en 2004 se implantó desfibrilador tras episodio de muerte súbita recuperada por fibrilación ventricular. En 2013 se realizó ablación septal sin éxito. Ingresó por insuficiencia cardiaca en 2015, y se lo derivó para valoración antes del trasplante. Se lo incluyó en lista electiva a los 3 meses, tras optimizar el tratamiento médico y resincronizar. Tras 1 año en lista, contrajo hipertensión pulmonar irreversible, y se decidió evaluarlo para DAVI como puente a candidatura. El cateterismo cardiaco derecho (en septiembre de 2016) mostró presión auricular derecha (PAD) de 11 mmHg; presión pulmonar media de 45 mmHg; enclavamiento (PCP) de 22 mmHg; índice cardiaco a 1,5 l/min/m2 y resistencias vasculares pulmonares en 9,2 UW. Se observó relación PAD/PCP de 0,45 e índice de trabajo sistólico de ventrículo derecho (VD) de 397 mmHg/ml/m2. Se realizó ecocardiograma transtorácico (figura 1) para valorar el VD y sus dimensiones, que parecieron suficientes. Presentaba insuficiencia mitral de grado III/IV por movimiento sistólico anterior y gradiente dinámico en tracto de salida de 50 mmHg, sin insuficiencia aórtica. El VD basal era de 48 mm; S’ del Doppler tisular, 9cm/s; desplazamiento sistólico del plano del anillo tricuspídeo (TAPSE), 14 mm, y función radial subjetiva conservada, con cambio fraccional de área del 59%. Se descartaron trombos intraventriculares y shunts mediante ecocardiograma transesofágico. De la analítica destacaban: aclaramiento de creatinina, 53ml/min, y fracción aminoterminal del propéptido natriurético cerebral, 4.866 pg/ml. Se calculó una puntuación HeartMate II de 2,67.
Ecocardiograma transtorácico antes del implante. A: eje paraesternal largo; diámetro telediastólico del ventrículo izquierdo (65,9 mm). B: apical de 4 cámaras-sístole; diferentes diámetros a nivel basal (44,9 mm) hasta el ápex (46,8 mm). C: apical de 4 cámaras-diástole; diferentes diámetros a nivel basal (54,8 mm) y hasta ápex (42,5 mm); trabeculación lateral apical (flecha roja), no visto en sístole. D: apical de 4 cámaras-sístole con color; trabeculación apical-lateral (flecha roja), con mejor definición de separación con pared lateral; la flecha amarilla muestra aceleración en el tracto de salida. E: apical de 2 cámaras-telediástole; diámetro telediastólico basal (72,3 mm) y medio (45,6 mm). F: apical de 3 cámaras-sístole; se observa movimiento sistólico anterior (flecha amarilla) y trabeculación apical (flecha roja). Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En octubre de 2016 se implantó un HeartWare HVAD con 113 min de circulación extracorpórea. Se desestimó la necesidad de realizar procedimientos quirúrgicos adicionales. La miectomía septal se consideró innecesaria, ya que añadiría complejidad a la cirugía y obligaría a pinzamiento aórtico, con riesgo de insuficiencia aórtica y/o shunts residuales. Durante el implante se comprobó visualmente y con ecocardiograma transesofágico que las trabéculas apicales no interferían con el orificio de entrada del sistema. No resecar las trabéculas evitó que una resección incompleta dejase restos que pudieran ser succionados por el DAVI, dada la dificultad técnica para hacerlo a través del pequeño orificio del coring. En la salida de bomba se apoyó el VD con milrinona y adrenalina y se usó óxido nítrico para reducir la poscarga. Se logró suspender el óxido nítrico rápidamente, con extubación a las 9 h. Se produjeron eventos de bajo flujo en las primeras 24-48 h, a pesar del bajo soporte (2.400 rpm), que respondieron a optimización de precarga con reposición de fluidos para PAD de 10-12mmHg, presión arterial media de 65-80mmHg y disminución progresiva de inotrópicos y vasopresores (milrinona y adrenalina). Esto último fue importante para solventar varios episodios de bajo flujo, al evitar que el aumento de contractilidad del ventrículo izquierdo secundario al uso de inotrópicos ocasionase que compitiese su propio ventrículo con el DAVI. En nuestro caso y dado que el VD se comportó bien, fue fácil una retirada de inotrópicos relativamente rápida. El paciente fue dado de alta con soporte optimizado a 2.500 rpm y 4-4,5 l/min, sin problemas de bajo flujo (figura 2).
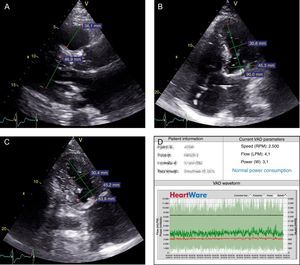
A–C: ecocardiograma transtorácico tras el implante. A: eje paraesternal largo; diámetro telediastólico de ventrículo izquierdo (46,9 mm), diámetro de ventrículo derecho (36,1 mm a este nivel). B: apical de 4 cámaras; diámetro telediastólico basal del ventrículo izquierdo (45,3 mm) y medio (31 mm). C: apical de 2 cámaras; diámetro telediastólico basal del ventrículo izquierdo (45,2 mm) y medio (30,4 mm). D: programación HeartWare HVAD; normalidad de parámetros con ritmo circadiano y sin eventos de bajo flujo. Flow LPM: flujo (l/min); Power W: potencia (W); Speed RPM: velocidad (rpm).
En conclusión, el implante de DAVI en pacientes con MCH es posible, especialmente en fase dilatada, y puede ser una opción más para pacientes con contraindicaciones relativas para trasplante. Sin embargo, representa un gran desafío en la selección del paciente y para el tratamiento a través de ajustes de precarga, poscarga, inotropismo y soporte de DAVI.