La litoplastia se ha demostrado segura y eficaz en el tratamiento de lesiones moderada o gravemente calcificadas del sistema arterial femoropoplíteo, incluso en oclusiones crónicas1. Los resultados muestran una reducción significativa de la estenosis, con bajo porcentaje de implante de stent y necesidad de revascularización en el seguimiento. Más recientemente se han publicado también experiencias en litoplastia con buen resultado para el tratamiento de lesiones coronarias calcificadas2.
Hay poca experiencia sobre el uso de litoplastia sobre vasos periféricos para llevar a cabo acceso femoral facilitado en el implante percutáneo de válvula aórtica3. De demostrarse su eficacia en este contexto, podría aumentar el porcentaje de pacientes tratados mediante acceso femoral, hecho importante si se tiene en cuenta que se ha demostrado que conlleva menos mortalidad y mejores resultados que otros accesos alternativos4.
Se presenta la experiencia inicial con 4 pacientes, hasta donde se conoce la más extensa, con lesiones graves y gravemente calcificadas en ambos vasos iliacos sometidos a litoplastia con el sistema Shockwave Lithoplasty (Shockwave Medical Inc.).
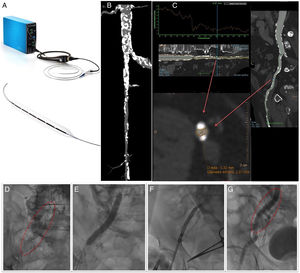
El Shockwave Lithoplasty balón (figura 1A) es un sistema que permite tratar lesiones estenóticas calcificadas de arterias periféricas mediante la emisión de ondas de presión sónicas que generan una alta energía mecánica. Esta energía agrieta el calcio superficial y profundo del vaso con un mínimo impacto en el tejido sano. El objetivo final es la modificación de la placa calcificada de una placa rígida e indilatable a otra con mayor distensibilidad que permita el paso de material a través de ella, minimizando el trauma en el vaso con respecto a la angioplastia con balones convencionales.
A: sistema Shockwave Lithoplasty. B y C: imágenes de tomografía computarizada que muestran la extensa calcificación de la arteria iliaca común y el origen de la iliaca externa derecha, así como de la arteria femoral común, que presentan además lesiones graves en todos estos segmentos con un diámetro luminal mínimo de 5,3×2,4mm. D: extensa calcificación observada en la escopia. E: inflado del balón de litoplastia de 7×60mm, sobre una guía de 0,014 pulgadas Asahi RG3 de 330cm. F: paso de una prótesis CoreValve Evolute Pro de 29 a través de la lesión calcificada. G: estado final de la arteria tras finalizar el procedimiento; se puede observar la fractura que se ha producido en el calcio sin imágenes de disección asociadas.
El dispositivo consta de una consola de pequeño tamaño donde se localiza el generador de pulsos y un pequeño monitor donde se contabilizan los pulsos administrados. A esta consola se conecta un cable, que en su porción más distal tiene un botón que activa y desactiva la administración de los pulsos a voluntad. Este cable conector se conecta a su vez con el catéter balón de litoplastia. Es un balón semicompliante, de diseño over the wire, que lleva en su interior 6 emisores de onda sónica miniaturizados. Es compatible con introductores de 6 y 7 Fr (balones de 6,5 y 7 mm) y se monta sobre guía de 0,014 pulgadas. Los tamaños actualmente disponibles van de 3,5 hasta 7mm, todos ellos con una longitud de balón 60mm y una longitud total del catéter de 110mm. Cada catéter puede administrar hasta 10 ciclos de 30 pulsos (300 pulsos en total por balón). Para aplicar las ondas sónicas, y una vez alcanzada la posición deseada, se infla previamente el balón a 4atm, se administran entonces los 30 pulsos y se suben posteriormente a 6atm (valor nominal); la presión de rotura es de 10atm. Dado que la propagación de la energía que produce la fragmentación del calcio se transmite cuando el balón entra en contacto con la íntima del vaso, es importante elegir un balón en relación 1:1 con el tamaño de la arteria para conseguir una buena aposición entre el balón y el calcio de la lesión cuando este se encuentre inflado a 4atm (2atm por debajo de su valor nominal).
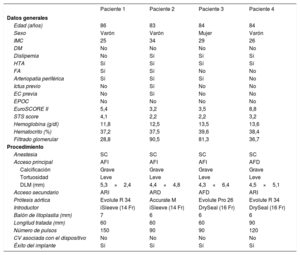
En la tabla 1 se muestran las características basales de los pacientes y del procedimiento. La mayoría eran varones con riesgo quirúrgico entre medio y alto, cuya afección arterial periférica no estaba diagnosticada previamente. Todos los procedimientos se hicieron mediante sedoanalgesia consciente, y en todos menos en uno se optó por usar la vía radial como acceso secundario, dada la afección femoral contralateral. En la mayoría, la longitud del balón (60 mm) cubrió la zona a tratar y en ningún caso fue necesario agotar los 300 pulsos disponibles para conseguir el resultado esperado. No hubo complicaciones asociadas con el dispositivo.
Características basales de los pacientes y del procedimiento
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | |
|---|---|---|---|---|
| Datos generales | ||||
| Edad (años) | 86 | 83 | 84 | 84 |
| Sexo | Varón | Varón | Mujer | Varón |
| IMC | 25 | 34 | 29 | 26 |
| DM | No | No | No | No |
| Dislipemia | No | Sí | Sí | Sí |
| HTA | Sí | Sí | Sí | Sí |
| FA | Sí | Sí | No | No |
| Arteriopatía periférica | Sí | Sí | Sí | No |
| Ictus previo | No | Sí | No | No |
| EC previa | No | Sí | No | No |
| EPOC | No | No | No | No |
| EuroSCORE II | 5,4 | 3,2 | 3,5 | 8,8 |
| STS score | 4,1 | 2,2 | 2,2 | 3,2 |
| Hemoglobina (g/dl) | 11,8 | 12,5 | 13,5 | 13,6 |
| Hematocrito (%) | 37,2 | 37,5 | 39,6 | 38,4 |
| Filtrado glomerular | 28,8 | 90,5 | 81,3 | 36,7 |
| Procedimiento | ||||
| Anestesia | SC | SC | SC | SC |
| Acceso principal | AFI | AFI | AFI | AFD |
| Calcificación | Grave | Grave | Grave | Grave |
| Tortuosidad | Leve | Leve | Leve | Leve |
| DLM (mm) | 5,3×2,4 | 4,4×4,8 | 4,3×6,4 | 4,5×5,1 |
| Acceso secundario | ARI | ARD | AFD | ARI |
| Prótesis aórtica | Evolute R 34 | Accurate M | Evolute Pro 26 | Evolute R 34 |
| Introductor | iSleeve (14 Fr) | iSleeve (14 Fr) | DrySeal (16 Fr) | DrySeal (16 Fr) |
| Balón de litoplastia (mm) | 7 | 6 | 6 | 6 |
| Longitud tratada (mm) | 60 | 60 | 60 | 90 |
| Número de pulsos | 150 | 90 | 90 | 120 |
| CV asociada con el dispositivo | No | No | No | No |
| Éxito del implante | Sí | Sí | Sí | Sí |
AFD: arteria femoral derecha; AFI: arteria femoral izquierda; ARD: arteria radial derecha; ARI: arteria radial izquierda; CV: complicación vascular; DLM: diámetro luminal mínimo; DM: diabetes mellitus; EC: enfermedad coronaria; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; HTA: hipertensión arterial; IMC: índice de masa corporal; SC: sedoanalgesia consciente; STS: Society of Thoracic Surgeons.
En la figura 1 se presenta el caso de un paciente. En ella se puede ver imágenes de tomografía computarizada del sector vascular ileofemoral previo al implante e imágenes del procedimiento.
Como conclusión de los resultados observados en nuestra serie, se puede decir que se trata de un procedimiento sencillo, muy reproducible y eficaz en el tratamiento de lesiones graves y muy calcificadas, pues se consiguió realizar el implante transfemoral en todos los casos. Su utilidad según el tipo de enfermedad vascular está por determinar.
CONFLICTO DE INTERESESR. Trillo Nouche es proctor de Medtronic.