La disfunción de las bioprótesis mitrales implica una reoperación compleja por las condiciones clínicas de los pacientes o por las dificultades técnicas que conlleva la resección de la prótesis y el implante de una nueva en un anillo debilitado, con la posibilidad de rotura estructural miocárdica o aparición de fugas perivalvulares.
El implante transcatéter de una válvula en bioprótesis mitrales degeneradas es una técnica muy poco extendida1–4. Es una alternativa a la cirugía convencional para pacientes complejos, que evita la disección cardiaca, la circulación extracorpórea y la isquemia miocárdica. Aunque la mayoría de los implantes se han realizado por vía transapical por ser un acceso más directo y con dispositivos de menor longitud, existe la opción de implante a través de la vena femoral, perforación del septo interauricular e implante anterógrado.
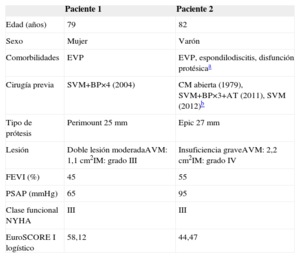
Desde enero de 2007 hasta septiembre de 2014, en nuestro centro se realizaron 70 implantes por vía transapical. En 6 pacientes se implantó una válvula en una prótesis degenerada, 4 en posición aórtica y 2 en posición mitral. Las características clínicas de los pacientes seleccionados para este tipo de procedimiento mitral se resumen en la tabla.
Descripción del perfil clínico de los dos pacientes
| Paciente 1 | Paciente 2 | |
|---|---|---|
| Edad (años) | 79 | 82 |
| Sexo | Mujer | Varón |
| Comorbilidades | EVP | EVP, espondilodiscitis, disfunción protésicaa |
| Cirugía previa | SVM+BP×4 (2004) | CM abierta (1979), SVM+BP×3+AT (2011), SVM (2012)b |
| Tipo de prótesis | Perimount 25 mm | Epic 27 mm |
| Lesión | Doble lesión moderadaAVM: 1,1cm2IM: grado III | Insuficiencia graveAVM: 2,2cm2IM: grado IV |
| FEVI (%) | 45 | 55 |
| PSAP (mmHg) | 65 | 95 |
| Clase funcional NYHA | III | III |
| EuroSCORE I logístico | 58,12 | 44,47 |
AT: anuloplastia tricuspídea; AVM: área valvular mitral; BP: bypass coronario; CM: comisurotomía mitral; EVP: enfermedad vascular periférica; FEVI: fracción de eyección del ventrículo izquierdo; IM: insuficiencia mitral; NYHA: New York Heart Association; PSAP: presión sistólica de la arteria pulmonar; SVM: sustitución valvular mitral.
Ambos casos se realizaron con anestesia general en la sala de hemodinámica por dos cirujanos cardiovasculares y un cardiólogo hemodinamista. Se realizó una minitoracotomía anterior izquierda por quinto-sexto espacio intercostal y, tras la apertura del pericardio, se aseguró el abordaje transapical mediante dos puntos en U de monofilamento 3/0 apoyados en teflón. Se introdujo una guía, mediante punción directa del ápex, a través de la prótesis mitral hasta la aurícula izquierda y se sustituyó por una de alto soporte, previamente preformada, para evitar perforaciones traumáticas de la pared auricular. Se alineó el anillo radioopaco de la bioprótesis con control radiológico y ecocardiográfico, con mayor dificultad para la Epic, ya que solo muestra el anillo radioopaco, mientras que la Perimount muestra un anillo mayor, además del soporte de la prótesis. Se realizó la predilatación con balón y posteriormente se implantaron unas prótesis Edwards SAPIEN XT (Edwards Lifesciences; Irvine, California, Estados Unidos) montadas en sentido contrario al implante aórtico transapical, de 23 y 26mm respectivamente, atendiendo a los diámetros protésicos internos descritos en la ficha técnica de cada prótesis, compatibles con las mediciones realizadas mediante ecocardiografía transesofágica (23mm para la Perimount 25 y 24,5mm para la Epic 27), según el protocolo habitual mediante sobrestimulación con marcapasos epicárdico (figura). Ambos implantes se realizaron sin incidencias técnicas, y se confirmó la correcta implantación mediante ecocardiografía transesofágica intraoperatoria.
A: prótesis SAPIEN-XT expandida dentro de la prótesis mitral degenerada Epic (St. Jude Medical; St. Paul, Minnesota, Estados Unidos); en las flechas se observa el anillo radioopaco alineado. B: prótesis SAPIEN preexpandida; se observa el anillo y el soporte de la prótesis mitral Perimount (Edwards Lifesciences; Irvine, California, Estados Unidos).
El primer paciente tuvo shock cardiogénico en las primeras horas tras el implante, con disfunción biventricular, insuficiencia renal aguda y elevación de enzimas hepáticas, que se revirtió con aminas e implante de un balón de contrapulsación intraaórtico durante 72h. El ecocardiograma al alta fue prótesis biológica mitral normofuncionante, fracción de eyección del ventrículo izquierdo del 35% y presión sistólica de la arteria pulmonar de 70mmHg.
El segundo paciente fue extubado a las 8h, sin requerir aminas en ningún momento, con tratamiento antibiótico intravenoso por infección respiratoria durante su estancia en planta. El ecocardiograma al alta fue prótesis biológica mitral normofuncionante, con insuficiencia periprotésica de grado I en comisura posterior, insuficiencia tricuspídea de grado II y presión sistólica de la arteria pulmonar de 65mmHg.
Ambos pacientes mejoraron la clase funcional de la New York Heart Association de III a II y los parámetros hemodinámicos, el paciente 1 a los 12 meses y el paciente 2 a los 6 meses de seguimiento.
- •
Paciente 1: área valvular mitral > 2cm2, velocidad máxima de 2,1 m/s, fracción de eyección del ventrículo izquierdo del 30%, presión sistólica de la arteria pulmonar de 65mmHg.
- •
Paciente 2: área valvular mitral de 2,2cm2, gradiente medio de 8mmHg, fracción de eyección del ventrículo izquierdo del 50%, presión sistólica de la arteria pulmonar de 55mmHg, insuficiencia tricuspídea grave, sin insuficiencia mitral.
En caso de disfunción de una prótesis biológica, el tratamiento quirúrgico es la primera opción terapéutica, pero la cirugía de explante valvular mitral no está exenta de riesgos. El implante transcatéter de válvulas está cambiando el abordaje de las valvulopatías aórticas en pacientes con alto riesgo quirúrgico, pero aún está por determinar el papel que pueden tener en las disfunciones de prótesis biológicas en posición mitral.
En nuestra serie, seleccionamos a 2 pacientes con alto riesgo quirúrgico rechazados para cirugía convencional. Aunque las evoluciones postoperatorias fueron muy diferentes, la evolución clínica ha sido favorable en ambos casos, aun cuando los pacientes presentaban comorbilidad múltiple. La disfunción ventricular izquierda sigue siendo un factor de riesgo en las correcciones de la insuficiencia mitral por la sobrestimación de la función ventricular5, que en parte explicaría la mala evolución inicial de la paciente 1. En nuestra opinión, en estos pacientes debe plantearse implantar antes de la cirugía un balón de contrapulsación intraaórtico e instaurar tratamiento inotrópico durante las primeras horas tras el implante. Estas medidas, una vez instauradas, cambiaron drásticamente la evolución de la paciente 1.
En conclusión, el implante transcatéter de una válvula mitral por vía transapical en bioprótesis degeneradas es un procedimiento factible que se está consolidando como una alternativa para los pacientes de alto riesgo o rechazados para cirugía convencional.