Las enfermedades cardiovasculares siguen siendo la principal causa de morbimortalidad en el mundo occidental. Entre los principales factores de riesgo de estas enfermedades están las hiperlipemias, entre ellas la hipercolesterolemia y la dislipemia aterogénica. Los tratamientos habituales de la hipercolesterolemia incluyen los inhibidores de la HMG-CoA reductasa (estatinas), los inhibidores de la NPC1L1 (ezetimiba), los fitosteroles, la menacolina K, los secuestradores de las sales biliares y los inhibidores de la PCSK9. Los fármacos hipolipemiantes en desarrollo son los inhibidores de la proteína transportadora del colesterol esterificado (CETP), los oligonucleótidos antisentido y los inhibidores de la proteína microsomal de transferencia de triglicéridos. La relación entre hiperlipemia y ateroesclerosis está bien documentada. Un fenómeno clave en la evolución de la ateroesclerosis coronaria es el remodelado positivo, descrito por Glagov hace más de 3 décadas, que consiste en el incremento del diámetro de la arteria a medida que progresa la placa de ateroma y aumenta su volumen, de modo que se atenúa la reducción de la luz vascular que tendría lugar como consecuencia del crecimiento de la placa de ateroma. Así, solo en fases muy finales, cuando el aumento del diámetro del vaso no es capaz de compensar el crecimiento de la placa de ateroma, tendrían lugar la reducción del flujo coronario y las consecuencias clínicas de esta. En este artículo se revisan los mecanismos de acción de los fármacos hipolipemiantes y la implicación de controlar las concentraciones lipídicas en la regresión de la placa ateroesclerótica.
Palabras clave:
Las enfermedades cardiovasculares (ECV) continúan siendo la principal causa de morbilidad y mortalidad en el mundo1,2, de ahí que la mayoría de los gobiernos3 y las sociedades científicas4-6 recomienden intensificar los esfuerzos para prevenirlas y tratarlas con todas las armas disponibles, como una dieta saludable, realizar más actividad física y evitar conductas de riesgo como el tabaquismo, y el uso racional de los tratamientos farmacológicos. Entre los principales factores de riesgo de las ECV, las dislipemias —especialmente la hipercolesterolemia y la dislipemia aterogénica— tienen un papel muy importante. El principal transporte plasmático de colesterol es el unido a lipoproteínas de baja densidad (cLDL), que es muy aterogénico, ya que existe una estrecha correlación entre cLDL y riesgo cardiovascular7-9. En cambio, la dislipemia aterogénica se caracteriza por un incremento de la concentración de triglicéridos y disminución del colesterol unido a lipoproteínas de alta densidad (cHDL)10. La concentración plasmática de triglicéridos también se asocia con ateroesclerosis, pero su relación con la incidencia de ECV es más débil11. También concentraciones bajas de cHDL se asocian con mayor riesgo de ECV12, al igual que la concentración de apolipoproteína B, y la relación apolipoproteína B/apolipoproteína A y lipoproteína (a)13.
La ateroesclerosis, uno de cuyos principales factores de riesgo es la hiperlipemia, es una enfermedad progresiva cuyo comienzo tiene lugar, en general, a partir de la segunda década de la vida, con la aparición de estrías grasas y disfunción endotelial. A partir de la tercera década, se originan las placas de ateroma propiamente dichas, que pueden progresar más o menos rápidamente, parcialmente en relación con roturas y sus complicaciones. Las manifestaciones clínicas tienen lugar cuando las placas de ateroma producen un grado importante de obstrucción de la luz vascular (cardiopatía isquémica estable) o cuando una placa sufre una complicación aguda con la aparición de fenómenos trombóticos intracoronarios (síndromes coronarios agudos)14. Un fenómeno clave en la evolución de la ateroesclerosis coronaria es el remodelado positivo, descrito por Glagov hace más de 3 décadas. Básicamente, consiste en que, a medida que progresa la placa de ateroma y aumenta su volumen, también se incrementa el diámetro de la arteria coronaria, de modo tal que compensa la reducción de la luz vascular que tendría lugar como consecuencia del crecimiento de la placa de ateroma. Así, solo en fases muy finales, cuando el incremento del diámetro del vaso no es capaz de compensar el crecimiento de la placa, tendrían lugar la reducción del flujo coronario y sus consecuencias clínicas15.
A continuación se expone una revisión del papel y los mecanismos de la dieta, la actividad física y los fármacos en el tratamiento de las hiperlipemias, así como la implicación del control lipídico en la reducción de la placa y la trascendencia de este fenómeno para nuestros pacientes.
Dieta y Ejercicio fÍSico en Las HiperlipemiasLos 2 patrones dietéticos más estudiados por sus efectos en el sistema cardiovascular son la dieta mediterránea 16,17 y la dieta DASH (Dietary Approaches to Stop Hypertension)18. Ambas abundan en frutas, verduras, frutos secos, legumbres, cereales integrales y pescado, y restringen la carne roja, los productos cárnicos procesados, los cereales refinados y los azúcares añadidos. La dieta mediterránea incluye además otros 2 alimentos clave, el aceite de oliva y el vino, consumido con moderación; y la dieta DASH, una reducción en el consumo de sal. Estas dietas han mostrado un efecto reductor del riesgo vascular al mejorar el perfil lipídico, además de mejorar otros factores de riesgo como la hipertensión arterial y el metabolismo de la glucosa, entre otros.
La vida sedentaria es otro de los principales factores de riesgo vascular. También está demostrado que la actividad física regular y el ejercicio físico reducen el riesgo de complicaciones cardiovasculares de las personas sanas, los individuos con riesgo vascular y los pacientes que ya han sufrido una complicación cardiovascular19. Se ha demostrado que el ejercicio aeróbico aporta beneficios en el perfil lipídico al aumentar la actividad de la lipoproteinlipasa extrahepática, que reduce la cifra de triglicéridos, y disminuir la actividad de la enzima CETP, que da lugar a un aumento del cHDL, en especial de la subfracción 2, que es la que provee mayor protección contra eventos cardiovasculares20.
Fármacos Comúnmente Utilizados en el Tratamiento de las HipercolesterolemiasInhibidores de la 3-hidroxi-3-metilglutaril-coenzima A reductasa (estatinas)Las estatinas son los fármacos de elección en el tratamiento tanto de la hipercolesterolemia como de la dislipemia aterógena. Su eficacia clínica se ha demostrado en varios metanálisis21, de ahí que incluso la última guía de la American Heart Association recomiende administrarlas a todos los pacientes con riesgo vascular4. Debe remarcarse que las estatinas aumentan la incidencia de diabetes22, además de otros efectos secundarios, por lo que su empleo generalizado es actualmente objeto de debate. Su principal efecto hipolipemiante se debe a una inhibición de la enzima que cataliza la conversión de la 3-hidroxi-3metilglutaril-coenzima A (HMG-CoA) a mevalonato, un metabolito clave en la síntesis del colesterol. Su bloqueo se debe a la gran similitud entre estos fármacos y la HMG-CoA. Además, las estatinas mejoran la función endotelial, estabilizan la placa de ateroma y previenen la formación de trombos23.
Inhibidores de NPC1L1 (ezetimiba)La ezetimiba es un inhibidor del receptor de la NPC1L1 (N-terminal Niemann-Pick C1-like protein 1) que se localiza en la cara luminal de los enterocitos y se encarga de la captación de colesterol. En monoterapia puede reducir las cifras de cLDL en un 18%24 y el estudio IMPROVE-IT ha demostrado que reduce en un 6,4% la incidencia de complicaciones cardiovasculares en los pacientes tratados25.
FitoesterolesLos esteroles de las plantas como el sitosterol y el campesterol están presentes en una dieta saludable en cantidades que se aproximan a los 0,5 g/día. No obstante, si se consume entre 1,8 y 2 g/día de estas sustancias se puede reducir el cLDL en un 10%26. Este efecto se atribuye a una interacción intestinal competitiva entre el colesterol de la dieta y estos productos. Por desgracia, no hay datos sobre sus posibles efectos reductores de eventos cardiovasculares.
Menacolina K (arroz rojo)La menacolina K es una sustancia natural que se halla en algunas especies de levaduras como Monascus purpureus, que tiene una estructura similar a la de la lovastatina. Su efecto es similar al de este fármaco y reduce el cLDL en un 33%27, pero sin producir los efectos secundarios observados con las estatinas.
Resinas secuestradoras de ácidos biliaresLa colestiramina, el colestipol y el colesevelam inhiben la circulación enterohepática de los ácidos biliares y forman complejos insolubles con estos ácidos, que se excretan con las heces. Pueden llegar a reducir el cLDL en un 15-30%. El problema es que suelen dar lugar a molestos efectos secundarios y a altas dosis inhiben la absorción intestinal de otros nutrientes, como las vitaminas liposolubles28.
Inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (PCSK9)El alirocumab y el evolocumab son una nueva familia de fármacos muy útiles en el tratamiento de las hipercolesterolemias. La proteína PCSK9 se une a los receptores de LDL, incrementa su degradación y reduce la eliminación de partículas de LDL. De esta forma, modula las concentraciones plasmáticas de colesterol. Los inhibidores de la PCSK9 anulan la acción de esta proteína, con lo que facilitan el trabajo de los receptores de LDL y, por consiguiente, disminuyen la cantidad de colesterol en sangre. Estos fármacos imitan lo que ocurre en los casos de mutación del gen PCSK9, que se relaciona con cifras de cLDL bajas. Con estos anticuerpos se puede llegar a reducir el cLDL a 25 mg/dl. Los ensayos clínicos realizados hasta ahora también indican una reducción en la incidencia de eventos cardiovasculares29.
Fármacos Comúnmente Utilizados en el Tratamiento de las HipertrigliceridemiasAgonistas PPAR-α (Peroxisome Proliferator-Activated Receptors)Los fibratos son uno de los fármacos más útiles en el tratamiento de las dislipemias aterogénicas y las hipertrigliceridemias, ya que reducen las cifras de triglicéridos y colesterol no cHDL, junto con un incremento de las concentraciones de cHDL y apolipoproteína AI. No obstante, a pesar de su amplia utilización, todavía hay controversia sobre su eficacia clinica. Dos estudios aleatorizados han demostrado una reducción de eventos cardiovasculares con el gemfibrozilo, mientras que el bezafibrato y el fenofibrato no han mostrado esta eficacia30-34.
Ácidos grasos omega-3Los omega-3 son ácidos grasos poliinsaturados. El aceite de pescado y la combinación de ácido eicosapentanoico (EPA) y ácido docosahexanoico (DHA) son muy útiles para el tratamiento de la hipertrigliceridemia, especialmente la asociada con dislipemia aterogénica o diabetes35,36. Sin embargo, los estudios realizados no han demostrado su eficacia en la prevención de eventos cardiovasculares ni en la reducción de la mortalidad37.
Nuevas Dianas TerapéuticasEn las últimas décadas ha habido grandes avances en la elucidación de los mecanismos implicados en la regulación del metabolismo de los lípidos plasmáticos, conocimientos que han permitido sentar las bases del desarrollo de nuevas estrategias de regulación lípidica. Asi, por ejemplo, el descubrimiento del receptor de LDL condujo a descubrir la proteína de la unión al elemento-1 regulador de esterol implicada en la transcripción de dichos receptores y encargada de regular las concentraciones de colesterol celular38-41. Similar ha sido el desarrollo de los nuevos anticuerpos totalmente humanizados, alirocumab y evolocumab, contra la PCSK9. A continuación se describen las vias emergentes más relevantes y las potenciales dianas terapéuticas implicadas en la regulación lipidica (tabla).
Mecanismo de acción de las terapias hipolipemiantes
| Clase farmacológica | Mecanismo de acción | Efecto en lipoproteínas |
|---|---|---|
| Estatinas | Inhibidores de la HMG-CoA reductasa | ↓cLDL y TGC |
| Ezetimiba | Inhibidor selectivo de la absorción intestinal de colesterol | ↓cLDL |
| Resinas | Intercambio iónico intestinal | ↓cLDL |
| Ácidos grasos omega-3 | Disminuyen la producción hepática de VLDL | ↓TGC |
| Fibratos | Agonistas de PPARa | ↓TGC ↑ ↓cHDL |
| iPCSK9 | Inhibe la unión de PCSK9 al receptor de LDL | ↓cLDL y ↓Lp(a) |
| Inhibidores de CETP | Reducción de CEPT | ↓cLDL y TGC y ↓cHDL |
| Oligonucleótidos antisentido ApoB | Reducen la producción hepática de ApoB-100 | ↓cLDL (ApoB) y ↓Lp(a) |
| Oligonucleótidos antisentido ApoC-III | Reducen la producción hepática de ApoC-III | ↓ApoC-III y ↓TGC |
| Oligonucleótidos antisentido Lp(a) | Reducen la producción hepática de Lp(a) | ↓Lp(a) |
| Inhibidores de MPT | Disrupción de la síntesis de lipoproteínas en el intestino y hepático | ↓cLDL y TGC |
| Ácido bempedoico | Bloquea la adenosina trifosfato citrato liasa (ACL) y activa la adenosina monofosfato-activado proteincinasa (AMPK) | ↓cLDL y ↓Lp(a) y ↓PCRs |
| Inhibidores de diaglicerol aciltransferasa | Inhiben la síntesis de TGC | ↓TGC |
| Inhibidores ACAT | Frenan la acumulación de EC en macrófagos | ↓VLDL |
ACAT: enzima acil-CoA colesterol aciltransferasa; ApoB: apolipoproteína B; ApoC: apolipoproteína C; CEPT: proteína transportadora de colesterol esterificado; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; LP(a): lipoproteína (a); MPT: proteína de transferencia de trigliceridos microsomal; PCRs: proteína C reactiva ultrasensible; PCSK9: proproteína convertasa subtilisina/kexina tipo 9; PPARα: receptor activado de proliferacion de peroxisomas alfa; TGC: trigliceridos; VLDL: lipoproteínas de muy baja densidad.
El mecanismo de acción de los inhibidores se basa en la supresión de la función de esta proteína, que conduce a un aumento del cHDL acompanado de una reducción de la concentración de triglicéridos y cLDL. En condiciones normales, la CETP media la transferencia de ésteres de colesterol del cHDL a la apolipoproteína B-100, que da lugar a una reducción del cHDL42. En personas con deficiencia de CETP, se observaron cifras de cHDL significativamente más altas43, por lo que la inhibición de la CEPT se convirtió en una atractiva diana terapéutica. Sin embargo, los datos obtenidos de los ensayos clínicos con 3 inhibidores de la CEPT, tordetrapib, dalcetrapib y evacetrapib, han resultado fallidos44-46. El anacetrapib es un nuevo inhibidor de la CEPT oralmente activo cuyos resultados de eficacia y seguridad en el ensayo DEFINE muestran un incremento sustancial de cHDL y apolipoproteína A1 (el 138 y el 45% respectivamente) y reducciones de cLDL, apolipoproteína B y lipoproteína (a) (el 40, el 21 y el 36%)47, si bien un estudio posterior realizado en pacientes con hipercolesterolemia familiar (REALIZE) mostró una reducción más discreta de los valores de cLDL48. El estudio REVEAL es un ensayo clínico aleatorizado, a doble ciego y controlado con placebo que evalúa la eficacia y la seguridad de la adición de anacetrapib 100 mg/día frente a atorvastatina, y sus resultados se esperan para finales de 2017.
Los paradójicos resultados de los estudios previamente comentados, con incremento del cHDL y ausencia de reducción de la mortalidad cardiovascular, resaltan la controversia sobre el verdadero papel de la concentración de cHDL en el desarrollo de la ateroesclerosis. Es posible que la funcionalidad de la partícula de HDL tenga un papel aún más importante que la concentración misma. La capacidad de eflujo de cHDL es la capacidad que tienen estas partículas de aceptar colesterol de los macrófagos, lo cual es un paso fundamental en el transporte inverso del colesterol y se convierte en un nuevo biomarcador que refleja la funcionalidad de las partículas de HDL49. En este sentido, los resultados recientes con un potente inhibidor de la CEPT hacen que el TA-8995 se posicione como una de las estrategias más prometedoras de futuro50.
Oligonucleótidos antisentidoEsta clase farmacológica basa su mecanismo de acción en un oligonucleótido antisentido diseñado para unirse a una secuencia específica de bases del ARN mensajero de la apolipoproteína B 10051 e imitar los efectos de una mutación natural. Como resultado, se produce una inhibición en la síntesis hepática de esta apolipoproteína que es crucial en la producción de las LDL y otras lipoproteínas aterogénicas52. Actualmente se investigan 2 de estos fármacos, el mipomersén53,54 y el volanesorsén55,56. Otros proyectos de investigación, como el oligonucleótido antisentido contra Lp (a) y la proteína similar a la angiopoyetina 3 (ISISANGPTL3RX), han completado con éxito los ensayos clínicos de fase I y actualmente se encuentran en fase II57.
Inhibidores de la proteína microsomal de transferencia de triglicéridosEl mecanismo de acción de estos inhibidores se basa en interrumpir la síntesis de lipoproteínas en el intestino y el hígado, lo que conduce a una reducción sustancial del cLDL (50%) y los triglicéridos (65%)58. La Food and Drug Administration (FDA) y la European Medicines Agency (EMA) aprobaron la utilización de la lomitapida para el tratamiento de la hipercolesterolemia homocigótica, y su efecto en la dislipemia aterogénica es prometedor59, aunque con graves efectos secundarios, que incluyen cirrosis60. Se están diseñando fármacos que eviten esta hepatotoxicidad61.
Otras terapias emergentesEl ácido bempedoico es un compuesto novedoso que actúa simultáneamente sobre 2 enzimas hepáticas, la adenosina trifosfato citrato liasa y la adenosina monofosfato-activado proteincinasa, reduce la producción de ácidos grasos e incrementa la oxidación beta de los ácidos grasos saturados, con efectos en el cLDL y la lipoproteína (a)63. Este nuevo grupo terapéutico, de alta eficacia en quienes no toleran las estatinas, tiene la ventaja de administrarse en 1 comprimido oral al día. Otros fármacos novedosos, como los inhibidores de la diaglicerol aciltransferasa, los inhibidores de la enzima acil-CoA colesterol aciltransferasa (avasimiba y eflucimiba), los inhibidores de la escualeno sintetasa, miméticos de la hormona tiroidea, los inhibidores de la fosfolipasa 2, u otros fármacos que aumentan el cHDL por otros mecanismos, se presentan en la tabla 164-67.
Implicación de la Reducción de la Concentración Lipídica en la Progresión/Regresión de la Placa Ateroesclerótica. Métodos de EstudioVistos los numerosos y efectivos fármacos existentes para el tratamiento de la hiperlipemia, y la relación de esta con la ECV ateroesclerótica, es importante conocer no solo la eficacia clínica de estas intervenciones terapéuticas (tratada en otro artículo de este suplemento), sino también su efecto patogénico, en la base del problema, que es el crecimiento, la progresión y la estabilidad de la placa de ateroma. La angiografía coronaria con contraste y el análisis coronario cuantitativo fueron la herramienta original para cuantificar la progresión o la regresión de la ateroesclerosis coronaria. Su uso se basaba en la premisa de que las mediciones seriadas del diámetro luminal mínimo en un segmento dado, teniendo en cuenta el diámetro de referencia adyacente, permitiría cuantificar el grado de progresión o regresión de la ateroesclerosis coronaria, y habitualmente se considera significativas las modificaciones > 0,4 mm en el diámetro luminal mínimo durante el seguimiento68,69. Este método tiene algunas limitaciones, como la frecuente visualización de calidad insuficiente, la necesidad de utilizar siempre la misma proyección porque permite solo una visión bidimensional en estenosis excéntricas, la dependencia de una calibración y medición precisas, la variabilidad intraobservador e interobservadores, y que se considere normal el segmento adyacente, cuando también puede presentar cierto grado de ateroesclerosis y, por lo tanto, no ser válido para cuantificar el grado de enfermedad en la estenosis observada en la angiografía. Sin embargo, la limitación más importante es que solo permite la visualización de la luz coronaria, por lo que subestima el grado de ateroesclerosis coronaria.
La ecografía intracoronaria (EIC) es un catéter que presenta en su porción distal un transductor de ultrasonidos de alta frecuencia y se introduce en la arteria coronaria a través de una guía. Evalúa no solo la luz coronaria, sino también su pared, por lo que permite detectar grados precoces de ateroesclerosis coronaria y cuantificar fenómenos como el remodelado del vaso, por lo que ofrece una información mucho más precisa y fiable que la angiografía70. Por otra parte, permite evaluar el tipo de composición de la placa (fibrosa, calcificada, etc.), la presencia de trombo, la disección y otros hallazgos. La EIC permite cuantificar, en una sección transversal del vaso, su área (delimitada desde el punto de vista práctico por la EEM), el área de la luz y, como resultado de estas 2 mediciones, el área de la placa y el porcentaje de reducción de la luz71. Utilizando programas informáticos, se puede integrar los valores obtenidos en cada uno de los cortes transversales y, por lo tanto, cuantificar el volumen de la placa de ateroma y el porcentaje de volumen de ateroma respecto al volumen del vaso72 con la siguiente fórmula:
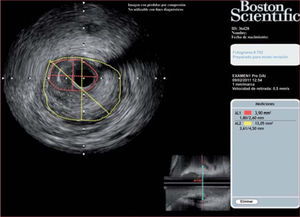
En la figura se muestra una imagen de ecografía intracoronaria en la que se ilustran estos cálculos. Tomar estas medidas mediante EIC en el mismo segmento coronario en momentos diferentes permite evaluar el cambio de volumen de la placa de ateroma y, con ello, su progresión o regresión.
Imagen de ecografía intracoronaria que muestra, en un corte transversal, un área del vaso (línea amarilla) de 13,05 mm2 y un área luminal mínima de 3,9 mm2 (línea roja). Estos datos suponen un área de placa en dicho nivel del 70%. Estos datos de un número determinado de cortes transversales permiten realizar cálculos volumétricos. La diferencia entre estos cálculos en 2 momentos diferentes permite cuantificar la progresión o regresión de la placa de ateroma en un segmento coronario dado.
En cuanto a las potenciales implicaciones clínicas del estudio de la cuantificación de la placa de ateroma, y de su progresión o regresión, se puede pensar que tiene varias limitaciones. En primer lugar, requiere técnicas invasivas. Segundo, los eventos clínicos no solo dependen del grado de progresión de la ateroesclerosis. A pesar de que las estatinas reducen la incidencia de eventos cardiovasculares, el efecto en el volumen de la placa de ateroma no ha estado tan claro, por lo que se ha pensado que el efecto beneficioso de estas reside sobre todo en una estabilización de las placas de ateroma (reducción del núcleo lípidico y aumento de la capa fibrosa), más que en una reducción de su volumen («paradoja angiográfica»). Tercero, aunque el volumen de la placa de ateroma puede ser importante, también puede serlo su composición. La EIC, además de cuantificar el volumen de la placa de ateroma, puede evaluar su composición. Finalmente, muchos fármacos mejoran el pronóstico de los pacientes con cardiopatia isquémica sin que se produzca regresión de la placa de ateroma.
A pesar de estas consideraciones, los estudios de regresión de placa presentan ventajas importantes. Hay que tener en cuenta que actualmente, para demostrar una reducción de eventos clínicos «duros» con nuevos fármacos, se precisa un número de pacientes cada vez mayor y un seguimiento más largo, dado que los pacientes del grupo control (sometidos a un control de los factores de riesgo cardiovascular cada vez mejor) presentan un pronóstico cada vez mejor. La evolución de la gravedad de la placa de ateroma puede ser un parámetro de valoración indirecto y, además, servir de base para la realización de estudios de mayor envergadura con parámetros de valoración clínicos. La EIC mejora mucho la precisión y reduce mucho la variabilidad, y por ello el número de pacientes necesario para objetivar diferencias significativas se reduce en comparación con la angiografia. Asi, la EIC actualmente permite realizar estudios para evaluar la posibilidad de reducción de la ateroesclerosis con diferentes fármacos.
Importancia pronóstica de la placa de ateromaA pesar de los grandes avances en el tratamiento de la enfermedad coronaria, las recidivas después de un evento coronario son frecuentes, y el pronóstico de los pacientes con enfermedad coronaria está relacionado con el grado de gravedad de la ateroesclerosis. En el estudio PROSPECT, se realizó EIC en las arterias coronarias principales de 697 pacientes con síndrome coronario agudo tratados mediante intervencionismo percutáneo73. Las incidencias a 3 anos de eventos relacionados con la lesión culpable inicial, con otra lesión y de origen indeterminado fueron del 12,9, el 11,6 y el 2,7% respectivamente. Es decir, que aproximadamente 1 de cada 8 pacientes sufrió 1 evento no relacionado con la lesión culpable en 3 anos. Los factores asociados con una mayor incidencia de eventos relacionados con lesiones inicialmente no culpables fueron la diabetes en tratamiento con insulina, el intervencionismo previo y 3 caracteristicas derivadas del estudio con EIC: una carga de placa > 70%, un área luminal minima < 4,0 mm2 y fibroateroma de cápsula fina73. En el ATHEROREMO-IVUS, se dio seguimiento clinico durante 1 ano a 581 pacientes con cardiopatia isquémica a los que se realizó EIC de una arteria no culpable. Los 3 hallazgos de la EIC con valor pronóstico en el estudio PROSPECT también se asociaron de manera significativa con una mayor tasa de eventos74. En el estudio SATURN se realizó EIC en situación basal y a los 24 meses a 1.039 pacientes aleatorizados a rosuvastatina o atorvastatina. La incidencia de eventos cardiovasculares a los 2 anos tuvo una clara relación con el porcentaje basal de volumen de la placa de ateroma, de aproximadamente el 6% en los pacientes en el primer cuartil de este parámetro y aproximadamente el 12% en el cuarto cuartil75.
Es decir, los pacientes que tienen mayor carga de ateroesclerosis coronaria presentan peor pronóstico a largo plazo, con mayor incidencia de eventos cardiovasculares. Además de las potenciales implicaciones clínicas de fármacos que puedan reducir la placa de ateroma de pacientes que ya han tenido un evento coronario (prevención secundaria), hay que tener en cuenta que, en general, cuando se manifiesta clínicamente, la enfermedad coronaria ya se encuentra en estadios muy avanzados. Por ello, los potenciales beneficios de la reducción de la placa de ateroma con medidas farmacológicas podrían tener implicaciones en la prevención primaria, es decir, en retrasar la aparición de manifestaciones clínicas en pacientes con factores de riesgo cardiovascular pero todavía asintomáticos.
Influencia de la regresión de la placa en la evolución clínicaTeniendo en cuenta lo anteriormente expuesto, es lógico pensar que los fármacos que consigan frenar e incluso revertir la ateroesclerosis pueden asociarse con una mejora de los parámetros clínicos. En un estudio con solo 86 pacientes sometidos a revascularización coronaria percutánea a los que se realizó EIC en lesiones no culpables en situación basal y a los 6 meses, se realizó un seguimiento clinico posterior hasta 4,8 anos76. Aquellos con progresión de la placa de ateroma presentaron una incidencia de eventos cardiovasculares significativamente superior que los pacientes que habian presentado una regresión de la placa76. En un metanálisis que incluyó 6 estudios aleatorizados (4.137 pacientes) en los que se realizó EIC en situación basal y en el seguimiento, la progresión media del volumen de placa de ateroma fue +0,3% a pesar de que se redujeron de manera significativa las cifras de cLDL (de 100,7 a 89,9 mg/dl), y la incidencia de eventos clínicos fue del 19,9%77. En este estudio, como en otros anteriormente descritos, los pacientes con mayor carga basal de ateroma tuvieron mayor incidencia de eventos cardiovasculares. Además, los pacientes que sufrieron eventos cardiovasculares habian tenido mayor progresión de la placa de ateroma77.
Un estudio que claramente ilustra las implicaciones clínicas de la regresión de la placa de ateroma utilizó, a pesar de sus limitaciones en comparación con la EIC, la angiografía coronaria78. Se realizó coronariografía en situación basal y a los 2 años a 605 pacientes. Definiendo progresión como una disminución ≥ 0,2 mm y regresión como un aumento ≥ 0,2 mm del diámetro luminal mínimo entre ambos estudios angiográficos, hubo regresión en el 8,8% de los pacientes y progresión en el 13,2% (en el 78% no hubo progresión ni regresión). Se realizó un seguimiento a los 8 años, y la mortalidad era del 37,5, el 25,2 y el 8,9% de los pacientes con progresión, sin modificación y con regresión respectivamente (p = 0,0025)78.
Efecto del Tratamiento Hipolipemiante en la Regresión de la Placa de AteromaRegresión de la placa con estatinasLa reducción del cLDL con estatinas se asocia con una reducción en la incidencia de eventos cardiovasculares. El efecto de estos fármacos en la progresión de la ateroesclerosis coronaria, sin embargo, ha tardado más en establecerse y no está aún claro. Con algunas terapias agresivas no farmacológicas, la reducción del cLDL se asoció con un retraso en la evolución de la ateroesclerosis79. Entre los fármacos, las estatinas son las más estudiadas para producir regresión de la ateroesclerosis coronaria. En varios estudios de regresión de ateroma con estatinas, se ha observado que el tratamiento intensivo con estos fármacos es capaz de reducir la progresión de la ateroesclerosis en comparación con las dosis estándar de estos fármacos. La mayor parte de los estudios se han realizado con EIC. No obstante, en el REGRESS80, realizado hace más de 20 años, se utilizó la angiografía en 885 varones aleatorizados a pravastatina o placebo. En ambos grupos, el diámetro luminal mínimo se redujo tras 24 meses, pero esta reducción fue menor en los pacientes asignados a pravastatina. Otros estudios realizados también con angiografía han corroborado que el tratamiento con estatinas disminuye la progresión de la ateroesclerosis81.
Ya con EIC, los estudios se han destinado especialmente a comparar 2 tratamientos hipolipemiantes diferentes, uno más agresivo que otro. En el REVERSAL, el tratamiento intensivo con atorvastatina 80 mg/día en comparación con pravastatina 40 mg/día no solo redujo más las cifras de cLDL, sino que evitó que progresara la ateroesclerosis evaluada mediante EIC (en los pacientes tratados con pravastatina, sin embargo, hubo un aumento del volumen de la placa de ateroma del 2,7% en 18 meses)82. En el SATURN, se comparó la rosuvastatina (40 mg/día) y la atorvastatina (80 mg/día) durante 24 meses en 1.039 pacientes con cardiopatía isquémica estable. Con ambos, se produjo regresión de ateroma en la mayoría de los pacientes (el 69% con rosuvastatina y el 63% con atorvastatina; p = 0,07). La rosuvastatina se asoció con valores de cLDL medios más bajos al final del seguimiento (63 frente a 70 mg/dl con atorvastatina; p < 0,001), pero el parámetro primario de valoración (reducción del porcentaje de volumen de ateroma) no alcanzó diferencias significativas (el -0,99 y el -1,22% con rosuvastatina y atorvastatina respectivamente; p = 0,17). No obstante, la reducción del volumen total de ateroma fue mayor con rosuvastatina (-6,39 frente a -4,42 ц1 con atorvastatina; p = 0,01)83.
No todos los estudios han mostrado que un tratamiento más intensivo con estatinas se asocie con efectos favorables en el volumen de la placa de ateroma. No obstante, en un metanálisis de 8 estudios aleatorizados, con un total de 1.881 pacientes en tratamiento intensivo con estatinas (atorvastatina 80 mg/día o rosuvastatina 40 mg/día), se observó una relación significativa entre el grado de reducción de la concentración de cLDL y el cambio en el volumen de la placa de ateroma y el porcentaje de volumen de placa de ateroma mediante EIC.
Regresión de la placa con los inhibidores de la PCSK9En cualquier caso, en los estudios citados y en los incluidos en el metanálisis, se evaluó cómo actúa sobre la placa de ateroma una reducción de la concentración de cLDL de hasta 60 mg/dl, sin explorar el efecto de reducciones más marcadas. Desde hace poco se cuenta con un nuevo grupo de fármacos (los inhibidores de la PCSK9), más potentes que las estatinas en la reducción del cLDL, que han obtenido cifras de hasta 20-30 mg/dl. De hecho, el grado de reducción del cLDL obtenido con estos fármacos es drástico, y se consigue una reducción adicional del cLDL superior al 50% cuando se combinan con dosis altas de estatinas84,85. Esto ocurre con los 2 fármacos de este grupo disponibles en nuestro medio (evolocumab y alirocumab), pero en el caso concreto del evolocumab, además se ha demostrado (estudio GLAGOV) que esta reducción adicional del cLDL produce regresión de la placa de ateroma86. En el estudio FOURIER, además, se ha demostrado que este fármaco reduce la incidencia de eventos cardiovasculares29.
En cuanto a la regresión de la placa, el estudio GLAGOV se diseñó con la hipótesis de que la reducción del cLDL con una inyección subcutánea mensual de 420 mg de evolocumab podría reducir significativamente el porcentaje de volumen de la placa de ateroma coronario tras un tratamiento de 78 semanas en pacientes que ya se encontraran en tratamiento con estatinas86. Básicamente, los pacientes tenían lesiones coronarias no significativas en la angiografía y cLDL ≥ 80 mg/dl o 60-80 mg/dl en presencia de factores de riesgo adicionales tras un periodo de estabilización y optimización del tratamiento con estatinas durante 4 semanas. A estos pacientes, se les realizó EIC en la angiografía basal y 78 semanas después. Se incluyó a 970 pacientes, y tras el seguimiento los valores de cLDL fueron 93 y 36,6 mg/dl en pacientes asignados a placebo y evolocumab respectivamente (p < 0,001). El parámetro primario de valoración fue el cambio en el porcentaje de volumen de la placa de ateroma, que fue el +0,05% con estatinas y el -0,95% con estatinas y evolocumab (p < 0,001). Por otra parte, el porcentaje de pacientes con regresión de la placa tras el periodo de tratamiento fue superior con evolocumab (el 64,3 frente al 47,3%; p < 0,001). Hay dos aspectos importantes, por una parte, que el grado de reducción del volumen de la placa fue mayor en los pacientes en que mayor reducción de cLDL se consiguió; por otra, que en los pacientes con cLDL basal < 70 mg/dl también se consiguió una reducción significativa del porcentaje de volumen de la placa (el -0,35 y el -1,97% con placebo y evolocumab respectivamente; p < 0,001). Este grupo, por otra parte, también tuvo una mayor proporción de pacientes con regresión de la placa (el 48 y el 81,2% con placebo y evolocumab respectivamente; p < 0,001). El tratamiento con evolocumab no se asoció con una mayor tasa de eventos adversos hepáticos, musculares, neurológicos o del metabolismo hidrocarbonado.
ConclusionesEl tratamiento de los trastornos lipídicos resulta fundamental en la reducción del riesgo vascular de los pacientes con ECV. Cuando la dieta y la actividad física resultan ineficaces en la prevención y el tratamiento de estos trastornos, debe recurrirse a los tratamientos farmacológicos. Los problemas principales de estos tratamientos son la falta de eficacia en reducir los eventos cardiovasculares en algunos de ellos y en otros, los efectos secundarios, las vías de administración o el coste. Actualmente se están desarrollando nuevos fármacos que actuarían en diferentes vías del metabolismo lipídico, por lo que es probable que en los próximos años se asista a un nuevo boom de fármacos hipolipemiantes, similar al vivido con los antidiabéticos orales. La reducción de la concentración de cLDL se ha asociado con un efecto de reducción de la placa, más marcado con los fármacos que más reducen el cLDL, como se ha visto en el estudio GLAGOV con evolocumab. Además de reducir significativamente los eventos clínicos, añadir evolocumab a un tratamiento óptimo con estatinas consigue una reducción adicional de la placa de ateroma coronario. Esto, lógicamente, abre una nueva era en el tratamiento de la cardiopatía isquémica.
FinanciaciónEsta publicación ha sido financiada por Amgen. Las conclusiones, interpretaciones y opiniones expresadas en ella corresponden exclusivamente a sus autores. Amgen declina cualquier responsabilidad sobre el contenido de la misma.
Conflicto de InteresesNinguno.