Recientemente, la miocardiopatía arritmogénica del ventrículo izquierdo (MCAVI) ha sido reconocida como parte del espectro de la miocardiopatía arritmogénica. Se caracteriza por el reemplazo fibroadiposo de la pared de dicho ventrículo. Se describen las formas de presentación clínica más frecuentes, hallazgos de imagen y eventos en el seguimiento, destacando la importancia de la resonancia magnética cardiaca (RMC).
MétodosRegistro prospectivo de pacientes con hallazgos compatibles con MCAVI. Se realizó análisis de imagen de RMC y seguimiento clínico. El objetivo primario fue la aparición de eventos cardiovasculares adversos mayores (MACE) durante el seguimiento, definidos como muerte súbita cardiaca, arritmias ventriculares sostenidas y trasplante cardiaco.
ResultadosSe incluyeron 74 pacientes consecutivos (edad media 48,6 años, 50 varones [67,6%]). Las indicaciones más frecuentes para la RMC fueron dolor torácico con coronariografía normal, arritmias ventriculares y sospecha de miocardiopatías. Los principales hallazgos de RMC fueron: realce tardío meso-subepicárdico (91,9%), infiltración grasa subepicárdica (83,8%) y anomalías segmentarias de la contractilidad del ventrículo izquierdo (47,9%). En un seguimiento medio de 3,74 años, 24 pacientes (32,4%) presentaron un MACE (muerte súbita cardiaca 8,1%, arritmias ventriculares sostenidas 21,6% y trasplante cardiaco 4,1%). La presencia en RMC de realce tardío grave, predice independientemente la aparición de MACE, además del hecho de ser varón y practicar deporte.
ConclusionesLa RMC es una herramienta clave para diagnosticar la MCAVI. La infiltración grasa subepicárdica y el realce tardío meso-subepicárdico son hallazgos característicos. El pronóstico de esta población es pobre con una alta incidencia de muerte súbita cardiaca y arritmias ventriculares.
Palabras clave
La miocardiopatía arritmogénica del ventrículo derecho es una enfermedad hereditaria que se caracteriza por la sustitución progresiva del miocardio por tejido adiposo y fibroso, lo cual predispone al sujeto a taquicardia ventricular y muerte súbita cardiaca (MSC). Fontaine et al.1 fueron los primeros en explicar la miocardiopatía arritmogénica del ventrículo derecho en 1977, y al cabo de 3 años proporcionaron una descripción preliminar de su perfil clínico2. Estos primeros estudios allanaron el camino a otros, que ayudaron a establecer la miocardiopatía arritmogénica del ventrículo derecho como una miocardiopatía que afecta principalmente al ventrículo derecho. La afectación del ventrículo izquierdo (VI) solo se consideró una manifestación tardía y no ha sido hasta hace poco que se han identificado 3 modalidades de la enfermedad: el subtipo clásico, conocido por su predilección por el ventrículo derecho; la variante biventricular, determinada por la afectación paralela de ambos ventrículos, y la miocardiopatía arritmogénica del ventrículo izquierdo (MCAVI), caracterizada por la afectación precoz y mayoritaria del VI. Las 3 categorías muestran parecida distribución por edades, lo que corrobora la premisa de que las modalidades son independientes y coexisten en la población con miocardiopatía arritmogénica del ventrículo derecho3. Así pues, cada vez es más habitual referirse a la enfermedad como miocardiopatía arritmogénica (MCA)2,4.
La MCAVI se caracteriza patológicamente por la sustitución fibroadiposa del VI, que a menudo surge como una banda circunferencial en el tercio externo del miocardio y en el lado derecho del tabique interventricular5. Esta infiltración fibroadiposa predispone a los pacientes a disfunción del VI y arritmias ventriculares potencialmente mortales. Hay pocos datos sobre esta entidad en la literatura médica, solo informes aislados4,6-12 desde que Sen-Chowdhry et al.5 establecieran por primera vez las características diagnósticas clínicas de la MCAVI en 2008. Estas son la inversión no explicada de la onda T en V5, V6±V4, I y aVL en el electrocardiograma (ECG); arritmias tales como la taquicardia ventricular sostenida o no sostenida con morfología de bloqueo de rama derecha, documentada en el ECG o la monitorización de Holter o durante las pruebas de esfuerzo; extrasístoles ventriculares frecuentes (morfología de bloqueo de rama derecha); aneurismas del VI en el estudio de diagnóstico por la imagen, dilatación leve del VI o disfunción sistólica (con síntomas de arritmia); pérdida de miocitos demostrada en la biopsia con sustitución fibroadiposa y resonancia magnética cardiaca (RMC) que muestra realce tardío de gadolinio (RTG) en el VI (con distribución meso-subepicárdica).
Hasta la fecha, la prevalencia observada de MCAVI es baja, aunque es posible que no siempre se identifique. El objetivo de este estudio es describir los cuadros clínicos más frecuentes de la MCAVI, los hallazgos de los estudios de diagnóstico por la imagen y los eventos durante el seguimiento destacando la importancia de la RMC.
MÉTODOSPacientes y diseño del estudioEntre 2014 y 2018, se incluyó prospectivamente a pacientes con hallazgos compatibles con MCAVI según los criterios de Sen-Chowdhry et al.5. También se revisaron retrospectivamente todos los estudios de RMC realizados entre 2010 y 2014 (finalmente se incluyó de manera prospectiva a 51 pacientes y de manera retrospectiva a 23 pacientes con hallazgos compatibles en la RMC que también satisfacían los criterios ya mencionados). Los estudios de cribado realizados en estos pacientes identificaron a familiares con pruebas genéticas positivas. También se incluyó a aquellos con hallazgos en la RMC compatibles con MCAVI o alteraciones en el ECG. Se excluyó a los pacientes con enfermedad coronaria (una vez descartada isquemia inducible o antecedentes de infarto de miocardio).
Se registraron los antecedentes clínicos, personales y familiares. Se remitió a los pacientes a una unidad específica de miocardiopatía, donde se les realizaron ecocardiograma y monitorización Holter de 24 h. Los datos clínicos del seguimiento se revisaron exhaustivamente. Los informes clínicos de los pacientes reingresados en el hospital y las entrevistas clínicas ambulatorias también se revisaron en busca de más información, para validarla en la base de datos del registro. También se analizaron los episodios de arritmia en los pacientes con desfibrilador automático implantable.
El protocolo del estudio fue aprobado por el comité de ética local y todos los pacientes proporcionaron el consentimiento informado por escrito tras ser informados del objetivo del estudio.
Resonancia magnética cardiacaObtención de las imágenesEn todos los estudios de RMC se utilizó un escáner de 1,5 T (Intera CV, Philips Medical Systems, Best, Países Bajos) provisto de una antena cardiaca de 5 elementos. Durante la exploración con ECG de una sola derivación y pulsioximetría, se monitorizó a los pacientes de manera continua. Estos se colocaron en decúbito supino, con la cabeza primero. Todas las imágenes se obtuvieron con sincronización con el ECG y en apnea. Las imágenes morfológicas en planos de eje corto, eje largo de 4 cámaras, eje largo de 2 cámaras y plano de 3 cámaras se obtuvieron utilizando una técnica estándar de precesión libre en estado estacionario. Las imágenes diagnósticas del RTG se realizaron 10 min después de la inyección periférica de un bolo de gadobutrol a 0,1 mmol/kg (Gadovist, Bayer Schering Pharma, Berlín, Alemania) utilizando una secuencia eco de gradiente tridimensional rápida con pulso de inversión-recuperación, que cubría otra vez todo el miocardio en los planos de eje corto, eje largo de 4 cámaras y eje largo de 2 cámaras. El tiempo de inversión se determinó de manera individual hasta la supresión de la señal miocárdica. En los casos en que podía apreciarse el adelgazamiento miocárdico en las imágenes de cine en el eje corto, también se obtuvieron las imágenes de grasa saturada en T1 y las de grasa no saturada en T1 en dicho plano.
Análisis de las imágenesUn radiólogo experto en RMC llevó a cabo el análisis de las imágenes en una estación de trabajo independiente proporcionada por el fabricante (View-Forum release 6.3, Philips Medical Systems). Para analizar el volumen ventricular, se determinó el borde del endocardio al final de la sístole y al final de la diástole en todas las imágenes del eje corto. Los volúmenes telediastólico y telesistólico del VI, el volumen sistólico, la fracción de eyección y el gasto cardiaco se calcularon a partir de una pila de imágenes secuenciales de cine en el eje corto (8-12 cortes contiguos) por segmentación semiautomática. Los volúmenes se indexaron por superficie corporal. Cada segmento del VI se examinó cuidadosamente para determinar la presencia de infiltración adiposa (evaluada visualmente en las imágenes de cine, definida como contorno irregular del epicardio o adelgazamiento del miocardio a expensas del epicardio), RTG o ambos. Los datos se obtuvieron a partir de un diagrama polar de los 17 segmentos miocárdicos. También se evaluó el patrón del RTG (subendocárdico, mesocárdico, subepicárdico o transmural).
Objetivos clínicosEl objetivo primario fue la aparición de eventos adversos cardiovasculares mayores (MACE) durante el seguimiento, tales como MSC, arritmias ventriculares sostenidas y trasplante cardiaco. El objetivo secundario fue el estudio individual de las variables que formaban el objetivo compuesto, así como la tasa de reingreso cardiológco por insuficiencia cardiaca. Cuando el motivo para pedir una RMC eran arritmias ventriculares sostenidas o MSC recuperada, estas situaciones se consideraban eventos tras el diagnóstico de MCAVI.
Análisis estadísticoSe comprobaron las variables continuas para la normalidad utilizando la prueba de Kolmogorov-Smirnov. Las variables con distribución normal se expresan como media±desviación estándar, mientras que las variables no paramétricas se expresan como mediana [intervalo intercuartílico]. Las variables discretas se presentan como frecuencias relativas, que se compararon utilizando la prueba de la χ2 o la prueba de Fisher, según fuera apropiado. Para las variables continuas, se utilizó la prueba de la t de Student.
Las variables identificadas como predictores de MACE en el análisis univariable (cociente de riesgos instantáneos [HR] <0,3) se incluyeron en una regresión de Cox multivariable con un modelo de selección por pasos hacia adelante (pentrada < 0,10; psalida < 0,05) para corregir la colinealidad. Se calcularon la HR ajustada y los intervalos de confianza del 95% (IC95%) para las variables con asociación independiente con los MACE.
Todas las pruebas eran bilaterales, y un valor de p < 0,05 se consideró estadísticamente significativo. Los análisis se realizaron con el software SPSS (versión 15.0, SPSS Inc Chicago, Illinois, Estados Unidos).
RESULTADOSSe incluyó a 74 pacientes consecutivos (media de edad, 48,6 años; varones, 50 [67,6%]). Tenían hipertensión el 20,3% de los pacientes y diabetes mellitus, el 6,8%. Se observaron alteraciones en el ECG (inversión de la onda T en las derivaciones I, aVL, II, III, aVF) en el 47,8% de los pacientes. Las características basales de los participantes se muestran en la tabla 1.
Características iniciales de la población del estudio (n=74)
| Variable | |
|---|---|
| Edad al diagnóstico (años) | 48,6±15,9 |
| Varones | 50 (67,6) |
| Peso (kg) | 79,8±18,2 |
| Estatura (cm) | 170,9±10,8 |
| Índice de superficie corporal (m2) | 1,9±0,2 |
| Hipertensión | 15 (20,3) |
| Diabetes mellitus | 5 (6,8) |
| Antecedentes familiares de MSC de causa desconocida | 19 (31,1) |
| Inversión de la onda T en I, aVL, II, III, aVF | 33 (47,8) |
| Arritmia ventricular documentada de origen biventricular o del VI | 49 (66,2) |
| Familiares con diagnóstico de MCAVI | 20 (28,2) |
MCAVI: miocardiopatía arritmogénica del ventrículo izquierdo; MSC: muerte súbita cardiaca; VI: ventrículo izquierdo.
Los valores expresan n (%) o media±desviación estándar.
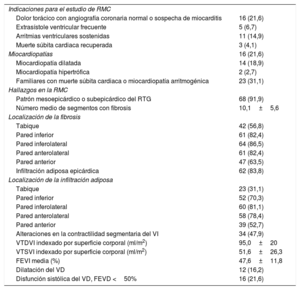
Las indicaciones para realizar estudios de RMC se describen en la tabla 2. Las indicaciones más frecuentes en los pacientes sintomáticos fueron dolor torácico con angiografía coronaria normal, arritmias ventriculares y sospecha de miocardiopatías en el estudio ecocardiográfico. El porcentaje mayor fue el hallado en el grupo de pacientes remitidos a cribado familiar de MCA (31,5%).
Indicaciones para el estudio de RMC y hallazgos en la RMC (n=74)
| Indicaciones para el estudio de RMC | |
| Dolor torácico con angiografía coronaria normal o sospecha de miocarditis | 16 (21,6) |
| Extrasístole ventricular frecuente | 5 (6,7) |
| Arritmias ventriculares sostenidas | 11 (14,9) |
| Muerte súbita cardiaca recuperada | 3 (4,1) |
| Miocardiopatías | 16 (21,6) |
| Miocardiopatía dilatada | 14 (18,9) |
| Miocardiopatía hipertrófica | 2 (2,7) |
| Familiares con muerte súbita cardiaca o miocardiopatía arritmogénica | 23 (31,1) |
| Hallazgos en la RMC | |
| Patrón mesoepicárdico o subepicárdico del RTG | 68 (91,9) |
| Número medio de segmentos con fibrosis | 10,1±5,6 |
| Localización de la fibrosis | |
| Tabique | 42 (56,8) |
| Pared inferior | 61 (82,4) |
| Pared inferolateral | 64 (86,5) |
| Pared anterolateral | 61 (82,4) |
| Pared anterior | 47 (63,5) |
| Infiltración adiposa epicárdica | 62 (83,8) |
| Localización de la infiltración adiposa | |
| Tabique | 23 (31,1) |
| Pared inferior | 52 (70,3) |
| Pared inferolateral | 60 (81,1) |
| Pared anterolateral | 58 (78,4) |
| Pared anterior | 39 (52,7) |
| Alteraciones en la contractilidad segmentaria del VI | 34 (47,9) |
| VTDVI indexado por superficie corporal (ml/m2) | 95,0±20 |
| VTSVI indexado por superficie corporal (ml/m2) | 51,6±26,3 |
| FEVI media (%) | 47,6±11,8 |
| Dilatación del VD | 12 (16,2) |
| Disfunción sistólica del VD, FEVD <50% | 16 (21,6) |
FEVD: fracción de eyección del ventrículo derecho; FEVI: fracción de eyección del ventrículo izquierdo; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio; VD: ventrículo derecho; VI: ventrículo izquierdo; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo.
Los valores expresan n (%) o media±desviación estándar.
Los hallazgos morfológicos más frecuentes de la RMC fueron el patrón mesocárdico o subepicárdico del RTG (91,9%), la infiltración adiposa del epicardio (83,8%) y las alteraciones en la contractilidad segmentaria del VI (47,9%) (tabla 2). La fracción de eyección del VI media era del 47,6±11,8%, y en el 47,3% el VI estaba dilatado (indexado por la superficie corporal). En prácticamente la mitad de los casos, el ecocardiograma previo era normal. Se observó disfunción sistólica del VD (fracción de eyección del VD <50%) en 16 pacientes (21,6%).
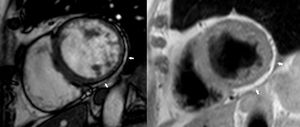
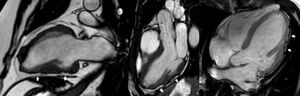
La localización más frecuente de fibrosis era en las paredes inferior e inferolateral (n=64), mientras que la afección del tabique era menos frecuente. La cantidad de fibrosis en el VI se relacionaba claramente con la cantidad de infiltración adiposa. De hecho, ambas presentaban una distribución similar. La infiltración adiposa tenía distinto aspecto en función del plano de obtención: en las proyecciones de cine del eje corto, se representaba como una banda circunferencial subepicárdica de tejido adiposo, normalmente en las paredes inferior y lateral (demostrada después con imágenes ponderadas en T1) (figura 1); en las imágenes de cine de 2, 3 y 4 cámaras, aparecía como irregularidades focales del contorno epicárdico, que denominamos «el signo de la mordedura de la rata» por el parecido a un trozo de queso mordido por este animal (figura 2).
Los pacientes con más segmentos del VI afectados por infiltración adiposa y fibrosis tenían con mayor probabilidad la función del VI reducida, así como mayores volúmenes.
SeguimientoSe dio seguimiento a todos los pacientes durante un periodo medio de 3,74 años; 24 pacientes (32,4%) sufrieron 1 o más eventos mayores durante este periodo: 16, arritmia ventricular sostenida (21,6%); 3, MSC recuperada (4,1%); 3, MSC confirmada (4,1%) y 3, trasplante cardiaco (4,1%) (tabla 3).
Resultados clínicos a largo plazo
| Eventos clínicos (n=74) | n (%) |
|---|---|
| Eventos adversos cardiovasculares mayores | 24 (32,4) |
| Muerte súbita cardiaca | 6 (8,1) |
| Confirmada | 3 (4,1) |
| Recuperada | 3 (4,1) |
| Arritmias ventriculares sostenidas | 16 (21,6) |
| Taquicardia ventricular | 14 (87,5) |
| Ritmo idioventricular acelerado | 2 (12,5) |
| Trasplante cardiaco | 3 (4,1) |
| Implante de desfibrilador automático implantable | 31 (42,5) |
| Arritmias tratadas mediante desfibrilador automático implantable | 11 (14,9) |
| Reingreso por insuficiencia cardiaca | 2 (2,7) |
En 31 pacientes (42,5%) se indicó la colocación de un desfibrilador automático implantable (14 pacientes por taquicardia ventricular sostenida, 6 por disminución de la fracción de eyección del VI, 7 por fibrosis generalizada y confirmación genética de MCAVI, 2 por síncope y 2 por MSC recuperada). En un paciente con MSC recuperada no se colocó desfibrilador automático implantable debido a una encefalopatía postanóxica grave. Durante el seguimiento, se registraron descargas apropiadas mayormente por taquicardia ventricular (n=11; 14,9%): 9 pacientes tuvieron taquicardia ventricular sostenida; 1, fibrilación ventricular y 1, taquicardia ventricular sostenida y fibrilación ventricular.
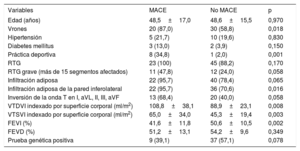
Las características relacionadas con la presencia de eventos durante el seguimiento se muestran en la tabla 4. El sexo masculino, la práctica de deporte (3 de cada 6 MSC ocurridas en la población del estudio tuvieron lugar durante la realización de actividad deportiva) y las alteraciones en el ECG se asociaron de manera significativa con la incidencia de MACE. En cuanto a los hallazgos de la RMC, la presencia de RTG no predijo por sí sola eventos graves, pero se constató un aumento en la tendencia a más eventos en los pacientes con un gran número de segmentos del VI con fibrosis, sobre todo cuando la afección es de más de 15 segmentos. La presencia de infiltración adiposa no se relacionó con los eventos.
Asociaciones entre distintas características y eventos en el seguimiento
| Variables | MACE | No MACE | p |
|---|---|---|---|
| Edad (años) | 48,5±17,0 | 48,6±15,5 | 0,970 |
| Vrones | 20 (87,0) | 30 (58,8) | 0,018 |
| Hipertensión | 5 (21,7) | 10 (19,6) | 0,830 |
| Diabetes mellitus | 3 (13,0) | 2 (3,9) | 0,150 |
| Práctica deportiva | 8 (34,8) | 1 (2,0) | 0,001 |
| RTG | 23 (100) | 45 (88,2) | 0,170 |
| RTG grave (más de 15 segmentos afectados) | 11 (47,8) | 12 (24,0) | 0,058 |
| Infiltración adiposa | 22 (95,7) | 40 (78,4) | 0,065 |
| Infiltración adiposa de la pared inferolateral | 22 (95,7) | 36 (70,6) | 0,016 |
| Inversión de la onda T en I, aVL, II, III, aVF | 13 (68,4) | 20 (40,0) | 0,058 |
| VTDVI indexado por superficie corporal (ml/m2) | 108,8±38,1 | 88,9±23,1 | 0,008 |
| VTSVI indexado por superficie corporal (ml/m2) | 65,0±34,0 | 45,3±19,4 | 0,003 |
| FEVI (%) | 41,6±11,8 | 50,6±10,5 | 0,002 |
| FEVD (%) | 51,2±13,1 | 54,2±9,6 | 0,349 |
| Prueba genética positiva | 9 (39,1) | 37 (57,1) | 0,078 |
FEVD: fracción de eyección del ventrículo derecho; FEVI: fracción de eyección del ventrículo izquierdo; MACE: eventos adversos cardiovasculares mayores; RTG: realce tardío de gadolinio; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo.
Los valores expresan n (%) o media±desviación estándar.
Los predictores de MACE se muestran en la tabla 5. El análisis multivariable demostró que las variables independientes asociadas con los MACE eran el sexo masculino (HR=7,99; IC95%, 1,55-41,32; p=0,013), el RTG grave (más de 15 segmentos afectados) (HR=3,77; IC95%, 1,23-11,44; p=0,019) y la práctica de deporte (HR=6,60; IC95%, 2,08-20,94; p=0,001).
Predictores independientes de MACE. Análisis de regresión de Cox
| Variable | HR | IC95% | p |
|---|---|---|---|
| Sexo masculino | 7,99 | 1,55-41,32 | 0,013 |
| Inversión de la onda en I, aVL, II, III, aVF | 2,06 | 0,28-15,25 | 0,481 |
| Dilatación del VI | 0,40 | 0,10-1,57 | 0,189 |
| Alteraciones en la contractilidad segmentaria del VI | 3,09 | 0,36-26,95 | 0,306 |
| RTG grave (más de 15 segmentos afectados) | 3,77 | 1,23-11,44 | 0,019 |
| Presencia de infiltración adiposa | 0,61 | 0,06-6,47 | 0,682 |
| Práctica deportiva | 6,60 | 2,08-20,94 | 0,001 |
HR: cociente de riesgos instantáneos; IC95%: intervalo de confianza del 95%; MACE: eventos adversos cardiovasculares mayores; RTG: realce tardío de gadolinio; VI: ventrículo izquierdo.
La autopsia realizada en un caso de MSC dio positivo para MCAVI. Mientras se redactaba el presente trabajo, se recibieron los resultados de 45 pruebas genéticas (60,8%): 8 fueron negativas y 37, positivas (82,2%). En el estudio de los probandos, el rendimiento diagnóstico de la prueba genética fue del 72%. Entre las mutaciones destacan las de los genes de la filamina (FLN), la desmogleína (DSG2), la desmoplaquina (DSP) y la titina (TTN) (tabla 6). Algunos pacientes dieron positivo para más de una mutación. El análisis realizado según el resultado de la prueba genética no mostró diferencias en cuanto a la fracción de eyección del VI, el grado de fibrosis o aparición de eventos, y no es predictor independiente de MACE.
Resultados de las pruebas genéticas (n=45)
| Características | n (%) |
|---|---|
| Positivo para mutaciones de MCAVI | 37 (82,2) |
| DSP (desmoplaquina) | 13 (35,1) |
| DSG-2 (desmogleína) | 6 (16,2) |
| FLN (filamina) | 4 (10,8) |
| TTN (titina) | 6 (16,2) |
| PKP2 (placofilina) | 6 (16,2) |
| Otros | 7 (18,9) |
| Negativo | 8 (17,8) |
MCAVI: miocardiopatía arritmogénica del ventrículo izquierdo.
Hasta la fecha, esta es la mayor serie publicada de pacientes con MCAVI diagnosticados mediante RMC. La RMC es una herramienta inestimable para el diagnóstico de esta entidad. Los principales resultados del estudio son los siguientes: primero, se constató presencia de infiltración adiposa subepicárdica en el 83,8% de los casos (mejor observada en las imágenes de cine en las proyecciones de 2, 3 y 4 cámaras como una irregularidad del contorno del epicardio, en un patrón llamado «signo de la mordedura de rata»). Segundo, se observó RTG meso-subepicárdico en el 91,9% de los pacientes, habitualmente afectando a las paredes inferior y lateral y, con frecuencia, extendiéndose hacia las paredes anterior y septal. El pronóstico de esta población era malo con una gran incidencia de MSC y arritmias ventriculares. Por último, se observó una elevada proporción de pruebas genéticas con resultados positivos para MCAVI (el 72% de los probandos).
En 1994, se establecieron los criterios del Grupo de Trabajo sobre miocardiopatía arritmogénica del VD13. Estos se modificaron en 2010 y pasaron a incluir numerosos parámetros estructurales, histopatológicos, electrocardiográficos, hereditarios, arrítmicos y genéticos14. Sin embargo, dichos criterios se obtuvieron de cohortes con disfunción del VD, ya que todavía no se consideraban las modalidades biventricular o dominante izquierda. Esto significa que los criterios podrían ser inapropiados en una proporción considerable de pacientes cuya enfermedad seguía estos patrones distintos.
En 2008, Sen-Chowdhry et al.5 establecieron las características para el diagnóstico clínico de la MCAVI. Desde entonces, solo se han publicado unos pocos informes en los que se describen casos aislados4,6-11 o algunas mutaciones genéticas asociadas con la entidad12,15-17.
En la serie retrospectiva de pacientes con muerte súbita debida a MCA de Miles et al.18, el 70% de los pacientes mostraban afección biventricular en la autopsia, y en ninguno de ellos se habrían satisfecho los criterios del Grupo de Trabajo. Así pues, las variantes del VI de la miocardiopatía arritmogénica pueden eludir la detección clínica con las herramientas diagnósticas actuales. Esto es algo que debería resolverse en futuras revisiones de los criterios del Grupo de Trabajo. Además, en esta misma serie, a más de la mitad de los fallecidos con diagnóstico de miocardiopatía en vida se les había identificado una miocardiopatía dilatada, aunque en la autopsia mostraban características patológicas de MCA. La superposición entre miocardiopatía dilatada y MCA puede presentar varios retos diagnósticos, sobre todo si la única técnica de diagnóstico por la imagen disponible es la ecocardiografía. Así pues, la RMC es de suma importancia en el diagnóstico de esta entidad, ya que permite detectar la infiltración adiposa y la fibrosis.
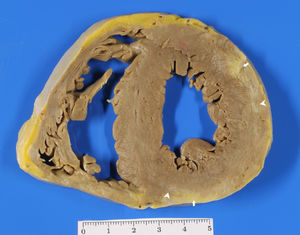
En la serie en estudio se observó infiltración adiposa en el 83,8% de los pacientes y RTG en el 91,9%. La fibrosis, con mayor presencia en la pared inferolateral, podría indicar el inicio de la enfermedad en estos segmentos miocárdicos. Se identificó un nuevo signo, llamado «mordedura de rata», que aún no se ha descrito en la literatura médica. La infiltración adiposa subepicárdica característica observada en muestras macroscópicas de pacientes con MCAVI (figura 3) está bien representada en las imágenes de cine de la RMC como una irregularidad del contorno epicárdico que recuerda un queso mordido. Esta característica se relaciona siempre con el RTG (figura 4), que representa la infiltración adiposa y es muy específico de esta entidad. Este signo puede ser muy útil para diagnosticar a los pacientes con MCAVI. Los pacientes con la modalidad biventricular de la enfermedad muestran signos parecidos.
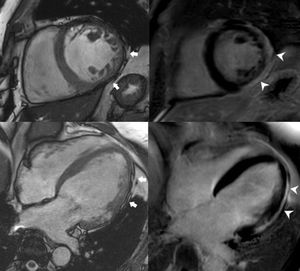
Imagen de cine en eje corto (cuadrante superior izquierdo) que muestra adelgazamiento miocárdico en las paredes inferior y lateral (flechas) e imagen correspondiente del RTG (cuadrante superior derecho) en la que puede demostrarse la presencia de fibrosis subepicárdica (puntas de flecha) en la misma localización. Asimismo, en las imágenes inferiores se evidencian en la imagen de cine en plano de 4 cámaras (cuadrante inferior izquierdo) irregularidades en el contorno epicárdico en la pared lateral (flechas) y fibrosis en la misma localización (puntas de flecha) en la imagen correspondiente del RTG (cuadrante inferior derecho). RTG: realce tardío de gadolinio.
El cuadro clínico de la MCAVI es heterogéneo y su diagnóstico puede ser complicado. En la serie en estudio, las principales indicaciones para realizar un estudio de RMC fueron las arritmias ventriculares sostenidas, el dolor torácico con angiografía coronaria normal o sospecha de miocarditis y la miocardiopatía dilatada. Hace unos 10 años, eran suficientes signos como el dolor torácico con arterias coronarias normales y una ligera elevación de la troponina. Si había mínimos antecedentes de infección (p. ej., gastroenteritis o un resfriado), se diagnosticaba miocarditis a los pacientes y no se indicaba ningún otro análisis ni seguimiento. A los pacientes con un ecocardiograma normal que por lo demás estaban asintomáticos se les daba de alta. Recientemente, la guía sobre infarto de miocardio sin ateroesclerosis coronaria obstructiva ha arrojado algo de luz en el enfoque de los pacientes con dolor torácico, elevación de troponinas y un angiograma coronario normal19. Actualmente, en el área de estudio (que incluye 1 hospital terciario y 5 hospitales secundarios), los pacientes con dolor torácico y arterias coronarias normales suelen someterse a estudio de RMC, bien en el momento del ingreso o poco después del alta. Muchos pacientes reciben un diagnóstico final de infarto con arterias coronarias normales, miocarditis o, con menor frecuencia (aunque no por ello menos importante), con MCA.
Consideramos de suma importancia mostrar el impacto pronóstico de esta enfermedad. La miocardiopatía arritmogénica del VD tiene un mal pronóstico a medio plazo, con alta incidencia de eventos graves20, pero hasta entonces se desconocía el pronóstico de la MCAVI. Con un seguimiento medio de 3,74 años, 24 pacientes (32,4%) sufrieron un MACE (MSC, el 8,1%; arritmias ventriculares sostenidas, el 21,6% y trasplante cardiaco, el 4,1%).
Así pues, una nueva contribución de este informe es una lista de predictores pronósticos que podrían ser muy útiles en el seguimiento clínico de estos pacientes. Un estudio de RMC que muestra RTG grave (más de 15 segmentos afectados) (HRa=3,77) y otros factores clínicos como el sexo masculino (HRa=7,99) y la práctica de deporte (HRa=6,60) son predictores independientes de la aparición de MACE.
Otro aspecto que destacar es la relevancia del estudio genético. En la serie en estudio, el 72% de los estudios genéticos realizados en probandos fueron positivos para las mutaciones relacionadas con esta entidad, lo que sirve para confirmar el diagnóstico sospechado y establecer la base para el cribado familiar. Los familiares con mutaciones positivas pueden someterse a un seguimiento más riguroso y recibir consejos conductuales como, por ejemplo, evitar el deporte, incluso en ausencia de hallazgos estructurales, con el objetivo de enlentecer la aparición de la enfermedad.
La evolución natural de la afectación del VI en la MCA es poco conocida. Ha habido series que mostraban la ausencia de relación entre la afección del VI y la edad en el momento del deceso. Además, el aspecto macroscópico del corazón en la autopsia corrobora los estudios de diagnóstico por la imagen que indican que la afección del VI puede tener lugar en una fase temprana18. Así pues, convendría ser prudentes con los familiares de los pacientes con MCA con pruebas de imagen negativas pero con mutaciones genéticas positivas. En la serie en estudio, se halló a 2 familiares de pacientes con MCA cuya corta edad podría explicar la ausencia de hallazgos estructurales. En el caso de estos pacientes, consideramos obligado el seguimiento para monitorizar su evolución y, si fuera necesario, ofrecerles el tratamiento apropiado.
Otra cuestión crucial es la comunicación directa entre el experto en RMC y el médico, que va más allá de la interconsulta aislada sobre los hallazgos de las imágenes. Hay que investigar más a fondo otros criterios diagnósticos y pedir pruebas genéticas cuando sea necesario. Es necesario que haya sinergia entre el médico que analiza las imágenes y el profesional sanitario que trata al paciente para una intervención temprana y un correcto cribado de los miembros de la familia. Esta simbiosis, basada en un buen conocimiento de los hallazgos radiológicos y otros parámetros clínicos (antecedentes familiares, personales, clínicos y del seguimiento), también evita la sobredetección potencialmente errónea.
LimitacionesLa MCA con afección predominante del VI es una entidad menos extendida y conocida9,21, sin criterios diagnósticos definidos, por lo que no hay ensayos clínicos o metanálisis específicos de esta enfermedad. Dado que el hospital donde se realiza el estudio es un centro de referencia en estudios de RMC para varias unidades de miocardiopatía especializadas, la serie del estudio es relativamente grande. Por otro lado, un único radiólogo experto ve todos los casos, de modo que no existe variabilidad entre observadores. No obstante, en términos absolutos, el número sigue siendo pequeño, lo que impide extraer conclusiones definitivas.
Debería mencionarse que la naturaleza ambispectiva de este estudio puede aumentar el rendimiento diagnóstico de la RMC mediante la inclusión de pacientes retrospectivos con hallazgos compatibles con la enfermedad estudiada.
Otra limitación podría ser que las pruebas genéticas no se realizaron a todos los pacientes, por decisión de los médicos remisores, ni el cribado a todos los familiares. Esto podría conllevar un riesgo de sesgo en la información, y los familiares quedarían sin diagnosticar.
Por último, tal como ya se ha mencionado, algunos familiares son cribados con pruebas de diagnóstico por la imagen (principalmente RMC) a edades muy tempranas. En estos pacientes, un resultado negativo no descarta necesariamente la enfermedad, que podría ser demasiado prematura para producir hallazgos estructurales en las imágenes.
Aun así, creemos que la serie en estudio destaca la importancia de pensar en esta enfermedad, prestando atención a los hallazgos de los estudios de RMC y llevando a cabo el cribado familiar apropiado para orientar a estos pacientes por el mejor camino posible tanto diagnóstico como terapéutico.
CONCLUSIONESLa RMC es una herramienta clave para diagnosticar la MCAVI: infiltración adiposa subepicárdica en aproximadamente el 83,8% de los pacientes y RTG meso-subepicárdico en aproximadamente el 91,9%, que habitualmente afecta a las paredes inferior y lateral. El pronóstico de esta población es malo, con elevada incidencia de MSC y arritmias ventriculares. La presencia de una prueba genética positiva en pacientes con MCAVI diagnosticados con RMC es muy alta (72%).
Una contribución de este estudio es la identificación de un hallazgo característico en las imágenes —contorno epicárdico irregular observado en las imágenes de cine de la RMC, llamado aquí «signo de mordedura de rata»— que se describe por primera vez. Las revisiones de los criterios diagnósticos de la MCA podrían considerarla una de las características de las imágenes incluidas.
- –
La MCAVI es una de las 3 modalidades de presentación de la miocardiopatía arritmogénica. Consiste en la sustitución fibroadiposa de la pared del VI, lo que predispone a los pacientes a alteración del VI, arritmias y, posiblemente, MSC. Algunas características clínicas ya se han descrito, pero se desconocen los principales hallazgos de los estudios de RMC.
- –
La ausencia de registros médicos de los pacientes con esta enfermedad impide conocer el pronóstico de esta entidad, así como la existencia de posibles predictores de eventos.
- –
Hasta la fecha, esta es la mayor serie publicada de pacientes con MCAVI diagnosticados con RMC. La RMC es una herramienta inestimable para el diagnóstico de esta entidad.
- –
Los principales hallazgos de la RMC fueron la presencia de infiltración adiposa subepicárdica (83,8%) y el RTG meso-subepicárdico (91,9%). El estudio también contribuyó a una nueva característica de la RMC, no descrita con anterioridad, que se considera muy típica de esta entidad: el signo de mordedura de rata, que es la representación visual de la infiltración adiposa subepicárdica en la pared del VI.
- –
También cabe subrayar la importancia de la RMC en el diagnóstico de esta enfermedad, los diversos tipos de cuadro clínico, los predictores de eventos y su mal pronóstico.
Ninguno.