Siguen sin estudio la eficacia y la seguridad del ticagrelor frente al prasugrel en pacientes con síndrome coronario agudo (SCA) según el índice de masa corporal (IMC). Se evaluaron la eficacia y la seguridad del ticagrelor frente a prasugrel en pacientes con SCA según el IMC.
MétodosSe agrupó a los pacientes (n=3.987) en 3 categorías: con peso normal (IMC <25; n=1.084), sobrepeso (IMC ≥ 25 <30; n=1.890) y obesidad (IMC ≥ 30; n=1.013). El objetivo primario de eficacia fue la incidencia de muerte por cualquier causa, infarto de miocardio o accidente cerebrovascular a 1 año. El objetivo secundario de seguridad fue la incidencia de hemorragias de tipo 3-5 de la Bleeding Academic Research Consortium a 1 año.
ResultadosEl objetivo primario se produjo en 63 pacientes asignados a ticagrelor y 39 asignados a prasugrel en el grupo de peso normal (el 11,7 frente al 7,5%; HR=1,62; IC95%, 1,09-2,42; p=0,018), 78 pacientes asignados a ticagrelor y 58 asignados a prasugrel en el grupo de sobrepeso (el 8,3 frente al 6,2%; HR=1,36; IC95%, 0,97-1,91; p=0,076) y 43 pacientes asignados a ticagrelor y 37 asignados a prasugrel en el grupo de obesidad (el 8,6 frente al 7,3%; HR=1,18; IC95%, 0,76-1,84; p=0,451). La incidencia de eventos hemorrágicos a 1 año en los pacientes con peso normal (el 6,5 frente al 6,6%; p=0,990), sobrepeso (el 5,6 frente al 5,0%; p=0,566) u obesidad (el 4,4 frente al 2,8%; p=0,219) no difirió entre el ticagrelor y el prasugrel. No hubo una interacción significativa entre el brazo de tratamiento y el IMC en relación con el objetivo primario (pinteracción=0,578) o el secundario (pinteracción=0,596).
ConclusionesEn pacientes con SCA, el IMC no influyó significativamente en el efecto del tratamiento con ticagrelor en términos de eficacia o seguridad frente al prasugrel.
Palabras clave
La obesidad es un importante factor de riesgo de enfermedades cardiovasculares1. Los pacientes obesos y con sobrepeso corren mayor riesgo de un síndrome coronario agudo (SCA)2, y varios estudios3–7 han demostrado que la mayoría de los pacientes que se someten a una intervención coronaria percutánea (ICP) tienen sobrepeso o son obesos. El tratamiento antiagregante plaquetario doble con un inhibidor del receptor P2Y12 y ácido acetilsalicílico es la piedra angular del tratamiento de los pacientes con SCA sometidos a ICP. Estudios previos indican que el índice de masa corporal (IMC) puede afectar a la respuesta a los inhibidores del receptor plaquetario P2Y12, principalmente al clopidogrel, pues se ha observado mayor reactividad plaquetaria durante el tratamiento en pacientes con sobrepeso y obesidad8–14. Los pacientes con sobrepeso necesitarían una mayor dosis de carga de clopidogrel para inhibir adecuadamente la agregación plaquetaria15,16, y se ha identificado un IMC >30 como un factor independiente predictor de la respuesta alterada al clopidogrel17. Los ensayos clínicos aleatorizados han demostrado la superioridad del prasugrel18 y el ticagrelor19 sobre el clopidogrel en la reducción del riesgo de eventos isquémicos en pacientes con SCA con un tratamiento invasivo. Estos ensayos han demostrado que la eficacia clínica y la seguridad del prasugrel y el ticagrelor pueden ser diferentes según el IMC de los pacientes con SCA en comparación con el clopidogrel. Sin embargo, debido a la falta de estudios comparativos directos, sigue sin conocerse el impacto del IMC en la eficacia y la seguridad del ticagrelor frente al prasugrel en pacientes con SCA con un tratamiento invasivo. El ensayo ISAR-REACT (Intracoronary Stenting and Antithrombotic Regimen: Rapid Early Action for Coronary Treatment) 5 comparó la eficacia y la seguridad del ticagrelor frente al prasugrel en pacientes con SCA que estaban programados para un tratamiento invasivo20. A continuación se presentan los resultados de este análisis post hoc que compara la eficacia y la seguridad del ticagrelor frente al prasugrel según el IMC.
MÉTODOSDiseño y población del estudioEste estudio es un análisis post hoc del ensayo ISAR-REACT 5 e incluye a todos los pacientes con datos de IMC disponibles. El diseño y los resultados del ensayo ISAR-REACT 5 se han comunicado con anterioridad20,21. Los pacientes eran aptos para la inclusión en el ensayo si estaban hospitalizados por un SCA (infarto de miocardio con elevación del segmento ST [IAMCEST], infarto de miocardio sin elevación del segmento ST [IAMSEST] o angina inestable) y estaban programados para tratamiento invasivo. Se aleatorizó a los pacientes a ticagrelor o prasugrel en proporción 1:1. Se trata de un estudio abierto en el que los pacientes del grupo de ticagrelor recibieron una dosis de carga de 180mg lo antes posible después de la aleatorización y continuaron con una dosis de mantenimiento de 90mg 2 veces al día. Los pacientes del grupo de prasugrel recibieron una dosis de carga de 60mg (inmediatamente después de la aleatorización los pacientes con IAMCEST y tras conocerse los resultados de la coronariografía —es decir, tras ella— pero antes de la ICP los pacientes con IAMSEST o angina inestable) y continuaron con una dosis de mantenimiento de 10mg/día. Para pacientes de 75 años o mayores y aquellos con un peso < 60kg, se recomendó una dosis de mantenimiento reducida de 5mg de prasugrel22. Todos los pacientes recibieron una dosis de carga de 150 a 300mg de ácido acetilsalicílico intravenosa o masticable, y luego una dosis de mantenimiento de 75 a 100mg 1 vez al día. Se obtuvo el consentimiento informado de todos los pacientes. El protocolo del estudio fue aprobado por el comité de ética local de cada centro participante. El estudio se ajustó a la Declaración de Helsinki.
Definiciones y objetivosEl IMC se calculó como el cociente entre el peso en kilogramos y el cuadrado de la estatura en metros medidos durante la estancia hospitalaria. Se dispuso de datos de IMC de 3.987 de los 4.018 pacientes del ensayo ISAR-REACT 5. El IMC osciló entre 14,0 y 55,0. Se clasificó a los pacientes en grupos según las categorías de IMC: pacientes con IMC <25 (grupo de peso normal), de ≥ 25 a <30 (grupo con sobrepeso) y ≥ 30 (grupo de obesidad). De los 1.084 pacientes del grupo de peso normal, 27 (el 2,5% del grupo con IMC <25) tenían un IMC <18,5.
El objetivo primario del estudio (eficacia) fue la incidencia a 12 meses de muerte por cualquier causa, infarto de miocardio o accidente cerebrovascular. El objetivo secundario (seguridad) fue la incidencia a 12 meses de hemorragia de tipo 3-5 del Bleeding Academic Research Consortium (BARC)23. El infarto de miocardio se definió según la Third Universal Definition of Myocardial Infarction24. La trombosis del stent y la muerte cardiovascular se definieron según los criterios del Academic Research Consortium (ARC)25. En el se ofrecen definiciones detalladas. Todos los resultados evaluados en el ensayo primario20 se incluyeron en este análisis. Todos los resultados primarios y secundarios se validaron de manera centralizada y enmascarada por miembros del comité de validación de eventos.
SeguimientoEl seguimiento se programó al mes, a los 6 meses y al año. En caso de posibles eventos adversos relacionados con el criterio de valoración, se solicitaron los datos originales. Todos los eventos adversos graves, como los resultados analizados en este estudio, se controlaron in situ. Se hizo un seguimiento de los pacientes mediante visitas al hospital, visitas ambulatorias o por teléfono y cartas de seguimiento.
Análisis estadísticosEste estudio es un análisis post hoc del ensayo ISAR-REACT 5. Las variables continuas se presentan como media ± desviación estándar o mediana [intervalo intercuartílico] y se compararon mediante la prueba de la t de Student o la prueba de suma de rangos de Wilcoxon, según la distribución de la variable. Los datos cualitativos se presentan como recuentos y proporciones, y se compararon mediante la prueba de la χ2. El objetivo primario y la muerte por cualquier causa se presentan como incidencias acumuladas y se calcularon mediante el método de Kaplan-Meier26,27. El resto de los objetivos se presentan como incidencias acumuladas después de tener en cuenta el riesgo competitivo de muerte. El análisis del riesgo competitivo se utiliza cuando hay un evento (en nuestro estudio, la muerte) cuya aparición excluye la del evento primario de interés28. La comparación entre los grupos se hizo mediante el modelo de riesgos proporcionales de Cox con el centro y la estratificación según la presentación clínica (SCA con elevación del segmento ST o sin elevación del segmento ST) introducidas en el modelo como covariables junto con el fármaco en estudio. La asociación del fármaco en estudio y la categoría del IMC con los objetivos primario y secundario se ajustó ante posibles factores de confusión utilizando el modelo de riesgos proporcionales de Cox. Se introdujeron en el modelo las siguientes variables: fármaco en estudio, edad, sexo, diabetes mellitus, tabaquismo, hipertensión, hipercolesterolemia, antecedentes de infarto de miocardio, antecedentes de ICP, antecedentes de cirugía de revascularización coronaria, shock cardiogénico, frecuencia cardiaca, creatinina sérica al ingreso, diagnóstico al ingreso, tipo de tratamiento (conservador o ICP), prasugrel 5mg e interacción entre rama de tratamiento e IMC. Para evaluar la interacción entre grupo de tratamiento e IMC en función de los objetivos del estudio, se introdujo un término de interacción en el modelo de riesgos proporcionales de Cox. Las estimaciones de riesgo se presentan como hazard ratio (HR) y sus intervalos de confianza del 95% (IC95%). El objetivo primario (eficacia) se analizó de acuerdo con el principio de intención de tratar (es decir, todos los pacientes asignados inicialmente cualquiera que fuera el tratamiento recibido en realidad). El objetivo secundario (seguridad) se analizó en una población por intención de tratar modificado (mITT) (es decir, todos los pacientes con al menos 1 toma del fármaco en estudio con hemorragia evaluada hasta 7 días después de la interrupción de dicho fármaco). El análisis estadístico se hizo con el paquete estadístico R 3.6.0 (The R Foundation for Statistical Computing, Austria). Un valor de p <0,05 bilateral se consideró que indicaba significación estadística.
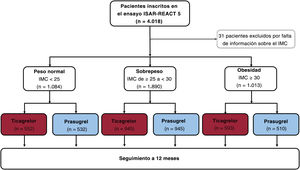
RESULTADOSDatos basales y de resultados según las categorías de IMCEl diagrama de flujo del estudio se muestra en la figura 1. Se conocían los datos del IMC de 3.987 pacientes: 1.084 con peso normal, 1.890 con sobrepeso y 1.013 con obesidad. Los datos basales se muestran en la . Los pacientes con obesidad eran más jóvenes, menos propensos a ser fumadores y más propensos a presentar diabetes, hipertensión, hipercolesterolemia o ICP previa. El shock cardiogénico fue menos frecuente y las concentraciones séricas de creatinina fueron mayores en los pacientes con obesidad. Hubo pocas diferencias entre las categorías del IMC en el número de coronariografías realizadas y la estrategia de tratamiento. Los datos angiográficos y de procedimiento se muestran en las . El tratamiento farmacológico al alta se muestra en la . De los 27 pacientes con un IMC < 18,5, 22 recibieron el alta con ticagrelor y 5, con prasugrel. De estos últimos, 4 pacientes recibieron el alta con una dosis de prasugrel reducida (5 mg). De los pacientes con peso normal, sobrepeso y obesidad, el objetivo primario se encontró en 102 (9,6%), 136 (7,3%) y 80 (8,0%) respectivamente (pacientes con sobrepeso frente a pacientes con peso normal, HR=0,77; IC95%, 0,59-0,99; p=0,047; pacientes con obesidad frente a pacientes con peso normal, HR = 0,84; IC95%, 0,62-1,13; p=0,240) (). El objetivo secundario (hemorragia tipo 3-5 BARC) se encontró en 79 (7,4%), 104 (5,6%) y 41 (4,1%) pacientes respectivamente (pacientes con sobrepeso frente a pacientes con peso normal, HR = 0,72; IC95%, 0,54-0,97; p=0,031; pacientes con obesidad frente a pacientes con peso normal, HR = 0,52; IC95%, 0,36-0,77; p=0,0008) ().
Datos basales según los fármacos en estudio y las categorías de IMCLos datos basales de los pacientes asignados a ticagrelor o prasugrel en cada categoría de IMC se muestran en la tabla 1. En el grupo con peso normal, la proporción de pacientes con hipertensión e ICP previa fue considerablemente mayor entre los pacientes asignados a ticagrelor. En el grupo con sobrepeso, las características basales estaban bien equilibradas entre los 2 grupos de tratamiento. En el grupo con obesidad, los pacientes asignados a ticagrelor eran más jóvenes que los asignados a prasugrel. En el resto de variables hubo pocas diferencias entre los pacientes asignados a ticagrelor y prasugrel en todas las categorías de IMC.
Características basales
| Característica | Peso normal(IMC < 25)(n=1.084) | Sobrepeso(IMC de ≥ 25 a <30)(n=1.890) | Obesidad(IMC ≥ 30)(n=1.013) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Ticagrelor(n=552) | Prasugrel(n=532) | p | Ticagrelor(n=945) | Prasugrel(n=945) | p | Ticagrelor(n=503) | Prasugrel(n=510) | p | |
| Edad (años) | 67,4±11,8 | 66,4±12,2 | 0,165 | 64,5±11,8 | 64,5±11,7 | 0,961 | 61,3±11,9 | 62,8±12,2 | 0,043 |
| Sexo | 0,504 | 0,313 | 0,787 | ||||||
| Mujeres | 189 (34,2) | 171 (32,1) | 165 (17,5) | 183 (19,4) | 122 (24,3) | 119 (23,3) | |||
| Varones | 363 (65,8) | 361 (67,9) | 780 (82,5) | 762 (80,6) | 381 (75,7) | 391 (76,7) | |||
| Diabetes | 88 (15,9) | 74/531 (13,9) | 0,401 | 189 (20,0) | 189 (20,0) | > 0,999 | 182/502 (36,3) | 160 (31,4) | 0,115 |
| Tratados con insulina | 25 (4,5) | 24/531 (4,5) | > 0,999 | 60 (6,4) | 55 (5,8) | 0,700 | 58/502(11,6) | 56 (11,0) | 0,850 |
| Tabaquismo | 190/548 (34,7) | 207/529 (39,1) | 0,146 | 325/942 (34,5) | 297/942 (31,5) | 0,186 | 163/500 (32,6) | 157/509 (30,8) | 0,595 |
| Hipertensión | 375/551 (68,1) | 324/531 (61,0) | 0,018 | 654/944 (69,3) | 638/943 (67,7) | 0,478 | 397/501 (79,2) | 407 (79,8) | 0,886 |
| Hipercolesterolemia | 314/550(57,1) | 277/530 (52,3) | 0,126 | 528/944 (55,9) | 541/944 (57,3) | 0,577 | 326/501 (65,1) | 334 (65,5) | 0,941 |
| Infarto de miocardio previo | 85/551(15,4) | 72/532(13,5) | 0,425 | 146 /944 (15,5) | 153/944 (16,2) | 0,705 | 79 (15,7) | 92 (18,0) | 0,364 |
| ICP previa | 117/551 (21,2) | 84/531(15,8) | 0,027 | 213 (22,5) | 234/944 (24,8) | 0,273 | 122 (24,3) | 141 (27,6) | 0,246 |
| Cirugía de revascularización coronaria previa | 28/551 (5,1) | 26/531 (4,9) | > 0,999 | 53 (5,6) | 66 (7,0) | 0,256 | 33 (6,6) | 34 (6,7) | > 0,999 |
| Shock cardiogénico | 10 (1,8) | 16 (3,0) | 0,277 | 16 (1,7) | 14 (1,5) | 0,854 | 5 (1,0) | 3 (0,6) | 0,503 |
| Presión arterial sistólica (mmHg) | 143±24,4 | 142±24,5 | 0,498 | 143±24,8 | 142±24,0 | 0,473 | 146±25,8 | 145±25,1 | 0,698 |
| Presión arterial diastólica (mmHg) | 80,7±14,6 | 81,2±13,5 | 0,555 | 81,8±14,1 | 81,9±13,9 | 0,845 | 83,8±15,3 | 82,1±14,2 | 0,072 |
| Frecuencia cardiaca (lpm) | 77,1±16,4 | 76,8±16,9 | 0,762 | 76,4±15,9 | 75,0±15,0 | 0,056 | 78,1±15,4 | 77,1±14,9 | 0,297 |
| Índice de masa corporal | 23,5[22,0-24,4] | 23,5[22,0-24,4] | 0,914 | 27,3[26,1-28,4] | 27,3[26,1-28,4] | 0,479 | 32,8[31,1-35,5] | 32,7[31,1-35,5] | 0,852 |
| Peso <60 kg | 107 (19,4) | 91 (17,1) | 0,372 | 1 (0,1) | 3 (0,3) | 0,625 | 0 | 0 | |
| Creatinina (μmol/l) | 83,6±23,6 | 85,0±33,9 | 0,418 | 89,5±28,4 | 88,1±28,0 | 0,254 | 88,9±29,0 | 91,6±30,7 | 0,153 |
| Diagnóstico al ingreso | 0,547 | 0,498 | 0,252 | ||||||
| Angina inestable | 71 (12,9) | 57 (10,7) | 114 (12,1) | 124 (13,1) | 64 (12,7) | 80 (15,7) | |||
| IAMSEST | 245 (44,4) | 243 (45,7) | 437 (46,2) | 451 (47,7) | 242 (48,1) | 223 (43,7) | |||
| IAMCEST | 236 (42,7) | 232 (43,6) | 394 (41,7) | 370 (39,2) | 197 (39,2) | 207 (40,6) | |||
| Coronariografía | 548 (99,3) | 531 (99,8) | 0,374 | 942 (99,7) | 943 (99,8) | > 0,999 | 501 (99,6) | 508 (99,6) | >0.999 |
| Estrategia de tratamiento | 0,475 | 0,091 | 0.506 | ||||||
| ICP | 453 (82,2) | 451 (84,8) | 791 (84,0) | 819 (86,7) | 421 (83,7) | 412 (80,9) | |||
| Cirugía de revascularización coronaria | 10 (1,8) | 10 (1,9) | 26 (2,7) | 14 (1,5) | 11 (2,2) | 12 (2,4) | |||
| Conservador | 88 (16,0) | 71 (13,3) | 125 (13,3) | 112 (11,9) | 71 (14,1) | 85 (16,7) | |||
ICP: intervención coronaria percutánea; IMC: índice de masa corporal; IAMCEST: infarto de miocardio con elevación del segmento ST; IAMSEST: infarto de miocardio sin elevación del segmento ST.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
Datos continuos faltantes:
Grupo de pacientes con peso normal (IMC <25): presión arterial diastólica, 1 paciente del grupo de ticagrelor y 3 del de prasugrel.
Grupo de pacientes con sobrepeso (IMC de ≥ 25 a <30): presión arterial sistólica, 2 pacientes (1 de cada grupo); presión arterial diastólica, 7 pacientes (5 del grupo de ticagrelor y 2 del de prasugrel).
Grupo de pacientes con obesidad (IMC ≥ 30): presión arterial sistólica, 1 paciente del grupo de prasugrel; presión arterial diastólica, 3 pacientes (1 del grupo de ticagrelor y 2 del de prasugrel). El resto de los datos continuos estaban completos.
Los datos angiográficos se muestran en la . No hubo diferencias entre los pacientes en relación con el acceso vascular, el número de arterias coronarias con lesiones significativas o la fracción de eyección del ventrículo izquierdo según los fármacos en estudio en los grupos de pacientes con peso normal, sobrepeso u obesidad. Las características del procedimiento se muestran en la . El tratamiento farmacológico al alta se presenta en la . Los pacientes asignados a prasugrel de los grupos de peso normal y sobrepeso recibieron más a menudo el alta con ácido acetilsalicílico (p=0,023) y clopidogrel (p=0,049) respectivamente.
Resultados clínicosLos resultados clínicos según los fármacos en estudio en todas las categorías de IMC se presentan en la tabla 2. En el grupo de pacientes con peso normal, el objetivo primario del estudio se presentó en 63 pacientes (11,7%) en el grupo de ticagrelor y en 39 (7,5%) en el de prasugrel (HR = 1,62; IC95%, 1,09-2,42; p=0,018) (figura 2A). En el grupo de pacientes con sobrepeso, el objetivo primario del estudio se presentó en 78 pacientes (8,3%) del grupo de ticagrelor y 58 (6,2%) del de prasugrel (HR = 1,36; IC95%, 0,97-1,91; p=0,076) (figura 2B). En el grupo de pacientes con obesidad, dicho objetivo se encontró en 43 (8,6%) del grupo de ticagrelor y 37 (7,3%) del de prasugrel (HR = 1,18; IC95%, 0,76-1,84; p=0,451) (figura 2C). No hubo interacción del grupo de tratamiento por IMC respecto al objetivo primario del estudio (p de la interacción=0,578). No hubo diferencias significativas respecto a la incidencia de muerte entre ticagrelor y prasugrel en las categorías del IMC. En el grupo de pacientes con peso normal, la incidencia de infarto de miocardio y trombosis del stent definida o probable fue mayor en los pacientes asignados a ticagrelor (el 5,9 frente al 2,5%; HR = 2,43; IC95%, 1,27-4,63; p=0,007) que en los asignados a prasugrel (el 2,0 frente al 0,4%; HR = 5,22; IC95%, 1,15-23,62; p=0,032). En el grupo de pacientes con sobrepeso, la incidencia de infarto de miocardio y trombosis del stent definida o probable en el grupo de ticagrelor fue del 3,3 frente al 2,9% (HR = 1,18; IC95%, 0,71-1,99; p=0,520) y en el de prasugrel, el 1,1 frente al 1,4% (HR = 0,79; IC95%, 0,34-1,79; p=0,567). En el grupo de pacientes con obesidad, la incidencia de infarto de miocardio y trombosis del stent definida o probable fue del 6,6 frente al 4,0% (HR = 1,68; IC95%, 0,96-2,93; p=0,067) en el grupo de ticagrelor y del 1,0 frente al 1,0% (HR = 1,01; IC95%, 0,29-3,48; p=0,991) en el de prasugrel.
Resultados clínicos
| Resultado | Peso normal(IMC <25)(n=1.084) | Sobrepeso(IMC de ≥ 25 a <30)(n=1.890) | [0,10-13] Obesidad(IMC ≥ 30 kg/m2)(n=1.013) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ticagrelor(n=552) | Prasugrel(n=532) | HR(IC95%) | p | Ticagrelor(n=945) | Prasugrel(n=945) | HR(IC95%) | p | Ticagrelor(n=503) | Prasugrel(n=510) | HR(IC95%) | p | |
| Objetivo primario (muerte, infarto de miocardio o accidente cerebrovascular) | 63 (11,7) | 39 (7,5) | 1,62(1,09-2,42) | 0,018 | 78 (8,3) | 58 (6,2) | 1,36(0,97-1,91) | 0,076 | 43 (8,6) | 37 (7,3) | 1,18(0,76-1,84) | 0,451 |
| Muerte | 34 (6,3) | 28 (5,3) | 1,22(0,74-2,02) | 0,429 | 42 (4,5) | 26 (2,8) | 1,59(0,97-2,59) | 0,065 | 14 (2,8) | 16 (3,2) | 0,89(0,44-1,83) | 0,760 |
| Cardiovascular | 24 | 23 | 27 | 21 | 12 | 13 | ||||||
| No cardiovascular | 10 | 5 | 15 | 5 | 2 | 3 | ||||||
| Infarto de miocardio | 32 (5,9) | 13 (2,5) | 2,43(1,27-4,63) | 0,007 | 31 (3,3) | 27 (2,9) | 1,18(0,71-1,99) | 0,520 | 33 (6,6) | 20 (4,0) | 1,68(0,96-2,93) | 0,067 |
| Tipo 1 | 16 | 7 | 12 | 16 | 24 | 12 | ||||||
| Tipo 2 | 1 | 2 | 1 | 1 | 2 | 0 | ||||||
| Tipo 4a | 6 | 2 | 10 | 4 | 3 | 5 | ||||||
| Tipo 4b | 8 | 2 | 8 | 6 | 4 | 3 | ||||||
| Tipo 5 | 1 | 0 | 0 | 0 | 0 | 0 | ||||||
| IAMCEST | 13 | 3 | 10 | 5 | 8 | 6 | ||||||
| Accidente cerebrovascular | 8 (1,5) | 4 (0,8) | 1,92(0,58-6,39) | 0,287 | 13 (1,4) | 10 (1,1) | 1,32(0,58-3,01) | 0,514 | 1 (0,2) | 5 (1,0) | 0,21(0,02-1,77) | 0,151 |
| Isquémico | 6 | 3 | 9 | 10 | 1 | 4 | ||||||
| Hemorrágico | 2 | 1 | 4 | 0 | 0 | 1 | ||||||
| Trombosis del stent definida o probable | 11 (2,0) | 2 (0,4) | 5,22(1,15-23,62) | 0,032 | 10 (1,1) | 13 (1,4) | 0,79(0,34-1,79) | 0,567 | 5 (1,0) | 5 (1,0) | 1,01(0,29-3,48) | 0,991 |
| Trombosis del stent definida | 9 (1,7) | 2 (0,4) | 4,17(0,89-19,37) | 0,069 | 8 (0,8) | 7 (0,7) | 1,18(0,43-3,27) | 0,746 | 5 (1,0) | 3 (0,6) | 1,71(0,41-7,16) | 0,464 |
| Hemorragia tipo 3-5 BARC* | 30/541 (6,5) | 29/472(6,6) | 1,00(0,60-1,67) | 0,990 | 45/935 (5,6) | 39/849 (5,0) | 1,13(0,74-1,74) | 0,566 | 19/501(4,4) | 11/434 (2,8) | 1,59(0,76-3,35) | 0,219 |
| 3a | 14 | 10 | 21 | 25 | 12 | 6 | ||||||
| 3b | 11 | 16 | 14 | 9 | 6 | 5 | ||||||
| 3c | 1 | 0 | 3 | 2 | 0 | 0 | ||||||
| 4 | 3 | 0 | 4 | 2 | 1 | 0 | ||||||
| 5a | 0 | 0 | 1 | 0 | 0 | 0 | ||||||
| 5b | 1 | 3 | 2 | 1 | 0 | 0 | ||||||
Los valores son números de eventos con estimaciones de Kaplan-Meier (%) del objetivo primario y muerte o incidencia acumulada (%) después de tener en cuenta el riesgo competitivo de muerte en los objetivos restantes.
BARC: Bleeding Academic Research Consortium; HR: hazard ratio; IAMCEST: infarto de miocardio con elevación del segmento ST; IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal.
Incidencia acumulada del objetivo primario (incidencia a 1 año de muerte, infarto de miocardio o accidente cerebrovascular) en lo grupos de ticagrelor y prasugrel. A: pacientes con peso normal. B: pacientes con sobrepeso. C: pacientes con obesidad. BARC: Bleeding Academic Research Consortium; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Los eventos hemorrágicos se muestran en la tabla 2. En el grupo de pacientes con peso normal, se produjo hemorragia tipo 3-5 BARC en 30 pacientes asignados a ticagrelor y 29 asignados a prasugrel (la incidencia acumulada representa el riesgo competitivo del 6,5 y el 6,6% respectivamente; HR = 1,00; IC95%, 0,60-1,67; p=0,990). En el grupo de pacientes con sobrepeso, se encontró hemorragia tipo 3-5 BARC en 45 pacientes asignados a ticagrelor y 39 asignados a prasugrel (la incidencia acumulada representa el riesgo competitivo del 5,6 y el 5,0% respectivamente; HR = 1,13; IC95%, 0,74-1,74; p=0,566). En el grupo de pacientes con obesidad se encontró hemorragia tipo 3-5 BARC en 19 pacientes del grupo de ticagrelor y 11 del grupo de prasugrel (la incidencia acumulada representa el riesgo competitivo del 4,4 y el 2,8%; HR = 1,59; IC95%, 0,76-3,35; p=0,219). Las curvas del tiempo transcurrido hasta el evento se muestran en la figura 3. No hubo interacción del grupo de tratamiento por IMC respecto al objetivo secundario (p de la interacción=0,596).
Incidencia acumulada del objetivo secundario (incidencia a 1 año de hemorragia tipo 3-5 del Bleeding Academic Research Consortium) teniendo en cuenta el riesgo competitivo de muerte en los grupos de ticagrelor y prasugrel. A: pacientes con peso normal. B: pacientes con sobrepeso. C: pacientes con obesidad. BARC: Bleeding Academic Research Consortium; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Para abordar un posible impacto de los pacientes con bajo peso (IMC < 18,5; n=27; el 2,5% del grupo con IMC <25), se hizo un análisis de sensibilidad excluyéndolos del grupo con peso normal (IMC <25). Entre los pacientes con IMC entre 18,5 y 25 (n=1.057), los objetivos primario y secundario se encontraron en 99 (9,5%) y 76 (7,3%) respectivamente. El objetivo primario se encontró en 60/532 pacientes asignados a ticagrelor y 39/525 asignados a prasugrel (el 11,5 frente al 7,6%; HR = 1,58; IC95%, 1,06-2,37; p=0,026). El objetivo secundario (hemorragia tipo 3-5 BARC) se encontró en 28/521 pacientes asignados a ticagrelor y 29/466 pacientes asignados a prasugrel (el 6,5 frente al 6,6%; HR = 0,96; IC95%, 0,57-1,61; p=0,877). Por lo tanto, en este análisis parece que la exclusión de pacientes con IMC <18,5 no tiene impacto alguno en la frecuencia de eventos adversos o en la eficacia y la seguridad del ticagrelor frente al prasugrel en pacientes con un IMC <25.
La asociación del fármaco del estudio y la categoría del IMC con los resultados principales y secundarios se ajustó por posibles factores de confusión mediante el modelo de regresión de riesgos proporcionales de Cox multivariable (consulte los métodos respecto a las variables introducidas en el modelo). Después del ajuste por posibles factores de confusión, el ticagrelor se asoció de manera independiente con el objetivo primario del estudio (HR ajustada = 1,52, IC95%, 1,13-2,04), pero no con el secundario (HR ajustada = 1,01; IC95%, 0,71-1,37). La categoría del IMC no se asoció con el objetivo primario (sobrepeso frente a peso normal, HR ajustada = 0,88; IC95%, 0,67-1,14; p=0,331; obesidad frente a peso normal, HR=1,07 [0,78-1,46]; p=0,696); sin embargo, parece que sí con el secundario (sobrepeso frente a peso normal, HR = 0,87; IC95%, 0,64-1,18; p=0,365; obesidad frente a peso normal, HR = 0,64; IC95%, 0,43-0,96; p=0,031).
DISCUSIÓNLos principales resultados de este estudio se pueden resumir de la siguiente manera: a) en pacientes con SCA, el IMC no afecta al efecto del ticagrelor frente al prasugrel por lo que respecta a la eficacia o la seguridad. El beneficio del prasugrel sobre el del ticagrelor en la reducción de la incidencia a 1 año del objetivo combinado de muerte, infarto de miocardio o accidente cerebrovascular fue uniforme en todas las categorías del IMC, aunque con diferentes estimaciones de riesgo. Las diferencias en el objetivo primario del estudio entre el ticagrelor y el prasugrel se debieron, sobre todo, a diferencias en la incidencia de infarto de miocardio, y b) parece que el riesgo de hemorragia es similar entre ticagrelor y prasugrel en todas las categorías del IMC, aunque es posible que este análisis post hoc no tenga la suficiente potencia estadística para determinar las diferencias en la seguridad.
Hasta ahora no se ha estudiado el impacto del IMC en la eficacia y la seguridad del ticagrelor frente al prasugrel en pacientes con SCA. Por lo tanto, el objetivo primario de este estudio es comparar la eficacia y la seguridad del ticagrelor frente al prasugrel en función de las categorías del IMC de estos pacientes. Los ensayos aleatorizados han ofrecido alguna evidencia de que la eficacia y la seguridad de prasugrel y ticagrelor pueden diferir según el peso corporal o el IMC en pacientes con SCA tratados con una ICP. En el Trial to Assess Improvement in Therapeutic Outcomes by Optimizing Platelet Inhibition with Prasugrel—Thrombolysis in Myocardial Infarction (TRITON-TIMI) 38, no se observó ningún beneficio clínico neto del prasugrel en comparación con el clopidogrel en pacientes con peso corporal <60kg18. Por lo tanto, se recomendó una dosis de mantenimiento reducida de 5mg de prasugrel para los pacientes con peso corporal <60kg18. En el ensayo PLATelet inhibition and patient Outcomes (PLATO), el beneficio de ticagrelor en reducción de eventos isquémicos se atenuó en los pacientes que tenían un peso inferior a la mediana en ambos sexos (p de interacción=0,04), mientras que en los pacientes con peso ≥80kg, el beneficio del ticagrelor frente al clopidogrel fue concordante con los resultados generales del estudio19. Sin embargo, en el ensayo PLATO, el riesgo de hemorragia fue mayor con ticagrelor que con clopidogrel en los pacientes con un IMC ≥3019. Debido a la falta de una comparación directa, las diferencias en las características basales de los pacientes tratados con prasugrel o ticagrelor y diferentes parámetros (peso corporal o IMC) estudiados en los 2 ensayos, sigue sin respuesta la cuestión de si el prasugrel y el ticagrelor son diferentes en eficacia y seguridad según el IMC de los pacientes con SCA tratados con ICP.
Nuestro estudio no encontró una interacción significativa entre el grupo de tratamiento por IMC y el objetivo primario, y el beneficio del prasugrel sobre el ticagrelor en la reducción del objetivo primario concordó con los resultados generales del ensayo. Sin embargo, parece que el beneficio del prasugrel es algo más evidente en pacientes con peso normal. Aunque siguen sin estar claras las razones exactas de este hallazgo, algunos estudios han señalado que la respuesta al prasugrel y el ticagrelor puede ser diferente en función de los índices de tamaño corporal o el IMC. Un estudio farmacodinámico de Jakubowski et al.12 mostró una relación inversa coherente entre el peso corporal y la respuesta al clopidogrel y el prasugrel, lo que indica que la respuesta al tratamiento con prasugrel o clopidogrel es mayor en pacientes con menor peso corporal. Otros estudios han demostrado que el IMC tiene un fuerte impacto en la respuesta al clopidogrel y el prasugrel, con una mayor incidencia de reactividad plaquetaria aumentada durante el tratamiento en los pacientes obesos después del implante de un stent coronario9,10,29. Estos estudios indican claramente que en los pacientes con bajo peso corporal la respuesta al prasugrel se conserva o incluso mejora.
Los datos sobre el impacto del IMC en la respuesta al ticagrelor son escasos y controvertidos. Un metanálisis previo de Alexopoulos et al.13 mostró una mayor reactividad plaquetaria con un aumento del IMC en pacientes con una dosis de mantenimiento de ticagrelor. Por el contrario, Deharo et al.9 apuntan que el IMC no influye en el grado de inhibición plaquetaria por ticagrelor. Un reciente análisis de subgrupos del ensayo GLOBAL LEADERS mostró que, en general, el IMC no influye en el efecto del tratamiento con ticagrelor en monoterapia30. Sin embargo, en pacientes con SCA, se observaron efectos beneficiosos de la monoterapia con ticagrelor por lo que respecta a la reducción del objetivo primario (incidencia a 2 años de muerte o nuevo infarto de miocardio con onda Q) en pacientes con IMC <27 (pinteracción = 0,047)30. Contrariamente a estos hallazgos, el ensayo PLATO mostró una atenuación de la eficacia del ticagrelor en comparación con el clopidogrel en pacientes con SCA y peso corporal por debajo del valor medio19. Por último, teniendo en cuenta un estudio previo que mostró resultados comparables en pacientes diabéticos asignados a ticagrelor o prasugrel31, quizá la mayor proporción de pacientes con diabetes en los grupos de sobrepeso/obesidad puede haber contribuido a los hallazgos del análisis actual. En total, aunque existen algunas explicaciones de por qué el beneficio del prasugrel sobre el ticagrelor en la reducción del riesgo isquémico puede ser algo más evidente en el grupo de pacientes con peso normal, pero menos evidente en los grupos de sobrepeso y obesidad, falta una explicación clara a estos hallazgos y se necesitan más estudios para desentrañar los mecanismos subyacentes. Además de la reducción de los eventos isquémicos en general, la importante reducción de la incidencia de infarto de miocardio y trombosis del stent probable o definida por prasugrel en pacientes con peso normal puede indicar, además, que el prasugrel ofrece una protección antiisquémica/antitrombótica más fuerte a los pacientes con SCA después de ICP en esta categoría del IMC en comparación con el ticagrelor.
El presente estudio muestra que el ticagrelor y el prasugrel se asocian con un riesgo hemorrágico semejante en todas las categorías del IMC. La evidencia sobre el perfil de seguridad (riesgo de hemorragia) del ticagrelor frente al prasugrel en diferentes categorías del IMC de pacientes con SCA después de ICP continúa siendo escasa, indirecta (principalmente obtenida de la comparación del clopidogrel con cualquiera de los fármacos) y controvertida18,19. En el ensayo TRITON-TIMI 38, los pacientes que pesaban menos de 60kg no obtuvieron ningún beneficio neto del prasugrel debido al elevado riesgo de hemorragia grave en este grupo18. En cambio, el ensayo PLATO comunicó el 21% de más riesgo hemorrágico con el ticagrelor que con el clopidogrel en pacientes con IMC ≥30 en comparación con un IMC <30 (pinteracción = 0,05)19. Nuestro estudio, que realizó una comparación directa entre el ticagrelor y el prasugrel en todas las categorías del IMC, no encontró diferencias significativas en el riesgo hemorrágico. En este sentido, nuestros datos son alentadores e importantes, teniendo en cuenta que la hemorragia ha recibido recientemente una atención considerable y se ha definido como un objetivo primario en los ensayos de estrategias de disminución gradual de antiagregantes plaquetarios.
LimitacionesNuestro estudio también presenta algunas limitaciones. Se trata de un análisis post hoc de un ensayo aleatorizado. Como tal, conlleva las limitaciones inherentes a este tipo de análisis. La clasificación de los pacientes en grupos según el IMC redujo la potencia del estudio para detectar diferencias en la eficacia y la seguridad del ticagrelor frente al prasugrel en las categorías del IMC. En el grupo de pacientes con peso normal, el 2,5% de ellos tenían un IMC <18,5. El análisis de sensibilidad mostró que la exclusión de pacientes con IMC <18,5 del grupo de peso normal casi no tuvo impacto (el 0,1% de diferencia) en la presentación de los objetivos primario y secundario o en la eficacia o la seguridad del ticagrelor frente al prasugrel. Sin embargo, estos datos no invalidan el impacto de la insuficiencia ponderal en la aparición de eventos adversos o la eficacia y la seguridad del ticagrelor frente al prasugrel en pacientes con SCA; simplemente muestran que la proporción de pacientes con bajo peso era demasiado pequeña para causar un impacto general en la presentación de eventos en el estudio actual. Además, la mayor reducción observada de eventos isquémicos con el prasugrel en comparación con ticagrelor en pacientes con peso normal puede ser el resultado de una probabilidad amplificada por numerosas pruebas32. Dado que la aleatorización no se realizó según el IMC, no se puede descartar por completo un posible impacto de factores de confusión ocultos a pesar de los ajustes por una serie de variables clínicas y demográficas en el análisis multivariante. Aunque el efecto del ticagrelor frente al prasugrel fue direccionalmente uniforme, el estudio no tuvo la suficiente potencia estadística para evaluar la heterogeneidad del efecto del tratamiento en todas las categorías del IMC. Por último, aunque todos los eventos adversos se validaron principalmente con enmascaramiento, el estudio fue abierto. Por estas razones, los resultados del estudio deben considerarse prospectivos o generadores de hipótesis.
CONCLUSIONESEn pacientes con SCA, el IMC no tuvo ningún impacto significativo en el efecto del ticagrelor frente al prasugrel en eficacia o seguridad. El beneficio del prasugrel sobre el ticagrelor en la reducción de la incidencia a 1 año del objetivo combinado de muerte, infarto de miocardio o accidente cerebrovascular fue uniforme en todas las categorías del IMC, aunque con estimaciones de riesgo diferentes. Parece que el riesgo de hemorragia es semejante entre el ticagrelor y el prasugrel en todas las categorías del IMC, aunque nuestro análisis podría no tener la suficiente potencia estadística para evaluar las diferencias en seguridad.
FINANCIACIÓNEste estudio contó con una subvención (FKZ 81X1600501) del German Center for Cardiovascular Research y el Deutsches Herzzentrum München, Alemania. Las instituciones patrocinadoras de este estudio no intervinieron en su diseño, la recogida, el análisis y la interpretación de los datos o la redacción del artículo.
CONTRIBUCIÓN DE LOS AUTORESConceptualización, metodología y financiación: A. Kastrati, S. Schüpke. Metodología: G. Ndrepepa, D.J. Angiolillo, S. Schüpke, A. Kastrati. Validación: S. Lahu, G. Ndrepepa, K. Mayer. Análisis formal: A. Kastrati. Recursos: F.-J. Neumann, D. Sibbing, I. Bernlochner, M. Menichelli, G. Richardt, S. Gewalt, J.J. Coughlan, A. Aytekin, B. Witzenbichler, W. Hochholzer, S. Cassese, S. Kufner, E. Xhepa, H.B. Sager, M. Joner, M. Fusaro, K.-L. Laugwitz, H. Schunkert e I. Akin. Redacción-primer borrador: S. Lahu. Redacción, revisión y edición: M. Behnes, G. Ndrepepa, F.-J. Neumann, D. Sibbing, I. Bernlochner, M. Menichelli, K. Mayer, G. Richardt, S. Gewalt, D.J. Angiolillo, J.J. Coughlan, A. Aytekin, B. Witzenbichler, W. Hochholzer, S. Cassese, S. Kufner, E. Xhepa, H.B. Sager, M. Joner, M. Fusaro, K.-L. Laugwitz, H. Schunkert, S. Schüpke, A. Kastrati, I. Akin. Visualización: S. Lahu y G. Ndrepepa. Supervisión: F.-J. Neumann, D. Sibbing, I. Bernlochner, M. Menichelli, K. Mayer, G. Richardt, B. Witzenbichler, K.-L. Laugwitz, H. Schunkert, S. Schüpke, A. Kastrati e I. Akin. Administración del proyecto: M. Behnes, F.-J. Neumann, D. Sibbing, I. Bernlochner, M. Menichelli, K. Mayer, G. Richardt, B. Witzenbichler, K.-L. Laugwitz, H. Schunkert, S. Schüpke, A. Kastrati e I. Akin. Aprobación final de la versión para ser publicada: todos los autores. Acuerdo de declaración de responsabilidad de todos los aspectos del trabajo: todos los autores. Todos los autores cumplen los criterios de autoría definidos por el Comité Internacional de Editores de Revistas Médicas.
CONFLICTO DE INTERESESF.-J. Neumann ha recibido honorarios por conferencias, pagados a su institución, de Amgen, Daiichi-Sankyo, Novartis y Ferrer; ha recibido honorarios por conferencias, pagados a su institución, y honorarios por asesoría, pagados a su institución, de AstraZeneca y Boehringer Ingelheim; ha recibido subvenciones y honorarios por conferencias, pagados a su institución, de Pfizer, Biotronic, Edwards Lifesciences, Bayer HealthCare y GlaxoSmithKline, y ha recibido subvenciones de Medtronic, Abbott Vascular y Boston Scientific. D. Sibbing ha recibido honorarios personales de Daiichi Sankyo, Sanofi y AstraZeneca, Bayer, Pfizer y Servier. I. Bernlochner ha recibido honorarios por conferencias de Sysmex Europe GmbH. D. Angiolillo ha recibido un pago individual por: a) honorarios de asesoría u honorarios de Abbott, Amgen, Aralez, AstraZeneca, Bayer, Biosensors, Boehringer Ingelheim, Bristol-Myers Squibb, Chiesi, Daiichi-Sankyo, Eli Lilly, Haemonetics, Janssen, Merck, PhaseBio, PLx Pharma, Pfizer, Sanofi y The Medicines Company, y b) participación en actividades de revisión de CeloNova y St Jude Medical; pagos institucionales de subvenciones de Amgen, AstraZeneca, Bayer, Biosensors, CeloNova, CSL Behring, Daiichi-Sankyo, Eisai, Eli Lilly, Gilead, Idorsia, Janssen, Matsutani Chemical Industry Co, Merck, Novartis, Osprey Medical, Renal Guard Solutions y Fundación Scott R. MacKenzie. W. Hochholzer ha recibido honorarios por asesoría de Daiichi-Sankyo, The Medicines Company; ha recibido honorarios por conferencias de Bayer Vital, Boehringer, Bristol-Myers Squibb y AstraZeneca. S. Kufner notifica honorarios personales de Bristol-Myers-Squibb, AstraZeneca y Translumina. H.B. Sager ha recibido financiación del Consejo Europeo de Investigación en el marco del Programa de Investigación e Innovación Horizonte 2020 de la Unión Europea (STRATO), la Fundación Else Kröner-Fresenius y Deutsche Forschungsgemeinschaft. M. Joner ha recibido honorarios personales de Abbott, Biotronik, Orbus Neich, Boston Scientific, Edwards, AstraZeneca, Schockwave y Recor; y ha recibido subvenciones de Boston Scientific, Edwards, Cardiac Dimensions, InfraRedx y Amgen. H. Schunkert ha recibido honorarios personales de Merck Sharp & Dohme, Amgen, Bayer Vital GmbH, Boehringer Ingelheim, Daiichi-Sankyo, Novartis, Servier, Brahms, Bristol-Myers Squibb, Medtronic, Sanofi, Synlab; y ha recibido subvenciones y honorarios personales de AstraZeneca. S. Schüpke ha recibido la subvención Else Kröner-Memorial de la Fundación Else Kröner-Fresenius, apoyo financiero del German Center for Cardiovascular Research (DZHK) y honorarios por asesoría de Bayer Vital GmbH y honorarios por conferencias de Daiichi-Sankyo y Biopas Laboratories. I. Akin ha recibido honorarios por conferencias de Boston Scientific, Boehringer, Daiichi-Sankyo, Gore. Todos los demás autores han notificado que no tienen ninguna relación relevante con el contenido de este documento que declarar.
- –
Los pacientes con SCA, sobrepeso y obesidad tienen mayor riesgo de eventos isquémicos que los pacientes con peso normal.
- –
El IMC influye en la respuesta a los inhibidores del receptor plaquetario P2Y12.
- –
Los pacientes con sobrepeso y obesidad a menudo responden mal a los antiagregantes plaquetarios (principalmente al clopidogrel) y pueden beneficiarse de estrategias de inhibición plaquetaria más potentes.
- –
Se desconoce la eficacia y la seguridad del ticagrelor frente al prasugrel en pacientes con SCA en función del IMC.
- –
En pacientes con SCA, el IMC no tuvo ningún impacto significativo en el efecto del ticagrelor frente al prasugrel por lo que respecta a la eficacia o la seguridad.
- –
El beneficio del prasugrel sobre el ticagrelor en la reducción de la incidencia a 1 año del objetivo combinado de muerte, infarto de miocardio o accidente cerebrovascular fue uniforme en todas las categorías del IMC, aunque con estimaciones de riesgo diferentes.
- –
El riesgo de hemorragia fue semejante entre ticagrelor y prasugrel en todas las categorías del IMC.
- –
El IMC no puede utilizarse para orientar la selección entre prasugrel y ticagrelor para pacientes con SCA tratados con una estrategia invasiva.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2021.11.006.