Las infecciones en dispositivos de electroestimulación cardiaca son cada vez más frecuentes debido a las indicaciones cada vez más amplias de estos sistemas. Algunos aspectos sobre su tratamiento son controvertidos y aportamos aquí nuestra amplia experiencia.
MétodosSe atendieron 325 infecciones (196 locales y 129 sistémicas) durante los años 1985 a 2015, el 28,5% de ellas procedentes de otros centros: 229 marcapasos, 69 desfibriladores automáticos implantables y 27 pacientes con terapia de resincronización cardiaca, con un seguimiento mínimo de 1 año tras el alta hospitalaria.
ResultadosLa tracción percutánea (TPC) fue la técnica utilizada más frecuentemente (n=280), en infecciones tanto locales (n=166) como sistémicas (n=114), con una tasas de extracción completa del sistema del 82,5% del total y de curación, del 89%; las complicaciones fueron escasas (2 muertes achacables a la técnica). La mortalidad total fue del 1% en infecciones locales y el 8% en las sistémicas. Tras 212 TPC completas, se reimplantó un nuevo sistema contralateral en 209: en 152 de ellas en el mismo acto (73%) y en 57 en un segundo tiempo; no se apreciaron diferencias en el número de recidivas en el nuevo sistema (2 en 1 tiempo y 1 en 2 tiempos).
ConclusionesLa TPC en manos expertas arroja buenos resultados en términos de eficacia, con escasas complicaciones. Se puede realizar el reimplante de dispositivos en un solo tiempo sin que ello conlleve un mayor riesgo de recidiva.
Palabras clave
En 1954 se realizaron los primeros implantes de marcapasos permanentes y en 1980, los primeros desfibriladores automáticos implantables. El uso de estos dispositivos de electroestimulación cardiaca (DEC) se ha incrementado de manera exponencial en los últimos años 10 años debido a las mejoras tecnológicas, la ampliación de sus indicaciones y la mayor expectativa de vida de la población receptora1–3. Este incremento se ha acompañado de un aumento, hasta cierto punto inesperado, de las complicaciones infecciosas en ellos4. El tratamiento de estas complicaciones no es fácil y aunque existen guías al respecto5,6, ciertos aspectos relacionados con el diagnóstico y, sobre todo, el tratamiento son aún objeto de debate. El objetivo de este trabajo es describir nuestra amplia experiencia en el tratamiento de estas infecciones, en el que se analiza fundamentalmente el rendimiento de los diversos abordajes terapéuticos empleados.
MÉTODOSPoblación y periodo de estudioPacientes con infecciones de DEC atendidos consecutivamente entre 1985 y 2015 en nuestro centro. De 1985 a 1998, los casos procedían de las consultas realizadas al servicio de enfermedades infecciosas. En 1999 se implementó un programa de intervención específico para estas infecciones desarrollado por un equipo multidisciplinario. En caso de sospecha de infección del DEC, los pacientes (del propio hospital o enviados de otros centros) eran evaluados por 1 miembro del equipo (A. de Alarcón González) para determinar el tipo de infección y la prioridad de actuación. Los datos se recogían de manera prospectiva y sistemática según un protocolo previamente establecido.
Recogida de muestras microbiológicas y ecocardiografíaEn todos los pacientes se realizaron 2 tandas de hemocultivos seriados (basal, a los 30 y a los 60 min) separadas 12 h. Si presentaban signos locales se obtenía muestra del exudado y, en caso de que no hubiera supuración externa, mediante punción-aspiración con aguja de la bolsa del generador, para tinción de Gram y cultivo de aerobios y anaerobios. Durante la cirugía se tomaban muestras de la bolsa y de los 4 cm distales de los cables, se procesaba parte para cultivo y se guardaba otra a –20°C. En caso de que los cultivos fueran negativos, a partir 2005 el material se procesaba también con técnicas genómicas de identificación: reacción en cadena de la polimerasa (PCR) RNAr16s. Si había sospecha clínica de infección sistémica y/o los hemocultivos eran positivos, se realizaba una ecografía cardiaca (desde 1999, siempre en modo transesofágico).
DefinicionesSegún la localización, las infecciones se clasificaron en:
- •
Infección local: se consideró que una infección era local cuando el paciente no presentaba síntomas sistémicos (fiebre, shock, embolias o complicación infecciosa a distancia), los hemocultivos eran negativos y había signos a nivel de la bolsa del generador: dolor, eritema y colección purulenta.
- •
Infección sistémica: se consideró que una infección era sistémica si el paciente presentaba síntomas sistémicos y los hemocultivos eran repetidamente positivos. En caso de que los hemocultivos fueran negativos, se exigía la demostración de vegetaciones en el cable o estructuras valvulares derechas.
Según el tiempo de aparición, las infecciones se clasificaron en: a) agudas: las que aparecían antes del mes desde el implante o la manipulación del dispositivo; b) diferidas: cuando aparecían entre 2 y 12 meses después del implante o manipulación, y c) tardías: cuando lo hacían después de 12 meses.
Tratamiento antibióticoEra guiado siempre por el antibiograma frente al agente etiológico aislado en cultivo. Tras la extracción del dispositivo, en las infecciones locales se mantenía 1-2 semanas después por vía oral. En caso de que no se extrajera, la duración era individualizada.
En las infecciones sistémicas se comenzaba siempre el tratamiento antimicrobiano por vía i.v. antes de la extracción y, salvo en casos de sepsis grave, esta se realizaba cuando los hemocultivos de control eran ya negativos (habitualmente a la semana). Si la extracción era completa, el tratamiento se mantenía después 2 semanas más, y se permitía la secuenciación a vía oral tras la primera semana de tratamiento. En caso de afección valvular (p. ej., tricúspide), el tratamiento antimicrobiano se mantenía un mínimo de 4 semanas.
Procedimiento quirúrgicoEl procedimiento quirúrgico se describe detalladamente en el .
Reimplante del dispositivo de electroestimulaciónEl reimplante del dispositivo de electroestimulación se realizó en 1 o 2 tiempos, según el tipo de dispositivo, tal como se detalla en el .
SeguimientoEn los pacientes de nuestro hospital se realizó un seguimiento específico durante 1 año en una consulta especializada de enfermedades infecciosas y luego de por vida en la consulta de revisión de marcapasos. Para los pacientes enviados desde otros centros, el seguimiento mínimo en nuestro hospital era de 3 meses y siempre se realizaban hemocultivos de control de las infecciones sistémicas y se contactaba con los hospitales de referencia hasta completar 1 año.
Consideramos que había una recidiva del episodio si, durante el año de seguimiento, se producía una infección del nuevo dispositivo implantado por el mismo microorganismo aislado en el sistema original extraído. Si en cambio se aislaba un microorganismo diferente, se consideraba el caso una reinfección y se registraba entonces como nuevo episodio. La persistencia de los signos y síntomas originales o el continuo aislamiento del mismo microorganismo tras un determinado abordaje terapéutico se definieron como fracaso del tratamiento.
Análisis estadísticoSe realizó un análisis descriptivo, con medidas de tendencia central y de dispersión en variables continuas y distribución de frecuencias para las cualitativas. Para la comparación de variables continuas, se utilizó la prueba de la t de Student (previo análisis de la normalidad con la prueba de Kolmogorov-Smirnov), y en caso de que no se verificara la normalidad de la distribución, se aplicó la prueba U de Mann-Whitney. En cuanto a las variables categóricas, se utilizó la prueba de la χ2 o la exacta de Fisher en su caso. El nivel de significación estadística se estableció en p<0,05.
RESULTADOSCaracterísticas epidemiológicasDurante el periodo de estudio se registraron 325 infecciones en 314 pacientes; 226 (72%) varones y 88 mujeres, y un 28,5% pacientes enviados desde otros centros. La mediana de edad de los pacientes era 69 [60-76] (intervalo, 14-90) años y un 32% de ellos presentaban 2 o más enfermedades crónicas concomitantes.
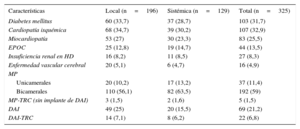
En 229 pacientes (71%) la infección asentó sobre un marcapasos, 91 pacientes portaban un desfibrilador automático implantable y 27 estaban sometidos a terapia de resincronización cardiaca (22 de ellos con desfibrilador automático implantable). Un resumen de las características principales de los pacientes se detalla en la tabla 1.
Características epidemiológicas de los pacientes según tipo de infección
| Características | Local (n=196) | Sistémica (n=129) | Total (n=325) |
|---|---|---|---|
| Diabetes mellitus | 60 (33,7) | 37 (28,7) | 103 (31,7) |
| Cardiopatía isquémica | 68 (34,7) | 39 (30,2) | 107 (32,9) |
| Miocardiopatía | 53 (27) | 30 (23,3) | 83 (25,5) |
| EPOC | 25 (12,8) | 19 (14,7) | 44 (13,5) |
| Insuficiencia renal en HD | 16 (8,2) | 11 (8,5) | 27 (8,3) |
| Enfermedad vascular cerebral | 20 (5,1) | 6 (4,7) | 16 (4,9) |
| MP | |||
| Unicamerales | 20 (10,2) | 17 (13,2) | 37 (11,4) |
| Bicamerales | 110 (56,1) | 82 (63,5) | 192 (59) |
| MP-TRC (sin implante de DAI) | 3 (1,5) | 2 (1,6) | 5 (1,5) |
| DAI | 49 (25) | 20 (15,5) | 69 (21,2) |
| DAI-TRC | 14 (7,1) | 8 (6,2) | 22 (6,8) |
DAI: desfibrilador automático implantable; EPOC: enfermedad pulmonar obstructiva crónica; HD: hemodiálisis; MP: marcapasos; TRC: terapia de resincronización cardiaca.
Los valores expresan n (%).
En 196 episodios (60,3%) las infecciones se catalogaron como locales y en 129 (39,7%), como sistémicas. En 160 pacientes (49%) la infección se originó tras una manipulación posterior (recambio del generador en el 80% de ellas) y estas se clasificaron en agudas (n=131 [40,3%]), diferidas (n=100 [30,8%]) y tardías (n=94 [28,9%]).
Etiología y rendimiento de las pruebas diagnósticasLos microorganismos más frecuentemente aislados (42,8%) fueron los estafilococos coagulasa-negativos y Staphylococcus aureus (16,9%). Una descripción más detallada de la etiología microbiana se detalla en la tabla 2A y 2B.
Etiología de las infecciones
| A. Según el momento de aparición | ||||
|---|---|---|---|---|
| Microorganismo | Aguda | Diferida | Tardía | Total |
| ECNa | 48 (36,6) | 46 (46) | 45 (47,9) | 139 (42,8) |
| Staphylococcus aureusb | 30 (22,9) | 13 (13) | 12 (12,8) | 55 (16,9) |
| BGN | 16 (12,2) | 4 (4) | 4 (4,3) | 24 (7,3) |
| Estreptococos | 1 (0,8) | 1 (1) | 4 (4,3) | 6 (1,8) |
| Anaerobios | 6 (6,6) | 5 (5) | 2 (2,1) | 13 (4) |
| Otros | 2 (1,5) | 4 (4) | 5 (5,3) | 12 (3,6) |
| Polimicrobiana | 16 (12,2) | 9 (9) | 9 (8,5) | 33 (10,2) |
| No conocido | 12 (9,2) | 18 (18) | 13 (13,8) | 43 (13,2) |
| Total | 131 | 100 | 94 | 325 |
| B. Según su localización | |||
|---|---|---|---|
| Microorganismo | Local | Sistémica | Total |
| ECNa | 90 (45,9) | 49 (38) | 139 (42,8) |
| Staphylococcus aureusb | 20 (10,2) | 35 (27,1) | 55 (16,9) |
| BGN | 13 (8,6) | 11 (8,5) | 24 (7,3) |
| Estreptococos | 1 (0,5) | 5 (3,9) | 6 (1,8) |
| Anaerobiosc | 13 (6,6) | 0 | 13 (4) |
| Otrosd | 6 (3,1) | 6 (4,5) | 12 (3,6) |
| Polimicrobianae | 12 (6,1) | 22 (16,3) | 33 (10,2) |
| No conocido | 41 (20,9) | 2 (1,6) | 43 (13,2) |
| Total | 196 | 129 | 325 |
BGN: bacilos Gram-negativos (incluidas enterobacterias y bacilos no fermentadores); ECN: estafilococos coagulasa-negativos.
En 11 episodios de infecciones por ECN se aislaron varias especies que no se han incluido en la categoría «polimicrobianas».
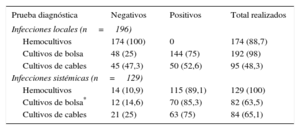
Cuando había síntomas locales, el rendimiento de los cultivos de la zona del generador fue elevado (un 75-85,3% de aislamientos) y también fue alta la positividad del cultivo de los cables en infecciones sistémicas (75%) e incluso en infecciones locales (52,6%). Una exposición más detallada de esto se muestra en la tabla 3.
Rendimiento de los diversos cultivos realizados según el tipo de infección
| Prueba diagnóstica | Negativos | Positivos | Total realizados |
|---|---|---|---|
| Infecciones locales (n=196) | |||
| Hemocultivos | 174 (100) | 0 | 174 (88,7) |
| Cultivos de bolsa | 48 (25) | 144 (75) | 192 (98) |
| Cultivos de cables | 45 (47,3) | 50 (52,6) | 95 (48,3) |
| Infecciones sistémicas (n=129) | |||
| Hemocultivos | 14 (10,9) | 115 (89,1) | 129 (100) |
| Cultivos de bolsa* | 12 (14,6) | 70 (85,3) | 82 (63,5) |
| Cultivos de cables | 21 (25) | 63 (75) | 84 (65,1) |
Los valores expresan n (%).
En 116 (90%) pacientes con infección sistémica se realizó un estudio ecocardiográfico previo a la extracción: 45 pacientes con estudio transtorácico, 42 con estudio transtorácico y transesofágico y en 29 se procedió directamente al estudio transesofágico. De las 87 ecografías transtorácicas, en 24 (27,5%) se visualizaron vegetaciones, frente al 63,3% (n=45) de los 61 estudios transesofágicos.
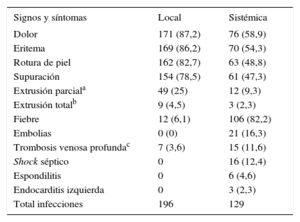
ClínicaLos síntomas y signos clínicos se muestran en la tabla 4. De los pacientes con infección sistémica, 77 (57,7%) presentaban signos locales, que en 32 (25%) estaban presentes mucho antes del desarrollo de la infección sistémica, por lo que se trató al paciente como tal (normalmente con cirugía de limpieza local) y posteriormente se evolucionó a una infección sistémica.
Manifestaciones clínicas
| Signos y síntomas | Local | Sistémica |
|---|---|---|
| Dolor | 171 (87,2) | 76 (58,9) |
| Eritema | 169 (86,2) | 70 (54,3) |
| Rotura de piel | 162 (82,7) | 63 (48,8) |
| Supuración | 154 (78,5) | 61 (47,3) |
| Extrusión parciala | 49 (25) | 12 (9,3) |
| Extrusión totalb | 9 (4,5) | 3 (2,3) |
| Fiebre | 12 (6,1) | 106 (82,2) |
| Embolias | 0 (0) | 21 (16,3) |
| Trombosis venosa profundac | 7 (3,6) | 15 (11,6) |
| Shock séptico | 0 | 16 (12,4) |
| Espondilitis | 0 | 6 (4,6) |
| Endocarditis izquierda | 0 | 3 (2,3) |
| Total infecciones | 196 | 129 |
Los valores expresan n (%).
En 102 infecciones locales (55,6%) se utilizaron como primer abordaje terapéutico opciones diferentes de la tracción percutánea (TPC), con un resultado no satisfactorio en 75 (73,5%) de ellas. La cirugía local (extracción del generador dejando cables in situ, desbridamiento y limpieza de la bolsa y colocación del nuevo generador) obtuvo apenas un 20% de curaciones, con una mediana de 2,5 [1-3] (1-12) procedimientos por paciente. En 9 ocasiones se reimplantó un sistema contralateral en el que se extrajo el generador infectado, pero se dejaban los cables y en todos los casos se observó extrusión y supuración en la misma zona meses después. El tratamiento antimicrobiano aislado tuvo éxito en el 48,3% de las ocasiones. Si se compara a los pacientes que tuvieron éxito con este tratamiento (n=15) con los casos en que fracasó (n=16), se observó: a) los pacientes presentaban una mediana de tiempo de evolución significativamente más corta: 10 [3-15] (2-60) frente a 35,5 [16-187] (11-474) días (p<0,01), y b) los pacientes presentaron menos frecuentemente rotura de piel: 4 ocasiones (28,6%) frente a 11 (64,7%; p=0,07). En ambos casos el tratamiento antimicrobiano prescrito fue prolongado: 60 [40-90] días, y siempre guiado por antibiograma.
La TPC en cambio condujo a la curación en el 96,3% de las extracciones completas (n=94) y en el 86,2% de las incompletas (n=20) con persistencia de fragmentos intravasculares por rotura de los cables. En 3 casos los pacientes desarrollaron, meses más tarde, una infección sistémica que obligó a la realización de cirugía cardiaca abierta.
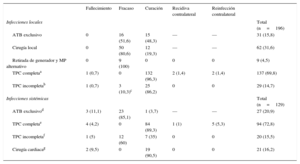
En las infecciones sistémicas el tratamiento antimicrobiano fue muy poco eficaz (un 85,1% de fracasos) y con una mortalidad elevada (11,1%). La TPC completa consiguió la curación en el 89,3% de los pacientes, mientras que la TPC incompleta produjo un 60% de fracasos (n=12) que obligaron a realizar una cirugía cardiaca en 11 y extracción posterior con lazada femoral en otro de ellos. De los 21 pacientes sometidos a cirugía cardiaca en este centro, 11 fueron por TPC fallidas, mientras que el resto procedían de otros centros en los que se había intentado la tracción manual simple. Los resultados de los diversos abordajes se muestran detalladamente en la tabla 5.
Evolución de las infecciones locales y sistémicas, según el abordaje empleado
| Fallecimiento | Fracaso | Curación | Recidiva contralateral | Reinfección contralateral | ||
|---|---|---|---|---|---|---|
| Infecciones locales | Total (n=196) | |||||
| ATB exclusivo | 0 | 16 (51,6) | 15 (48,3) | — | — | 31 (15,8) |
| Cirugía local | 0 | 50 (80,6) | 12 (19,3) | — | — | 62 (31,6) |
| Retirada de generador y MP alternativo | 0 | 9 (100) | 0 | 0 | 0 | 9 (4,5) |
| TPC completaa | 1 (0,7) | 0 | 132 (96,3) | 2 (1,4) | 2 (1,4) | 137 (69,8) |
| TPC incompletab | 1 (0,7) | 3 (10,3)c | 25 (86,2) | 0 | 0 | 29 (14,7) |
| Infecciones sistémicas | Total (n=129) | |||||
| ATB exclusivod | 3 (11,1) | 23 (85,1) | 1 (3,7) | — | — | 27 (20,9) |
| TPC completae | 4 (4,2) | 0 | 84 (89,3) | 1 (1) | 5 (5,3) | 94 (72,8) |
| TPC incompletaf | 1 (5) | 12 (60) | 7 (35) | 0 | 0 | 20 (15,5) |
| Cirugía cardiacag | 2 (9,5) | 0 | 19 (90,5) | 0 | 0 | 21 (16,2) |
ATB: antibiótico; MP: marcapasos; TPC: tracción percutánea.
Los valores expresan n (%).
83 TPC como técnica inicial y 54 secundarias, tras el fracaso de otros abordajes (tratamiento antibiótico exclusivo o combinado con cirugía local).
La TPC se realizó en un total de 280 episodios (166 infecciones locales y 114 sistémicas) y se logró la extracción completa en 231 casos (82,5%) y la curación en 246 (89%). El porcentaje de éxito con esta técnica se relacionó con los años de antigüedad del DEC implantado (tabla 6), y no influyen otros factores tales como el número de cables, el lado del implante o el tipo de dispositivo.
Resultados de la tracción percutánea según el tiempo desde el implante
| Tiempo desde implante | Extracción completa | Extracción incompleta | Total tracciones percutáneas |
|---|---|---|---|
| ≤ 1 año | 97 (97) | 3 (3) | 100 (35,7) |
| 2-5 años | 52 (86,6) | 8 (13,4) | 60 (21,4) |
| 6-10 años | 55 (74,3) | 19 (25,7) | 74 (26,4) |
| 11-15 años | 18 (72) | 7 (28) | 25 (8,9) |
| >15 años | 9 (42,8) | 12 (57,2) | 21 (7,5) |
| Total | 231 (82,5) | 49 (17,5) | 280 (100) |
Los valores expresan n (%).
En el total de esta serie se produjeron 12 fallecimientos: 2 (1%) pacientes con infección local y 10 (7,7%) con infección sistémica. Solo 2 de ellos estuvieron relacionados con la técnica de TPC (desgarro de vena cava superior, 1 en un paciente con infección local y 1 con infección sistémica). En otros 7 episodios la etiología fue la sepsis: 3 de ellos en tratamiento antimicrobiano, 2 con TPC (1 de ellos con extracción incompleta y el otro con extracción completa) y 2 operados mediante cirugía cardiaca. Otros 2 pacientes murieron varios días después de completar la TPC por causa no relacionada (accidente derebrovascular, uno de ellos con infección local) y finalmente otro paciente, con miocardiopatía dilatada sometido a terapia de resincronización en la que no se reimplantó el sistema, falleció meses después por insuficiencia cardiaca.
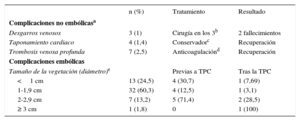
Las diversas complicaciones relacionadas con la TPC se describen en la tabla 7.
Complicaciones de la tracción percutánea
| n (%) | Tratamiento | Resultado | |
|---|---|---|---|
| Complicaciones no embólicasa | |||
| Desgarros venosos | 3 (1) | Cirugía en los 3b | 2 fallecimientos |
| Taponamiento cardiaco | 4 (1,4) | Conservadorc | Recuperación |
| Trombosis venosa profunda | 7 (2,5) | Anticoagulaciónd | Recuperación |
| Complicaciones embólicas | |||
| Tamaño de la vegetación (diámetro)e | Previas a TPC | Tras la TPC | |
| <1 cm | 13 (24,5) | 4 (30,7) | 1 (7,69) |
| 1-1,9 cm | 32 (60,3) | 4 (12,5) | 1 (3,1) |
| 2-2,9 cm | 7 (13,2) | 5 (71,4) | 2 (28,5) |
| ≥ 3 cm | 1 (1,8) | 0 | 1 (100) |
TPC: tracción percutánea.
En los 59 episodios (el 45% de todas las infecciones sistémicas) en que se visualizaron vegetaciones, estas se alojaron en los cables (n=45), los cables y las válvulas derechas (n=8) y solo las válvulas (n=8). El diámetro de las vegetaciones se midió en 57 episodios y fue<1 cm en 13, 1-1,9cm en 34, 2-2,9 cm en 9 y ≥ 3 cm en 1 paciente.
En 13 pacientes (4%) de esta serie se decidió no realizar el recambio del dispositivo tras la extracción.
En 9 pacientes con infecciones locales sometidos a TPC con extracción completa, se hizo primero un implante contralateral y se retiró solo el generador, y en nuestro centro se realizó la retirada de los cables remanentes pues el paciente seguía con signos de infección. De los 128 restantes, se procedió al recambio en el mismo acto quirúrgico en 96 (75%) y en 2 tiempos en 32, sin diferencias significativas en la frecuencia de infección contralateral.
En las 4 infecciones sistémicas sometidas a TPC se realizó la extracción tras la colocación previa de un sistema contralateral. De las 81 restantes, este reimplante se realizó en el mismo acto de la extracción en 56 (69%) y en un segundo tiempo en 25. Se observó 1 infección por el mismo microorganismo y otra por un germen diferente (3,5%) en las realizadas en un primer tiempo, mientras que en las de 2 tiempos se registraron 4 infecciones (16%) por un microorganismo diferente (p=0,04).
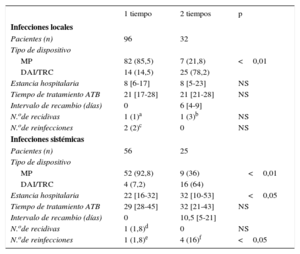
Las diferencias entre ambos procedimientos se muestran en la tabla 8.
Características de los pacientes sometidos a tracción percutánea y reimplante en 1 o 2 tiempos
| 1 tiempo | 2 tiempos | p | |
|---|---|---|---|
| Infecciones locales | |||
| Pacientes (n) | 96 | 32 | |
| Tipo de dispositivo | |||
| MP | 82 (85,5) | 7 (21,8) | <0,01 |
| DAI/TRC | 14 (14,5) | 25 (78,2) | |
| Estancia hospitalaria | 8 [6-17] | 8 [5-23] | NS |
| Tiempo de tratamiento ATB | 21 [17-28] | 21 [21-28] | NS |
| Intervalo de recambio (días) | 0 | 6 [4-9] | |
| N.ode recidivas | 1 (1)a | 1 (3)b | NS |
| N.ode reinfecciones | 2 (2)c | 0 | NS |
| Infecciones sistémicas | |||
| Pacientes (n) | 56 | 25 | |
| Tipo de dispositivo | |||
| MP | 52 (92,8) | 9 (36) | <0,01 |
| DAI/TRC | 4 (7,2) | 16 (64) | |
| Estancia hospitalaria | 22 [16-32] | 32 [10-53] | <0,05 |
| Tiempo de tratamiento ATB | 29 [28-45] | 32 [21-43] | NS |
| Intervalo de recambio (días) | 0 | 10,5 [5-21] | |
| N.ode recidivas | 1 (1,8)d | 0 | NS |
| N.ode reinfecciones | 1 (1,8)e | 4 (16)f | <0,05 |
ATB: antibiótico; DAI: desfibrilador automático implantable; MP: marcapasos; TPC: tracción percutánea; TRC: terapia de resincronización cardiaca.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
De los 304 pacientes supervivientes, en 13 (4,3%) no tuvimos un seguimiento mínimo (3 meses), pero se siguió al resto al menos 1 año: mediana, 36 [9,5-70,5] (6-309) meses, si bien 12 pacientes aún no lo habían completado en el momento de cerrar este estudio. Se registraron 31 fallecimientos (10%) por causas no relacionadas con problemas del dispositivo.
DISCUSIÓNEn nuestro país son muy escasos los trabajos comunicados sobre infecciones en DEC7–9, aunque el consenso general es claro sobre la necesidad de retirar completamente estos dispositivos cuando están infectados5,6. Sin embargo, no es esa precisamente la actitud predominante en nuestra comunidad y sorprende la cantidad de cirugías locales que se llevan a cabo (incluso varias en un mismo paciente), cuando la tasa de curación con este procedimiento no llega al 20%. No es pues sorprendente, que hasta el 25% de las infecciones sistémicas registradas en esta serie derivaran inicialmente de una infección local con un abordaje inadecuado. Las razones pueden ser un no reconocimiento de la infección, y no tener una preparación adecuada para realizar una extracción completa. Sin embargo, cuando se hace de manera correcta, la toma de cultivos arroja información muy útil y en este sentido son muy interesantes los datos sobre la eficacia del tratamiento antimicrobiano en las infecciones locales cuando se hace en circunstancias favorables. El mejor tratamiento para cualquier infección local es la retirada completa del dispositivo, pero la mitad de las infecciones se producen después de una manipulación (habitualmente el recambio del generador)10,11 con cables de muchos años de antigüedad. En esa tesitura, si no se dispone de un equipo entrenado en la extracción, un tratamiento antimicrobiano apropiado y precoz puede resolver el problema en ciertos casos seleccionados. Por el contrario, en las infecciones sistémicas debe de abordarse el problema siempre desde la perspectiva de la extracción total, ya que en nuestra experiencia el tratamiento antimicrobiano aislado condujo al fracaso o la muerte en el 96% de los episodios. En la literatura hay ejemplos de curaciones con tratamiento antimicrobiano exclusivamente, pero solo hay 1 trabajo en el que se defiende esta alternativa de manera protocolizada en los casos en que no hay síntomas en el generador y tampoco vegetaciones visualizadas en la ecografía transesofágica12. En nuestra serie se trató exclusivamente con antimicrobianos solo a 4 pacientes que cumplían esta condición, pero todos recidivaron, lo que hizo que se abandonara este proceder, que incluso se ha relacionado con mayor mortalidad13. Por lo tanto, la TPC realizada por manos expertas es la técnica de elección, y no creemos que ni siquiera esté justificado no realizarla en pacientes con vegetaciones>2 cm por el riesgo de embolias, como en ocasiones se ha preconizado14,15. En este estudio, 3 pacientes con vegetaciones>2 cm sometidos a TPC sufrieron síntomas de embolia pulmonar tras la extracción, pero con pronta recuperación, lo que coincide con lo publicado por otros autores que, sin negar un mayor número de embolizaciones con un diámetro mayor de la vegetación, no observaron que esto tuviera influencia en la evolución final o la estancia de los pacientes16. Se debe considerar la cirugía cardiaca como una opción secundaria, ya que su mortalidad es alta (el 10% en esta serie), lo que no es de extrañar teniendo en cuenta la edad y las comorbilidades de la mayoría de estos pacientes17. La TPC tampoco está exenta de complicaciones mayores potencialmente mortales (2 casos en este estudio). Incluso realizada por personal experto y con las máximas condiciones de seguridad18, es imprescindible el apoyo de cirujanos cardiacos bien familiarizados con la técnica para actuar de manera inmediata en caso de complicaciones mayores. El éxito de la TPC va a depender en gran medida de la experiencia del operador y de los años de antigüedad del cable19. En las infecciones locales, aun con una extracción no completa puede lograse la curación20, pero es de resaltar que, en 3 ocasiones en esta serie, una extracción incompleta en una infección local dio paso a una infección sistémica meses más tarde. De hecho, la clasificación en infecciones locales y sistémicas basándonos en la positividad de los hemocultivos y/o la detección de vegetaciones en los cables parece razonable, pero llama la atención que en el 50% de los pacientes con infecciones catalogadas como «locales» en esta serie, el cultivo de los cables fuera positivo. Se ha intentado explicarlo por el hecho de que, al extraer el cable mediante TPC, este pasa por la zona infectada donde estaba el generador21. Sin embargo, se ha demostrado que hasta el 72% de la porción intravascular de los cables extraídos por vía femoral de pacientes con infección catalogada como estrictamente local tienen cultivos positivos22. Por lo tanto, la diferencia entre infección local y sistémica no es clara en ocasiones y debe motivar siempre la retirada de todo el material en cualquier tipo de infección.
Mención especial merece la frecuente realización en este estudio del recambio del implante en 1 solo tiempo, lo que permitió reducir la estancia hospitalaria y optimizar el uso del quirófano. En una encuesta realizada en Europa, la mayoría de los centros reimplantaban los dispositivos en un segundo tiempo con un intervalo que variaba entre 48 h y 2 semanas dependiendo del tipo de infección23; en este intervalo se utilizaron marcapasos transitorios por vía yugular, femoral o epicárdicos. De hecho, las guías al uso recomiendan la explantación del dispositivo con un sistema de estimulación transitorio y, en caso de que los hemocultivos sean negativos a las 72 h, reimplantar entonces el nuevo sistema definitivo5,6. Sin embargo, esta «recomendación de expertos» ha sido cuestionada recientemente en cuanto a las infecciones locales, pues Mountantonakis et al.24 demostraron que el recambio en un solo tiempo no mostraba una mayor incidencia de reinfecciones. En infecciones sistémicas la renuencia a reimplantar en el mismo momento de la extracción es aún mayor, pues se asume que un reimplante en el mismo acto podría contaminar el nuevo sistema desde el antiguo. Sin embargo, hay que resaltar que con tratamiento antimicrobiano la adhesión de los microorganismos a materiales abióticos está seriamente afectada, incluso a concentraciones subóptimas, tal como se ha demostrado en estudios in vitro25 y modelos experimentales26. Por lo tanto, no hay una razón convincente para pensar en un mayor riesgo de infección del nuevo dispositivo en un paciente con tratamiento antimicrobiano apropiado y hemocultivos negativos en quien va a realizarse un explante completo del material infectado. Esto se ha demostrado en otros implantes27 y de hecho en nuestra serie el reimplante en 1 solo tiempo no se asoció a una mayor tasa de reinfecciones y, en cambio, cuando se realizó 2 tiempos, sí hubo una mayor incidencia de infección en el nuevo dispositivo por microorganismos resistentes al tratamiento administrado. Puede que el antimicrobiano empleado largo tiempo favoreciera una mayor colonización de la piel por especies naturalmente no sensibles a él. En este mismo sentido de abogar por reducir los tiempos de reimplante cuando los hemocultivos son negativos, se han pronunciado otros autores21,28.
LimitacionesNuestro trabajo presenta ciertas limitaciones: a) al actuar como centro de referencia, puede haber un número excesivo de fracasos con la cirugía de limpieza local, ya que en la mayoría de los pacientes remitidos ya había fracasado este abordaje, por lo que no refleja así su eficacia real; sin embargo, se repitió el análisis en los casos solo de nuestro centro (datos no mostrados) y los resultados fueron idénticos; b) al tener un porcentaje considerable de pacientes remitidos de otros centros, puede que la positividad de los estudios microbiológicos mostrados aquí sean incluso inferiores a la realidad, ya que en muchos casos los cultivos no se obtuvieron en origen de la manera correcta y los pacientes ya venían con tratamiento antimicrobiano, lo que dificultaba en gran medida su identificación; de igual manera, no se hizo un estudio ecocardiográfico transesofágico a todos los pacientes con infecciones sistémicas, por lo que es posible que el número de vegetaciones sea mayor que el indicado; sin embargo, no creemos que esto afecte de manera importante al núcleo fundamental del trabajo, que es el análisis de los diversos abordajes terapéuticos, y c) el recambio en 1 o 2 tiempos no fue aleatorizado, con un mayor número de implantes de desfibriladores y resincronizaciones en el grupo de recambio en 2 tiempos; por su mayor tamaño y la dificultad de implante, es más largo el proceso quirúrgico y se favorece un mayor número de infecciones. Sin embargo, esto no invalida la conclusión de que el recambio en 1 solo tiempo es igual de seguro y permite evitar los inconvenientes del «intervalo puente» en pacientes dependientes de marcapasos (encamamiento y hospitalización más largos).
CONCLUSIONESLas infecciones en DEC son un problema emergente, no siempre bien reconocido y tratado en nuestro medio. Sin embargo, la TPC en manos expertas es capaz de lograr unos resultados satisfactorios y evitar en gran medida la cirugía cardiaca. El reimplante en el mismo acto es una opción que no parece inferior al recambio en 2 tiempos.
CONFLICTO DE INTERESESNinguno.
Los autores están en deuda con el Dr. Enrique Oliva de Anquín, sin cuya guía y entusiasta apoyo en los primeros tiempos no habría sido posible la realización del programa.