Palabras clave
INTRODUCCION
Las adipocitocinas son proteínas bioactivas sintetizadas y secretadas por el tejido adiposo (TA), pre-sentan un papel importante en la regulación del metabolismo energético, la función inmunitaria, el remodelado vascular, la angiogénesis y la función neuroendocrina1. Estas proteínas pueden actuar localmente, de forma autocrina/paracrina, o sistémica, a través de efectos endocrinos2.
La adiponectina es una proteína de masa molecular de 28 kDa3, sintetizada principalmente por los adipocitos; también se ha descrito su producción por otros tipos celulares, como los cardiomiocitos4. Esta hormona circula abundantemente en el plasma humano y su concentración es un 0,01% del total de proteínas plasmáticas5. Uno de los papeles más importantes de esta hormona es mejorar la resistencia a la insulina mediante el incremento de la oxidación de los ácidos grasos en el tejido adiposo y la disminución de las concentraciones de ácidos grasos en sangre y el contenido intracelular de triglicéridos en el hígado y el músculo. Además, tiene un papel protector en los procesos de aterosclerosis6 y sus concentraciones plasmáticas están disminuidas en estados de resistencia a la insulina, como la obesidad y la diabetes tipo 27,8, así como en pacientes con enfermedad coronaria9.
La leptina es una citocina de 16 kDa que actúa como señal de saciedad en el sistema nervioso central y está relacionada con el metabolismo de la glucosa y la insulina. Se ha señalado que podría ser el nexo de unión entre obesidad, diabetes y riesgo cardiovascular10.
Sus concentraciones plasmáticas aumentan de forma exponencial con el incremento de la masa grasa corporal11, y el estado de hiperleptinemia es reflejo de la resistencia a la leptina presente en la obesidad12. Los pacientes con insuficiencia cardiaca presentan concentraciones plasmáticas elevadas de leptina13, que se han asociado también con una disminución en la distensibilidad arterial14 y con valores elevados de marcadores inflamatorios en individuos obesos15.
Ambas adipocitocinas son secretadas en mayor grado por el TA subcutáneo que por el TA visceral16,17. Recientemente, se ha demostrado que el TA epicárdico secreta diversos mediadores inflamatorios en mayor proporción que el TA subcutáneo en pacientes con alto riesgo cardiaco18. Asimismo, Iacobellis et al19 demostraron la expresión proteínica de adiponectina en el tejido adiposo epicárdico y que sus concentraciones en pacientes con enfermedad coronaria severa son menores19. Este nuevo hallazgo ha proporcionado nuevas funciones al tejido adiposo epicárdico, aunque está por esclarecer el significado de dichos resultados.
En vista de los estudios previos y las propiedades antiinflamatorias de la adiponectina20 y la asociación de la leptina con marcadores inflamatorios15, en este trabajo hemos determinado si hay alguna diferencia en cuanto a las concentraciones de ARNm de adiponectina y leptina entre el TA epicárdico y el subcutáneo de pacientes con enfermedad cardiovascular.
MÉTODOS
Este trabajo se realizó con la aprobación del comité ético local y el consentimiento informado de todos los pacientes incluidos en el estudio. Se extrajeron muestras de tejido adiposo epicárdico y subcutáneo de 46 pacientes del servicio de cirugía cardiaca, 15 mujeres y 31 varones, en los que se había realizado cirugía de bypass coronario o reemplazo valvular aórtico/mitral. Las biopsias fueron recogidas antes de la circulación extracorpórea e inmediatamente fueron congeladas en nitrógeno líquido y almacenadas a 80 °C hasta su procesamiento. Debido a que los propios sujetos fueron controles de sí mismos, solamente se excluyó del estudio a los pacientes con alguna infección viral.
La media de edad de los pacientes incluidos fue de 71,1 ± 1,3 años para las mujeres y 67,4 ± 1,7 años para los varones, y el índice de masa corporal de 29,5 ± 1,3 y 28,48 ± 0,5, respectivamente. Los distintos parámetros y características clínicas analizadas, así como las frecuencias de la medicación de los pacientes, se especifican en la tabla 1.
Inmunohistoquímica
El análisis cualitativo de expresión proteínica de adiponectina y leptina se realizó en una pequeña porción del tejido adiposo epicárdico y subcutáneo de un paciente escogido al azar.
Las muestras de tejido se fijaron en una solución de formaldehído al 4%, se deshidrataron y se cortaron en secciones de 5 µm.
La detección antigénica se realizó por medio de la incubación con el anticuerpo primario, para el caso de la adiponectina se utilizó el anticuerpo de cabra anti-ACRP30 N-20 (Santa Cruz Biotechnology, Santa Cruz, CA, Estados Unidos) a una dilución de 1/200 durante toda la noche a 4 °C. Para la detección de leptina, las muestras se incubaron durante 1 h a temperatura ambiente con el anticuerpo de conejo anti-Ob A-20 (Santa Cruz Biotechnology); posteriormente, las muestras se incubaron con el complejo estreptavidina-peroxidasa Dako LSAB® System HRP (Dako) durante 30 min y se revelaron utilizando la solución tetracloridrato de 3,3'-diaminobenzidina (DAB) preparada según las instrucciones del fabricante durante 10 min.
Los controles negativos se realizaron con los anticuerpos primarios previamente bloqueados toda la noche a 4 °C con sus respectivos antígenos o usando TBS sin anticuerpo.
Extracción de ARN
El ARN se extrajo mediante la homogeneización en frío del tejido adiposo en una solución 0,025 mol/l de citrato sódico compuesta por los siguiente reactivos: tiocianato de guanidina 4 mol/l, beta-mercaptoetanol 0,1 mol/l y 0,5% de sodio lauroil sarcosinato, seguida del aislamiento mediante el método de Chomzynski y Sacchi21. La concentración del ARN se analizó a una absorbancia de 260 nm y la pureza de la muestra se determinó por el cociente obtenido de la mediada de absorbancia a 260 y 280 nm. Posteriormente se realizó un tratamiento con DN-asa de las muestra. Por cada 5 µg de ARN se trató con 10 U/µl de DN-asa I y 20 U/µl de inhibidor de RN-asa (ambos productos de Invitrogen Ltd., Paisley, Reino Unido) durante 2 h a 37 °C. Las proteínas y el ADN se eliminaron de las muestras a través de la extracción de fenol, cloroformo e isoamilalcohol. El ARN se precipitó con una solución de etanol al 96% y acetato sódico 0,3 mol/l, y posteriormente se resuspendió en agua tratada con un 0,1% de dietilpirocarbonato.
RT-PCR en tiempo real
Se utilizaron 1,2 µg de ARN purificado para la síntesis del ADN complementario. La reacción de retrotranscripción se realizó utilizando 200 U del enzima transcriptasa reversa MMLV (Invitrogen) en 20 µl de una solución compuesta por tampón Tris-HCl (pH 8,4) 20 mmol/l, KCl 50 mmol/l, 2,5 mmol/l de MgCl2, dNTP 1 mmol/l de cada 20 U de inhibidor de ribonucleasa y fragmentos de hexámeros que sirven como cebadores. Las condiciones de la reacción fueron: 50 min a 37 °C, 10 min a 42 °C y 5 min a 95 °C.
El análisis comparativo de la expresión de adiponectina y leptina se realizó mediante la técnica de PCR en tiempo real. La reacción se realizó siguiendo las instrucciones del fabricante, en 20 µl, en las que se utilizaron 2 µl del ADNc obtenido en la RT, 0,25 µmol/l de los cebadores correspondientes, 3 mmol/l MgCl2, 2 µl SybrGreen (Roche Diagnostics, SL. Barcelona, España) y 30 nmol/l de Rox (Stratagene, La Jolla, CA). La cuantificación de la expresión de los genes se midió mediante la fluorescencia emitida por el fluorocromo del compuesto de SyberGreen tras su unión a la doble cadena de ADN. El fluorocromo Rox se utilizó como control de carga de la reacción. La pureza de los productos amplificados se analizó mediante la obtención de un solo pico por producto en la curva de disociación.
La amplificación de los genes de adiponectina22 y leptina22 se realizó mediante los siguientes cebadores:
- Adiponectina
Sentido: 5'-TGGTGAGAAGGGTGAGAA-3'
Antisentido: 5'-AGATCTTGGTAAAGCGAATG-3'
- Leptina
Sentido: 5'-TTGGCCCTATCTTTTCTATG-3'
Antisentido: 5'-GCATACTGGTGAGGATCTGT-3'
Como control de carga y calidad del ADNc empleado en el estudio, se amplificó el gen que codifica para el GAPDH23:
- GAPDH
Sentido: 5'-TCCATGACAACTTTGGCATCGTGG-3'
Antisentido: 5'-GTTGCTGTTGAAGTCACAGGAGAC-3'
El programa de amplificación de los genes consistió en un paso inicial de desnaturalización a 95 °C durante 5 min, seguido de 40 ciclos con las siguientes condiciones: desnaturalización, 30 s a 95 °C, hibridación, 45 s a 60 °C, y 1 min a 72 °C para la extensión del ADN. Los productos de amplificación se separaron mediante electoroforesis en un gel de agarosa al 1,5%, se tiñeron con bromuro de etidio y se visualizaron en el sistema de captación de imágenes Typhoon 9410 System (Amersham Pharmacia Biotechnology Inc., Bioscience, Friburgo, Alemania).
El análisis de los resultados obtenidos se realizó con el software del equipo de PCR en tiempo real (Stratagene, Mx3000PTM; Stratagene, La Jolla, CA). Para cada muestra, el programa informático calcula el número de ciclo en el que el lector empieza a detectar un incremento de fluorescencia significativo con respecto a la señal base. El ciclo en el que se empieza a detectar el aumento de fluorescencia se denomina punto de corte o ciclo umbral (Ct: threshold cycle). Los grados de la expresión de adiponectina y leptina se normalizaron con respecto a la expresión del control interno GAPDH en cada muestra.
Análisis estadístico
Los resultados obtenidos en este trabajo se expresaron como valores medios ± error estándar medio (EEM). Las comparaciones entre tejido epicárdico y subcutáneo de cada paciente se realizaron mediante un test de la t de Student para datos pareados. Para las comparaciones de género se aplicó un test de la t de Student no pareado con un intervalo de confianza (IC) del 95%. Los valores de p < 0,05 se consideraron estadísticamente significativos. Para el análisis estadístico se utilizó el software GraphPad InStat.
RESULTADOS
Las principales características clínicas de los 46 pacientes estudiados se representan en la tabla 1. No hay diferencias significativas entre el grupo de varones y el de mujeres en cuanto a los parámetros analizados. En dicha tabla también se refleja la proporción de pacientes (varones y mujeres) tratados con diferentes grupos de fármacos empleados para el tratamien-to de enfermedades cardiovasculares y diabetes sin diferencias significativas entre ambos grupos. Sólo un varón recibía tratamiento con glitazona (rosiglitazona).
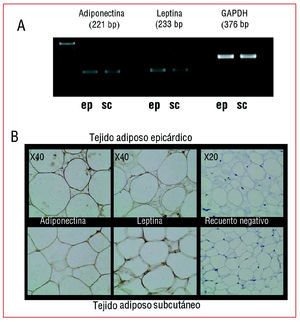
El tejido adiposo epicárdico y subcutáneo expresa adiponectina y leptina (fig. 1). Los productos de amplificación obtenidos fueron de 221 pb para la adiponectina, 223 pb para la leptina y 376 pb para GAPDH. Los controles negativos correspondientes no mostraron evidencias de contaminación.
Fig. 1. A: Resultados de los productos de RT-PCR en un gel de agarosa para adiponectina, leptina y GAPDH en el tejido adiposo epicárdico (ep) y subcutáneo (sc). B: Inmunorreactividad del tejido adiposo epicárdico y subcutáneo de un paciente con anticuerpos contra la adiponectina (izquierda) y la leptina (central). En la parte derecha de la foto se muestran los controles negativos.
La expresión proteínica se analizó mediante inmunhistoquímica y se observó que el citoplasma de los adipocitos de TA epicárdico y subcutáneo son inmunorreactivos para adiponectina y leptina. Los controles negativos correspondientes no mostraron tinción alguna (fig. 1).
Los valores relativos de expresión de adiponectina fueron mayores que los valores de leptina en ambos tejidos analizados (TA epicárdico y subcutáneo); sin embargo, los valores de ARN mensajero (ARNm) de adiponectina y leptina son significativamente más altos en el tejido adiposo subcutáneo que en el tejido adiposo epicárdico. En la adiponectina, las concentraciones de ARNm fueron significativamente más altas en el TA subcutáneo (13,54 ± 0,59 [n = 46] frente a 12,3 ± 0,48 [n = 46]; p < 0,05). Asimismo, los valores obtenidos para la leptina fueron significativamente más altos en el TA subcutáneo (9,8 ± 0,39 [n = 46] frente a 8,7 ± 0,26 [n = 46]; p < 0,01) (fig. 2).
Fig. 2. RT-PCR cuantitativa a tiempo real de los valores de expresión de adiponectina y leptina en tejido adiposo epicárdico (TAE) y subcutáneo (TAS) de 46 pacientes con respecto a GAPDH. Los asteriscos indican las diferencias estadísticamente significativas (ap < 0,05, bp < 0,01).
No se encontró ninguna correlación significativa entre las características clínicas analizadas en la tabla 1 (edad, índice de masa corporal, concentraciones de colesterol, etc.) y los grados de expresión de adiponectina o leptina. Cuando los grados de expresión de la adiponectina y la leptina se analizaron por sexos encontramos diferencias estadísticamente significativas. En las mujeres, los grados de expresión de la adiponectina en el TA epicárdico son significativamente mayores que los de los varones (14,81 ± 0,47 [n = 15] frente a 11,08 ± 0,55 [n = 31]; p < 0,001) (fig. 3A), sin diferencias en el TA subcutáneo. Al igual que la adiponectina, los grados de expresión de la leptina son mayores en el TA epicárdico de mujeres que de varones (9,4 ± 0,4 [n = 15] frente a 8,3 ± 0,3 [n = 31]; p < 0,05) (fig. 3B), mientras que no se observan diferencias en el TA subcutáneo.
Fig. 3. Resultados de RT-PCR cuantitativa a tiempo real de adiponectina (A) y leptina (B) del tejido adiposo epicárdico (TAE) y subcutáneo (TAS) de 31 varones y 15 mujeres en los que se ha realizado cirugía cardiaca con respecto a GAPDH. Los asteriscos indican las diferencias estadísticamente significativas (ap < 0,05; bp < 0,01; cp < 0,001).
En varones, las diferencias de expresión entre los tejidos epicárdico y subcutáneo se mantuvieron y fueron significativas, tanto para la adiponectina (11,28 ± 0,59 frente a 12,83 ± 0,61; p < 0,01) como para la leptina (8,32 ± 0,33 frente a 9,32 ± 0,36; p < 0,01). Sin embargo, no se encontraron diferencias significativas entre los tejidos adiposos epicárdico y subcutáneo en mujeres (fig. 3 A y B).
La relación de ARNm de adiponectina/leptina en el tejido adiposo epicárdico fue significativamente mayor en las mujeres que en los varones (1,62 ± 0,1 frente a 1,35 ± 0,04; p < 0,01) (fig. 4). Al igual que en los resultados anteriores, no se hallaron diferencias significativas en el tejido adiposo subcutáneo (fig. 4).
Fig. 4. Resultados de la relación de ARNm de adiponectina/leptina del tejido adiposo epicárdico (TAE) y subcutáneo (TAS) entre varones y mujeres. La significatividad se indica como **p < 0,01.
No se encontraron diferencias estadísticas significativas cuando se analizó la expresión del ARNm de adiponectina y leptina en el tejido adiposo epicárdico de pacientes en los que se había realizado un bypass coronario (cardiopatía vascular) y de aquellos en los que se había efectuado un reemplazo valvular (fig. 5).
Fig. 5. Resultados de RT-PCR cuantitativa a tiempo real de adiponectina y leptina del tejido adiposo epicárdico de 34 pacientes con cardiopatía isquémica (CI) y 17 con reemplazo valvular (RV) con respecto a GAPDH.
DISCUSION
La obesidad es un factor de riesgo cardiovascular que no sólo actúa de forma pasiva al aumentar la carga en el corazón, sino que también lo hace de forma activa al provocar una alteración de las concentraciones plasmáticas de diversos factores moleculares que son producidos por el tejido adiposo. Estos factores tienen efectos cardiovasculares, además de un papel regulador del metabolismo energético24-26, hechos que determinan que la grasa sea un auténtico órgano endocrino.
La adiponectina y la leptina se encuentran entre los factores que secreta el tejido adiposo y se engloban en el grupo de las adipocitocinas1. Hay una asociación entre las concentraciones plasmáticas de leptina y los factores de riesgo cardiovascular clásicos, la resistencia a la insulina, la presencia de síndrome metabólico y los marcadores de inflamación, incluso cuando la proporción de grasa corporal se encuentra en un intervalo normal27-29. En varones con hipercolesterolemia, las concentraciones plasmáticas de leptina están elevadas y se asocian con un mayor riesgo coronario30.
La adiponectina es una hormona relacionada de forma directa con la sensibilidad a la insulina, la obesidad abdominal y las alteraciones del perfil lipídico (en particular, concentraciones bajas de colesterol ligado a lipoproteínas de alta densidad [cHDL]). Por otro lado, hay una relación inversa entre la inflamación vascular y las concentraciones plasmáticas de dicha hormona20. En esta línea, diversos estudios han observado una relación directa entre unas concentraciones plasmáticas reducidas de adiponectina y la extensión de la aterosclerosis, y en varones con cardiopatía isquémica se han documentado valores reducidos de dicha hormona25.
Recientemente se ha publicado que los pacientes con cardiopatía isquémica presentan grados más elevados de expresión de la proteína quimiotáctica de monocitos (MCP-1) y de diversas citocinas proinflamatorias (interleucina-1 [IL-1]) en el TA epicárdico con respecto al subcutáneo18, especulándose que la grasa epicárdica podría desempeñar un papel paracrino en las enfermedades que afectan a las arterias coronarias (aterotrombosis) y al miocardio (disfunción cardiaca).
En esta línea, y dada la asociación entre la leptina y los marcadores proinflamatorios, cabría esperar que esta hormona se expresase también en mayor proporción en el TA epicárdico que en el subcutáneo. En este sentido, se han observado diferencias de expresión de la leptina y la adiponectina en los distintos depósitos de grasa, que es de mayor grado en el TA subcutáneo que en el TA visceral16,17,31,32.
En este trabajo se describe que los TA epicárdico y subcutáneo producen diferentes concentraciones de adiponectina y leptina, y que éstas son significativamente mayores en el TA subcutáneo. Esta diferencia es debida en mayor grado a la influencia del sexo, ya que cuando los resultados se analizan según el sexo de los pacientes se observa que la grasa epicárdica de las mujeres produce mayores concentraciones de adiponectina y leptina que la de los varones (fig. 3 A y B). Debido a que, en general, hay mayor expresión de adiponectina que de leptina en el tejido adiposo, las diferencias observadas entre el tejido adiposo epicárdico y subcutáneo son mayores con respecto a la adiponectina que las observadas con la leptina. Este hecho podría indicar que la adiponectina producida por el tejido adiposo desempeña un papel metabólico de mayor relevancia que la leptina.
A diferencia de los resultados obtenidos por Iacobellis et al19, en los que se demuestra en 16 pacientes una menor síntesis de adiponectina en el tejido adiposo epicárdico en los que tienen cardiopatía isquémica en comparación con los controles (reemplazo valvular aórtico o mitral), en nuestro estudio no encontramos diferencias significativas de expresión de adiponectina en pacientes con cardiopatía isquémica (n = 34) y pacientes con reemplazo valvular (n = 17). La menor expresión de adiponectina y leptina en TA epicárdico del grupo de pacientes con cardiopatía isquémica no alcanza significación estadística.
No obstante, no podemos descartar la posibilidad de que la discrepancia encontrada con los datos aportados por Iacobellis et al se deba a mecanismos de regulación postranscripcionales, por lo que no se observan diferencias en los grados de expresión génica, y a diferencias en las características de los pacientes, aunque no en el tamaño muestral, ya que nosotros incluimos un mayor número de casos.
Con respecto a los resultados publicados por Baker et al33, nosotros también observamos una menor expresión de ARNm de adiponectina y leptina en el tejido adiposo epicárdico con respecto al tejido adiposo periférico (subcutáneo, omental y perimuscular)33. Sin embargo, creemos que nuestros resultados tienen una mayor validez metodológica, ya que para las determinaciones hormonales empleamos en el mismo paciente el tejido adiposo epicárdico y subcutáneo, y Baker et al analizan el tejido adiposo epicárdico procedente de pacientes en los que se ha realizado cirugía coronaria y lo comparan con el tejido adiposo periférico de otros pacientes sin enfermedad coronaria o diabetes tipo 233. Estos resultados impiden comparar si hay diferencias en los mismos pacientes en la expresión de estas hormonas entre grasa epicárdica y periférica.
Por otro lado, no podemos descartar que parte de la producción de adipocitocinas pueda ser debida a la presencia de células inflamatorias en el tejido adiposo, aunque la producción de adiponectina y leptina se debe principalmente a los adipocitos y, por el contrario, los macrófagos están más especializados en la producción de citocinas como factor de necrosis tumoral alfa (TNF-α) o interleucina-6 (IL-6)34; y aunque un 10% del contenido del tejido adiposo está compuesto por macrófagos y el número de éstos se correlaciona directamente con la adiposidad y el tamaño del adipocitos, el porcentaje de estas células inflamatorias no varía entre el tejido adiposo subcutáneo y visceral, por lo que no cabe esperar que influyan en las diferencias observadas en nuestro estudio35.
Hay diversos factores que podrían justificar nuestros hallazgos en relación con las diferencias entre varones y mujeres; en varones, las concentraciones de adiponectina podrían estar disminuidos por efecto de los andrógenos36. Tsou et al37 describieron la influencia de las hormonas sexuales en las concentraciones plasmáticas de adiponectina; del mismo modo, los valores de leptina en plasma están influidos por hormonas sexuales38. Esta relación entre adiponectina y leptina con andrógenos y estrógenos podrían determinar en parte nuestros datos, en particular la menor actividad de adiponectina en el TA epicárdico en varones.
Nuestros resultados podrían tener cierta relevancia clínica. Como hemos comentado, hay una relación entre las concentraciones bajas de adiponectina y factores directamente implicados en la enfermedad vascular aterotrombótica, una relación directa entre las concentraciones plasmáticas de adiponectina y el riesgo de diferentes enfermedades vasculares, en particular entre valores reducidos de dicha hormona y riesgo de infarto de miocardio39. En este sentido, el mayor riesgo de enfermedades vasculares de etiología aterotrombótica, y en particular podríamos especular que la cardiopatía isquémica en varones, podría relacionarse con la menor producción de adiponectina en el TA epicárdico de los varones, ya que, como hemos comentado, podría desempeñar una función paracrina directa sobre las arterias coronarias, lo que contribuiría a justificar parte de las diferencias en el riesgo de cuadros clínicos debidos a aterotrombosis coronaria entre varones y mujeres. Esta posible explicación fisiopatológica sobre la relación entre la actividad metabólica de la grasa epicárdica y el riesgo de aterotrombosis coronaria se refuerza si se tiene en cuenta que la mayor concentración de grasa epicárdica se distribuye en las arterias coronarias epicárdicas.
CONCLUSIONES
En conclusión, describimos por primera vez que la producción de leptina y adiponectina por TA epicárdico es menor que la que presenta el TA subcutáneo. No obstante, cuando los resultados se analizan por sexos, se muestra una diferencia de expresión en el TA epicárdico (mayor producción de adiponectina y leptina) en mujeres que en varones. El análisis del índice adiponectina/leptina confirma que la diferencia de expresión de adiponectina en el tejido adiposo epicárdico es debida al sexo y no a la presencia de alguna alteración inflamatoria, como se pudo observar tras el análisis de la expresión de dichas hormonas entre los pacientes con cardiopatía isquémica y reemplazo valvular.
AGRADECIMIENTOS
Expresamos nuestro agradecimiento al Dr. Otero, del Departamento de Bioestadística de la Facultad de Medicina de la Universidad de Santiago de Compostela, por su colaboración en el análisis de datos.
Full English text available from: www.revespcardiol.org
*Ambos autores contribuyeron igualmente en este trabajo.
Este trabajo ha sido financiado por el Ministerio de Sanidad y Consumo dentro del Programa de Promoción de la Investigación Biomedicina y en Ciencias de la Salud (PI040693).
Correspondencia:
Dr. J.R. González-Juanatey.
Laboratorio 1 Investigación y Docencia. Unidad de Investigación en Cardiología Celular y Molecular (planta 0). Hospital Clínico Santiago de Compostela.
Choupana, s/n. 15706 Santiago de Compostela. La Coruña. España.
Correo electrónico: jose.ramon.gonzalez.juanatey@sergas.es
Recibido el 8 de noviembre de 2005.
Aceptado para su publicación el 17 de agosto de 2006.