La diabetes mellitus tipo 2 (DM2) es un trastorno metabólico que predispone al desarrollo de la enfermedad cardiovascular (ECV). Se estima que su prevalencia alcance los 700 millones a nivel mundial en el año 20451. El crecimiento de la DM2 está asociado con el envejecimiento de la población y con un aumento desproporcionado de la obesidad, lo que en última instancia condiciona el incremento exponencial de la ECV.
La DM2 tiene un sustrato fisiopatológico complejo y asocia diversos trastornos metabólicos, como la resistencia a la insulina, un estado inflamatorio sistémico crónico y un incremento del estrés oxidativo, determinantes a su vez en la progresión hacia la insuficiencia cardiaca (IC) y la ECV. En los últimos años, el estudio de nuevos fármacos antidiabéticos con un marcado beneficio cardiovascular está revolucionando el tratamiento de estos pacientes desde un punto de vista esencialmente glucocéntrico hacia un abordaje que incluye todo el espectro cardiometabólico.
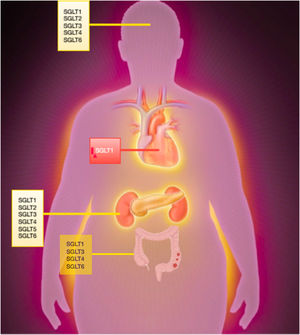
RECEPTORES DEL COTRANSPORTADOR DE SODIO-GLUCOSALos receptores del cotransportador de sodio-glucosa (SGLT, por sus siglas en inglés) pertenecen a la familia de correceptores SLC5 (solute carrier 5 family) integrada por 12 receptores diferentes. Todos ellos (excepto los SGLT3) están relacionados con el transporte activo de sodio y glucosa.
Los SGLT1-6 son los más importantes como transportadores de glucosa, siendo los receptos SGLT1 y SGLT2 los más estudiados. En condiciones fisiológicas, los SGLT2 son responsables aproximadamente del 90% de la reabsorción de glucosa a nivel renal (segmentos S1 y S2 del túbulo proximal). Los receptores SGLT1 (segmento S3) son responsables del 10% restante, encargándose además de la reabsorción de glucosa a nivel intestinal. En determinadas situaciones, como la DM incontrolada o la inhibición de SGLT2, el papel de los SGLT1 adquiere más relevancia en la reabsorción de glucosa a nivel renal.
El receptor SGLT1, al contrario que el SGLT2, tiene una mayor ubicuidad en el organismo. Está presente en el sistema nervioso central y el miocardio, especialmente en condiciones isquémicas.
Di Franco et al. comunicaron la sobreexpresión del receptor SGLT1 en corazones hipertróficos e isquémicos humanos2. También se ha descrito en otras situaciones, como en pacientes con miocardiopatía dilatada, síndrome metabólico o después del implante de asistencias ventriculares izquierdas. Si bien la ausencia total de SGLT1 es incompatible con la vida, las variantes genéticas que condicionan una menor expresión de este receptor parecen asociar ciertos beneficios. Estudios poblaciones han observado cómo una expresión atenuada de SGLT1 se asocia a una resistencia al daño tras isquemia/reperfusión y a un efecto protector sobre la DM y la IC. El uso de inhibidores selectivos del receptor SGLT1 atenúa parcialmente su actividad, lo que podría traer consigo igualmente un efecto protector.
El resto de los receptores de la misma familia se encargan de regular el transporte de mioinositol (SLC5A3 y SLC5A11), yodo (SLCE5A5), vitamina (SLC5A6), aminoácidos (SLC5A7) y monocarboxilato (SLC5A8 y SLC5A12) (figura 1).
INHIBIDORES DEL COTRANSPORTADOR DE SODIO-GLUCOSA TIPO 2Los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2), inicialmente desarrollados como agentes hipoglucemiantes, se han convertido en el cuarto pilar terapéutico en la IC. Los beneficios cardiovasculares se traducen en una reducción sólida de eventos cardiovasculares en pacientes con DM2 y a lo largo de todo el espectro de la IC (IC con fracción de eyección reducida y fracción de eyección conservada), independientemente de la DM, como se ha confirmado en un metanálisis reciente3.
Se constató inicialmente el beneficio cardiovascular independiente de su actividad hipoglucémica en nuestro ensayo de corte mecanístico EMPA-TROPISM4 (NCT03485222), que incluye exclusivamente pacientes no diabéticos con IC con fracción de eyección reducida. El estudio describió una mejora del remodelado adverso ventricular (reducción significativa de los volúmenes, espesores y esfericidad ventriculares, y con el consecuente incremento de la fracción de eyección) tras solo seis meses de tratamiento con empagliflozina.
Nuestros estudios sugieren que los iSGLT2 inducen un paradigma transcripcional de privación de nutrientes e hipoxia con aumento de la cetosis, así como una mejoría del metabolismo del hierro5. El uso selectivo de los cuerpos cetónicos como fuente de energía mejora la eficiencia energética en el miocardio. Estos fármacos también reducen el tejido adiposo epicárdico en pacientes con IC, y alteran la señalización de adipoquinas inflamatorias y oxidantes. Por último, tanto en modelos experimentales como clínicos, los iSGLT2 reducen la rigidez de los miofilamentos y la remodelación/fibrosis de la matriz extracelular en el corazón, lo que mejora la función diastólica6.
INHIBIDORES DUALES DEL COTRANSPORTADOR DE SODIO-GLUCOSA TIPOS 1 Y 2La sotagliflozina es el inhibidor más selectivo, pero no el único, con efecto sobre el receptor SGLT1. La sotagliflozina tiene una selectividad ×20 para SGLT2 en contraste con SGLT1, en comparación con ×2.500 para empagliflozina, ×1.200 para dapagliflozina y ×250 para canagliflozina7. Curiosamente, canagliflozina, el iSGLT2 con mayor impacto sobre SGLT1, ha demostrado recientemente efectos cardioprotectores, sobre todo a partir de la reducción del estrés oxidativo atribuido a su acción sobre el SGLT1 (corroborado previamente en el programa CANVAS con una marcada tendencia no estadísticamente significativa a la reducción de eventos aterotrombóticos)8.
Su acción intestinal implica directamente una reducción en la hiperglucemia posprandial, reconocido factor de riesgo para la IC. Esto se confirmó en estudios experimentales con modelos murinos, donde un inhibidor selectivo del SGLT1 mejoraba tanto los valores de glucemia posprandial como los de glucohemoglobina9. La inhibición de SGTL1 a nivel intestinal generará la llegada de más glucosa en el colon, lo que de esta forma estimulará la producción de péptido de tipo glucagón 1 (GLP-1) por parte del microbioma. El probable mecanismo asociado es la degradación de glucosa en ácidos grasos de cadena corta, estando implicados en la génesis y expresión indirecta de GLP-1.
Los beneficios cardiometabólicos observados en los estudios SOLOIST-WHF (NCT03521934)10 y SCORED (NCT03315143)11 con sotagliflozina han despertado el interés sobre los inhibidores duales del cotransportador de sodio-glucosa tipos 1 y 2 (iSGLT1-2), postulando que esta inhibición dual podría potenciar el beneficio de los inhibidores puros del SGLT2.
En el estudio SOLOIST-WHF realizado en pacientes con DM2 y descompensación reciente de IC, sotagliflozina iniciada antes o inmediatamente después del alta logró una reducción relativa del 33% en el objetivo primario de muerte cardiovascular, hospitalizaciones y visitas a urgencias por IC, y una reducción en hospitalizaciones por IC del 36%. No se observó reducción significativa en la mortalidad cardiovascular ni de otras causas. En el estudio SCORED en pacientes con DM2 y enfermedad renal crónica, con o sin albuminuria, sotagliflozina disminuyó un 26% el objetivo primario de muerte cardiovascular, hospitalización por IC o visita a urgencias por IC frente a placebo. Curiosamente, sotagliflozina es el primer agente dentro de este grupo de fármacos que reduce eventos aterotrombóticos, con una disminución en la incidencia de ictus e infarto agudo de miocardio (IAM) —mortal y no mortal— de más del 30%.
En Estados Unidos, la Food and Drug Administration recientemente ha aprobado sotagliflozina —al igual que el iSGLT2— para el tratamiento de pacientes con IC. Los resultados de estos dos estudios10,11 respaldaron esta polémica aprobación independientemente de la fracción de eyección, la enfermedad renal crónica e incluso el estatus glucémico, a pesar de no incluir pacientes diabéticos y contar con una mediana de seguimiento corta. El efecto de clase previsto (tabla 1) en este grupo, asociado con los resultados tan destacados descritos y con un efecto aterotrombótico ilusionante, compone las bases tanto de esta aprobación como probablemente de futuras (como por la Agencia Europea del Medicamento), así como de esperanzadores estudios en pacientes con IC.
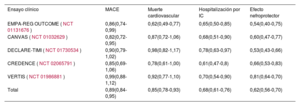
Efecto de clase del cotransportador de sodio-glucosa tipo 2
| Ensayo clínico | MACE | Muerte cardiovascular | Hospitalización por IC | Efecto nefroprotector |
|---|---|---|---|---|
| EMPA-REG OUTCOME (NCT 01131676) | 0,86(0,74-0,99) | 0,62(0,49-0,77) | 0,65(0,50-0,85) | 0,54(0,40-0,75) |
| CANVAS (NCT 01032629) | 0,82(0,72-0,95) | 0,87(0,72-1,06) | 0,68(0,51-0,90) | 0,60(0,47-0,77) |
| DECLARE-TIMI (NCT 01730534) | 0,90(0,79-1,02) | 0,98(0,82-1,17) | 0,78(0,63-0,97) | 0,53(0,43-0,66) |
| CREDENCE (NCT 02065791) | 0,85(0,69-1,06) | 0,78(0,61-1,00) | 0,61(0,47-0,8) | 0,66(0,53-0,83) |
| VERTIS (NCT 01986881) | 0,99(0,88-1,12) | 0,92(0,77-1,10) | 0,70(0,54-0,90) | 0,81(0,64-0,70) |
| Total | 0,89(0,84-0,95) | 0,85(0,78-0,93) | 0,68(0,61-0,76) | 0,62(0,56-0,70) |
IC: insuficiencia cardiaca; MACE: eventos cardiovasculares adversos mayores; NCT: National Clinical Trial.
Hasta ahora, los iSGLT2 no han reducido la incidencia de ictus o IAM, a pesar de la importancia de la prevención en pacientes con DM2. La reducción de biomarcadores inflamatorios, estrés oxidativo, obesidad visceral y presión arterial sistólica se ha asociado tradicionalmente en estudios epidemiológicos con una disminución de ictus. A pesar de ello, no se ha observado una reducción de ictus en pacientes con iSGLT2. El incremento en la producción de eritropoyetina, con el aumento del hematocrito y de la viscosidad sanguínea, podría tener un papel en este contexto.
Los metanálisis más recientes12 describen una modesta reducción (aproximadamente del 10%) de los iSGLT2 en la incidencia de IAM. Algunos estudios en modelos porcinos han descrito una disminución en el tamaño del IAM basada fundamentalmente en menor apoptosis y estrés oxidativo en modelos tratados con empagliflozina4. Sin embargo, conviene señalar que esta disminución está básicamente relacionada con la reducción en las demandas de oxígeno a nivel miocárdico, sin existir un efecto directo sobre la ateroesclerosis.
Los iSGLT1-2, en cambio, han mostrado hallazgos prometedores. El estudio SCORED, como ya hemos subrayado, demostró una reducción significativa en riesgo de IAM y de ictus con sotagliflozina. Los mecanismos asociados con el desarrollo de IAM e ictus en diabéticos son múltiples (resistencia a insulina, calcificación vascular, disfunción endotelial, estado inflamatorio, etc.); por tanto, el conocimiento de los mecanismos responsables de la reducción de IAM e ictus con iSGLT1-2 es escaso.
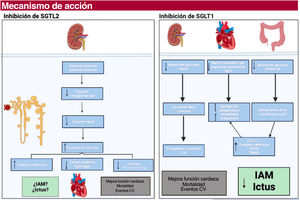
Se han postulado múltiples mecanismos de acción para explicar sus beneficios (figura 2):
- •
La inhibición dual de SGLT1-2 está asociada con un aumento del GLP-1 endógeno. Este aumento de GLP-1 está relacionado en estudios preclínicos con estabilización de placa y enlentecimiento del crecimiento trombótico13.
- •
La alteración del microbioma como resultado de la inhibición del SGLT1 es fundamental. Existe una disminución de los valores de ácidos grasos de cadena corta a nivel intestinal en pacientes con obesidad, DM2, estatus inflamatorios o pacientes con IC. Esto provoca un posterior incremento de bacterias y producción de lipopolisacáridos, altamente asociados con alteraciones de la coagulación12.
- •
El microbioma también produce el metabolito TMAO (n-óxido de trimetilamina), asociado con un aumento del riesgo cardiovascular. La disminución de su producción en contexto de iSGLT1-2 podría ser clave13.
- •
La sobreproducción de cuerpos cetónicos provocada con la inhibición de los SGLT1-2 está relacionada directamente con una optimización del consumo energético por parte del miocardio, y podría tener un papel acompañante5.
Inhibidores selectivos del cotransportador de sodio-glucosa tipo 1 (SGLT1) y 2 (SGLT2), y sus posibles mecanismos de acción. CV: cardiovascular; GLP-1: péptido de tipo glucagón 1; IAM: infarto agudo de miocardio; Na: sodio; PA: presión arterial; ROS: estrés oxidativo; SCFA: ácidos grasos de cadena corta; SGLT: cotransportador de sodio-glucosa; TMAO: n-óxido de trimetilamina.
Entre las limitaciones de estos fármacos quizá la principal sea la relativa menor experiencia que existe con ellos. En los 2 estudios más potentes10,11, la media de exposición con iSGLT1-2 fue de 14.112 pacientes-año, comparado con los 39.798 pacientes-año de los estudios con iSGLT2. A su vez, la duración del tratamiento en IC es llamativamente menor en pacientes con sotagliflozina (917 pacientes-año con sotagliflozina frente a 21.602 o 18.214 pacientes-año con dapagliflozina y empagliflozina respectivamente).
Los efectos adversos son superponibles a los iSGLT2. Las infecciones micóticas genitales son el efecto adverso más común, y el riesgo tanto de hipoglucemia como de acidosis diabética es mínimo. Sin embargo, estos datos están descritos en pacientes diabéticos, sin conocer exactamente su tolerancia en no diabéticos.
OTROS RECEPTORES DEL COTRANSPORTADOR DE SODIO-GLUCOSAAunque el conocimiento del resto de los receptores es escaso14, podemos resumir algunos aspectos:
- •
SGLT3. Está ubicado esencialmente en el sistema nervioso autónomo a nivel del aparato digestivo y actúa como sensor glucémico. Su expresión está reducida en la obesidad y quizá pueda tener un papel en el síndrome metabólico. Existen SGLT2 (dapagliflozina, ertugliflozina y sergliflozina etabonato) capaces de influir en la expresión cerebral de SGLT3. Se desconoce hasta el momento su implicación clínica.
- •
SGTL4. Es principalmente un transportador de manosa. Está principalmente localizado en el intestino delgado, riñón, cerebro e hígado. Se ha relacionado con la patogénesis de la retinopatía diabética proliferativa, con escaso conocimiento de sus implicaciones terapéuticas.
- •
SGLT5. Se expresa a nivel del túbulo proximal. Al igual que SGLT3, contribuye a la absorción de fructosa. Se ha relacionado con alteraciones del metabolismo lipídico.
- •
SGLT6. Es un transportador de mioinositol. Está expresado principalmente a nivel renal. Se ha detectado su relación en enfermedades autoinmunes y psiquiátricas.
Los nuevos agentes terapéuticos iSGLT2, los iSGLT1-2, así como los agonistas del receptor GLP-1, han demostrado de manera individualizada que alcanzan objetivos metabólicos más allá del control glucémico. Su efecto biológico parece actuar a través de mecanismos de acción complementarios. La inhibición del receptor SGLT1, ampliamente distribuido en el organismo, podría potenciar el beneficio de los iSGLT2, especialmente con su relación a nivel intestinal en la producción de GLP-1. De esta forma, el estudio comparativo de estos fármacos abre nuevas y prometedoras vías de investigación clínica en el futuro. También es interesante el estudio de la combinación simultánea o secuencial de los inhibidores SGLT (selectivos o duales) con los agonistas del receptor GLP-1, principalmente en pacientes con alto riesgo cardiovascular.
Finalmente, la presencia de estos receptores a nivel cerebral y el impacto descrito sobre los ictus ofrecen nuevas oportunidades de investigación. Tanto el SGLT1 como el SGLT2 están expresados en el sistema nervioso central, siendo responsables del transporte de glucosa, galactosa y sodio. Hasta ahora, solo estudios experimentales en modelos murinos sugieren que, después de una lesión cerebral, el bloqueo de SGLT1 está asociado a una menor área de lesión y un menor edema, e incluso con una mejora cognitiva15. Este posible efecto neuroprotector avalará nuevos retos en este campo.
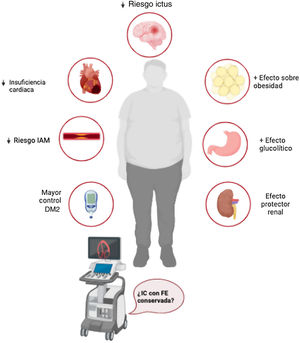
APLICACIÓN CLÍNICAMientras que el mecanismo de acción tanto de iSGLT2 como de iSGLT1-2 en IC continúa siendo un interrogante, su acción sobre el remodelado ventricular, grasa epicárdica, rigidez vascular, fibrosis o estatus inflamatorio, conocidos determinantes de la disfunción diastólica, les podría otorgar un rol perfilado a un grupo de pacientes: la IC con fracción de eyección conservada. Esto, sumado al papel aterotrombótico descrito (ictus e IAM), su mayor efecto glucolítico y su efecto sobre la función renal (estudio SCORED), les promete protagonismo en pacientes con alto y muy alto riesgo cardiovascular (especialmente en pacientes con DM2, obesidad y enfermedad renal crónica), tanto en prevención primaria como secundaria, incluso por delante de iSGTL2. El estudio SOTA-P-CARDIA (NCT05562063) evaluará la eficacia y mecanismo de sotagliflozina en pacientes con IC con fracción de eyección conservada no diabéticos e intentará dar respuesta a dichos interrogantes (figura 3).
En resumen, sotagliflozina es el primer inhibidor con un mecanismo de acción dual sobre el SGLT1 y SGTL2 en demostrar un claro beneficio cardiovascular. Los prometedores resultados con este fármaco han despertado el interés por la inhibición de ambos receptores y cómo puede contribuir (o potenciar) el beneficio cardiovascular de los iSGLT2. Su potencial beneficio añadido sobre ictus e IAM en pacientes con alto riesgo cardiovascular los postulan como actores principales en el tratamiento de estos o en pacientes con ECV establecida.
FINANCIACIÓNNinguna.
CONFLICTO DE INTERESESSin conflicto de intereses.