Los niveles circulantes de la proteína de unión del factor de crecimiento de tipo insulina 2 (IGFBP2) aumentan en la insuficiencia renal crónica (IRC), y se asocian con un mayor riesgo de mortalidad en la miocardiopatía dilatada. Dado que la IRC se asocia con una mayor mortalidad en la insuficiencia cardiaca (IC), hemos investigado si, en pacientes con IC de distinta etiología, IGFBP2 se asocia con la IRC, y si la IRC modifica el valor pronóstico de esta proteína.
MétodosSe estudiaron pacientes con IC (n=686, edad media 66,6 años, 32,7% mujeres) durante 3,5 años (min-máx: 0,1-6 años). Los pacientes se clasificaron como IRC con una tasa de filtrado glomerular estimada disminuida (TFGe <60ml/min/1,73 m2) y como pacientes con TFGe ≥ 60ml/min/1,73 m2. IGFBP2 se determinó en suero mediante ELISA.
ResultadosLa IGFBP2 sérica estaba aumentada (p <0,001) en los pacientes con IRC y TFGe <60ml/min/1,73 m2 (n=290, 42,3%), comparados con aquellos con TFGe ≥ 60 ml/min/1,73 m2. IGFBP2 se asociaba directamente con el NT-proBNP e inversamente con la TFGe (p <0,001), independientemente de factores confundentes. Además, IGFBP2 se asociaba directa e independientemente con la mortalidad cardiovascular y por cualquier causa (p <0,001) en todos los pacientes, mostrando en los pacientes con IRC y TFGe <60ml/min/1,73 m2 mayor asociación con muerte cardiovascular (p interacción <0,05) y valor pronóstico añadido sobre factores de riesgo relevantes.
ConclusionesLos niveles séricos de IGFBP2 se asocian con un empeoramiento de la función renal en pacientes con IC y con un mayor riesgo de muerte cardiovascular, principalmente en los pacientes con IC y IRC con una TFGe disminuida.
Palabras clave
La enfermedad renal crónica (ERC) tiene gran prevalencia en la insuficiencia cardiaca (IC) y se asocia con un mayor riesgo de mortalidad y eventos cardiovasculares1,2. La presencia de uno de estos trastornos tiene una notable influencia en el otro, debido a las interacciones recíprocas existentes entre el riñón y el corazón, que no se conocen por completo3. A este respecto, tal como se ha señalado recientemente, se ha propuesto la evaluación fenotípica basada en el empleo de biomarcadores, entre otros instrumentos, para mejorar el conocimiento de la interrelación entre los 2 trastornos y desarrollar estrategias óptimas para detectarlos, prevenirlos, diagnosticarlos y tratarlos4. Sin embargo, la evidencia que respalda el uso de los biomarcadores actuales es todavía escasa y se han hecho pocos avances en la identificación de nuevos biomarcadores circulantes que sean útiles para la estratificación del riesgo de los pacientes con IC y ERC5.
Las hormonas reguladoras que forman parte del sistema del factor de crecimiento insulínico (IGF) se han relacionado tanto con enfermedades renales como con enfermedades cardiacas. Concretamente, los resultados de los estudios renales ponen de manifiesto una disminución de las concentraciones séricas de IGF-1 en los pacientes con ERC6, así como una asociación entre los valores bajos de IGF-1 y un mayor riesgo de mortalidad en esos pacientes7. Además, la baja concentración sérica de IGF-1 se asocia con un riesgo superior de mortalidad por cualquier causa en los pacientes con IC crónica8. Es de destacar que como mínimo un 98% del IGF-1 circulante está unido a proteínas de unión al IGF (IGFBP), y que la proteína 2 de unión al factor insulinoide de crecimiento (IGFBP2) es una de las proteínas de esta familia más abundantes en la sangre9. Así pues, la bioactividad del IGF-1 se ve influida directamente por el perfil de la IGFBP, puesto que un exceso de IGFBP2 puede reducir la disponibilidad de IGF-1 libre para sus receptores diana9,10. En este contexto, se ha observado que la IGFBP2 circulante está aumentada en los pacientes con ERC11-14 y en los pacientes con IC, y muestra una asociación con un riesgo superior de mortalidad en los pacientes con miocardiopatía dilatada15.
Teniendo en cuenta todo lo anterior, se plantea la hipótesis de que las concentraciones de IGF-1 e IGFBP2 circulantes pueden estar influidas por la ERC en los pacientes con IC y pueden tener utilidad pronóstica, en especial en los pacientes que presentan ambos trastornos. Así pues, este estudio se diseñó para determinar lo siguiente: en primer lugar, si las concentraciones de IGF-1 e IGFBP2 circulantes muestran una asociación con la ERC en los pacientes con IC; en segundo lugar, si estas proteínas circulantes predicen la mortalidad (de causa cardiovascular o por cualquier causa) en estos pacientes, y en tercer lugar, si la presencia de ERC modifica la asociación de estas proteínas con el riesgo de muerte de causa cardiovascular y de muerte por cualquier causa en los pacientes con IC.
MÉTODOSTodos los participantes dieron su consentimiento informado por escrito para participar en el estudio, y los protocolos del estudio fueron aprobados por los comités de ética de investigación de los centros (comités de ética de investigación clínica del Hospital Universitario de Donostia y del Hospital Universitari Germans Trias i Pujol, España). El estudio se atuvo a los principios de la Declaración de Helsinki de 1975, modificados en 1983.
Población del estudioEntre 2002 y 2010 se incluyó a los pacientes consecutivos de 2 unidades multidisciplinarias de IC del Servicio de Cardiología del Hospital Universitario de Donostia (San Sebastián, España) y el Servicio de Cardiología del Hospital Universitari Germans Trias i Pujol (Badalona, España). Formaron la población del estudio 686 pacientes (media de edad, 66,6 [intervalo, 21-96] años; mujeres el 32,7%) y el criterio principal de inclusión fue la presencia de IC según las directrices de la Sociedad Europea de Cardiología, con independencia de su etiología, junto con la existencia de al menos 1 hospitalización por IC y/o una fracción de eyección del ventrículo izquierdo (FEVI) reducida16,17. La mediana de tiempo transcurrido desde el diagnóstico de la IC hasta la inclusión en el estudio fue 8,0 [intervalo intercuartílico, 2,0-45,7] meses.
Se obtuvieron muestras de sangre de la vena antecubital en el momento de la inclusión en el estudio; se conservaron en hielo durante un máximo de 1-2 h antes de su procesamiento, se distribuyeron en alícuotas y se conservaron a −80°C hasta el momento de la determinación. Además, las muestras se analizaron por lotes, con objeto de reducir al mínimo las diferencias debidas al procesado y la conservación de las muestras.
Objetivos del estudioEl objetivo principal del estudio fue la mortalidad de causa cardiovascular y el objetivo secundario, la mortalidad por cualquier causa. Puede consultarse información complementaria en el .
Análisis bioquímicosLas concentraciones séricas de IGF-1, IGFBP2, fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) y troponina T de alta sensibilidad (TnTas) se determinaron mediante ELISA. Las concentraciones séricas de creatinina se analizaron con el método CREA y la tasa de filtrado glomerular estimada (TFGe) se calculó con la ecuación de creatinina de la Chronic Kidney Disease Epidemiology Collaboration 2009 (CKD-EPI)18. La presencia de ERC se estableció por una disminución de la TFGe (es decir, <60ml/min/1,73 m2)19. Para más información, véase el .
Análisis estadísticoLos análisis se realizaron en todos los pacientes y también en los pacientes clasificados según la ausencia o presencia de ERC con disminución de la TFGe. Se demostró la normalidad de la distribución mediante las pruebas de Shapiro-Wilks o de Kolmogorov-Smirnov. Las variables de distribución no normal se examinaron tras una transformación logarítmica. Se elaboraron modelos de regresión lineal multivariables, con ajustes respecto a las covariables que eran significativas en los análisis univariables. Se determinaron los valores de corte óptimos para predecir los resultados de interés mediante un análisis de la curva de características operativas del receptor (ROC), seguido del cálculo del estadígrafo J de Younden.
Se estimó la incidencia acumulada de mortalidad por cualquier causa con el método de Kaplan-Meier, y se evaluaron las diferencias sin ajustar mediante log-rank test. Se utilizaron modelos de regresión de Cox univariables y multivariables o de riesgos competitivos (Fine-Gray) con un ajuste para la muerte de causa no cardiovascular para calcular la hazard ratio (HR) o la sub-hazard ratio (SHR) y los correspondientes intervalos de confianza del 95% (IC95%) del riesgo de muerte por cualquier causa o de muerte de causa cardiovascular respectivamente. Los pacientes que no habían presentado el resultado evaluado fueron censurados para el análisis en la fecha del último seguimiento. Para determinar si la asociación de la IGFBP2 y el IGF-1 con los resultados de interés difería en función de la presencia de una ERC con disminución de la TFGe, se realizaron análisis de interacción cuantitativos con análisis de regresión de Cox o de riesgos competitivos en modelos en los que se incluyó la IGFBP2 o el IGF-1 como variables continuas, la ERC con disminución de la TFGe (sí/no) y sus respectivos términos de interacción. Se realizaron, además, análisis de interacción cualitativos mediante análisis de regresión de Cox o de riesgos competitivos en modelos que incluían la IGFBP-1 o el IGF-1 (≤ o > valor de corte determinado mediante los análisis de ROC), la ERC con disminución de la TFGe (sí/no) y sus respectivos términos de interacción.
Las características basales consideradas covariables se identificaron como significativas en análisis de Cox y de regresión de riesgos competitivos univariables de la mortalidad de causa cardiovascular y la mortalidad por cualquier causa respectivamente (), seguidos de una selección escalonada retrógrada con minimización del criterio de información de Akaike y fijando el valor de p en 0,15 para la eliminación. En los pacientes sin disminución de la TFGe, las covariables seleccionadas se incluyeron en 3 modelos diferentes, dado el bajo número de resultados de muerte de causa cardiovascular. En los pacientes con ERC y disminución de la TFGe, se eligió un primer modelo según el método previo y se consideró también un segundo modelo que incluía las covariables de interés clínico que eran significativas en los análisis univariables.
El valor adicional de la combinación de biomarcadores para la predicción del riesgo de los resultados de interés se evaluó con el estadígrafo c de Harrell y con los índices de discriminación integrada (IDI) y de reclasificación neta (IRN) continuos. Las estimaciones del estadígrafo c de Harrell se hicieron con el programa Stata somersd. La varianza de la estimación del IRN y la del IDI se calcularon mediante remuestreo (bootstrapping) (1.000 remuestras).
Los valores expresan media ± desviación estándar o mediana [intervalo intercuartílico], y las variables cualitativas se expresan mediante número y porcentaje. Se calcularon errores estándares robustos mediante la opción vce(cluster center) de Stata, teniendo en cuenta el efecto de agrupación debido a la inclusión de pacientes en 2 unidades multidisciplinarias de IC diferentes. La significación estadística se estableció en un valor bilateral de p de 0,05. Los análisis estadísticos se realizaron con los programas SPSS (versión 15.0) y STATA (versión 12.1).
Para más información, véase la sección de análisis estadístico del .
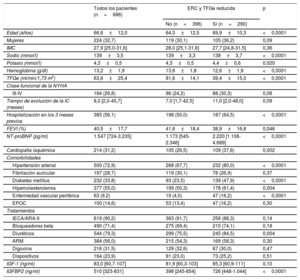
RESULTADOSCaracterísticas de los pacientesLa población de pacientes la formaron 686 pacientes, con una media de edad de 66,6 (intervalo, 21-96) años, mujeres el 32,7%. En la tabla 1 se muestran las características clínicas y ecocardiográficas de todos los pacientes con IC y de los pacientes clasificados en los 2 grupos: pacientes con ERC definida por la disminución de la TFGe (es decir, <60ml/min/1,73 m2) (n=290) y pacientes sin disminución de la TFGe (es decir, ≥ 60ml/min/1,73 m2) (n=396). En comparación con los pacientes sin disminución de la TFGe, los pacientes con ERC eran de más edad, tenían mayores concentraciones séricas de sodio y hemoglobina y una FEVI reducida y mostraban valores aumentados de potasio sérico y NT-proBNP y mayores tasas de hospitalización en los 3 meses previos, cardiopatía isquémica, hipertensión, diabetes mellitus, hipercolesterolemia, enfermedad vascular periférica y tratamiento con diuréticos (tabla 1).
Características clínicas de los pacientes con insuficiencia cardiaca clasificados según la ausencia o presencia de ERC con disminución basal de la TFGe (< 60ml/min/1,73 m2)
| Todos los pacientes (n=686) | ERC y TFGe reducida | p | ||
|---|---|---|---|---|
| No (n=396) | Sí (n=290) | |||
| Edad (años) | 66,6±12,0 | 64,3±12,5 | 69,9±10,3 | <0,0001 |
| Mujeres | 224 (32,7) | 119 (30,1) | 105 (36,2) | 0,09 |
| IMC | 27,9 [25,0-31,6] | 28,0 [25,1-31,6] | 27,7 [24,8-31,5] | 0,36 |
| Sodio (mmol/l) | 139±3,5 | 139±3,3 | 138±3,7 | <0,0001 |
| Potasio (mmol/l) | 4,3±0,5 | 4,3±0,5 | 4,4±0,6 | 0,020 |
| Hemoglobina (g/dl) | 13,2±1,9 | 13,6±1,8 | 12,6±1,9 | <0,0001 |
| TFGe (ml/min/1,73 m2) | 63,8±25,4 | 81,6±14,1 | 39,4±15,0 | <0,0001 |
| Clase funcional de la NYHA | ||||
| III-IV | 184 (26,8) | 96 (24,2) | 88 (30,3) | 0,08 |
| Tiempo de evolución de la IC (meses) | 8,0 [2,0-45,7] | 7,0 [1,7-42,5] | 11,0 [2,0-48,0] | 0,09 |
| Hospitalización en los 3 meses previos | 385 (56,1) | 198 (50,0) | 187 (64,5) | <0,0001 |
| FEVI (%) | 40,5±17,7 | 41,6±18,4 | 38,9±16,8 | 0,046 |
| NT-proBNP (pg/ml) | 1.547 [724-3.235] | 1.173 [545-2.346] | 2.220 [1.108-4.689] | <0,0001 |
| Cardiopatía isquémica | 214 (31,2) | 105 (26,5) | 109 (37,6) | 0,002 |
| Comorbilidades | ||||
| Hipertensión arterial | 500 (72,9) | 268 (67,7) | 232 (80,0) | <0,0001 |
| Fibrilación auricular | 197 (28,7) | 119 (30,1) | 78 (26,9) | 0,37 |
| Diabetes mellitus | 232 (33,8) | 93 (23,5) | 139 (47,9) | <0,0001 |
| Hipercolesterolemia | 377 (55,0) | 199 (50,3) | 178 (61,4) | 0,004 |
| Enfermedad vascular periférica | 63 (9,2) | 19 (4,0) | 47 (16,2) | <0,0001 |
| EPOC | 100 (14,6) | 53 (13,4) | 47 (16,2) | 0,30 |
| Tratamientos | ||||
| IECA/ARA-II | 619 (90,2) | 363 (91,7) | 256 (88,3) | 0,14 |
| Bloqueadores beta | 490 (71,4) | 275 (69,4) | 215 (74,1) | 0,18 |
| Diuréticos | 544 (79,3) | 299 (75,5) | 245 (84,5) | 0,004 |
| ARM | 384 (56,0) | 215 (54,3) | 169 (58,3) | 0,30 |
| Digoxina | 216 (31,5) | 129 (32,6) | 87 (30,0) | 0,47 |
| Dispositivos | 164 (23,9) | 91 (23,0) | 73 (25,2) | 0,51 |
| IGF-1 (ng/ml) | 83,0 [60,7-107] | 81,9 [60,3-103] | 85,3 [60,9-111] | 0,10 |
| IGFBP2 (ng/ml) | 510 [323-831] | 398 [245-654] | 726 [448-1.044] | <0,0001 |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; IGF: factor de crecimiento insulínico; IGFBP2: proteína 2 de unión al factor insulinoide de crecimiento; IMC: índice de masa corporal; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; TFGe: tasa de filtrado glomerular estimada.
Las variables cuantitativas se expresan en forma de media±desviación estándar o mediana [intervalo intercuartílico]. Las variables cualitativas se expresan como n (%).
Los valores séricos de IGF-1 fueron similares en los 2 grupos, pero los de IGFBP2 en suero fueron mayores en los pacientes con ERC y disminución de la TFGe que en aquellos sin disminución de la TFGe (tabla 1).
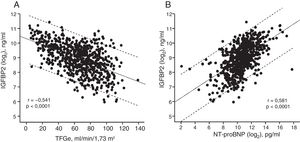
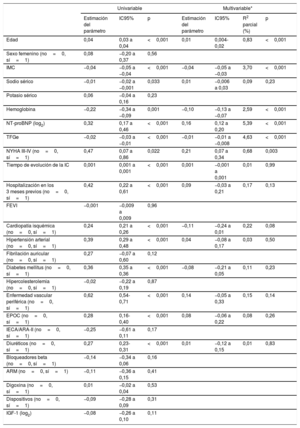
Análisis de las asociacionesEn el total de pacientes, la IGFBP2 mostró una correlación inversa con la TFGe (figura 1A) y una correlación directa con la NT-proBNP (figura 1B). Los análisis de regresión múltiple que se muestran en la tabla 2 mostraron que la TFGe y la NT-proBNP eran factores predictivos del aumento de la IGFBP2 con independencia de las características de edad, índice de masa corporal, sodio sérico, hemoglobina, clase funcional de la New York Heart Association (NYHA), el tiempo de evolución de la IC, la hospitalización en los 3 meses previos y la presencia de cardiopatía isquémica, hipertensión, diabetes mellitus, enfermedad vascular periférica, enfermedad pulmonar obstructiva crónica y tratamiento con diuréticos. Tiene interés señalar que, de entre las variables antes mencionadas, la TFGe y la NT-proBNP eran las que explicaban un mayor porcentaje de la varianza de la IGFBP2 (tabla 2).
Gráficos de regresión lineal entre la tasa de filtrado glomerular estimada (TFGe) y la concentración de proteína 2 de unión al factor insulinoide de crecimiento (IGFBP2) (log2) (y=10,3-0,02x) (A) y entre la concentración de la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) (log2) y la IGFBP2 (log2) (y=0,32x-5,62) (B) en el total de pacientes con insuficiencia cardiaca. Las líneas discontinuas corresponden a los límites de predicción del 95%.
Análisis de regresión lineal univariable y multivariable para la asociación de la IGFBP2 (log2) con las variables clínicas
| Univariable | Multivariable* | ||||||
|---|---|---|---|---|---|---|---|
| Estimación del parámetro | IC95% | p | Estimación del parámetro | IC95% | R2 parcial (%) | p | |
| Edad | 0,04 | 0,03 a 0,04 | <0,001 | 0,01 | 0,004-0,02 | 0,83 | <0,001 |
| Sexo femenino (no=0, sí=1) | 0,08 | −0,20 a 0,37 | 0,56 | ||||
| IMC | −0,04 | −0,05 a −0,04 | <0,001 | −0,04 | −0,05 a −0,03 | 3,70 | <0,001 |
| Sodio sérico | −0,01 | −0,02 a −0,001 | 0,033 | 0,01 | −0,006 a 0,03 | 0,09 | 0,23 |
| Potasio sérico | 0,06 | −0,04 a 0,16 | 0,23 | ||||
| Hemoglobina | −0,22 | −0,34 a −0,09 | 0,001 | −0,10 | −0,13 a −0,07 | 2,59 | <0,001 |
| NT-proBNP (log2) | 0,32 | 0,17 a 0,46 | <0,001 | 0,16 | 0,12 a 0,20 | 5,39 | <0,001 |
| TFGe | −0,02 | −0,03 a −0,01 | <0,001 | −0,01 | −0,01 a −0,008 | 4,63 | <0,001 |
| NYHA III-IV (no=0, sí=1) | 0,47 | 0,07 a 0,86 | 0,022 | 0,21 | 0,07 a 0,34 | 0,68 | 0,003 |
| Tiempo de evolución de la IC | 0,001 | 0,001 a 0,001 | <0,001 | 0,001 | −0,001 a 0,001 | 0,01 | 0,99 |
| Hospitalización en los 3 meses previos (no=0, sí=1) | 0,42 | 0,22 a 0,61 | <0,001 | 0,09 | −0,03 a 0,21 | 0,17 | 0,13 |
| FEVI | −0,001 | −0,009 a 0,009 | 0,96 | ||||
| Cardiopatía isquémica (no=0, sí=1) | 0,24 | 0,21 a 0,26 | <0,001 | −0,11 | −0,24 a 0,01 | 0,22 | 0,08 |
| Hipertensión arterial (no=0, sí=1) | 0,39 | 0,29 a 0,48 | <0,001 | 0,04 | −0,08 a 0,17 | 0,03 | 0,50 |
| Fibrilación auricular (no=0, sí=1) | 0,27 | −0,07 a 0,60 | 0,12 | ||||
| Diabetes mellitus (no=0, sí=1) | 0,36 | 0,35 a 0,36 | <0,001 | −0,08 | −0,21 a 0,05 | 0,11 | 0,23 |
| Hipercolesterolemia (no=0, sí=1) | −0,02 | −0,22 a 0,19 | 0,87 | ||||
| Enfermedad vascular periférica (no=0, sí=1) | 0,62 | 0,54-0,71 | <0,001 | 0,14 | −0,05 a 0,33 | 0,15 | 0,14 |
| EPOC (no=0, sí=1) | 0,28 | 0,16-0,40 | <0,001 | 0,08 | −0,06 a 0,22 | 0,08 | 0,26 |
| IECA/ARA-II (no=0, sí=1) | −0,25 | −0,61 a 0,11 | 0,17 | ||||
| Diuréticos (no=0, sí=1) | 0,27 | 0,23-0,31 | <0,001 | 0,01 | −0,12 a 0,15 | 0,01 | 0,83 |
| Bloqueadores beta (no=0, sí=1) | −0,14 | −0,34 a 0,06 | 0,16 | ||||
| ARM (no=0, sí=1) | −0,11 | −0,36 a 0,15 | 0,41 | ||||
| Digoxina (no=0, sí=1) | 0,01 | −0,02 a 0,04 | 0,53 | ||||
| Dispositivos (no=0, sí=1) | −0,09 | −0,28 a 0,09 | 0,31 | ||||
| IGF-1 (log2) | −0,08 | −0,26 a 0,10 | 0,11 | ||||
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; IGF: factor de crecimiento insulínico; IGFBP2: proteína 2 de unión al factor insulinoide de crecimiento; IMC: índice de masa corporal; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: clase funcional de la New York Heart Association; TFGe: tasa de filtrado glomerular estimada.
Por otro lado, la concentración de IGF-1 circulante mostró una asociación con los parámetros edad, sexo femenino, clase de la NYHA, hospitalización en los 3 meses previos y tratamiento con bloqueadores beta y digoxina (). Sin embargo, esta proteína no mostró asociaciones univariables con la TFGe ni con la NT-proBNP ().
Análisis de supervivenciaDurante una mediana de seguimiento de 3,5 (intervalo, 0,1-6) años, se produjo la muerte por causa cardiovascular de 98 pacientes (14,3%) y la muerte por cualquier causa de 177 (25,8%). En los pacientes sin disminución de la TFGe, la muerte de causa cardiovascular y la muerte por cualquier causa se dieron en 36 (9,1%) y 83 (21,0%) pacientes. En el grupo de ERC, la muerte de causa cardiovascular y la muerte por cualquier causa se dieron en 62 (21,4%) y 94 (32,4%) pacientes. En los análisis longitudinales se observó que los pacientes con ERC (y disminución de la TFGe) tenían unos riesgos de muerte de causa cardiovascular y de muerte por cualquier causa superiores que los demás pacientes sin disminución de la TFGe ().
Los análisis de regresión de Cox y de riesgos competitivos multivariables mostraron que, mientras que el aumento de la IGFBP2 y la disminución del IGF-1 se asociaban con la mortalidad por cualquier causa de manera independiente en un modelo basal que incluía los factores edad, índice de masa corporal, clase de la NYHA, TFGe, NT-proBNP (log2), hemoglobina, enfermedad pulmonar obstructiva crónica, diabetes mellitus y enfermedad vascular periférica, tan solo la IGFBP2 se asociaba con la mortalidad de causa cardiovascular de modo independiente de los parámetros edad, clase de la NYHA, TFGe, NT-proBNP (log2), hemoglobina, enfermedad pulmonar obstructiva crónica, miocardiopatía isquémica y tratamiento con diuréticos (tabla 3). Sin embargo, no se observó una mejora pronóstica significativa con la IGFBP2 añadida a cualquiera de los modelos basales considerados en los análisis de discriminación y reclasificación de IDI. No obstante, la IGFBP2 mejoró la discriminación de ambos resultados según los valores de IRN (p ≤ 0,05) (tabla 3).
Asociaciones de las concentraciones de IGF-1 e IGFBP2 con los resultados de interés y valor predictivo que se agraga
| IGF-1 (log2) | IGFBP2 (log2) | |||||
|---|---|---|---|---|---|---|
| Valor | IC95% | p | Valor | IC95% | p | |
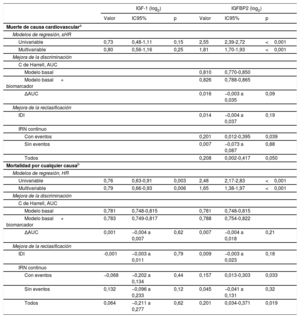
| Muerte de causa cardiovasculara | ||||||
| Modelos de regresión, sHR | ||||||
| Univariable | 0,73 | 0,48-1,11 | 0,15 | 2,55 | 2,39-2,72 | <0,001 |
| Multivariable | 0,80 | 0,56-1,16 | 0,25 | 1,81 | 1,70-1,93 | <0,001 |
| Mejora de la discriminación | ||||||
| C de Harrell, AUC | ||||||
| Modelo basal | 0,810 | 0,770-0,850 | ||||
| Modelo basal + biomarcador | 0,826 | 0,788-0,865 | ||||
| ΔAUC | 0,016 | −0,003 a 0,035 | 0,09 | |||
| Mejora de la reclasificación | ||||||
| IDI | 0,014 | −0,004 a 0,037 | 0,19 | |||
| IRN continuo | ||||||
| Con eventos | 0,201 | 0,012-0,395 | 0,039 | |||
| Sin eventos | 0,007 | −0,073 a 0,087 | 0,88 | |||
| Todos | 0,208 | 0,002-0,417 | 0,050 | |||
| Mortalidad por cualquier causab | ||||||
| Modelos de regresión, HR | ||||||
| Univariable | 0,76 | 0,63-0,91 | 0,003 | 2,48 | 2,17-2,83 | <0,001 |
| Multivariable | 0,79 | 0,66-0,93 | 0,006 | 1,65 | 1,38-1,97 | <0,001 |
| Mejora de la discriminación | ||||||
| C de Harrell, AUC | ||||||
| Modelo basal | 0,781 | 0,748-0,815 | 0,781 | 0,748-0,815 | ||
| Modelo basal + biomarcador | 0,783 | 0,749-0,817 | 0,788 | 0,754-0,822 | ||
| ΔAUC | 0,001 | −0,004 a 0,007 | 0,62 | 0,007 | −0,004 a 0,018 | 0,21 |
| Mejora de la reclasificación | ||||||
| IDI | -0,001 | −0,003 a 0,011 | 0,79 | 0,009 | −0,003 a 0,023 | 0,18 |
| IRN continuo | ||||||
| Con eventos | −0,068 | −0,202 a 0,134 | 0,44 | 0,157 | 0,013-0,303 | 0,033 |
| Sin eventos | 0,132 | −0,096 a 0,233 | 0,12 | 0,045 | −0,041 a 0,131 | 0,32 |
| Todos | 0,064 | −0,211 a 0,277 | 0,62 | 0,201 | 0,034-0,371 | 0,019 |
AUC: área bajo la curva de características operativas del receptor; HR: hazard ratio; IC95%: intervalo de confianza del 95%; IDI: índice de discriminación integrado; IGF: factor de crecimiento insulínico; IGFBP2: proteína 2 de unión al factor insulinoide de crecimiento; IRN: índice de reclasificación neta; sHR: sub-hazard ratio.
Los valores de HR y sHR corresponden a la magnitud del efecto para el aumento al doble del IGF-1 y la IGFBP2 séricos.
Modelo inicial: edad, clase funcional de la New York Heart Association, tasa de filtrado glomerular estimada, fracción aminoterminal del propéptido natriurético cerebral (log2), hemoglobina, enfermedad pulmonar obstructiva crónica, miocardiopatía isquémica y tratamiento con diuréticos. En el modelo final, n = 684.
Modelo basal: edad, índice de masa corporal, clase funcional de la New York Heart Association, tasa de filtrado glomerular estimada, fracción aminoterminal del propéptido natriurético cerebral (log2), hemoglobina, enfermedad pulmonar obstructiva crónica, diabetes mellitus y enfermedad vascular periférica. En el modelo final, n = 683.
Los valores de corte de la IGFBP2 y el IGF-1 para la predicción de la muerte de causa cardiovascular y la muerte por cualquier causa se calcularon con análisis ROC del total de pacientes (). Con la aplicación de esos umbrales, se clasificó a 237 pacientes (34,5%) en el subgrupo de IGFBP2 alta y 316 (46,1%) en el subgrupo de IGF-1 bajo. Se realizaron análisis de interacción para determinar si las asociaciones entre el IGF-1 o la IGFBP2 y los resultados de interés podían verse influidos por la presencia de ERC (con disminución de la TFGe), considerando las concentraciones de estas proteínas como variables continuas o cualitativas (> o < valor de corte determinado en los análisis ROC) en análisis cuantitativos y cualitativos respectivamente. En los análisis ajustados según los modelos basales antes mencionados (seleccionados para cada resultado de interés en la población total), se observó una interacción significativa en cuanto a la influencia de la ERC en la asociación entre la IGFBP2 y la muerte de causa cardiovascular en los análisis cuantitativos (p=0,038) y cualitativos (p < 0,001) (X2=7,5; gl=2; pómnibus=0,023 para el efecto de interacción general en el análisis cualitativo). De hecho, mientras que en los pacientes sin disminución de la TFGe los valores de IGFBP2 elevados (superiores al valor de corte de 686 ng/ml) se asociaron con una subhazard ratio de 1,97 (IC95%, 1,58-2,47; p < 0,001) para el riesgo de muerte de causa cardiovascular (), en los pacientes con ERC los niveles de IGFBP2 aumentados se asociaron con una subhazard ratio de 6,48 (IC95%, 3,21-13,0; p <0,001) (). Además, en la se muestra que los pacientes que presentaban tanto cifras de IGFBP2 altas con una TFGe <30ml/min/1,73 m2 fueron los que presentaron la mayor tasa de mortalidad de causa cardiovascular (40,6%). Por lo que respecta a la asociación entre la IGFBP2 y la muerte por cualquier causa, no se observaron interacciones en los análisis cualitativos (p=0,78) o cuantitativos (p=0,63).
No hubo interacciones significativas en cuanto a la influencia de la ERC en la asociación entre el IGF-1 y los resultados de interés en los análisis cuantitativos (muerte de causa cardiovascular, p=0,55; muerte por cualquier causa, p=0,99) o cualitativos (muerte de causa cardiovascular, p=0,72; muerte por cualquier causa, p=0,87).
Dado que la presencia de ERC puede influir en el posible valor pronóstico de la IGFBP2, se han realizado análisis longitudinales destinados a evaluar la asociación de la IGFBP2 con la muerte de causa cardiovascular (como resultado en el que se ha identificado una interacción) en los pacientes sin disminución de la TFGe y en pacientes con ERC (y disminución de la TFGe) por separado.
Valor pronóstico de la IGFBP2 en pacientes sin disminución de la TFGeEl análisis ROC mostró que el área bajo la curva (AUC) correspondiente a la IGFBP2 para la predicción de la muerte de causa cardiovascular en los pacientes sin disminución de la TFGe fue de 0,674 (IC95%, 0,585-0,763; p=0,001) y el mejor valor de corte fue el de 564 ng/ml, con una sensibilidad del 61,1% y una especificidad del 69,7%. Empleando este umbral, 131 pacientes (33,1%) quedaban incluidos en el subgrupo de IGFBP2 alta.
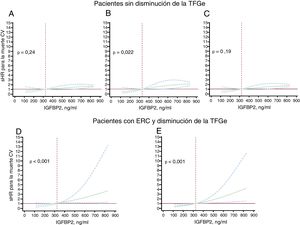
Los análisis ajustados mostraron la existencia de asociaciones independientes de la variable de la IGFBP2 tanto continua como cualitativa (inferior o superior a 564 ng/ml) con la muerte de causa cardiovascular en pacientes sin disminución de la TFGe (figura 2A-C y ). Sin embargo, no se observó ninguna mejora pronóstica significativa al añadir la variable IGFBP2 tanto continua como cualitativa a ninguno de los modelos basales considerados en los análisis de discriminación y reclasificación de IDI, si bien se observaron valores del IRN significativos para la variable IGFBP2 cualitativa ().
Valor pronóstico de la IGFBP2 en pacientes con ERC y disminución de la TFGeEl análisis ROC mostró que el AUC correspondiente a la IGFBP2 en cuanto a la predicción de la muerte de causa cardiovascular en pacientes con ERC fue de 0,730 (IC95%, 0,667-0,794; p <0,001) y que el mejor valor de corte fue el de 726 ng/ml, con una sensibilidad del 83,9% y una especificidad del 59,3%. Empleando este umbral, 145 pacientes (50,0%) quedaban incluidos en el subgrupo de IGFBP2 alta.
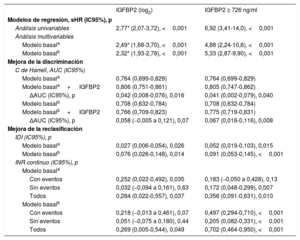
Los análisis ajustados mostraron la existencia de asociaciones de la variable IGFBP2 tanto continua como cualitativa (inferior o superior a 726 ng/ml) con la muerte de causa cardiovascular en pacientes con ERC y TFGe reducida tras el ajuste por las covariables del modelo 1 (edad, NYHA, miocardiopatía isquémica, TFGe y NT-proBNP) y del modelo 2 (hemoglobina, diabetes mellitus, tratamiento con inhibidores de la enzima de conversión de la angiotensina [IECA]/antagonistas del receptor de la angiotensina II [ARA-II]) (figura 2C,D y tabla 4). Además, el estadígrafo c de Harrell indicó una mejora significativa de la discriminación en la predicción de la muerte de causa cardiovascular tras la adición de las variables de la IGFBP2 continua y cualitativa a los modelos basales (tabla 4). Además, los índices IDI e IRN indicaron que la adición de la IGFBP2 a los modelos basales mejoró la capacidad de predicción de la mortalidad de causa cardiovascular en los pacientes con ERC (tabla 4).
Valores de subhazard ratio (sHR; líneas continuas) e intervalos de confianza del 95% (líneas discontinuas) para la asociación entre la concentración inicial de proteína 2 de unión al factor insulinoide de crecimiento (IGFBP2) y la muerte de causa cardiovascular (CV) en pacientes con insuficiencia cardiaca sin disminución de la tasa de filtrado glomerular estimada (TFGe ≥ 60ml/min/1,73 m2) tras un ajuste por la edad y el sexo (A), el sodio sérico y la clase funcinal de la NYHA (B) y cardiopatía isquémica y fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) (log2) (C), y en pacientes con IC y enfermedad renal crónica (ERC) con disminución de la TFGe (< 60ml/min/1,73 m2) tras un ajuste por edad, NYHA, miocardiopatía isquémica, TFGe y NT-proBNP (log2) (D), y tras un ajuste por hemoglobina, diabetes mellitus y tratamiento con un inhibidor de la enzima de conversión de la angiotensina o un antagonista del receptor 1 de la angiotensina II (E). En cada modelo, se modelizaron los valores basales de IGFBP2 con splines cúbicos restringidos, con 3 nudos en los modelos de regresión de riesgos competitivos (Fine-Gray), en los que el evento competitivo era la muerte de causa no cardiovascular. Se fijó como nivel de referencia el centil 25 en la población total (324 ng/ml, línea vertical discontinua). Todos los gráficos se truncaron en el centil 75 (831 ng/ml). La línea horizontal indica una sHR = 1.
Asociaciones de la IGFBP2 y valor predictivo de muerte de causa cardiovascular agregado en los pacientes con ERC y disminución de la TFGe (< 60ml/min/1,73 m2)
| IGFBP2 (log2) | IGFBP2 ≥ 726 ng/ml | |
|---|---|---|
| Modelos de regresión, sHR (IC95%), p | ||
| Análisis univariables | 2,77* (2,07-3,72), <0,001 | 6,92 (3,41-14,0), <0,001 |
| Análisis multivariables | ||
| Modelo basala | 2,49* (1,68-3,70), <0,001 | 4,88 (2,24-10,6), <0,001 |
| Modelo basalb | 2,32* (1,93-2,78), <0,001 | 5,33 (2,87-9,90), <0,001 |
| Mejora de la discriminación | ||
| C de Harrell, AUC (IC95%) | ||
| Modelo basala | 0,764 (0,699-0,829) | 0,764 (0,699-0,829) |
| Modelo basala+ IGFBP2 | 0,806 (0,751-0,861) | 0,805 (0,747-0,862) |
| ΔAUC (IC95%), p | 0,042 (0,008-0,076), 0,016 | 0,041 (0,002-0,079), 0,040 |
| Modelo basalb | 0,708 (0,632-0,784) | 0,708 (0,632-0,784) |
| Modelo basalb+ IGFBP2 | 0,766 (0,709-0,823) | 0,775 (0,719-0,831) |
| ΔAUC (IC95%), p | 0,058 (−0,005 a 0,121), 0,07 | 0,067 (0,018-0,116), 0,008 |
| Mejora de la reclasificación | ||
| IDI (IC95%), p | ||
| Modelo basala | 0,027 (0,006-0,054), 0,026 | 0,052 (0,019-0,103), 0,015 |
| Modelo basalb | 0,076 (0,026-0,148), 0,014 | 0,091 (0,053-0,145), <0,001 |
| INR continuo (IC95%), p | ||
| Modelo basala | ||
| Con eventos | 0,252 (0,022-0,492), 0,035 | 0,183 (−0,050 a 0,428), 0,13 |
| Sin eventos | 0,032 (−0,094 a 0,161), 0,63 | 0,172 (0,048-0,299), 0,007 |
| Todos | 0,284 (0,022-0,557), 0,037 | 0,356 (0,091-0,631), 0,010 |
| Modelo basalb | ||
| Con eventos | 0,218 (−0,013 a 0,461), 0,07 | 0,497 (0,294-0,710), <0,001 |
| Sin eventos | 0,051 (−0,075 a 0,180), 0,44 | 0,205 (0,082-0,331), <0,001 |
| Todos | 0,269 (0,005-0,544), 0,049 | 0,702 (0,464-0,950), <0,001 |
ARA-II: antagonistas del receptor de la angiotensina II; AUC: área bajo la curva; ERC: enfermedad renal crónica; IC95%: intervalo de confianza del 95%; IDI: índice de discriminación integrado; IECA: inhibidores de la enzima de conversión de la angiotensina; IGFBP2: proteína 2 de unión al factor insulinoide de crecimiento; IRN: índice de reclasificación neta; sHR: subhazard ratio; TFGe: tasa de filtrado glomerular estimada.
En los 2 modelos basales, n = 290.
Los resultados principales de este estudio son: a) en los pacientes con IC, mientras que el IGF-1 se mantuvo inalterado, la IGFBP2 aumentó en los pacientes con ERC (y disminución de la TFGe) en comparación con los pacientes sin disminución de la TFGe; b) la IGFBP2 mostró una asociación independiente, inversa y directa con la TFGe y la NT-proBNP respectivamente; c) el aumento de la IGFBP2 se asoció con un mayor riesgo de mortalidad de causa cardiovascular y de mortalidad por cualquier causa en el conjunto de los pacientes con IC; d) la asociación de la IGFBP2 con la muerte de causa cardiovascular fue significativamente mayor en los pacientes con IC y ERC (con disminución de la TFGe), con un valor pronóstico creciente que va más allá del aportado por variables clínicas de interés (incluidos parámetros cardiacos y renales).
Nuestros resultados indican que las concentraciones séricas de IGFBP2 están especialmente aumentadas en los pacientes con IC y ERC (es decir, con disminución de la TFGe) en comparación con los pacientes con IC sin disminución de la TFGe, mientras que no se observaron cambios significativos en el IGF-1 circulante. Es de destacar que en estudios previos ya se había descrito un incremento de la concentración sérica de IGFBP2, sin variación del IGF-1, en los pacientes con enfermedad renal, con correlaciones inversas entre la IGFBP2 y la TFGe14,20. Además, un estudio experimental reciente ha confirmado la asociación de la concentración de IGFBP2 circulante elevada con la lesión renal21. Sin embargo, no se conoce la causa del aumento de IGFPB2 en suero de los pacientes con IC, en especial aquellos con ERC. A este respecto, se ha descrito que, en el ser humano, la IGFBP2 se produce principalmente en el corazón y el hígado22. Los estudios experimentales indican que el incremento de la IGFBP2 circulante hallado en ratas con nefrosis tiene su causa, al menos en parte, en un aumento de la síntesis hepática de esta proteína transportadora12. Además, se ha descrito un aumento de la expresión renal de la IGFBP2 en la enfermedad renal tanto en experimentos como en humanos23. En este contexto, serán necesarios nuevos estudios para determinar si el incremento de la IGFBP2 circulante en pacientes con IC y ERC está relacionado con una mayor síntesis cardiaca, renal o hepática. Otra posibilidad es que el aumento del paso de IGFBP2 a la circulación procedente de otros orígenes tisulares pueda contribuir también a producir la asociación de la IGFBP2 con el deterioro de la función renal descrito en este estudio. Por otro lado, a pesar de que el tamaño de la IGFBP2 es inferior al del poro glomerular normal (aproximadamente 10nm), no se puede descartar la posibilidad de que la acumulación de IGFBP2 en el suero a medida que la TFGe disminuye sea consecuencia de una retención renal de los complejos de IGFBP2.
Es interesante que se haya observado que la disminución del IGF-1 y el aumento de la IGFBP2 se asocian con un mayor riesgo de mortalidad en los pacientes con IC. Estos resultados confirman las observaciones previas que relacionan los valores de IGF-1 sérico bajos con un mayor riesgo de mortalidad en los pacientes con IC crónica y FEVI reducida8. Además, la asociación entre una concentración alta de IGFBP2 y el riesgo de mortalidad se ha descrito anteriormente en 90 pacientes con miocardiopatía dilatada idiopática15. En este estudio se confirman y se amplían estas observaciones en una cohorte más amplia de pacientes con IC de diferentes etiologías, y se describe por primera vez que la capacidad pronóstica de la IGFBP2 para predecir la muerte de causa cardiovascular es más potente en los pacientes con IC y ERC (con disminución de la TFGe). Concretamente, la IGFBP2 mejora la exactitud pronóstica de los modelos basales que incluyen biomarcadores cardiacos y renales de interés clínico como la NT-proBNP y la TFGe en los pacientes con IC y ERC. Es de destacar que se ha estudiado la utilidad pronóstica de la concentración circulante de otros componentes de la familia de la IGFBP en pacientes cardiacos, con resultados contradictorios. Concretamente, las concentraciones de IGFBP1 están aumentadas en los pacientes con IC, aunque sin mostrar valor pronóstico alguno, y los estudios en los que se ha evaluado la IGFBP3 como biomarcador cardiovascular han mostrado resultados contradictorios24. Además, la IGFBP7 se asocia con un mayor riesgo de mortalidad por cualquier causa y de hospitalización por IC en los pacientes con IC y FEVI conservada, si bien su valor pronóstico se reduce en presencia de factores de riesgo cardiovascular de interés25. Considerados en conjunto, nuestros resultados indican que la IGFBP2 cumple los requisitos necesarios26 para considerarla un posible biomarcador del riesgo cardiovascular de los pacientes con IC, en especial los pacientes con IC y ERC (con disminución de la TFGe): a) asociación del marcador por sí solo con el resultado interés; b) asociación del marcador con el resultado de interés después de un ajuste estadístico por los factores de riesgo estándares, y c) mejora significativa de un modelo que contenga los factores de riesgo estándares tras la adición del nuevo marcador. No obstante, para confirmar el valor de la IGFBP2 como biomarcador de utilidad clínica, sería necesario desarrollar métodos de análisis estandarizados para determinar su reproducibilidad y facilitar su disponibilidad en la práctica clínica. Además, serán necesarios nuevos estudios para realizar validaciones prospectivas en cohortes independientes, una evaluación de la utilidad para el tratamiento del paciente y su evolución clínica y, en última instancia, una relación coste-efectividad favorable26.
No se conocen aún los posibles mecanismos fisiopatológicos que relacionan la IGFBP2 con la IC. En este trabajo se observa una correlación directa entre la IGFBP2 y la NT-proBNP en pacientes con IC, y esta asociación es independiente de la TFGe, entre otras variables clínicas de interés. La IGFBP2 tiene la capacidad de unirse al IGF-1 y el IGF-2 e inhibe principalmente las acciones del IGF en el tejido10. Teniendo en cuenta que el IGF-1 tiene actividad de protección cardiorrenal27,28 y que los complejos de IGF-1-IGFBP2 pueden ser más abundantes en presencia de ERC e IC15,29, resulta tentador especular con la posibilidad de que la IGFBP2 pudiera inhibir la bioactividad del IGF-1 protectora de órganos, con una repercusión negativa en las funciones cardiaca y renal y en el pronóstico de la IC.
Nuestro estudio tiene ciertas limitaciones. En primer lugar, refleja la experiencia de tan solo 2 centros y se limita principalmente a individuos caucásicos. En segundo lugar, el estudio se centra solo en el IGF-1 y la IGFBP2, pero sería interesante evaluar también otros componentes de las familias del IGF y la IGFBP en los pacientes con IC de este estudio. Además, el estudio se habría enriquecido con la evaluación del IGF-1 y la IGFBP2 en una población de control. En tercer lugar, a menudo los análisis de subgrupos se consideran exploratorios y poco generalizables. Además, el reducido tamaño muestral y la frecuencia de los objetivos de interés como consecuencia de la clasificación en subgrupos pueden haber afectado a la potencia estadística para evaluar el valor pronóstico de la IGFBP2, en especial en los pacientes con IC sin disminución de la TFGe. Por consiguiente, serán necesarios nuevos análisis en cohortes independientes para confirmar estos resultados. En cuarto lugar, los posibles problemas asociados con la multiplicidad podrían haber influido en los resultados obtenidos. En quinto lugar, dado que no se dispuso de las concentraciones de albúmina en orina ni exploraciones de diagnóstico por la imagen renal de los pacientes de este estudio, no se puede descartar la posibilidad de una lesión renal estructural en los pacientes sin disminución de la TFGe, que podrían encontrarse en los estadios 1 y 2 de ERC. Por último, dado que son de carácter descriptivo, las asociaciones observadas entre los valores de IGFBP2 circulante, las funciones cardiaca y renal y los resultados clínicos no establecen una causalidad.
En conclusión, la IGFBP2 sérica se asocia de manera independiente con la disminución de la TFGe y un mayor riesgo de mortalidad en los pacientes con IC y muestra un mayor valor pronóstico de muerte de causa cardiovascular en los pacientes con IC y ERC (con disminución de la TFGe) concomitantes. Así pues, hay una modificación del efecto de la ERC en la asociación de la IGFBP2 con la mortalidad de causa cardiovascular en los pacientes con IC. Además, la IGFBP2 sérica mejora la predicción del riesgo cuando se añade a los factores de riesgo cardiovascular y renal tradicionales en los pacientes con IC y ERC. Así pues, la IGFBP2 surge como biomarcador prometedor de la interacción cardiorrenal en los pacientes con IC. Sin embargo, es necesario investigar los mecanismos fisiopatológicos que relacionan el aumento de la IGFBP2 con la disminución de la TFGe, así como su asociación con un mal resultado cardiovascular en cohortes más grandes e independientes de pacientes con IC sin ERC. Resulta tentador especular con la posibilidad de que esos mecanismos puedan aportar información útil sobre las interacciones complejas existentes entre el corazón y el riñón en los pacientes con IC.
FINANCIACIÓNEste trabajo contó con el apoyo de la Dirección General de Industria, Energía e Innovación, Gobierno de Navarra, España (MINERVA; códigos 0011-1411-2018-000053 y 0011-1411-2018-000044), Ministerio de Economía y Competitividad, España (Instituto de Salud Carlos III subvenciones CB16/11/00483), y el Programa FP7 de la Comisión Europea (proyecto HOMAGE 2012-305507).
CONFLICTO DE INTERESESNo se declara ninguno.
- -
La mortalidad y la morbilidad de la IC son inaceptablemente altas. La ERC es una comorbilidad prevalente en la IC, que aumenta en mayor medida el riesgo de mortalidad. La presencia de uno de estos trastornos tiene una notable influencia en el otro, debido a las interacciones recíprocas existentes entre el riñón y el corazón, que no se conocen por completo. Se presenta evidencia que respalda el papel de la IGFBP2 como biomarcador que podría ayudar a mejorar la estratificación del riesgo y con ello facilitar un mejor tratamiento para los pacientes con IC y ERC.
- -
En este artículo se describe por primera vez que el aumento de la concentración sérica de IGFBP2 se asocia con un deterioro de la función renal y con biomarcadores de disfunción cardiaca en pacientes con IC, y aporta una información pronóstica adicional sobre el riesgo de mortalidad, más allá de la proporcionada por los factores de riesgo cardiovascular y renal tradicionales, en especial en los pacientes que tienen tanto IC como ERC (con disminución de la TFGe). Creemos, pues, que nuestros resultados respaldan el concepto de que la IGFBP2 es un prometedor biomarcador de la interacción cardiorrenal en los pacientes con IC.
Los autores agradecen a Sonia Martínez su inestimable ayuda técnica.