Andreas Gruentzig abrió el camino del intervencionismo coronario, pero probablemente le debamos mucho más que eso. Inició el camino de la inventiva percutánea y con ello dio pie a otros «revolucionarios» como Amplatz, Lock, Bonhoeffer o Cribier que ampliaron el campo del intervencionismo cardiaco más allá del territorio de la circulación coronaria. El intervencionismo en cardiopatía estructural representa una nueva rama del intervencionismo percutáneo que abarca una gama amplia de enfermedades congénitas y adquiridas que previamente se trataban quirúrgicamente o simplemente no se trataban. El término cardiopatía estructural se ha utilizado ampliamente para referirse a un grupo de enfermedades no coronarias que varían desde los defectos del septum hasta la enfermedad valvular adquirida. Esta nueva rama del intervencionismo presenta varias características particulares: a) la mayoría de las afecciones requieren un abordaje multidisciplinario que incluye especialistas en imagen cardiaca, cardiólogos clínicos, cardiólogos intervencionistas, intervencionistas pediátricos y cirujanos cardiacos, entre otros; b) es necesario realizar un estudio exhaustivo de los pacientes para la adecuada selección de aquellos que se beneficiarán del intervencionismo percutáneo; c) requiere formación continua y conocimiento de los diferentes materiales y dispositivos necesarios para tratar las diferentes enfermedades, y d) se necesita adaptar la sala de hemodinámica para poder realizar procedimientos híbridos.
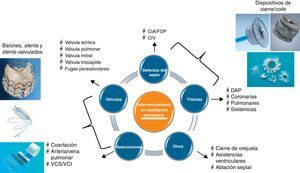
Podemos agrupar los procedimientos estructurales en: a) defectos del septo; b) valvulopatías; c) obstrucciones vasculares; d) fístulas, y e) otro tipo de afecciones. Grosso modo, el abordaje podría simplificarse en dos grupos de intervenciones: a) las que requieren la desobstrucción de un conducto vascular o una válvula, que se tratan con procedimientos de dilatación utilizando balones, stents o stents valvulados, y b) las que requieren ocluir una comunicación anómala entre dos cavidades cardiacas o conductos vasculares, que se tratan con dispositivos de cierre o coils (Figura 1).
Figura 1. Esquema de los diferentes tipos de procedimientos del intervencionismo en cardiopatía estructural. CIA: comunicación interauricular; CIV: comunicación interventricular; DAP: ductus arteriosus permeable; FOP: foramen oval permeable; VCI: vena cava inferior; VCS: vena cava superior.
A pesar de que el intervencionismo en cardiopatía estructural saltó a la palestra gracias al implante de las válvulas aórticas vía transcatéter, en esta revisión eludimos el intervencionismo valvular, que ya se ha abordado en Revista Española de Cardiología y del que se tiene mayor conocimiento1, 2. Por ello, este artículo describe brevemente diversas afecciones en las que el intervencionismo percutáneo se ha convertido en una opción terapéutica de primera línea.
Defectos del septoForamen oval permeableDesde que en 1877 Cohnheim describiera el ictus de origen paradójico a través del foramen oval permeable (FOP)3, el cierre percutáneo de esta anomalía es motivo de continua controversia. Se estima que el FOP se presenta aproximadamente en la cuarta parte de la población general y ha sido reconocido como un mediador de diversas enfermedades como la embolia paradójica, la desaturación ortostática observada en el síndrome platipnea-ortodesoxia, el síndrome de descompresión observado en los buceadores y la migraña, entre otros.
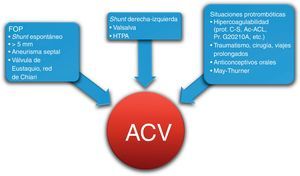
La embolia paradójica se produce cuando un trombo venoso alcanza la circulación arterial a través del FOP. Rara vez se observa el trombo a través del FOP, por lo que la embolia paradójica es un diagnóstico de presunción y debe considerarse en casos en los que: a) no se observa una fuente tromboembólica arterial; b) se observa un potencial shunt derecha-izquierda a través del FOP en la ecocardiografía, y c) si se observa material trombótico en el sistema venoso. No obstante, las guías clínicas neurológicas y cardiológicas no presentan consenso y estudios controvertidos como el CLOSURE I no aclaran las dudas del beneficio del cierre percutáneo frente al tratamiento antiagregante4. Parte de esta controversia puede que se deba a la heterogeneidad de factores que participan e influyen en el ictus criptogénico: factores clínicos del paciente (la edad<55 años presenta un riesgo relativo [RR]=3), los estados protrombóticos, problemas de retorno venoso como el síndrome de May-Thurner que incrementan el riesgo de trombosis venosa y las características del FOP que incrementan la posibilidad de un shunt derecha-izquierda (Figura 2, Figura 3). Por ello, los pacientes que acumulan múltiples factores que incrementan el riesgo de recidiva, los que presentan una recidiva estando en tratamiento médico o los que no toleran el tratamiento médico son candidatos al cierre percutáneo. Además, hay que tener en cuenta la baja tasa de complicaciones del procedimiento (< 1%) y la reducción de eventos observada tras el cierre descrita en varios metaánalisis (del 4,9 al 2,9%)5.
Figura 2. Factores involucrados en la etiología del accidente cerebrovascular paradójico a través del foramen oval permeable. Ac-ACL: anticuerpos anticardiolipínicos; ACV: accidente cerebrovascular; prot. C-S: déficit de las proteínas C y S; FOP: foramen oval permeable; HTPA: hipertensión pulmonar arterial; Pr. G20210A: mutación de la protrombina G20210A.
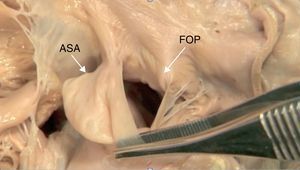
Figura 3. Anatomía patológica de un foramen oval permeable con un aneurisma gigante del septum. ASA: aneurisma del septo auricular; FOP: foramen oval permeable.
La platipnea-ortodesoxia, un síndrome que se caracteriza por una desaturación en bipedestación debido a un shunt derecha-izquierda a través del FOP y se corrige con el decúbito, es una indicación clara para el cierre; por el contrario, el cierre parece más que discutible en casos de migraña y de síndrome de descompresión de los buceadores.
Comunicación interauricularLa comunicación interauricular (CIA) es una comunicación directa entre las cavidades auriculares que permite un shunt izquierda-derecha. Representa el 22-30% de las cardiopatías congénitas en el adulto, más prevalente en mujeres (2:1). Muchos de estos defectos pasan inadvertidos durante la infancia, pero cuando el shunt es significativo, la disnea de esfuerzo se observa en el 30% en la tercera década y en el 75% en la quinta6. Hay diferentes tipos de CIA (ostium secundum, ostium primum, seno venoso y seno coronario); el más frecuente (70%), y en teoría el único abordable percutáneamente, es el tipo ostium secundum, que paradójicamente se debe a un déficit del ostium primum.
El cierre percutáneo de las CIA está indicado en los pacientes con dilatación de cavidades derechas y bordes adecuados alrededor del defecto (Tabla 1)7. Antes del cierre, es necesario realizar un adecuado estudio diagnóstico con ecocardiografía transesofágica (ETE)8 para determinar el tamaño de la CIA, la presencia de bordes y la ausencia de otros defectos asociados. El modo tridimensional (3D) es útil para determinar los diámetros anteroposterior y superoinferior del defecto y a su vez ayuda a discernir la presencia de más de un defecto en el septum (Figura 4). La resonancia magnética es útil para calcular el grado del shunt y las resistencias pulmonares de manera no invasiva, y es esencial en el caso de que haya alguna duda sobre un posible retorno anómalo de las venas pulmonares.
Tabla 1. Indicaciones para el cierre percutáneo de comunicaciones interauriculares basado en las guías de práctica clínica de American College of Cardiology/American Heart Association 2010
| Indicaciones para el cierre de CIA | |
| Clase I | Dilatación auricular y ventricular derecha con o sin síntomas asociados |
| Clase IIa | Embolia paradójica o síndrome de platipnea-ortodesoxia |
| Clase IIb | Presencia de shunt neto izquierda-derecha cuando la presión arterial pulmonar es < dos tercios de la presión sistémica o las resistencias vasculares pulmonares son < dos tercios de las sistémicas y responden a los vasodilatadores pulmonares o hay positivo en un test de oclusión del defecto |
| Criterios para el cierre percutáneo | CIA con diámetro mínimo > 5 y < 40 mm en el estudio ecocardiográfico |
| Bordes adecuados (> 5 mm) desde el defecto hacia las estructuras vecinas incluyendo vena cava superior e inferior, seno coronario, válvulas auriculoventriculares y venas pulmonares | |
| Contraindicaciones para el cierre percutáneo | Todos los defectos septales que no sean tipo ostium secundum, incluidos los defectos de ostium primum, seno venoso y seno coronario |
| Evitar aquellos con septum muy aneurismático o con defectos multifenestrados en los que se observe escasez de tejido circundante | |
| Se debe considerar otras opciones en caso de alergias al níquel o contraindicación para terapia antiplaquetaria |
CIA: comunicación interauricular.
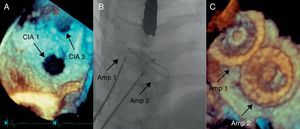
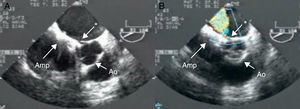
Figura 4. Cierre de dos defectos interauriculares observados en un mismo paciente. A: estudio con ecocardiografía transesofágica tridimensional donde se observan dos defectos diferenciados en el ostium primum. B: implante de dos dispositivos Amplatzer®. Amp 1: dispositivo Amplatzer® ocluyendo el primer defecto; Amp 2: dispositivo Amplatzer® ocluyendo el segundo defecto; CIA 1: primera comunicación interauricular; CIA 2: segunda comunicación interauricular.
Desde el primer cierre percutáneo realizado por King y Mills en 1975, se han implantado más de 100.000 dispositivos en todo el mundo. Son múltiples los dispositivos comercializados actualmente y la mayoría de ellos utilizan el sistema de doble disco para el cierre. El implante se puede realizar guiado por ETE, que presenta la ventaja principal de que se puede realizar una medición precisa del tamaño del defecto sin tener que recurrir al habitual sizing balloon. No obstante, el eco intracardiaco ofrece un soporte de imagen similar al de la ETE (excepto por el modo 3D, actualmente en desarrollo), con la ventaja de que evita la necesidad de anestesia general, lo que hace más corto y tolerable el procedimiento, por ello el número de partidarios del eco intracardiaco se ha incrementado en los últimos años. El cierre percutáneo presenta una tasa de éxito comparable a la del cierre quirúrgico, pero con una tasa de complicaciones menor. Entre las complicaciones del cierre percutáneo, quizá la más temida sea la erosión, que se observa en menos del 0,05% de los casos y se debe en su mayoría a un sobredimensionamiento de los dispositivos (Figura 5).
Figura 5. Erosión aórtica tras cierre de comunicación interauricular con un dispositivo Amplatzer®. A: la ecocardiografía transesofágica en modo bidimensional muestra una muesca marcada entre la aorta y la aurícula izquierda. B: el Doppler color muestra un chorro de alta velocidad entre la aorta y la aurícula izquierda. Amp: dispositivo Amplatzer® Atrial Septal Defect Occluder; Ao: aorta; *erosión.
Comunicación interventricularLas comunicaciones interventriculares (CIV) son infrecuentes en la población adulta sin enfermedad congénita. La mayoría de las CIV diagnosticadas por cardiólogos de adultos son en el contexto de infarto de miocardio, y rara vez como resultado de un traumatismo o como efecto iatrogénico tras una cirugía cardiaca9. Estos pacientes suelen presentar un elevado riesgo quirúrgico y por ello se los debería considerar para el cierre percutáneo. La mortalidad de las CIV postinfarto es > 90% con tratamiento médico, del 46% tras cirugía y del 37% tras cierre percutáneo. El cierre percutáneo presenta la ventaja de que el tratamiento es más precoz, reduce la mortalidad y posibilita cerrar defectos inferiores. Las CIV postinfarto presentan un tejido friable y necrótico, por lo que la tasa de shunt residual tras el cierre con dispositivo es elevada (80%). No obstante, se trata de un procedimiento que incrementa la supervivencia de los pacientes y muchos de estos shunts residuales se toleran bien o pueden corregirse en un segundo tiempo (Figura 6).
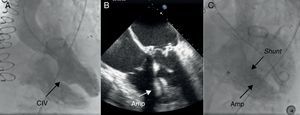
Figura 6. Comunicación interventricular postinfarto en una paciente operada de triple bypass y reemplazo válvular mitroaórtico. A: ventriculografía en proyección craneal izquierda que muestra una Comunicación interventricular de gran tamaño comunicando ampliamente los ventrículos izquierdo y derecho. B: ecocardiografía transesofágica que muestra el adecuado posicionamiento de un dispositivo Amplatzer® Atrial Septal Defect Occluder. C: la ventriculografía tras el implante del dispositivo muestra un shunt residual (flujo residual en el borde superior del dispositivo). Amp: Amplatzer® Atrial Septal Defect Occluder; CIV: comunicación interventricular; shunt: flujo residual en el borde superior del dispositivo.
El otro grupo de CIV que encuentra el cardiólogo de adultos es el de las musculares que, a pesar de ser pequeñas, presentan una historia de endocarditis. En estos casos, se debería considerar el cierre percutáneo como el tratamiento de elección tras el adecuado tratamiento de la endocarditis (Tabla 2)7. El dispositivo de cierre de CIV perimembranosas aún no ha sido aprobado por la Food and Drug Administration.
Tabla 2. Indicaciones para el cierre percutáneo de comunicaciones interventriculares basadas en las guías de práctica clínica de American College of Cardiology/American Heart Association 2010
| Indicaciones para el cierre de CIV | |
| Clase I | QP/QS > 2 o signos de sobrecarga del ventrículo izquierdo |
| Clase I | Antecedente de endocarditis infecciosa |
| Clase IIa | QP/QS > 1,5 y cuando la presión arterial pulmonar es < dos tercios de la presión sistémica o las resistencias vasculares pulmonares son < dos tercios de las sistémicas o hay disfunción ventricular izquierda sistólica o diastólica |
| Criterios para el cierre percutáneo | Sólo las CIV tipo IV o musculares son tributarias de cierre percutáneo (IIb), aunque hay amplia experiencia con CIV tipo II o perimembranosas |
| Las CIV postinfarto rechazadas para cirugía o casos de shunt residual tras la cirugía | |
| Bordes adecuados (> 4 mm) desde el defecto hacia las estructuras vecinas incluyendo las válvulas aórtica, pulmonar, mitral y tricúspide | |
| Contraindicaciones para el cierre percutáneo | Todos los defectos septales que no sean de tipo muscular, como los defectos tipo I o subpulmonares y los de tipo III o canal auriculoventricular. Hay dudas con las de tipo II o perimembranosas |
| En el caso de las perimembranosas, se debe evitar las que presenten prolapso de la válvula aórtica o septum muy aneurismático | |
| Hay que considerar otras opciones en caso de alergias al níquel o contraindicación para terapia antiplaquetaria |
CIV: comunicación interventricular.
Es necesario el estudio previo con ETE y durante el procedimiento. Son necesarias múltiples proyecciones para una correcta evaluación de la CIV, que incluyan el plano transgástrico (delinear el defecto), cuatro cámaras y el eje corto basal. Es importante determinar la presencia de regurgitación aórtica. Para los defectos muy apicales, la ecocardiografía transtorácica puede presentar una mejor resolución que la ETE.
El cierre percutáneo presenta buenos resultados y tasa de complicaciones baja. El bloqueo auriculoventricular es una de ellas, pero la incidencia de bloqueo no es superior que en pacientes tratados con cierre quirúgico10.
Aneurismas de seno coronario y seudoaneurismas ventricularesSon dos enfermedades infrecuentes. Los aneurismas del seno de Valsalva son generalmente defectos congénitos; lo más frecuente es que afecten al seno derecho y el no coronario. Son asintomáticos hasta que se produce una rotura que desemboca en el ventrículo derecho o la aurícula derecha y da lugar a un shunt izquierda-derecha. Tan sólo excepcionalmente, en casos de aneurismas importantes, pueden causar un bloqueo auriculoventricular, insuficiencia aórtica o estenosis pulmonar subvalvular. El tratamiento tradicional ha sido la extirpación quirúrgica, con una mortalidad del 2%. En caso de que no haya gran distorsión de la válvula con insuficiencia grave, el cierre percutáneo puede ser una alternativa a la cirugía, aunque las series publicadas son escasas.
Los seudoaneurismas ventriculares son una complicación rara pero grave del infarto de miocardio. El tratamiento es quirúrgico, pero muchos de los pacientes están en alto riesgo operatorio y en estos casos el cierre percutáneo es una alternativa adecuada. En series recientes de pacientes que tienen alto riesgo operatorio, se ha observado una tasa de éxito del 100% utilizando la angiografía por tomografía computarizada (angio-TC) y la ETE 3D para guiar adecuadamente el procedimiento11.
FístulasDuctus arterioso persistenteEl ductus arterioso no es una fístula como tal, y consiste en una comunicación persistente entre la aorta y la arteria pulmonar. Las guías de American College of Cardiology/American Heart Association indican el cierre en caso de sobrecarga del ventrículo izquierdo con dilatación (clase I), endarteritis (clase I) e incluso ductus arteriosos pequeños asintomáticos (clase IIa)7. En caso de diagnóstico durante la edad adulta, el cierre percutáneo es el tratamiento de elección, ya que la calcificación del ductus incrementa las complicaciones operatorias y los resultados con los dispositivos percutáneos han sido muy buenos, con baja tasa de complicaciones. Para el estudio adecuado de la anatomía del ductus, la angio-TC es la técnica de mejor resolución, ya que permite medir el tamaño del ductus en su parte más estrecha, el tamaño de la ampolla y su forma (Figura 7). Con ductus pequeños (< 2,5-3 mm), el cierre se puede realizar con coils y los de mayor tamaño, con dispositivos tipo Amplatzer® Duct Occluder (St. Jude Medical, St. Paul, Minnesota, Estados Unidos).
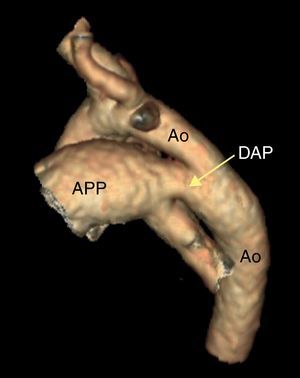
Figura 7. Angiografía por tomografía computarizada con reconstrucción tridimensional de un ductus arterioso. Ao: aorta; APP: arteria pulmonar principal; DAP: ductus arterioso permeable.
Fístulas coronariasLas fístulas coronarias son malformaciones congénitas en las que se establece una comunicación directa entre una arteria coronaria y una cavidad cardiaca, vena o arteria pulmonar. Es la anomalía más frecuente del sistema coronario (0,22%) y muchas veces se trata de un hallazgo casual12. No obstante, los enfermos pueden presentar angina, infarto o insuficiencia cardiaca como consecuencia del fenómeno de robo. En las fístulas de tamaño importante o en las moderadas que causan isquemia documentada, arritmias o dilatación ventricular, está indicado el cierre percutáneo (American College of Cardiology/American Heart Association, indicación de clase I)7 previo estudio de la trayectoria de la fístula y habiendo confirmado el potencial de cierre completo por angiografía y angio-TC. El cierre se puede realizar a través de coils o con dispositivos Amplatzer® Vascular Plug, con una incidencia < 5% de shunt residual (Figura 8)13.
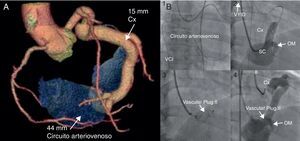
Figura 8. Fístula coronaria. A: la angiografía por tomografía computarizada con reconstrucción tridimensional muestra una gran fístula entre la parte distal de la circunfleja y la parte media del seno coronario, con un cuello estrecho (7,1 mm). B: cierre percutáneo retrógrado de la fístula coronaria utilizando un Amplatzer® Vascular Plug II de 16 mm, con el empleo de un circuito arteriovenoso (introducción anterógrada de la guía en la fístula, exteriorización por la vena yugular interna derecha tras colocación del asa en la vena cava inferior). Cx: circunfleja; OM: obtusa marginal; SC: seno coronario; VCI: vena cava inferior; VYID: vena yugular interna derecha. Modificado con permiso de Noble et al 13 .
Fístulas arteriovenosas pulmonaresLas fístulas arteriovenosas pulmonares son conexiones directas entre la arteria y la vena pulmonar que producen un shunt derecha-izquierda. Se asocian con frecuencia a la enfermedad de Rendu-Osler-Weber (30%). Pueden ser simples (80%) con una única arteria nutricia o complejas (20%) con múltiples arterias. Si no se tratan, pueden presentarse complicaciones como hemoptisis, hemotórax, accidente isquémico transitorio y embolias paradójicas. La angio-TC y la angiografía por resonancia magnética arterial son técnicas adecuadas para la detección y la descripción de las fístulas. El cierre percutáneo se realiza con coils o dispositivos tipo Amplatzer® Vascular Plug II, con el que se ha obtenido una tasa de éxito inmediato del 86% y con un 2% de recurrencias; estas se producen en arterias de mayor diámetro, cuando se utilizan menos coils o se posicionan en la porción proximal de la arteria14. Dado que se han descrito casos de embolia cerebral paradójica tras el procedimiento, se recomienda iniciar doble antiagregación inmediatamente (Figura 9).
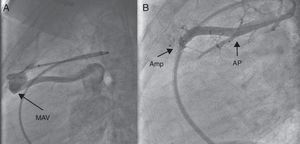
Figura 9. Cierre de una malformación pulmonar arteriovenosa. A: angiografía en proyección lateral que muestra una malformación arteriovenosa simple que drena en la aurícula izquieda. B: cierre con un dispositivo Amplatzer® Vascular Plug II que obtuvo una oclusión completa de la fístula y sin obstruccíon de las ramas pulmonares circundantes. Amp: dispositivo Amplatzer®; AP: arteria pulmonar; MAV: malformación arteriovenosa.
ObstruccionesCoartación aórticaLa coartación aórtica consiste en una estrechez de la aorta descendente, a nivel de la región del ligamento arterioso adyacente a la arteria subclavia izquierda, aunque en ocasiones esta estrechez puede extenderse al arco aórtico o al istmo. Se ha de descartar la presencia de anomalías cardiacas asociadas como válvula bicúspide aórtica (80%), hipoplasia de arco o CIV. El estudio con angiografía por resonancia magnética arterial o angio-TC con reconstrucción 3D es esencial en estos casos, dado que la presencia de abundantes colaterales podría reducir el gradiente a través de la obstrucción y enmascarar su gravedad. Además, la angiografía por resonancia magnética arterial permite descartar la presencia de aneurismas intracraneales (5%). El intervencionismo está indicado cuando se observa un gradiente pico-pico > 20mmHg a través de la coartación o cuando se observa una estrechez significativa por imagen radiológica (clase I)7. La coartación presenta dos retos para el cardiólogo intervencionista de adultos: a) la presencia de tejido anómalo en la pared aórtica incrementa el riesgo de disección o rotura en el área de la coartación, y b) muchos pacientes son referidos para reintervención tras implantación de stent que queda pequeño tras el periodo de crecimiento del paciente. El desarrollo de stents cubiertos ha solucionado en parte ambos problemas, dado que posibilita cubrir las áreas de rotura y disección y evitar la posterior formación de seudoaneurismas; por otra parte, permite dilatar stents previos hasta producir su rotura y poder implantar un stent de mayor tamaño (Figura 10). Es un procedimiento seguro, con una tasa de éxito del 98% y una tasa de complicaciones baja: vasculares, el 2,6%; migración de stent, el 4,8%; rotura focal/disección, el 1,6%; la mayoría se puede resolver en la sala de hemodinámica15. Estos pacientes requieren seguimiento continuo a pesar de la corrección de la coartación.
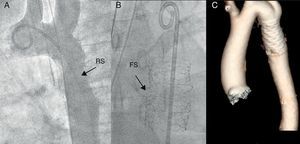
Figura 10. Recoartación debido a que el stent implantado queda pequeño tras el desarrollo de la paciente. A: en la aortografía se observa una muesca en el punto de obstruccion máxima; en este punto se midió un gradiente pico de 20 mmHg. B: tras dilatar el stent con un balón «no compliante», se obtiene la rotura del stent en dos fragmentos y dilatación del calibre aórtico. C: la angiografía por tomografía computarizada con reconstrucción tridimensional muestra el stent recubierto implantado tras la dilatación inicial, con buena aposición. FS: fractura de stent; RS: reestenosis.
Estenosis de venas y arterias pulmonaresLas estenosis de venas pulmonares que se observan en la edad adulta suelen ser consecuencia de ablación por radiofrecuencia de venas pulmonares o secundarias a una cirugía de corrección de anomalía de venas pulmonares8. Los resultados iniciales con angioplastia simple y con stent convencional mostraron reestenosis temprana debido a la falta de esqueleto metálico en la angioplastia y el pequeño diámetro de los stents. No obstante, el desarrollo de balones y stents farmacoactivos, y sobre todo los stents bioabsorbibles, puede suponer la solución del problema.
En lo que se refiere a las estenosis arteriales pulmonares, la mayoría son secundarias a enfermedades conotroncales (como la tetralogía de Fallot o la atresia pulmonar) que llegan a la edad adulta. No obstante, en un menor porcentaje se observa en pacientes con vasculitis, especialmente en la enfermedad de Takayatsu, o tras irradiación o compresión extrínseca por neoplasias. La afección de una rama aislada puede ser asintómatica, pero en la mayoría de los casos son múltiples las ramas afectadas, lo que implica una sobrecarga del ventrículo derecho. En el caso de pacientes jóvenes, se prefiere el tratamiento con angioplastia simple o cutting balloon; se produce reestenosis en menos del 12%16. En los pacientes adultos a quienes se decide implantar un stent, es esencial el estudio previo con angiografía por resonancia magnética arterial o angio-TC para determinar el diámetro adecuado del stent. El abordaje es similar al coronario y en ocasiones es necesario recurrir a estrategias similares a las utilizadas en las bifurcaciones coronarias (Figura 11).
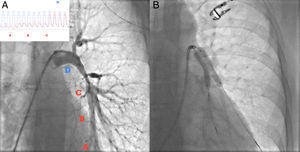
Figura 11. Estenosis de la rama pulmonar izquierda principal en una paciente con enfermedad de Takayasu. A: la angiografía pulmonar muestra una estenosis significativa de la rama pulmonar izquierda y la curva de presión muestra un incremento progresivo y marcado del gradiente entre los puntos D y C. B: se implantaron dos stents con la técnica de kissing.
Otro tipo de intervencionesCierre de la orejuelaLa fibrilación auricular es la arritmia más frecuente, afecta a un 3-5% de la población > 65 años y causa un 15-20% de los infartos cerebrales isquémicos. El score CHADS2 es una clasificación sencilla, validada y útil para estimar el riesgo cardioembólico de los pacientes y determinar quiénes requieren tratamiento anticoagulante. No obstante, los pacientes con CHADS2 más elevado son a su vez los que presentan mayor riesgo de hemorragia (p. ej., los pacientes con CHADS2=4 tienen un riesgo de embolia del 11% anual, pero un riesgo de hemorragia del 23%)17. Además, hay la disyuntiva de cómo tratar a los pacientes que requieren combinar tratamiento antiagregante y anticoagulante o que sufren una hemorragia mayor y requieren anticoagulación. Por todo ello, y más teniendo en cuenta que el 90% de los trombos en los pacientes con fibrilación auricular se originan en la orejuela, la exclusión de la orejuela es una alternativa terapéutica interesante. El estudio PROTECT-AF, el único estudio aleatorizado hasta la actualidad, demostró la no inferioridad del dispositivo Watchman® (Atritech Inc., Minneapolis, Minnesota, Estados Unidos) frente a la anticoagulación con warfarina (3 frente a 4,9 eventos cada 100 años/paciente; RR=0,62; intervalo de confianza del 95%, 0,35-1,25)18. No obstante, la tasa de complicaciones inicial dificultó la aprobación del dispositivo por la Food and Drug Administration, aunque los registros posteriores han demostrado una clara reducción en los eventos adversos, que probablemente sea atribuible a la curva de aprendizaje (reducción del 10 al 5%)19. Por otra parte, se están realizando estudios con nuevos dispositivos como el Amplatzer® Cardiac Plug y los registros han demostrado una tasa de complicaciones inferior a la observada en el estudio PROTECT-AF. La llegada de fármacos antitrombóticos más seguros como el dabigatrán y el rivaroxabán no desbancará la exclusión percutánea de la orejuela, dado que probablemente seguirá habiendo pacientes con hemorragia mayor que no toleren la anticoagulación (Figura 12).
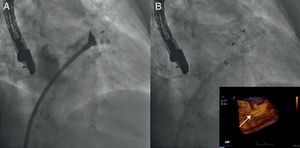
Figura 12. Cierre de orejuela. A: el angiograma muestra el dispositivo Amplatzer® Cardiac Plug abierto parcialmente y posicionándose en la orejuela. B: el dispositivo ha sido implantado y la imagen de la ecocardiografía transesofágica tridimensional confirma el adecuado posicionamiento.
Asistencias ventriculares percutáneasEl desarrollo de nuevos dispositivos de asistencia ventricular que se implantan de manera percutánea posibilita mejorar el tratamiento de los pacientes en shock cardiogénico, ya que permiten un flujo sistémico > 4 l/min, y un mejor soporte en intervenciones coronarias complejas (p. ej., el tronco no protegido con fracción de eyección del ventrículo izquierdo reducida o estenosis aórtica asociada a enfermedad multivaso). Dispositivos como el Impella® o el TandemHeart® requieren la inserción de una cánula de 12–14 Fr y, por consiguiente, es necesario conocer las técnicas de cierre vascular. Además, el TandemHeart® requiere el posicionamiento de una cánula en la aurícula izquierda a través de una punción transeptal. Por ello el implante de estos dispositivos requiere operadores habituados a este tipo de procedimientos.
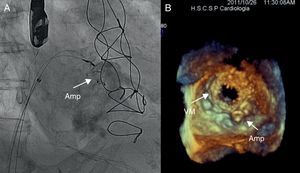
VálvulasFugas paravalvularesLas fugas paravalvulares son una complicación relativamente frecuente tras la cirugía y se observan hasta en el 10% en posición aórtica y el 17% en la mitral. El 3% de los pacientes requerirá intervención debido a los síntomas: hemolisis, insuficiencia cardiaca o ambas20. La reoperación presenta una alta tasa de mortalidad al tratarse de al menos una primera reoperación y por ello el abordaje percutáneo se está convirtiendo en una opción atractiva tanto para cirujanos como para intervencionistas. Tras el tratamiento percutáneo se observa una reducción del grado de regurgitación, que es menos que moderada en el 76% de los casos; la supervivencia libre de cirugía a 3 años es del 64% en este grupo de pacientes. Aquellos con una fuga residual severa presentan una supervivencia libre de eventos del 31%21. Además, en el caso de los centros europeos y canadienses que tienen disponible el Amplatzer® Vascular Plug III la tasa de éxito es aún superior (Figura 13).
Figura 13. Cierre de una fuga periprotésica mitral severa anterolateral. A: se observa el posicionamiento de dos dispositivos Amplatzer® Vascular Plug III. B: la ecocardiografía trasesofágica tridimensional confirma el posicionamiento adecuado de los dispositivos. Amp: dispositivo Amplatzer®; VM: válvula mitral.
ConclusionesEl intervencionismo en cardiopatía estructural abarca una amplia gama de procedimientos de cardiopatías congénitas y adquiridas en las que se incluyen enfermedades valvulares, defectos del septum, obstrucciones arteriales o venosas, fístulas y otra serie de técnicas como el cierre de la orejuela. Los resultados positivos obtenidos con el tratamiento transcatéter de las válvulas han despertado el interés de los cardiólogos por este campo. Ello, junto con el desarrollo y la mejora continua de los dispositivos, augura un futuro más que prometedor a esta subespecialidad del intervencionismo cardiaco.
Conflicto de interesesNinguno.
Full English text available from: www.revespcardiol.org
Autor para correspondencia: Hospital de la Santa Creu i Sant Pau, Sant Antoni Maria Claret 167, 08025 Barcelona, España. darzamendi@santpau.cat