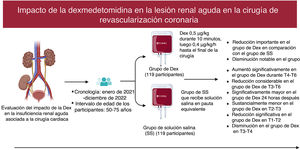
El objetivo es evaluar el impacto de la dexmedetomidina (Dex) en la insuficiencia renal aguda (IRA) asociada con cirugía cardiaca (ACC), la función renal y el estrés metabólico y oxidativo en pacientes sometidos a cirugía de revascularización coronaria con circulación extracorpórea.
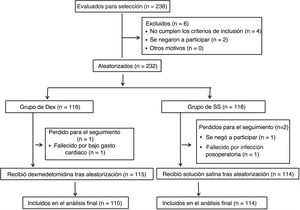
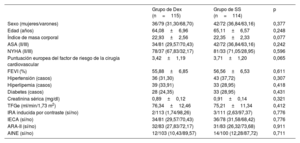
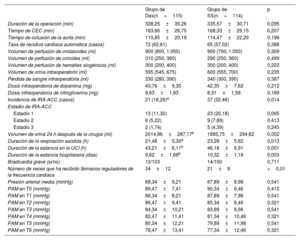
MétodosSe llevó a cabo un ensayo aleatorizado y a doble ciego con 238 sujetos (edades, 50-75 años) sometidos a cirugía de revascularización coronaria desde enero de 2021 hasta diciembre de 2022. Se dividió a los participantes en los grupos de Dex (n=119) y de solución salina normal (SS) (n=119). Se administró Dex a 0,5μg/kg durante 10min seguida de 0,4μg/kg/h hasta el final de la cirugía. El grupo de SS la recibió en pauta equivalente. Se tomaron muestras de sangre y orina en varios momentos antes y después de la cirugía. El resultado primario fue la incidencia de IRA por ACC, definida como la aparición de IRA en las 96h posteriores a la cirugía.
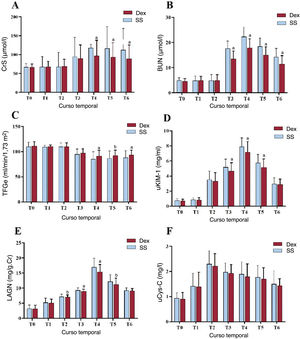
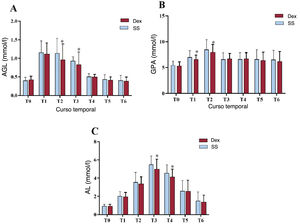
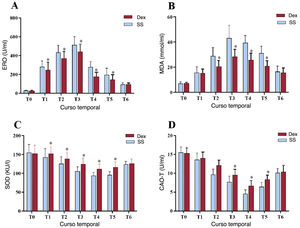
ResultadosEn el grupo de Dex la incidencia de IRA ACC fue significativamente menor que en el de SN (el 18,26 frente al 32,46%; p=0,014), las cifras de creatinina sérica disminuyeron considerablemente, la tasa de filtrado glomerular estimada fue sustancialmente alta en T4-T6 (p<0,05), el valor de nitrógeno ureico en sangre disminuyó notablemente en T3-T6 (p<0,01), el volumen de orina a las 24h de la cirugía aumentó significativamente (p<0,01), los ácidos grasos libres disminuyeron sustancialmente en T2-T3 (p<0,01), la glucemia se redujo significativamente en T1-T2 (p<0,01) y el lactato se redujo significativamente en T3-T4 (p<0,01).
ConclusionesLa Dex reduce la IRA ACC, potencialmente a través de la regulación de los trastornos metabólicos y la reducción del estrés oxidativo.
Inscrito en el Registro de Estudios Clínicos de China (n.° ChiCTR2100051804).
Palabras clave
Identifíquese
¿Aún no es suscriptor de la revista?
Comprar el acceso al artículo
Comprando el artículo el pdf del mismo podrá ser descargado
Precio: 19,34 €
Teléfono para incidencias
De lunes a viernes de 9h a 18h (GMT+1) excepto los meses de julio y agosto que será de 9 a 15h