La enfermedad coronaria multivaso es un importante factor pronóstico postinfarto a pesar de nuevas formas de reperfusión como la angioplastia primaria. El objetivo del presente estudio es determinar la secuencia de variación de diferentes poblaciones de células progenitoras endoteliales y factores angiogénicos (factor de crecimiento endotelial vascular, factor de crecimiento hepatocitario) según el grado de extensión de la enfermedad coronaria.
MétodosEstudiamos la cinética de liberación en 32 pacientes ingresados por un primer infarto, agrupados según tuvieran enfermedad coronaria monovaso o multivaso y 26 sujetos que constituyen el grupo control.
ResultadosLos pacientes presentaban un mayor número de células progenitoras endoteliales y citocinas angiogénicas que los controles en las tres determinaciones realizadas (al ingreso, día 3 y día 7) de las siguientes subpoblaciones: CD34, CD34+CD133+, CD34+KDR+ y CD34+CD133+KDR+CD45+ (débil); este último era mayor el día 7. Los valores de las tres poblaciones analizadas eran mayores en los pacientes con enfermedad coronaria monovaso en las tres determinaciones. Las cifras del factor de crecimiento endotelial vascular subían durante la primera semana y las del factor de crecimiento hepatocitario mostraron un pico precoz al ingreso. No apreciamos diferencias significativas en las variaciones de citocinas según el grado de extensión de la enfermedad coronaria.
ConclusionesAunque las cinéticas de liberación de diferentes poblaciones de células progenitoras endoteliales en pacientes con un primer infarto agudo de miocardio con enfermedad monovaso con enfermedad multivaso fueron similares, su número fue mayor en los pacientes con enfermedad coronaria monovaso. Las cifras del factor de crecimiento endotelial vascular ascendieron durante la primera semana y las del factor de crecimiento hepatocitario muestran un pico precoz al ingreso.
Palabras clave
La enfermedad cardiovascular es la causa de muerte más frecuente en el mundo. Tiene especial importancia la cardiopatía isquémica, a pesar de un pronóstico ligeramente mejor del infarto agudo de miocardio en la última década1. Esta situación requiere un mejor conocimiento de los mecanismos fisiopatológicos que subyacen al infarto agudo de miocardio para poder aplicar tratamientos más eficaces y, por lo tanto, mejorar el pronóstico infausto de esta enfermedad.
Las células progenitoras endoteliales (EPC) descritas por Asahara et al2 proceden de precursores hemopoyéticos pluripotenciales, se caracterizan por tener cierto papel regenerador de vasculogénesis y la angiogénesis, se han usado en test clínicos3 y muestran en su superficie los marcadores CD133, CD34 y KDR o VGFR. No obstante, las EPC son difíciles de definir, puesto que pueden coexistir diversas poblaciones de células progenitoras en la circulación, y todas ellas han sido designadas por diferentes autores como EPC, incluidas las EPC tempranas CD34+CD133+KDR+ y las EPC tardías CD34+CD133-KDR+ (tras la pérdida de su CD133)4. Recientemente, algunos grupos5 han definido las EPC fenotípicamente con el empleo de un marcador de membrana adicional, el CD45+ (débil), junto con los marcadores clásicos CD34+CD133+KDR+.
Además del importante papel que desempeñan diversos subgrupos de células, se ha involucrado también a varias citocinas. Estas son liberadas como resultado de la lesión vascular e inducen la movilización de las EPC de la médula ósea6. Es de destacar que entre estas citocinas se encuentran el factor de crecimiento endotelial vascular (VEGF)6 y el factor de crecimiento hepatocitario (HGF)7, lo que indica su posible intervención en los mecanismos de reparación del miocardio. El VEGF participa en la reparación cardiaca a través de las células madre, tanto por su papel prominente en la angiogénesis como por su capacidad de movilización de células madre de la médula ósea hacia la sangre periférica en pacientes con infarto de miocardio. El HGF y su receptor (c-met) participan en la cardiogénesis, en la que se expresa transitoriamente durante el desarrollo cardiaco inicial. Tanto in vitro como in vivo, el HGF potencia la supervivencia de los miocardiocitos en condiciones isquémicas8.
La importancia pronóstica de la enfermedad coronaria multivaso en pacientes con infarto agudo de miocardio es bien conocida9 y está relacionada con diversos marcadores bioquímicos de la lesión celular, como la proteína alfa-actina10. Esta asociación pronóstica continúa siendo importante a pesar de los nuevos métodos de reperfusión para el tratamiento del infarto agudo de miocardio11.
Pese a la controversia existente respecto a la cinética del aumento de los diferentes subgrupos celulares y citocinas, es decir, los incrementos con efecto desde el momento del infarto12, 13, 14 en contraposición con los aumentos progresivos que alcanzan un pico 1 semana después del infarto15, ningún estudio ha examinado todavía estos aumentos en relación con el grado de extensión de la enfermedad coronaria que se produce en la mitad del total de infartos. Además, la terapia de reperfusión es el tratamiento utilizado en los test clínicos de implantes celulares3 y no conocemos todavía el momento óptimo para implantar estos subgrupos celulares.
El objetivo de este estudio es determinar la secuencia temporal de la liberación a la sangre periférica de los subgrupos de células mononucleares CD34+, CD34+CD133+, CD34+KDR+ y CD34+CD133+KDR+CD45+ (débil) y las citocinas circulantes VEGF y HGF según el grado de extensión de la enfermedad coronaria, para intentar determinar el momento óptimo para la implantación de células tras el infarto. Estudiamos, además, las diferencias en los subgrupos de células mononucleares y en las citocinas circulantes entre un grupo control y los pacientes con un primer infarto de miocardio.
MétodosPacientesEntre agosto de 2006 y junio de 2007 estudiamos a 32 pacientes ingresados por un infarto agudo de miocardio con elevación del ST (IAMCEST) definido como dolor torácico que lo indique y una elevación de al menos 3 mm en el segmento ST en un mínimo de tres derivaciones precordiales con troponina positiva, sin antecedentes de cardiopatía isquémica y en las primeras 8 h tras el inicio de los síntomas. Se estudió a un grupo control de 26 personas con características demográficas similares que acudieron al hospital para un análisis de sangre. Se obtuvo una breve historia clínica que incluía los antecedentes relativos a factores de riesgo, para descartar a los pacientes con posibles síntomas cardiovasculares. Los criterios de exclusión, tanto para los casos como para los controles, incluyeron la presencia de cardiopatía isquémica crónica, valvulopatía grave, antecedentes de infarto de miocardio previo, neoplasia actual o previa, uso crónico de fármacos antiinflamatorios e insuficiencia renal crónica (creatinina > 2mg/dl). Posteriormente se utilizó a otros 13 controles de características demográficas similares para la determinación de los valores de control de citocinas.
Se consideró que había enfermedad monovaso si alguna arteria epicárdica de > 2,5mm presentaba una estenosis > 70%, y se consideró que había enfermedad multivaso si estaban afectados más de un vaso epicárdico > 2,5mm (revisaron la coronariografía dos cardiólogos intervencionistas con experiencia). El estudio cumplió las normas de la Declaración de Helsinki y fue aprobado por el comité ético del hospital. Todos los pacientes dieron su consentimiento informado por escrito para participar en el estudio.
Aislamiento de células mononucleares de sangre periféricaSe extrajeron muestras de sangre en tres ocasiones en los pacientes con IAMCEST (a su llegada al servicio de urgencias y a los 3 y 7 días) y en una ocasión en los controles. La muestra se procesó y se almacenó para posteriores análisis mediante citometría de flujo tras verificar que todos los pacientes tenían resultados normales del análisis de sangre. Todas las muestras se recogieron en tubos con ácido etilendiamino tetraacético (EDTA) y se procesaron en un plazo de 24 h tras la extracción. Las muestras de sangre se diluyeron con solución salina tamponada con fosfato y se aislaron las células mononucleares de sangre periférica mediante centrifugación en gradiente de densidad con solución de separación Ficoll. Las células recuperadas se lavaron dos veces con solución salina tamponada con fosfato y se resuspendieron en solución salina tamponada con fosfato.
Estudio de inmunofenotipo y cuantificación de las células progenitoras circulantesLa cuantificación de la población de células CD34+ de sangre periférica se realizó según lo indicado en las guías ISHAGE16. Se tiñeron las células viables con los siguientes anticuerpos antihumanos: anti-CD34 conjugado con isotiocianato de fluoresceína (Becton Dickinson, Pharmigen; San Jose, California, Estados Unidos), anti-CD133 conjugado con ficoeritrina (Miltenyi Biotech; Bergisch Gladbach, Alemania), anti-CD45 conjugado con proteína peridina-clorofila (Becton Dickinson; San José, California, Estados Unidos) y anti-KDR conjugado con aloficocianina (R&D Systems; Mineápolis, Minnesota, Estados Unidos). Se utilizaron controles igualados respecto al isotipo (Becton Dickinson y R&D Systems) para descartar la presencia de unión de anticuerpos inespecíficos. Las células se obtuvieron con un citómetro de flujo FACScalibur y se analizaron con el programa informático Cell-Quest (Becton Dickinson). El análisis se realizó excluyendo los restos celulares en un gráfico de dispersión de puntos lateral/anterógrado. Se realizaron determinaciones del número absoluto de células CD34+, CD34+CD133+, CD34+KDR+ y CD34+CD133+KDR+ CD45+ (débil) en la población de células mononucleares circulantes.
Determinación de concentraciones circulantes de factor de crecimiento endotelial vascular y factor de crecimiento hepatocitarioSe obtuvieron muestras de sangre periférica de los pacientes en tubos con EDTA al ingreso y a los 3 y 7 días tras el inicio del infarto agudo de miocardio. Los pacientes no recibían ningún tratamiento con heparina que pudiera haber alterado los valores de VEGF. Las muestras de sangre se centrifugaron durante 15 min a 1.000g, en los 30 min siguientes a la obtención, tras lo cual se prepararon de inmediato muestras alícuotas de plasma que se almacenaron a –80°C hasta el momento del análisis. Las concentraciones plasmáticas de VEGF y HGF se determinaron por duplicado con dos kits comerciales de inmunoanálisis enzimático en sandwich cuantitativos (R&D Systems; Minneapolis, Minnesota, Estados Unidos) según las instrucciones del fabricante. Las variaciones interanalíticas (1 muestra analizada en 10 análisis distintos) e intraanalíticas (1 muestra analizada 10 veces en 1 placa) fueron del 7,1 y el 4,2% para el HGF y del 8,2 y el 5,1% para el VEGF, y estaban dentro del intervalo de precisión del análisis indicado en la información del producto de R&D Systems Inc. El valor mínimo detectable fue de 9 pg/ml para el VEGF y 40 pg/ml para el HGF.
Análisis estadísticoLos datos cuantitativos se expresan en forma de media±desviación estándar y los datos cualitativos, en forma de porcentajes. Se utilizó la prueba de la t de Student para analizar la diferencia entre las variables cuantitativas continuas en dos muestras independientes siempre que se cumpliera la normalidad; en los demás casos se utilizó la prueba de la U de Mann-Whitney. Se utilizó la prueba de Shapiro-Wilk para verificar la normalidad. Se utilizó la prueba de Friedman para analizar las diferencias en medidas repetidas, con la prueba de Wilcoxon para muestras apareadas. Se aplicó una corrección de Bonferroni a los valores de p, estableciendo el nivel de significación en p<0,016. El análisis de las diferencias entre las variables cuantitativas continuas en más de dos muestras independientes se realizó mediante ANOVA (con la prueba de Bonferroni para analizar las diferencias entre subgrupos). Las variables categóricas se analizaron con la prueba de la χ2 con la prueba de Fisher. Utilizamos un modelo lineal univariable general en el análisis de los datos para introducir un control del sesgo de selección del sexo del paciente y el tabaquismo como variables en este estudio de casos y controles. Las correlaciones entre las variables se midieron con el coeficiente de correlación de Pearson cuando esas variables cumplían los criterios de normalidad y con el coeficiente de correlación de Spearman cuando no. Las diferencias se consideraron significativas para un valor de p<0,05. Los datos se analizaron con el programa SPSS 12.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
ResultadosCaracterísticas basalesDe los 32 pacientes con infarto, 8 fueron tratados inicialmente con angioplastia primaria y los otros 24 con fibrinolisis, aunque fue necesaria una angioplastia de rescate en 9 de estos casos. De los 15 pacientes a los que no se realizó angiografía coronaria durante la fase aguda, sí se hizo a 10 durante los 5±2 días siguientes. A los 5 pacientes restantes con infarto de miocardio de cara inferior no complicado no se les realizó coronariografía por razones clínicas o porque no dieron su consentimiento. La fracción de eyección (FE) se determinó en todos los pacientes, ya fuera durante el estudio hemodinámico o después de un estudio ecocardiográfico (4,2±1,5 días). Al alta, el 87% de los pacientes estaban en tratamiento con inhibidores de la enzima de conversión de la angiotensina o antagonistas de los receptores de la angiotensina II, el 87% con bloqueadores beta, el 88,6% con estatinas y el 63,4% con la combinación de ácido acetilsalicílico y clopidogrel. No se observaron diferencias significativas en los antecedentes vasculares (carotídeos, aórticos, iliofemorales) ni en la medicación previa (antihipertensivos, estatinas y antiagregantes plaquetarios).
Las características basales de los pacientes con IAMCEST diferían de las de los controles en el porcentaje de pacientes fumadores (el 63,6 frente al 15,4%) y en la distribución por sexos (más mujeres en el grupo control) (Tabla 1). No se observaron diferencias en las características basales de los pacientes en función del grado de extensión de su enfermedad coronaria (Tabla 1).
Tabla 1. Características basales del grupo total de pacientes, los 27 pacientes a los que se realizó un examen angiográfico y los controles
| IAMCEST (n=32) | IAMCEST monovaso (n=15) | IAMCEST multivaso (n=12) | Controles (n=26) | |
| Edad (años) | 59,5±12,4 | 58,6±11,4 | 60,9±13,9 | 64,2±6,4 |
| Mujeres (%) | 9 (28) * | 3 (20) * | 3 (25) * | 15 (57,7) |
| Factores de riesgo cardiovascular (%) | ||||
| Hipertensión | 21 (65,6) | 8 (53,3) | 9 (75) | 15 (57,7) |
| Tabaquismo | 21 (65,6) * | 10 (66,7) * | 10 (83,3) * | 4 (15,4) |
| Diabetes mellitus | 11 (34,4) | 5 (33,3) | 4 (33,3) | 8 (30,8) |
| Hipercolesterolemia | 14 (43,8) | 5 (33,3) | 5 (41,7) | 11 (42,3) |
| Infarto de cara anterior | 13 (42) | 7 (46,7) | 4 (33,3) | |
| Tratamiento trombolítico | 24 (74) | 12 (80) | 8 (66,7) | |
| Tiempo entre el inicio del dolor y la reperfusión (min) | 234±27 | 228±24,8 | 236±30,2 | |
| Fracción de eyección (%) | 51,9±12,2 | 52,5±13,4 | 50,6±12,7 | |
| Uso de abciximab | 22 (68,7) | 12 (80) | 10 (83,3) | |
| Pico de troponina T | 54,4±13,1 | 61,6±12,2 | 77±13,6 | |
IAMCEST: infarto agudo de miocardio con elevación del ST.
Los datos expresan n (% del total de cada grupo) o media±desviación estándar.
* Diferencias significativas en comparación con el grupo control (p<0,05).
La muestra de sangre inicial se extrajo una media de 234,4±27min después del inicio de los síntomas de IAMCEST, antes de empezar el tratamiento con fibrinolisis y heparina. Todos los subgrupos de células analizados presentaron valores más altos en los pacientes que en los controles (Tabla 2, Figura 1). Los pacientes continuaban presentando unos recuentos celulares superiores a los de los controles tras introducir un control para el sesgo de selección del sexo y el tabaquismo en un modelo lineal univariable.
Tabla 2. Inmunofenotipo/caracterización y media±desviación estándar del número de células progenitoras circulantes y citocinas en sangre periférica de los pacientes tras un infarto de miocardio con elevación del ST
| Control | Ingreso | Día 3 | Día 7 | |
| Número células/103PBMC | ||||
| CD34+ | 5,7±2 | 51,9±31,9 a | 51,5±32,3 a,b | 55,4±33 a,b |
| CD34+CD133+ | 0,6±0,3 | 9,2±5,7 a | 8,5±5,2 a,b | 10,5±6,5 a,b |
| CD34+KDR+ | 0,6±0,2 | 8,5±5,3 a | 8,2±5,3 a,b | 9,7±5,8 a,b |
| EPC | 0,5±0,2 | 6,8±4,5 a | 6,5±4,2 a,b | 8±5,2 a,b |
| Citocinas (pg/ml) | ||||
| VEGF | 57±26,6 | 68,1±43,9 | 97,7±63,9 a | 91,5±49,3 a,b |
| HGF | 859,1±607,8 | 10.175,5±4.561,3 c | 3.743,6±1.956,3 c | 2.655,4±4.023,9 a,b |
EPC: células progenitoras endoteliales; HGF: factor de crecimiento hepatocitario; PBMC: células mononucleares de sangre periférica; VEGF: factor de crecimiento endotelial vascular.
EPC definidas como células CD34+CD133+KRD+CD45+ (débil).
a Diferencias significativas en comparación con el grupo control (p<0,05).
b Diferencias significativas (prueba de Friedman) en determinaciones repetidas (p<0,001).
c Diferencias significativas en comparación con el grupo control (p<0,001).
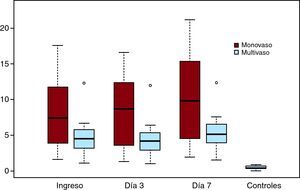
Figura 1. Cinética de las células progenitoras endoteliales según la extensión de la enfermedad coronaria.
La secuencia temporal mostró diferencias significativas en las cifras de las diferentes poblaciones celulares al ingreso y los días 3 y 7 postinfarto (Tabla 2, Figura 1). El análisis de las diferencias entre los grupos mostró valores elevados de todos los subgrupos celulares el día 7 en comparación con el día 3 y el día 7 en comparación con los valores obtenidos al ingreso (p<0,016). No se observaron diferencias en el número de células CD34+, CD34+CD133+ o CD34+KDR+ el día 3 en comparación con los valores al ingreso, si bien el número de células CD34+CD133+KDR+CD45+ (débil) fue inferior (p=0,012) (Tabla 2). No hubo diferencias en las cifras de los diversos subgrupos celulares ni en las citocinas en ninguna de las tres determinaciones en función de la presencia de disfunción ventricular postinfarto (FE<45%), excepto por los valores más elevados de VEGF en la segunda determinación en los pacientes con disfunción ventricular (0,294 frente a 0,22ng/ml; p<0,005).
El examen de las variaciones que se produjeron en los subgrupos celulares en los tres momentos de valoración considerados (al ingreso y a los 3 y 7 días) mostró diferencias significativas en cada uno de los subgrupos de células CD34+, CD34+CD133+, CD34+KDR+ y EPC, de tal manera que las EPC fueron significativamente inferiores el día 3 en comparación con el valor al ingreso (p<0,016) y las células CD34, CD34+CD133+, CD34+KDR+ y EPC fueron significativamente superiores el día 7 en comparación con el día de ingreso y el día 3 (p<0,016).
Determinación de citocinas y secuencia temporalLos valores de VEGF fueron significativamente mayores los días 3 y 7 de la fase aguda del infarto en comparación con los del grupo control (97,7 y 91,5 frente a 57pg/ml) (Tabla 2). No se observaron diferencias significativas entre los valores de VEGF al ingreso y los valores del grupo control (68,1 frente a 57) (Tabla 2). Los valores de HGF estaban aumentados en los tres momentos de valoración durante la fase aguda del infarto, en comparación con lo observado en el grupo control (10.175, 3.743 y 2.655 frente a 859pg/ml; p<0,003). La primera determinación fue significativamente mayor que la segunda y la tercera (p<0,016), sin que hubiera diferencias significativas entre las dos últimas (Tabla 2). Así pues, los valores de HGF fueron más altos durante la fase aguda del IAMCEST que en el grupo control, con un pico precoz en la primera determinación efectuada al ingreso.
Estos resultados ponen de manifiesto que las dos citocinas poseen cinéticas de liberación diferentes tras el infarto. El VEGF alcanzó un máximo el día 3, doblando los valores en sangre periférica, y luego se redujo progresivamente, pero continuó mostrando cifras altas el día 7 (1,8 veces las de los controles). Sin embargo, el HGF presentó valores muy altos al ingreso tras el infarto (11,8 veces superiores a los de los controles) y se mantuvo elevado durante toda la primera semana postinfarto, aunque con una reducción progresiva hasta el día 7 (3 veces superior a los valores de los controles).
Subgrupos de células, citocinas y secuencia temporal según el grado de extensión de la enfermedad coronaria (monovaso frente a multivaso)Se observaron diferencias significativas entre los diversos subgrupos de células progenitoras en los tres momentos de valoración en función del grado de extensión de la enfermedad coronaria, documentado mediante angiografía coronaria (Tabla 3). Los valores fueron más altos en los pacientes con enfermedad de un solo vaso. La cinética de liberación de los subgrupos de células progenitoras circulantes no variaba en función del grado de afección coronaria.
Tabla 3. Inmunofenotipo/caracterización y media±desviación estándar del número de los subgrupos de células progenitoras circulantes y citocinas en sangre periférica de los pacientes tras un infarto de miocardio con elevación del ST
| Control | Monovaso | Multivaso | |||||
| Ingreso | Día 3 | Día 7 | Ingreso | Día 3 | Día 7 | ||
| Número de células/103PBMC | |||||||
| CD34+ | 5,7±2 | 62,68±39,8 a,b | 60,9±39,7 a | 68,8±40,6 a,b | 37±17,9 a | 38,1±18,8 a | 38,3±16,8 a |
| CD34+CD133+ | 0,6±0,2 | 10,8±6,8 a | 10,1±5,6 a | 12,9±7,8 a,b | 7,1±3,8 a | 6,4±3,4 a | 7,8±3,7 a |
| CD34+KDR+ | 0,6±0,2 | 10±6,2 a | 9,2±5,7 a | 11,7±6,8 a | 6,6±3,5 a | 6,2±3,5 a | 7,3±3,4 a |
| EPC | 0,5±0,2 | 8,8±5,5 a,b | 8,2±4,9 a,b | 10,6±6,2 a,b | 4,8±2,8 a | 4,6±2,9 a | 5,6±2,7 a |
| Citocinas (pg/ml) | |||||||
| VEGF | 57±27,6 | 68,8±37,4 | 98,6±59,2 c | 96,1±42,5 c | 62,7±57,8 | 105,3±83,6 | 79,6±66,7 |
| HGF | 859,1±607,8 | 10.001±4.560,8 a | 3.037,4±4.228,4 a | 1.993,6±2.332,2 c | 10.306,44±3.603,8 c | 4.039,22±3.895,6 c | 3.396,9±5.989,8 c |
EPC: células progenitoras endoteliales; HGF: factor de crecimiento hepatocitario; PBMC: células mononucleares de sangre periférica; VEGF: factor de crecimiento endotelial vascular.
Diferencias significativas (prueba de Friedman) en las determinaciones repetidas (p<0,001) en diferentes subgrupos celulares en pacientes monovaso y multivaso.
EPC definidas como células CD34+CD133+KRD+CD45+ (débil).
a p<0,001 frente al grupo control.
b p<0,05 frente al grupo multivaso.
c p<0,05 frente al grupo control.
No se observaron diferencias entre los grupos de enfermedad monovaso y multivaso para los valores de las dos citocinas estudiadas, y la cinética de liberación fue similar en ambos grupos (Figura 1). No hubo diferencias entre los pacientes tratados con fibrinolisis o con angioplastia primaria, ni siquiera en la tercera determinación cuando había daño vascular debido a la implantación del stent.
Correlaciones entre el número de células CD34 y los subgrupos; cifras de citocinas (factor de crecimiento endotelial vascular y factor de crecimiento hepatocitario) y grado de extensión de la enfermedad coronaria (monovaso frente a multivaso)Ninguna de las correlaciones entre el número de células de los diferentes subgrupos analizados y los valores de VEGF y HGF en los tres momentos de valoración (al ingreso y a los 3 y 7 días) fue significativa (Tabla 4). Tampoco se observaron correlaciones significativas entre las concentraciones de células o de citocinas y el pico de cratincinasa o la FE<45% (Tabla 4). No se observaron diferencias significativas en las correlaciones de los subgrupos de células y las citocinas en presencia de enfermedad monovaso o multivaso en los pacientes a quienes se realizó una angiografía coronaria (datos no presentados) ni hubo diferencias en el número de células en los tres momentos de valoración. Tampoco se detectaron diferencias en las concentraciones de células y de citocinas ni en la cinética observada entre los pacientes tratados con angioplastia primaria y los tratados con fibrinolisis ni en los subgrupos con enfermedad monovaso o multivaso (datos no presentados).
Tabla 4. Correlaciones entre los subgrupos de células progenitoras endoteliales, citocinas, fracción de eyección y pico de creatincinasa
| VEGF | HGF | FE | Pico de CK | |||||||||
| Ingreso | Día 3 | Día 7 | Ingreso | Día 3 | Día 7 | Ingreso | Día 3 | Día 7 | Ingreso | Día 3 | Día 7 | |
| CD34 | 0,24 | −0,15 | −0,12 | −0,31 | −0,27 | 0,3 | 0,07 | 0,04 | 0,08 | 0,13 | 0,14 | 0,15 |
| CD34133 | 0,05 | −0,18 | −0,13 | −0,19 | −0,22 | 0,22 | 0,13 | 0,11 | 0,14 | 0,07 | 0,1 | 0,15 |
| CD34KDR | 0,03 | −0,14 | −0,12 | −0,21 | −0,21 | 0,24 | 0,1 | 0,08 | 0,15 | 0,07 | 0,09 | 0,06 |
| EPC | −0,08 | −0,3 | 0 | −0,03 | −0,16 | 0,12 | 0,23 | 0,17 | 0,25 | 0,18 | 0,17 | 0,04 |
| VEGF | 0,14 | 0,37 * | −0,13 | −0,17 | −0,41 * | 0,14 | ||||||
| HGF | 0,22 | −0,1 | −0,11 | −0,22 | −0,1 | 0,22 | ||||||
CK: creatincinasa; EPC: células progenitoras endoteliales; FE: fracción de eyección; HGF: factor de crecimiento hepatocitario; VEGF: factor de crecimiento endotelial vascular.
* p<0,05.
El principal resultado obtenido en este estudio fue el mayor número de EPC en sangre periférica en los pacientes con infarto y una enfermedad monovaso, en comparación con los pacientes con infarto y enfermedad multivaso, según lo documentado por la angiografía coronaria. La cinética de liberación de estas células en ambos subgrupos fue mayor el día 7 postinfarto, sin que se apreciaran diferencias significativas en la cinética de liberación de las dos citocinas estudiadas (VEGF y HGF) durante la primera semana postinfarto.
Un evento isquémico mayor libera EPC de la médula ósea y factores quimioatácticos (citocinas) en un intento de «reparar» el daño isquémico2, 16. Nuestros resultados indicaron un aumento muy notable de diversos subgrupos de células CD34+, incluidas las CD34+ CD133+ y KDR+CD45+ (débil) (10 veces el valor normal) y de las citocinas angiogénicas VEGF y HGF durante la primera semana siguiente al infarto, en comparación con un grupo control. Esta elevación fue muy precoz (en un plazo de 4 h tras el inicio de los síntomas) y los valores más altos para los subgrupos celulares se observaron el día 7 tras el inicio de los síntomas. Estos datos indican que la regulación adecuada de la señalización existente entre la médula ósea, la circulación periférica y el miocardio infartado es de gran importancia para la organización del proceso de movilización, alojamiento (homing), incorporación, supervivencia, proliferación y diferenciación de las células madre, que conduce a la regeneración del miocardio17.
Un análisis más detallado de las citocinas puso de manifiesto que el VEGF aumentaba a partir de la segunda determinación (día 3) y que el HGF mostraba un pico precoz de liberación en la primera determinación (en un plazo de 4 h tras el inicio de los síntomas), y se mantenía elevado en comparación con el grupo control, pero con una reducción gradual durante la primera semana postinfarto. Tras la lesión tisular, cuando hay una necesidad urgente de formación de nuevos vasos sanguíneos, el VEGF interviene en la proliferación, la diferenciación y la quimiotaxia de las células endoteliales. La elevación precoz del HGF postinfarto podría producirse en respuesta a la necesidad inicial que tiene el organismo de factores que induzcan la supervivencia celular, la antiapoptosis, una mejora de la supervivencia de los miocardiocitos en condiciones isquémicas y un estímulo de proliferación celular8, todo lo cual se ha descrito como factores asociados al HGF. Posteriormente, después de establecida la lesión isquémica (días 3-7), el miocardio intenta favorecer la formación de microvasos, un estímulo angiogénico que se produce a través del VEGF18.
Las EPC se reducen en ciertos trastornos crónicos, en presencia de factores de riesgo cardiovascular y en las personas de edad avanzada18; se ha observado incluso una menor capacidad de producir unidades formadoras de colonias en pacientes con enfermedad coronaria crónica y lesiones multivaso19. Sin embargo, a pesar del desarrollo de la terapia celular en pacientes postinfarto, la cinética de liberación de las células progenitoras circulantes y las citocinas en sangre periférica no se conoce, al igual que ocurre con su relación con el grado de extensión de la enfermedad coronaria en los pacientes con un infarto reciente. Esta información podría ser útil para decidir qué pacientes podrían obtener un efecto beneficioso con este tratamiento y en qué momento concreto debe aplicarse. El número inferior de EPC en los pacientes con enfermedad multivaso podría ser consecuencia de la pérdida de la capacidad de regeneración vascular del organismo y la liberación de un número suficiente de EPC, como se ha descrito en los pacientes con trastornos arterioscleróticos.
Por lo que respecta a la cinética de las dos citocinas angiogénicas, los valores de VEGF aumentaron a partir del día 3 en los pacientes con enfermedad coronaria monovaso y en los que tenían enfermedad multivaso, sin que se apreciaran diferencias entre los dos grupos. Sin embargo, se observaron diferencias significativas entre los pacientes con enfermedades monovaso y los controles. De todos modos, tras un pico precoz en las cifras de HGF al ingreso, estas se mantuvieron estables los días 3 y 7 en ambos grupos, en comparación con los controles. El nivel de significación en comparación con el grupo control fue mayor en los pacientes con enfermedad coronaria multivaso. Se sabe que el HGF induce la angiogénesis de manera independiente del VEGF20 y actúa en sinergia con el VEGF para la amplificación de la angiogénesis. Nuestros resultados indican que los valores de HGF se mantienen con el tiempo en los pacientes con mayor extensión de la enfermedad coronaria, con objeto de estimular la liberación de EPC a la sangre periférica en los pacientes cuyas cifras de EPC están claramente reducidas. De igual modo, el hecho de que no hubiera diferencias significativas en los valores de VEGF respecto a los controles podría haberse visto compensado por una mayor producción de HGF en los pacientes con mayor afección vascular. Además, este mayor aumento podría estar relacionado con la capacidad del HGF de inducir la proliferación no sólo en las EPC movilizadas, sino también en las células endoteliales residentes21, y mejorar la supervivencia de los miocardiocitos en los pacientes con enfermedad coronaria multivaso.
Al igual que otros autores6, 11, no encontramos correlación alguna entre las cifras de los diversos subgrupos celulares y las citocinas examinadas. Las diferencias en el número de personas estudiadas, el tipo de población en estudio (no seleccionada, tratada con otras opciones de reperfusión distintas de las de nuestro estudio) y la notable variación interindividual en el número de células, según lo descrito por Leone et al13, pueden explicar esta discrepancia. Tampoco detectamos asociación alguna del número de células y las citocinas con la FE ventricular izquierda, lo cual coincide nuevamente con lo indicado por otros autores12, aunque algunos estudios indican que cuanto mayor es el aumento de las células mononucleares mejor es la recuperación de la función ventricular13, y otros han observado una asociación entre el número de células mononucleares y la mejora de la función ventricular, lo cual indica un efecto beneficioso de estas células13.
El valor clínico de este estudio es relevante, puesto que muestra diferencias en las cifras de EPC entre los subgrupos de pacientes con un primer infarto en función del grado de extensión de la enfermedad coronaria y la importancia que puede tener el HGF en la respuesta del organismo a una mayor extensión de la enfermedad coronaria. Estos resultados podrían ser útiles para aclarar uno de los aspectos actualmente controvertidos de la terapia celular, es decir, qué tipo de células utilizar y el mejor momento para realizar la implantación22, 23, 24. A diferencia de las células progenitoras mesenquimatosas, cuya liberación parece ser muy temprana, la liberación de las células progenitoras CD34 es más constante en la primera semana y puede ser aún mayor al séptimo día, como se ha descrito aquí. Esto podría señalar a un efecto beneficioso de una implantación celular tardía (día 5 a 7), como se ha descrito en el test clínico REPAIR-AMI25. Los resultados de este estudio indican también que el número de células necesario para alcanzar un efecto clínicamente relevante es mayor en los pacientes con enfermedad coronaria multivaso. Es de destacar la importancia clínica del HGF para estimular la reparación de la lesión y su posible relación con el pronóstico de los pacientes con enfermedad multivaso, lo que deberá examinarse con mayor detalle en futuros estudios.
LimitacionesA pesar del número de pacientes de este estudio, observamos diferencias claras en el número de células en función del grado de extensión de la enfermedad coronaria en pacientes con un primer infarto agudo de miocardio. Optamos por estudiar casos de primer infarto con objeto de evitar un sesgo en el número de células progenitoras circulantes derivado de una isquemia previa. No conocemos el posible mecanismo de la isquemia previa en los pacientes con enfermedad coronaria multivaso. Una posible limitación es la relativa a las diferencias existentes en las características basales por sexo y edad, a pesar del empleo de un modelo lineal univariable. Este estudio aporta una posible explicación a las diferencias entre las enfermedades coronarias monovaso y multivaso. Serán necesarios nuevos estudios para determinar la eficacia de esta idea.
ConclusionesNuestros resultados muestran la movilización de un mayor número de células progenitoras de sangre periférica en pacientes que presentan un primer infarto agudo de miocardio y enfermedad coronaria monovaso respecto a los pacientes con un primer infarto y enfermedad multivaso, según lo documentado por la angiografía coronaria. La cinética de liberación (VEGF, HGF) en ambos subgrupos de pacientes fue mayor el día 7 tras el infarto. El HGF mostró un pico precoz, en un plazo de 4 h tras el inicio de los síntomas, y con valores superiores los días 3 y 7 para los pacientes con enfermedad coronaria aguda multivaso, lo cual indica un papel relevante del HGF en la proliferación y la reparación del tejido cardiaco en estos pacientes.
FinanciaciónEste trabajo fue financiado por subvenciones (TCMR014/2006 y TCMR018/2005) de la Consejería de Salud, Junta de Andalucía, y la Consejería de Economía, Innovación y Ciencia (proyecto de excelencia número CTS-6568) de España. Este estudio recibió también una financiación parcial de la Red Cardiovascular (RECAVA) del Fondo de Investigación Sanitaria del Ministerio de Sanidad y Consumo.
Conflicto de interesesNinguno.
Agradecimientos
Queremos agradecer al Dr. Juan Moreno Josende una generosa beca a nuestro grupo. Damos las gracias al Servicio de Hematología del Hospital Clínico de Málaga por su ayuda técnica en el análisis de los subgrupos celulares con citometría de flujo; a la Dra. Silvia García-Segovia, becaria predoctoral de la Fundación Progreso y Salud (Consejería de Salud, Junta de Andalucía) y a Beatriz Segura por su ayuda técnica, y a la Dra. Consuelo del Cañizo, Servicio de Hematología del Hospital Clínico de Salamanca, por la revisión del manuscrito inicial.
Recibido 12 Mayo 2011
Aceptado 3 Julio 2011
Autor para correspondencia: Servicio de Cardiología, Hospital Clínico Universitario Virgen de la Victoria, Campus de Teatinos s/n, 29010 Málaga, España. jimeneznavarro@secardiologia.es