El 30% de los casos de ictus sigue siendo de etiología desconocida (criptogénicos). En un 20-28% de los pacientes con ictus inicialmente clasificados como criptogénicos, se detecta posteriormente fibrilación auricular paroxística. El objetivo de este estudio es analizar la función auricular izquierda de pacientes con ictus isquémico para identificar patrones asociados a la etiología cardioembólica y determinar si se puede observar tales patrones en individuos clasificados inicialmente como ictus criptogénicos.
MétodosSe incluyó una cohorte de pacientes hospitalizados por ictus isquémico remitidos a ecocardiografía transtorácica. Los neurólogos al cargo determinaron la etiología del ictus según la clasificación TOAST. Se evaluó la función contráctil de la aurícula izquierda utilizando ecocardiografía bidimensional para determinar su fracción de eyección, y mediante técnicas de deformación miocárdica (speckle tracking o rastreo de marcas) se determinó la onda a del strain rate (tasa de deformación). Se comparó la función de la aurícula izquierda entre los subgrupos etiológicos del ictus así como con un grupo de control de individuos sanos.
ResultadosSe incluyó a 97 pacientes (de 67±15 años) con ictus isquémico (el 16,5% aterotrombóticos, el 15,5% lacunares, el 11,3% cardioembólicos, el 5,1% de otra etiología determinada y el 51,1% criptogénicos) y 10 voluntarios sanos (de 63±7 años). Se observó una disminución significativa de la fracción de eyección de la aurícula izquierda solo en los pacientes con ictus cardioembólico y criptogénico respecto al grupo de control (31,5±17,2%, 40,2±17,1% y 59,1±8,4% respectivamente; p=0,004). El strain-rate de la aurícula izquierda fue significativamente inferior en los pacientes con ictus cardioembólicos, criptogénicos o aterotrombóticos en comparación con el grupo control (–0,86±0,49, –1,31±0,56, –1,5±0,47 y –2,37±1,18 respectivamente; p<0,001).
ConclusionesLos pacientes con ictus criptogénico que presentan una función auricular izquierda (fracción de eyección y strain) similar a la de los pacientes con ictus cardioembólico podrían estar clasificados de forma incorrecta, por lo que en ellos sería útil una monitorización electrocardiográfica prolongada. El análisis de la función auricular izquierda (fracción de eyección y strain) podría ser útil para identificar a los pacientes con ictus cardioembólico inicialmente mal clasificados como criptogénicos.
Palabras clave
El ictus es una causa importante de mortalidad y discapacidad en los adultos, especialmente el ictus cardioembólico, pero la etiología puede seguir siendo desconocida tras el estudio diagnóstico detallado1–3. Entre las demás causas de ictus4, se encuentra el ictus aterotrombótico, el lacunar y el de otra etiología determinada. Cuando la ecocardiografía muestra la presencia de masas o una disfunción significativa del ventrículo izquierdo, el ictus cardioembólico es relativamente fácil de diagnosticar. No obstante, la mayoría de los ictus cardioembólicos son secundarios a fibrilación auricular (FA)5, que es un factor de riesgo de esta etiología independiente y claramente establecido6.
En aproximadamente un 10% de los pacientes con ictus isquémico agudo o con un accidente isquémico transitorio, se diagnostica FA durante su hospitalización7; en otro 12% de los pacientes, puede hallarse FA cuando se los criba con monitorización electrocardiográfica continua prolongada8,9, que recientemente se ha introducido en las recomendaciones para el estudio de los pacientes con ictus isquémico agudo o accidente isquémico transitorio sin causa aparente10. Dada la importante prevalencia de FA en la población general, es posible que algunos ictus cardioembólicos se clasificaran erróneamente como criptogénicos. Si se pudiera confirmar un origen cardioembólico, este grupo de pacientes podría beneficiarse del inicio de un tratamiento anticoagulante. En estudios previos se ha señalado que la FA no conocida podría darse en un 20–28% de los pacientes con ictus criptogénico11–15.
Es bien sabido que el tamaño de la aurícula izquierda (AI) es predictor de FA e ictus16,17 y que está relacionado también con ictus en pacientes sin FA previa18,19. La función de la AI, evaluada mediante los cambios volumétricos (fracción de eyección de la AI [FEAI]) o técnicas de deformación miocárdica (strain de la AI [SAI] y strain rate de la AI [SRAI])20–23, se ha relacionado también con la FA paroxística15,24–26. En los pacientes con ictus criptogénico, el SAI (onda s) se ha relacionado con la FA paroxística27. Además, en pacientes con FA persistente, el SAI fue predictor de ictus28 incluso en pacientes con bajo riesgo de ictus29. Más recientemente, el diagnóstico de FA paroxística mediante monitorización Holter continua se ha relacionado con cambios de la función de la AI en pacientes con ictus criptogénico15; los pacientes con FA presentaron mayor reducción de la función de la AI que los pacientes sin FA.
La puntuación CHA2DS2-VASc (insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 [doble], diabetes mellitus, ictus previo [doble], enfermedad vascular, edad 65–74 y sexo [mujer])30 incluye parámetros clínicos para establecer el riesgo de ictus en pacientes con FA. Además, es un potente predictor de ictus isquémico en pacientes con enfermedad coronaria sin FA31,32.
Teniendo en cuenta la prevalencia de FA que los pacientes con ictus pueden tener y el elevado número de pacientes con ictus de etiología criptogénica, se plantea la hipótesis de que algunos ictus clasificados como criptogénicos podrían tener un origen cardioembólico, con una FA subyacente silente y no diagnosticada. En este sentido, la evaluación de indicadores indirectos de disfunción auricular, como el tamaño y la función de la AI, podría delimitar un subgrupo de pacientes con riesgo de FA y, por lo tanto, una posible reclasificación al grupo de ictus cardioembólico. Así pues, el objetivo de este estudio es caracterizar la función de la AI en pacientes hospitalizados por ictus isquémico, para identificar patrones de función de la AI que permitirían detectar ictus potencialmente mal diagnosticados como criptogénicos cuando el origen en realidad sería cardioembólico. Para estos pacientes, podría resultar útil la monitorización electrocardiográfica a largo plazo y la apropiada introducción de tratamiento anticoagulante, que podría reducir el riesgo de recurrencia de ictus.
MÉTODOSSe incluyó en el estudio una cohorte retrospectiva de pacientes hospitalizados por ictus isquémico y remitidos a ecocardiografía transtorácica durante la hospitalización entre 2010 y 2013. El neurólogo a cargo del tratamiento estableció el diagnóstico final basándose en la clasificación TOAST4.
PacientesLa cohorte retrospectiva incluyó a pacientes ingresados en la unidad de ictus del centro por un ictus isquémico a los que se había practicado una ecocardiografía transtorácica como parte del estudio para determinar su etiología. En el estudio de la etiología del ictus, la ecocardiografía se realiza principalmente a pacientes con infarto de vaso grande sin estenosis intracraneal o extracraneal significativa (< 50%). Los criterios de exclusión fueron el ictus hemorrágico, la reducción intensa de la fracción de eyección del ventrículo izquierdo (< 35%), las valvulopatías cardiacas graves, la presencia de válvulas cardiacas protésicas y la endocarditis activa. Se evaluó el riesgo de ictus con la puntuación CHA2DS2-VASc30. Para disponer de valores de referencia de la función normal de la AI, se incluyó a un grupo de voluntarios sanos sin ninguna enfermedad cardiovascular previa conocida, apareados por edad con los pacientes. Todos los participantes firmaron un documento de consentimiento informado por escrito y el estudio recibió la autorización del comité ético del centro.
Diagnóstico del ictusEl neurólogo que los trataba estableció el diagnóstico del ictus; solo se incluyó a pacientes con ictus isquémico. Los pacientes ingresaron en la unidad de ictus y se realizó monitorización electrocardiográfica continua durante 72 h, así como una evaluación de las arterias extracraneales e intracraneales mediante ecografía o angiografía por resonancia magnética. Empleando la clasificación TOAST4, se subdividió la etiología del ictus en cardioembólica, aterotrombótica, lacunar, otra etiología determinada o criptogénica.
Realización y análisis de la ecocardiografíaSe realizó una ecocardiografía transtorácica bidimensional con Doppler convencional y Doppler tisular con el sistema comercial Philips IE33 (Andover, Massachusetts, Estados Unidos). Todos los pacientes estuvieron en ritmo sinusal durante la ecocardiografía. Se obtuvieron imágenes ecocardiográficas bidimensionales a una frecuencia > 50 fotogramas/s, que se almacenaron digitalizadas para un análisis posterior en una estación de trabajo por dos ecocardiografistas que no conocían el diagnóstico final del subtipo de ictus. Se determinaron las dimensiones de la AI y el ventrículo izquierdo según las recomendaciones actuales33. Se determinó el volumen de la AI al final de la diástole y la sístole desde plano apical de cuatro cámaras. La FEAI se calculó con la fórmula [(diástole AI – sístole AI)/diástole AI]×100. La deformación longitudinal de la AI se analizó posteriormente, a partir de la ecocardiografía bidimensional con un programa informático comercial (Qlab versión 7.1, Philips), utilizando speckle tracking para determinar strain y strain rate. Partiendo de la proyección apical de cuatro cámaras, se seleccionaron tres puntos en la AI (dos en el anillo mitral y uno en el techo de la AI) y se trazó manualmente el borde endocárdico usando la técnica de apuntar y hacer clic. El programa informático dividió la pared de la AI en seis segmentos, y el promedio se utilizó para el análisis. Se determinaron los siguientes parámetros de la AI: SAI durante la sístole ventricular, SRAI durante la sístole ventricular, SRAI durante la fase temprana de llenado ventricular y SRAI durante la diástole tardía/contracción auricular (SRAIa). Se tomó el inicio del complejo QRS en el electrocardiograma de superficie21–23 como punto de referencia para el análisis del strain (figura 1). Se tomó el SRAIa como valor de referencia para el strain, ya que se ha relacionado con el inicio de la FA en población general de manera más intensa que el SRAI durante la sístole ventricular26.
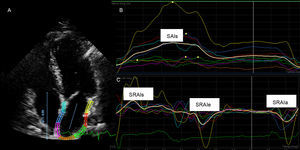
Perfiles de strain de la aurícula izquierda medidos con el dispositivo Qlab (Philips). A: ecocardiografía bidimensional en proyección apical de cuatro cámaras; el borde endocárdico de la aurícula izquierda se trazó manualmente con la técnica de apuntar y hacer clic. B: strain longitudinal general de la aurícula izquierda. C: ondas de strain rate de la aurícula izquierda durante la sístole ventricular; SAIs: strain general de la aurícula izquierda; SRAIa: strain rate de la aurícula izquierda durante la diástole tardía/contracción auricular; SRAIe: strain rate auricular durante la fase temprana del llenado ventricular; SRAIs: strain rate de la aurícula izquierda durante la sístole ventricular.
Las variables se presentan como media±desviación estándar, distribución de frecuencias o porcentajes, según proceda. Se evaluó la distribución normal de las variables cuantitativas empleando la prueba de Kolmogorov-Smirnov. Se utilizó un análisis descriptivo y comparativo de los diferentes grupos diagnósticos. Se empleó la prueba de la χ2 o la prueba de Fisher para comparar las variables discretas, y la prueba de la t de Student para muestras independientes en las variables cuantitativas. Se utilizaron las pruebas estadísticas de análisis de la varianza y de Bonferroni para comparar las variables cuantitativas de más de dos grupos. Se consideró estadísticamente significativo p<0,05 (bilateral). Se analizó la variabilidad intraobservador e interobservadores (alfa de Cronbach) en 10 pacientes para el análisis del SAI, y sus respectivos resultados fueron los siguientes: SAI, 0,984, 0,978; SRAI durante la sístole ventricular, 0,979, 0,953; SRAIa, 0,963, 0,960, y SRAI durante la fase temprana de llenado ventricular, 0,961, 0,943. Los datos se analizaron con el programa SPSS versión 19 (IBM; Armonk, Nueva York, Estados Unidos).
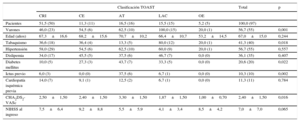
RESULTADOSCaracterísticas demográficas y datos clínicosSe excluyó a 7 pacientes debido a la mala calidad de la ecocardiografía. Finalmente, se incluyó a 97 pacientes con ictus isquémico y 10 controles sanos (67±15 frente a 63±8 años; p=0,36). Las características basales de los pacientes con ictus se indican en la tabla 1. Los pacientes eran mayoritariamente varones con hipertensión, tabaquismo y puntuación CHA2DS2-VASc de 2,4±1,5. La etiología del ictus más prevalente fue la criptogénica, seguida de la aterotrombótica y la lacunar. Solo 5 pacientes tenían FA previa conocida; finalmente se clasificó a todos en la categoría de ictus cardioembólico. Los pacientes con ictus de otra etiología determinada eran más jóvenes y tenían baja prevalencia de factores de riesgo cardiovascular. En cambio, en los grupos de ictus lacunar y aterotrombótico se daba la prevalencia más alta de factores de riesgo cardiovascular. La máxima puntuación CHA2DS2-VASc se observó en el grupo de pacientes con ictus aterotrombótico, y se atribuyó a la mayor prevalencia de diabetes mellitus y antecedentes de ictus previo. A pesar de tener puntuaciones CHA2DS2-VASc inferiores, entre los pacientes con ictus de tipo lacunar había también mayor porcentaje de varones y fumadores. Al no haber antecedentes conocidos de enfermedad cardiovascular o ictus en los controles sanos, su puntuación CHA2DS2-VASc media fue de 0,6±0,8.
Características basales de los pacientes con ictus
| Clasificación TOAST | Total | p | |||||
|---|---|---|---|---|---|---|---|
| CRI | CE | AT | LAC | OE | |||
| Pacientes | 51,5 (50) | 11,3 (11) | 16,5 (16) | 15,5 (15) | 5,2 (5) | 100,0 (97) | |
| Varones | 46,0 (23) | 54,5 (6) | 62,5 (10) | 100,0 (15) | 20,0 (1) | 56,7 (55) | 0,001 |
| Edad (años) | 67,3±16,6 | 68,2±15,6 | 70,7±10,2 | 66,4±10,7 | 53,2±14,5 | 67,0±15,0 | 0,244 |
| Tabaquismo | 36,6 (18) | 36,4 (4) | 13,3 (5) | 80,0 (12) | 20,0 (1) | 41,3 (40) | 0,018 |
| Hipertensión | 58,0 (29) | 54,5 (6) | 62,5 (10) | 60,0 (9) | 20,0 (1) | 56,7 (55) | 0,557 |
| Dislipemia | 34,0 (17) | 45,5 (5) | 37,5 (6) | 46,7 (7) | 0,0 (0) | 36,1 (35) | 0,407 |
| Diabetes mellitus | 10,0 (5) | 27,3 (3) | 43,7 (7) | 33,3 (5) | 0,0 (0) | 20,6 (20) | 0,022 |
| Ictus previo | 6,0 (3) | 0,0 (0) | 37,5 (6) | 6,7 (1) | 0,0 (0) | 10,3 (10) | 0,002 |
| Cardiopatía isquémica previa | 14,0 (7) | 9,1 (1) | 12,5 (2) | 6,7 (1) | 0,0 (0) | 11,3 (11) | 0,784 |
| CHA2DS2-VASc | 2,50±1,50 | 2,40±1,50 | 3,30±1,50 | 1,87±1,50 | 1,00±0,70 | 2,40±1,50 | 0,016 |
| NIHSS al ingreso | 7,5±6,4 | 9,2±8,8 | 5,5±5,9 | 4,1±3,4 | 8,5±4,2 | 7,0±7,0 | 0,065 |
AT: aterotrombótico; CE: ictus cardioembólico; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 (doble), diabetes mellitus, ictus previo (doble), enfermedad vascular, edad 65-74 y sexo (mujer); CRI: criptogénico; LAC: lacunar; NIHSS: National Institute of Health Stroke Scale; OE: otra etiología conocida;; TOAST: Trial of Org 10172 in Acute Stroke Treatment.
Los datos expresan % (n) o media±desviación estándar.
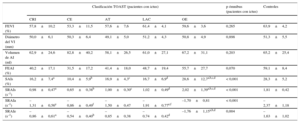
En la tabla 2 se muestran los parámetros ecocardiográficos de los diferentes grupos de etiología del ictus y el grupo de control. En el análisis de la varianza de los diversos subtipos de ictus, no se observaron diferencias en cuanto a las dimensiones del ventrículo izquierdo, la fracción de eyección del ventrículo izquierdo, el volumen de la AI o la FEAI. A pesar de la tendencia de los pacientes con ictus cardioembólico a mayor volumen de la AI y menor FEAI, las diferencias entre los distintos grupos no alcanzaron significación estadística. Al analizar la función de la AI utilizando la deformación auricular, los pacientes con ictus de otra etiología determinada presentaron unos valores similares a los de los controles sanos. Todos los demás pacientes con otros subtipos de ictus presentaron unos parámetros de deformación de la AI (SAI durante la sístole ventricular, SRAI durante la sístole ventricular, SRAI durante la fase temprana de llenado ventricular) significativamente inferiores, aunque sin diferencias significativas entre ellos. El SRAIa estaba disminuido en todos los subtipos de ictus, y los valores más bajos fueron los observados en los pacientes con ictus criptogénico e ictus cardioembólico, sin que se apreciaran diferencias estadísticamente significativas entre ellos, aunque ambos mostraron unos valores de SRAIa significativamente menores que los pacientes con ictus lacunar. Estos resultados indican deterioro de la función de la AI en los pacientes con ictus, y en especial en el grupo de ictus cardioembólico, que fue el que presentó menor valor de SAI.
Parámetros ecocardiográficos
| Clasificación TOAST (pacientes con ictus) | p ómnibus (pacientes con ictus) | Controles | |||||
|---|---|---|---|---|---|---|---|
| CRI | CE | AT | LAC | OE | |||
| FEVI (%) | 57,8±10,2 | 53,3±11,5 | 57,6±7,6 | 61,4±4,1 | 59,6±3,6 | 0,265 | 63,9±4,2 |
| Diámetro del VI (mm) | 50,0±6,1 | 50,3±6,4 | 49,1±5,0 | 51,2±4,3 | 50,8±4,9 | 0,898 | 51,3±5,5 |
| Volumen de AI (ml) | 62,9±24,6 | 82,8±40,2 | 58,1±26,5 | 61,0±27,1 | 67,2±31,1 | 0,203 | 65,2±25,4 |
| FEAI (%) | 40,2±17,1 | 31,5±17,2 | 41,4±18,0 | 48,7±19,4 | 55,7±27,7 | 0,070 | 59,1±8,4 |
| SAIs (%) | 16,2±7,4a | 10,4±5,9b | 16,9±4,3c | 16,7±6,9d | 28,6±12,7a,b,c,d | < 0,001 | 28,3±5,2 |
| SRAIs (s–1) | 0,98±0,47a | 0,65±0,38b | 1,00±0,30c | 1,02±0,49d | 2,02±1,39a,b,c,d | < 0,001 | 1,81±0,42 |
| SRAIa (s–1) | –1,31±0,56e | –0,86±0,49f | –1,50±0,47 | –1,91±0,77e,f | –1,70±0,81 | < 0,001 | –2,37±1,18 |
| SRAIe (s–1) | –0,86±0,61a | –0,54±0,40b | –0,85±0,38 | –0,74±0,42d | –1,76±1,15a,b,d | 0,004 | –1,63±1,02 |
AI: aurícula izquierda; AT: aterotrombótico; CE: cardioembólico; CRI: criptogénico; FEAI: fracción de eyección de la aurícula izquierda; FEVI: fracción de eyección del ventrículo izquierdo; LAC: lacunar; OE: otra etiología conocida; SAIs: strain de la aurícula izquierda durante la sístole ventricular; SRAIa: strain rate de la aurícula izquierda durante la diástole tardía/contracción auricular; SRAIe: strain rate de la aurícula izquierda durante la fase temprana de llenado ventricular; SRAIs: strain rate de la aurícula izquierda durante la sístole ventricular; TOAST: Trial of Org 10172 in Acute Stroke Treatment; VI: ventrículo izquierdo.
Diferencias estadísticamente significativas en el análisis de Bonferroni post-hoc:
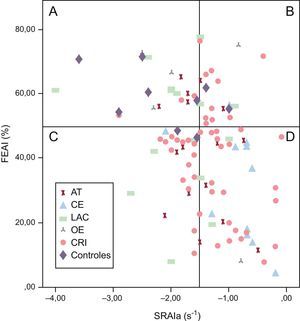
Con objeto de identificar posibles parámetros de la función de la AI, se clasificó a los pacientes según su función de la AI fuera normal o anormal. Para definir la «normalidad», se tomó un valor de corte de la FEAI del 50%, según lo indicado en publicaciones previas15,24. Además, se determinó la «normalidad» de la función de bomba de la AI con los valores de SRAIa obtenidos en el grupo de control: el valor medio en este grupo fue de –2,37±1,18s−1 (intervalo de confianza del 95%, –1,52 a –3,21s−1). El límite inferior del intervalo de confianza (–1,52s−1) se tomó como límite de la normalidad del SRAIa. En la figura 2 se muestra la distribución de la cohorte completa de pacientes con ictus según los valores de FEAI y SRAIa. La mayoría de los pacientes con ictus cardioembólico (82%) presentaron un deterioro uniforme de la función de la AI (reducción de la FEAI y reducción del SRAIa) y estaban situados en el cuadrante «d». En la población de estudio, el 44% de los pacientes con ictus criptogénico estaban situados también en el cuadrante «d». Los demás subtipos de ictus presentaban una distribución difusa en todos los cuadrantes.
Distribución de los pacientes según la fracción de eyección de la aurícula izquierda y el strain rate de la aurícula izquierda. Cuadrante «a»: fracción de eyección de la aurícula izquierda y strain rate de la aurícula izquierda (onda a) normales; cuadrante «b»: fracción de eyección de la aurícula izquierda normal y strain rate de la aurícula izquierda (onda a) bajo; cuadrante «c»: fracción de eyección de la aurícula izquierda baja y strain rate de la aurícula izquierda (onda a) normal; cuadrante «d»: fracción de eyección de la aurícula izquierda y strain rate de la aurícula izquierda (onda a) bajo. AT: ictus aterotrombótico; CE: ictus cardioembólico; CRI: ictus criptogénico; FEAI: fracción de eyección de la aurícula izquierda; LAC: ictus lacunar; OE: otra etiología del ictus determinada; SRAIa: strain rate de la aurícula izquierda (onda a).
Se estudió la función de la AI de pacientes con diferentes subtipos de ictus isquémico según lo definido por la clasificación TOAST. En los pacientes con ictus cardioembólico hubo un deterioro significativo de la función de la AI (FEAI y SAI). Ninguno de los pacientes con ictus criptogénico tenía antecedentes conocidos de una FA previa, pero casi la mitad de ellos presentaban un deterioro de la función de la AI similar al de los pacientes con ictus cardioembólico, lo cual indica que una disfunción importante de la AI podría haber sido el origen del ictus isquémico. Los pacientes con otros tipos de ictus no presentaban un patrón definido de función de la AI, si bien los pacientes con ictus aterotrombóticos mostraban también un leve deterioro de la función de la AI.
En estudios previos12–15,17 se ha descrito que hasta un 28% de los pacientes con ictus criptogénico experimentan FA durante el seguimiento. Estos pacientes presentan un aumento del riesgo de recurrencia de ictus a menos que se les administre un tratamiento apropiado. Las últimas guías10 recomiendan monitorización Holter de larga duración (30 días). Al igual que otros autores27, se ha observado que el análisis de la función de la AI también permitía detectar o predecir la FA al ingreso, lo que resulta más cómodo para los pacientes, puesto que ya se adquieren imágenes para la exploración ecocardiográfica ordinaria y solo es necesario el posprocesado. La monitorización de larga duración es costosa y está poco disponible. En consecuencia, la ecocardiografía es una exploración con una relación coste-efectividad favorable para la selección de los pacientes que podrían beneficiarse de la monitorización a largo plazo.
Durante el ciclo cardiaco, la AI actúa como un reservorio que recibe el retorno venoso pulmonar durante la sístole del ventrículo izquierdo; constituye también un conducto para el paso pasivo de la sangre al ventrículo izquierdo durante la fase inicial de la diástole y actúa como bomba en el llenado activo del ventrículo izquierdo en la fase tardía de la diástole. Todas estas funciones intervienen en la contribución de la aurícula al volumen de eyección34. La FEAI es un marcador de la función general de la AI y se ha relacionado con la aparición de FA15,24. En el presente estudio, la FEAI estaba reducida en los pacientes con ictus cardioembólicos, según lo descrito anteriormente, y también en los pacientes con ictus criptogénicos15. Se ha propuesto que la FEAI < 50% es el valor umbral para descartar o sospechar ictus cardioembólico15 e identificar la FA paroxística20. En esta población, solo 1 paciente con ictus cardioembólico presentó una FEAI > 50%. Teniendo en cuenta lo publicado en estudios previos que han relacionado el SAI con la aparición de FA paroxística16,26, se propone agregar el análisis del SAI al de la FEAI no solo para descartar el diagnóstico de ictus cardioembólico, sino también para una posible identificación de los pacientes con ictus cardioembólico que pudieran haberse erróneamente como ictus criptogénico, con objeto de ampliar el estudio etiológico mediante monitorización de larga duración e iniciar tratamiento anticoagulante.
Es de destacar que la mayoría de los pacientes presentaban un deterioro de la función de reservorio (determinada mediante SAI y SRAI durante la sístole ventricular), lo cual se relaciona con fibrosis de la AI35,36 y la función del ventrículo izquierdo. Para los pacientes con ictus criptogénicos, recientemente se ha propuesto el empleo del SAI como un instrumento útil para la detección de los pacientes con FA paroxística oculta27. En el presente estudio, el deterioro del SAI fue similar en los grupos de pacientes con ictus criptogénico, aterotrombótico y lacunar y menor en el grupo de pacientes con ictus cardioembólico. Se tomó el SRAIa como marcador de la función de la AI indicativo de FA oculta, dada la evidencia de que este parámetro es superior al SAI para detectar FA paroxística en la población general26. La función de bomba de la AI (SRAIa) tuvo un valor más bajo en los subgrupos de pacientes con ictus cardioembólico (–0,86±0,49s−1) e ictus criptogénico (–1,31±0,56s−1), pero su reducción fue mucho menor en el grupo de ictus aterotrombóticos (–1,5±0,47s−1). La clasificación de los pacientes en función de la FEAI y el SRAIa (figura 2) puso de manifiesto que los pacientes con ictus cardioembólicos estaban claramente confinados al cuadrante de FEAI baja y SRAIa bajo, lo que indica clara relación entre la disfunción de la AI y la etiología cardioembólica. En estudios previos se ha descrito también la asociación existente entre disminución del SAI e ictus en los pacientes con FA crónica persistente28,29; los resultados del presente estudio confirman esta asociación descrita con anterioridad y plantean la cuestión del posible papel del análisis de la función de la AI mediante el SAI en los pacientes con ictus cardioembólicos con objeto de mejorar su estratificación del riesgo de recurrencia del ictus.
En los pacientes con ictus criptogénicos hubo un deterioro de la FEAI o el SRAIa y casi la mitad de ellos presentaron bajos valores de ambos parámetros. En los pacientes con ictus de otra etiología conocida y en los individuos del grupo de control, la distribución de estos valores fue similar; estas observaciones podrían explicarse por el hecho de que estas «otras» etiologías del ictus (vasculopatías no ateroscleróticas, estados de hipercoagulabilidad, trastornos hematológicos) están menos relacionadas con la aterosclerosis sistémica. Por lo que respecta a los demás pacientes con otros subtipos de ictus, se observó una distribución difusa en todos los cuadrantes, lo cual indica ausencia de relación con la función de la AI. No se observaron diferencias significativas del SRAIa entre los pacientes con ictus lacunares y el grupo de control. La observación de que los pacientes con ictus criptogénicos presentaban un deterioro significativo de la función de la AI que difería significativamente del de los demás subtipos (excepto el ictus cardioembólico) indica asociación entre la disfunción de la AI y el ictus criptogénico. Los pacientes con ictus criptogénico y deterioro de la función de la AI (tanto la FEAI como el SRAIa) podrían presentar una posible FA paroxística y, en consecuencia, el ictus podría tener origen cardioembólico.
El volumen de la AI se ha relacionado con la aparición de FA16, y también con la incidencia de ictus en los pacientes sin FA conocida18,19. En esta cohorte, el volumen de la AI no mostró diferencias significativas entre los grupos, a pesar de la tendencia de los pacientes con ictus cardioembólicos a un mayor volumen de la AI; de hecho, esta tendencia podría ser secundaria a la presencia de un porcentaje de pacientes con ictus cardioembólicos que ya tenían FA paroxística conocida (36,4%). Los volúmenes de la AI similares entre los pacientes con ictus criptogénicos y los controles sanos indican que este parámetro es de menor utilidad para la reclasificación del subgrupo de pacientes con ictus criptogénico que corresponden a ictus cardioembólico clasificado erróneamente.
Implicaciones clínicasSe identificó un subgrupo de pacientes con ictus criptogénicos que tenían una función de la AI (fracción de eyección y strain) similar a la de los pacientes con ictus cardioembólicos. Estos pacientes pueden corresponder a casos de ictus cardioembólico mal clasificados. El análisis de la función de la AI con el empleo de la ecocardiografía transtorácica (SAI y FEAI) es un método no invasivo, barato y viable de identificar a los pacientes con disfunción de la AI20–23 y alto riesgo de FA paroxística25,26; para dichos pacientes podría ser útil un estudio etiológico ampliado, con monitorización del ritmo cardiaco de larga duración. Actualmente, los registradores implantables son el instrumento más eficaz para detectar FA oculta pero, dado su carácter invasivo, no serían apropiados para todos los pacientes y solo se debe implantarlos en casos seleccionados37,38. Si en futuros estudios prospectivos (con un registrador implantable o un Holter de 30 días) se confirma la utilidad del estudio de la función de la AI mediante speckle tracking para establecer el strain y determinar qué pacientes tienen alta probabilidad de presentar ictus cardioembólico, tras el estudio de ecocardiografía podría iniciarse la anticoagulación. El desarrollo de instrumentos para identificar a los pacientes con ictus criptogénicos y alto riesgo de etiología cardioembólica subyacente y el inicio de tratamiento anticoagulante podrían reducir la recurrencia del ictus en estos pacientes.
LimitacionesEl presente estudio monocéntrico se basa en una cohorte retrospectiva formada por un pequeño número de pacientes con ictus isquémico. Se incluyó solo a pacientes con ictus isquémico cuyo estudio etiológico incluía una ecocardiografía. No se suele remitir a examen ecocardiográfico a los pacientes con claro diagnóstico etiológico del ictus (p. ej., estenosis carotídea grave), por lo que el grupo de pacientes con ictus de origen aterotrombótico es reducido. Además, el tamaño del grupo de control era pequeño; sin embargo, cada vez hay más datos en la literatura médica actual que presentan valores similares a los descritos en el presente estudio. El volumen de la AI no se indexó respecto al área de superficie corporal, por lo que no se puede descartar un posible sesgo causado por el tamaño de los pacientes. Por último, no se dio seguimiento sistemático a los pacientes para detectar y confirmar cualquier posible FA paroxística. Sin embargo, estos resultados son generadores de hipótesis, por lo que está justificado realizar nuevos estudios en una cohorte prospectiva más amplia formada por pacientes con seguimientos más largos.
CONCLUSIONESEl estudio de la función de la AI con ecocardiografía transtorácica es fiable y puede resultar útil para diferenciar a los pacientes con ictus isquémico criptogénico y significativa disfunción de la AI que podrían tener un ictus cardioembólico mal clasificado. La monitorización de larga duración podría ser adecuada para estos pacientes, que podrían beneficiarse del tratamiento anticoagulante.
CONFLICTO DE INTERESESNinguno.