La imagen cardiaca es un componente crucial en el abordaje de los pacientes cardiacos, y como tal influye en múltiples partes interrelacionadas del flujo de trabajo clínico: el contacto médico-paciente, la adquisición de imagen, el preprocesamiento y posprocesamiento de imágenes, los informes de estudios, el diagnóstico y el pronóstico, las intervenciones médicas y, por último, el desarrollo del conocimiento a través de la investigación clínica. La incesante infiltración de la inteligencia artificial en cardiología pone de manifiesto que, usada apropiadamente, influirá y puede mejorar —a través de la automatización, la estandarización y la integración de datos— todos los componentes del flujo de trabajo clínico. El objetivo de esta revisión es presentar una visión holística de cómo se integra la inteligencia artificial en el abordaje clínico del paciente, con especial foco en la imagen cardiaca, pero aplicable a toda la gestión de información, y discutir las barreras actuales que aún deben superarse para su implementación generalizada.
Palabras clave
La inteligencia artificial (IA) ha resultado ser un ejemplo ilustrativo de una innovación tecnológica de carácter general, ubicua en las comunicaciones, el marketing, la economía y el sector de las tecnologías de la información. Como consecuencia de los avances tecnológicos, la mayor disponibilidad de datos y los códigos fuente abiertos de los algoritmos, las soluciones de IA han mejorado de manera constante, al tiempo que han aportado unos beneficios sin precedentes: cambio en los flujos de trabajo, mejora de la eficiencia, perfeccionamiento del tratamiento de datos y servicios de orientación dirigidos a usuarios específicos. El interés generado respecto a la integración de la IA en diversos subcampos de la medicina ha sido enorme, en ámbitos que van de la dermatología a la oncología, la oftalmología o la cardiología1.
En cardiología, los datos reflejan la necesidad de nuevas soluciones. Las enfermedades cardiovasculares se han mantenido constantes en la primera posición como causa de morbilidad en Europa, con unas tasas de hospitalización crecientes desde el año 20002, y al mismo tiempo se ha producido un aumento drástico de las fuentes de información, que ha conducido a que se genere una verdadera explosión de datos. En consecuencia, la carga de tratamiento de los pacientes que esto supone es inmensa, y hay una gran necesidad de análisis de datos que sean apropiados, muy informativos y que ahorren tiempo y costes. La IA brinda la posibilidad de abordar oportunidades de optimización y personalización a través del proceso de trabajo de las técnicas de imagen, desde la elección de la modalidad de diagnóstico por la imagen apropiada hasta la predicción de los resultados. Mientras que en revisiones anteriores se han resumido satisfactoriamente los aspectos tecnológicos y la aplicación de la IA en diferentes métodos de imagen1,3-9, el objetivo de esta es presentar una perspectiva de la integración completa de la IA en el abordaje clínico ordinario de los pacientes, con un enfoque centrado en las exploraciones cardiológicas de diagnóstico por la imagen. Se comentan también los obstáculos que será preciso superar antes de alcanzar una amplia integración de la IA y las preocupaciones clínicas existentes, así como los retos técnicos y éticos que se plantean.
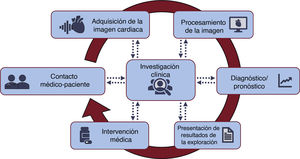
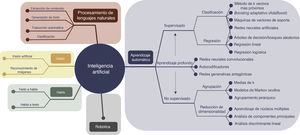
ABORDAJE DE LOS PACIENTES CARDIACOS E IMAGEN CARDIACA. MULTITUD DE OPORTUNIDADES PARA LA IAEl tratamiento integral de los pacientes con enfermedades cardiacas incluye necesariamente tratar con información cardiaca, datos que se emplean para orientar el diagnóstico, evaluar el riesgo, guiar el tratamiento o las intervenciones y decidir el seguimiento. Así, las técnicas de imagen cardiaca, por ejemplo, son un componente crucial del tratamiento del paciente cardiaco y, por consiguiente, una de las múltiples partes interrelacionadas del proceso de trabajo clínico: la comunicación médico-paciente, la adquisición de la imagen, el preprocesamiento y el posprocesamiento de los datos de imagen, los informes de las exploraciones, la interpretación de los datos, los métodos diagnósticos y el pronóstico, las intervenciones médicas y, por último, el desarrollo del conocimiento a través de la investigación clínica. La IA tiene un importante potencial para mejorar cada una de las partes del proceso de trabajo en el abordaje del paciente (figura 1). En el esquema de figura 2, se muestra una perspectiva general de los campos y subcampos de la IA, junto con algunos algoritmos de interés.
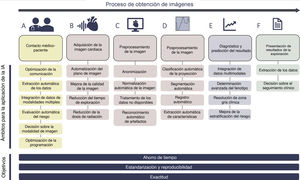
Con una carga de trabajo administrativo en aumento y la dificultad de uso de los registros electrónicos de la asistencia sanitaria, la IA brinda oportunidades de normalización y mejora de la eficiencia en la obtención de datos y la calidad de la comunicación (figura 3), con el objetivo de reducir las tareas laboriosas de bajo nivel y centrarse en la interacción entre médico y paciente. Los métodos de análisis del habla y del texto podrían mejorar la transferencia de información al guiar la comunicación (proporcionando retroalimentación sobre el aporte de información y la claridad del contenido), estandarizar la anamnesis e informar a los pacientes en un lenguaje asequible y fácil de entender10. Se podría analizar las respuestas verbales, las expresiones faciales y el tono de voz de los pacientes para orientar la interacción, tanto presencial como por telemedicina11. Además, actualmente la comunicación puede tener lugar a través de portales electrónicos para los pacientes, en los que herramientas basadas en la IA, como el procesamiento de lenguajes naturales (PLN) y el aprendizaje automático (AA), pueden clasificar los mensajes de texto libre de los pacientes, con la finalidad de organizar el triaje y automatizar las respuestas a problemas médicos cardiovasculares urgentes12.
Representación de las diversas partes del proceso de trabajo en las exploraciones por imagen cardiaca. La inteligencia artificial (IA) puede integrarse en todo el proceso, con el objetivo de alcanzar la automatización, la estandarización y la integración de los datos, así como una mejora de la eficiencia y la exactitud.
En el ámbito ambulatorio, para la evaluación del riesgo y el triaje habitualmente se utilizan sistemas de apoyo para las decisiones (DSS) en los que podría integrarse la extracción de características a partir de las imágenes o los informes clínicos mediante IA para automatizar la entrada de la información y aumentar la eficiencia13. Como ejemplos, cabe citar la posibilidad de crear automáticamente una lista exacta de los diagnósticos del paciente a partir de las notas clínicas14 o identificar factores de riesgo a partir de los registros electrónicos de la historia clínica, como el riesgo asociado de muerte súbita cardiaca en pacientes con miocardiopatía hipertrófica15. Además, la integración del AA puede mejorar la evaluación ambulatoria del riesgo de grupos de pacientes específicos. Para evaluar el riesgo de mortalidad en una cohorte de 5.822 pacientes con insuficiencia cardiaca, se utilizó un algoritmo de árbol de decisiones reforzado16. El modelo se validó externamente y mostró un rendimiento satisfactorio similar, con lo que se demostró su capacidad de generalización en el espectro de enfermedad de la insuficiencia cardiaca. Un modelo de riesgo eficiente y de amplia aplicabilidad podría ser útil para la identificación rápida y el triaje hacia las siguientes pruebas diagnósticas y la asistencia avanzada de pacientes adecuadamente seleccionados.
Un algoritmo integrado de IA/DSS podría ser útil también para seleccionar la técnica de imagen apropiada para obtener la máxima información diagnóstica y pronóstica en el mínimo tiempo posible, a la vez que se maximiza la seguridad del paciente y se minimizan los costes de las pruebas adicionales17. En un reciente estudio multicéntrico, se demostró que un DSS automatizado en el punto de entrada, basado en algoritmos de árbol de decisiones, determinaba con rapidez si las exploraciones de imagen cardiaca eran apropiadas para evaluar enfermedad coronaria (EC)18. Otro estudio mostró un enfoque basado en el PLN para la asignación a los protocolos de tomografía computarizada (TC) y cardiorresonancia magnética (CRM)19. Según lo indicado por estos estudios, la IA/DSS en el punto de entrada podría ser un instrumento eficiente para orientar las decisiones relativas a las exploraciones de imagen de los pacientes y maximizar la eficiencia tanto para el paciente como para el profesional de la salud.
Adquisición de imágenes cardiacas: automatización, ahorro de tiempo y seguridadUna vez elegida la modalidad de imagen, la IA puede mejorar el proceso de adquisición (figura 3B). En la ecocardiografía, las redes neurales convolucionales (CNN) —un tipo de aprendizaje profundo (AP) muy apropiado para las tareas orientadas a la imagen— pueden automatizar la adquisición de la imagen ecocardiográfica guiando el movimiento de la sonda hacia las posiciones óptimas, como la proyección tetracameral, lo cual permite captar imágenes ecocardiográficas diagnósticas tras una capacitación mínima20. La Food and Drug Administration de Estados Unidos ha aprobado recientemente el primer programa informático cardiológico basado en IA para guiar la adquisición de imágenes ecográficas21. Las consecuencias son una mejora de la formación del personal, una mayor aplicabilidad de las técnicas de imagen en centros con escasez de conocimiento experto, un menor número de artefactos en las técnicas de imagen y una mayor reproducibilidad de las exploraciones.
Las nuevas tecnologías pueden mejorar también la adquisición de las imágenes de CRM y TC; la CRM adolece de unos largos tiempos de adquisición consecuencia de la gran resolución temporal y espacial. Debido a su capacidad de utilizar grandes conjuntos de datos para aprender los parámetros de reconstrucción clave, recientemente se han propuesto los enfoques de AA, y en especial el AP, para reducir los tiempos de exploración en la CRM22. Asimismo se han aplicado redes generativas antagónicas para sintetizar imágenes de CRM de tipo cine a partir de secuencias de CRM en tiempo real (es decir, las secuencias que se utilizan como alternativa cuando los pacientes no pueden aguantar la respiración o sufren arritmias durante la exploración), y con ello se ha obtenido una mejora de la calidad de la imagen, con imágenes más claras y una distinción anatómica mejor definida23. La TC se ha beneficiado también de avances prometedores aportados por el AA, destinados a reducir los tiempos de reconstrucción y la dosis de radiación aplicada. Se han aplicado métodos de AP para aprender con imágenes de TC con dosis bajas y reconstruirlas para obtener imágenes de TC con dosis ordinarias, sintetizar imágenes de TC con contraste a partir de imágenes sin contraste, reducir el ruido en las exploraciones de TC con dosis bajas, posibilitar TC con dosis más bajas y TC con muestreo reducido, y reducir los artefactos debidos al metal24. Estos ejemplos de las contribuciones realizadas por la IA en la adquisición de imágenes resultarán de gran utilidad en la formación médica, el ahorro de tiempo, la reducción de costes y la seguridad de los pacientes.
Procesamiento de la imagen: automatización y reproducibilidad del preprocesamiento y posprocesamientoDespués de la adquisición, los datos de imagen brutos destinados al análisis son con frecuencia heterogéneos, es decir, tienen una calidad de imagen variable y se han adquirido con configuraciones y con aparatos de distintos proveedores. En consecuencia, el preprocesamiento (lo que incluye la anonimización, la normalización y el tratamiento de los datos no disponibles) es una parte crucial del proceso de obtención de las imágenes (figura 3C). Características como el contraste, el brillo y la intensidad de la imagen afectan a la robustez y la exactitud del análisis de las imágenes. Por mencionar tan solo unos pocos ejemplos, la normalización puede incluir el ajuste y la estandarización del tamaño de la imagen25-29, la aplicación de filtros a las imágenes para eliminar el ruido25 y la intensificación del contraste para facilitar el proceso de extracción de características30. Para preparar los datos para el AP, los vídeos de ecocardiografía pueden convertirse en matrices numéricas multidimensionales de intensidades de píxeles, con dimensiones correspondientes al tiempo, las coordenadas en el espacio y los códigos de la información del color31. La normalización de las imágenes de TC puede obtenerse también a través del AP, por ejemplo, con la estrategia basada en U-Net32. Además, el AP ha abordado recientemente tareas que plantean más dificultades, mediante el cribado con CNN para detectar los artefactos de movimiento o la presentación errónea de la proyección tetracameral en el primer paso del proceso de análisis de las imágenes33,34. El AA puede aportar también soluciones para los datos no disponibles, con innovadores métodos de atribución que utilizan datos de imagen cardiaca35.
En conjunto, los enfoques de preprocesamiento consiguen una uniformización de los datos de imagen, y con ello permiten una mejora del posprocesamiento y la extracción de características, para lo cual pueden utilizarse diversas estrategias de selección de características del conjunto de datos para determinar las que son de mayor interés. Sin embargo, sea cual sea la modalidad de imagen utilizada, el procesamiento de los datos para extraer las variables clínicas (es decir, volúmenes, grosor de la pared, deformación, morfología de las válvulas) lamentablemente requiere mucho tiempo y meticulosidad y es propenso al error y a diferencias entre distintos operadores. La interpretación de las imágenes depende en gran manera de la experiencia y del observador, lo que hace que haya una variabilidad de las mediciones que no es satisfactoria. Esto puede resultar problemático para el seguimiento longitudinal de los pacientes. Esto es lo que ocurre, por ejemplo, en cardio-oncología o en insuficiencia cardiaca, donde es esencial una evaluación reproducible de la función cardiaca, o lo que sucede en las bases de datos multicéntricas y de múltiples expertos, en las que la variabilidad de las mediciones introduce un sesgo en el análisis. La automatización del análisis de las imágenes a través del AA puede ser beneficiosa al ahorrar tiempo y aumentar la exactitud, la reproducibilidad y la estandarización33,36–38 (figura 3D).
La identificación de las proyecciones cardiacas es un primer paso crucial en el análisis de las imágenes. Cuando un cardiólogo identifica la proyección cardiaca, las estructuras cardiacas específicas de esa proyección pueden segmentarse, medirse y cuantificarse para evaluar la función y el remodelado del corazón. Recientemente se ha abordado la clasificación de las proyecciones sobre todo con métodos de AP como las CNN, que incorporan la información tanto espacial como temporal contenida en los bucles de ecografía y alcanzan unas tasas de exactitud del 92,1%26. Los modelos de CNN más avanzados permiten clasificar las ecocardiografías transtorácicas ordinarias completas (modo B, modo M, Doppler, tanto imágenes estáticas como vídeos) de pacientes con una amplia variedad de afecciones, configuraciones técnicas y calidades de imagen27. Al evitar los subconjuntos de entrenamiento idealizados, estos modelos muestran su posible aplicabilidad en el ámbito clínico, con una exactitud elevada, del 97,8%.
Tras identificar la proyección, la segmentación de la imagen es el proceso de partición de una imagen en sus partes componentes (p. ej., cada parte correspondiente a una estructura cardiaca distinta) con objeto de cuantificar la estructura y la función. En la ecocardiografía bidimensional, se ha puesto de manifiesto que las mediciones totalmente automatizadas mediante AA del volumen del ventrículo izquierdo (VI), la fracción de eyección y el strain (deformación) son rápidas y reproducibles y muestran una buena coincidencia con las mediciones manuales39. Además, se ha demostrado que un proceso automático de interpretación de las imágenes es viable e incorpora la identificación de la proyección, la segmentación de la imagen y la cuantificación de la estructura y la función31. La ecocardiografía tridimensional (3D) podría proporcionar una cuantificación más reproducible de las cámaras cardiacas, pero requiere un procesamiento manual laborioso que implica una importante carga en el proceso de trabajo y la aplicabilidad. Un algoritmo de análisis adaptativo automático para la cuantificación simultánea de los volúmenes ventricular y auricular resultó reproducible y comparable con lo obtenido con segmentaciones manuales y valores de CRM, pero esta tecnología solo es aplicable a pacientes con una calidad de imagen suficiente40. Se han presentado también soluciones factibles para la evaluación tridimensional automática del ventrículo derecho36. Además, al plantearse la evaluación valvular, la cuantificación de la geometría de la válvula mitral con la ecocardiografía transesofágica tridimensional automática mostró una buena correlación con las mediciones manuales y una reducción significativa del tiempo de medición, aunque, de nuevo, requirió imágenes de gran calidad41. Aunque los retos que plantea el análisis automático de conjuntos de datos tridimensionales continúan siendo importantes, los estudios actuales ponen de manifiesto un cambio incremental, que muestra un potencial de mejora de las limitaciones del proceso de trabajo en el ámbito clínico. Se ha publicado una revisión detallada de la cuantificación automática en la ecocardiografía5.
Hemos asistido a un desarrollo similar en la automatización de la CRM. Se ha presentado una cuantificación totalmente automática de la masa del VI, los volúmenes biventriculares y la fracción de eyección en un conjunto de datos de CRM heterogéneo, en la que se mostraron segmentaciones factibles y unos resultados similares a los de la cuantificación normal, aunque con una coincidencia inferior en los casos de alteración grave de la anatomía y escasa calidad de las imágenes38. Se ha descrito que la segmentación y la cuantificación de las imágenes de CRM basada en CNN es más rápida que las técnicas humanas más precisas y tiene una precisión similar, a pesar del reto que supone emplear datos de examen-reexamen en enfermedades múltiples, centros variados y condiciones de práctica clínica real para evaluar la precisión de la medida42. Además, se ha presentado la integración de algoritmos de control de calidad, que detectan los resultados erróneos, en una cohorte de voluntarios sanos y pacientes con una amplia variedad de trastornos cardiacos33. También puede abordarse la función cardiaca y la caracterización de los tejidos; la cuantificación totalmente automática del flujo aórtico en la CRM con contraste de fase puso de manifiesto una alternativa factible y más rápida para las segmentaciones y el análisis de conjuntos de datos de CRM grandes37, mientras que se han propuesto enfoques de cuantificación semiautomática43 y datos sintéticos44 para automatizar la segmentación con el realce tardío de gadolinio. Los datos sintéticos se han empleado también para generar imágenes de CRM basadas en un modelo biomecánico de referencia del VI para crear una denominada «certeza de base» que permita poner a prueba la robustez de los métodos de segmentación y registro45.
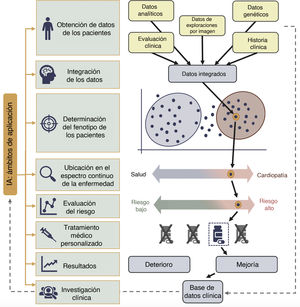
Diagnóstico y pronóstico: integración de los datos y determinación avanzada del fenotipoDespués del análisis de las imágenes y el procesamiento, los siguientes pasos son la integración de las medidas obtenidas con otras fuentes de datos, para obtener una representación integrada del paciente en estudio. Los métodos tradicionales de determinación del fenotipo se enfrentan con las dificultades de una cuantificación no estandarizada, los supuestos geométricos, la gran variabilidad del observador, un pequeño conjunto de parámetros y una tendencia a convertir fenogrupos de carácter continuo en fenogrupos discretos. Como se muestra en la figura 4, la combinación de unas imágenes con información abundante (es decir, imágenes de deformación, conjuntos de datos tridimensionales, caracterización del tejido, flujo tetradimensional, etc.) y un AA facilitó el paso de unos descriptores unidimensionales de la función y la estructura cardiacas a la determinación de un fenotipo multiparamétrico de alta resolución4. Un mensaje de interés aprendido a través de estos enfoques avanzados es que las enfermedades cardiacas suelen ser un espectro continuo de enfermedad, en el que una clasificación binaria en enfermo o sano no refleja la complejidad subyacente. Un enfoque reciente de AA no supervisado, en el que se utilizaron patrones de velocidad miocárdica longitudinal del VI, clasificó a los pacientes hipertensos y con dificultad respiratoria en una zona de transición del espectro de la insuficiencia cardiaca con fracción de eyección conservada, y puso de manifiesto posibles fallos de los algoritmos diagnósticos clínicos convencionales, así como el amplio espectro del síndrome de insuficiencia cardiaca con fracción de eyección conservada, que es heterogéneo46. Además, es precisamente la heterogeneidad de la insuficiencia cardiaca y la falta de linealidad de la función diastólica lo que puede plantear un reto apropiado para el AA, en especial con los enfoques no supervisados, que pueden extraer patrones ocultos de los datos y agrupar a los pacientes con independencia del conocimiento preexistente o las etiquetas clínicas conocidas47,48. Los datos del mismo paciente, obtenidos en la ecocardiografía en reposo y en ejercicio, pueden integrarse mediante AA para crear representaciones de reposo-ejercicio espaciotemporales de la función del VI con objeto de determinar la presencia de la insuficiencia cardiaca con fracción de eyección conservada48. Por último, el gran potencial de la integración de datos y la determinación del fenotipo a través de IA se pone claramente de manifiesto en los nuevos enfoques que combinan el conocimiento obtenido a partir de las técnicas de imagen, la genómica y la proteómica mediante la combinación de la secuenciación del ADN de alto rendimiento, junto con métodos de AA para abordar los retos que plantea la escalabilidad y la alta dimensionalidad de los datos4. Como ejemplo notable, cabe mencionar que se ha observado que las puntuaciones de riesgo poligénicas de los fenotipos del VI tienen capacidad de predecir insuficiencia cardiaca con independencia de los factores de riesgo clínicos, así como los fenotipos derivados de la CRM altamente heredables, que muestran que los fenotipos y el remodelado del VI basados en los datos de imagen están relacionados con la base genética subyacente49. Además, la combinación de la determinación del fenotipo de alta resolución con el análisis de datos automático puso de manifiesto que las variantes de truncación de la titina, que antes se consideraba irrelevantes en la población general, se asocian con mayores volúmenes del VI en el análisis de la CRM y con remodelado excéntrico50. La proteómica se ha utilizado también para identificar el riesgo de EC (predicción tanto de las placas de alto riesgo como de la ausencia de EC en la angio-TC coronaria de pacientes con sospecha de la enfermedad)51.
Los avances en la integración de los datos y en la determinación del fenotipo están intrínsecamente asociados con una mejora significativa de la predicción del diagnóstico y el resultado (figura 3E), aunque la mayoría de los estudios en que se ha utilizado la IA son todavía estudios observacionales unicéntricos y solo pueden considerarse generadores de hipótesis. No obstante, la IA se ha utilizado en datos de técnicas de imagen para diagnosticar infarto de miocardio, insuficiencia cardiaca, EC, ateroesclerosis, miocardiopatías y valvulopatías, entre otros trastornos. Los modelos de AP mostraron unos resultados comparables a los obtenidos por los cardiólogos en la detección de anomalías regionales isquémicas del movimiento de la pared y su ubicación52 o una gran exactitud en la detección (área bajo la curva [AUC], 0,94) de infarto de miocardio crónico en las imágenes de cine de CRM sin contraste, en comparación con las de CRM con realce tardío de gadolinio53. También se han observado resultados en estudios de TC, en los que el análisis de la textura fue más objetivo y reproducible para el diagnóstico del infarto de miocardio crónico, en comparación con la evaluación visual54. En la insuficiencia cardiaca, el AA no supervisado se ha utilizado en un gran conjunto de datos de un ensayo para identificar fenogrupos con características clínicas específicas relacionadas con los resultados55 o para identificar a pacientes con insuficiencia cardiaca con fracción de eyección conservada a través de las variaciones espaciotemporales de la tasa de strain del VI en los datos ecocardiográficos obtenidos en reposo y en ejercicio48. La capacidad de las técnicas de imagen cardiacas para evitar intervenciones invasivas innecesarias es un objetivo claro en la EC. Las aplicaciones del AP han mostrado también la identificación satisfactoria de la EC obstructiva a partir de las imágenes de perfusión con TC de emisión monofotónica (SPECT)56. En estudios multicéntricos recientes, un clasificador con boosting de gradiente mostró que la adición del examen de perfusión con TC en reposo a la angio-TC puede mejorar la predicción de isquemia significativa en la estenosis coronaria57, mientras que un algoritmo de la reserva de flujo fraccional en la TC, basado en AA y aplicado in situ, mejoró el rendimiento de la angio-TC al reclasificar la estenosis sin trascendencia hemodinámica, con un rendimiento equivalente al de los enfoques de dinámica de fluidos computacionales58. También se han explorado cada vez más la cuantificación de la calcificación y la caracterización de la placa, y se ha observado que las características radiómicas permitirían discriminar las placas con el signo del servilletero59, que es algo que plantea un verdadero reto, dado su carácter cualitativo. En el campo de las valvulopatías se han utilizado máquinas de soporte de vectores y análisis discriminante lineal para separar a los pacientes en función de la gravedad de la insuficiencia mitral, cuantificada a partir de las características de textura extraídas de 3 proyecciones de ecocardiografía en modo B, con una exactitud> 99% para cada uno de los niveles cualitativos de la insuficiencia25. De igual modo, la diferenciación de las distintas miocardiopatías ha sido un objetivo lógico para la aplicación de las capacidades avanzadas de determinación del fenotipo que proporciona la IA. El análisis de textura radiómico basado en las imágenes de CRM con ponderación T1 y el clasificador de máquina de vectores de soporte se han aplicado para diferenciar la cardiopatía hipertensiva de la miocardiopatía hipertrófica29. En un modelo de AA de conjunto (ensemble) se utilizaron los datos de ecocardiografía de speckle-tracking para la diferenciación automática de los patrones patológicos y fisiológicos del remodelado observado en la miocardiopatía hipertrófica respecto a los de los corazones de deportistas (AUC, 0,80)60. Puede consultarse una presentación detallada de las aplicaciones diagnósticas de la IA en el diagnóstico por la imagen cardiaca en las publicaciones de Al’Aref et al.6 y Martin-Isla et al.8.
Presentación de los resultados de la exploraciónUna vez realizado el análisis completo de los datos, la presentación rápida, precisa y reproducible de los resultados, con la ayuda de la IA, es beneficiosa para un eficaz tratamiento del paciente (figura 3F). En este campo, el reconocimiento y la traslación automáticos de la voz a un texto (reconocimiento del habla) fue uno de los primeros ejemplos de la integración de la IA en el proceso de trabajo del diagnóstico por la imagen. A pesar de los retos aún no resueltos, la aplicación en departamentos de radiología ha mostrado ya beneficios en cuanto a la reducción del tiempo de notificación y los costes, así como en el aumento de la productividad61. Además, la IA podría ser útil como método «a prueba de fallos» para la notificación de los resultados de las exploraciones, ya que los informes de ecocardiografía pueden analizarse mediante redes neurales artificiales para predecir la mortalidad de los pacientes y los reingresos hospitalarios de los pacientes con insuficiencia cardiaca62. El PLN puede facilitar la interpretación clínica de los informes y los borradores de informes al evaluar el riesgo tras un examen de imagen de perfusión miocárdica63, de la que anteriormente se ha observado que se subestima la isquemia en los informes. Otro reto crucial es el que no se cumplan las recomendaciones de seguimiento de las técnicas de imagen, ya que ello puede conducir a un deterioro de la salud del paciente, un fallo del tratamiento avanzado y un aumento de los costes. Así pues, los algoritmos de PLN de detección escalables y automáticos para el seguimiento pueden ser útiles para determinar el porcentaje de cumplimiento de las exploraciones de imagen de seguimiento y para definir en qué pacientes puede obtenerse un mayor beneficio con una posible intervención, con objeto de mitigar el riesgo64.
Intervenciones médicas: orientación proporcionada por la IA y las técnicas de diagnóstico por la imagenDiversos campos de la IA, como AA, PLN, visión artificial y robótica, han generado un gran interés para abordar los retos que se plantean en el campo de la cardiología intervencionista, con el objetivo de mejorar la toma de decisiones en tiempo real, simplificar los procesos de trabajo en el laboratorio de cateterismo y estandarizar las intervenciones realizadas mediante catéter a través de la robótica avanzada65. Un ejemplo claro es el que puede encontrarse en las soluciones de técnicas de imagen para la planificación y la elección de la válvula en las intervenciones de implante percutáneo de la válvula aórtica. En el implante percutáneo de válvula aórtica, la TC es el patrón de referencia actual para determinar el tamaño de la prótesis; sin embargo, un programa informático automático para la ecocardiografía transesofágica tridimensional permitiría una modelización y una cuantificación reproducible de las dimensiones del anillo y la raíz aórticas, con una alta correlación con las mediciones realizadas en la TC66. Además, después del implante percutáneo de válvula aórtica, no se dispone de un método de referencia sólido para evaluar la insuficiencia paravalvular que pueda abordarse con un proceso basado en una simulación ecográfica67. En el campo de la insuficiencia cardiaca, el AA no supervisado se ha aplicado también para integrar los datos ecocardiográficos del ciclo completo y datos clínicos heterogéneos para predecir la respuesta a la terapia de resincronización cardiaca68. También hemos asistido a avances en los DSS y la evaluación del riesgo después del alta hospitalaria: un algoritmo de conjunto con boosting mostró un valor pronóstico para la predicción de la EC superior al de las actuales puntuaciones de riesgo coronario integradas basadas en la angio-TC, al maximizar el uso de la información sobre la estenosis y la composición de la placa69. Además, una integración mediante AA de los datos clínicos y de angio-TC predijo la mortalidad por todas las causas a 5 años (AUC, 0,79), con un rendimiento significativamente mejor que el de los parámetros de medida existentes. Se han propuesto enfoques similares para la predicción de los eventos adversos cardiacos mayores a 3 años en pacientes con imágenes de perfusión miocárdica mediante SPECT, en quienes la integración mediante AA de las variables clínicas, de estrés y de imagen mostró una exactitud predictiva superior a la de la evaluación visual o automática de las imágenes de perfusión por sí sola70.
Investigación clínica: disponibilidad de datos y análisis de datos totalmente automáticoLa integración de la IA y la automatización del análisis que se han descrito pueden hacer avanzar la asistencia de los pacientes en diversas situaciones clínicas; sin embargo, la integración tiene también repercusiones de interés en lo relativo a la investigación clínica (figura 1 y figura 4). La calidad y el tamaño de los conjuntos de datos disponibles determinan la calidad de los resultados obtenidos con el AA. En este campo, un obstáculo importante es la necesidad de anotaciones de alta calidad por parte de expertos en los conjuntos de datos de imagen, ya que al etiquetado son inherentes las incertidumbres, los sesgos y los supuestos. Recientemente se han propuesto métodos autosupervisados para abordar este problema, debido a su capacidad de explorar datos que no han sido etiquetados71. Además, los datos sintéticos, con propiedades realistas y texturas de ruido específicas de la modalidad de imagen de que se trate, pueden ser útiles para obviar el problema incluyéndolos en el procedimiento para entrenar los algoritmos de AA además de los datos clínicos reales. A modo de ejemplo, se ha utilizado una red generativa antagónica para la síntesis de imágenes de TC realistas basadas en maquetas corporales, con el objetivo de aumentar el tamaño del conjunto de datos para mejorar el entrenamiento y el rendimiento de las redes de segmentación de vasos72. Por otra parte, muchos de los algoritmos de AA tienen la limitación de la escasez de conjuntos de datos grandes y heterogéneos: la mayor parte de los estudios disponibles se limitan a cohortes de un solo centro o cohortes de poblaciones específicas; sin embargo, el AA ha mostrado su capacidad para integrar datos de conjuntos de datos diferentes para alcanzar un análisis más sólido73. Al mismo tiempo, hay una iniciativa creciente de ampliar la disponibilidad de bases de datos de imagen, biobancos, biorrecursos y registros para el entrenamiento del AA; cabe mencionar como ejemplo las iniciativas del UK Biobank o el registro REFINE-SPECT (REgistry of Fast Myocardial Perfusion Imaging with NExt generation SPECT)8. No obstante, la puesta en común de datos y la falta de metodologías eficientes para satisfacer a todas las partes involucradas continúan siendo una dificultad frecuente. Se han propuesto métodos de nueva generación mediante un AA federado y descentralizado para reemplazar el paradigma actual de datos compartidos y almacenamiento centralizado; los algoritmos podrían distribuirse a centros o dispositivos que tuvieran los datos para la realización local de las tareas, y los resultados se devolverían al repositorio central para actualizar el algoritmo principal74. También se han propuesto ideas para integrar las soluciones procedentes del sector financiero, como la tecnología blockchain, para el uso de bases de datos descentralizadas, un intercambio de datos seguro, rastreable y escalable, y la integración de herramientas de IA con capacidad de blockchain, distribuidas y ligadas a un sistema de incentivos que vayan a parar al propietario de cada dato en función de su valor75.
Por último, cuando se dispone de conjuntos de datos, es necesario realizar un análisis de alta calidad. Los informes recientes prevén un análisis totalmente automático; se utilizó una red CNN con imágenes ecográficas para identificar las estructuras cardiacas locales, realizar mediciones automáticas de la estructura y la función y predecir los fenotipos que modifican el riesgo cardiovascular, basándose tan solo en datos de técnicas de imagen28. En otro estudio reciente se llevó a cabo un análisis retrospectivo de una base de datos de ecocardiografías de 10 años procedentes de diversos proveedores, y se puso de relieve que los algoritmos de CNN pueden respaldar un análisis escalable, en un tiempo razonable y de bajo coste dentro del sistema de asistencia sanitaria31. Es importante señalar que la aplicación de estos instrumentos de procesamiento automático requiere un control de calidad. La inspección manual de cada segmentación no es viable en cohortes más grandes, y enfoques como la exactitud de clasificación inversa muestran potencial para un control de calidad exacto y totalmente automático, como se ha observado en un gran número de casos de CRM del estudio del UK Biobank76. Además, los parámetros estimados a partir de las segmentaciones automáticas, como el volumen de eyección del VI y el ventrículo derecho, pueden rastrearse, y se puede detectar y marcar las exploraciones con un volumen de eyección desproporcionado. Pueden usarse otros algoritmos de AA adicionales, como las máquinas de soporte de vectores, para clasificar los resultados de los algoritmos de AA como normales o anormales33. Por último, los datos de investigación no solo se almacenan en imágenes. El abordaje de los pacientes cardiacos produce un flujo inmenso de datos clínicos, la mayoría de las veces en informes no estandarizados y no estructurados, que no permiten un análisis inmediato. Como ya se ha comentado, los algoritmos de PLN pueden desempeñar un papel crucial extrayendo conceptos cardiacos a partir de texto libre procedente de múltiples centros y de informes semiestructurados. Estas tecnologías prometedoras constituyen un vínculo importante en la automatización del análisis de bases de datos para la investigación clínica.
CUESTIONES CLÍNICAS, TÉCNICAS Y ÉTICAS EN LA INTEGRACIÓN DE LA IA EN EL ABORDAJE DE LOS PACIENTESEn paralelo con todos los posibles beneficios, es continua la preocupación sobre la dependencia y la confianza excesiva en las capacidades de la automatización, y existe el temor de que con el tiempo puedan conducir a una pérdida de las capacidades de los clínicos y falte destreza para la realización manual de la ecocardiografía o se pierda la capacidad de analizar e interpretar de manera independiente las exploraciones de imagen cardiaca. Sin embargo, la aplicación apropiada de la IA en diferentes partes del proceso de trabajo clínico tiene como objetivo enriquecer la práctica clínica actual, no reemplazarla. La comunicación y la obtención de datos durante las visitas ambulatorias pueden mantenerse en esencia inalteradas, pero pueden ser más eficientes y dejar más tiempo para la interacción entre clínico y paciente. La cuantificación estructural o funcional puede llegar a ser más rápida y estandarizada a través de la automatización, con lo cual se liberaría una cantidad de tiempo considerable, pero siempre con la opción de revisar y ajustar las segmentaciones. Además, en vez de conducir a una pérdida de las capacidades, la IA puede usarse también con fines de formación: la guía en la adquisición puede ser útil para la capacitación de los operadores con menos experiencia, los marcos de aprendizaje por transferencia enseñan la anatomía cardiaca77 y las soluciones de AP sirven de herramienta de aprendizaje, ya que pueden alcanzar mejores resultados que los evaluadores internos para valorar las anomalías del movimiento de la pared52. Otro temor es que se abandone el enfoque holístico de la asistencia del paciente, y se predice que el centro de interés se desplazará hacia las características de los datos en vez de a la complejidad del paciente que subyace a esos datos. Sin embargo, se puede argumentar que, en realidad, la IA podría ampliar el horizonte del enfoque holístico a través de una integración completa de datos multimodales: de evaluación clínica, de exploraciones por imagen, moleculares y genéticos, así como registros electrónicos de salud, como ya se ha comentado. Estas mejoras han abierto el camino al concepto de «gemelo digital», una herramienta virtual que integra los datos clínicos adquiridos a lo largo del tiempo para crear una representación dinámica y completa del paciente78, con lo que se facilitaría un abordaje personalizado y sin precedentes en la asistencia de los pacientes.
Para alcanzar todo el potencial de la IA, será preciso abordar con rigor la generalización y la interpretabilidad. En contra de la promesa de la IA de impulsar un abordaje personalizado en la asistencia de los pacientes, la generalización observada en los estudios de cohortes o los estudios controlados y aleatorizados tradicionales (es decir, resultados obtenidos en estudios poblacionales aplicados para tratar a individuos) es también un problema que está incluido en las soluciones de IA. Un algoritmo basado en datos de entrenamiento sesgados (imágenes procedentes de una cohorte local o de un proveedor específico) podría no dar buen resultado en un contexto de práctica clínica real, y ello hace que no sea viable la interpretación correcta de un caso con una enfermedad o un fenotipo que quede fuera de los datos utilizados para el entrenamiento. Se ha utilizado el aprendizaje por transferencia, que combina una arquitectura de CNN-red generativa antagónica para mejorar el rendimiento de los algoritmos de AP al aplicarlos a datos de otros proveedores, y ello aporta una solución al reto frecuente de aplicar un algoritmo a datos de múltiples centros y múltiples proveedores79. Conjuntamente con la validación interna (es decir, múltiples pautas en muestras divididas como la validación de múltiplo x), la validación multicéntrica y externa (es decir, la predicción en un nuevo conjunto de datos no relacionado) es crucial para demostrar la generalización. Por otra parte, la disponibilidad pública de los datos y los algoritmos, tal como defienden las iniciativas de datos abiertos y de fuente abierta, y la repetición por otros grupos de investigación, podrían fortalecer la confianza en el modelo, aunque esos enfoques se ven limitados por los intereses comerciales. Puede alcanzarse un control de calidad integral de los algoritmos de AA mediante herramientas que permitan medir el rendimiento, realizar una supervisión y proporcionar una valoración para la retroalimentación, así como mecanismos de responsabilidad80.
En un algoritmo de IA integrado generalizable, la necesidad de herramientas para explorar el razonamiento que subyace a los resultados de los algoritmos será siempre de capital importancia para la interpretabilidad y crucial para generar confianza y facilitar su adopción. Cuando se disponga de ella, debe proporcionarse una explicación intuitiva y motivada del proceso de decisión, respaldada resaltando los datos importantes para proporcionar una interpretación fisiopatológica y que permita comprender de qué modo contribuye cada una de las numerosas variables al resultado final, como pueden ser los datos de velocidad que explican los cambios de la función diastólica y sistólica en grupos de pacientes distintos46. En las situaciones en que el algoritmo aplicado es una caja negra, hay metodologías novedosas que pueden ayudar a «entrar en la caja»; los experimentos de pruebas de oclusión incluyen pruebas de exactitud de la clasificación después de ocultar diferentes partes de la imagen de entrada, mientras que los mapas de prominencia (saliency maps) muestran los píxeles de la imagen ponderados con mayor intensidad en la decisión de clasificación de la red neural27,28. No obstante, las decisiones tomadas por algoritmos más complejos actualmente pueden ser difíciles de interpretar, y ello hace que la posible integración en el contexto clínico sea actualmente un verdadero reto ético.
Aparte de muchas consideraciones éticas relativas al uso de los datos médicos de los pacientes, la IA abarca un ámbito más amplio. Muchos de los algoritmos de AA se han elaborado y validado para modalidades de exploración avanzadas y caras, que se aplican con frecuencia en países de rentas altas y centros de alto nivel81. Es frecuente que los pacientes de países de renta baja o media estén infrarrepresentados. Por consiguiente, la cuestión que se plantea es si la IA puede ayudar a resolver las desigualdades en salud o hacer que las existentes pasen a ser más profundas. Sin embargo, si se emplea adecuadamente, la IA puede ayudar a democratizar la asistencia sanitaria, al reducir los costes y llevar las técnicas de diagnóstico por la imagen a regiones en las que el conocimiento experto especializado escasea. Por ejemplo, algunos estudios ponen de manifiesto que la aportación del AP puede consistir en imágenes de diagnóstico médico de menor tamaño, que lleguen a ahorrar un 96-99% del tamaño de los archivos en comparación con las imágenes habituales en la evaluación clínica27. Las consecuencias son una menor capacidad de almacenamiento en las regiones geográficas de bajos recursos, datos compartidos con mayor facilidad y uso de escáneres más antiguos con menor resolución. Sin embargo, de manera similar a lo ocurrido en el pasado con otros ejemplos de tecnologías de amplia aplicación (como la electricidad o los ordenadores), los efectos plenos de la IA en la asistencia sanitaria no se apreciarán hasta que se hayan elaborado y aplicado sucesivas oleadas de innovaciones complementarias82. De igual modo, su implantación dependerá en gran manera de la actitud de los profesionales de la salud y la población respecto a estas nuevas tecnologías. Por ejemplo, las actitudes respecto a compartir los datos para el desarrollo de la IA resaltan la importancia de la confianza en las instituciones y de una comunicación clara de los posibles beneficios83. Además, estudios recientes han revelado cierta resistencia de los pacientes a las soluciones de IA; la preferencia de los pacientes se decanta claramente por la interacción humana y no por la automática, incluso si ello implica peor rendimiento84. Centrarse en el carácter único de cada paciente en la prestación de la asistencia, la personalización percibida de la asistencia médica aumentando la cantidad de información del usuario integrada o incorporando elementos indicadores de la especificidad de cada paciente podrían ser elementos de interés para facilitar la buena recepción de la IA84.
CONCLUSIONESDespués de una constante infiltración en la asistencia clínica y con una robusta literatura sobre pruebas de concepto y posibles beneficios de la aplicación de la IA a la cardiología, la visión de la integración completa de la IA en el tratamiento habitual del paciente cardiaco y el proceso de la información cardiológica está pasando a ser una realidad palpable. Con independencia de los múltiples retos que debe afrontar (preguntas técnicas, dificultades de aplicación, idoneidad para tareas específicas y dilemas éticos), la IA inevitablemente aportará valor a la asistencia de los pacientes. Además de todas las consecuencias favorables de la IA, la más valiosa sería la devolución de tiempo a los clínicos, que daría lugar a un cambio del enfoque para regresar a lo esencial y más valioso, la relación médico-paciente, pero esta vez a través de un abordaje personalizado, eficiente y sin precedentes.
FINANCIACIÓNEste trabajo se financió en parte por el Proyecto Horizonte 2020 de la Comisión Europea H2020-MSCA-ITN-2016 (764738), el Ministerio de Ciencia, Innovación y Universidades de España y el Programa Retos I+D (RTI2018-101193-B-I00), el Programa de Unidades de Excelencia María de Maeztu (MDM-2015-0502) y la Fundació La Marató de TV3 (20154031).
CONFLICTO DE INTERESESLos autores no tienen conflictos de intereses.